Застосування пробіотиків як езофагопротеторних та виразкозагоювальних засобів при неерозивних ураженнях стравоходу
Номер патенту: 52561
Опубліковано: 25.08.2010
Автори: Гжегоцький Мечислав Романович, Савицька Мар'яна Ярославівна, Заячківська Оксана Станіславівна
Формула / Реферат
Застосування пробіотиків як езофагопротекторних та виразкозагоювальних засобів при неерозивних ураженнях стравоходу.
Текст
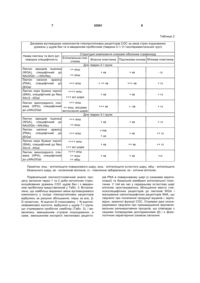
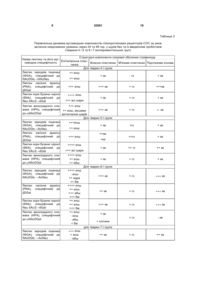
Застосування пробіотиків як езофагопротекторних та виразкозагоювальних засобів при неерозивних ураженнях стравоходу. (19) (21) u201003819 (22) 02.04.2010 (24) 25.08.2010 (46) 25.08.2010, Бюл.№ 16, 2010 р. (72) САВИЦЬКА МАР'ЯНА ЯРОСЛАВІВНА, ЗАЯЧКІВСЬКА ОКСАНА СТАНІСЛАВІВНА, ГЖЕГОЦЬКИЙ МЕЧИСЛАВ РОМАНОВИЧ 3 Пробіотики - живі мікроорганізми, які поліпшують мікробний баланс. В сучасній медицині одним з перших термін "пробіотики" використав R.B. Fuller в 1991 році для опису "живих добавок з мікроорганізмів, які приносять допомогу організму, поліпшуючи його мікробний баланс". З 1995 року під пробіотиками розуміють біотерапевтичні агенти, тобто мікроорганізми зі специфічними властивостями, які інгібують ріст патогенних бактерій на слизовій оболонці травної системи. Використання даних біопрепаратів впливає на функціонування різних систем органів, а саме: протизапальна дія, корекція кишкового дисбіозу і деяких метаболічних порушень, наприклад, при гіперліпідемії тощо. По стосунку до лікування і попередження атопічних реакцій, імуномодулюючих ефектів і деяких інших станів є вагомі докази їхньої ефективності. В основу корисної моделі поставлене завдання розширення галузі застосування пробіотиків як нового, безпечного у застосуванні засобу езофагопротекції для профілактики і терапії захворювань стравоходу, конкурентноспроможного за ефективністю, що відновлює механізми захисту СОС, діє на інші етіопатогенетичні ланки ульцерогенезу та репаративні властивості. Поставлене завдання вирішується застосуванням пробіотиків як езофагопротекторного та виразкозагоювального засобу при неерозивних ураженнях стравоходу. Вживання пробіотиків сприяє інтенсифікації виразкозагоювання СОС у порівнянні зі спонтанним загоюванням, що дозволяє використовувати їх для профілактики та лікування неерозивновиразкових захворювань стравоходу. Для підтвердження ефективності заявленої корисної моделі було вивчено вплив пробіотиків на процеси загоювання неерозивних уражень СОС шляхом оцінки структурно-функціональної реорганізації вуглеводних компонентів глікопротеїнових рецепторів стравоходу в умовах експериментального моделювання гострого стресу та в різні терміни загоювання. Запропонований засіб езофагопротекції та виразкозагоєння неерозивних уражень СОС досліджено у модельних серійних дослідженнях, що проведені відповідно до положень університетського комітету з біоетики та Міжнародних принципів "Європейської конвенції про захист хребетних тварин, яких використовують для експериментів та в інших наукових цілях" на нелінійних щурах самцях (n=67), масою 200±20г, що були розділені на групи: 1-а - контрольна, 2-а і 3-а - тварини, що зазнали евтаназії відразу після індукції стресу, 4-а і 5-а через 24год після стресу, 6-а і 7-а - через 48год після стресу (модель водно-імобілізаційного стресу за Takagi et al., 1964), при цьому щурам 3-ї, 5-ї і 7-ї груп вводили per os пробіотик "Симбітер" (виробник "О.Д. Пролісок", Україна), об'ємом 0,5мл (140мг/кг), решті - плацебо (фізрозчин 0,5мл). Для візуалізації функціональної реорганізації мікроскопічних уражень СОС гістологічний матеріал нижньої третини стравоходу фіксували у 4% формаліні і заливали у парафін за загальноприйнятою методикою з фарбуванням гематоксиліном та еозином. Оцінювання вуглеводних компонентів глі 52561 4 копротеїнових рецепторів СОС проводили за аналізом хімічного складу гістохімічної реакції, за наявністю коричневого, осаду у місцях зв'язування лектину, за напівкількісним методом з використанням лектинів різної вуглеводної специфічності, мічених пероксидазою [3, 5]. Підбір панелі лектинів був здійснений з урахуванням їхніх відмінностей у вуглеводній специфічності з метою більш точної та повної ідентифікації вуглеводних компонентів глікопротеїнових рецепторів СОС: лектину зародків пшениці (WGA), специфічного до NAcDGlc→NAcNeu; лектину насіння арахісу (PNA), специфічного до DGal-H-→3DGalNAcDGal; лектину кори бузини чорної (SNA), специфічного до Neu5Ac/2→6Gal; лектину виноградного слимака (НРА), специфічного до NAcDGal (НДЛ "Летинотест", м. Львів). Перегляд препаратів та фотографування здійснювали за допомогою мікроскопа Carl Zeiss. Відеоаналіз здійснювали із застосуванням ліцензованої системи відеозапису зображення AVerMedia. Інтенсивність лектин-рецепторної реакції оцінювали напівкількісним методом ("-" - слабка реакція, "+" - помірна реакція, "++" - сильна реакція, "+++" - дуже сильна реакція) за забарвленням препаратів. Результати досліджень представлені на ілюстраціях описів мікро фото зафарбування ГЕ (зб. 600): на Фіг.1 зображено слизову оболонку стравоходу щурів контрольної групи: поверхневий шар (а), остистий шар (б), базальний шар (в) епітеліальної пластинки, власна пластинка (г), м'язова пластинка (д); на Фіг.2 - слизова оболонка стравоходу у тварин після індукції стресу: десквамація поверхневого шару (а) звуження просвіту судин підслизової основи, набряк сполучної тканини (в). Слизова оболонка стравоходу щурів контрольної групи (інтактні тварини) включала епітеліальну пластинку, що утворювала багатошаровий плоский епітелій, який лежав на базальній мембрані; власну пластинку, представлену пухкою сполучною тканиною з судинами та типовими клітинними елементами і волокнистими структурами, що характерні для сполучної тканини; м'язову пластинку - один шар гладких міозитів; підслизову основу з пухкою сполучною тканиною, що разом із слизовою утворили поздовжні складки, що на поперечних зрізах дало характерний рисунок (Фіг.1). У тварин, яким індукували стрес, спостерігались зміни товщини епітелію, локальне витончення, десквамація поверхневого шару. Просвіт судин власної пластинки та підслизової основи був подекуди звужений, місцями простежувався набряк сполучної тканини, що створювало враження звуження просвіту стравоходу та заповнення його десквамованими елементами поверхневого шару СОС (Фіг.2). Зафарбування зрізів лектинами WGA, PNA, SNA, HPA показало виразне структурування епітеліальної пластинки СОС на базальний, остистий та поверхневий шари, що було використано для інтерпретації просторової орієнтації та експресії лігандів лектинів. Вуглеводні детермінанти у вигляді DGal та нейрамінової кислоти виявлені як у цитоплазмі епітеліоцитів базального шару, так і на їхній апікальній поверхні, у місцях формування 5 міжклітинних контактів, у складі базальної мембрани, де започатковуються процеси синтезу компонентів слизового бар'єру. У напрямку від базального шару до поверхні епітелію вищеназвані детермінанти виявлялися на поверхні епітеліоцитів остистого шару СОС, відбувалася незначна редукція NAcDGlc та нейрамінової кислоти у напрямку до люменального простору. Натомість у поверхневому шарі з'явилися вуглеводні детермі 52561 6 нанти NAcDGlc. У власній пластинці та підслизовій основі рецептори WGA були спостережені у волокнистих структурах (колагенові волокна). Окрім того, рецептори лектину PNA виявлені у внутрішній оболонці судин, клітинних елементах сполучної тканини, тканинних базофілах. Напівкількісний аналіз інтенсивності експресії високоспецифічних глікопротеїнових рецепторів СОС щурів контрольної групи подано у Табл.1. Таблиця 1 Рецептори лектинів у структурних компонентах слизової оболонки стравоходу щурів контрольної групи (інтактні тварини) Структурні компоненти слизової оболонки стравоходу Назва лектину та його вуглеЕпітеліальна плаводнева специфічність Власна пластинка М'язова пластинка Підслизова основа стинка Лектин зародків пшениці +++ епш; включно (WGA), специфічний до з компонентами NAcDGlc→NAcNeu ебш +++ пш; включно з Лектин насіння арахісу (PNA), слизовим бар'єром; специфічний до DGal +++ ебш +++ еш Лектин кори бузини чорної (SNA), специфічний до Neu ++ еош 5Ac/2→6Gal +++ ебш +++ апікальна поЛектин виноградного слимака верхня; епш (НРА), специфічний до + еош, NAcDGal ++ ебш ++ кв + гз + кв ++ кв + гз ++ кв + гз ++ кв +++ кв + гз +++ кв Примітка: епш - епітеліоцити поверхневого шару, еош - епітеліоцити остистого шару, ебш - епітеліоцити базального шару, кв - колагенові волокна, гз - гомогенне забарвлення. Індукція стресу зумовила модифікацію вуглеводних детермінант: зниження експресії N-ацетилD-глюкозаміну, N-ацетил-нейрамінової кислоти і Neu 5Ас/2→6Gal у епітеліальній пластинці, у меншій мірі - -D-галактози, особливо у власній пластинці, через зміну хімічного складу передепітеліального бар'єру СОС, міжклітинних контактів, десквамацію епітелію, що змінило проникність СОС і зумовило процеси запального характеру. Порівняльний аналіз нейро-трофічних уражень СОС та дані про специфічність експресії глікополімерів NAcDGlc→NAcNeu, DGalH→3DGalNAcDGal, Neu5Ac/2→6Gal, NAcDGal, індукованих стресом у щурів без та зі застосуванням пробіотиків, представлено у Табл. 2. Застосу вання пробіотиків спричинило інтенсивну сіалізацію апікальних мембран, міжклітинних контактів, особливо у поверхневому шарі, а також клітинноматриксних з'єднань СОС, що було зумовлено кількісно-якісними змінами синтезу компонентів слизово-епітеліального бар'єру, а саме: збільшення експресії вуглеводних компонентів DGal, NAcDGal виявлено у епітеліальній пластинці СОС (Табл. 2). Отримані результати зумовлені змінами вмісту локальних вазодилятаторних факторів: простагландинів, оксиду азоту (NO) та кальцитонін ген спорідненого пептиду (CGRP), що є наслідком природних захисних реакцій [3]. 7 52561 8 Таблиця 2 Динаміка вуглеводних компонентів глікопротеїнових рецепторів СОС за умов стрес-індукованих уражень у щурів без та із введенням пробіотиків (тварини 2-ї і 3-ї експериментальних груп) Структурні компоненти слизової оболонки стравоходу Назва лектину та його вугЕпітеліальна плалеводна специфічність Власна пластинка Підслизова основа М'язова пластинка стинка Для тварин 2-ї групи Лектин зародків пшениці ++ епш (WGA), специфічний до + кв + кв - гз ++ еош NAcDGlc→+NAcNeu Лектин насіння арахісу (PNA), специфічний до +++ епш + ++ кв +++ кв + гз DGal Лектин кори бузини чорної ++++ епш (SNA), специфічний до Neu + кв + кв + гз +++ всі шари 5Ac/2→6Gal +++ епш Лектин виноградного слимака (НРА), специфічний ++ еош, місцями +++ кв до NAcDGal витончення шарів Для тварин 3-ї групи Лектин зародків пшениці +++ епш (WGA), специфічний до + кв ++ еош NAcDGlc→NAcNeu Лектин насіння арахісу ++кв; (PNA), специфічний до +++ епш + ке DGal Лектин кори бузини чорної ++++ епш (SNA), специфічний до Neu + кв +++ всі шари 5Ac/2→6Gal Лектин виноградного слимака (НРА), специфічний до NAcDGal ++++ епш ++ еош ++ ебш + кв +- кв + гз + кв + гз + кв ++ гз ++ кв ++ гз + кв +гз Примітка: епш - епітеліоцити поверхневого шару, еош - епітеліоцити остистого шару, ебш - епітеліоцити базального шару, кв - колагенові волокна, гз - гомогенне забарвлення, ке - клітини епітелію. Порівняльний лектингістохімічний аналіз процесу загоєння через 1 та 2 доби нетопічних стресасоційованих уражень СОС щурів без і з введенням пробіотика представлений у Табл. 3. Встановлено, що найбільш виражені зміни вуглеводневого компоненту у складі глікопротеїнових рецепторів відбулись за рахунок збільшення, перш за все, D-галактози, N-ацетил-D-глюкозаміну і N-ацетилнейрамінової кислоти, відбулися у щурів 7-ї групи, що отримували пробіотик симбітер (Табл. 3), і виявлялись зменшенням ступеня пошкодження, а саме, зменшенням експресії лектинових рецепто рів PNA в поверхневому шарі (з ознаками кератинізації) та базальній мембрані епітеліальної пластинки. У той же час у середньому остистому шарі епітелію простежувалось збільшення вмісту глюкозоспецифічних рецепторів до лектинів WGA і маскування сіалоспецифічних рецепторів SNA, що свідчило про посилення продукції муцинів і, відповідно, захисної функції СОС. Отримані дані опосередковано свідчили про пришвидшення відновлювальних регенеративних процесів, що співпадає з нашими попередніми дослідженнями [4] і є фізіологічною характерною ознакою загоєння. 9 52561 10 Таблиця 3 Порівняльна динаміка вуглеводних компонентів глікопротеїнових рецепторів СОС за умов загоєння неерозивних уражень через 24 та 48 год. у щурів без та із введенням пробіотиків (тварини 4 і 5 та 6 і 7 експериментальних груп) Структурні компоненти слизової оболонки стравоходу Назва лектину та його вугЕпітеліальна пласлеводна специфічність Власна пластинка М'язова пластинка Підслизова основа тинка Для тварин 4-ї групи Лектин зародків пшениці ++ епш (WGA), специфічний до + кв - гз + кв ++ еош NAcDGlc→NAcNeu Лектин насіння арахісу (PNA), специфічний до DGal Лектин кори бузини чорної (SNA), специфічний до Neu 5Ac/2→6Gal +++ епш +++ кв +++ всі шари +++кв + кв + гз + кв + гз +- кв +гз + кв ++гз + кв + кв ++ гз ++ кв + кв ++++ епш + гз + гз + кв +++ кв + гз +++ кв ++ кв + гз +++ кв +++ кв + гз +++ кв + гз - кв + гз ++ кв +++ епш Лектин виноградного слимака (НРА), специфічний ++ еош, місцями +++ кв до NAcDGal витончення шарів Для тварин 5-ї групи Лектин зародків пшениці +++епш (WGA), специфічний до + кв ++ еош NAcDGlc→AcNeu Лектин насіння арахісу (PNA), специфічний до DGal Лектин кори бузини чорної (SNA), специфічний до Neu 5Ac/2→6Gal Лектин виноградного слимака (НРА), специфічний до NAcDGal ++кв; +++ епш +ке ++++ епш +++ всі шари ++++ епш ++ еош ++ ебш Для тварин 6-ї групи Лектин зародків пшениці (WGA), специфічний до NAcDGlc →AcNeu Лектин насіння арахісу (PNA), специфічний до DGal Лектин кори бузини чорної (SNA), специфічний до Neu 5Ac/2→6Gal Лектин виноградного слимака (НРА), специфічний до NAcDGal ++++ епш - еош ++ ядра ++ бм ++++ епш ++ еош +++ ебш +++ бм ++ епш ++ еош +++ бм ++ епш - еош - ебш + бм + кв + клітини для тварин 7-ї групи Лектин зародків пшениці (WGA), специфічний до NAcDGlc →AcNeu +++ епш + еош - ебш ++ кв 11 52561 12 Продовження таблиці 3 Порівняльна динаміка вуглеводних компонентів глікопротеїнових рецепторів СОС за умов загоєння неерозивних уражень через 24 та 48 год. у щурів без та із введенням пробіотиків (тварини 4 і 5 та 6 і 7 експериментальних груп) Структурні компоненти слизової оболонки стравоходу Назва лектину та його вугЕпітеліальна пласлеводна специфічність Власна пластинка М'язова пластинка Підслизова основа тинка +++ епш Лектин насіння арахісу (PNA), специфічний до +++ ебш + кв + гз + кв DGal ++ еош Лектин кори бузини чорної (SNA), специфічний до ++ епш +++ кв ++ гз + кв Neu 5Ac/2→6Gal +++ епш Лектин виноградного сли+ еош мака (НРА), специфічний +++ кв + гз +++ кв + ебш до NAcDGal +++ бм Примітка: епш - епітеліоцити поверхневого шару, еош - епітеліоцити остистого шару, ебш - епітеліоцити базального шару, кв - колагенові волокна, гз - гомогенне забарвлення, бм - базальна мембрана. Корекція пробіотиком цитоагресивного впливу візуалізувалась у модифікації експресії лектинорецепторів, що вказувало на індуковану ним функціональну реорганізацію епітеліального бар'єру та більш виражені ознаки загоєння, активування регенерації, елімінації уражених клітин, порівняно з результатами, отриманими за умов спонтанного загоювання у групі 6. Проведені дослідження показують, що процес загоювання у СОС обумовлений як зростанням біосинтезу глікопротеїнів, так і/або зменшенням їхньої деградації внаслідок активності NOS та простагландинів. Динаміка мозаїки експресії лектинових рецепторів підтвердила участь глікокон'югатів у процесах цитолізу та загоювання, що може бути використано як критерій регенерації СОС. Результати проведених досліджень свідчать, що застосування пробіотиків має виразну цитопротекторну, регенераційну і захисну дію, що реалізується у структурно-функціональній реорганізації епітеліального бар'єру СОС та пришвидшенні виразкозагоєння деструктивних стрес-індукованих уражень СОС. Таким чином, пробіотики - це новий засіб езофагопротекції та виразкозагоювання неерозивних уражень стравоходу, що є підставою для їх клінічного застосування (впровадження). Джерела інформації: 1. Майкова Т.В. Стрес як чинник розвитку поєднаної патології органів травлення. - Сучасна гастроентерологія. - 2004. - 4(18). - С.49-52. 2. Бабак О.Я. Гастроэзофагеальная рефлюксная болезнь / О.Я. Бабак, Г.Д. Фадеенко. - К.: Интерфарма, 2000. - 175с. 3. Заячківська О.С., Гжегоцький М.Р., Слівовський З. та ін. Модельні дослідження участі оксиду азоту, простаноїдів та глікокон'югатів епітеліального бар'єру стравоходу в езофагопротекції // Лікарська справа. - 2006. - №7. - С.35-41. 4. Заячківська О.С., Джура О.Р., Ященко A.M. Вивчення вазодилататорних ефектів мелатоніну на експресію лектинових рецепторів за умов експериментального езофагіту in vivo // Буковинський медичний вісник. - 2006. - ТЛО, №4. - С.47-49. 5. Савицька М.Я., Заячківська О.С., Гжегоцький М.Р., Ященко A.M. Особливості складу вуглеводного компоненту глікопротеїнових рецепторів епітеліального бар'єру стравоходу за умов гоєння стрес-індукованих уражень (експериментальні дослідження) // Практична медицина. - 2009. - 2 (Т. XV). - С.69-80. 13 Комп’ютерна верстка Л. Ціхановська 52561 Підписне 14 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of probiotics as esophagoprotectors and ulcer-healing agents in nonerosive lesions of esophagus
Автори англійськоюSavytska Mariana Yaroslavivna, Zaiachkivska Oksana Stanislavivna, Hzhehotskyi Mechyslav Romanovych
Назва патенту російськоюПрименение пробиотиков как эзофагопротекторных и средств и средств для заживления язвы при неэрозивных поражениях пищевода
Автори російськоюСавицкая Марьяна Ярославовна, Заячковская Оксана Станиславовна, Гжегоцкий Мечислав Романович
МПК / Мітки
МПК: A61K 35/66, A61P 1/00
Мітки: езофагопротеторних, застосування, ураженнях, засобів, неерозивних, виразкозагоювальних, пробіотиків, стравоходу
Код посилання
<a href="https://ua.patents.su/7-52561-zastosuvannya-probiotikiv-yak-ezofagoprotetornikh-ta-virazkozagoyuvalnikh-zasobiv-pri-neerozivnikh-urazhennyakh-stravokhodu.html" target="_blank" rel="follow" title="База патентів України">Застосування пробіотиків як езофагопротеторних та виразкозагоювальних засобів при неерозивних ураженнях стравоходу</a>
Попередній патент: Спосіб вольтамперометричного визначення вітаміну b 1 (тіамін броміду) у водних розчинах
Наступний патент: Креслярський пристрій для відтворення гіперболи
Випадковий патент: Пристрій контролю обриву фаз трифазної мережі