Спосіб одержання поверхневого антигену віруса гепатиту в за допомогою рекомбінантних штамів дріжджів hansenula polymorpha з пошкодженою катаболітною репресією
Номер патенту: 73449
Опубліковано: 25.09.2012
Автори: Сибірний Андрій Андрійович, Стасик Олег Володимирович, Красовська Олена Сильвестрівна
Формула / Реферат
Спосіб одержаного поверхневого антигену вірусу гепатиту В за допомогою рекомбінантних штамів дріжджів Hansenula Polymorpha з пошкодженою катаболітною репресією, який відрізняється тим, що експресія поверхневого антигена вірусу гепатиту В здійснюється мутантними штамами дріжджів Н. polymorpha з пошкодженою катаболітною репресією, здатними синтезувати поверхневий антиген на середовищі з глюкозою або ксилозою, а селекція мультикопійних інтегрантів проводиться без використання генів стійкості до антибіотиків, а на основі нативних генів дріжджів.
Текст
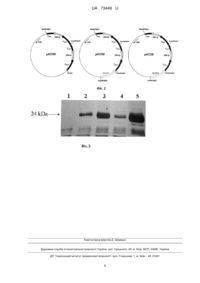
Реферат: Спосіб одержаного поверхневого антигену вірусу гепатиту В за допомогою рекомбінантних штамів дріжджів Hansenula Polymorpha з пошкодженою катаболітною репресією, причому експресія поверхневого антигену вірусу гепатиту В здійснюється мутантними штамами дріжджів Н. polymorpha з пошкодженою катаболітною репресією, здатними синтезувати поверхневий антиген на середовищі з глюкозою або ксилозою, а селекція мультикопійних інтегрантів проводиться без використання генів стійкості до антибіотиків, а на основі нативних генів дріжджів. UA 73449 U (54) СПОСІБ ОДЕРЖАННЯ ПОВЕРХНЕВОГО АНТИГЕНУ ВІРУСА ГЕПАТИТУ В ЗА ДОПОМОГОЮ РЕКОМБІНАНТНИХ ШТАМІВ ДРІЖДЖІВ HANSENULA POLYMORPHA З ПОШКОДЖЕНОЮ КАТАБОЛІТНОЮ РЕПРЕСІЄЮ UA 73449 U UA 73449 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель стосується галузі біотехнології і є способом одержання рекомбінантного білка - поверхневого антигену вірусу гепатиту В як компонента вакцини проти відповідної хвороби на основі метилотрофних дріжджів Hansenula polymorpha. Експресія гетерологічних білків є одним із промислово важливих біотехнологічних процесів, що здійснюється дріжджами. Одна із систем експресії чужорідних білків, які на даний момент використовуються у світі, була створена на основі метилотрофних дріжджів Н. polymorpha. Традиційна система експресії базується на використанні потужного промотору гена алкогольоксидази (РМОХ). Відповідний промотор регулюється вуглецевими ростовими субстратами: індукується метанолом, але повністю репресується глюкозою чи іншими цукрами. Регульований характер РМОХ дає можливість оптимального використання поживних ростових субстратів при двофазовому режимі ферментації: спочатку у середовищі з глюкозою нарощується висока біомаса, після чого додаванням метанолу індукується синтез гетерологічного білка [1]. Такий спосіб ферментації є зручним, якщо великі кількості рекомбінантного білка призводять до цитотоксичного ефекту, як у випадку компонента вакцини проти гепатиту В (HBsAg). Однак, традиційна система експресії має також і недоліки. Використання метанолу у великомасштабному виробництві для індукції синтезу гетерологічних білків має ряд недоліків і ускладнюється тим фактом, що ця сполука є токсичною для інших організмів, в тому числі людини, легко займається, потребує великих енергозатрат на процес аерації, і, як наслідок, затратами на охолодження біореактора. Тому, при існуючому промисловому виробництві, синтез білків у Н. polymorpha досягається у більшості випадків у середовищі з гліцеролом, який забезпечує лише 30 % максимальної індукції РМОХ і процес виробництва є недостатньо ефективним [2]. Крім того, для досягнення максимальної продукції даного гетерологічного білка (HBsAg) необхідна мультикопійна інтеграція касети експресії в геном штама-продуцента, а отже, ефективний метод селекції таких інтегрантів. В основу корисної моделі поставлена задача розробити спосіб отримання покращеного продуцента вірусу гепатиту В на дешевих і нетоксичних альтернативних джерелах вуглецю за допомогою мультикопійних інтегрантів, отриманих з використанням нативних генів дріжджів як селективних маркерів ауксотрофності. Поставлена задача вирішується тим, що у способі одержання продуцента поверхневого антигену на основі дріжджів Н. polymorpha, згідно з корисною моделлю, продукція гетерологічного білка здійснюється рекомбінантними штамами дріжджів Н. polymorpha з пошкодженою катаболітною репресією промотора гену алкогольоксидази, в геном яких вводять касету експресії HBsAg під контролем цього промотора. Відбір мультикопійних інтегрантів здійснюють за рахунок відновлення прототрофності. Більшість методів селекції мультикопійних інтегрантів базується на використанні генів стійкості до антибіотиків, що є потенційно небезпечним для навколишнього середовища. Спосіб одержання продуцента HBsAg базується на використанні нативних генів дріжджів. Гени URA3 дріжджів Saccharomyces cerevisiae під контролем нативного промотора і ADE1 Pichia pastoris під контролем власного вкороченого до 55 пар нуклеотидів промотору експресуються на низькому рівні у Н. polymorpha, тому відбір трансформантів реципієнтних ауксотрофних штамів (Н. polymorpha ura3 та ade1 відповідно) векторами, що містять ці гени, відбувається за принципом максимального відновлення росту за рахунок інтеграції у геном великої кількості копій касет експресії. Найбільш близьким до запропонованого є спосіб одержання поверхневого антигену вірусу гепатиту В за допомогою дріжджів P. pastoris [3]. Вихід HBsAg у P. pastoris складає приблизно 27 мг/л. Однак така продуктивність синтезу HBsAg є все-ще недостатньою для налагодження рентабельного промислового виробництва. Окрім цього, штам продукує гетерологічний білок за класичною схемою на середовищі з гліцеролом і метанолом, а відбір трансформантів здійснюється за рахунок введення гена стійкості до антибіотика зеоцину у геном продуцентів. У запропонованому способі використовуються методи: полімеразна ланцюгова реакція (ПЛР), конструювання рекомбінантних плазмід, виділення плазмід з Escherichia coli, рестрикційний аналіз, електрофорез ДНК в агарозному гелі, трансформація Е. coli методом електропорації, електрофорез та фарбування сріблом білків в поліакриламідному гелі, описані в [4]. Трансформацію Н. polymorpha проводять, як описано в [5]. Виділення сумарної ДНК з дріжджів проводиться як для S. cerevisiae [6]. Спосіб одержання поверхневого антигену вірусу гепатиту В за допомогою рекомбінантних штамів дріжджів Н. polymorpha з пошкодженою катаболітною репресією ілюструється графічними матеріалами: 1 UA 73449 U 5 10 15 20 25 30 35 40 На Фіг. 1 зображено схему конструювання і перевірки мутанта Н. polymorpha EAO2Δade1 з делецією гена ADE1, де 5' і 3' - фланкуючі ділянки гена ADE1 Н. polymorpha, К - вихідний штам Н. polymorpha EAO2 leu 1-1, Δade1- отриманий мутант Н. polymorpha EAO2Δade1. На Фіг. 2. зображено схеми плазмід рКО35, рКО36, рКО38, де промотор алкогольоксидази позначено чорною стрілкою; термінатор амінооксидази позначено чорною смугою; ген HBsAg позначено сірою смугою; гени ADE1 Р. pastoris і URA3 S. cerevisiae позначено білими смугами; тонкою чорною лінією позначено бактерійну частину вектора. Сайти рестрикції позначено: BamHI; BglII. На Фіг. 3 зображено електрофорез безклітинних екстрактів штамів: 1 - Н. polymorpha ЕАО2 leu 1-1, 2 - продуцента HBsAg ЕАО2 Н25 [9], 3 - ЕАО2 Н15, 4 - ЕАО2 Н15 ura3, 5 - ЕАО2 Н90. Нанесено по 20 мкг клітинного лізату. Спосіб одержання поверхневого антигену вірусу гепатиту В за допомогою рекомбінантних штамів дріжджів Н. polymorpha з пошкодженою катаболітною репресією здійснюють у декілька етапів: Етап 1. Конструювання реципієнтного штаму Н. polymorpha з делецією гена ADE1 на основі мутанта з пошкодженою катаболітною репресією Для одержання мутанта з делецією гена ADE1 конструюють плазміду, що містить ген LEU2 S. cerevisiae та фланкуючі 5' і 3' ділянки гена ADE1 Н. polymorpha, отримані ПЛР за допомогою праймерів OL120, OL121 (5') та OL122, OL123 (3') з геномної ДНК штаму дикого типу. 3'-ділянку клонують по сайтах ендонуклеаз рестрикції Хbal та Sall, 5'-ділянку - по сайтах PstI, HindIII на плазміду pYT1 [7]. Сконструйовану плазміду позначено рКО24. За допомогою праймерів OL120, OL123 з рКО24 отримують делеційну касету і трансформують штам Н. polymorpha EAO2 leu 1-1 з пошкодженою катаболітною репресією [8, Табл.]. + Трансформацію проводять методом електропорації, селекцію Leu -трансформантів проводять на мінімальному середовищі YNB з 1 % глюкозою. Серед низки трансформантів + відбирають стабільні Leu -інтегранти, не здатні рости на мінімальному середовищі без аденіну. Коректність делеції перевіряють за допомогою ПЛР з використанням відповідної пари праймерів (OL120 і ОL123) (Фіг. 1, Табл.). Етап 2. Конструювання векторів для експресії HBsAg Касету експресії HBsAg отримують за допомогою праймерів OL147 та OL148, використовуючи як матрицю плазміду рКО26, похідну від рКО6 [9]. Отриманий фрагмент, який містить промотор гену алкогольоксидази, ген HBsAg і термінатор амінооксидази обробляють ендонуклеазами рестрикції ВатНІ і BglІІ і клонують на плазмідний вектор pUC19 [4]. Відбирають вектор, що несе дві копії касети експресії HBsAg. Сконструйовану плазміду позначено рКО35 (Фіг. 2). Ген URA3 S. cerevisiae під контролем власного промотора отримують з геномної ДНК S. cerevisiae методом ПЛР за допомогою праймерів OL186 і OL187. Ген ADE1 P. pastoris під контролем власного промотора отримують з геномної ДНК P. pastoris методом ПЛР за допомогою праймерів OL188 і OL189. Фрагменти обробляють ендонуклеазою рестрикції BglІІ і клонують на плазмідний вектор рКО35. Сконструйовані вектори позначено рКО36 і рКО38 (Фіг. 2). Таблиця Перелік праймерів, які використовують на 1, 2 та 3 етапах способу Назва праймера Послідовність нуклеотидів OL120 OL121 OL122 OL123 OL147 OL148 OL186 OL187 OL188 OL189 OL167 OL170 Етап 3. Конструювання рекомбінантних штамів Н. polymorpha 2 UA 73449 U 5 10 15 20 25 30 35 40 45 Плазмідою рКО36, попередньо лінеаризованою рестриктазою КpnI, трансформують рецепієнтний штам Н. polymorpha EAO2 Δade1, отриманий на першому етапі роботи. Селекцію + Аde -трансформантів проводять на мінімальному середовищі YNB з 1 % глюкозою. Серед низки + трансформантів відбирають стабільні Аde -інтегранти. Стабільність перевіряють шляхом інкубації трансформантів на неселективному середовищі YPD (ріст протягом 60 генерацій) з наступним перенесенням на селективне середовище YNB з 1 % глюкозою. Трансформанти, які залишаються прототрофами за аденіновим маркером є стабільними. Інтегранти, що ростуть найкраще на мінімальному середовищі, відбирають для перевірки продукції HBsAg методом електрофорезу білків в полаакриламідному гелі. Відбирають трансформант, що продукує найбільшу кількість HBsAg, позначений Н. polymorpha EAO2 Н15 і на основі нього одержують мутант аусотрофний за урацилом. Для цього за допомогою праймерів OL167 і OL170 з геномної ДНК ауксотрофного по урацилу штаму Н. polymorpha RB11 ura3 виділяють фрагмент ДНК, що відповідає пошкодженому мікроделецією гену URA3. Цим фрагментом трансформують ¯ відібраний продуцент HBsAg методом електротрансформації. Селекцію Ura -трансформантів проводять на мінімальному середовищі YNB з 1 % глюкозою, урацилом і 5-фтороротовою ¯ кислотою. Серед низки трансформантів відбирають стабільні Ura -мутанти, не здатні рости на середовищі без додавання урацилу. Стабільність перевіряють шляхом інкубації трансформантів на неселективному середовищі YPD (ріст протягом 60 генерацій) з наступним перенесенням на селективне середовище YNB з 1 % глюкозою, урацилом і 5'фтороротовою кислотою. Трансформанти, які залишаються стійкими до 5'фтороротової кислоти і ауксотрофами за урациловим маркером є стабільними. Плазмідою рКО38, попередньо лінеаризованою рестриктазою КpnI, трансформують рецепієнтний штам Н. polymorpha EAO2 Н15 ura3. Трансформацію проводять методом + електропорації, селекцію Ura -трансформантів проводять на мінімальному середовищі YNB з 1 + % глюкозою. Серед низки трансформантів відбирають стабільні Ura -інтегранти. Стабільність перевіряють, як описано вище. Інтегранти, що ростуть найкраще на мінімальному середовищі, відбирають для перевірки продукції HBsAg методом електрофорезу білків в поліакриламідному гелі (Фіг. 3). Трансформант, що продукує найбільшу кількість HBsAg, позначений Н. polymorpha EAO2 Н90. Етап 4. Умови індукції синтезу та екстракції HBsAg Індукцію синтезу HBsAg проводять на середовищі YNB з 1 % ксилозою, 0,25 % метиламіном і 0,1 % дріжджовим екстрактом протягом 144 годин, як описано в [9]. Для екстракції використовують буфер, що містить 10 мМ калійфосфатний буфер рН 7,5, 5 мМ ЕДТА, 0,5 М NaCl, 0,5 % Triton Х100 [9]. Очистку HBsAg проводять як описано для P. pastoris [3]. Джерела інформації: 1. Gellissen G. // Appl. Microbiol. Biotechnol.-2000. - Vol. 54. - Р. 741-750. 2. Gellissen G. et al. // FEMS Yeast Res.-2005. - Vol. 5, N11. - P. 1079-1096. 3. Liu R. et al. // Appl. Biochem. Biotechnol.-2009. - Vol. 158. - P. 432-44. 4. Sambrook J., Fritsh E. F., Maniatis T. Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory, Cold Spring Harbor, New York. 1989. 5. Faber K. et al. // Curr. Genet.-1994. - Vol. 25, N. 4. - P. 305-310. 6. Wach A., Pick H., Philipsen P. In: Molecular Genetics of Yeast. A Practical Approach (Johnston, JR., Ed.), IRL Press, Oxford.-1994. - P. 1-16. 7. Tan, X. etal. //J. Cell Biol.-1995. - Vol. 128, N3. - P. 307-319. 8. Stasyk O, Stasyk O., Sibirny A. // Biopolymers Cells.-2002. - Vol. 18. - P. 155-160. 9. Krasovska et al. // Biotech. Bioeng.-2007. - Vol. 97, N. 4. - P. 858-870. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 50 55 Спосіб одержаного поверхневого антигену вірусу гепатиту В за допомогою рекомбінантних штамів дріжджів Hansenula Polymorpha з пошкодженою катаболітною репресією, який відрізняється тим, що експресія поверхневого антигену вірусу гепатиту В здійснюється мутантними штамами дріжджів Н. polymorpha з пошкодженою катаболітною репресією, здатними синтезувати поверхневий антиген на середовищі з глюкозою або ксилозою, а селекція мультикопійних інтегрантів проводиться без використання генів стійкості до антибіотиків, а на основі нативних генів дріжджів. 3 UA 73449 U 4 UA 73449 U Комп’ютерна верстка Д. Шеверун Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 5
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for production of hepatitis b virus surface antigen by recombinant strains of yeast hansenula polymorpha with damaged catabolite repression
Автори англійськоюKrasovska Olena Sylvestrivna, Stasyk Oleh Volodymyrovych, Sybirnyi Andrii Andriiovych
Назва патенту російськоюСпособ получения поверхностного антигена вируса гепатита в с помощью рекомбинантных штаммов дрожжей hansenula polymorpha с поврежденной катаболитной репрессией
Автори російськоюКрасовская Елена Сильвестровна, Стасик Олег Владимирович, Сибирный Андрей Андреевич
МПК / Мітки
МПК: C12P 7/06
Мітки: катаболітною, репресією, штамів, антигену, hansenula, допомогою, віруса, polymorpha, спосіб, рекомбінантних, одержання, гепатиту, дріжджів, поверхневого, пошкодженою
Код посилання
<a href="https://ua.patents.su/7-73449-sposib-oderzhannya-poverkhnevogo-antigenu-virusa-gepatitu-v-za-dopomogoyu-rekombinantnikh-shtamiv-drizhdzhiv-hansenula-polymorpha-z-poshkodzhenoyu-katabolitnoyu-represiehyu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання поверхневого антигену віруса гепатиту в за допомогою рекомбінантних штамів дріжджів hansenula polymorpha з пошкодженою катаболітною репресією</a>
Попередній патент: Формувач періодичної послідовності пачок з фіксованою кількістю імпульсів в пачці, рівною чотирьом, з перестроюваною тривалістю імпульсів і паузи між пачками
Наступний патент: Спосіб підготовки рідких середовищ до диспергування
Випадковий патент: Спосіб зниження токсичності грунтів