Спосіб стабілізації індивідуального субстрату для спектрального визначення злоякісності
Формула / Реферат
Спосіб стабілізації індивідуального субстрату для спектрального визначення злоякісності, у якому ексудатом, взятим стерильно з організму людини є плевральний випіт, перикардіальний випіт або асцит і як стабілізатор використовують сульфат амонію, сульфат гуанідинію, сульфат цезію або первинний кислий фосфат калію і як спектральний розчинник використовують 95% етанол, тетрагідрофуран або діоксан, в якому 18 - 20 мл ексудату стабілізують 0,3 - 1,2 мл 10% водного розчину стабілізатора і одержану суміш центрифугують протягом 800 - 1050 сек. зі швидкістю 22,8 - 26,6 обертів/сек., який відрізняється тим, що беруть 2,2 - 2,7 мл від загального об'єму одержаного прозорого зразка, до якого додають 0,3 - 0,7 мл прозорого розчинника спектральної чистоти і одержаний зразок індивідуального субстрату заморожують при 248 – 257 К до використання або негайно знімають спектр.
Текст
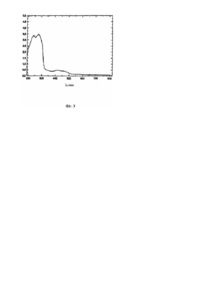
Винахід належить до нових, спектральних скринінг діагностичних способів в медицині і відноситься до нового, додаткового, UV-VTS спектрального скринінг діагностичного способу для визначення злоякісних і доброякісних рідин аналізом індивідуального субстрату для спектральної діагностики злоякісності. [За Міжнародною патентною класифікацією має наступний індекс: А61В-05/00, А61К51/00; G01N33/00, G01N33/53; G01N33/573, G01N33/574, С12Q1/68 і інш.]. Технічною проблемою, що вирішується даним винаходом, є забезпечення такого UV-VIS спектрального скринінг діагностичного способу, який вказує на наявність злоякісності в стабілізованому субстраті in vitro новим способом, не описаним досі в попередньому рівні. Крім того, прийняті і надійні методи, що використовуються досі в онкології, наприклад біопсія, є дуже інвазивними. Поставити діагноз є звичайною клінічною і технічною проблемою. Будь-яка додаткова інформація в діагностиці, в значенні додаткових скринінг діагностичних способів дуже дорогоцінна, тому що поповнює картину патологічного процесу в організмі і таким способом полегшує встановлення правильного остаточного діагнозу. Основною проблемою кожного способу діагностики (класичного і додаткового), є те, що він повинен бути менш інвазивним або неінвазивним, швидким і надійним. Приклад складності такої задачі - діагноз гіпертензії, тобто саме точне вимірювання кров'яного тиску здійснюється інвазивним способом за допомогою внутрішньоартеріального катетера. Внаслідок інвазивності, технічних обмежень і за фінансовими причинами, такий спосіб не придатний для щоденного застосування і скринінга [Momcilo Babic, Skrining u medicini, Markom-publik, Beograd, 2001]. На жаль, точність діагностичного способу часто пропорційна його інвазивності, і тому його використовують як останній діагностичний спосіб. Тому, проводять роботи по розвитку і відкриттю додаткових діагностичних способів, які менш інвазивні, але звичайно менш точні. Враховуючи те, що всі методи мають свої переваги і недоліки і що жоден з них не є 100% надійним, або однозначним, остаточний діагноз завжди встановлюється при використанні декількох різних діагностичних способів. Розв'язання проблеми правильної діагностики досягається розвитком нових додаткових, швидких, скринінг діагностичних способів, що полегшують і прискорюють звичайну стандартну клінічну процедуру. Новий діагностичний спосіб повинен бути більш швидким і інформативним, ніж існуючі, менш інвазивним і для його застосування повинен бути доступний економічно більш сприятливий інструментарій. Відомі численні діагностичні методи в онкології і пульмонології, наприклад: рентгенівський аналіз, ультразвук, ядерно-магнітний резонанс, СТ scan MRI (зріз КТ ЯМР) плевроцентез, біопсія хворої тканини, тести крові і т.п. [Ruckdeschel JC. Malignant Pleural Effusions, Recent Advances in Diagnosis and Management, Princeton, J. Jersey, Bristol Myers Squibb Company, 1992, 8-11]. Кількість і наявність злоякісних клітин, наприклад в плевральному випоті, неможливо визначити цитологічним аналізом тільки в одному випробуванні. Декілька послідовних випробувань дають більш надійний результат, але не завжди. У випадку біопсії тканини, тканина являє собою субстрат для подальшого діагностичного способу. Тканина, що аналізується, повинна бути репрезентативною, тобто повинна відповідати певним умовам, і це: саме зразок повинен містити тканину пухлини, що тестується, а також і частину тканини, що межує з нормальною тканиною. Також важливо, щоб в пухлинній тканині не було повторних змін (некроз, кровотеча і інш.). Найбільш велика кількість помилково-позитивних і помилково-негативних діагнозів встановлена саме на зразках тканин, які були здавленими, коагульованими, набряклими від крові, некротичними, фіксованими невідповідним чином або через недостатність матеріалу. У цей час в діагностиці раку використовуються наступні діагностичні методи: 1. Біопсія ex tempore (одночасна), (Frozen Section, FS) 2. Аспіраційна біопсія з цитологічним мазком (Fine needle Aspiration, FNA). Також використовуються: 3. Гістохімія, 4. Імуногістохімія, 5. Електронна мікроскопія, 6. Культура тканин (гібридизація in situ, рецепторна ауторадіографія і інші нові методи, недоступні нам по фінансових причинах). Ex tempore біопсія повинна бути точною, надійною і швидкою, а щоб це здійснити, повинні існувати і відповідні передумови для роботи, а це: 1. Хороше знання патології (солідний досвід), 2. Репрезентативний матеріал (добре приготований субстрат), 3. Відповідні технічні умови. При виконанні вищезгаданих умов, досвідчений патолог може поставити точний діагноз у 90-96% випадків, враховуючи і тривалі відповіді (на тривалих препаратах), що є істотним, оскільки точний діагноз дає можливість хірургу відразу застосувати дуже тривале хірургічне втручання. Репрезентативний матеріал має на увазі, що патолог отримає досить тканин і що зразок містить саме патологічну зміну з частиною тканини, що оточує її. При виконанні біопсії ex tempore у випадках, в яких підозрюється злоякісність існує три можливих відповіді: (a) позитивно на злоякісність, (b) негативно на злоякісність, (c) діагноз відстрочений до тривалих препаратів. [Beahrs O.H.: Staging of cancer of the breast as a guide to therapy. Cancer 53, 592, 1984; Bugis S.P., Yuoung J.E.M. et al.: Diagnosis accuracy of fine needle aspiration biopsy versus frozen section in solitary thyroid nodules. Amer J Surg 152, 411, 1986; Carter D.: Interpretation of Breast Biopsies. New York, Raven Press, 1988]. Цитологічні мазки (Папаніколау) забезпечують ще один спосіб діагностики раку. Даний спосіб має широке застосування у визначенні раку шийки матки, часто в преінвазивній стадії, але також використовується для затвердження випадків потенційної злоякісності, якими є рак ендометрію, бронхогенний рак, рак сечового міхура i передміхурової залози, рак шлунка. Даний спосіб також використовують для ідентифікації клітин пухлини в абдомінальній, плевральній, синовіальній і цереброспінальній рідинах. Як відомо, клітини раку втрачають властивість зчеплення, лущаться і відвалюються, і показують весь спектр морфологічних змін, охоплених терміном анаплазія. Тому, потрібно тестувати лускаті клітини на ознаки анаплазії, що вказують на їх походження. На відміну від гістологічного аналізу, зроблені висновки спираються виключно на порушення цитології індивідуальної клітини, або іноді невеликої групи клітин, без наявності знаків порушення архітектури, втрати орієнтації або доказу інвазії. Даний спосіб дозволяє диференціювати нормальні, дисплазивні і клітини раку, а іноді забезпечує виявлення клітинних змін, характерних для карциноми in situ. Мазки інших типів пухлини - легенів, шлунка, простати, набагато важче оцінити. Потрібно підкреслити, що всі позитивні результати треба підтвердити застосуванням біопсії і гістологічним випробуванням, до застосування будь-якої терапії. Також потрібно указати на те, що негативний цитологічний результат не виключає злоякісну пухлину. Хоч гістологія і ексфоліативна цитологія залишаються методами, що частіше за все застосовуються в діагностиці раку, постійно з'являються нові методи, сприяючі більш швидкій і точній діагностиці. [Cancer statistics, 1989, Cancer 39, 13, 1989; Robbins L.S., Cotran R.S., Kumar V.: Pathologic Basis of Disease, 4 th ed. WB Saunders Co. Philadelphis 1989]. У випадку злоякісного процесу в легенях, найнадійнішим способом є плевроскопія, але як і при діагнозі гіпертензії внутрішньоартеріальним катетером, він являє собою найбільш агресивний і інвазивний спосіб для людини. При лапароскопії використовується так звана лапароскопія media stinuma і плевральної порожнини, відома як інвазивна техніка. При вивченні літератури можна знайти дані про розвиток нових, додаткових діагностичних способів, які або менш інвазивні, ніж вищезазначені, або більш надійні, ніж цитологічний аналіз в значенні встановлення якісного остаточного діагнозу. При детальному розгляді доступної наукової і спеціальної літератури виявлено, що існує дуже невелика кількість, посилань, які відносяться до даної проблеми, і одночасно намагаються подолати недоліки відомих інвазивних діагностичних способів. Так наприклад, "Biomax Technologies Inc.", в своїй патентній заявці від 24.06.1999p. [WO 9966830, СА 9900586] описує пристрій і методи, які дають можливість прямого огляду тканини, індукованої флюоресценцією за допомогою ендоскопу, без використання великої і дорогої допоміжної апаратури. З іншого боку, Board of Regents, The University of Texas System, в своїй заявці від 24.12.1997p. [WO 97/48329, PCT/US 97/10204] описує NIR Raman спектроскопію для in vitro і in vivo визначення передракових поразок шийки матки. Жодна з вказаних патентних заявок в своїх роботах не описує такий простий спосіб ранньої діагностики, як це надає наш спосіб за допомогою відносно простої UV-VIS спектроскопії, що вказує на наявність злоякісної пухлини в стабілізованому субстрат in vitro. Суть винаходу полягає в тому, що захворювання, присутнє в організмі змінює хімію рідини організму, а змінену хімію можна виявити скринінг UV-VIS спектроскопією взятого і стабілізованого індивідуального субстрату in vitro, що визначається довжиною хвилі, кількістю і формою отриманих піків на UV-VIS спектрі запису рідини (стабілізованого індивідуального субстрату). Спосіб стабілізування індивідуального субстрат in vitro для спектральної ідентифікації злоякісної пухлини відповідно до нашого винаходу охоплює додання 0,3-1,2мл 10%мас. водного розчину стабілізатора до рідини організму людини, взятої in vivo (плевральний пунктат, асцит, перикардіальний випіт) і отриману суміш цетрифугують протягом 800-1050сек при 1370-1600обертів/хв., причому із загального об'єму отриманого зразка прозорого вмісту беруть аліквотну частину від 2,2-2,7мл, додають 0,3-0,7мл прозорого розчинника спектральної чистоти і отриманий зразок індивідуального субстрату заморожують при 248-257°К до використання або відразу знімають спектр на UV-VIS спектроскопі. Відповідно до переважного варіанту винаходу, стабілізаторами, що володіють функцією денатурування і стабілізування рідини організму, в якій, між іншим, містяться і протеїни, є: сульфат амонію, сульфат цезію, первинний кислий фосфат калію і гуанідинію сульфат. Відповідно до найбільш переважного варіанту винаходу як стабілізатор використовуються водні розчини сульфату амонію або первинного кислого фосфату калію. Всі UV-VIS спектри зняті при довжині хвилі 200-800нм. Отримані два типи спектрів, один, характерний для злоякісних захворювань, а другий для доброякісних захворювань, наявність яких однозначно виявлена в плевральних випотах, асцитах, перикардіальних випотах. На спектрі першого типу при 230-275нм виявляються два піки. Обидва піки дуже добре оформлені і визначені. Поглинання обох піків має значення між 4 і 5. В діапазоні від 380нм до 500нм виявлено одне дуже рівне плато з низьким значенням поглинання (близько 0,5). Це звичайний тип спектра всіх вказаних рідин організму (плевральних випотів, асцитів і перикардіальних випотів) при наявності злоякісного захворювання в будь-якій частині організму. У 620 з 650 випробуваних рідин організму з підозрою на наявність злоякісності в організмі, отриманий такий тип спектра. Діагноз, поставлений UV-VIS спектроскопією, був підтверджений і співпадає з діагнозом, поставленим звичайними клінічними, радіологічними, цитологічними і гістопатологічними процедурами. Другий тип отриманих спектрів показав замість двох добре визначених піків в ділянці 230-280нм - одну дуже широку смугу, яка на верху в основному має багато шумів. Значення поглинання становить 4-5. Дана широка смуга типова для рідин організму, що є наслідком доброякісних захворювань в організмі. У діапазоні від 380нм до 599нм з'являється високе плато, яке в чотири п'ять разів вище, ніж плато у випадку злоякісних захворювань. Діагноз відсутності злоякісності пухлини підтверджений у 300 з 325 випробуваних рідин організму (плевральний випіт, асцит, перикардіальний випіт). Істотною відмінністю є те, що новим скринінг діагностичним способом можна виявити злоякісне захворювання в трьох випробуваних видах рідин організму. Перевага і суть винайденого способу в порівнянні з існуючими діагностичними методами, якими є всі методи, вказані в розділі, що описує рівень техніки, полягають в тому, що він проводиться швидше за всі способи, що він є інформативним в значенні надання ясних вказівок в якому напрямі потрібно застосовувати інші відомі додаткові діагностичні методи, доступним з фінансової сторони і неінвазивним, тому що використовує рідини організму людини, взяті з організму хворої людини, що є стандартною частиною клінічної процедури, є таким, що підтверджується в значенні збігу з іншими клінічними методами, наприклад з магнітним резонансом, цитологічним аналізом, рентгеном і гістопатологічним результатом. Незалежно від того, в якому органі розвивається злоякісне захворювання, даним способом може бути виявлена злоякісність в будь-якій випробуваній рідині організму. Фіг.1 - типовий UV-VIS спектр асцитів, характерний для наявності злоякісних захворювань в організмі. Фіг.2 - типовий UV-VIS спектр перикардіального випоту, характерного для наявності доброякісного захворювання в організмі (пневмонії). Фіг.3 - UV-VIS спектр перикардіального випоту пацієнта з серцевою недостатністю і хворобою Ходжкіна, де чітко бачимо типовий UV-VIS спектр, який показує наявність злоякісного процесу в організмі. Таблиця - всі дані в зв'язку з вибраним зразком певного числа (30) пацієнтів, стабілізовану рідину організму яких аналізували, в якій діагноз, поставлений UV-VIS спектроскопією, однозначно співпадає з клінічними діагнозами, встановленими за допомогою різних інших клінічних способів. Таблиця Шифр Ексудат (вид Вік/стать пацієнта взятої тіл. рідини) перикардіальний ХХ02 1967/ж випіт плевральний ХХ05 1914/ж випіт ХХ07 1951/ж асцит ХХ08 1939/ж асцит ХХ09 1947/ж асцит XY10 1934/ч асцит XXI3 1940/ж асцит XX14 1948/ж асцит XX22 1925/ж асцит XY24 1945/ч асцит XY27 1941/ч асцит XX28 1940/ж плевральний випіт XX29 1956/ж плевральний випіт ХХ30 1938/ж асцит XY32 1953/ч асцит ХХ33 1945/ж асцит ХХ34 1972/ж ХХ35 1920/ж перикардіальний випіт асцит Клінічний діагноз Результат цитології UV/VIS діагноз Non-Hodgkin lymphoma st IVB;St. post злоякісні клітини irrad. CNS am I/iand VCS am I Μ Adenocarcinoma pulm.I. dex. Μ St.post.resec.sigmae pp ca aa II St.post.amp. Mammae I.sin pp Ca aaXII; Effusio pleurae I. sin. maligna, Pleurodesis am III; Ascites St.post hysterectomiam totalis cum adnexextomiam bill.pp ca ovarii st.IC Neo ventriculi cum meta hepatitis Са ventriculi typus diffusum (anaplasticum) cum meta. in lymphonodis St.post. amput. Mammae I. dex.pp Ca. Meta hepatis Tu ovarii lat dex. Adenocarcinoma partim anaplasticum f. ventriculi. Meta hepatitis. Carcinosis peritonei. Ascites Μ злоякісні клітини, що походять з осередку карциноми Μ Μ Μ злоякісні клітини, що походять з карциноми клітини Ascites. Carcinosis peritonei ex origine аденокарциноми, ignote. частково гігантоклітинної St.post.amp mammae I. dex. pp Ca ductale inv. exulc. Gr. Ill aa III. St.post. irrad. Post op. Meta. Pulmo. bil. cum pleuritis carcinomatosa I. dex. Meta ossium gen. St.post. incultus vascularis cerebri. St.post.amp. Mammae I. dex. pp Ca ductale inv. GUI aalX, meta hepatis, meta pulmonum. еритроцити, лімфоцити, St. post. amp. mammae I. dexpp Ca макрофаги і маса aaXXSt. post irradiationem praeoper. окремих клітин і ssXX Hepattomeglia. Infiltratio hepatis сосочкових пухлин. susp. Ascites. Effusio pleurae I. dex. Злоякісні. Infiltratio mal. Peritonei. Cystitis ovarii I. Походження з dex. Hzdronephrosis ren. Pancreatitis осередку слабко chronica. Noduli диферен. гігантокл. карциноми Adenocarcinoma corporis ventriculi typus diffusum inop. carcinosis peritonei. ascites. hypoalbuminemia. St. post. lap. Expl. a.m. II. St. post. amp. m. Isin. p.p. Ca aa V. St.post. TCTpostop. A.a. IV/V. St.post. ovariect. bil. Pp Meta aa II meta ossium gen. St.post. ira. Palitiva coxae pp meta pangastritis chronica erosiva. anemia complexa sec. trombocythopaen. Μ Μ Μ Μ Μ Μ Μ Μ Μ Μ Morbus Hodgkin. Μ Tn ovarii sus. Ascites. Effusio pleurae Μ bil. St.post. AMLDpp. Ca ductale infiltrativum aa V/VI. Recidivum locale. Effusio pleurae Ca ovarii st IV. Carcinosis peritonei parietalis et visceralis Laesio hepatitis. Ascites. St.post. nephrectomiam I. dex. Stpost. ICV Status post laryngectomiam partialis horisontalis supragolottica et explorationem cillibilateralis A.A. Ill Ca laryngis recidivans St. post, extirpationem Tu mesosigmae a.a.I/II Ph: Sckwanoma cellulare ХХ45 1952/ж плевральний випіт ХХ46 1936/ж асцит ХХ47 1931/ж асцит ХХ50 1946/ж плевральний випіт ХХ51 1975/ж асцит XY54 1930/ч асцит Ca ventriculi, meta hepatis, carcinosis peritonei ХХ58 1924/ж ХХ59 1934/ж ХХ61 ХХ62 XY65 ХХ66 1942/ж 1946/ж 1931/ч 1934/ж асцит плевральний випіт асцит асцит асцит асцит Tu abdominalis Schwanoma malignum regio cruris lot. Dex. susp. meta Tu ovarii sin. St.post. extirpatio I. gli. colli. I. sin. PP St.post. resecsigmae. Meta hepatis Adenocarcinoma uteri necroticum змішана насиченість клітинами Μ Μ злоякісний мезителіом Μ Μ Μ еритроцити, макрофаги і клітини мезителіому Μ Μ Μ Μ Μ Μ Μ У таблиці вказаний вік пацієнтів, вид випробуваної рідини організму (ексудат), клінічний діагноз і цитологічний результат. В останній графі вказаний результат (діагноз), отриманий UV-VIS спектральним способом, і наявність злоякісної пухлини, позначена "М". Рідини, що аналізуються (ексудати): плевральний пунктат (рідина, що є наслідком патологічного процесу в організмі і що нагромаджується в плевральному просторі), асцит (рідина, що нагромаджується як наслідок патологічного процесу в перитонеальній порожнині) і перикардіальний випіт (рідина, що нагромаджується як наслідок патологічного процесу між двома листками перикорду). Таблиця чітко показує (на зразку, вибраному від 30 пацієнтів), що клінічний діагноз, тобто наявність злоякісної пухлини при різних пухлинних процесах однозначно співпадає з діагнозом, поставленим UV/VIS спектроскопією. Незалежно від виду процесу злоякісної пухлини в організмі (деякі приклади з таблиці: ХХ05 Adenocarcinoma pulm. I. dex., XY10 - Neo ventriculi cum meta hepatitis, XX59 - Schwanoma malignum, XX66 Adenocarcinoma uteri necroticum, XX02 - Non-Hodgkin lymphoma) способом UV-VIS спектроскопії однозначно виявлена наявність злоякісної пухлини (в таблиці позначено "М"). Незалежно від виду випробуваної рідини організму (ексудату), наявність злоякісного процесу виявлена UV/VIS спектроскопією і однозначно співпадає з клінічним діагнозом, отриманим стандартними клінічними методами діагностики раку (біопсія, патогістологічний огляд). Це показують приклади з Таблиці: в перикардіальному випоті (ХХ02) виявлена наявність злоякісної нухлини - Non-Hodgkin lymphoma, позначена в таблиці "М". У плевральному випоті (ХХ05) виявлена наявність злоякісної пухлини - Adenocarcinoma pulm.I.dex, позначена в таблиці "М". В асциті виявлена наявність злоякісної пухлини (ХХ46) - Са ovarii st IV. Carcinosis peritonei pariet alis et visceralis, позначено в таблиці "М". Інформації про хворобу всіх випробуваних пацієнтів збирали у відповідності до стандартного клінічного протоколу і формою, що має на увазі вік, стать, посаду, появу перших симптомів, звичку до куріння, вагу тіла і результати інших аналізів. Для всіх випробуваних пацієнтів з плевральним і перикардіальним випотами характеристично те, що в момент UV-VIS зняття у них не було діагнозу і 90% пацієнтів не проходили курс терапії (за винятком тих, які протягом взяття анамнезу не сказали, що приймають поза лікарським контролем і знання). До цього часу провели випробування на 232 пацієнтах з плевральними випотами, 565 з асцитами і 178 з йерикардіальними випотами. Середній вік випробуваних пацієнтів становить 44,6 років з співвідношенням чоловіки: жінки - 519:456. Приклади методик отримання індивідуального субстрату для спектральної діагностики злоякісності Приклад А. Беруть стерильно звичайним чином з людського тіла 19мл плеврального випоту або перикардіального випоту або асциту, як ексудату, і додають 1мл стабілізатора. Як стабілізатор використовують 10%мас. водного розчину сульфату цезію. Отриману суміш центрифугують протягом 900сек. при 1500обертів/хв. Отриманий прозорий розчин розділяють по 2,5мл без залишку, і додають 0,5мл прозорих спектральних розчинники 95% етанолу і добре перемішують. Отриманий зразок індивідуального субстрату заморожують при 253°К до використання або відразу використовують для спектрального дослідження злоякісності. Приклад В. Чинять так, як і в прикладі А, враховуючи тільки те, що замість сульфату цезію використали сульфат амонію як стабілізатор. Приклад С Чинять так, як і в прикладі А, враховуючи тільки те, що замість сульфату цезію використаний сульфат гуанідинію як стабілізатор. Приклад D. Чинять так, як і в прикладі А, враховуючи тільки те, що замість сульфату цезію використаний первинний кислий фосфат калію як стабілізатор. Приклад Е. Чинять так, як і в прикладі D, враховуючи тільки те, що як прозорий спектральний розчинник використовують діоксан. Приклад F. Чинять так, як і в прикладі D, враховуючи тільки те, що як прозорий спектральний розчинник використовують тетрагідрофуран. Приклад G. Чинять так, як і в прикладі А, враховуючи тільки те, що замість цезію сульфату використовують відповідну кількість еквімолярної суміші сульфату амонію і первинного кислого фосфату калію як стабілізатор. Приклад Н. Чинять так, як і в прикладі G, враховуючи тільки те, що як прозорий розчинник використовують тетрагідрофуран. Приклад І. Чинять так, як і в прикладі G, враховуючи тільки те, що як прозорий розчинник використовують діоксан. Приклад J. Індивідуальний субстрат для спектральної діагностики злоякісності отримують з 2,5мл прозорого вмісту, отриманого з центрифугованого ексудату з людського тіла, до якого заздалегідь додали 1мл стабілізатору, змішали його з 0,5мл прозорого розчинника і заморожували при 253°К до моменту використання. Подальші деталі даного винаходу будуть представлені в наступних прикладах (1-8), без обмеження об'єму даного винаходу тільки цими прикладами. Приклад 1: У пацієнта XY01 (1955/ч) провели екстракцію асциту з абдомінальної ділянки і 2мл асциту (без додаткової обробки) перенесли в кварцову кюветку для UV-VIS спектроскопа. Зняли UV-VIS спектр на UV-VIS спектрофометрі: Hewlett Packard, модель 8452А, в діапазоні 200-800нм. Як еталонний розчин використали дистильовану воду. На Фігурі 1 зображений отриманий UV-VIS спектр. У діапазоні від 230нм до 275нм помічаються два добре формовані і визначені піки. Поглинання піків має значення між 3 і 4. В діапазоні 380-500нм чітко видиме рівне плато з низьким значенням поглинання, близько 0,5 (Фігура 1). Це звичайний тип спектра для рідини організму людини, що є наслідком злоякісних захворювань в організмі, в цьому випадку UV-VIS спектр знятого асциту чітко вказує на злоякісність. Клінічний діагноз, встановлений за допомогою інших діагностичних способів, свідчить: Adenocarcinoma ventriculi inop. Carcinosis peritonei ascites. Приклад 2: У пацієнта ХХ01 (32, ж) екстрагували плевральний випіт з плеврального простору і в момент екстракції не існував будь-який клінічний діагноз. Взяли 2мл плеврального випоту ясно-жовтого кольору, зробили індивідуальний субстрат за способом аналогічним прикладу В, і перенесли в кварцову кюветку для UV-VIS спектроскопії. Як еталонний розчин використали дистильовану воду. Зняли спектр на UV-VIS спектрофометрі: Hewlett Packard, модель 8452А при 200-800нм. Як еталонний розчин використали дистильовану воду. На Фігурі 2 зображений отриманий UV-VIS спектр. У діапазоні від 230нм до 280нм видима широка смуга з множиною піків зі значенням поглинання, що становить 4-5. Широка смуга з множиною піків типова для наявності доброякісних хвороб в організмі. У діапазоні від 380нм до 599нм з'являється високе плато, яке також характерне для наявності доброякісної хвороби (Фігура 2). Клінічним діагнозом, отриманим пізніше за допомогою інших класичних діагностичних способів, є пневмонія. Приклад 3: У пацієнта ХХ02 (1967/ж) екстрагували перикардіальний випіт з перикарду, тому що він страждав серцевою недостатністю. Взяли 2мл перикардіального випоту, зробили індивідуальний субстрат як в прикладі А і перенесли в кварцову кюветку для UV-VIS спектроскопії. Зняли спектр на UV-VIS спектрофотометрі: Hewlett Packard, модель 8452А, діапазон 200-800нм. Як еталонний розчин використали дистильовану воду. На Фігурі 3 зображений отриманий UV-VIS спектр. У діапазоні від 230нм до 275нм помічаються два добре сформовані і визначені піки. Поглинання піків має значення між 3 і 4. В діапазоні 380-500нм чітко видиме рівне плато з низьким значенням поглинання, близько 0,5. Це звичайний тип спектра для рідини організму людини, що є наслідком злоякісного захворювання в організмі (Фігура 3). У цьому випадку знятий UV-VIS спектр перикардіального випоту чітко вказує на злоякісність. У пацієнта ХХ02 за допомогою різних діагностичних способів встановили, що він хворіє також Non-Hodgkin lymphoma st, IVB; st. post irrad. CNS am I/II and VCS am. Перевага UV-VIS діагностичного способу зняттям спектра рідини організму людини в тому, що отриманий спектр вказує на злоякісний процес в організмі, незалежно від того, з якої частини організму взяли рідину і в якому органі відбувається розвиток злоякісного процесу. Приклад 4. З людського тіла звичайним чином стерильно беруть 19мл асциту як ексудату і додають 1мл стабілізатора. Як стабілізатор використовують 1мл 10%мас. водного розчину сульфату цезію. Отриману суміш центрифугують протягом 950сек. з швидкістю 1500обертів/хв. З отриманого прозорого вмісту беруть аліквотну частину від 2,5мл, до неї додають (0,5мл спектрального розчинника, 95% етанолу і добре перемішують. Отриманий зразок індивідуального субстрату заморожують при 253°К до використання або негайно використовують для спектральної діагностики злоякісності. Приклад 5. З людського тіла звичним чином стерильно беруть 19,5мл асциту як ексудату, і додають 0,5мл стабілізатора. Як стабілізатор використовують 0,5мл 10%мас. водного розчину сульфату амонію. Отриману суміш центрифугують протягом 800сек. з швидкістю 1600обертів/хв. З отриманого прозорого вмісту беруть аліквотну частину від 2,4мл, до цього додають 0,6мл спектрального розчинника, 95% етанолу і добре перемішують. Отриманий зразок індивідуального субстрату заморожують при 250°К до використання або негайно використовують для спектральної діагностики злоякісності. Приклад 6. З людського тіла звичайним чином стерильно беруть 20мл асциту як ексудату, і додають 0,3мл стабілізатора. Як стабілізатор використовують 0,3мл 10%мас. водного розчину первинного кислого фосфату калію. Отриману суміш центрифугують протягом 1000сек. з швидкістю 1400обертів/хв. З отриманого прозорого вмісту беруть аліквотну частину від 2,6мл, до цього додають 0,4мл спектрального розчинника, 95% етанолу і добре перемішують. Отриманий зразок індивідуального субстрату заморожують при 257°К до використання або негайно використовують для спектральної діагностики злоякісності. Приклад 7. З людського тіла звичайним чином стерильно беруть 18,7мл асциту як ексудату і додають 0,8мл стабілізатора. Як стабілізатор використовують 0,8мл 10%мас. водного розчину сульфату гуанідинію. Отриману суміш центрифугують протягом 1050сек. з швидкістю 1370обертів/хв. З отриманого прозорого вмісту беруть аліквотну частину від 2,7мл, до цього додають 0,3мл спектрального розчинника, 95% етанолу і добре перемішують. Отриманий зразок індивідуального субстрату заморожують при 248°К до використання або негайно використовують для спектральної діагностики злоякісності. Приклад 8. З людського тіла звичайним чином стерильно беруть 18,4мл асциту як ексудату і додають 1,2мл стабілізатора. Як стабілізатор використовують 1,2мл 10%мас. водного розчину сульфату амонію. Отриману суміш центрифугують протягом 850сек. з швидкістю 1550обертів/хв. З отриманого прозорого вмісту беруть аліквотну частину від 2,2мл, до даного об'єму додають 0,7мл спектрального розчинника, 95% етанолу і добре перемішують. Отриманий зразок індивідуального субстрату заморожують при 250°К до використання або негайно використовують для спектральної діагностики злоякісності. Приклад 9. З людського тіла звичайним чином стерильно беруть 18,0мл плеврального випоту як ексудату і додають 1,0мл стабілізатора. Як стабілізатор використовують 1,0мл 10% мас. водного розчину сульфату амонію. Отриману суміш центрифугують протягом 880сек. з швидкістю 1500обертів/хв. З отриманого прозорого вмісту беруть аліквотну частину від 2,5мл, до неї додають 0,9мл спектрального розчинника, 95% етанолу і добре перемішують. Отриманий зразок індивідуального субстрату заморожують при 250°К до використання або негайно використовують для спектральної діагностики злоякісності. Приклад 10. З людського тіла звичайним чином стерильно беруть 18,0мл перикардіального випоту як ексудату і додають 1,0мл стабілізатора. Як стабілізатор використовують 1,0мл 10%мас. водного розчину сульфату амонію. Отриману суміш центрифугують протягом 880сек. з швидкістю 1500обертів/хв. З отриманого прозорого вмісту беруть аліквотну частину від 2,5мл, і додають 0,9мл спектрального розчинника, 95% етанолу і добре перемішують. Отриманий зразок індивідуального субстрату заморожують при 250°К до використання або негайно використовують дія спектральної діагностики злоякісності.
ДивитисяДодаткова інформація
Назва патенту англійськоюProcedure for stabilizing individual substrate for spectroscopic detection of malignancy
Назва патенту російськоюСпособ стабилизации индивидуального субстрата для спектрального выявления злокачественных новообразований
МПК / Мітки
МПК: G01J 3/28, G01N 33/487, A61B 5/00
Мітки: визначення, індивідуального, стабілізації, злоякісності, спосіб, субстрату, спектрального
Код посилання
<a href="https://ua.patents.su/7-78740-sposib-stabilizaci-individualnogo-substratu-dlya-spektralnogo-viznachennya-zloyakisnosti.html" target="_blank" rel="follow" title="База патентів України">Спосіб стабілізації індивідуального субстрату для спектрального визначення злоякісності</a>
Попередній патент: Спосіб одержання моносилану
Наступний патент: Таблетована композиція із швидким вивільненням надчистої флудари та її застосування
Випадковий патент: Спосіб підбору індивідуальної лікувальної дози газоподібних біологічно активних речовин