Стероїди, які мають змішаний андрогенний і прогестагенний профіль
Номер патенту: 84037
Опубліковано: 10.09.2008
Автори: Лейсен Дірк, ван дер Лаув Яп, ротенгейс Арей Ян, де Ґоейер Марсель Еверт
Формула / Реферат
1. Сполука формули І
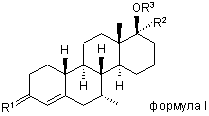 ,
,
де:
R1 - О або NOR, R є гідрогеном, (С1-6) алкілом або (С1-6) ацилом,
R2 є метилом або етилом, а
R3 є гідрогеном або (С1-15) ацилом.
2. Сполука за п. 1, в якій R1 - О.
3. Сполука за п. 1 або 2, яка відрізняється тим, що R1 - О, a R3 є гідрогеном.
4. Сполука (7α,17αβ)-17а-гідрокси-7,17а-диметил-D-гомоестр-4-ен-3-он.
5. Сполука за будь-яким з пп. 1-4 для застосування у терапії.
6. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-4 і фармацевтично прийнятний наповнювач.
7. Застосування сполуки за будь-яким з пп. 1-4 для виробництва медикаменту, який має контрацептивну активність.
8. Комплект для контрацепції самців, який містить засіб для застосування прогестагену і засіб для застосування андрогену, який відрізняється тим, що один із засобів є фармацевтичною композицією за п. 6.
9. Застосування сполуки за будь-яким з пп. 1-4 для виробництва медикаменту для лікування андрогенної недостатності або медикаменту для заміщення тестостерону.
Текст
1. Сполука формули І OR3 R2 2 84037 1 3 84037 стю. Стосовно безпечності особливо важливо мінімізувати ризик втрати кісткової маси і гепатотоксичність. Сполуки, як з андрогенними, так і з прогестагенними властивостями добре відомі з рівня техніки. Наприклад, 7a,17a-диметилнандролон (Міболерон) є високоактивним андрогеном, що також виявляє прогестагенну активність [див., наприклад, L. Markiewicz et аl., Способи і відкриття у експериментальній та клінічній фармакології (1997), 19(4), 215-222]. Вони є перорально активними, але недостатньо безпечними, стосовно гепатотоксичності [див., наприклад, J. Seaman, Токсикологічна патологія (1985), 13(3), 177-180]. Також відомі певні D-гомостероїди, які мають змішаний андрогенний і прогестагенний профіль Наприклад, (17ab)-13-етил-17а-гідрокси-Dгомогон-4-ен-3-он, (17ab)-13-етил-17а-гідрокси17а-метил-D-гомоген-4-ен-3-он, і (17ab)-13,17адиетил-17а-гідрокси-D-гомогон-4-ен-3-он, які описані у US 3,959,322, заявлені як такі, що мають як андрогенну, так і прогестагенну активність. Однак ми показали, що ці сполуки не є перорально активними. 7a-Метил-19-нор-D-гомотестостерон розкрито як синтетичний інтермедіат у WO 85/05361. Ми показали, що ця сполука виявляє андрогенний і прогестагенний профіль. Однак також ми показали, що ця сполука також не є перорально активною. 17аa-метил-19-нор-D-гомотестостерон виявлений, як такий, що має анаболічну активність, і з нашої сторони також має прогестагененну активність [описано у S.N. Ananchenko etal, in Tetrahedron (1962), 18, 1355-67]. Однак, ми показали, що ця сполука страждає від комбінації низької активності при пероральному введенні і не здатна запобігати втраті мінеральної щільності губчатої речовини кісток (МЩГРК). Тепер несподівано виявлено, що у ряді 19нор-D-гомостероїдів, існують змішані андрогенні/прогестагенні стероїди, які є перорально активними, які запобігають втраті мінеральної щільності губчатої речовини кісток, і у яких відсутня гепатотоксичність. Отже першою особливістю винаходу є те, що запропоновано ряд сполук формули І: де, R1 є O, або NOR, R є гідрогеном, (C1-6) алкілом або (C1-6) ацилом, R2 є метилом або етилом, і R3 є гідрогеном або (C1-15) ацилом. В одному з втілень винаходу запропоновано сполуки формули І, де R1 - O. В іншому з втілень винаходу запропоновано сполуку формули І, де R1 - O, a R3 -гідроген, тобто, сполуки (7a,17ab)-17а-гідрокси-7,17а-диметил-D 4 гомоестр-4-ен-3-он і (7a,17аb)-17а-етил-17агідрокси-7-метил-D-гомоестр-4-ен-3-он, зокрема сполука (7а,17ab)-17а-гідрокси-7,17а-диметил-Dгомоестр-4-ен-3-он. Вираз (С1-6)алкіл представляє розгалужену або нерозгалужену алкільну групу, яка має 1-6 атомів карбону. Приклади (С1-6) алкільних гр уп включають метил, етил, пропіл, ізопропіл, бутил, і третичний бутил. Вираз (С1-6)ацил і (С1-15)ацил представляє ацильну груп у, по хідну від карбонової кислоти, що має відповідно 1-6 і 1-15 атомів карбону. Ацильна група може містити вуглеводень, який може бути розгалуженим або нерозгалуженим, насиченим або ненасиченим. Приклади (С1-6) ацильних груп включають форміл, ацетил, пропаноїл, пропеноїл і пивалоїл, а приклади (C1-15) ацилу включають деканоїл і ундеканоїл. Також включені в межах визначення (C1-6) ацил і (C1-15) ацил є ацильними групами, похідними від дикарбонових кислот подібних гемі-малоїлу, гемі-сукциноїлу і геміглутароїлу. Сполуки, де R1 - NOR, R є гідрогеном, (C11-6) алкілом або (С1-6) ацилом, є проліками сполук, де R1 - O. Аналогічно сполуки, де R3 - (C1-15) ацилом є проліками відповідних сполук, де R3 є гідрогеном. Зазначені проліки є зазвичай неактивними похідними вихідних сполук, які перетворюються in vivo в активні форми. Похідні 19-нор-D-гомостероїдів цього винаходу мають звичайні 8b-, 9a-, 10b-, 13b- і 14aконфігурації. Конфігурація при С-7 є 7a, а при С17a конфігурацією є 17а b. Сполуки винаходу можуть бути синтезовані способами, добре відомими з рівня техніки органічної хімії взагалі, а зокрема, з рівня техніки хімії стероїдів. Дивись, наприклад, Fried, J. and Edwards, J.A., 'Органічні реакції у хімії стероїдів, ¢Tом І і II, van Nostrand Reinhold Company, New York, 1972. Підходящим вихідним матеріалом для виготовлення сполук формули І, де R1 - O, R2 має значення, які описано вище, a R3 є гідрогеном, є, наприклад, (7a)-3-метокси-7-метилестр-1,3,5(10)триєн-17-он (тобто сполука формули II). Цю сполуку можна синтезувати, використовуючи способи, добре відомі з рівня техніки, див., наприклад, FR 1434172.4 Гомологізацію (7a)-3-метокси-7-метилестр1,3,5(10)-триєн-17-ону з D-кільцем можна здійснювати певною кількістю способів. Наприклад, його можна перетворювати у (7a)-17-(амінометил)-3метокси-7-метилестр-1,3,5(10)-триєн-17-ол, а потім обробляти, наприклад, NaNO2/AcOH для продукування (7a)-метокси-7-метил-D-гомоестр1,3,5(10)-триєн-17а-ону [див., наприклад, Avery, M.A. et al., Стероїди, 1990, 55,59]. Альтернативно 5 84037 його можна перетворювати у (7a,17b)-3-метокси-7метил-16,17-метилен-17[(триметилсиліл)окси]естр-1,3,5(10)-триєн, а потім обробляти, наприклад, хлоридом феруму (III), для продукування (7a)-3-метокси-7-метил-D-гомоестр1,3,5(10), 16-тетраєн-17а-ону [див., наприклад, Johns, W.F. et. аl, J. Org. Chem., 1971, 36, 1952 and lto, Y. et al., J. Org. Chem., 1976, 41, 2073]. Останній можна перетворювати у (7a)-3-метокси-7метил-D-гомоестр-і,3,5(10)-триєн-17а-он, наприклад, каталітичною гідрогенізацією. (7a)-3-метокси-7-метил-D-гомоестр-13,5(10)триєн-17а-он можна обробити метиллітієм або етиллітієм, або відповідними реагентами Гриньяра у присутності хлориду церію(ІІІ), щоб продукувати похідну (7a,17аb)-17а-алкіл-3-метокси-7-метил-Dгомоестр-1,3,5(10)-триєн-17а-олу. Остання може продукуватися разом з відповідним 17аa-OH, 17аb-алкільним ізомером у цьому випадку відділяють потрібний 17аb-ОН,17аа-алкільний ізомер від непотрібної останньої сполуки за допомогою хроматографії або кристалізації. Альтернативно, (7a)-3-метокси-7-метил-D-гомоестр-1,3,5(10)триєн-17а-он може взаємодіяти, наприклад, з триметилсульфоній йодидом і основою, що дає 17аепоксид, який можна потім перетворити у 17аbОН,17аa-метилову сполуку або у 17аb-ОН,17аaетилову сполуку при взаємодії з відновником (наприклад, літій алюмогідридом або триетилбораном літію) або сполукою метилкупруму (наприклад Me2CuLi), відповідно. Відновленням по Бьорчу отримуємо похідну (7a,17аb)-17а-алкіл-3-метокси7-метил-D-гомоестр-1,3,5,(10)-триєн-17а-олу, яку описано у Caine, D. Org. reactions, Wiley, New York, 1976, 23, 1, слідом за гідролізом таким чином отриманих похідних D2,5{10) дієну, потім отримуємо (7a,17аb)-17а-гідрокси-7,17а-диметил-D-гомоестр4-ен-3-он або (7a,17аb)-17а-етил-17а-гідрокси-7метил-D-гомоестр-4-ен-3-он. Сполуки винаходу, де R1 - NOR R, що є гідрогеном, (С1-6) алкілом або (C1-6) ацилом і сполуки винаходу, де R3 є (C 1-15) ацилом отримують швидко способами, добре відомими з рівня техніки. Наприклад, сполуки, де R3 - (С1-15)ацил, швидко отримують за допомогою ацилування відповідних проміжних продуктів, де R3 є гідрогеном, використовуючи, наприклад, ацилювальний агент, як-то бажаний хлорангідрид у присутності основи, як-то триетиламін. 19-нор-D-гомостероїди винаходу є підходящими для застосування у терапії, наприклад, між іншим, у контрацепції самців і ГЗТ для самців. ГЗТ для самців припускає андрогенну добавку, а також замінник тестостерону. Застосування сполуки винаходу дуже посприяє виробництву фармацевтичних композицій. Тому представлений винахід також стосується фармацевтичної композиції, яка містить сполуку винаходу, змішану з фармацевтично прийнятним наповнювачем, як ті, що описані у Gennaro et al., Remmington: Наука і практика фармації, 20-те видання, Lippincott, Williams and Wilkins, 2000; див. головним чином частину 5: фармацевтичне виробництво. Готові підходящі наповнювачі є, напри 6 клад, у Довіднику з фармацевтичних наповнювачів, 2-ге видання; Editors A. Wade and P.J.Weller, Американська фармацевтична асоціація, Washington, The Pharmaceutical Press, London, 1994. Суміші сполуки згідно представленого винаходу і фармацевтично прийнятного наповнювачу можна пресувати у тверді дозовані форми, як-то таблетки, або виготовити в капсулах або як супозиторії. Для створення дозованих форм, як-то таблеток, припускають застосовувати традиційні адитиви, як-то наповнювачі, барвники, полімерні зв'язуючі. Взагалі можна застосовувати будь-який фармацевтично прийнятний адитив, який не впливає на функцію активних сполук. Підходящі наповнювачі, з якими можуть виготовляти і вводити фармацевтичні композиції включають лактозу, крохмаль, целюлозу і їх похідні, або застосовують їх суміші у підходящи х кількостях. Часто контрацепцію самців описують, включаючи режим застосування гормонів, у якому прогестаген допомагає досягненню контрацептивного ефекту, а андроген допомагає поповнити утворений зменшений рівень тестостерону. Комбінована андрогенна/прогестагенна природа сполук винаходу дозволяє досягти контрацепції через систему прогестаген-андроген на основі однієї індивідуальної сполуки. Отже винахід стосується застосування стероїдної сполуки винаходу для виробництва медикаменту, який має контрацептивну активність (для якого також у рівні техніки застосовується вираз 'контрацептивний агент'). Винахід стосується способу контрацепції, який полягає у введенні здатному до дітородіння самцю, особливо чоловіку, сполуки винаходу у дозованій кількості і у режимі, який є достатнім для зазначеної сполуки, яка буде, по суті, контрацептивно ефективною, і яка одночасно слугуватиме для підтримки достатнього рівня андрогену у самця, об'єкта цього способу контрацепції. Альтернативно запропонований спосіб контрацепції представленого винаходу полягає у введенні здатному до дітородіння самцю, особливо чоловіку, контрацептивно ефективної комбінації стерилітанту, якто прогестаген, і сполуки винаходу. Як друга альтернатива, спосіб контрацепції полягає у введенні сполуки винаходу, як (прогестагенного) стерилітанту, де підтримку достатнього рівня андрогена розглядають, як частину андрогенної активності сполуки винаходу, і яка постачає додатковий андроген. Винахід також стосується комплекту для контрацепції самців, який містить засіб для введення прогестагену і засіб для введення андрогену, який відрізняється тим, що один із засобів є фармацевтичною композицією, яка містить сполуку представленого винаходу. Андрогенні/прогестагенні сполуки винаходу можна також застосовувати як тестостеронну добавку при частковому нестатку (старіння) андрогену у чоловіка. Андрогенні/прогестагенні сполуки винаходу можна також застосовувати для (часткової) заміни ендогенного тестостерону. Прогестагенна активність слугує перевагою сполук винаходу, в яких 7 84037 супресується продукування ендогенного тестостерону. Андрогенна активність слугує для компенсації отриманого дефіциту тестостерону. Це дозволяє замінити тестостерон екзогенним андрогеном, який є безпечнішим за екзогенний тестостерон. Екзогенний тестостерон перетворюється за допомогою 5a-редуктази у більш сильний 5aдигідротестостерон, що призводить до добре відомого шкідливого впливу, як-то проблеми з простатою, запалення сальної залози, втрати волосся. Отже перевагою андрогенних/прогестагенних сполук винаходу є те, що вони можуть переважно зменшувати внутрішній негативний вплив ендогенного тестостерону. Тому, та точніше, сполуки винаходу можна застосовувати для лікування доброякісної гіпертрофії простати (ДГП). Як варіант, андрогенні/прогестагенні сполуки винаходу можна комбінувати з андрогеном, відомим з рівня техніки, який не є 5a-відновлюваними, як-то MENT, або андрогенами, описаними у WO 99/67271, WO 00/53619, WO 00/59920 або WO 01/05806, або прогестагеном, відомим з рівня техніки. Отже винахід стосується застосування сполуки винаходу для виробництва медикаменту для лікування андрогенної недостатності або медикаменту - замінника тестостерону. Спеціалістихіміки, хто знається у цій області техніки, повинні взяти до уваги, що застосування полягає у комбінованому введенні сполуки винаходу і андрогену, або альтернативно у комбінованому застосуванні сполуки винаходу і прогестагену. Згідно з винаходом також запропоновано спосіб лікування в рамках горомонозамісної терапії самців, який полягає у введенні самцю сполуки, яка описана тут вище (у підходящій фармацевтичній лікарській формі). Винахід також стосується способу лікування, який полягає у введенні самцю, який потребує андрогенної добавки або заміннику тестостерону, терапевтично ефективної кількості сполуки винаходу, як варіант, у комбінації з відомим з рівня техніки андрогеном, або відомим з рівня техніки прогестагеном. Винахід проілюстровано наступними прикладами. Приклад 1 Виготовлення (7a,17аb)-17а-гідрокси-7,17адиметил-D-гомоестр-4-ен-3-ону (7a, 17аb)-17а-гідрокси-7,17а-диметил-Dгомоестр-4-ен-3-он І) - Розчин діізопропіламіну (42.4мл) у сухому тетрагідрофурані (294мл) охолоджують до -30°C. n-BuLi (1.6M розчину у гексані, 173мл) додають краплями (T < -10°С) і продовжують перемішува ти при -30°С протягом 10хв. Реакційну суміш охолоджують до -78°C і додають по краплі розчин (7a)-3метокси-7-метилестр-1,3,5(10)-триєн-17-он [див. FR 1434172; 25.0г] в сухому тетрагідрофурані (398мл). Продовжують перемішування протягом 1г при -78°C. Додають хлортриметилсилан (31.5мл, тільки що дистильованого з CaH) і дають можливість температурі піднятися до кімнатної температури. Суміш перемішують протягом 30хв., потім додають триметилхлорсилан, охолоджений до 0°С, а потім гасять насиченим водним розчином хлориду амонію. Суміш екстрагують етилацета 8 том, комбіновані органічні фази промивають розсолом, сушать над сульфа том натрію і концентрують під пониженим тиском, що дає (7a)-3-метокси7-метил-17-[(триметилсиліл)окси]естр-1,3,5(10),16тетраєн (35.5г). Продукт застосовують на наступному етапі без додаткового очищення. іі) - Розчин продукту отриманого на попередньому етапі (35.5г) і дійодометану (27.3мл) в сухому дихлорметані (503мл) охолоджують до 0°С. Додають розчин діетилцинку у гексані (15% мас, 305мл) (T 30 >30 1.0 імітація операції під анестезією ізофураном. Після відновлення свідомості після анестезії протягом 24 годин щурів лікували один раз на добу протягом шести тижнів, перорально різними дозами сполук винаходу або тільки наповнювачами (плацебо некастрованих, плацебо після орх) у об'ємі 1мл/кг (n=5). Через одну добу після останнього введення було зроблено автопсію і видалено праве стегно. Мінеральну щільність губчатої речовини кісток частини метафазу було виміряно за допомогою pQCT (пристрою для периферичної кількісної комп'ютерної томографії; XCT 960А, Stratec, Birkenfeld, Germany). Результати зібрані у Таблиці 2. Таблиця 2 Результати дослідження на остеопороз Сполука Плацебо для некастрованих щурів Плацебо для щурів, яким зробили орхідектомію Сполука Прикладу 1 Порівняльна сполука А Доза МЩГРК ((середнє геометричне) ± CB (похибка) Середня пропорційна різниця кісткової щільності 0мг/кг 217+27 100% 0мг/кг 100±17 0% 8мг/кг 16мг/кг 255±22 133±20 133% 28% Визначення безпечності для печінки: аналіз ретенції БСФ Головною метою цього тесту є оцінювання функції печінки вимірюванням коефіцієнту очищення для одиничної внутрішньовенної дози бромсульфофталеїн у (БСФ) через сім діб (один раз на добу) лікування за допомогою перорального лікування кастрованих самців кроликів. Коротше, тест було проведено на дорослих кастрованих самцях кроликів NZW. Щонайменше два тижні після кастрації тварин лікували протягом семи днів (один раз на добу) сполуками винаходу у таблетках або у наповнювачі з арахісовою олією + 5% етанолу, у дозах 10мг/кг. Через 24 години після останнього введення кроликам внутрішньом'язово ввели легке заспокійливе, 0.15мл Hypnorm і БСФ (1мг/кг, внутрішньовенно, розчинений у 5% (за масою/об'ємом) манітолу/Н 2О). Кров було взято через 5, 10, 15 і 20 хвилин, а вміст БСФ у плазмі визначали спектрофотометром. Т1/2 стосовно БСФ обчислювали з отриманих даних (див. Таблицю 3). 13 84037 14 Таблиця 3 Дані про БСФ сполуки винаходу Сполука Сполука Прикладу 1 Тестостерон Порівняльна сполука C Сполука Прикладу 1 Тестостерон Порівняльна сполука C Комп’ютерна в ерстка Л. Купенко Наповнювач Таблетка Таблетка Таблетка Арахісова олія + 5% етанолу Арахісова олія + 5% етанолу Арахісова олія + 5% етанолу Підписне Т1/2 БСФ 6.3 5.2 13.6 4.6 4.2 7.1 Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSteroids having a mixed androgenic and progestagenic profile
Автори англійськоюVan Der Louw Jaap, Leysen Dirk, Grootenhuis Arij Jan, De Gooijer Marcel Evert
Назва патенту російськоюСтероиды, которые имеют смешанный андрогенный и прогестагенный профиль
Автори російськоюван дер Лаув Яп, Лейсен Дирк, Гротенгейс Арей Ян, де Гоейер Марсель Эверт
МПК / Мітки
МПК: C07J 63/00
Мітки: андрогенний, профіль, прогестагенний, стероїди, змішаний, мають
Код посилання
<a href="https://ua.patents.su/7-84037-sterodi-yaki-mayut-zmishanijj-androgennijj-i-progestagennijj-profil.html" target="_blank" rel="follow" title="База патентів України">Стероїди, які мають змішаний андрогенний і прогестагенний профіль</a>
Попередній патент: Фунгіцидна комбінація активних речовин та матеріал для розмноження
Наступний патент: Композиція для теплоізоляційного шару, спосіб її приготування та спосіб утворення теплоізоляційного шару на підкладці
Випадковий патент: Спосіб фіксації дистального сухожилка біцепса при його розриві за допомогою анкерної фіксації











