15b-заміщені стероїди, що мають селективну естрогенну активність
Номер патенту: 89964
Опубліковано: 25.03.2010
Автори: Дейкс Фредерікус Антоніус, Едерван Антоніус Ґерардус Гендріксон, Лозен Губерт Ян Йозеф
Формула / Реферат
1. 15β-заміщена стероїдна сполука Формули I
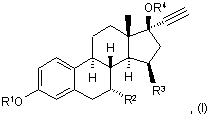
де
R1 - Н, С1-5алкіл, С1-12ацил, ді-(С1-5алкіл)амінокарбоніл, (С1-5алкіл)оксикарбоніл або сульфамоїл,
R2 - Н, С1-3алкіл, С2-3алкеніл або С2-3алкініл, кожний з яких може бути, як варіант, заміщений галогеном,
R3 - С1-2алкіл, етеніл або етиніл, кожний з яких може бути, як варіант, заміщений галогеном, і
R4 - H або С1-12ацил.
2. Сполука за п. 1, яка відрізняється тим, що R2 є С1-3алкіл, С2-3алкеніл або С2-3алкініл, кожний з яких може бути, як варіант, заміщений галогеном.
3. Сполука за будь-яким з пп. 1 або 2, яка відрізняється тим, що R1 і R4 обидва є Н.
4. Сполука за п. 1, яка відрізняється тим, що R1 є Н, R2 є Н або С1-3алкіл, R3 є С1-2алкіл, a R4 є Н.
5. Сполука за п. 1, яка відрізняється тим, що R1 є Н, R2 є Н або С1-2алкіл, R3 є метил, a R4 є H.
6. Сполука за п. 1, яка відрізняється тим, що сполукою є 7α-етил-15β-метил-19-нор-17α-прегна-1,3,5(10)-триєн-20-ін-3,17β-діол.
7. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-6 і фармацевтично прийнятний наповнювач.
8. Сполука за будь-яким з пп. 1-6 для застосування у терапії.
9. Застосування сполуки за будь-яким з пп. 1-6 для виробництва медикаменту для лікування чи попередження пов'язаних з рецепторами естрогену хвороб або для контролювання або лікування, або попередження інших пов'язаних з рецепторами естрогену фізіологічних станів.
10. Застосування за п. 9 для виробництва медикаменту для гормонального лікування.
11. Застосування за п. 10, яке відрізняється тим, що гормональне лікування є лікуванням клімактеричних ускладнень.
12. Застосування за п. 10, яке відрізняється тим, що гормональне лікування є лікуванням остеопорозу.
13. Застосування за п. 9 для виробництва медикаменту для використання у контрацепції.
Текст
1. 15β-заміщена стероїдна сполука Формули I 2 (19) 1 3 використовують для контрацепції і попередження або лікування: - клімактеричних ускладнень: напливу крові, потіння і коливань настрою; - руйнування кісток внаслідок: остеопорозу, остеоартриту, гіпокальцемії, гіперкальцемії, хвороби Паджета, остеомаляції, остеогістогенезу, множинної мієломи; - переломів кісток; - нестриманості сечі, сечостатевої атрофії, вагінальної або шкіряної атрофії, прищів, меланоми, гірсутизму; - доброякісної пухлини молочної залози, раку молочної залози, гінекомастії; і - серцево-судинних захворювань, високих рівнів холестерину, високих рівнів ПСД (порогу слухового дискомфорту), хвороб коагуляції, рестенозу, проліферації клітин гладеньких м'язів судин. Незважаючи на давно існуючу доступність сполук, зокрема стероїдів, які можуть бути використані для полегшення таких естрогеннорецепторних станів, все ще залишається необхідність у нових економічних, ефективних і безпечних способах лікування за допомогою ліків. Сполуки, які мають естрогенну активність зараз використовують для жінок в якості медикаментів для лікування ускладнень та остеопорозу доі/або після менопаузи. Але, для жінок з неушкодженою маткою ці неселективні естрогени, наприклад, коньюговані кінські естрогени, 17-естрадіол, і 17-етиніл-17-естрадіол, не можуть бути прийнятними для довготривалої терапії (більше 3 місяців) оскільки ці сполуки викликають високу ступінь едометріальної проліферації (фолікулярнихі фазоподібних змін), які приводять до кровотечі, ендометріальної гіперплазії і/або ендометріального раку. Загальна клінічна практика полягає у комбінуванні цих неселективних естрогенів з прогестагенними сполуками, процедурі, яка добре відома стосовно зменшення ендометричної стимуляції і зміни ендометрію від фолікулярно-фазоподібного до лютеально-фазоподібного і/або атрофічного ендометрію. Нажаль, додавання прогестагенної сполуки при цьому лікуванні збільшує ризик раку молочної залози, що було продемонстровано нещодавно при дослідженнях в Центрі Здоров'я Жінок (ЦЗЖ) (Women's Health Initiative (WHI)) (див. Статті дослідників ЦЗЖ. Ризики і корисні результати застосування естрогену плюс прогестин на здоров'я постклімактеричних жінок: головні результати рандомізованих контрольованих випробувань на випадковість у ЦЗЖ. ЯМА 2002; 288:321-333) (Writing Group for the Women's Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from The Women's Health Initiative randomized controlled trial. JAMA 2002; 288:321333). Після відкриття два окремі підтипи естрогенних рецепторів, позначених як ER і ER, то тепер існує можливість відкриття підтипів селективних естрогенно рецепторних лігандів. Оскільки ці два підтипи мають різне розподілення у тканинах людини, то такі селективні стосовно підтипів сполук 89964 4 можуть забезпечити ефективне лікування або профілактику пов'язаних з рецепторами естрогену станів з мінімальною побічною дією. Тепер знайдено, що ряд похідних 15заміщених сполук естрадіолу є потенційними стероїдами, які мають гарні рівні функціональної селективності стосовно рецептору естрогену підтипу. Винахід забезпечує сполуки формули І: де, 1 R Н, С1-5алкіл, С1-12ацил, di-(С15алкіл)амінокарбоніл, (С1-5алкіл)оксикарбоніл або сульфамоїл, 2 R - Н, С1-3алкіл, С2-3алкеніл або С2-3алкініл, кожний з яких, як варіант, може бути заміщений галогеном, 3 R - С1-2 алкіл, етеніл або етиніл, кожний з яких, як варіант, може бути заміщений галогеном, і 4 R - Η або С1-12ацил. 1 4 Стероїди, в яких R і/або R не є гідрогеном, є так званими проліками. Вираз С1-5алкіл, що використовується у формулі І, представляє розгалужену або не розгалужену алкіл групу, яка має 1-5 атомів карбону. Прикладами таких груп є метил, етил, ізопропіл, третинний бутил і пентил. Подібним чином, вираз С1-3алкіл і С1-2алкіл означають (розгалужену або не розгалужену) алкіл групу, яка має 1-3 і 1-2 атомів карбону відповідно. Вираз С2-3алкеніл представляє розгалужену або не розгалужену алкіл групу, яка має 2-3 атомів карбону і один подвійний зв'язок. Прикладами таких груп є етеніл і пропен-2-іл. Вираз С2-3алкініл представляє алкінілгрупу, яка має 2-3 атомів карбону і один потрійний зв'язок. Прикладами таких груп є етиніл і пропін-2-іл. Вираз С1-12 ацил представляє ацилгрупу, яка є похідною від карбонової кислоти, яка має 1-12 атомів карбону. Ацил група може мати вуглеводень, який може бути розгалуженим, не розгалуженим, насиченим або ненасиченим. Прикладами таких груп є: форміл, ацетил, пропаноїл, пропеноїл, півалоїл, гептаноїл, деканоїл, і ундеканоїл. Також включеними у визначення С1-12 ацил є групи, які походять від дікарбV кислот, як-nj гемі-малоїл, гемі-сукціноїл і гемі-глутароїл. Прикладом ді-(С1-5алкіл) амінокарбонілгрупи є диметилкарбамоїл. Прикладом (С1-5алкіл) оксикарбонілгрупи є етоксикарбоніл. Галогеном може бути один або більше атомів галогену, наприклад, один або більше атомів хлору або фтору. 2 В одному втіленні винаходу R є Н, С1-3алкіл, С2-3алкеніл або С2-3алкініл, кожний з яких, як варіант, може бути заміщений галогеном, 1 4 В іншому втіленні R і R обидва є Н. 1 2 В іншому втіленні R - Н, R є Н, С1-3алкіл, С23 3алкеніл або С2-3алкініл, R є С1-2алкіл, етеніл або 4 1 2 етиніл, і R - Н. В іншому втіленні R - Н, R - Η або 5 89964 6 С1-3алкіл, який, як варіант, заміщений галогеном R - С1-2алкіл, який, як варіант, може бути заміщений 4 галогеном, a R - Н. 1 2 В іншому втіленні R - Н, R - Η або С1-2алкіл, 3 4 R - метил, a R - Н. 1 2 В іншому втіленні R - Н, R - Η або С1-3алкіл, 3 4 R - С1-2алкіл, a R - Н. В іншому втіленні сполукою є 7-етил-15метил-19-нор-17-прегна-1,3,5(10)-трієн-20-ін3,17-діол. 1 В іншому втіленні R - Н, С1-5алкіл або С12 3 4 12ацил, R - Η або С1-3алкіл, R - С1-2алкіл і R - Η або С1-12ацил 1 В іншому втіленні R - Н, С1-5алкіл або С12 3 4 ацил, R - С1-3алкіл, R - метил і R - Η або С112 12ацил. 1 В іншому втіленні R - Н, С1-5алкіл або С12 3 4 12ацил, R - етил, R - метил і R - Η або С1-12ацил. 3 В іншому втіленні R - Η або С1-12ацил, R - Η 3 4 або С1-3алкіл, R - С1-2алкіл і R - Η або С1-12ацил. 1 2 В іншому втіленні R - Η або С1-12ацил, R - Η 3 4 або С1-3алкіл, R - метил і R - Η або С1-12ацил. 1 2 В іншому втіленні R - Η або С1-12ацил, R 3 4 етил, R - метил і R - Η або С1-12ацил Сполуки за винаходом можуть бути синтезовані відомими в органічній хімії способами, зокрема, відомими в хімії стероїдів. Див. наприклад, (Fried, J. and Edwards, J.A., 'Organic Reactions in Steroid Chemistry', Volumes I and II, van Nostrand Reinhold Company, New York, 1972; and С Djerassi, 'Steroid Reactions', Holden-Day, Inc., San Francisco, 1963). Загальні процедури синтезу, які використані для приготування сполук, описаних у прикладах нижче показані на Схемі І. Варіанти цієї схеми можуть бути легко відтворені фахівцем у цій галузі. 1 2 Субстрат А, вихідний матеріал для синтезу, показаного на Схемі І, синтезують в чотири стадії. По-перше, добавки кон'югантів металоорганічних матеріалів (наприклад, купратів) до С17захищеного естра-4,6-дієн-3-онів забезпечують потрібні 7-заміщений естр-4-ен-3-они. Невеликі кількості утворених 7-ізомерів можуть бути швидко видалені або хроматографією, або кристалізацією на цій стадії синтезу, або на наступних стадіях. 7-заміщені естренони легко ароматизують, використовуючи, наприклад, процедури, галогенування/де галогенування до 7-естронів, які при алкілуванні на С3 і знятті захисту на С17 забезпечують отримання субстрату А. ,-ненасичений кетон С отримують при окисненні силіл фенол етеру В, використовуючи, наприклад, паладій діацетат. Майкл- додавання до С, використовуючи металоорганічні речовини, наприклад, діалкіл купрат, тоді дають адукт D. Метил естрон D при знятті захисту, використовуючи, наприклад, комплекс бор трифлуориддіметилсульфід, дає отримання фенол Е, який при повторному знятті захисту перетворюється у, наприклад, силіл-етер F. Додаванням, наприклад, літій ацетиліду до кетону F отримують продукт G, а потім вилучають силіл-етерну захисну групу, використовуючи, наприклад, тетрабутиламоній флуорид, можна отримати бажаний продукт Н. (Проліки) похідні вільних гідрокси груп сполук G або Η швидко отримують з цих сполук відомими способами, наприклад, ацилуванням, використовуючи хлорангідрид карбонової кислоти у присутності основи або ацилуванням, використовуючи карбонову кислоту у присутності реагенту сполучення, як-то діциклогексилкарбодіімід і т.д. з наступним видаленням силіл етер захисної силілетерної групи у випадку сполук G. Було знайдено, що сполуки формули І, які мають групи, визначені у п.1 формули винаходу і в 1 4 яких R і R є гідрогеном, мають відповідно кращу селективність стосовно рецептору естрогену підтипу, комбінованого з високою ефективністю стосовно -рецептору естрогену, тобто з ефективністю, яка дорівнює або більше ніж 1,0% (відносно 7 89964 -11 17-естрадоїл, який має EC50 приблизно 4x10 М, а за визначенням - ефективність 100%). Така сполука є агоністом стосовно -рецептору естрогену і є принаймні у 10 разів менш активною стосовно рецептору естроген і/або є частковим агоністом стосовно -рецептору естрогену, з ефективністю, що дорівнює або менше, ніж 60% максимальної активації, індукованої 17-естрадіолом. Це призводить до високої функціональної селективності для -рецептору естрогену, тобто, селективність, яка активує -рецептор естрогену, але ні/або тільки частково активує -рецептор естрогену. 1 4 Стероїди формули І, в яких R і/або R є/ не є гідрогеном є проліками, які не обов'язково зустрічаються у вище зазначених дефініціях. Ці проліки 1 4 перетворюються у сполуки, в яких R і R є гідрогеном і які зустрічаються у зазначених дефініціях. Крім того, селективні (естрогенні) ліганди за винаходом не викликають високого ступеню ендометріальної проліферації (фолікулярних фазоподібних змін) і тому можуть бути застосовані в якості медикаментів для (довготривалого) лікування і/або профілактики лікування ускладнень та остеопорозу до і/або після менопаузи без додавання прогестагенних сполук. Профіль селективної активації рецептору естрогену сполук винаходуом робить їх прийнятними для застосування у терапії. Крім того, винахід стосується застосування сполуки за формулою І для виробництва медикаменту для лікування або профілактики пов'язаних з рецепторами естрогену хвороб, регулювання, лікування, або профілактики інших пов'язаних з рецепторами естрогену фізіологічних станів. Інший аспект винаходу стосується застосування сполуки формули І для виробництва медикаменту для терапії гормонозахищення або лікування гормонами. Таке застосування є особливо прийнятним для жінок для виявлення ускладнень та остеопорозу до і/або після менопаузи. Інший аспект винаходу стосується застосування сполуки формули І для виробництва медикаменту для застосування у контрацепції. Для цього сполука винаходу може бути введена, як частина 8 режиму лікування, який включає також введення відповідної кількості прогестагену. Такі режими добре відомі в області контрацепції. Введенню сполуки за винаходом буде допомагати виробництво прийнятних дозованих форм. Тому винахід також стосується фармацевтичних композицій або дозованих форм, які містять сполуку винаходу, змішану з фармацевтично прийнятним наповнювачем, таким як описаний у роботі (Gennaro et al., Remmington: The Science and th Practice of Pharmacy, 20 Edition, Lippincott, Williams and Wilkins, 2000); див. зокрема частину 5:фармацевтичне виробництво. Прийнятні наповнювачі описані, наприклад, у (Handbook of nd Pharmaceutical Excipients, 2 Edition; Editors A. Wade and P.J.Weller, American Pharmaceutical Association, Washington, The Pharmaceutical Press, London, 1994). Суміші сполуки винаходу фармацевтично прийнятного наповнювачу можуть бути спресовані у тверді дозовані вироби, такі як таблетки, або можуть бути дозовані у капсули або супозиторії. За допомогою фармацевтично прийнятних рідин сполуки також можуть бути застосовані як ін'єкційні препарати у вигляді розчинів суспензій, емульсій або аерозолів, наприклад, аерозолів для носу або роту. Для виробництва дозованих виробів, наприклад, таблеток, можливе використання звичайних добавок, таких як наповнювачі, барвники, полімерні в'яжучі речовини і їм подібні. Взагалі, можуть бути використані будь-які прийнятні добавки. Сполуки за винаходом можуть також бути включені в імплантант, вагинальне кільце, бляшку, гель або у будь-який інший препарат для негайного і/або довготривалого вивільнення. Прийнятними наповнювачами, з якими фармацевтичні композиції можуть бути приготовлені і введені, включають лактозу, крохмаль, целюлозу і їх похідні і їм подібні речовини або їх суміші, які використані у відповідних кількостях. Дозовані кількості за винаходом для нормального виконання естрогенних сполук, будуть складати, наприклад, порядку 0,01-100мг, і зокрема 0,1-10мг для введення. Винахід ілюструється наступними прикладами: 9 Приклад 1 Приготування 7-етил-15-метил-19-но-17прегна-1,3,5(10)-трієн-20-іне-3,17-діол (8) (див Схема II) Приготування 7-етил-3-метокси-естра1,3,5(10),15-тетраен-17-ону (3). 7-етил-3-метоксіестрон 1 отримано з 17-17(ацетилокси)-естра-4,6-діен-3-ону і етилмагній броміду по аналогії зі способом, описаним в європатенті ЕР 0869132 А1 (див. Приклад І і Схему І, Сполуки 1-5). Розчин 7-етил-3-метоксіестрону 1 (1г) у ТГФ (3мл) додавали крапля за краплею при 60 °С до розчину LDA [приготовленого додаванням 1.6Μ розчину n-БуЛі у гептані (4,7мл) при 50°С до діізопропіламіну (2,1мл) у ТГФ (15мл)]. Суміш перемішали протягом 14 години при -60°С, а потім обробили триметилсилілхлоридом (2мл). Реакційну суміш нагрівали до 0°С протягом ½ години, а потім залили у 10% розчин NH4CI (100мл) і екстрагували етилацетатом. Після промивання і сушки (Na2SO4) проводили концентрування, яке дало сирий сіліленолат 2 (1,1г), який застосовували у наступній стадії без додаткового очищення. До розчину сировинного сіліленолату 2 (1,1г) у ацетонітрилі (15мл) додали Pd(OAc)2 (750мг). Суміш гріли при кипінні під зворотним холодильником протягом 15хвил. Потім додали воду і етилацетат, органічну суміш профільтрували крізь броунмілерит і продукт екстрагували у етилацетатом. Таким чином виділений органічний матеріал очищали пропусканням його крізь коротку кварцеву колонку, елюючи гептан/етил ацетатом, для отримання сполуки 3 (710мг), як безбарвне масло. Rf (1) 0.47, Rf (2) 0.80, Rf (3) 0.46, елюент гептан/етил ацетат 8/2. NMR (CDCI3), 7.58 (1Η), 7.21 (1Η), 6.74 (1Η), 6.66 (1Н), 3.79 (3H, СН3О), 1.11 (s, 3H, 18-CH3), 1.00 (t, 3H, етил) Отримання 7-етил-15-метил-3-метоксиестра-1,3,5(10)-тріен-17-ону (4). До розчину 3, (300мг) у сухому ТГФ (5мл) додали безводний Сu(ОАс)2 (100мг). Суміш перемішували протягом 2хвил при -70°С, після чого краплями додавали метил магній хлорид (1М у THF, 5мл). Реакційну суміш нагрівали протягом ½ годин до 0°С і охолодили додаванням 10% розчину NH4CI. Продукт екстрагували етилацетатом, а потім очищали хроматографією крізь силікагель, використавши гептан/етил ацетат як елюент для отримання сполуки 4, як білої твердої речовини (280мг), т.п.120-122°С; NMR (CDCI3) 7.22 (1Н), 6.73 (1Н), 6.65 (1Н), 3.79 (1Н), 1.20 (3H, s, 18СН3), 0.98, 0.96 (6Н, 2t, 7 і 15 етил). Отримання 7-етил-15-метил-3[(триметилсиліл)окси-естра-1,3,5(10)-тріен-17-ону (6). До розчину 4 (270мг) у дихлорометані (1мл) додали комплекс BF3.ДMC (800мкл). Суміш перемішували протягом 1,5 годин і потім вилили у льодяну воду і екстрагували етилацетатом. Отриманий таким чином осад розтирали з ефіром/гептаном (1/1) для отримання сполуки 5, (250мг) як блідо-рожевої аморфної твердої речовини; Rf 0.27 (гептан /етил ацетат 8/2). Матеріал 89964 10 розчинили у ДМФ (3мл), після додавання імідазолу (300мг) додали трет-бутил-диметилсилілхлорид. Після перемішування протягом 2 годин при кімнатній температурі силілування було завершене. Після охолодження реакційної суміші додаванням льодової води, продукт екстрагували етилацетатом. Хроматографічним очищенням на короткій колонці з діоксидом силіцію (гептан /етилацетат 9/1) отримали сполуку 6 (220мг) як густе безбарвне масло; Rf 0.60 (гептан /етил ацетат 8/2). ЯМР (CDCI3) 7.12 (1Η), 6.62 (1Η), 6.18 (1Η), 1.03 (s, 3H, 18-СН3), 0.98 (s, 9Н, тетрбутилсиліл), 0.97, 0.95 (2t, 6Н, 7 та 15 етил), 0.20 (s, 6H, СН3-силіл-етер). Отримання 7-етил-15-метил-19-нор-17прегна-1,3,5(10)-тріен-20-ін-3,17-діолу (8). Розчин Li-ацетиліду був створений додаванням краплями н-бутиллітію (1,6Μ у гексан, 5мл) до 1,2-диброметену (300мл) в сухому ТГФ (6мл) при 60°С. Після перемішування протягом 20хвил. додавали розчин 6 (220мг) у ТГФ (2мл), видаляли охолоджуючий засіб і реакційну суміш перемішували протягом 1 години при 0°С. Потім після додавання 5% NH4CI (50мл) екстрагували етилацетатом. При проходженні сирого продукту крізь коротку колонку з діоксидом силіцію (улюірування гептан/етил ацетатом 8/2) отримали сполуку 7 (180мг), як білу піну у особливо чистій формі, R f 0.28 (гептан/етил ацетат 8/2), Rf початковий матеріал, 0.48. ЯРМ (CDCI3) 7.14 (1Н), 6.62 (1Н), 6.57 (1Н, 2.60, ацетилен), 0.99 (s, 12Н, 18-СН3 і терт.бутилсиліл), 0.95 i 0.86 (2xt, 3H, етил), 0.20 (s, 6Н, диметилсиліл). До розчину 7 (180мг) у ТГФ (1мл) додали TBAF (1M у ТГФ, 0,7мл). Суміш перемішували протягом 15хвил., а потім заливали у 10 % водний NH4CI (20мл). Продукт було піддано екстракції етилацетатом і пропущено крізь коротку колонку з діоксидом силіцію, використовуючи гептан/етилацетат 7/3 як елюент для отримання сполуки 8 (120мг) як аморфного матеріалу. ЯМР (DMSO D6) 8.89 (s, фенольний ОН), 7.08 (1Н), 6.5 (1Н), 6.43 (1Н), 5.34 (s,1H, 17-OH), 0.84 (s, 3H, 18-СН3), 0.80 і 0.90 (2xt, 6Н, 15 і 7- етил). Приклад 2 Отримання 3-півалоїлокси-7-етил-15-метил19-нор-17-прегна-1,3,5(10)-трієн-20-ін-17р-олу (9а) Сполуку 8 (300мг) розчинили у піридині (10мл). Півалоїлхлорид (1,5екв.) додали краплями. Після 2 годин реакційну суміш охолодили водою. Реакційна суміш була концентрована, розчинена у етилацетаті і піддана екстракції водним натрій бікарбонатом і водою. Органічний шар висушили (Na 2SO4) і піддали концентруванню. Осад очистили хроматографією на силікагелі (гептан-етил ацетат (1:0>4:1) для отримання чистої сполуки 9а (347мг). ЯМР (CDCI3) 1.35 (s, 9Н, півалоїл), 1.08 (d, 3H, 15-Μe), 1.02 (s, 3H, 18-Ме), 0.94 (t, 3H, 7-етил). Сполуки 9b (289мг; ЯМР (CDCI3) 3.0 і 3.08 (2xs, 6Н, NMe2) 1.08 (d, 3H, 15-Me), 1.02 (s, 3H, 18-Ме), 0.93 (t, 3H, 7-етил)) ι 9с (283 mg; ЯМР (CDCI3) 4.32 (q, 2H, ОСН2СН3), 1.38 (d, 3H, ОСН2СН3), 1.08 (d, 3H, 15р-Ме), 1.02 (s, 3H, 18-Ме), 0.93 (t, 3H, 7 11 89964 етил)) були приготовлені у подібний спосіб, але використовуючи Ν,Ν-диметилкарбамоїлхлорид і етилоксикарбонілхлорид, відповідно. Приклад 3 Агоністична активність сполук на рецептори естрогену була визначена у лабораторних умовах на біопробах з рекомбінантними клітинами яєчника китайського хомяка (ЯКХ), стабільно співтрансфектованих -рецептором естрогену людини (ЕРЛ) або (ΕΡΠ), окситоциновим промотором щура (ЩО) і люциферазним репортерним ген (ЛУЦ). Потужність тестованої сполуки стосовно стимуляції трансактивації ферментом люциферази, що опосередковано рецепторами естрогену ЕРЛ або ЕРЛ, тобто естрогенну агоністичну трансактивацію, визначають як процент (%) відносно EK50 стандартного естрогену 17-естрадіол (потужність тест-сполуки=(EK5017естрадіолу/EK50 тест-сполуки)х100%). Ефективність, тобто, значення максимальної активації рецептору сполукою, виражають як процент (%) відносно максимальної активації сандартним естрогеном 17-естрадіол (ефективність тестованої сполуки=(максимальна активація тестованою сполукою/максимальну активацію 17естрадіолом)x100%). Більш детальний опис методології можна знайти у (De Gooyer Μ.Ε., Deckers G.H., Schoonen W.G.E.J., Verheul H.A.M. and Kloosterboer H.J., Steroids, Vol. 68, 2003, pp. 21-30). Селективність ΕΡ/ΕΡ визначають, як відношення РЕ-потужність/ΡΕ-потужність. Сполуки винаходу є антагоністичними стосовно рецептору естрогену, з потужністю, яка дорівнює або більше 1,0% (відносно 17-ecтpaдioлy) і є принаймні у 10-разів менше активності стосовно рецептору естрогену (селективність ΕΡ/ΕΡ дорівнює або більше 10) і/або є частковими антагоністами стосовно -рецептоу естрогену, з ефективністю, яка дорівнює або менше 60% максимальної активації, яка викликана17-естрадіолом. Гістопатологічна оцінка тканини матки мавпи Cynomolgus була виконана патологом після 8 тижневого перорального лікування тестованою сполукою на чотирьох тваринах на групу лікування. Порівняльну Сполуку X дозували один раз щоденно дозою 40мкг/kr, Порівняльну Сполуку Υ - 200мкг/кг, а Сполуку 8 дозою 40 і 200мкг/kr. Наступні морфологічні характеристики були досліджені у забарвлених Н&Е зрізах, на основі маточних фаз нормального менструального циклу у мавп Cynomolgus. А. Фолікулярні фазоподібні зміни: 12 вільна ендометріальна строма прямі ендометріальні залози гіпертрофія ендометріального епітелію мітотичні фігури гіпертрофія міометрію ранній розвиток кровоносних судин (проростання або рання прголіферація) основна секреція В. Лютеальні фазоподібні зміни: псевдодецидуально збільшені стромальні клітини скручування ендометріальних залоз пізній розвиток кровоносних судин (утворення спіральних артерій) утворення вакуолей ендометріального епітелію секреція у просвіт С. Оваріектомізований або нестимульований (атрофічний) ендометрій компактна ендометріальна строма атрофія ендометріального епітелію атрофія ендометріальних залоз атрофія міометрію Суворість будь-чого з цих вищезгаданого оцінювали, використовуючи наступну шкалу градації: бал 0: не знайдено бал 1: мінімальний, дуже невеликий, дуже малий бал 2: слабкий, малий бал 3: помірний, помірне число, помірний розмір бал 4: помітний, великий бал 5: масивний, велике число, великий розмір. Така класифікація була зроблена для кожної тварини. Потім середній розрахунок на лікувальну групу обчислювали для кожної характеристики. Наприкінці, середній розрахунок по категорії, атрофічний, фолікулярний- або лютеальний фазоподібний було підраховано за середніми індивідуальними характеристиками. Сприятливий ендометричний профіль безпеки для сполуки характеризує невелика викликана сполукою фолікулярна фазоподібна активність, комбінована з більш лютеальними фазоподібними характеристиками і/або атрофічним ендометрієм. Дані для Сполуки 8 і для Порівняльних сполук 1 4 X (17-етиніл-17-естрадіол, Формула І, де R -R Η), a Y (17-естрадіол) представлені в Таблиці 1 (дані для клітин in vitro) і в Таблиці 2 (дані in vivo). Таблиця 1 Сполука ΡΕ-потужність (%) ΡΕ-потужність (%) ΡΕ-ефективність (%) 8 X Υ 23,45 102,8 100,0 1,54 20,70 100,0 40 104 100 Результати, показані в Таблиці 1, демонструють, що сполуки за винаходом мають відповідно кращу функціональну селективність стосовно підтипу рецептору естрогену, комбіновану з висо ΕΡ/ΕΡ-селективність (потужність) 15,2 5,0 1,0 кою потужністю стосовно -рецептору естрогену, тобто, селективно активуючи естрогенний рецептор і не активуючи або тільки частково активуючи естрогенний -рецептор. Сполука 8 показує 13 89964 потужність естрогенного -рецептору 23,45% і має 15,2-разову селективність стосовно естрогенного -рецептору у порівнянні з -рецептором естрогену, і є частковим агоністом стосовно -рецептору естрогену з ефективністю 40%. 14 Близько споріднені сполуки 17-етиніл-17естрадюл (Сполука X) і 17-естрадіол (Сполука Υ) показують рівні переваги для обох підтипів естрогенних рецепторів і є повними агоністами стосовно -рецептору естрогену. Таблиця 2 Сполука 8: 40мкг/кг 8: 200мкг/кг X: 40мкг/кг Υ: 200мкг/кг Фолікулярний 0,0 0,5 2,8 3,6 Ендометріальний профіль мавпи (бали) Лютеальний Атрофічний 0,0 3,0 0,2 2,3 0,4 0 0,2 0 Сприятливий профіль ендометріальної безпечності сполук винаходу є несподіваним оскільки близько споріднені сполуки 17-етиніл-17естрадіол і 17-естрадіол стимулюють ендометрій, як це показано в Таблиці 2 чіткими показниками фолікулярної фазоподібної активності при тільки маргінальній лютеальній фазоподібній активності і тому атрофічного ендометрію немає. Приклад 4 Сексуальна поведінка самки щура є гормонально залежною. У дозованих естрогеном самок щурів прогестерон чітко підвищує сексуальність самки або лордозну поведінку. Але, прогестерон є не ефективним при викликанні лордозу у оваріектомованих самок, які не отримали естрогену (див. також J.B. Becker, S.M. Breedlove and D. Crews (Eds), Behavioral Endocrinology, 1992, pp. 82-84). Комп’ютерна верстка Е. Гапоненко Спроможність тестованих сполук до полегшаної прогестерон-індукованої лордозної поведінки у самок оваріектомованих щурів була застосована для демонстрації на живих істотах естрогенної активності при пероральному дозуванні таких сполук. Самки були попередньо оброблені протягом трьох днів тестованими сполуками після лікування прогестагеном на четвертий день. Через чотири години після лікування прогестероном сексуальна поведінка самки щура була виміряна у присутності самця щура шляхом підрахунку кількості лордозних реакцій протягом 10 хвилин. 1 Проліки Сполуки 8, де R - півалоїл (Сполука 1 1 9а), R - диметил-карбамоїл (Сполука 9b) або R етоксикарбоніл (Сполука 9с), демонстрували активність естрогенних сполук при пероральному дозуванні у 1мг/кг.день. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською15beta-substituted steroids having selective estrogenic activity
Автори англійськоюLoozen Hubert Jan Jozef, Ederveen Antonius Gerardus Hen, Dijcks Fredericus Antonius
Назва патенту російською15b-замещенные стероиды, которые имеют селективную эстрогенную активность
Автори російськоюЛозен Губерт Ян Йозеф, Эдерван Антониус Герардус Гендриксон, Дейкс Фредерикус Антониус
МПК / Мітки
МПК: A61P 5/00, C07J 1/00, A61K 31/56
Мітки: селективну, стероїди, 15b-заміщені, естрогенну, активність, мають
Код посилання
<a href="https://ua.patents.su/7-89964-15b-zamishheni-sterodi-shho-mayut-selektivnu-estrogennu-aktivnist.html" target="_blank" rel="follow" title="База патентів України">15b-заміщені стероїди, що мають селективну естрогенну активність</a>
Попередній патент: Похідні тетрагідрокарбазолу, що мають покращену біологічну дію та покращену розчинність, як ліганди g-білок сполучених рецепторів (gpcr)
Наступний патент: Опорна траверса для каркаса сідла велосипеда
Випадковий патент: Гідроциклон











