Виділена культура sphaerodes mycoparasitica для боротьби з fusarium spp.
Формула / Реферат
1. Виділена культура Sphaerodes mycoparasitica, в якій вид характеризується комбінацією:
(a) розміру, форми (веретеноподібна і трикутна) і візерунка на поверхні стінки (сітчастий візерунок і гладка поверхня) аскоспор;
(b) конідії утворюються від простих фіалід на поверхні перидіальної стінки аскоми, на аскомі, що оточує гіфи, і на нерегулярно розгалужених конідіофорах, що утворюються з гіфів; і
(c) формує гачкоподібні структури, що паразитують на живих гіфах Fusarium, де виділена Sphaerodes mycoparasitica являє собою штам IDAC 301008-01.
2. Виділена культура Sphaerodes mycoparasitica за п. 1, що включає ген, який кодує велику субодиницю рибосомної РНК, наведену в SEQ ID NO: 1, або її варіант; ген, що кодує малу субодиницю рибосомної РНК, наведену в SEQ ID NO: 2, або її варіант; і/або ген, що кодує внутрішню транскрибовану спейсерну рибосомну ДНК, наведену в SEQ ID NO: 3, або її варіант.
3. Виділена культура Sphaerodes mycoparasitica за будь-яким з пп. 1 або 2 для застосування при боротьбі з Fusarium spp.
4. Виділена культура Sphaerodes mycoparasitica за п. 3 для застосування при боротьбі з Fusarium spp. на рослинах.
5. Виділена культура за п. 1 або 2 для застосування при модуляції синтезу або розщеплення одного з трихотеценового мікотоксину Fusarium дезоксиніваленолу (ДОН), мікотоксину 3-АДОН, мікотоксину 15-АДОН, мікотоксину зеараленону і мікотоксину аурофузарину.
6. Композиція, що містить виділену культуру Sphaerodes mycoparasitica за п. 1 або 2 і носій.
7. Композиція за п. 6, яка додатково включає додатковий протигрибковий засіб.
8. Спосіб боротьби з Fusarium spp. на рослинах, що включає обробку партії насіння культурою за п. 1 або 2 або композицією за п. 6 або 7, і потім вирощування рослин з обробленого насіння.
Текст
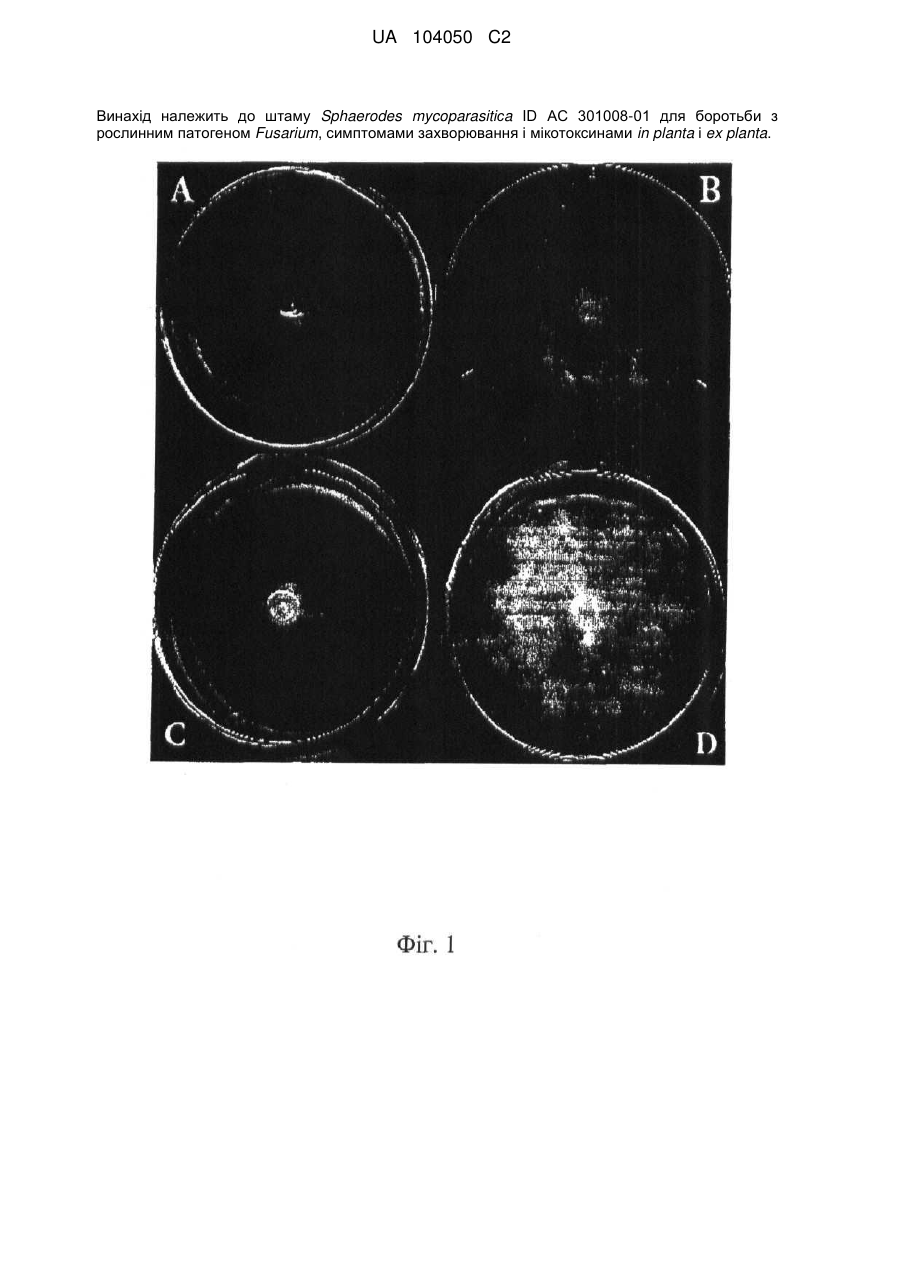
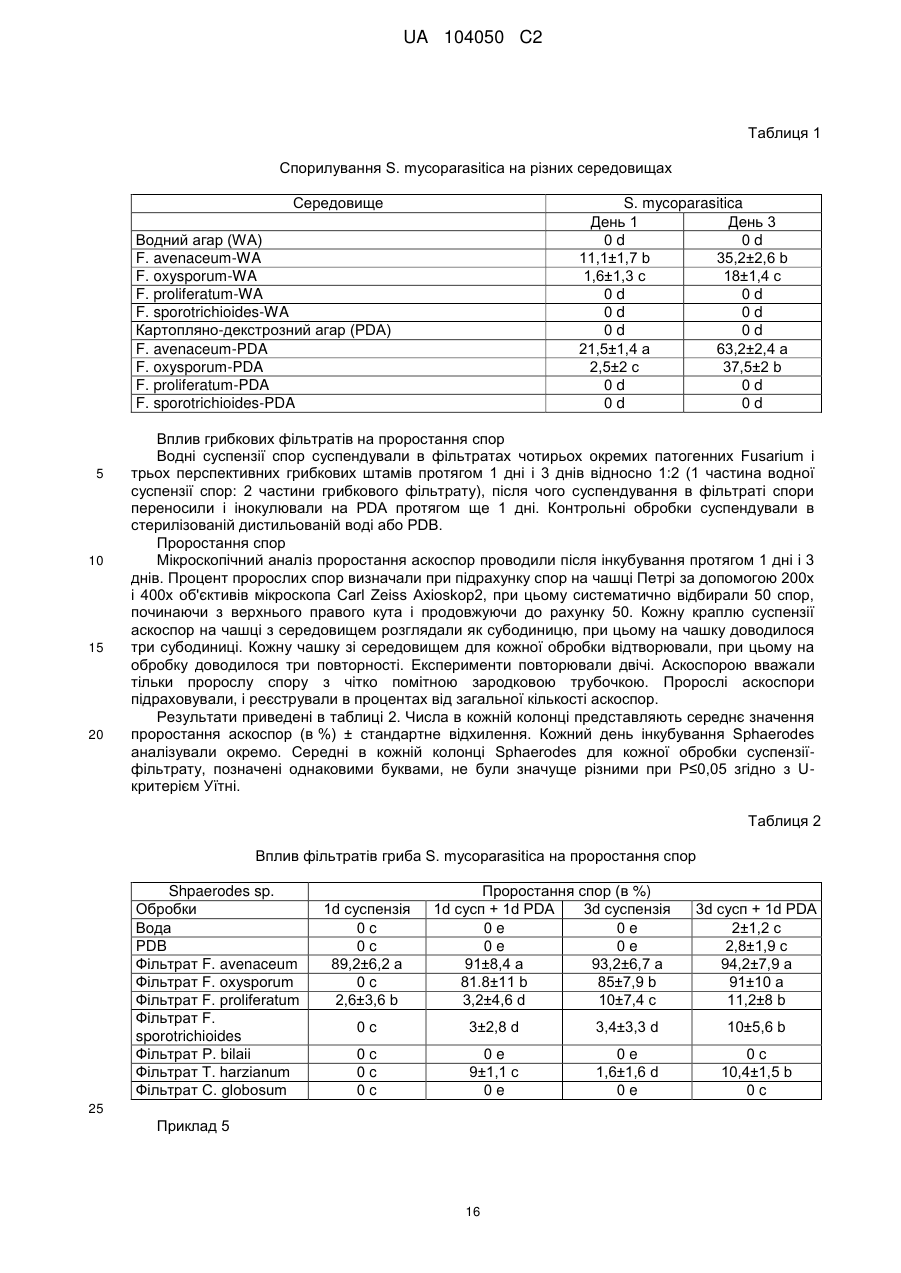
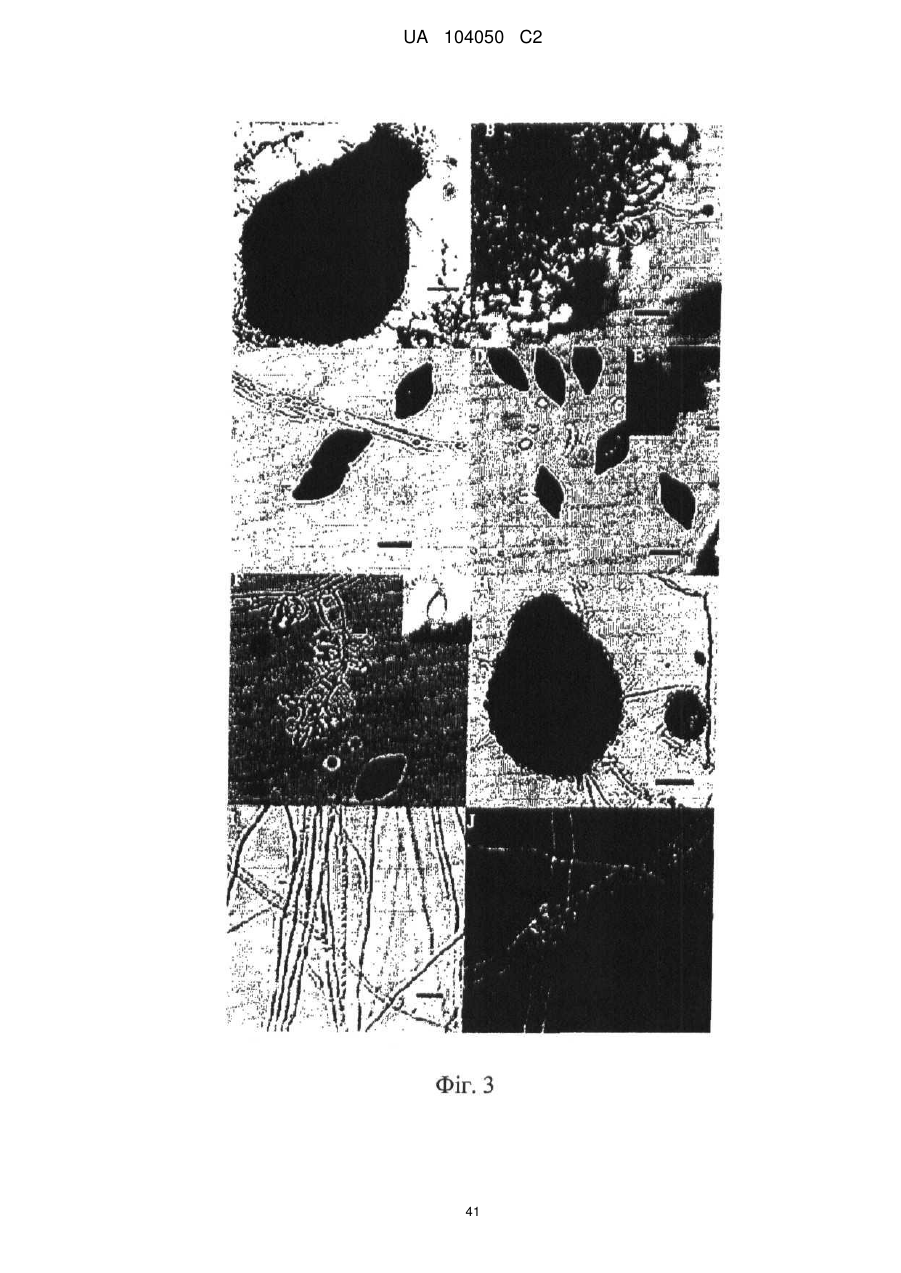
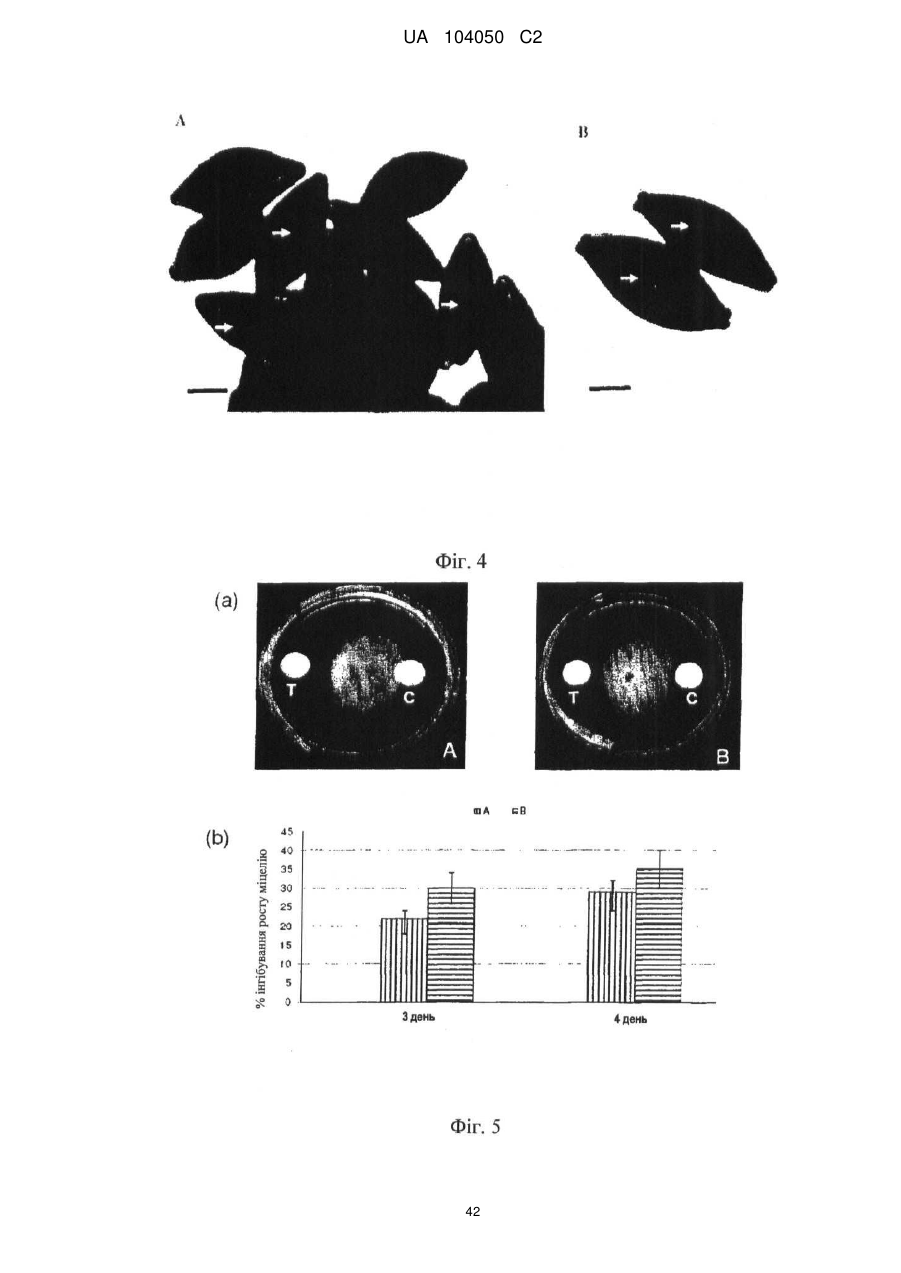
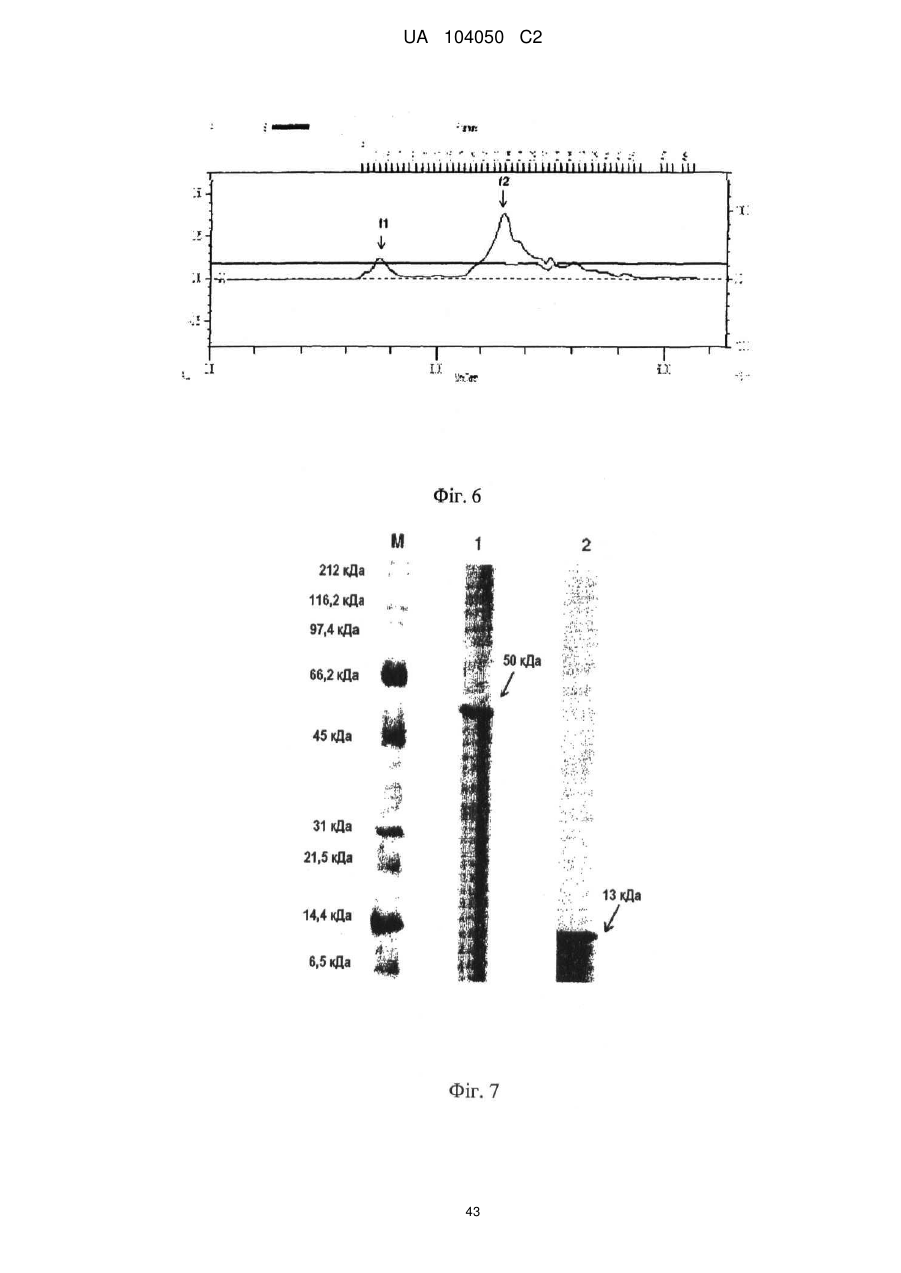
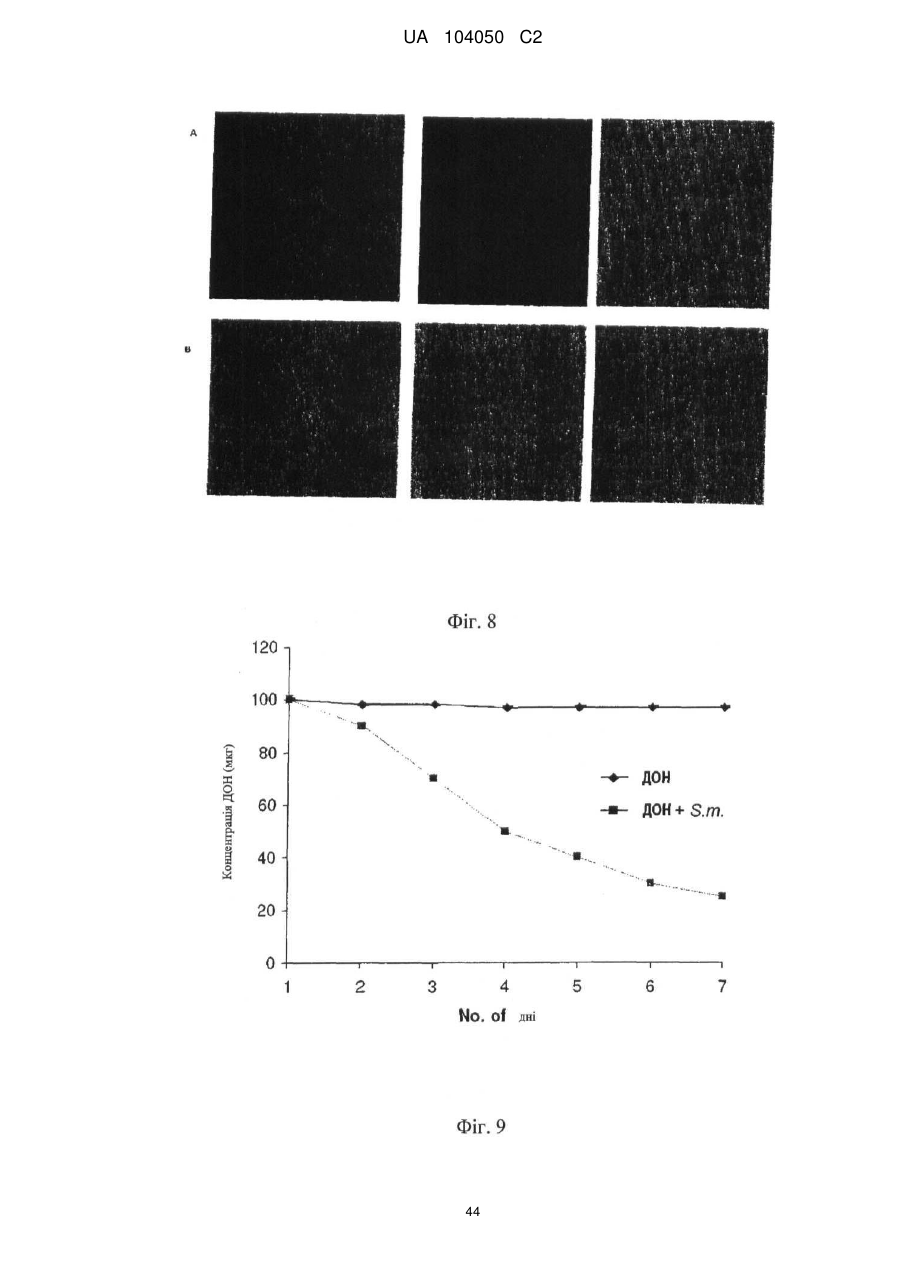
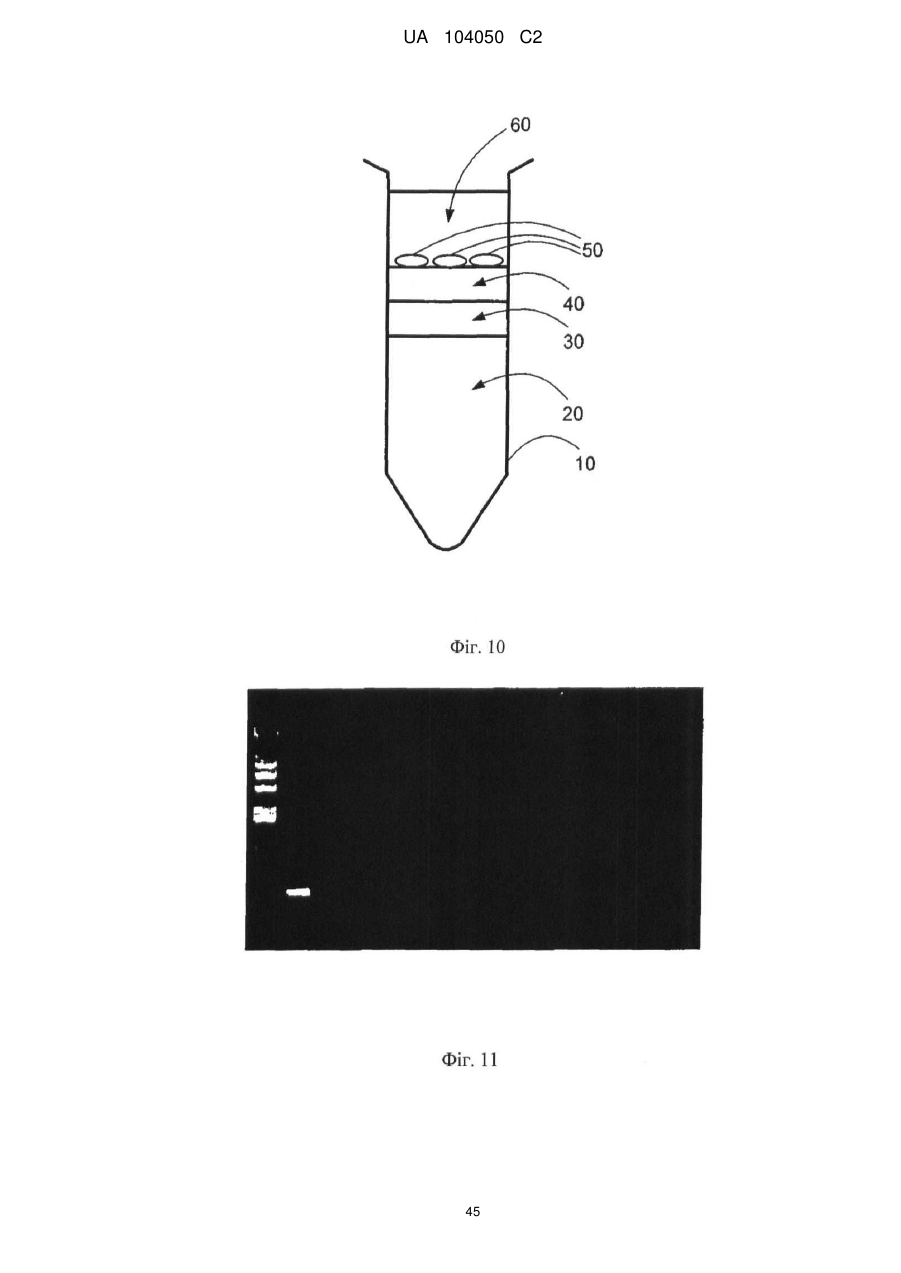
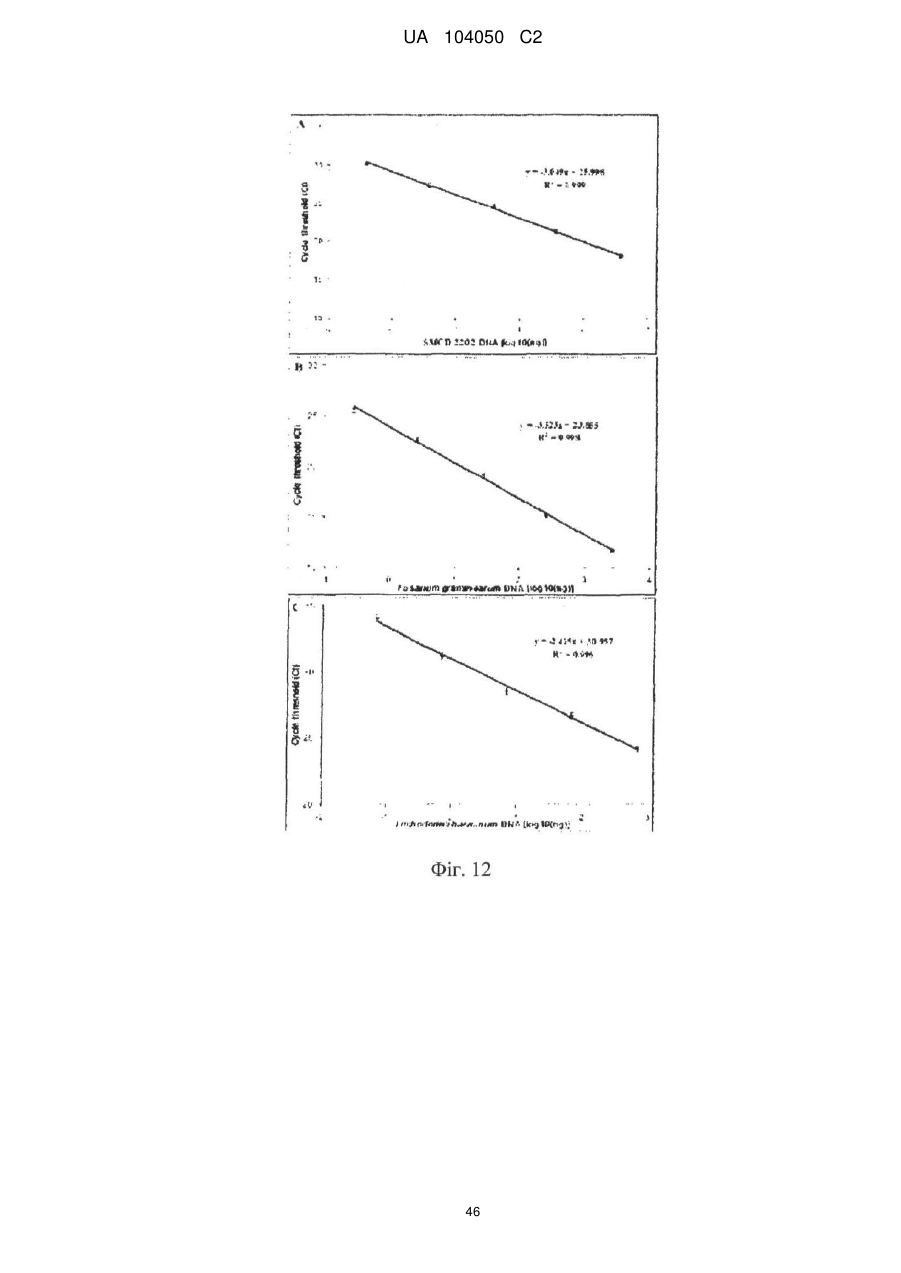
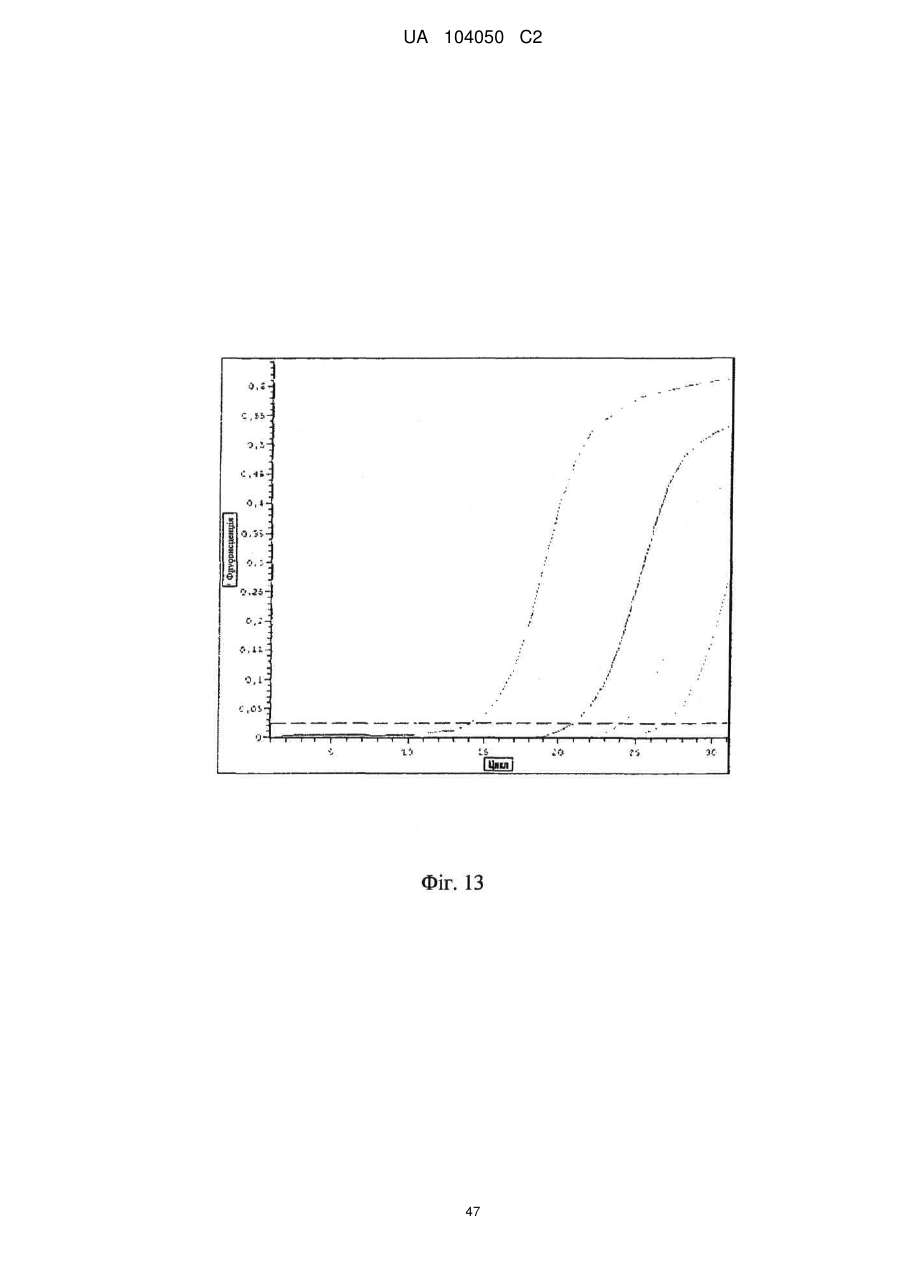
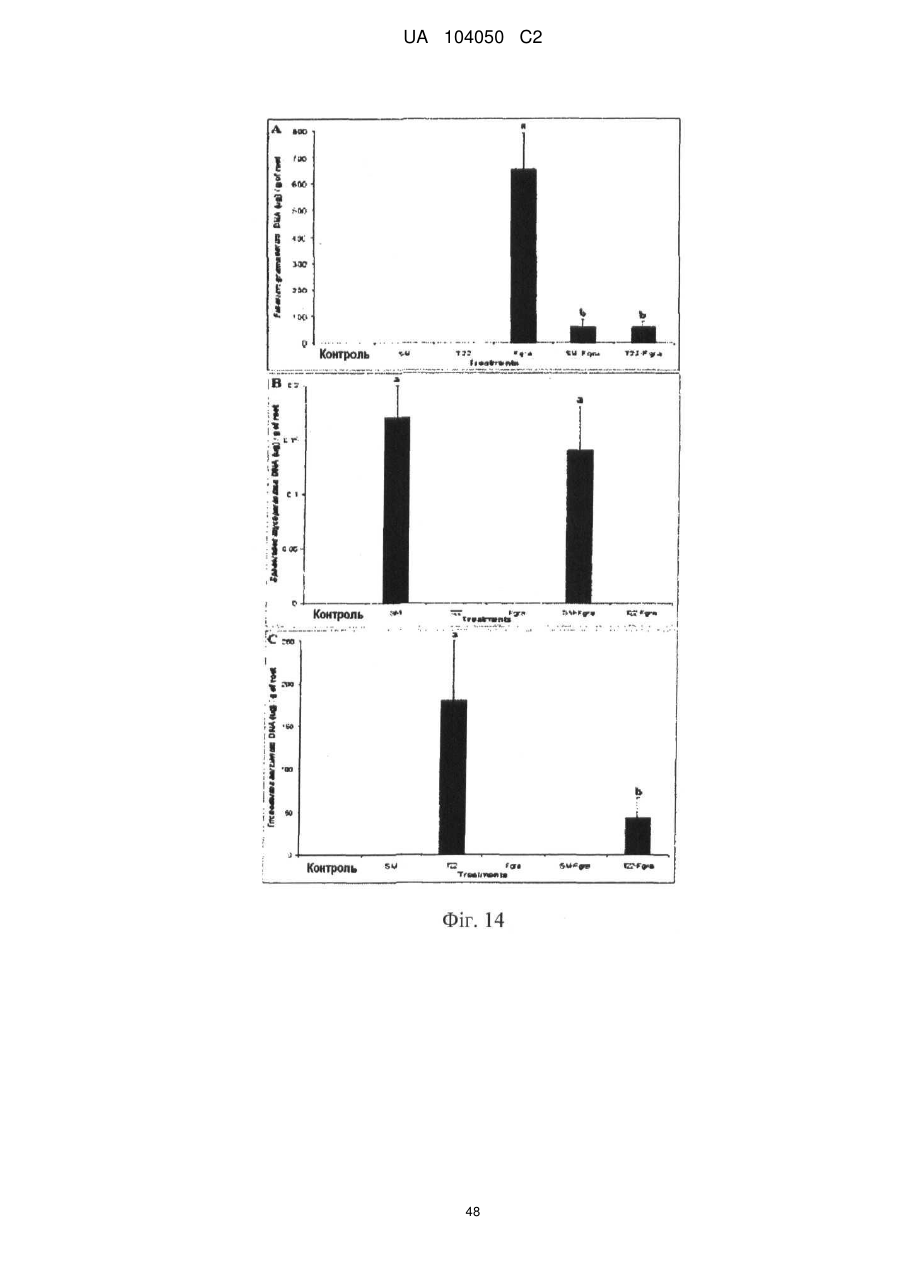
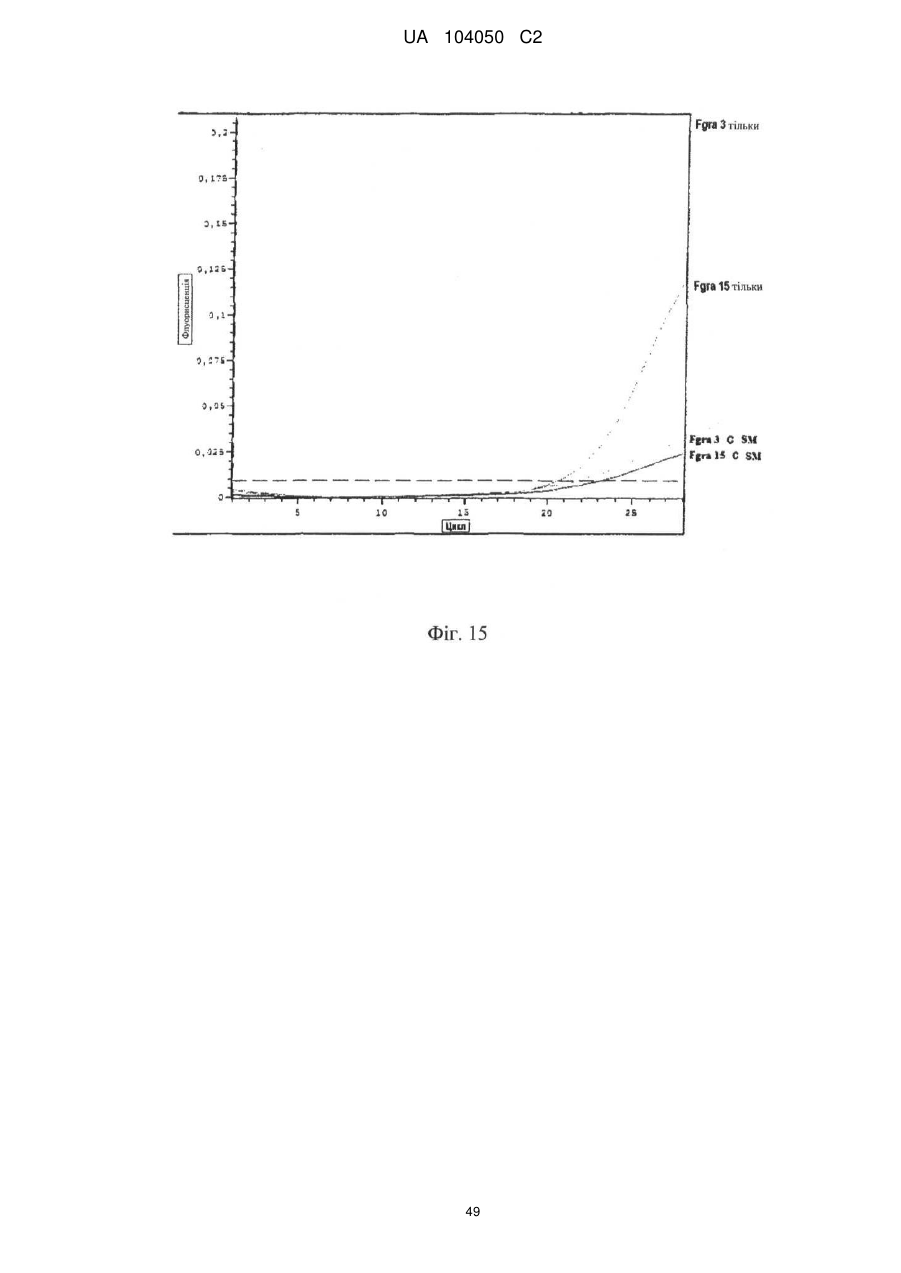
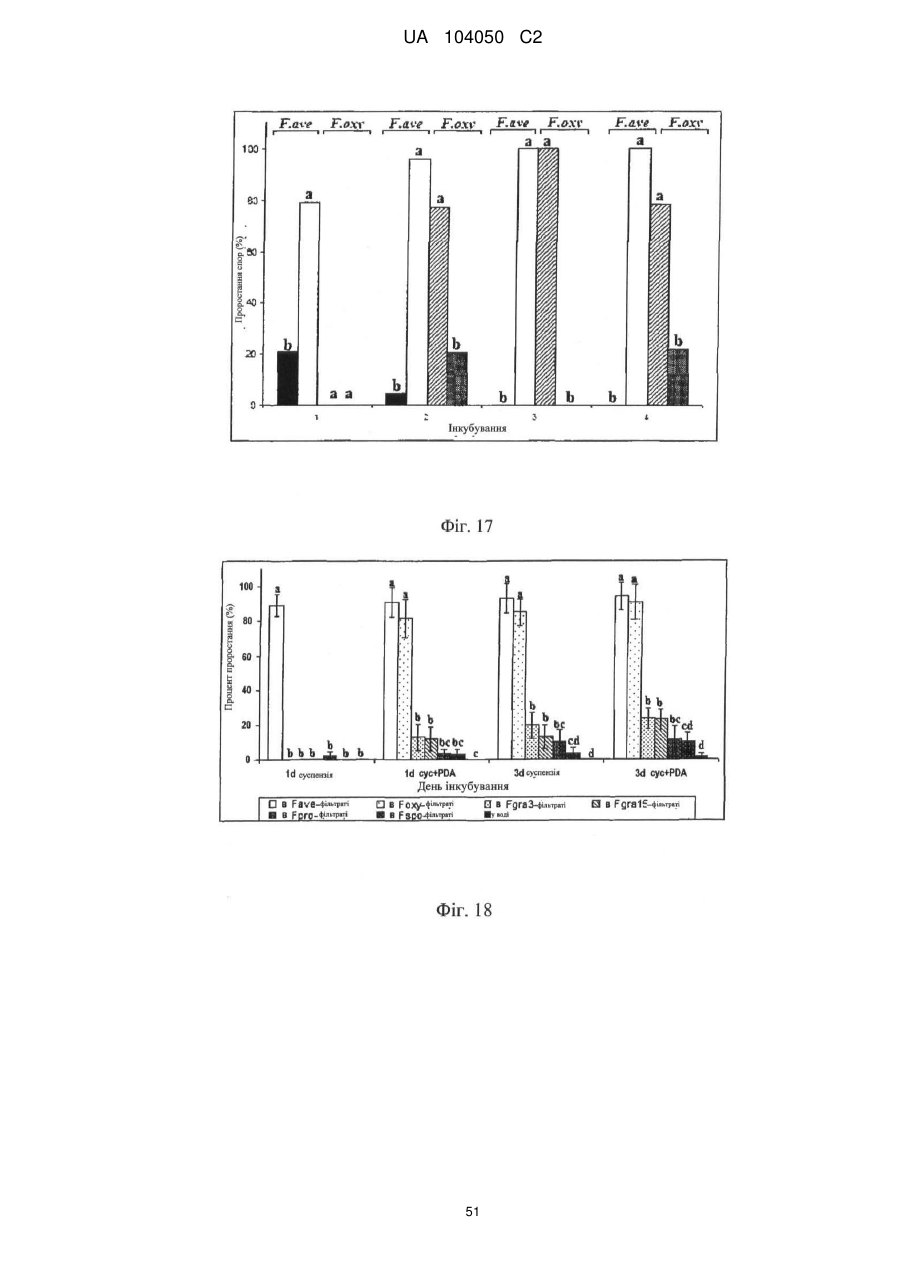
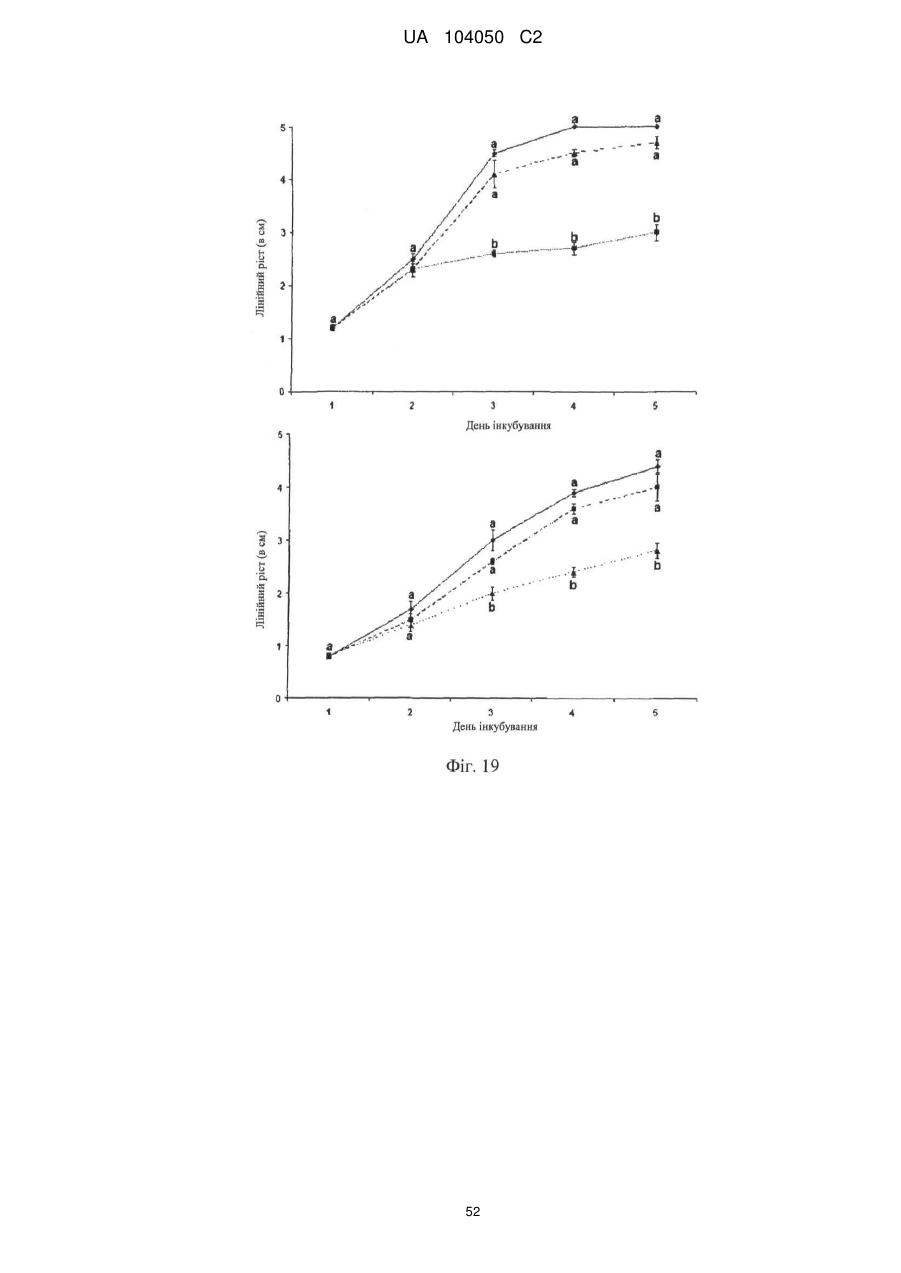
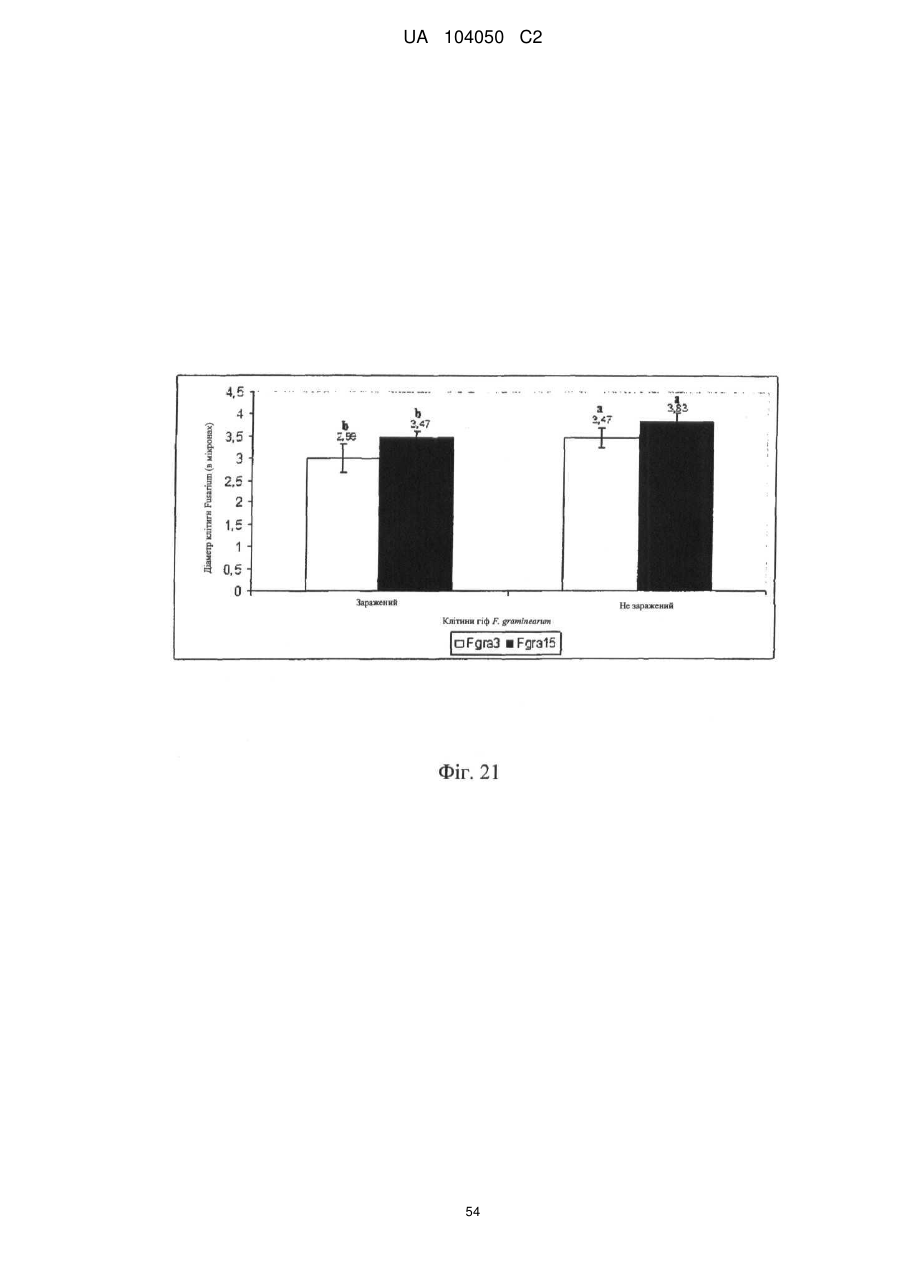
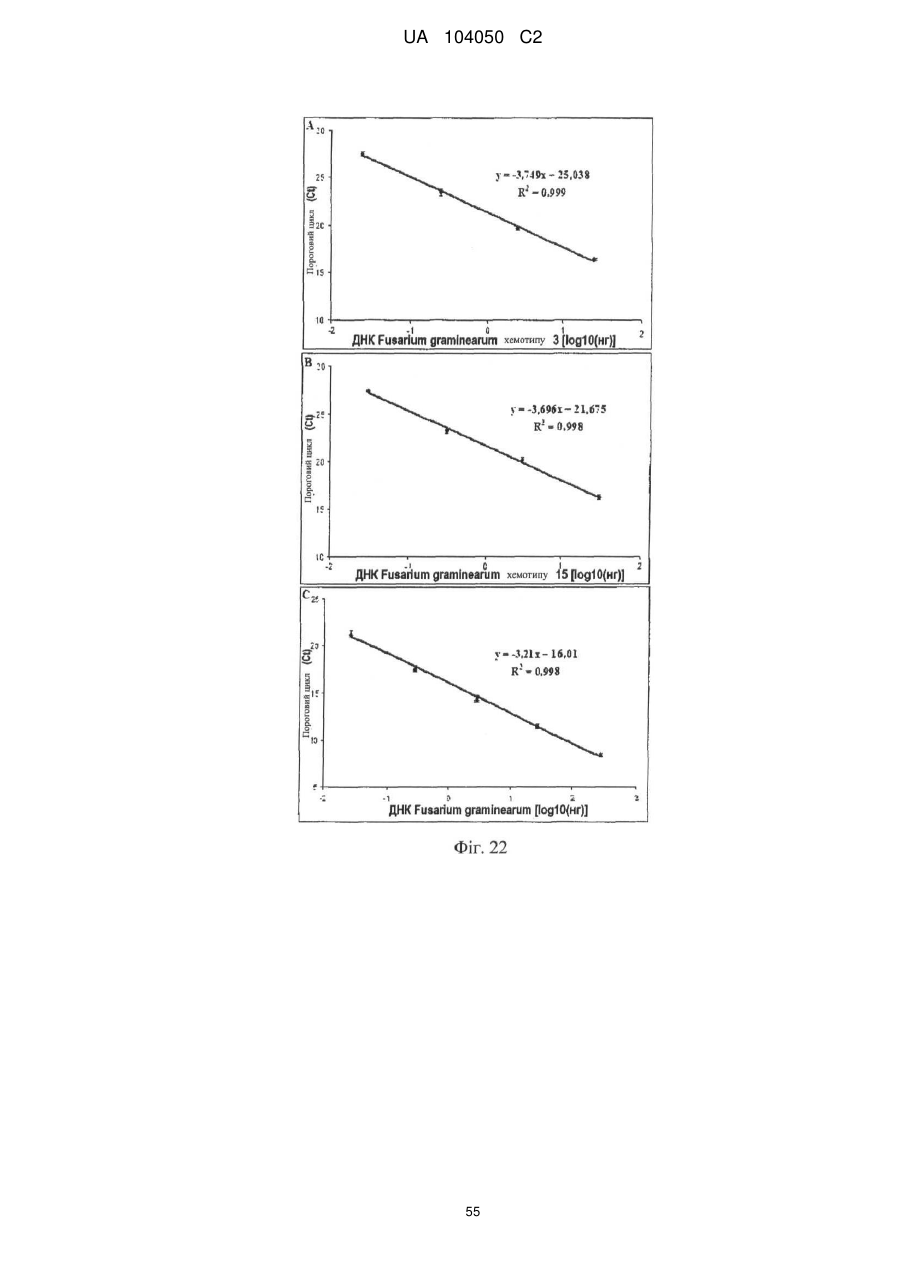
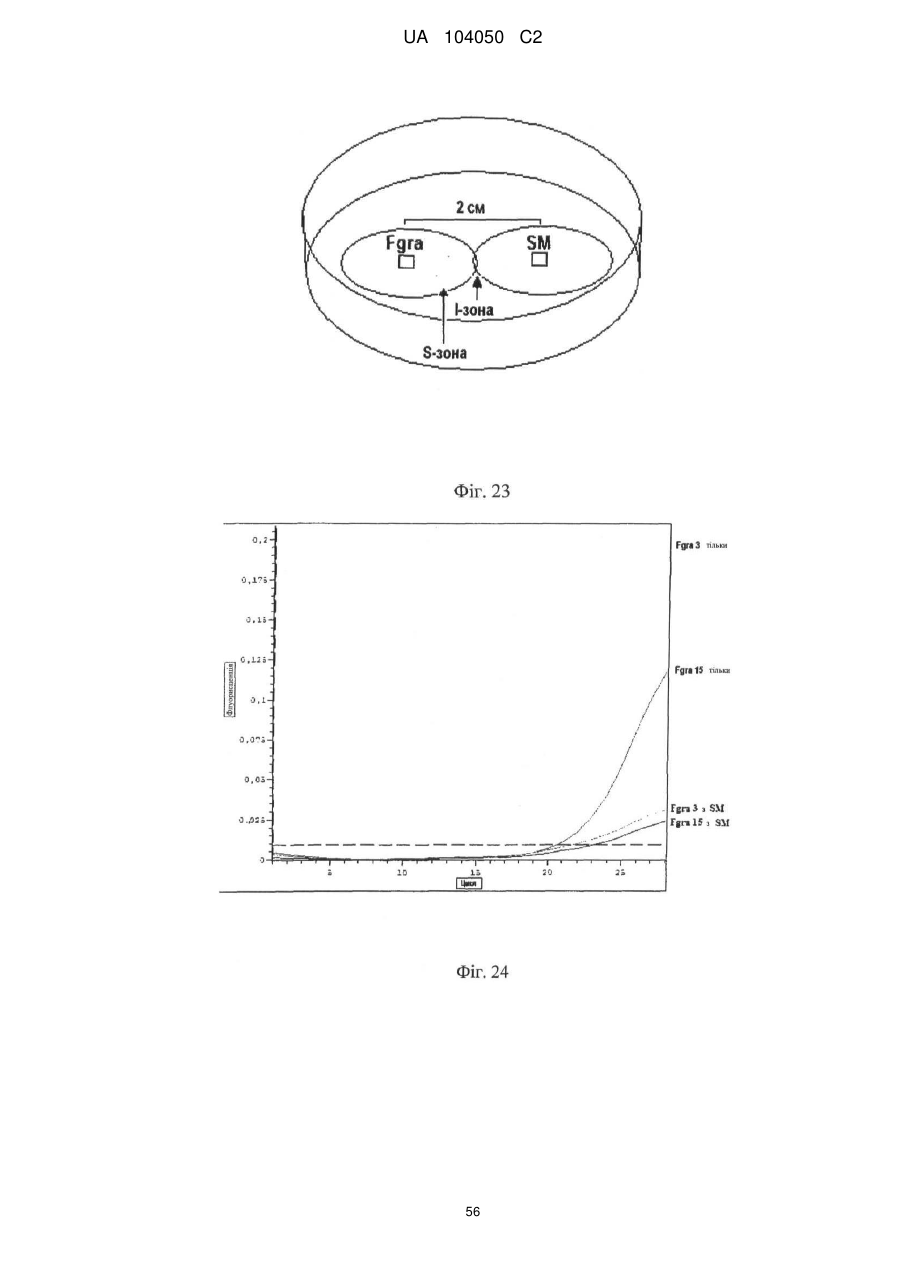
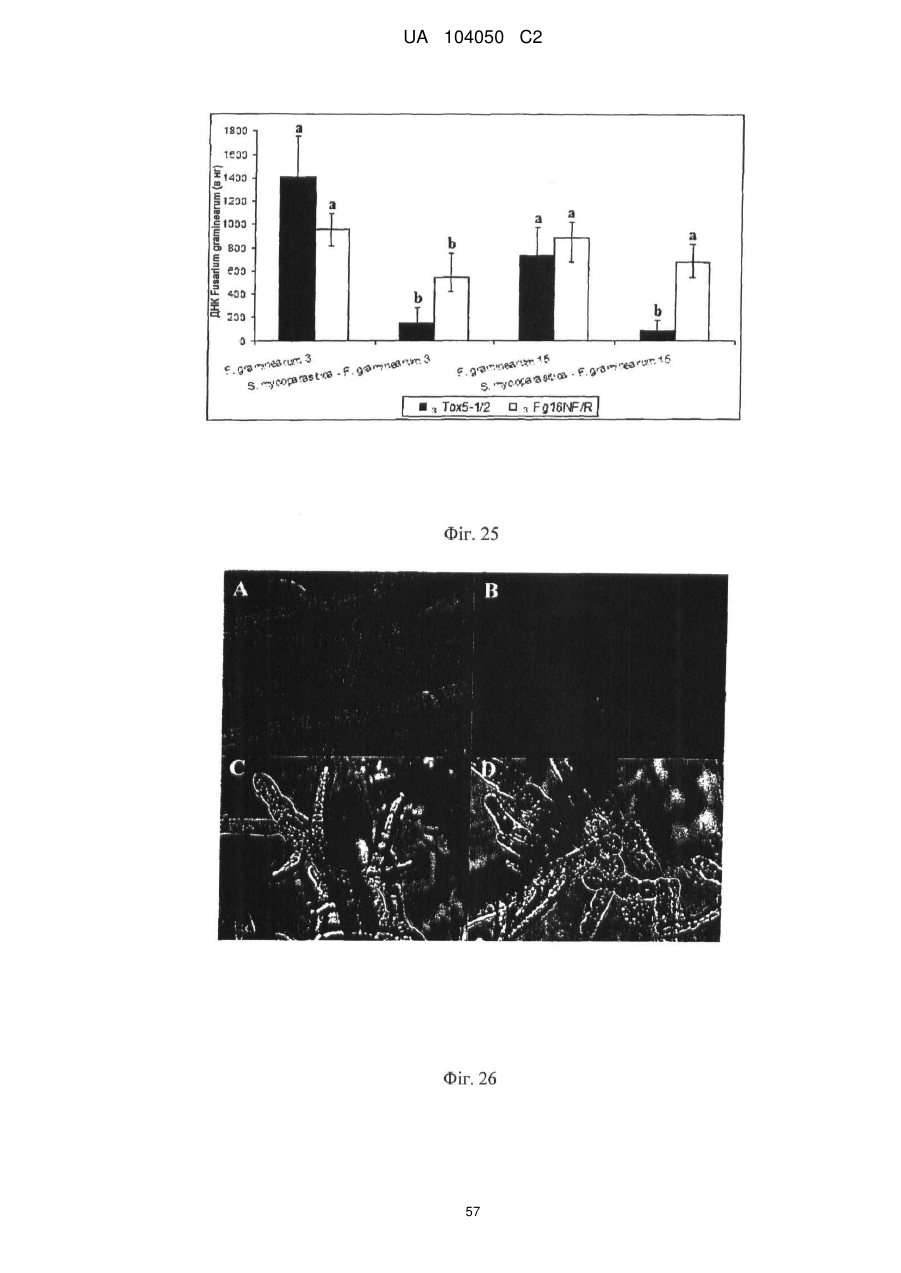
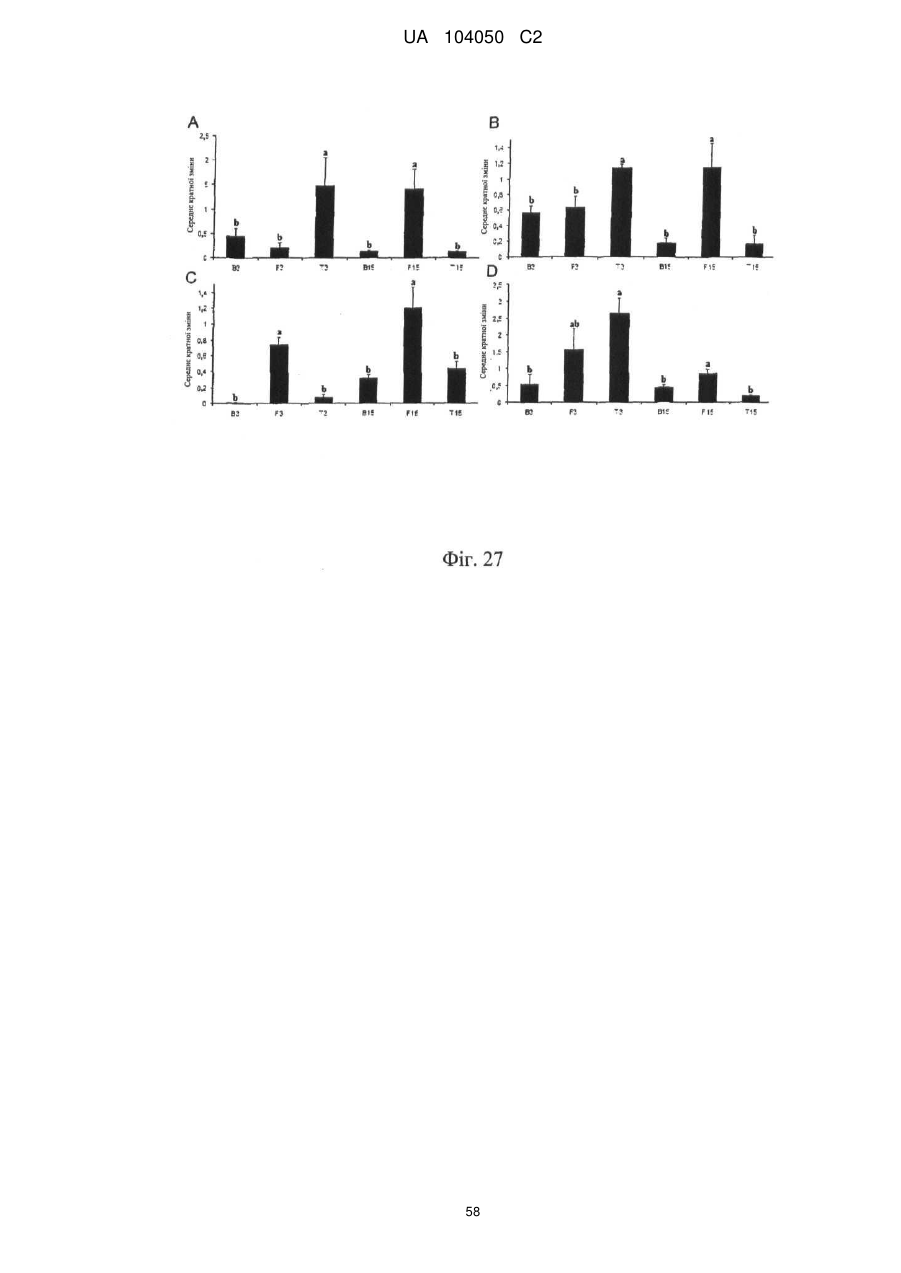
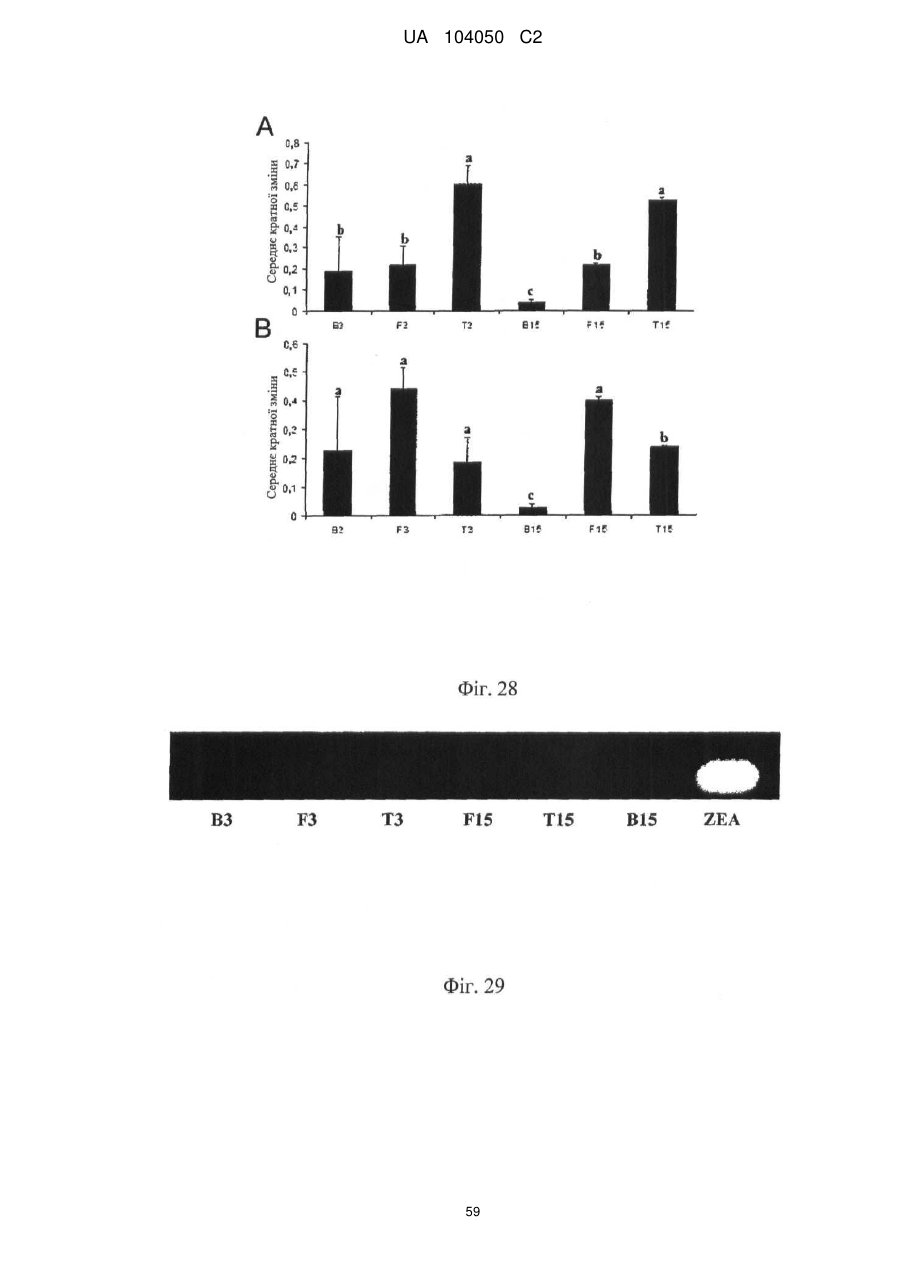
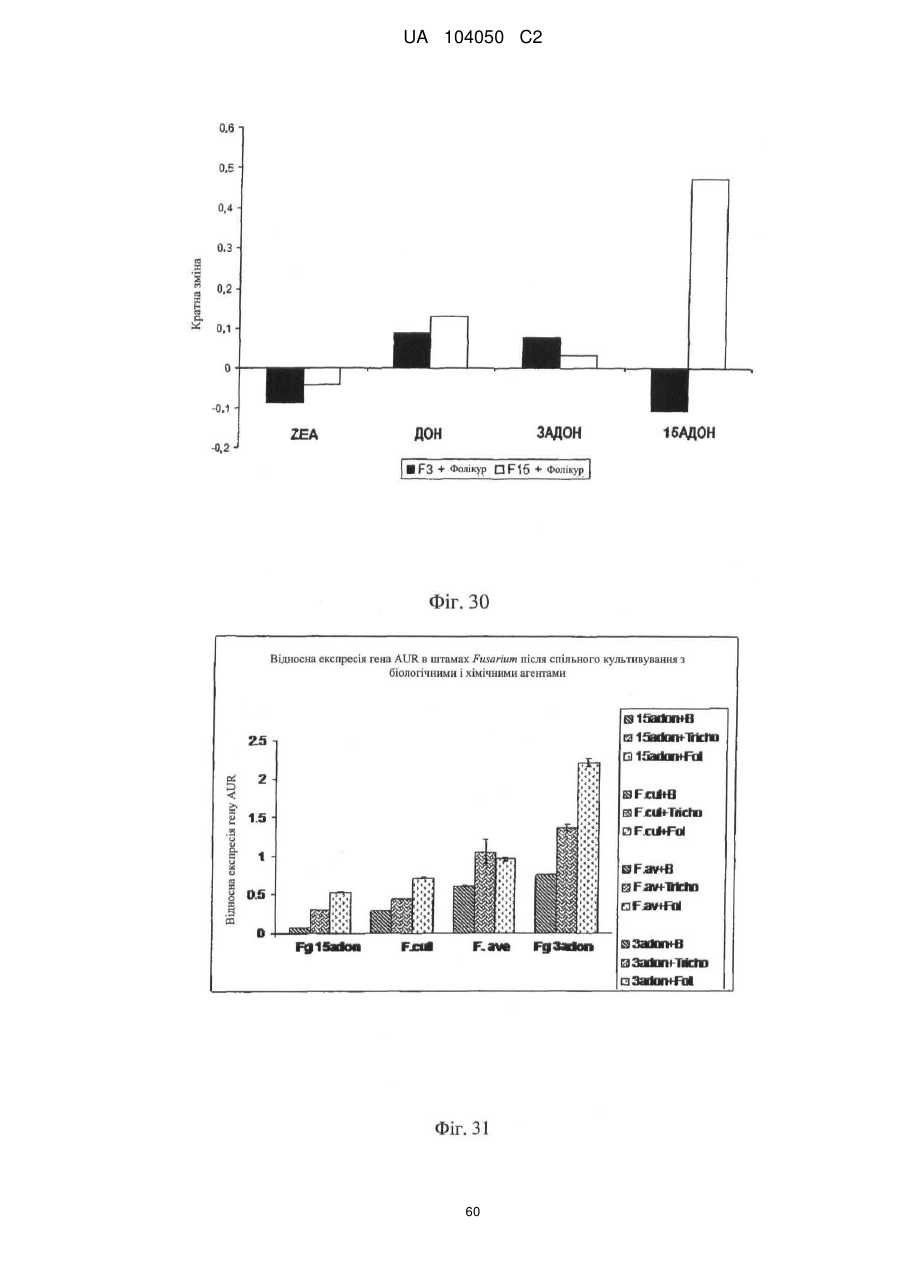
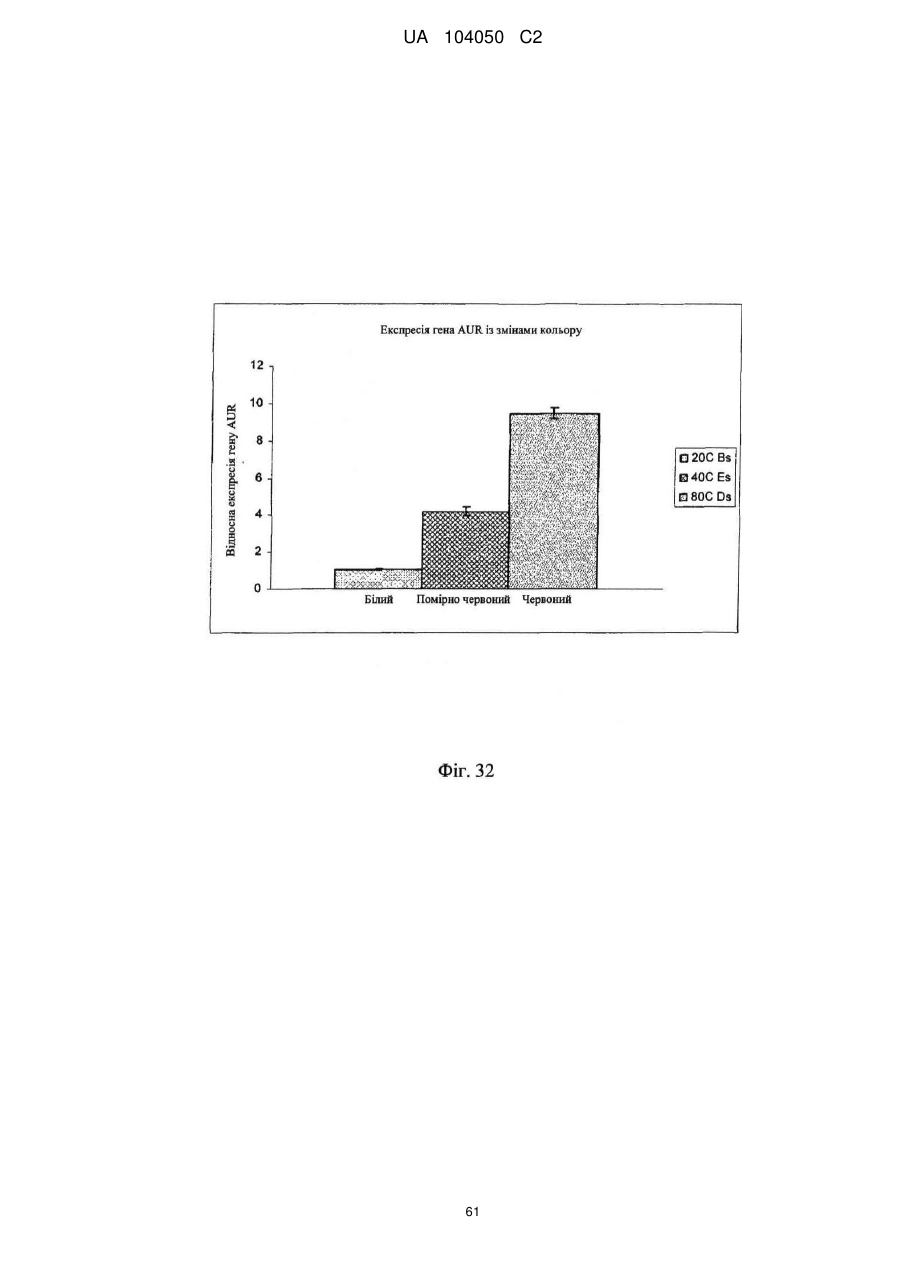
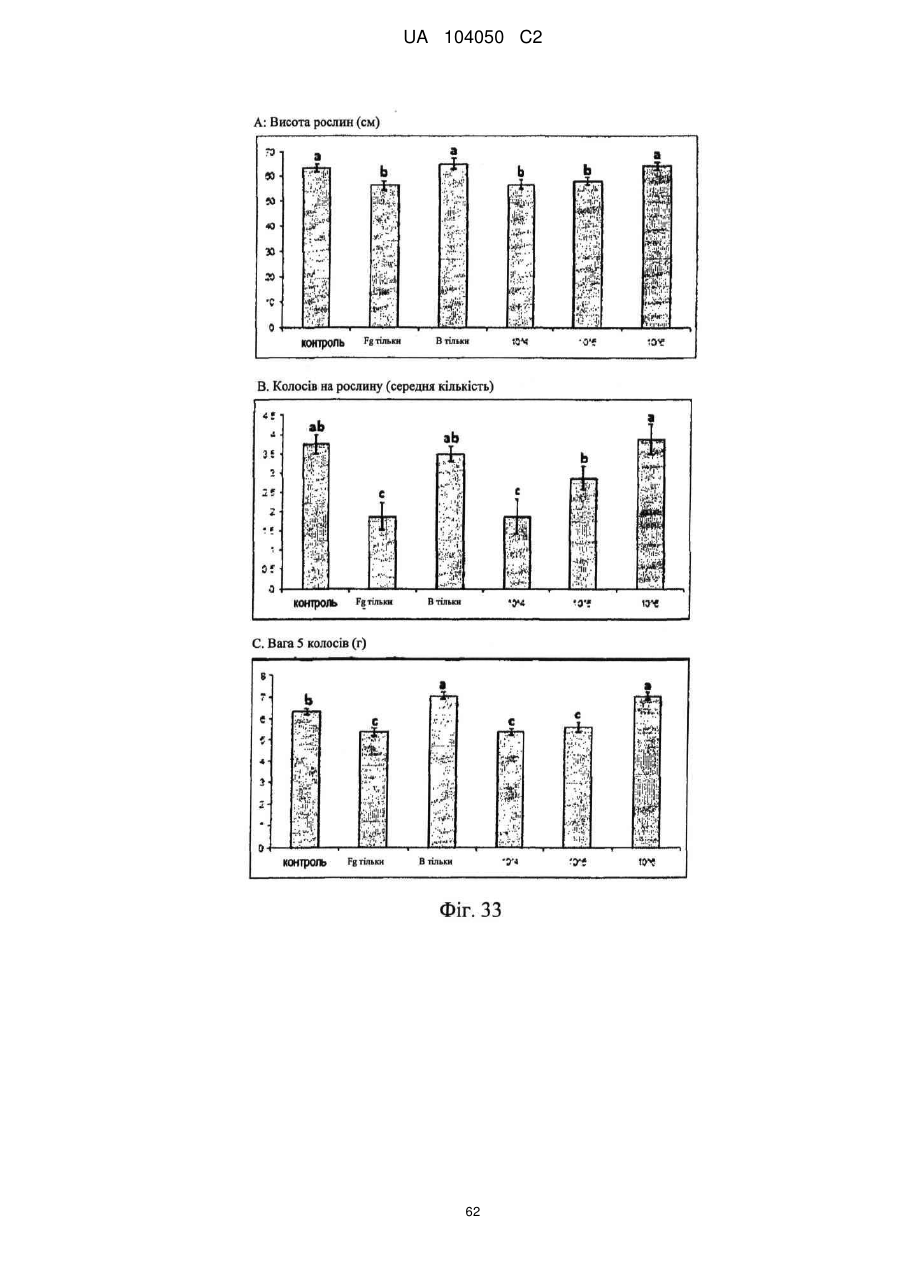
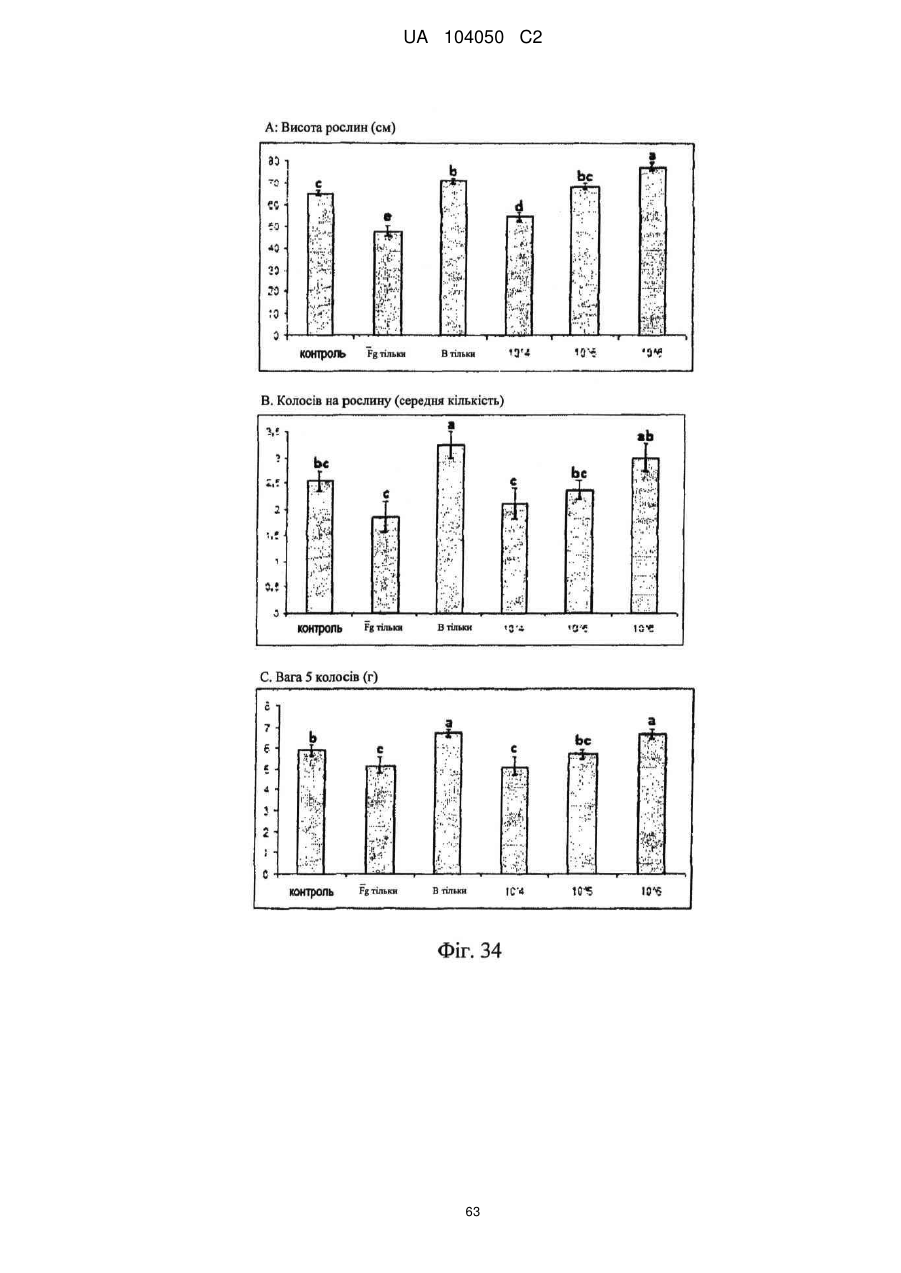
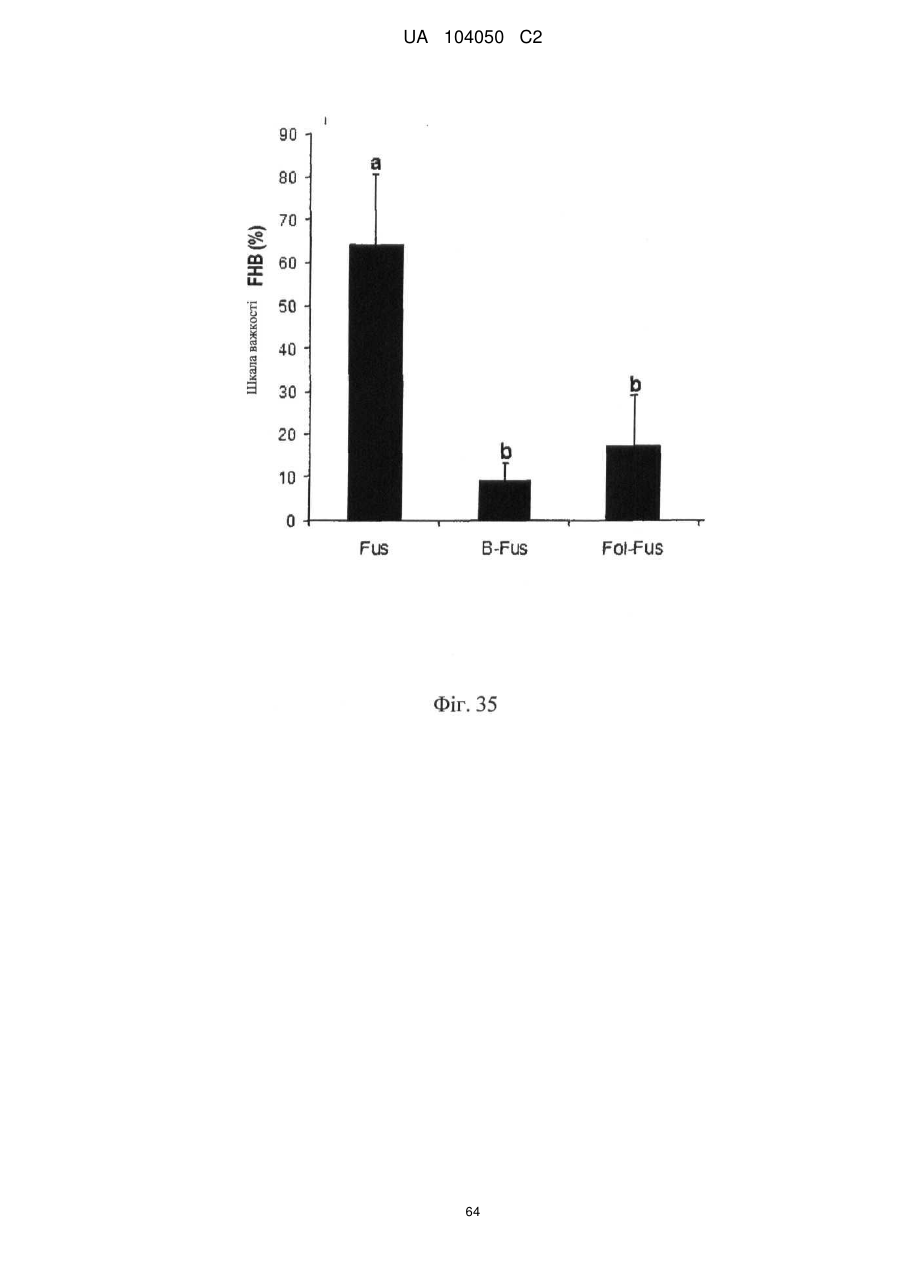
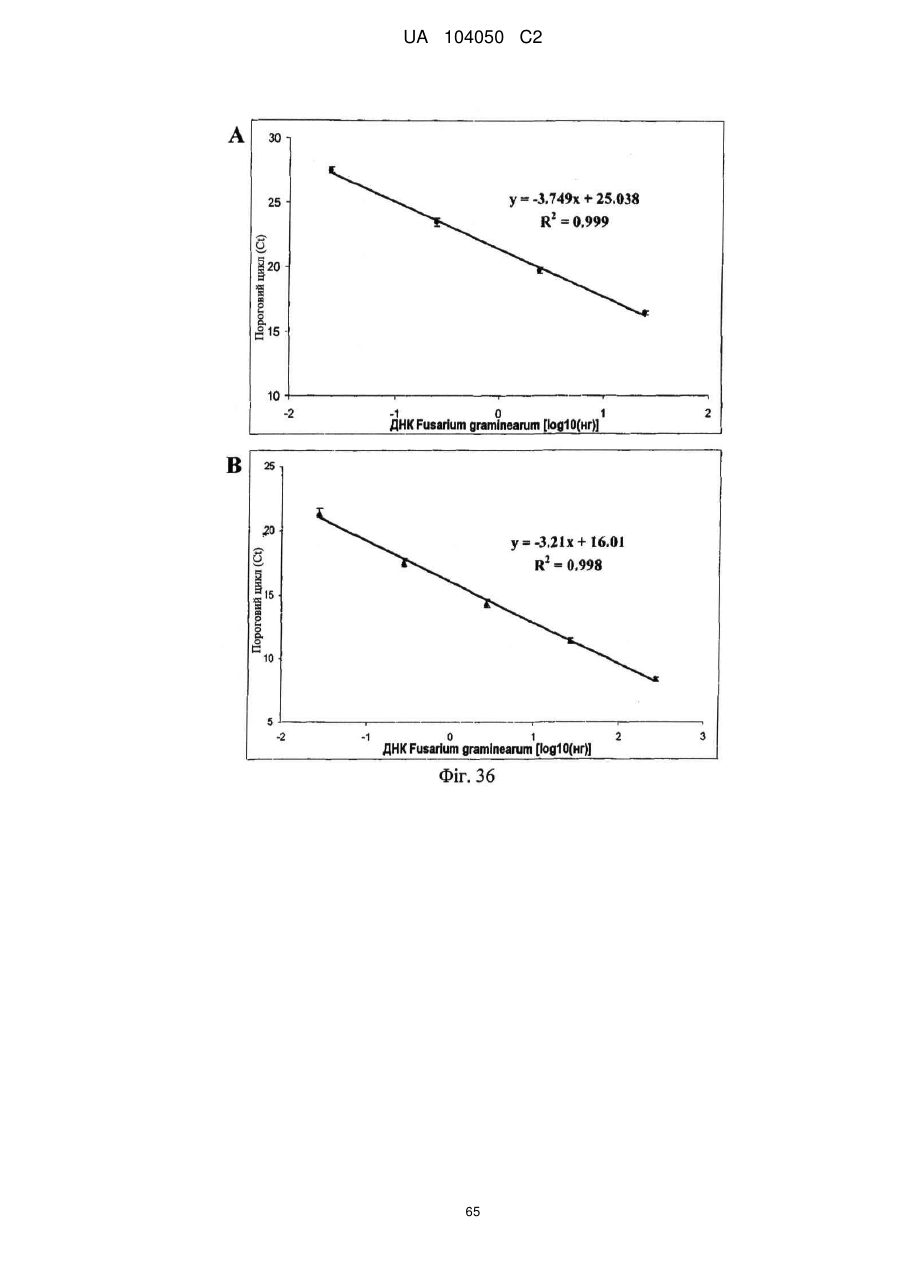
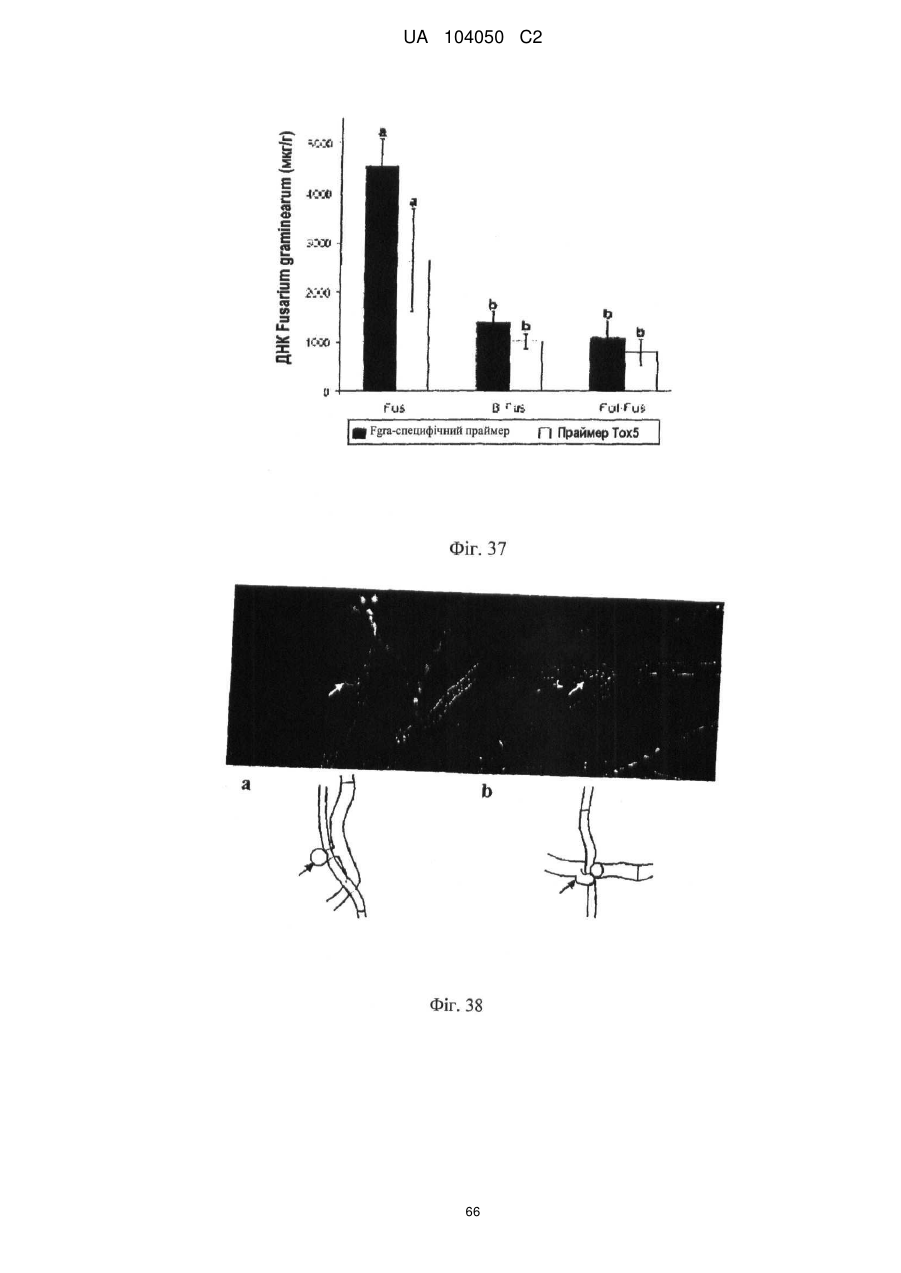
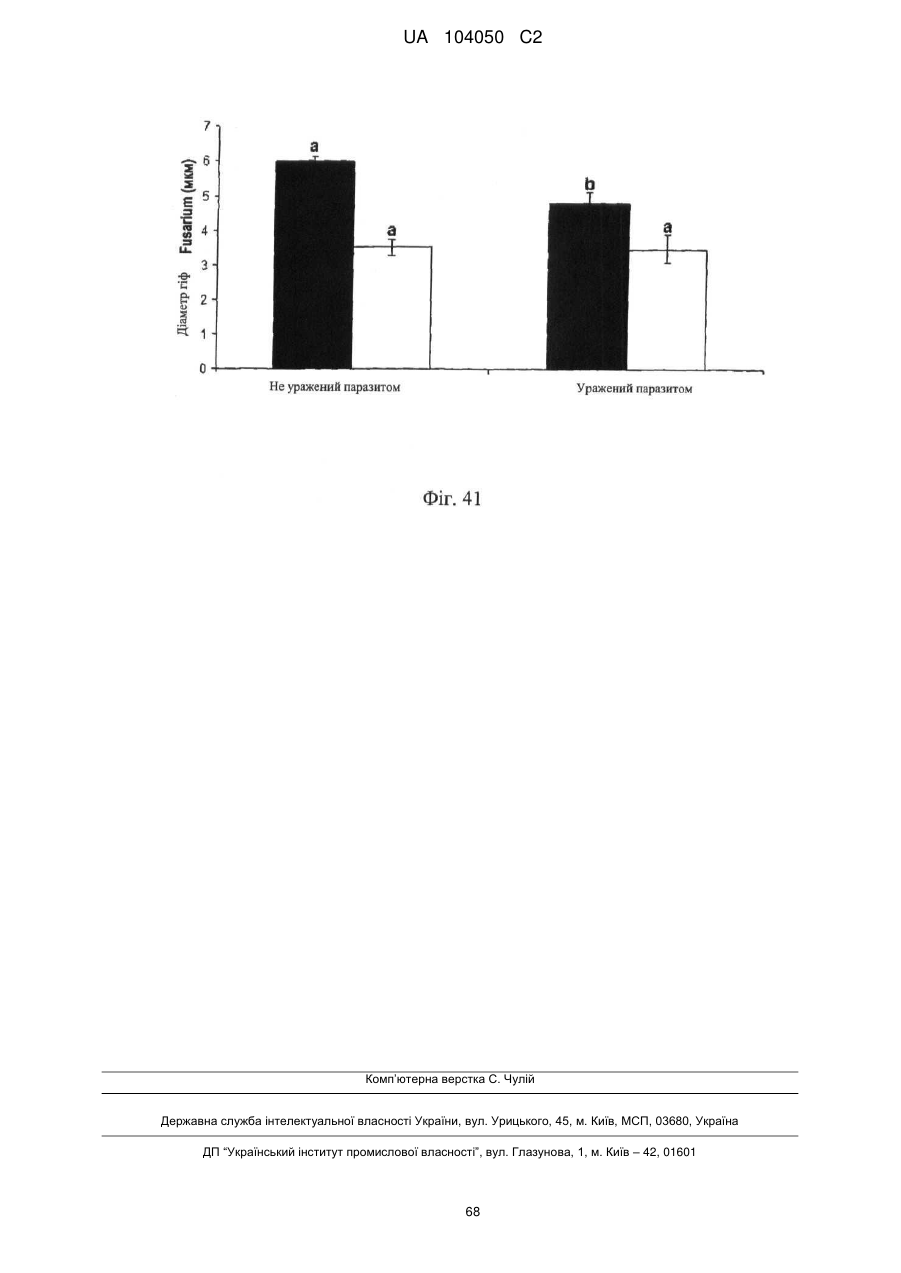
Реферат: UA 104050 C2 (12) UA 104050 C2 Винахід належить до штаму Sphaerodes mycoparasitiсa ID АС 301008-01 для боротьби з рослинним патогеном Fusarium, симптомами захворювання і мікотоксинами in planta і ex planta. UA 104050 C2 5 10 15 20 25 30 35 40 45 50 55 Галузь техніки, якої стосується винахід Даний винахід стосується нових біорегулюючих агентів, пов'язаних композиціям з мікоцидним ефектом і їх застосування. Зокрема, даний агент має мікоцидний ефект відносно грибів роду Fusarium. Даний винахід також стосується виділеного грибкового інокулянту, генів, білків і/або організмів, а також їх застосування і включаючих їх способів і композицій. Рівень техніки Fusarium - рід нитчастих грибів, широко поширених на рослинах і в ґрунті. Деякі види фузаріумів є патогенами рослин. Наприклад, Fusarium oxysporum викликає фузаріозне в'янення більше ніж у ста видів рослин. Фузарії колонізують ксилему рослин, що може приводити до блокади і руйнування. Коли це відбувається, на рослині з'являються такі симптоми як в'янення і пожовтіння листя, зрештою, які приводять до загибелі рослини. Даний стан був основною причиною зниження чисельності і зникнення сорту банана Грос Мішель з ринків по всьому світу. Недавно новий штам почав вражати рослини домінуючого сорту Кавендіш, що привело до побоювань щодо того, що за відсутності рішення даний сорт також зникне зі світових ринків. Коренева гниль, що викликається фузарієм, є головною причиною загибелі розсади в лісових розплідниках, і також викликає знижену виживаність після пересаджування протягом першого періоду вегетації. Захворювання викликається декількома видами Fusarium і поширене в багатьох частинах світу. Дане захворювання представляє особливу проблему в Західній Канаді і Сполучених Штатах, а також в Північних Центральних і Південних штатах. Крім того, смолистий рак сосни, що викликається грибом Fusarium circinatum, є важким захворюванням сосен, і представляє загрозу лісової промисловості, особливо в США і Новій Зеландії. Сосни Radiata або Monterey дуже сприйнятливі до даного захворювання, причому загибель зрілих дерев в деяких областях Каліфорнії становить 80 %. Фузаріоз колоса злакових культур (FHB), також відомий як парша злакових, є захворюванням пшениці, ячменю, вівса і зерен інших дрібних зернових, що викликаються Fusarium. Кукурудза і маїс можуть бути уражені подібним захворюванням, відомим як стеблова гниль. Вищезгадане захворювання може знижувати урожай і якість культури, а також може потенційно приводити до контамінації зерна мікотоксинами. Згідно з оцінкою FHB обходиться зерновій промисловості майже в $5 мільярдів щорічно. У останні роки FHB став істотною і зростаючою проблемою для культур пшениці і ячменю, що мають господарське значення, в Західній Канаді. Раніше були ідентифіковані Fusarium oxysporum і Fusarium avenaceum як два види, що переважно асоціюються з FHB в Канаді, де урожаї в деяких уражених областях падали на 30 % або більше. Зібране зерно, уражене FHB і стебловою гниллю, часто контаміноване мікотоксинами, такими як дезоксиніваленолом (ДОН), трихотеценами, які пов'язані з відмовою від корму, загальними травними розладами, діареєю, геморагічними явищами. Поява токсиногенного 3-ацетилдезоксиніваленолу (3-АДОН) в популяції Fusarium graminearum в Північній Америці – досить нове явище. Він замінює хемотип 15-АДОН. Крім того, профілі мікотоксинів F. culmorum, аналогічно F. graminearum як в лабораторних, так і в польових умовах, представляють додаткову загрозу виробництву кукурудзи, маїсу і пшениці у всьому світі. У даний час не існує ніяких ефективних способів боротьби з FHB і відповідними мікотоксинами. Крім того, також не існує ніяких стійких сортів кукурудзи, пшениці, ячменю, вівса або інших дрібних злаків. Фунгіциди можуть бути ефективними, але тільки тимчасово придушують захворювання. У доповнення до того, що фузарії є поширеними патогенами рослин, Fusarium spp. можуть в деяких умовах інфікувати тварин і можуть бути збудниками шкірних і/або системних інфекцій у людей. Фузарії є одними з найстійкіших до лікарських засобів грибів, що робить інфекції, що викликаються фузаріями, такими, що важко піддаються лікуванню, при цьому інвазивні інфекції можуть виявитися летальними. Суть винаходу Даний винахід пов'язаний з новим сумчастим грибом (аскоміцетом) Sphaerodes mycoparasitia, ідентифікованим у вигляді штаму IDAC 301008-01 і, альтернативно, у вигляді штаму SMCD2220-01, який має мікопаразитичну і антимікотоксичну дію. Крім того, зі штаму S. mycoparasitia IDAC 301008-01 були виділені мікотоксичні білки. У даній заявці також розкриті застосування, способи, композиції, послідовності і продукти. Короткий опис фігурФіг. 1 являє собою мікофотознімок, на якому показані культури Sphaerodes mycoparasitica через два тижні інкубування на (А) модифікованому агарі Леоніана і (В) картопляному агарі з декстрозою - верхня сторона, (С) і (D) - нижня сторона; 1 UA 104050 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 2 являє собою мікофотознімок, на якому показано проростання аскоспор Sphaerodes mycoparasitica, при цьому показана схема однополюсного і двополюсного проростання, а також схема формування анастомозу гіф (стрілка); Фіг. 3 являє собою мікофотознімок, на якому показані Sphaerodes mycoparasitica: (А) Аскома, (В) Гіаліновий спорофор, що утворюється з вузької частини (стрілка), (С) Сітчасті аскоспори (стрілки), (D) Гладка аскоспора (стрілка), (Е) Трикутна аскоспора (стрілка), (F) Фіаліди, що утворилися на аскомі, що оточує гіфи, (G) Колбоподібна фіаліда, що утворилася на поверхні перидіальної стінки аскоми, (Н) Формування зрілих і зростаючих аском, (I) Формування гачкоподібних структур S. mycoparasitica, що паразитують на живих гіфах Fusarium oxysporum (стрілки), і (J) Збільшене зображення гачкоподібних структур на живих гіфах F. avenaceum. Масштабні мітки для (А) і (Н) відповідають 50 пм; для (В), (С), (D), (Е), (F), (G) і (J) - 10 пм; для (I) - 25 пм; Фіг. 4(А) являє собою мікофотознімок, на якому показані аскоспори Sphaerodes mycoparasitica з помітно ребристою поверхнею і виступаючими нерегулярними подовжніми ребрами (стрілки); (В) показані аскоспори Sphaerodes quadrangularis. Масштабна мітка 5 пм; Фіг. 5(a) являє собою мікофотознімок, на якому показане інгібування росту міцелію (А) Fusarium oxysporum і (В) Fusarium graminearum під дією позаклітинних білків, виділених з культури Sphaerodes mycoparasitica; 5(b) - діаграма, на якій показаний процент інгібування росту міцелію А) Fusarium oxysporum і (В) Fusarium graminearum під дією позаклітинних білків S. mycoparasitica; Фіг. 6 являє собою FPLC-хроматограму, на якій показані позаклітинні білки f1 і f2, виділені з культури Sphaerodes mycoparasitica; Фіг. 7 являє собою мікофотознімок ДСН-ПААГ гелів очищених позаклітинних білків, виділених з культури Sphaerodes mycoparasitica. Доріжка М містить маркерні білки. Доріжка 1 містить очищений білок з піка f1. Доріжка 2 містить очищений білок з піка f2; Фіг. 8 являє собою мікофотознімки, на яких показане інгібування проростання спор F. oxysporum (A-a-b) і проростання спор F. graminearum (В-1-b) під дією очищених білків f1 і f2 в порівнянні з контролем (A-c і B-c); Фіг. 9 являє собою діаграму, на якій показаний рівень деградації 3-АДОН під дією Sphaerodes mycoparasitica в картопляно-декстрозному поживному середовищі, при аналізі ВЕРХ; Фіг. 10 являє собою схематичне зображення системи для вирощування рослин пшениці в контейнері (4×4×16 см) з різними шарами гідропонних сумішей для вирощування; Фіг. 11 являє собою мікофотознімок гелю, на якому показані ампліфікування з використанням праймерів SmyITSF/R ПЛР-продукти для S. mycoparasitica (SM), п'яти штамів Fusarium (Fa=F. avenaceum, Fo=F. oxysporum, Fs=F. sporotrichioides, Fg3=F. graminearum хемотип 3 і Fg15=F. graminearum хемотип 15), двох видів Trichoderma (T22=T. harzianum T22 і Tv=T. viride), двох видів Cladosporium (ACC=C. cladosporioides і СМ = C. minourae) і Penicillium aurantiogriseurn (PA), після електрофорезу (1 %-ий агарозний гель при 100В протягом 20 хвилин). Розмір смуги відповідає приблизно 300-400 п. н.; Фіг. 12 являє собою діаграму, на якій показані стандартні лінійні криві для (А) Sphaerodes 2 -2 mycoparasitica (в діапазоні, 8×10 -3,8×10 нг при десятиразовому зменшенні); (В) Fusarium 3 -1 graminearum 3-ADCIN (в діапазоні 2,7×10 -2,7×10 нг при десятиразовому зменшенні); (С) 2 -2 Trichoderma harzianum Т-22 (в діапазоні 7,0×10 -7,0×10 нг при десятиразовому зменшенні); Фіг. 13 являє собою діаграму, на якій показані сигмоїдальні кольорові криві ПЛР-РВ для 2 Sphaerodes mycoparasitica (SMCD 2220-01) з 0,025 лінією флуоресценції, в діапазоні 3,8×10 -2 3,8×10 нг при десятиразовому зменшенні; Фіг. 14 являє собою діаграми, на яких показані кількості геномної ДНК для (А) F. graminearum (Fgra); (b) S. mycoparasitica (SM) і (С) Trichoderma harzanium (Т-22) при аналізі в корінні ярової пшениці за допомогою родоспецифічної кількісної ПЛР в реальному часі. Всі значення є середніми для 6 повторів. Планки погрішностей вказують стандартне відхилення; Фіг. 15 являє собою діаграму, на якій показані криві флуоресценції в реальному часі послідовностей гена tri5, ампліфікованих з використанням набору праймерів Tox5-1/2 з сумарної ДНК, виділеної в аналізах на подвійній культурі штаму Fusarium graminearum і попередньо інокульованого Sphaerodes mycoparasitica SMCD2220-01 (SNI) або окремо вирощених 3-АДОН і 15-АДОН хемотипів F. graminearum; Фіг. 16 являє собою мікофотознімки аском і аскоспор Sphaerodes mycoparasitica: (А) формування аском S. mycoparasitica на колонії F. avenaceum (стрілки вказують, що аскоми утворилися поряд або оточують культури Fusarium); (В) утворення численних S. mycoparasitica перитеціїв з остіолами на колонії F. oxysporum (стрілки вказують перитеції, сформовані на 2 UA 104050 C2 5 10 15 20 25 30 35 40 45 50 55 60 ізоляті Fusarium); (С) непроросла темно-коричнювата сітчаста аскоспора S. mycoparasitica; (D) проростаюча аскоспора S. mycoparasitica в суспензії фільтрату F. oxysporum, показана монополярна проростаюча спора: (Е) монополярна проростаюча спора S. mycoparasitica через 3 дні в суспензії фільтрату F. oxysporum; (F) аскоспора S. mycoparasitica, що демонструє біполярне проростання в суспензії фільтрату F. oxysporum через 3 дні з додатковим 1-денним інкубуванням на PDA; (G) структура біполярного проростання S. mycoparasitica в суспензії фільтрату F. avenaceum з додатковим 1-денним інкубуванням на PDA; (Н) монополярне проростання спор S. mycoparasitica, суспендированних в фільтраті F. avenaceum, протягом 3 днів з 1-денним інкубуванням на PDA; (I) моно і біполярне проростання, що демонструється аскоспорами S. mycoparasitica через 3 дні інкубування в суспензії фільтрату F. avenaceum з додатковим 1-денним інкубуванням на PDA. Масштабні мітки для (С)-(Н) відповідають 10 мкм, а для (I) - 20 мкм. SM, Fa і Fo означають S. mycoparasitica, F. avenaceum і F. oxysporum, відповідно; Фіг. 17 являє собою діаграму, на якій показані структури проростання спори Sphaerodes mycoparasitica біотрофного ікопаразитичного гриба зі спорами, виділеними з колонії F. oxysporum. Моно ( ) і бі (□) полярне проростання в суспензії фільтрату F. avenaceum; і Моно ( ) і бі ( ) полярне проростання в суспензії фільтрату F. oxysporum. 1=1- денна суспензія, 2=1денна суспензія плюс 1-денне інкубування на PDA, 3=3- денна суспензія і 4=3- денна суспензія плюс 1- денне інкубування на PDA. Для кожного дня інкубування S. mycoparasitica проводили окремий аналіз; Фіг. 18 являє собою діаграму, на якій показано проростання аскоспор Sphaerodes mycoparasitica в фільтратах шести штамів Fusarium і обробки водних суспензій протягом чотирьох різних днів інкубування. Суспензії в різних обробках були наступними: Fave-фільтрат = фільтрат F. avenaceum; Foxy-фільтрат = фільтрат F. oxysporum; Fgra3-фільтрат = фільтрат F. graminearum хемотипу 3; Fgra15-фільтрат = фільтрат F. graminearum хемотипу 15; Fproфільтрат = фільтрат F. proliferatum; Fspo-фільтрат = фільтрат F. sporotrichioides; і вода = контроль. День інкубування був наступним: 1- денна суспензія = спори, суспендовані протягом 1 дні в різних обробках суспензії; 1d sus+PDA = спори, суспендовані протягом 1 дні при обробці суспензії і потім інокулювання на середовище PDA ще на день; 3- денна суспензія = спори, суспендовані протягом 3 днів при різних обробках суспензії; і 3d sus+PDA = спори, суспендовані протягом 3 днів при обробці суспензії і потім інокулювання на середовище PDA ще на день; Фіг. 19 являє собою діаграми, на яких показане лінійне зростання міцелію (А) Fusarium graminearum хемотипу 3, і (В) Fusarium graminearum хемотипу 15 в аналізах на двох культурах, що заражаються Sphaerodes mycoparasitica при спільній інокуляції (один день) (--▲--) і … … попередній інокуляції (за 1 день до інокуляції Fusarium) ( ), а також контроль (без мікопаразита) протягом 5 днів; Фіг. 20 являє собою мікофотознімки взаємодій між хемотипами F. graminearum 3-АДОН (Fgra3) і 15-АДОН (Fgra15) в мікроскопічному дослідженні культур з використанням S. mycoparasitica (S) біотрофного мікопаразитичного гриба: (А) Одиночний міцелій S. mycoparasitica, (В) міцелій F. graminearum з червоним комплексом, (С) Абсорбція червоного комплексу з F. graminearum S. mycoparasitica (стрілка), (D) Екскреція червоного комплексу в кристалічних формах (стрілки) S. mycoparasitica з міцелію, взаємодіючого тільки з F. graminearum хемотипу 3, (Е) Формування ряду гачкоподібних структур S. mycoparasitica, (F) Паразитування S. mycoparasitica на міцелії F. graminearum з формуванням гачкоподібних структур, екскреція кристалоподібних сполук (стрілки) і внутрішніх гаусторіїв, (G) Ініціація формування проникаючого паростка S. mycoparasitica на F. graminearum, (Н) Заражені або розкриті і незаражені клітини міцелію, (I) Розростання гаусторію всередині хазяїна Fusarium, (J) Формування великих розгалужених структур F. graminearum хемотипу 15 тільки в зоні контакту з S. mycoparasitica. Масштабні мітки: (А)-(I) 5 мкм, і (J) 20 мкм; Фіг. 21 являє собою діаграму, на якій показані відмінності в діаметрах між зараженими і незараженими клітинами-хазяїнами F. graminearum хемотипу 3 (Fgra3) і 15 (Fgral5) в присутності Sphaerodes mycoparasitica в мікроскопічному дослідженні культур. Стовпчики, розмежовані різними малими буквами, являють собою значущу відмінність в розмірі заражених гіфів в порівнянні з незараженими гіфами для двох різних хемотипів F. graminearum при Р=0,05 з використанням Т-критерію; Фіг. 22 являє собою діаграми стандартних кривих Fusarium graminearum хемотипу 3 і 15 стандартів концентрації геномної ДНК в порівнянні з пороговим циклом (Ct), при виконанні реакцій ПЛР в трьох повторах з використанням наборів праймерів; (А) Tox5-1/2, з геномною ДНК в межах від 270 нг (Log10=2,90) до 0,27 нг (Log10=-0,60), зчитування при 0,005 лінії флуоресценції; (В) Tox5-1/2, з геномною ДНК в межах від 30 нг (Log10=1,48) до 0,03 нг (Log10= 3 UA 104050 C2 5 10 15 20 25 30 35 40 45 50 55 601,52), зчитування при 0,005 лінії флуоресценції; і (С) Fg16NF/R, з ДНК матрицею в межах від 270 нг (Log10=2,43) до 0,027 нг (Log10=-1,57); при 10-кратному розведенні, зчитані при 0,025 лінії флуоресценції. Планки погрішностей вказують стандартне відхилення середнього для стандартних кривих F. graminearum хемотипу 3 і 15, отриманих на основі гена tri5 і специфічних для F. graminearum набору праймерів; Фіг. 23 являє собою схематичне зображення експериментальної системи для аналізу на подвійній культурі, що використовується для отримання бляшок міцелію F. graminearum хемотипу 3-АДОН або 15-АДОН для виділення ДНК. Зона відбору зразків (S-зона) вказує 2 область зразка 0,5×1,5 см , розташовану приблизно на відстані 0,2 см від зони взаємодії (Iзона). I-зона являє собою зону взаємодії або контакту між F. graminearum (Fgra) і S. mycoparasitica (SM); Фіг. 24 являє собою діаграму, на якій показані криві флуоресценції в реальному часі послідовностей F. graminearum, ампліфікованих з використанням набору праймерів Fg16NF/R з сумарної ДНК, виділеної при аналізі на подвійній культурі штамів F. graminearum, і попередньо інокульованого Sphaerodes mycoparasitica (SM), або окремо вирощених культур F. graminearum хемотипу 3 і 15; Фіг. 25 являє собою діаграму, на якій показані порівняння між різними концентраціями ДНК з F. graminearum хемотипу 3 і 15, ампліфікованої з використанням наборів праймерів Tox5-1/2 (специфічного до гена tri5) і Fg16NF/R (специфічного до F. graminearum). Грибкову ДНК виділяли в 5-денному аналізі на подвійній культурі, з попередньою інокуляцією S. mycoparasitica за 1 день. З Т-критерієм при Р=0,05, для порівняння обробленого і S. mycoparasitica необробленого F. graminearum хемотипу 3 і 15 для наборів праймерів Tox5-1/2 і Fg16NF/R, відповідно (з Log10 перетворенням для ДНК, ампліфікованої з праймерами Tox5-1/2); Фіг. 26 являє собою мікофотознімки міцелію Fusarium graminearum в зоні контакту з біологічними і хімічними агентами: (А) Немає видимих змін клітин в присутності біотрофного мікопаразита Sphaerodes mycoparasitica; (В) Руйнування клітин в присутності некротрофного мікопаразиту Trichoderma harzianum; (С) Формування 3-АДОН хламідоспор в ланцюгах при обробці фунгіцидом; (D) формування 15-АДОН хламидоспор в кластерах при обробці фунгіцидом. Масштабні мітки вказують: (А)=5 мкм і (В)-(D)=10 мкм; Фіг. 27 являє собою діаграми, на яких показана експресія різних генів Tri для F. graminearum хемотипу 3 (продуцента 3-АДОН) і F. graminearum хемотипу 15 (продуцента 15-АДОН) в аналізі in vitro з трьома окремими обробками: (А) Ген Tri4; (В) Ген Tri5; (С) Ген Tri6; і (D) Ген Tri10. Умовні позначення: B3=S. mycoparasitica+F. graminearum, що продукує 3-АДОН; F3 = Фолікур® + F. graminearum, що продукує 3-АДОН; T3=T. harzianum+F. graminearum, що продукує 3-АДОН; B15=S. mycoparasitica+F. graminearum, що продукує 15-АДОН; F15 = Фолікур + F. graminearum, що продукує 15-АДОН; і T15=T. harzianum+F. graminearum, що продукує 15-АДОН. Середні для трьох різних обробок в F. graminearum хемотипу 3 і 15 аналізували окремо за допомогою LSDкритерію при Р=0,05. Значення є середніми ± станд. помилка для трьох зразків; Фіг. 28 являє собою діаграми, на яких показана експресія генів PKS для F. graminearum хемотипу 3 (продуцента 3-АДОН) і F. graminearum хемотипу 15 (продуцента 15-АДОН) в аналізі in vitro з трьома окремими обробками: (А) PKS4 і (В) PKS13. Умовні позначення: B3=S. mycoparasitica+F. graminearum, що продукує 3-АДОН; F3 = Фолікур + F. graminearum, що продукує 3-АДОН; T3=T. harzianum+F. graminearum, що продукує 3-АДОН; B15=S. mycoparasitica+F. graminearum, що продукує 15-АДОН; F15 = Фолікур + F. graminearum, що продукує 15-АДОН; і T15=T. harzianum+F. graminearum, що продукує 15-АДОН. Середні для трьох різних обробок в F. graminearum хемотипу 3 і 15 аналізували окремо за допомогою LSDкритерію при Р=0,05. Значення є середніми ± станд. помилка для трьох зразків; Фіг. 29 являє собою мікофотознімок аналізу методом тонкошарової хроматографії (ТСХ) для зеараленону (ZEA), екстрагованого з шести окремих обробок. Умовні позначення: B3=S. mycoparasitica+F. graminearum, що продукує 3-АДОН; F3 = Фолікур + F. graminearum, що продукує 3-АДОН; T3=T. harzianum+F. graminearum, що продукує 3-АДОН; F15 = Фолікур + F. graminearum, що продукує 15-АДОН; T15=T. harzianum+F. graminearum, що продукує 15-АДОН, B15=S. mycoparasitica+F. graminearum, що продукує 15-АДОН і ZEA = Стандарт зеараленону; Фіг. 30 являє собою діаграму, на якій показане відношення хемотипу F. graminearum, обробленого фунгіцидом Фолікур, до контролю, що містить тільки F. graminearum, отримане для всіх чотирьох різних мікотоксинів - ZEA, ДОН, 3-АДОН і 15-АДОН. Умовні позначення вказують F. graminearum хемотипу 3-АДОН з Фолікуром ( ) і F. graminearum хемотипу 15-АДОН з Фолікуром (□); Фіг. 31 являє собою діаграму, на якій показана відносна експресія гена AUR в штамах Fusarium після спільного культивування з біологічними і хімічними агентами. Умовні позначення: 4 UA 104050 C2 5 10 15 20 25 30 35 40 45 50 55 60 15ADON - хемотип F. graminearum 15-ацетил-дезоксиніваленол; 3ADON - хемотип F. graminearum 3-ацетил-дезоксиніваленол; F.cul. - F. culmorum; F.ave. - F. avenaceum; У Sphaerodes mycoparasitica (біотрофний мікопаразит); Tricho-Trichoderma harzianum (некротрофний мікопаразит); Fol - фунгіцид Фолікур (тебуконазол); Фіг. 32 являє собою діаграму, на якій показані зміни експресії гена AUR, що підтверджується кольором гіф гриба. Умовні позначення: Ds #71232В: Червоний і високотоксичний, стійкий при 80 °C протягом 4 годин; Es #4E040B: Помірно червоний і помірно токсичний, стійкий при 40 °C протягом 4 годин; Bs #A86608: Білий і нетоксичний, чутливий до 40 °C протягом 4 годин; Фіг. 33 являє собою діаграми, на яких показані ефекти інокуляції сприйнятливого до фузаріуму сорту ячменю F. graminearum, S. mycoparasitica, і обробки зараженого F. graminearum ячменю різними концентраціями S. mycoparasitica відносно: (А) висоти рослин; (В) середньої кількості колосів на рослині; і (С) середньої ваги 5 колосів; Фіг. 34 являє собою діаграми, на яких показані ефекти інокуляції сприйнятливого до фузаріуму сорту пшениці F. graminearum, S. mycoparasitica, і обробки зараженої F. graminearum пшениці різними концентраціями S. mycoparasitica відносно: (А) висоти рослин; (В) середньої кількості колосів на рослині; і (С) середньої ваги 5 колосів; Фіг. 35 являє собою діаграму, на якій порівнюються результати біологічного регулювання в присутності S. mycoparasitica відносно тяжкості симптомів фузаріозної гнилі із захистом, що забезпечується комерційним фунгіцидом; Фіг. 36 являє собою діаграми, на яких показані стандартні криві стандартів концентрації геномної ДНК Fusarium graminearum хемотипу 3 в порівнянні з пороговим циклом (Ct) в реакціях ПЛР, що проводяться в трьох повторах з використанням наступних наборів праймерів: (А) Tox51/2, з геномної ДНК в межах від 270 нг (Log10=2,90) до 0,27 нг (Log10=-0,60), зчитування при 0,005 лінії флуоресценції; і (В) Fg16NF/R, з матрицею ДНК в межах від 270 нг (Log 10=2,43) до 0,027 нг (Log10=-1,57); при 10-кратному розведенні, зчитування при 0,025 лінії флуоресценції; Фіг. 37 являє собою діаграму, на якій показані результати обробки S. mycoparasitica (В) і фунгіцидом Фолікур (Fol) відносно геномної ДНК F. graminearum хемотипу 3-АДОН, що виявляється в колосах ячменю з використанням ПЛР-РВ. Обробки були наступними: Fus-F. graminearum; B-Fus-S. mycoparasitica з F. graminearum; Fol-Fus - фунгіцид Фолікур з F. graminearum; Фіг. 38 являє собою мікофотознімки, на яких показані аналізи мікопаразитизму Sphaerodes mycoparasitica-Fusarium spp.: (A-a). Гачкоподібні контактні структури (стрілки); (B-b). Хомутоподібні захоплюючі клітини (стрілки), "a" і "b" є схематичними зображеннями для (А) і (В), відповідно. Масштабні мітки = 5 мкм; Фіг. 39 являє собою мікофотознімки, на яких показаний внутрішньоклітинний паразитизм, реакція інгібування росту гіф і анаморфні стадії в процесі взаємодій Sphaerodes mycoparasiticaFusarium spp.: (А) Внутрішньоклітинний паразитизм S. mycoparasitica в F. equiseti (стрілка); (В) Реакція інгібування росту гіф Fusarium при зараженні S. mycoparasitica; деформація гіф з формуванням розеткоподібних структур (стрілка); (С) Анаморфні стадії гіаліну S. mycoparasitica; (D) Анаморфні стадії Sphaerodes mycoparasitica з адсорбцією червоних пігментів з F. culmorum. Масштабні мітки А, С, D=5 мкм; У=20 мкм; Фіг. 40A і 40B являють собою мікофотознімки внутрішньоклітинного паразитизму Sphaerodes в F. equiseti (стрілки), а 40C і 40D - мікофотознімки внутрішньоклітинних гіф Sphaerodes в клітинах F. equiseti з гачкоподібною контактною структурою (стрілки). Зображення 40A і 40B отримували за допомогою оптичної мікроскопії; тоді як в 40C і 40D гіфи забарвлювали лактофуксином і отримували зображення за допомогою флуоресцентної і конфокальної лазерної мікроскопії, відповідно. Масштабні мітки = 5 мкм; і Фіг. 41 являє собою діаграму, на якій показані середні діаметри гіф заражених і незаражених біотрофним мікопаразитом Sphaerodes mycoparasitica клітин F. equiseti ( ) і F. culmorum (□) в 1тижневих культурах. Дані є середніми зі стандартними відхиленнями. Такі ж малі букви означають відсутність значущої відмінності між зараженими і незараженими паразитом гіфами при Р=0,05, Т-критерій. Докладний опис винаходу Sphaerodes mycoparasitica (Аскоміцети, Меланоспорові) був виділений з ізолятів Fusarium avenaceum, Fusarium graminearum і Fusarium oxysporum, отриманих з полів пшениці або спаржі. Даний вигляд характеризується унікальною комбінацією розміру, форми (веретеноподібна і трикутна) і візерунку на поверхні стінки (сітчастий візерунок і гладка поверхня) аскоспор. Крім того, конідії утворюються від простих фіалід на поверхні перидіальної стінки аскоми, на аскомі, що оточує гіфи, і на нерегулярно розгалужених конідіофорах, що утворюються з гіфів. S. mycoparasitica має фіалідний анаморф і утворює прості фіаліди на поверхні перидіальної стінки 5 UA 104050 C2 5 10 аскоми або нерегулярно розповсюджується на аскому, що оточує гіфи, і на конідіофори. S. mycoparasitica формує гачкоподібні структури, що паразитують на живих гіфах фузаріумів. Послідовність ДНК 1266 п. н. гена великої субодиниці рибосомної РНК (LSU) S. mycoparasitica приведена в SEQ ID NO:1. SEQ ID NO:1 Послідовність ДНК 1233 п. н. гена малої субодиниці рибосомної РНК (SSU) S. mycoparasitica приведена в SEQ ID NO:2. SEQ ID NO:2 6 UA 104050 C2 5 10 15 20 Зразки культур Sphaerodes mycoparasitica були депоновані в колекції мікроорганізмів і базі даних Саскачевана під реєстраційним номером SMCD2220-01, а також в Міжнародному депозитарії Канадської колекції мікроорганізмів (1015 Arlington Street, Winnipeg, Canada, R3E 3R2) під реєстраційним номером IDAC301008-01. Sphaerodes mycoparasitica може застосовуватися як протигрибковий засіб. S. mycoparasitica може застосовуватися для лікування, зменшення інтенсивності або іншої боротьби з інфекціями, що викликаються грибами Fusarium. Зокрема, S. mycoparasitica може застосовуватися для лікування, зменшення інтенсивності або іншої боротьби з інфекціями, що викликаються Fusarium avenaceum, Fusarium graminearum і/або Fusarium oxysporum, а також для поліпшення стану або росту рослини. S. mycoparasitica може застосовуватися як профілактичний засіб для зменшення імовірності розвитку грибкової інфекції, особливо інфекції, що викликається Fusarium. S. mycoparasitica може застосовуватися для лікування рослин, уражених фузаріозним в'яненням або фузаріозною гниллю. S. mycoparasitica може застосовуватися для запобігання поширенню таких захворювань або як профілактична міра, для зменшення ризику розвитку таких захворювань. У даному винаході S. mycoparasitica може бути виділений з прийнятних джерел. Наприклад, S. mycoparasitica може бути виділений ізолятів F. graminearum або F. avenaceum, отриманих з полів пшениці, способом, описаним в Vujanovic V, et. al., Can. J. Microbiol. 48(9):841-847 (2002). S. mycoparasitica також доступний з Міжнародного депозитарію Канади (IDAC301008-01). S. mycoparasitica може застосовуватися для лікування, зменшення інтенсивності або іншої боротьби з інфекціями, що викликаються грибами Fusarium. S. mycoparasitica може 7 UA 104050 C2 5 10 15 20 25 30 35 40 застосовуватися будь-яким прийнятним способом відносно організму, що має потребу в подібній обробці. Наприклад, ізоляти S. mycoparasitica можуть застосовуватися безпосередньо, або вони можуть бути додатково перероблені в гранульовані, брикетовані, що вносяться в ґрунт або наносяться на насіння або рослини в періоді цвітіння інокулянти на основі рідини. S. mycoparasitica може бути отриманий за допомогою ферментації і введений в пестицидну композицію. Прийнятний спосіб ферментації включає підбір середовища культивування (твердофазного або рідкого), концентрації компонентів середовища, параметрів подачі кисню, температури інкубування, часу збирання і обробки після збирання. Мета полягає в підборі оптимальних умов, які гарантують отримання багатої, стабільної і ефективної популяції мікопаразитичного мікроорганізму. При включенні S. mycoparasitica в пестицидну композицію потрібно приділяти увагу компонентам, що підбираються, які: (i) забезпечують стабільність в процесі виробництва, обробки і зберігання, (ii) сприяють нанесенню, (iii) захищають пестицид від несприятливих умов зовнішнього середовища і (iv) посилюють пестицидну активність в мішені. Контакт з інактивованим організмом-хазяїном/патогеном або його продуктами може підвищувати активність S. mycoparasitica. Композиції, розкриті в даній заявці, звичайно включають: (i) активний компонент, (ii) носій, як правило, інертний матеріал, що використовується як основа і для доставки концентрованого активного компонента до мішені, і, необов'язково, (iii) ад'юванти - сполуки, які посилюють і сприяють функції активного компонента шляхом захисту від УФ-випромінювання, які забезпечують дощостійкість на мішені і підтримують вологість або захищають від висихання, або сприяють поширенню і розподілу біопестициду з використанням стандартного сільськогосподарського обладнання, такого, як описано в Hynes and Boyetchko (2006, Soil Biology & Biochemistry 38:845-84). Секвенували внутрішню транскрибовану спейсерну (ITS) рибосомну ДНК S. mycoparasitica. Послідовність ДНК 560 п. н. області ITS приведена в SEQ ID NO:3. SEQ ID NO:3 Даний винахід надає набір праймерів SmyITSF/R (SmyITSF приведений в SEQ ID NO:4, а SmyITSR - в SEQ ID NO:5), які можуть застосовуватися для ідентифікації S. mycoparasitica: SEQ ID NO:4 5'- TCATGGCTCTGCCAACCCTGTAA-3' SEQ ID NO:5 5'- AATGCAGGGCACAGAGGACATCG-3' Даний праймер селективний відносно S. mycoparasitica і може застосовуватися для оцінки і кількісного аналізу грибка в промислових продуктах, рослинних матеріалах, зразках насіння і пробах навколишнього середовища при використанні технологій ПЛР і ПЛР-РВ. Набір праймерів SmyITSF/R може застосовуватися в методі кількісної ПЛР в реальному часі для аналізу експресії генів, при виявленні грибкових патогенів і при кількісному аналізі грибків на живих рослинах. Набір праймерів SmyITSF/R тестували з SMCD2220-01, сімома разів видами Fusarium, дев'ятьма різними ізолятами аскоміцетів, двома зигоміцетами і трьома штамами базидіоміцетів. При ПЛР даний набір праймерів забезпечував ампліфікацію тільки у випадку SMCD2220-01, але не інших грибів. Біомаса коріння, повна біомаса, довжина коріння, повна довжина і 8 UA 104050 C2 5 10 15 20 25 30 35 40 45 50 55 проростання насіння зараженої F. graminearum ярової пшениці значно підвищувалися при обробці S. mycoparasitica в порівнянні з інокуляцією F. graminearum. У подальших дослідженнях ПЛР-РВ специфічний праймер SmyITSF/R використовували для S. mycoparasitica в комбінації з F. graminearum-Fg12NF/R і Trichoderma-TGP4-F/R як контроль, в межах яких праймер показав високу точність при оцінці взаємодій біорегулювання-патоген-рослина. Екстракти сумарних позаклітинних білків з Sphaerodes mycoparasitica демонстрували істотне інгібування проростання спор фузаріумів. Даний винахід надає протигрибковий засіб, що включає екстракти позаклітинних білків з S. mycoparasitica. З сумарного білкового екстракту виділяли два білки, один, який має молекулярну масу 13 кДа і інший, який має молекулярну масу 50 кДа. Даний винахід надає протигрибковий засіб, що включає один або обидва вказаних білка. Стандартні методи молекулярної біології можуть використовуватися для виділення, аналізу і отримання даних білків. Наприклад, для ідентифікації гена (генів) справжніх білків S. mycoparasitica можна обробляти фільтратами F. oxysporum і виділяти апрегульовану мРНК за допомогою стандартного Нозерн-блоттингу. кДНК може бути отримана з мРНК за допомогою ПЛР із зворотною транскриптазою (ЗТ-ПЛР). кДНК може бути ампліфікована, очищена і вбудована у прийнятний вектор. Вказаний вектор може бути введений у прийнятну клітинухазяїна. Клонування і експресія можуть бути зосереджені на виділенні гена, що кодує антибактеріальні білки, шляхом підбору праймерів для ідентифікованих білків. Виділені гени можуть бути клоновані у прийнятні вектори експресії (дріжджові або бактеріальні) з прийнятними/ефективними промоторами з метою отримання промислових штамів для крупномасштабного виробництва білків, що розглядаються. Вказані вектори можуть бути придбані в Promega, Invitrogen, Clontech або інших компаніях. Клонування гени можуть бути протестовані на експресію білка, в свою чергу, експресовані білки очищають (з використанням His-tag або інших колонок). Очищені білки можуть бути протестовані проти грибів, патогенних для рослин, на предмет їх протигрибкової активності за допомогою аналізу на чашках і/або методів аналізу в мікотитрувальних планшетах (наприклад, Drummond and Waigh, 2000, Recent Research Developments in Phytochemistry, 4:143-152). Потім генно-інженерні методи, що включають мутацію гена або введення енхансерів, інтронів або білків-специфічних промоторів (що індукуються GA), або введення делеції можуть використовуватися для збільшення продукції білків. Відібрані гени можуть бути трансформовані в пшеницю і ячмінь з отриманням трансгенних ліній, що мають протигрибкову активність проти патогенних грибів, з використанням методів, відомих кваліфікованим фахівцям в даній галузі (наприклад, Sanghyun et al., 200,8 J. Expt. Botany, 59, 2371-2378; Dennis et al., 2007, Plant Cell Reports, 26:631-639). S. mycoparasitica продемонструвала здатність розщеплювати мікотоксин дезоксиніваленол (ДОН). Даний винахід надає спосіб розщеплення ацетилдезоксиніваленолу, особливо 3ацетилдезоксиніваленолу. S. mycoparasitica можна стимулювати чистим ДОН і виділяти мРНК з підвищеною регуляцією за допомогою стандартного Нозерн-блоттингу. ПЛР із зворотною транскриптазою може використовуватися для ідентифікації гена (генів) з підвищеною регуляцією білків, потім відповідна кДНК конструкція може бути вбудована у прийнятнний вектор для отримання білка. Крім того, генно-інженерні методи ДНК можуть застосовуватися для створення трансгенних рослин з антимікотоксичними властивостями. Даний винахід надає протигрибкові композиції, що включають S. mycoparasitica, а також відповідні ізоляти, культури або білки. Даний винахід також надає спосіб боротьби з грибковим захворюванням рослини і спосіб детоксифікації мікотоксину, які включають нанесення на ділянку рослини S. mycoparasitica, відповідних ізолятів, культур або білків, що в сукупності називаються надалі "протигрибковий засіб". Композиції винаходу можуть, наприклад, бути нанесені на насіння рослин, на середовище проростання (наприклад, ґрунт або воду) або на листя рослин. Даний винахід надає композицію, що включає протигрибковий засіб і носій, що відповідає вимогам сільського господарства, або розріджувач, який буде гарантувати стабільність і ефективність кінцевого продукту. Носій або розріджувач повинні бути сумісні з активним компонентом, відповідати вимогам сільського господарства, мати хорошу абсорбційну здатність і прийнятну об'ємну густину, що дозволяє легку диспергування частинок і нанесення. Композиції в даній заявці можуть бути нанесені у вигляді водних спреїв, гранул і порошкових складів відповідно до практики, що устоялася, відомої в рівні техніки. Водні спреї звичайно 9 UA 104050 C2 5 10 15 20 25 30 35 40 45 50 55 60 приготовляють, змішуючи змочуваний порошок або емульгований концентрований склад сполуки винаходу з відносно великою кількістю води, отримуючи дисперсію. Змочувані порошки можуть включати точно дозовану суміш протигрибкового засобу, твердого носія і поверхнево-активної речовини. Твердий носій звичайно вибирають з атапульгітових глин, каолінових глин, монтморилонітових глин, кізельгуру, тонкодисперсного діоксиду кремнію, очищених силікатів або комбінацій перерахованого. Поверхнево-активні речовини, які можуть застосовуватися в даному винаході, мають здатність до змочування, просочення і/або диспергування. Вони звичайно присутні в кількості приблизно від 0,5 % до приблизно 10 % по вазі. Поверхнево-активні речовини в даній заявці можуть бути вибрані, наприклад, з алкілбензолсульфонатів, алкілсульфатів, нафталінсульфонатів і конденсованих нафталінсульфонатів, сульфованих лігнінів, а також неіонних поверхнево-активних речовин. Емульговані концентрати можуть включати протигрибковий засіб винаходу в рідкому носії, який є сумішшю розчинника, який не змішується з водою, і поверхнево-активної речовини. Розчинники, які можуть застосовуватися в даному винаході, включають розчинники на основі ароматичних вуглеводнів, таких як ксилоли, алкілнафталіни, продукти перегонки нафти, терпенові розчинники, ефіроспирти, органічні складноефірні розчинники або прийнятні комбінації перерахованого. У тому випадку, якщо композиція винаходу повинна бути нанесена на рослинні залишки або обпале листя для регуляції джерела контамінації і дисперсії інокулянту, або на ґрунт, як захист перед появою сходів, гранульовані склади або дусти іноді більш зручні, ніж спреї. У одному варіанті здійснення протигрибкові засоби в даній заявці інкапсульовані в альгінатні гранули. Гранули можуть бути виготовлені будь-яким прийнятним способом. Наприклад, один корисний спосіб описаний в Harveson, et al. (2002, Plant Disease; Vol.86, № 9, 1025-1030). Композиція може включати інші активні речовини, корисні в протигрибковому засобі. Наприклад, дані композиції можуть включати інші протигрибкові засоби, такі як Trichoderma, сірку, олію маргози, олію розмарину, олію жожоба, Bacillus subtilis, аліламіни (наприклад, тербинафін), антиметаболіти (наприклад, флуцитозин), азоли (наприклад, кетоконазол, ітраконазол), ехінокандини (наприклад, каспофунгін), поліени (наприклад, амфотеріцин В), системні засоби (наприклад, гризеофульвін) або комбінації перерахованого. Композиції в даній заявці можуть містити приблизно від 0,1 % до приблизно 95 % по вазі протигрибкового засобу і приблизно від 0,1 % до приблизно 95 % по вазі носія і/або поверхневоактивної речовини. Пряме нанесення на насіння рослини до саджання може бути досягнуте в деяких випадках при змішуванні твердої порошкової композиції винаходу або порошкового складу з насінням, з отриманням по суті гомогенного покриття, яке є дуже тонким, і складає тільки один або два проценти по вазі або менше, з розрахунку на вагу насіння. Однак в деяких випадках як носій переважно використовується нетоксичний для рослин розчинник, такий як метанол, що сприяє однорідному розподілу композиції винаходу на поверхні насіння. Композиції в даній заявці можуть застосовуватися при лікуванні грибкових захворювань рослин. Таким чином, дані композиції можуть включати S. mycoparasitica, прийнятні ізоляти, культури або білки, а також фармацевтично прийнятний носій. S. mycoparasitica утворюють спори в присутності Fusarium. Аськоспори S. mycoparasitica виявилися стійкі до проростання в різних стандартних лабораторних умовах (стерильна дистильована вода, на водному агарі і комерційних середовищах) і в умовах теплового або холодового шоку. Навпаки, проростання спор було отримане на стандартному картопляному агарі з декстрозою, що містить фільтрати Fusarium. Істотне підвищення процента пророслих спор отримували для спор, суспендованих в фільтратах Fusarium. Фільтрати F. avenaceum і F. oxysporum спричиняли найвище проростання, тоді як F. sporotrichioides і F. proliferatum спричиняли проростання з нижчою частотою. Фільтрати перспективних грибкових інокулятів: Trichoderma harzianum (RootShield, виробництва BioWorks Inc., Victor, NY, USA; RootShield є зареєстрованою торговою мазкою BioWorks Inc), Penicillium bilaii (JumpStart, виробництва Novozymes Biologicals Ltd., Saskatoon, SK, CA; JumpStart є зареєстрованою торговою мазкою Philom Bios Inc.) і Chaetomium globosum не надали ніякого впливу на проростання. Аскоспори, суспендовані в фільтраті F. avenaceum, демонстрували біполярний характер проростання. З іншого боку, при суспендуванні в фільтраті F. oxysporum, істотна кількість спор демонструвала монополярний характер проростання. S. mycoparasitica, вирощений на F. oxysporum, зберігав такий же мікопаразитичний характер проростання в трьох поколіннях потомства при перенесенні на F. avenaceum, що вказує на стабільну, регульовану на геномному рівні експресію. Даний винахід надає спосіб отримання спор S. mycoparasitica за допомогою контакту з F. avenaceum або F. oxysporum, або їх фільтратами, екстрактами або композиціями. 10 UA 104050 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід надає спосіб отримання протигрибкової композиції, що включає S. mycoparasitica або відповідні ізоляти, культури, гени або білки. Спосіб включає: (a) стимуляцію спороутворення S. mycoparasitica; (b) культивування S. mycoparasitica; (с) збирання S. mycoparasitica. Спосіб може додатково включати будь-який з наступних додаткових етапів: (d) зберігання/зберігання S. mycoparasitica; (е) застосування S. mycoparasitica; (f) оцінку S. mycoparasitica; (g) продукування білків S. mycoparasitica; (h) збирання білків S. mycoparasitica; (i) фракціонування білків S. mycoparasitica; (j) розділення білків S. mycoparasitica; (k) зберігання/зберігання білків S. mycoparasitica; (l) застосування білків S. mycoparasitica; (m) оцінку білків S. mycoparasitica. ПРИКЛАДИ Приклад 1 Відбір зразків, вирощування гриба і мікроскопія Міклобутаніл-агарове (MBA) середовище використовували для селективного виділення різних таксонів Fusarium і асоційованих біотрофних мікопаразитів з сільськогосподарських полів Канади, застосовуючи спосіб, описаний в Vujanovic V, et al. (2002, Can. J. Microbiol. 48(9):841847). Sphaerodes в деяких випадках виділяли з ізолятів F. graminearum і часто з ізолятів F. avenaceum, що походять з полів пшениці в Саскачевані; також його виділяли з Fusarium oxysporum з полів спаржі в Квебеці, Канада. Моноспорову, чисту культуру мікопаразита отримували з кожного виду Fusarium згідно зі способом, запропонованим Харвесоном і Кімброу (Harveson & Kimbrough, 2001, Int. J. Plant Sci. 162(2):403-410). Чисті ізоляти аскоспор підтримували на картопляному агарі з декстрозою (PDA) (Difco, BD Biosciences, Mississauga, -1 ON, CA) і з додаванням антибіотиків (100 мкг 1-1 стрептоміцину сульфату і 13 мкг 1 неоміцину сульфати; Sigma-Aldrich Canada Ltd., Oakville, ON, CA) і зберігали при -80 °C в Колекції мікроорганізмів і базі даних Саскачевана (SMCD2220-01) і в Міжнародному Депозитарії Канади (IDAC301008-01). Ріст грибів оцінювали на модифікованому агарі Леоніана (MLA) і картопляному агарі з декстрозою (PDA). Біотрофні взаємодії між штамами Sphaerodes і Fusarium досліджували за допомогою методу культур на предметному склі, запропонованим Джорданом і Барнеттом (Jordan & Barnett, 1978, Mycologia 70(2):300-312). Морфологічні дослідження аском, аскоспор, міцелію і анаморфних структур проводили після закінчення двох тижнів інкубування (21 °C-22 °C) під мікроскопом Carl Zeiss Axioskop2 з камерою Carl Zeiss AxioCam ICcl. Грибкові матеріали для мікроскопічного дослідження фіксували в барвниках лактофуксині і лактофенолі бавовняному синьому. Виділення, ампліфікація і секвенування ДНК Три штами Sphaerodes: SMCD 2220-01 на F. avenaceum з пшениці, SMCD 2220-02 на F. graminearum з пшениці і SMCD 2220-03 на F. oxysporum зі спаржі культивували на середовищі PDA при 21C протягом тижня перед виділенням ДНК. Геномну ДНК екстрагували з використанням міні набору DNeasy Plant (Qiagen Inc., Mississauga, ON, CA; DNEasy є зареєстрованою торговою мазкою Qiagen GmbH Corp, Hilden, Fed. Rep. Germany). Фрагменти LSU (велика субодиниця) рДНК ампліфікували, використовуючи набори праймерів NS1/NS6, з використанням методів, відомих кваліфікованим фахівцям (наприклад, Gardes & Bruns, 1993, Molecular Ecology 2:113-118; White et ah 1990, PCR Protocols: а guide to methods and application: 315-322. Academic Press, New York) і LS1/LR5 (наприклад, Hausner et al., 1993, Canadian Journal of Botany 71:52-63; Rehner & Samuels, 1995, Canadian Journal of Botany 73 (Suppl. 1): S816-S823; Zhang & Blackwell, 2002, Mycological Research 106:148-155). Цільові області зразків грибкової геномної ДНК ампліфікували, використовуючи полімеразну ланцюгову реакцію (ПЛР) в реакційних сумішах об'ємом 25 мкл, що містять 2,5 мкл 10Х буфера, 5 мкл буфера Q, 0,5 мкл 10 мМ dNTPs, 1 мкл кожного праймера, 0,13 мкл 0,625 одиниці Taq ДНК-полімерази, 2 мкл виділеної грибкової ДНК і 12,87 мкл стерилізованої ультраочищеної води Millipore. Набори для ПЛР Qiagen Taq були придбані у Qiagen Inc, Mississauga, ОN, CA. Очищені ДНК ПЛР-продукти секвенували. Вирівнювання і філогенетичний аналіз послідовностей Послідовності LSU з даного дослідження і послідовності, знайдені в GenBank, вирівнювали, використовуючи програму Clustal X (версія 1.82) (Thompson et al. 1997, Nucleic Acids Research 11 UA 104050 C2 5 10 15 20 25 30 35 40 45 50 55 60 24:4876-4882), і редагували в Bioedit (Hall, 1999, Nucleic Acids Symposium Series 41:95-98). Дерева відстаней будували з використанням програми PAUP (філогенетичний аналіз з використанням економії) 4.0b10 (Swofford 2000) з методом об'єднання сусідніх пар і перевіряли з використанням бутстреп-аналізів з 1000 повторів. Дерево відстані для грибків будували з послідовностями, що показали бутстреп-значення вище ніж 50 %. Дерева вкоріняли з послідовностями Xylaria hypoxylon U47841. Таксономія: Sphaerodes mycoparasitica Vujanovic, sp. nov. (фіг. 1-5) [MycoBank: MB 515144] в Міжнародному Депозитарії Канади як штам Sphaerodes mycoparasitica IDAC 301008-01. Колонії на картопляно-декстрозному агарі: lentior crescents, 4,0 см ad 7d, floccose, pallidobrunneis. Hyphis septatis, ramosis, anastomosantibus, laevibus, palide fulvis, 2,5-5,0 мкм diam compositum. Ascomata superficialia vel immersa, pyriformia vel globosa, ostiolata, flavo-brunnea, 250-300 мкм longa, 200-280 мкм diam. Collum nul, conicum vel cylindricum, 30-75 мкм longum, (0-) 50-70 мкм latum ad basim. Peridium membranaceum, cellulis 8-15 мкм, е 3-6 stratis, 8-15 мкм crassum, textura angulari compositum. Setae rectae vel parum curvae, hyalinae vel dilute flavae, crassitunicatae, 10-40 мкм longae, septatae. Asci 8-spori, ovoidei vel clavati, 50-75 × 17-25 мкм, superne late rotundati, brevistipitati, tenuitunicati, evanescentes. Paraphysis nullis. Ascosporae unicellulares, irregulariter biseriatae, primum hyalinae, deinde brunneae vel atrobrunneae, crassitunicatae, fusiformes, 18-24 × 9-12 мкм, reticulatae, costis protrudentibus, е polo visae polygonales, utrinque umbonatae, foramine germinali praeditae. Phialidis hyalinis, status conidialis. Характеристики культури: Колонії штаму Sphaerodes mycoparasitica, IDAC 301008-01, що культивуються на MLA, росли швидше, ніж на PDA, 1,1 см і 0,6 см в день, відповідно (21-22 °C), і складалися з дещо зануреного міцелію і повітряна гіф, зерниста внаслідок утворення великої кількості аском. На MLA (фіг. 1A і 1C) і PDA (фіг. 1B і 1D) культури утворювали ворсистий міцелій, від жовтуватого до рожевувато-коричнюватого з обох сторін. При 37 °C ріст не реєстрували. Колір гіф варіював від білого до блідо-жовтого, діаметр 2,5-5,0 мкм, з перегородками, анастомоз спостерігався незабаром після проростання аскоспор (фіг. 2). Колонії на картопляному агарі з декстрозою (PDA) розросталися рясним, повітряним міцелієм від білого до блідо-жовтого кольору з невеликою кількістю аском. Аскоми, в перитеції або клейстотеції, окремі або агреговані в невеликі групи, поверхневі, грушовидні або шароподібні, з остіолами (в зрілому стані), від світло до темно-жовтувато-коричневого кольору, прозорі, що здаються чорними через масу зрілих аскоспор, висотою 250-300 мкм, діаметром 200-280 мкм. Шийка відсутня або коротка, конічної або циліндричної форми, довжиною 25-75 мкм, шириною 20-70 мкм в основі, іноді оточена вінцем коротких, вертикальних спорофорів довжиною 10-40 мкм. Перидій перетинковий, 3-6-шаровий, товщиною 8-10 мкм, прозорий, від свотло-жовтого до світло-коричневого кольору, сформований з клітин діаметром 8-15 мкм, розташованого в textura angularis. Сумки 8-спорові, булавоподібні, 50-75 × 17-25 мкм, округлі на вершині, без апікальних структур, тонкостенні і недовговічні після дозрівання. Стерильна гіфа відсутня. Аскоспори нерегулярно розташовані в сумках, в першому гіаліні, але набувають кольору від коричневого до темно-коричневого, товстостінні, одноклітинні, веретеноподібні або в рідких випадках трикутні, 18-24 × 9-12 мкм, сітчасті або іноді гладкі, з нерегулярними поперечними секціями і зі суворо умбонатною зародковою порою на кожному кінці. Фіаліди гіалінові, колбоподібні, утворені безпосередньо на аскомах або на гіфах, що оточують аскоми, і на нерегулярно розгалужених конідіофорах. Штам S. mycoparasitica IDAC 301008-01 має унікальну комбінацію властивостей, показаних на фіг. 3. Висота аском звичайно менша 250 мкм з конічною або циліндричною шийкою (фіг. 3A). Довжина спорофор звичайно менше 40 мкм (фіг. 3B), а довжина спори, як правило, менша 23 мкм (фіг. 3C). Спори демонструють помітну ребристість і помітні нерегулярні подовжні ребра, позначені стрілками на фіг. 4A. Спори Sphaerodes quadrangularis показані на фіг. 4B для порівняння. Спори штаму S. mycoparasitica IDAC 301008-01 іноді мають трикутну форму (фіг. 3D і 3E). Утворення вихідної і зрілої аскоми штаму S. mycoparasitica IDAC 301008-01 показане на фіг. 3H. Даний штам утворює прості фіаліди на поверхні перидіальних стінок аскоми або, альтернативно, фіаліди можуть бути нерегулярно розподілені на аскомі, що оточує гіфи, і на конідіоспорах з характерним гіллястим візерунком (фіг. 3F і 3G). Штам S. mycoparasitica IDAC 301008-01 формує гачкоподібні структури для паразитування на живих гіфах фузаріумів (фіг. 3I і 3J). Приклад 2 Ізоляти Sphaerodes mycoparasitica (SMCD 2220-01) при 21 °C культивували в картоплянодекстрозному середовищі (PDB). Приблизно 3 мл культури переносили в колби Ерленмеєра об'ємом 250 мл, що містять 50 мл середовища PDB. Колби інкубували протягом 7 днів на ротаційному шейкері (150 об/хв) при кімнатній температурі. 12 UA 104050 C2 5 10 15 20 25 30 35 40 45 50 55 60 Виділення позаклітинного білка: Молодий міцелій фільтрували через фільтрувальний папір Whatman № 1 (Whatman є зареєстрованою торговою мазкою Whatman International Ltd., Kent, UK). Фільтроване середовище культивування, що містить позаклітинні білки, концентрували з використанням ультрафільтраційних центрифужних пробірок Amicon з мембраною, що відсікає білки масою 3000 Дальтон, проводячи центрифугування при 4000 об/хв і 4 °C. Аналіз дифузії в диски: Протигрибкову активність екстрактів позаклітинних білків тестували в стерильних умовах в аналізі радіальної дифузії на дисках в чашках, як описано Робертсом і Силетренникофф (Roberts & Selitrennikoff, 1986, Biochim. Biophys. Acta, 880:161-170). Аналіз виділеного білка на протигрибкову активність відносно F. oxysporum і F. graminearum проводили в чашках Петрі, що містять картопляний агар з декстрозою. Бляшки міцелію з чашок з активно зростаючим грибом поміщали в центр чашок Петрі, і на поверхню агару поміщали стерильні диски фільтрувального паперу (діаметром 5 мм з фільтрувального паперу Whatman номер 1) на відстані 0,5 см від краю колонії міцелію. На диск наносили аліквоту (60 мкл), що містить 2,5 мкг позаклітинного білка. Стерильна дистильована вода і буфер служили як контроль. Потім чашки інкубували при кімнатній температурі протягом 4 днів, і оцінювали на інгібування. Вимірювали площу колонії міцелію, і визначали інгібування росту грибків, обчислюючи % зменшення площі колонії міцелію в порівнянні з контролем (фіг. 5A). Після 4-ого дня проростання спостерігали приблизно 30 %-е інгібування росту гіф F. oxysporum і 35 %-е інгібування росту гіф F. graminearum (фіг. 5B). Швидка рідинна хроматографія білків (FPLC) позаклітинних білків: Білки фракціонували через колонку з Superdex 75 GL 10/30, використовуючи систему очищення FPLC AKTA (GE Healthcare, Biosciences AB, CA: AKTA є зареєстрованою торговою мазкою GE Healthcare BioSciences AB Ltd., Uppsala, Sweden) згідно з інструкціями виробника. Колонку попередньо врівноважували стерильною водою і 50 мМ натрій фосфатним буфером, pH 7,0, що містить 0,15 М NaCl, з подальшим введенням білка (приблизно 500 мкл) і елююванням білків тим же буфером при витраті 1,0 мл/хв. Фракції об'ємом 0,8 мл збирали в окремі пробірки. При гельфільтрації на Superdex 75 (Superdex є зареєстрованою торговою маркою GE Healthcare BioSciences AB Ltd., Uppsala, Sweden) білки розділяли на два окремих піки (f1 і f2) і декілька піків меншої інтенсивності (див. фіг. 6). Зразки з усіх фракцій піків об'єднували в пули, осаджували і тестували їх протигрибкову активність. Електрофорез в поліакриламідному гелі з додецилсульфатом натрію (ДСН-ПААГ): електрофорез в ДСН-ПААГ (12 %) білків, виділених з фракцій FPLC, проводили по методу Леммлі (Laemmli, U. K. 1970, Nature 227:680-685). Всі фракції, що відповідають окремим пікам FPLC, об'єднували в пули і осаджували в 1:4 об'єму холодного ацетону і залишали при -20 °C на ніч. Після центрифугування при 12000 g протягом 10 хв осаджені білки (осади) розчиняли в мінімальній кількості (30 мкл) буфера для аналізу. Білки аналізували в ДСН-ПААГ з 5 % концентруючим гелем (pH 6,8) і 12 % розділяючим акриламідним гелем (pH 8,8) в Трисгліциновому буфері (pH 8,3) і з прийнятними маркерами. Перед ДСН-електрофорезом білок змішували з рівним об'ємом буфера для нанесення (60 мМ Трис-HCl буфер, 4 % ДСН, pH 6,8), що містить 5 % (-меркаптоетанолу. Використовували суміш стандартних маркерних білків (білкові маркери Bio-Rad, Bio-Rad Laboratories Inc, Mississauga, НА, CA). Всі зразки нагрівали протягом 5 хв при 95 °C, і охолоджували до кімнатної температури перед нанесенням в гель. Білки візуалізували з використанням методу фарбування сріблом (набір для фарбування Bio-Rad Silver staining kit, Bio-Rad Laboratories Inc., Mississauga, ON, CA). Молекулярні маси білків оцінювала по рухливості стандартних маркерів молекулярної ваги. Смуги білків молекулярної маси 13 кДа і 50 кДа виявляли в піках f1 і f2, відповідно (фіг. 7). Аналіз на мікотитрувальних планшетах: Процент інгібування проростання спор проводили за допомогою методу аналізу на мікотитрувальних планшетах (Ghosh, 2006, Ann. Bot. 98:11451153; Yadav et al. 2007, J. Med. Microbiol. 56:637-644) для тестування протигрибкової активності білків, виділених з фракцій FPLC. Можливу токсичність фракціонованих білків тестували за допомогою аналізу процента інгібування росту з використанням F. oxysporum і F. graminearum. Протигрибкову активність in vitro фракціонованих білків визначали в 96-ямкових мікотитрувальних планшетах. У мікотитрувальних ямках 10 мкл картопляно-декстрозного середовища (PDB; BD Biosciences, Mississauga, ON, CA) змішували з 3 мкл суспензії спор F. oxysporum і F. graminearum. Аліквоту об'ємом 7 мкл різних пікових фракцій білків додавали до суспензій в мікотитрувальних планшетах (12-8 ямка). Воду і буфер використовували як негативний контроль. Потім мікотитрувальний планшет інкубували при кімнатній температурі в темряві. Через 24 год. візуально оцінювали інгібування проростання спор в необроблених і в оброблених ямках з використанням інвертаційного і флуоресцентного мікроскопа. Число 13 UA 104050 C2 5 10 15 20 25 30 35 40 45 50 55 60 пророслих і непророслих спор і процент площі, покритої міцелієм в полі мікроскопа, використовували для визначення процента інгібування росту. Піки f1 і f2, що містять білки, чинили інгібуючу дію на проростання спор через 24 години в порівнянні з контрольною обробкою. Викид спор з спорангіїв інгібувався вказаними білковими фракціями. Повторне розгалуження (формування міцелію) спостерігали в оброблених контролем спорах F. oxysporum (фіг. 8A-c) і F. graminearum (фіг. 8B-c). Розгалуження не спостерігали в оброблених f1 і f2 білками спорах F. oxysporum (фіг. 8A-a-b) і F. graminearum (фіг. 8B-a-b). Розмір зародкових трубок (гіф), оброблених контролем спор перевищував 100 мкм в порівнянні з 10-15 мкм для оброблених білками спор (фіг. 8A-a-b; 8B-a-b). Приклад 3 Активно зростаючий міцелій S. mycoparasitica (SMCD 2220-01) культивували на картоплянодекстрозному середовищі (PDB) у струшуваній колбі при 21 °C протягом 3 днів, а потім промивали. Вологий міцелій (0,1 г) ресуспендували в 1 мл середовища PDA з додаванням 100 мкг/мл 3-АДОН (Sigma-Aldrich Canada Ltd., Oakville, ON, CA) і інкубували протягом 10 днів. 2 Бляшку S. mycoparasitica площею 0,2 см інкубували в 1 мл PDB, що містить 3-АДОН в 15 концентрації 100 мкг при КТ протягом 7 днів. Зразок аналізували на предмет розщеплення ДОН за допомогою аналізу ВЕРХ і ТСХ. Екстрагування 3-АДОН: 3-АДОН екстрагували методом, описаним Vasavada і Hsieh (1987, Appl. Micro. Biotechnol. 26:517-521). Відпрацьоване середовище у відібраних колбах фільтрували через фільтрувальний папір Whatman, видаляючи міцелій. 3- АДОН екстрагували з середовища трьома порціями етилацетату об'ємом по 10 мл. Суміш середовища і розчинника енергійно струшували, і залишали на 5 хвилин для розділення фаз. Органічну фазу відбирали, і пропускали над сульфатом натрію для видалення залишкової води. Розчинник залишали випаровуватися при кімнатній температурі. Залишок знову розчиняли в ацетонітрилі для аналізу. ТСХ-аналіз ДОН: Тонкошарову хроматографію (ТСХ) використовували для аналізу ДОН. ТСХ проводили методом, описаним Андреа з співр. (Andrea et al. 2004, J. Basic Microbiol, 44:147-156). Висушені залишки розчиняли в 75 мкл, і наносили на пластини ТСХ з силікагелем, покриті флуоресцентним індикатором (60 F254, шар 0,2 мм; Merck Frosst Canada Ltd, Kirkland, PQ, CA). Плями елюювали в системі розчинників з етилацетатом-толуолом (3:1) протягом 40,5 хв. Пластини гелю обприскували 20 % хлоридом алюмінію в 95 % етанолі. Трихотецени візуалізували у вигляді темних плям при опроміненні короткохвильовим УФ-випромінюванням (254 нм). Хроматограми фотографували, використовуючи систему документування гелів. Відомий стандартний контроль чистого 3-АДОН (Sigma-Aldrich Canada Ltd., Oakville, ON, CA) використовували для порівняння з іншими обробками. Зразок, що містить S. mycoparasitica, показав значно менший вміст 3-АДОН, ніж контрольний зразок. Високоефективна рідинна хроматографія (ВЕРХ) ВЕРХ-систему Waters: 250×4,60 мм id Prodigy 5 мкл (3) 100A, з колонкою C 18 5 мкл мікрон (Phenomenex Inc, Torrance, CA, USA) і детектором на фотодіодній матриці (PDA) використовували з градієнтною системою розчинників (суміш води-ацетонітрилу, що містить 0,005 % (бо/об) трифтороцтової кислоти). Датчик PDA вимірював в УФ-спектрі (200-600 нм). Зразки розчиняли в ацетонітрилі, і наносили 20 мкл на колонку, використовуючи автоматичний -1 ін'єктор. ДОН елюювали розчинником в рухомій фазі при витраті 1 мл хв . 3- АДОН, отриманий від Sigma-Aldrich (Sigma-Aldrich Canada Ltd., Oakville, ON, CA), використовували як стандарт. Результати показані на фіг. 9. Зразок з S. mycoparasitica містив значно знижений рівень 3АДОН. Приклад 4 Картопляно-декстрозний агар (PDA), картопляно-декстрозна стріла (PDB), дріжджовий екстракт, агар на солодовому екстракті (MEA), агар і пептон були придбані в BD Biosciences (Mississauga, НА, CA). Стрептоміцину сульфат, неоміцину сульфат і інші реактиви аналітичної міри чистоти були придбані в Sigma-Aldrich Canada Ltd. (Oakville, ON, CA). Грибкові штами і умови зростання Чотири фітопатогенні штами Fusarium (F. avenaceum, F. sporotrichioides, F. oxysporum і F. proliferatum); три перспективних грибкових інокулята (Trichoderma harzianum (RootShield), Penicillium bilaii (JumpStart) і Chaetomium globosum; і один штам мікопаразитичного гриба (Sphaerodes mycoparasitica SMCD 2220-01), виділений з хазяїна F. oxysporum, підтримували на PDA з додаванням антибіотиків (100 мг/л стрептоміцину сульфату і 12 мг/л неоміцину сульфату) 14 UA 104050 C2 5 10 15 20 25 30 35 40 45 50 і використовували в ході даного дослідження. Ізолят мікопаразитичного гриба S. mycoparasitica відділяли від його хазяїна F. oxysporum, і отримували моноспорові культури згідно з методами, описаними Harveson RM, Kimbrough J.W. (2001, Int. J. Plant Sci. 162:403-410) з деякими модифікаціями. Зрілі перитеції збирали, суспендували і струшували в 2 мл стерилізованої чистої води. Потім суспензію спор сіяли на чашки PDA. Через декілька хвилин за допомогою стереомікроскопа Carl Zeiss Stemi 1000 індивідуальні спори видаляли і переносили на PDA з додаванням 100 мл/л фільтрату Fusarium. Всі грибкові ізоляти зберігали в Колекції мікроорганізмів і базі даних Саскачевана, Канада (SMCD). Отримання спор Бляшки міцелію з краю активно зростаючої моноспорової культури Sphaerodes вирізали і вміщували на модифікований агар Леоніана (MLA: мальтоза 6,25 г; солодовий екстракт 6,25 г; KH2PO4 1,25 г; дріжджовий екстракт 1,0 г; MgSO4·7H2O 0,625 г; пептон 0,625 г; агар 20 г і 1 л dH2O. Інокулювання чашки MLA інкубували при кімнатній температурі (23 °C) в темряві протягом місяця перед збиранням спор для аналізу проростання. За допомогою стереомікроскопа зрілі спори, виступаючі з аском і розташовані на остіолярному отворі, обережно збирали стерильними голками, і вміщували в пробірки об'ємом 2 мл в 1 мл стерилізованої дистильованої води. Потім суспензію фільтрували через чотири тонких шари марлі для видалення решти рослинних клітин або міцелію. Щільність суспензії спор визначали за допомогою рахункової 5 камери, і доводили приблизно до 5-5-6×10 спор на мл в стерилізованій воді. Використовували свіжоприготовлені водні суспензії спор. Приготування грибкових фільтратів Чотири патогенних штама Fusarium і три перспективних грибкових штама вирощували в культурах, що перемішуються, протягом 7 днів при кімнатній температурі (23 °C) в колбах об'ємом 500 мл, що містять 100 мл середовища PDB. Після інкубування протягом 7 днів в середовищі PDB міцелій видаляли шляхом фільтрування через фільтрувальний папір, а потім фільтрати стерилізували фільтром. Свіжоприготовлені грибкові фільтрати використовували для тестів на проростання спор. Штам Sphaerodes mycoparasitica SMCD 2220-01, як виявили, утворював спори на фузаріумі або при спільній інокуляції з такими видами Fusarium, як F. avenaceum і F. oxysporum. Як спостерігали, S. mycoparasitica, утворював приблизно однакову кількість аском на F. oxysporum і F. avenaceum. S. mycoparasitica, як знаходили, не утворював спорангіїв на інших видах Fusarium або штамух інших грибів, таких як F. proliferatum, F. sporotrichioides, Р. bilaai, Т. harzianum і З. globosum. У зоні контакту біотрофних мікопаразитів і видів Fusarium формувалися гачкоподібні контактні структури. Вплив теплової і холодової обробки на проростання спор Sphaerodes Водні суспензії аскоспор піддавали тепловому шоку при 60 °С і 65 °С протягом 20 хвилин, і обробляли холодом при 4 °С, -20 °С і -70 °С протягом 5 хвилин і 20 хв. Потім піддані тепловому і холодовому шоку спори переносили і інокулювали на WA і PDA протягом 1 дні і 3 днів. Щодня оцінювали проростання спор. Спори, не піддані тепловому або холодовому шоку, використовували як контроль. Проростання не спостерігали ні у однієї з груп теплової і холодової обробки протягом 3 днів. Додаткові спостереження продовжували до 7 днів і проростання спор не спостерігали. Проростання на різних середовищах Водні суспензії спор переносили і інокулювали на поверхню наступних середовищ: - 1,5 % водний агар (WA), PDA, MLA, MEA, гвоздично-листовий агар (CLA); - 1,5 % водний агар плюс 100 мл/л фільтрату Fusarium; - PDA з 100 мл/л фільтрату Fusarium. Використовували наступні штами Fusarium: F. avenaceum, F. oxysporum, F. proliferatum і F. sporotrichioides. Потім інокулювання аскоспорами чашки інкубували при кімнатній температурі (23ºС) протягом 3 днів. Проростання спор перевіряли щодня. Результати приведені в таблиці 1. Кожен день інкубування Sphaerodes аналізували окремо. Числа в кожній колонці представляють середнє значення проростання аскоспор (в %) ± стандартне відхилення. Середні в кожній колонці для кожного середовища обробки, позначені однаковою буквою, не є значуще різними при Р≤0,05 згідно з U-критерієм Уїтні. 55 15 UA 104050 C2 Таблиця 1 Спорилування S. mycoparasitica на різних середовищах Середовище S. mycoparasitica День 1 День 3 0d 0d 11,1±1,7 b 35,2±2,6 b 1,6±1,3 с 18±1,4 с 0d 0d 0d 0d 0d 0d 21,5±1,4 а 63,2±2,4 а 2,5±2 с 37,5±2 b 0d 0d 0d 0d Водний агар (WA) F. avenaceum-WA F. oxysporum-WA F. proliferatum-WA F. sporotrichioides-WA Картопляно-декстрозний агар (PDA) F. avenaceum-PDA F. oxysporum-PDA F. proliferatum-PDA F. sporotrichioides-PDA 5 10 15 20 Вплив грибкових фільтратів на проростання спор Водні суспензії спор суспендували в фільтратах чотирьох окремих патогенних Fusarium і трьох перспективних грибкових штамів протягом 1 дні і 3 днів відносно 1:2 (1 частина водної суспензії спор: 2 частини грибкового фільтрату), після чого суспендування в фільтраті спори переносили і інокулювали на PDA протягом ще 1 дні. Контрольні обробки суспендували в стерилізованій дистильованій воді або PDB. Проростання спор Мікроскопічний аналіз проростання аскоспор проводили після інкубування протягом 1 дні і 3 днів. Процент пророслих спор визначали при підрахунку спор на чашці Петрі за допомогою 200x і 400x об'єктивів мікроскопа Carl Zeiss Axioskop2, при цьому систематично відбирали 50 спор, починаючи з верхнього правого кута і продовжуючи до рахунку 50. Кожну краплю суспензії аскоспор на чашці з середовищем розглядали як субодиницю, при цьому на чашку доводилося три субодиниці. Кожну чашку зі середовищем для кожної обробки відтворювали, при цьому на обробку доводилося три повторності. Експерименти повторювали двічі. Аскоспорою вважали тільки пророслу спору з чітко помітною зародковою трубочкою. Пророслі аскоспори підраховували, і реєстрували в процентах від загальної кількості аскоспор. Результати приведені в таблиці 2. Числа в кожній колонці представляють середнє значення проростання аскоспор (в %) ± стандартне відхилення. Кожний день інкубування Sphaerodes аналізували окремо. Середні в кожній колонці Sphaerodes для кожної обробки суспензіїфільтрату, позначені однаковими буквами, не були значуще різними при Р≤0,05 згідно з Uкритерієм Уїтні. Таблиця 2 Вплив фільтратів гриба S. mycoparasitica на проростання спор Shpaerodes sp. Обробки Вода PDB Фільтрат F. avenaceum Фільтрат F. oxysporum Фільтрат F. proliferatum Фільтрат F. sporotrichioides Фільтрат P. bilaii Фільтрат T. harzianum Фільтрат С. globosum 1d суспензія 0c 0c 89,2±6,2 a 0c 2,6±3,6 b Проростання спор (в %) 1d сусп + 1d PDA 3d суспензія 0e 0e 0e 0e 91±8,4 a 93,2±6,7 a 81.8±11 b 85±7,9 b 3,2±4,6 d 10±7,4 с 3d сусп + 1d PDA 2±1,2 c 2,8±1,9 c 94,2±7,9 a 91±10 a 11,2±8 b 0c 3±2,8 d 3,4±3,3 d 10±5,6 b 0c 0c 0c 0e 9±1,1 с 0e 0e 1,6±1,6 d 0e 0c 10,4±1,5 b 0c 25 Приклад 5 16 UA 104050 C2 5 10 15 20 25 30 35 40 45 50 55 60 Оскільки F. graminearum 3-АДОН є найбільш патогенним і мікотоксигенним у пшениці, 3АДОН використовували для кількісного аналізу взаємодій мікопаразит-Fusarium-корінь пшениці при регульованих умовах у фітотроні. Грибкові штами і ріст Штами Fusarium: F. graminearum 3-АДОН штаму SMCD2243, біотрофний мікопаразит Sphaerodes mycoparasitica SMCD2220-01 і Trichoderma harzianum T-22 (комерційний продукт RootShield) як контрольний штам з мікопаразитичними властивостями підтримували на PDA з додаванням антибіотиків. Таксонспецифічні праймери Набір специфічних праймерів до: F. graminearum-Fg1 2NFi (Nicholson et al., 1998. Plant Pathology 53:17-37); Trichoderma-TGP4-F IR (Kim and Knudsen 2008. Applied Soil Ecology 40:100108) і S. mycoparasitica SMCD2220-01-SmyITSF/R використовували в даному дослідженні. Взаємодії мікопаразит/Fusarium/рослина Рослини пшениці CDC-TEAL 2001 інокулювали мікотоксигенним і патогенним Fusarium, а також Trichoderma (контрольний мікопаразит) або Sphaerodes SMCD2220-01 і піддавали кількісному аналізу з використанням ПЛР-РВ для оцінки кількості грибкової ДНК у коренях пшениці при регульованих умовах через 14 днів інкубування в умовах фітотрона. Умови росту й інокуляція грибків П'ять міцелярних бляшок S. mycoparasitica, T. harzianum і F. graminearum вирізали, переносили і вирощували в трьох окремих культурах, що перемішуються, протягом 14 днів при кімнатній температурі (23 °C) у колбах на 500 мол з 100 мол PDB (картопляно-декстрозне середовище). Після 14-денної інкубації в середовищі PDB культури грибків фільтрували через фільтрувальний папір Whatman® номер 1 для видалення рідкого середовища. Потім міцелій переносили в стерильні пробірки Falcon на 50 мл зі стерильними скляним намистом і 40 мл автоклавованої дистильованої води. Потім пробірки Falcon, заповнені міцелієм, струшували на вортексі протягом 1 хвилини для поділу міцелію на менші фрагменти. Міцелярну суспензію фільтрували через 2 шари марлі для видалення скляного намиста і великих фрагментів міцелію. Отриманий фільтрат використовували як стік міцелярної суспензії (10°) для серійних -2 -3 -4 розведень. Стік міцелярної суспензії потім розводили в серії 10 , 10 і 10 . Дані серійні розведення сіяли на чашки PDA, використовуючи метод глибинного посіву на чашки. Число КУО (колонієутворювальних одиниць) підраховували і реєстрували. Міцелярні суспензії доводили -5 -6 стерильною водою до приблизно 10 -10 КУО/мол для S. mycoparasitica і T. harzianum, і до -4 -5 приблизно 10 -10 КУО/мл для F. graminearum. Кількісний аналіз взаємодій між мікопаразитом-патогеном-коренями пшениці проводили на яровій пшениці CDC-TEAL 2001. Рослини пшениці вирощували в контейнерах (4×4×16 див) з 10 г різних шарів гідропонної ростової суміші (Фіг. 10). Поверхня всіх насінин стерилізували перед посівом. Контейнери 10 вистилали фільтрувальним папером, і заповнювали 6 г гідропонної суміші Pro-Mix (Sun Gro Horticulture Canada Ltd., Delta, BC, CA; Pro-Mix є зареєстрованою торговою маркою Premier Horticulture Ltd., Riviere-du-Loop, PQ, CA), що складала перший шар 20. Зазначений шар 20 потім покривали другим шаром 30 (1 г) суміші Pro-Mix, гомогенізованої 4 із суспензією міцелію ~5-6×10 КУО F. graminearum, або альтернативно суміші Pro-Mix тільки з водою. Після другого шару 30 наносили третій шар 40 (1 г) торф'яного моху Sunshine (Sunshine є зареєстрованою торговою маркою Sun Gro Horticulture Canada Ltd., Seba Beach, AB, 5 CA), гомогенізованого з ~5-6×10 КУО S. mycoparasitica, або альтернативно із суспензією міцелію T. harzianum, або альтернативно тільки з водою. Потім шість насінин ярової пшениці сіяли на поверхню третього шару 40, і накривали п'ятим шаром 60 2 г торф'яного моху Sunshine (Фіг. 10). Насіння ярової пшениці пророщували, і вирощували в умовах 16-годинного -2 -1 світлового періоду (22 °C удень/15 °C уночі), з інтенсивністю світла 250 мкмоль м с , з поливом кожні 2 дні і внесенням 1300 м. ч. добрива NPK (20-20-20) кожні 14 днів. Всі обробки в експерименті проводили в трьох повторностях, а експеримент повторювали двічі. У середині росту розсади, що відповідає 13 стадії росту по Зедоксу (Zadoks et al. 1974, дослідження бур'яну 14:415-421), рослини пшениці з коренями витягали з контейнерів і промивали під проточною водопровідною водою для повного видалення частинок ґрунту. Промиті корені обтирали досуха фільтрувальним папером. Число пророслих насінин, повну біомасу, біомасу коренів, повну довжину і довжину коренів обчислювали і вимірювали. Відсоток проростання насіння обчислювали за наступною формулою: (число пророслих насінин у визначеній обробці/число пророслих насіння у контрольній обробці)×100 %. Потім корені піддавали виділенню сумарної ДНК із використанням міні набору DNeasy Plant (Qiagen Inc., Mississauga, ON, CA). Виділену ДНК із коренів різних обробок використовували в кількісному аналізі за допомогою ПЛР у реальному часі. 17 UA 104050 C2 5 10 Статистичні аналізи Біомасу коренів (г), повну біомасу (г), довжину коренів (см), повну довжину (див), проростання насіння (%); і кількісний аналіз геномної ДНК S. mycoparasitica, T. harzianum і F. graminearum з коренів рослин ярової пшениці аналізували з використанням дисперсійного аналізу (ANOVA). Перетворення Log10 робили при необхідності відповідності вимогам ANOVA. Множинні порівняння більше ніж для двох зразків аналізували з використанням критерію стьюдентизованого розмаху Тьюкі при P=0,05 (SPSS 1990). Зростання пшениці й інокуляція гриба Біомаса коренів, повна біомаса, довжина коренів, повна довжина і проростання насіння ярової пшениці, зараженої F. graminearum, значно підвищувалися при обробці S. mycoparasitica у порівнянні з інокуляцією тільки F. graminearum (таблиця 3). Таблиця 3 Вплив інокуляційної обробки SMCD2220-01 (SM) і F. graminearum 3-АДОН (Fgra) на біомасу коренів (г), повну біомасу (г), довжину коренів (см), повну довжину (см) і проростання насіння (%) рослин ярової пшениці Біомаса коренів (г) Контроль 0,27±0,06 b SM 0,32±0,03 ab Fgra 0,18±0,03 с SM-Fgra 0,27+0,03 b Обробка Загальна біомаса (г) 0,56±0,56 b 0,69±0,69 a 0,38±0,48 с 0,54±0,54 b Довжина коренів Загальна довжина Проростання (см) (см) насіння (%) 9,63±0,74 b 31,88±2,39 с NA* 13,88±1,11 a 38,13±2,76 ab 101±2 a 7,88±1,89 c 23,75±1,98 d 31,25±1,4 c 12,13±1,35 ab 32,13±3,91 be 87,25±2 b Приведені значення є середніми для шести повторностей ± стандартне відхилення середнього. Значення, позначені однаковими буквами в кожній колонці, не є значно відмінними при використанні критерію розмаху Тьюкі (P
ДивитисяДодаткова інформація
Назва патенту англійськоюFusarium and fusarium mycotoxin biocontrol
Автори англійськоюVujanovic, Vladimir
Автори російськоюВуянович Владимир
МПК / Мітки
МПК: C12N 15/63, C12Q 1/68, A01P 3/00, C07K 14/37, C12N 15/31, A01N 63/04, C12N 1/14, C12N 15/80
Мітки: mycoparasitica, боротьби, культура, sphaerodes, fusarium, виділена
Код посилання
<a href="https://ua.patents.su/70-104050-vidilena-kultura-sphaerodes-mycoparasitica-dlya-borotbi-z-fusarium-spp.html" target="_blank" rel="follow" title="База патентів України">Виділена культура sphaerodes mycoparasitica для боротьби з fusarium spp.</a>
Попередній патент: Спосіб розкриття законтурних запасів корисних копалин
Наступний патент: Культиватор-рослинопідживлювач
Випадковий патент: Спосіб стандартизації квіток цмину піскового (helichrysum arenarium l.) в багатокомпонентних рослинних сумішах