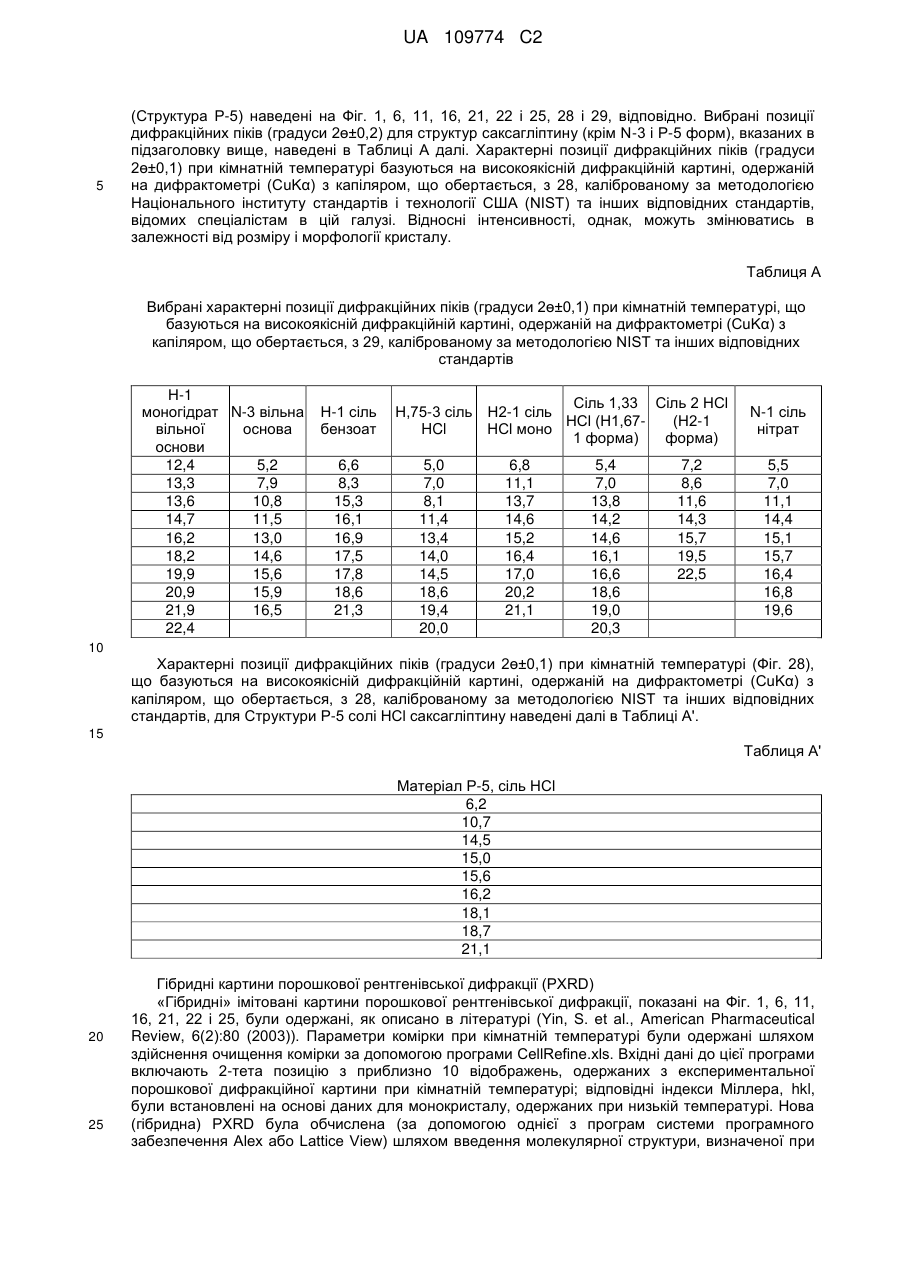
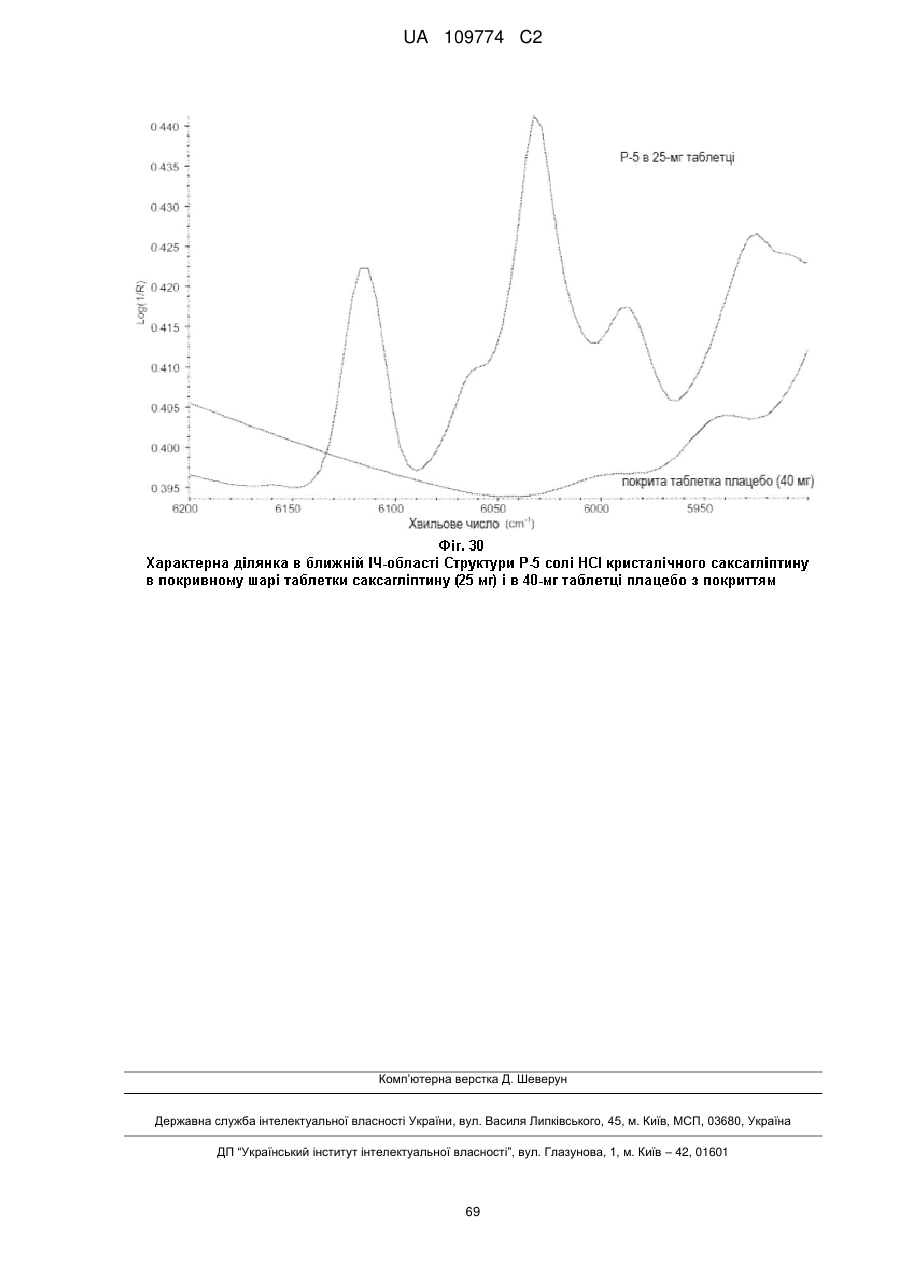
Кристалічні форми саксагліптину та процес його одержання (варіанти)
Номер патенту: 109774
Опубліковано: 12.10.2015
Автори: Маллей Мері Ф., Вей Ченкоу, Їн Ксіаотіан С., Ю Юронг, Джонс Грегорі Скотт, Дімарко Джон Д., Савадж Скотт А., Гоугоутас Джек З., Ву Трук Чі
Формула / Реферат
1. Кристалічна форма сполуки, що має структуру
 (саксагліптин),
(саксагліптин),
у формі гідрату, сольвату або вільної основи або у формі фармацевтично прийнятної солі цієї сполуки, крім солі трифтороцтової кислоти або солі неорганічної кислоти.
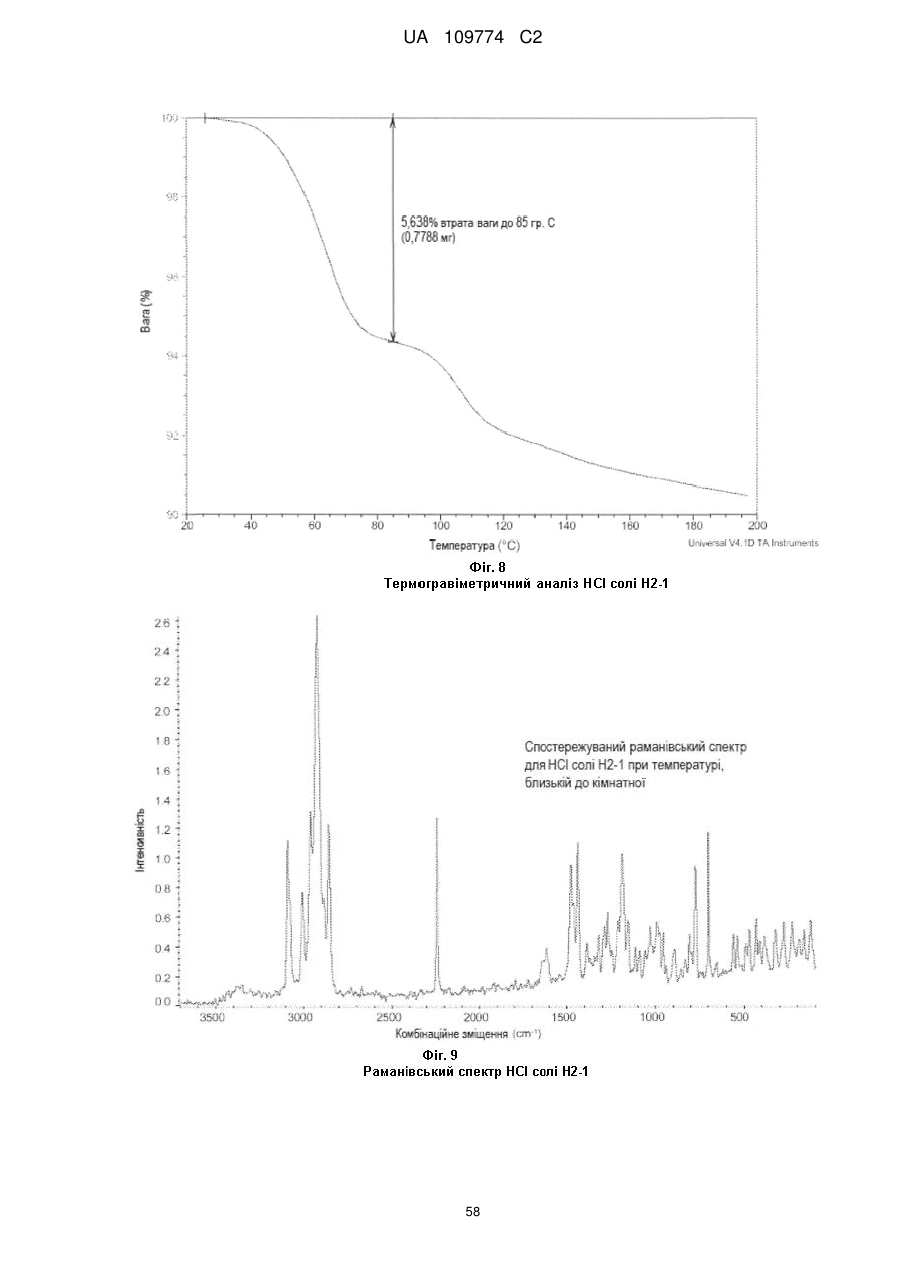
2. Кристалічна форма за пунктом 1:
(a) у формі моногідрату вільної основи (Н-1 форма);
(b) у формі півгідрату вільної основи (0,5 еквівалента Н2О) (Н.5-2 форма); або
(c) у формі вільної основи без домішок (такої, що не містить розчинника) (N-3 форма).
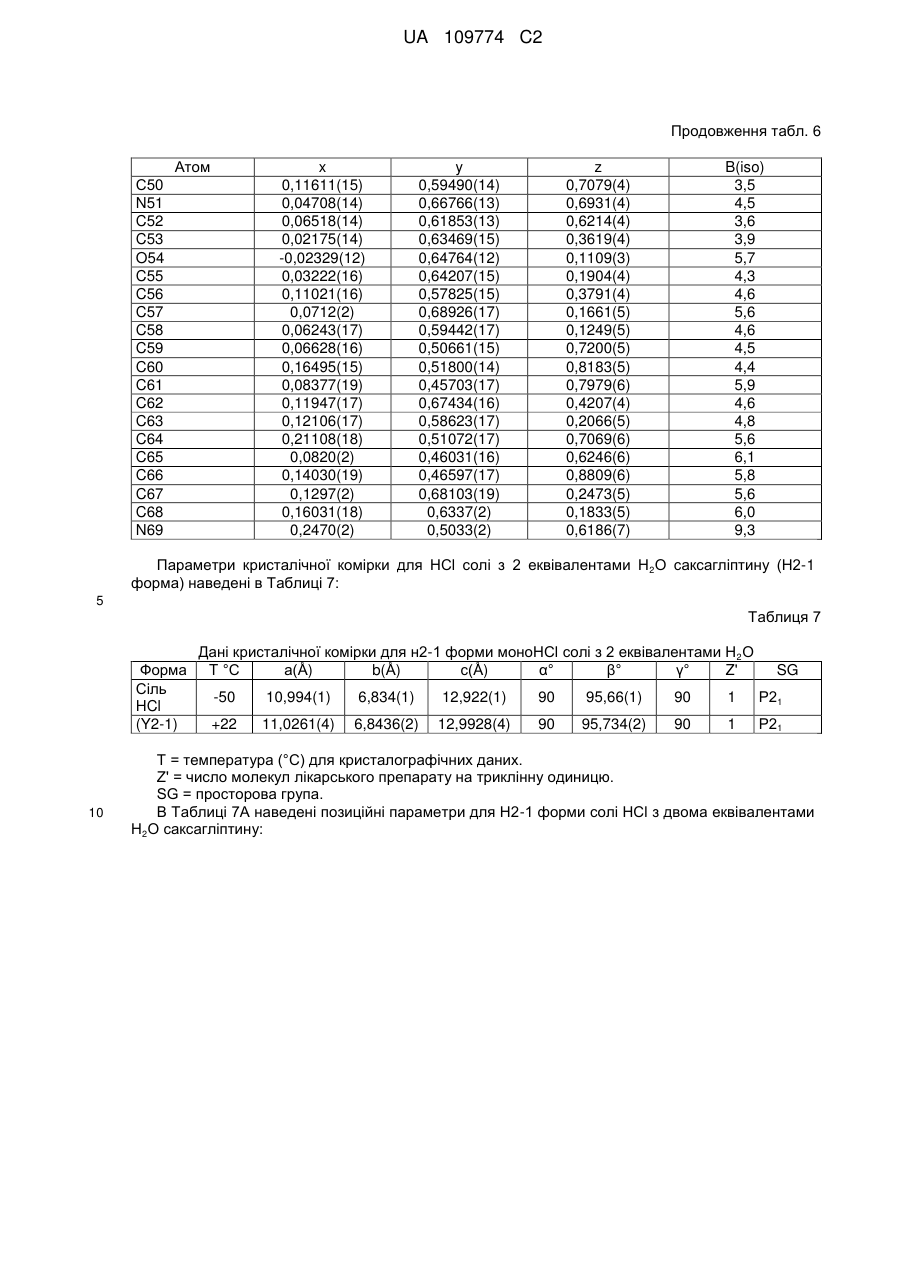
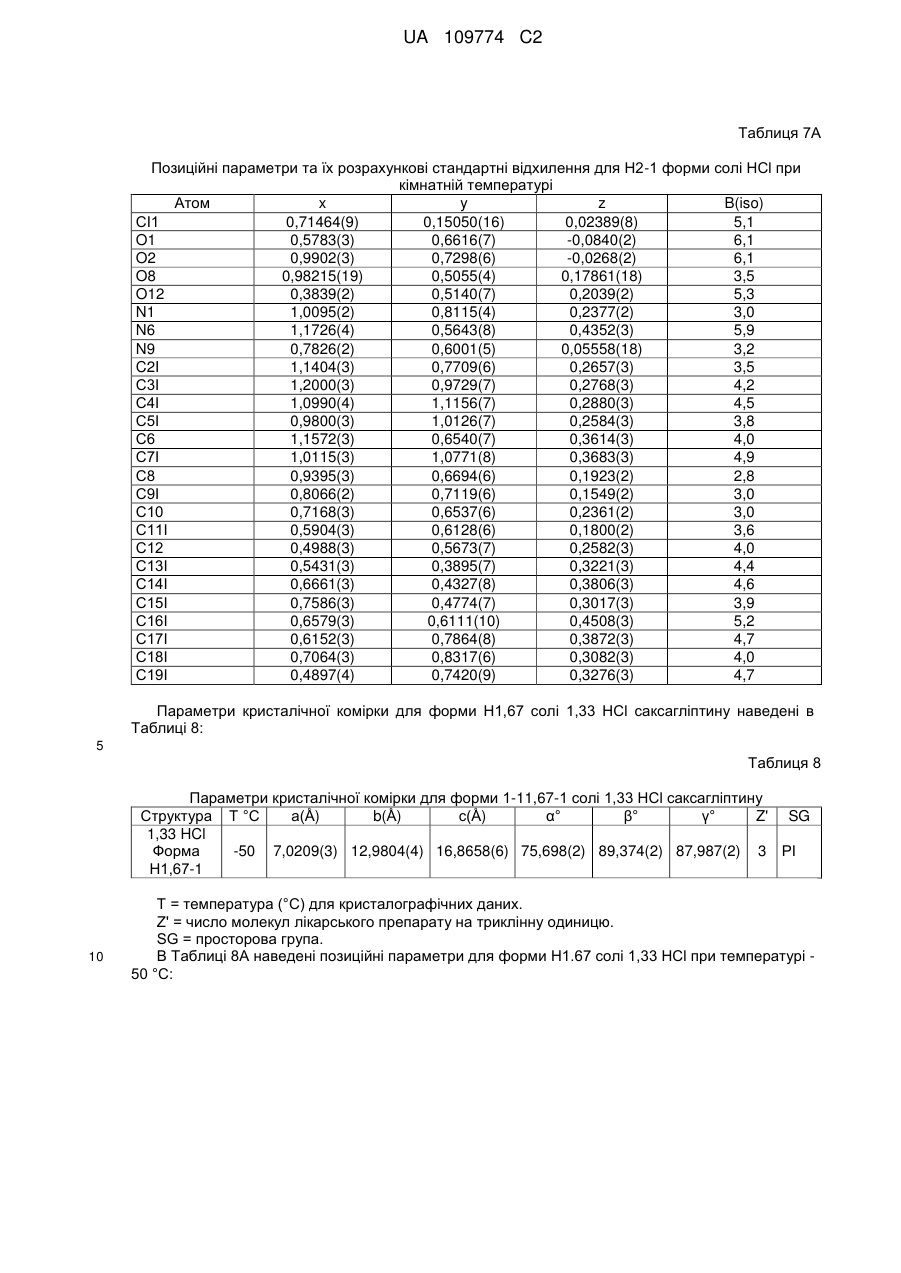
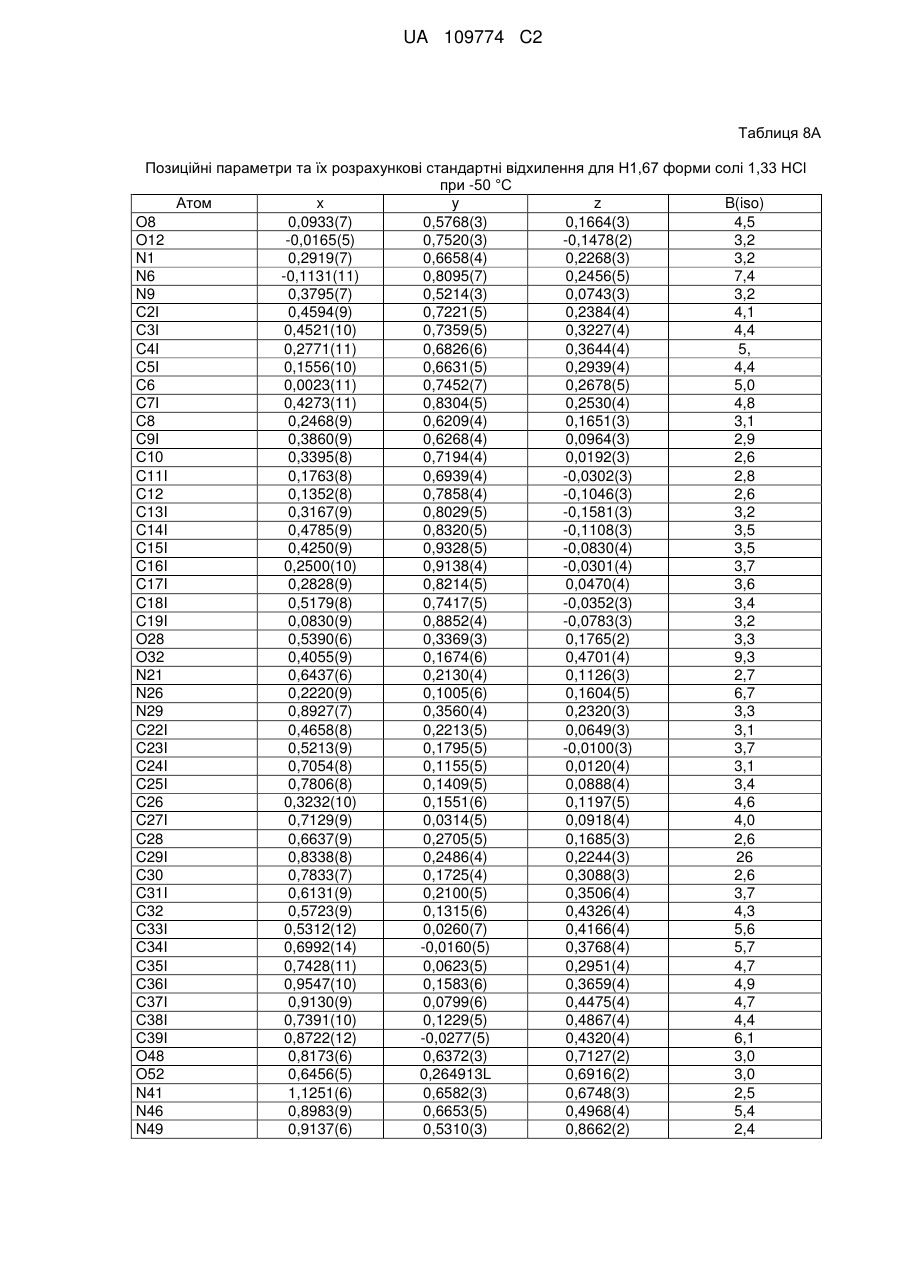
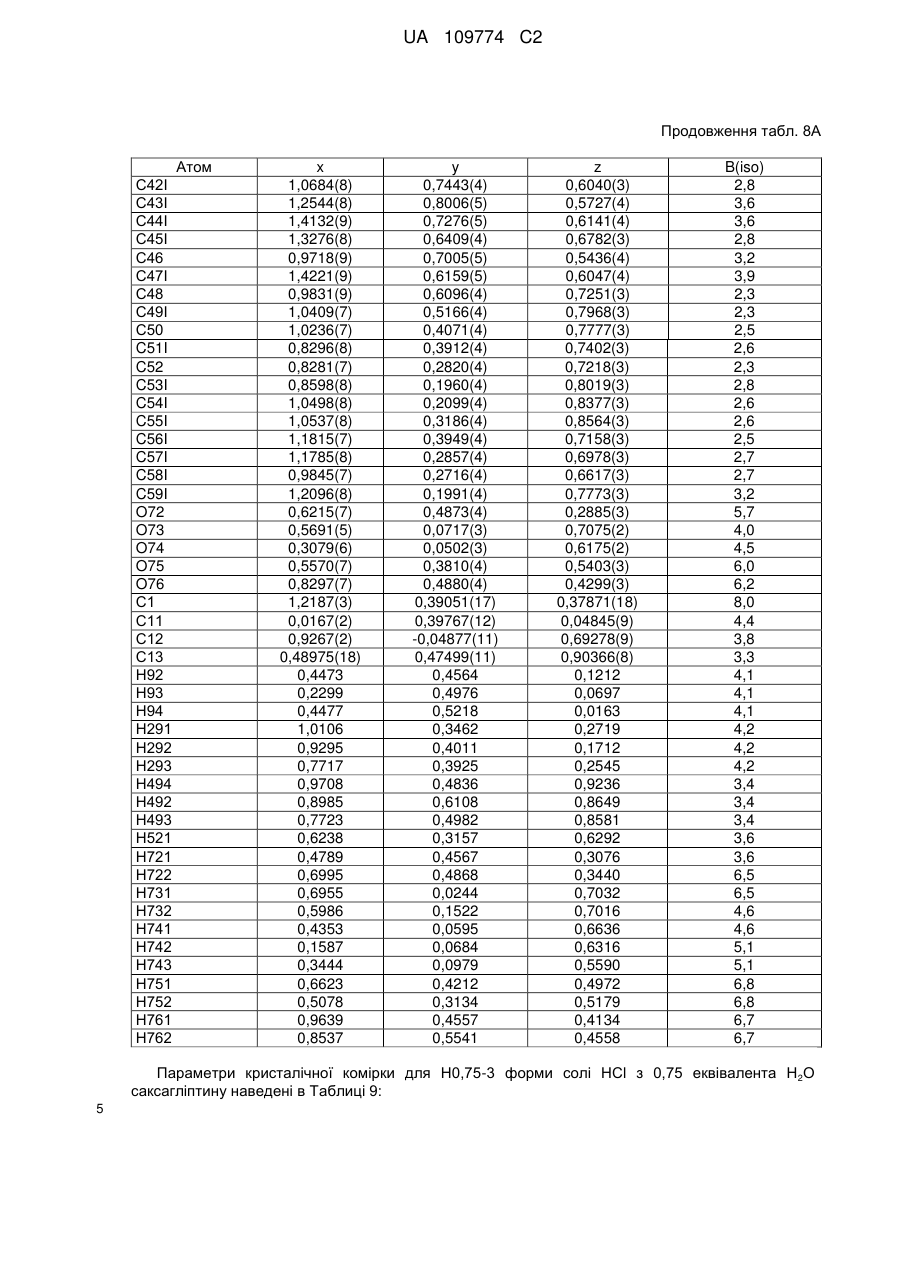
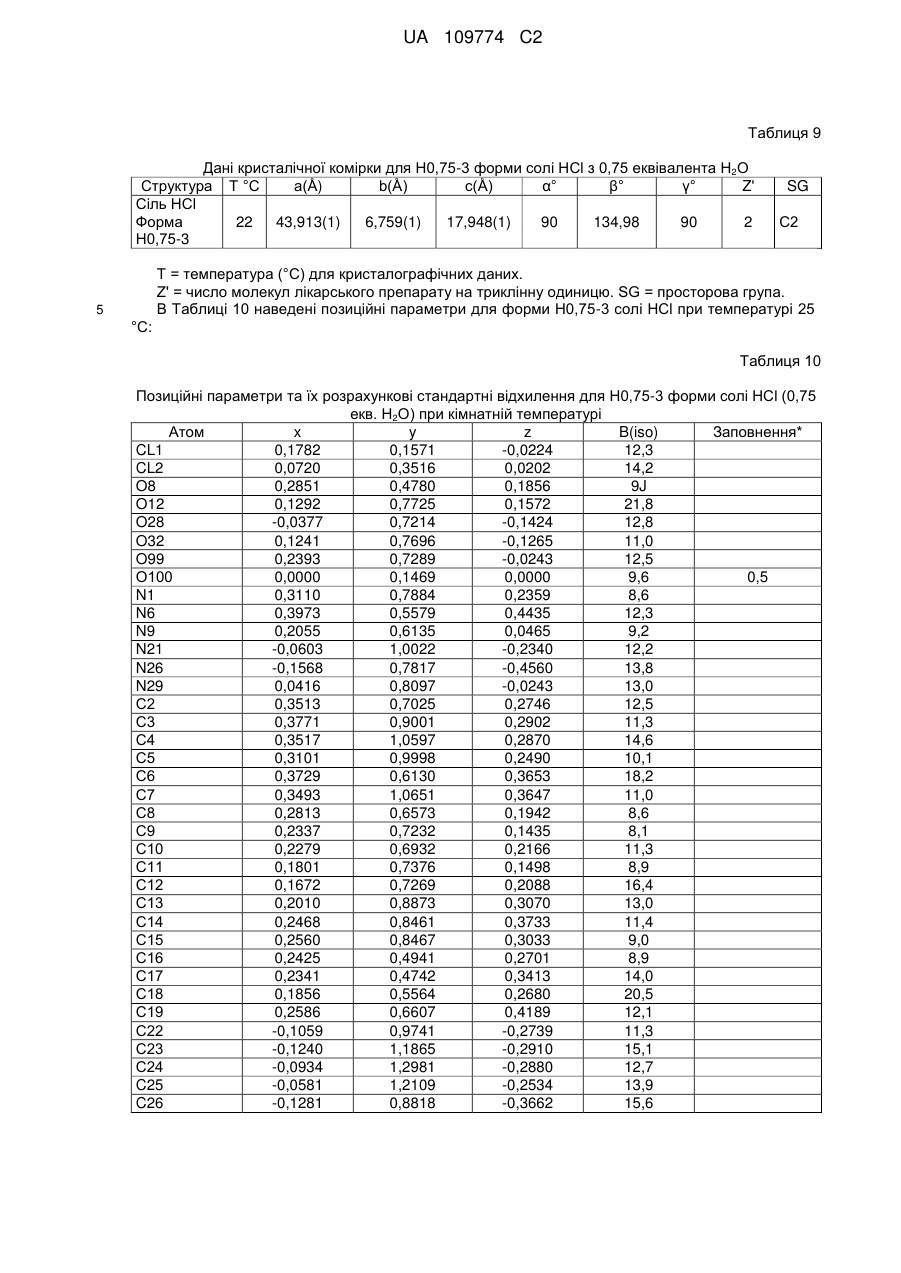
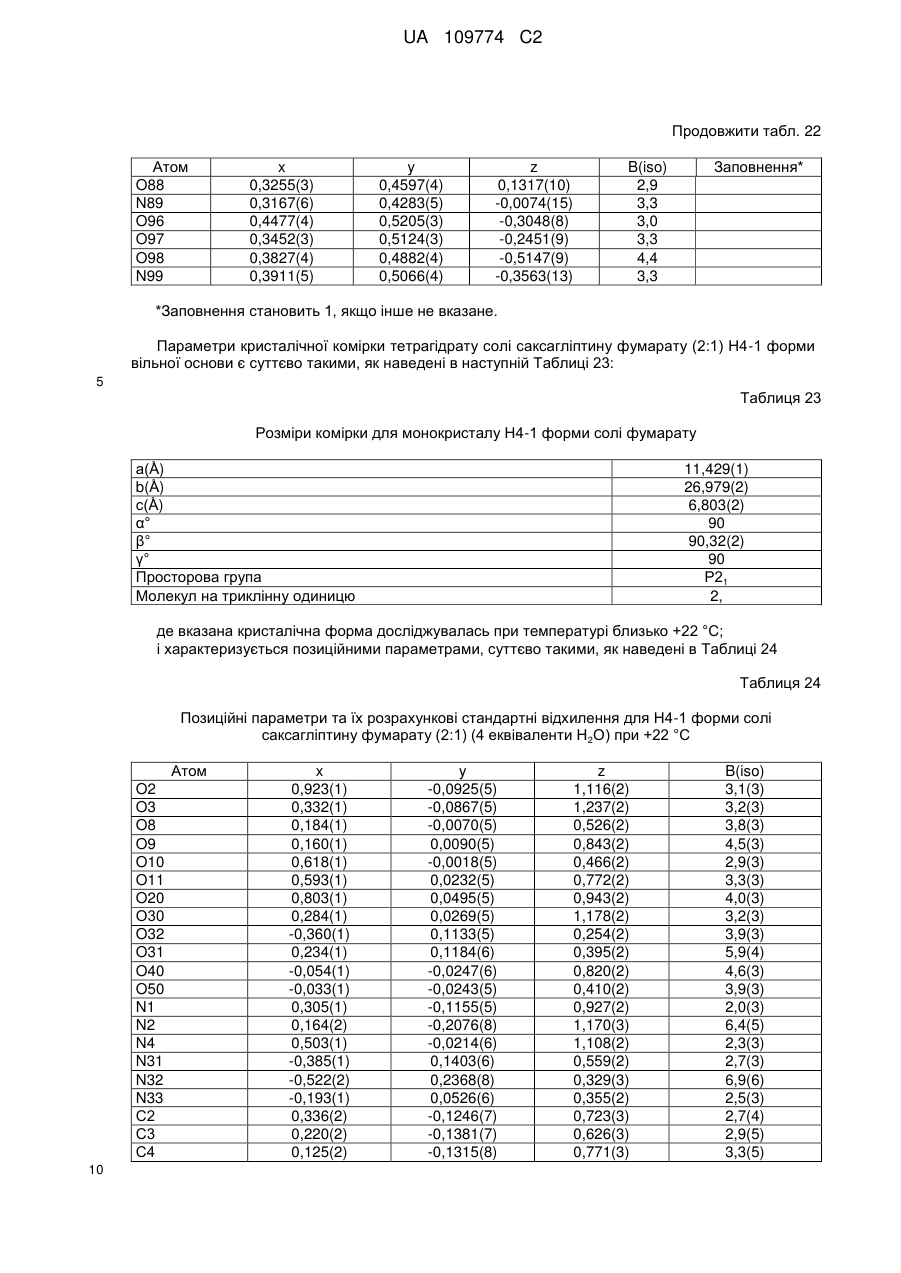
3. Кристалічна форма за пунктом 1 у вигляді Н.5-1 форми (І) гідратованої солі R-H-тартрату, що містить 0,5 еквівалента Н2О;
або у вигляді Н4-1 форми (II) гідратованої солі фумарату, що містить 4 еквіваленти Н2О.
4. Кристалічна форма сполуки, що має структуру
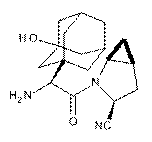 ,
,
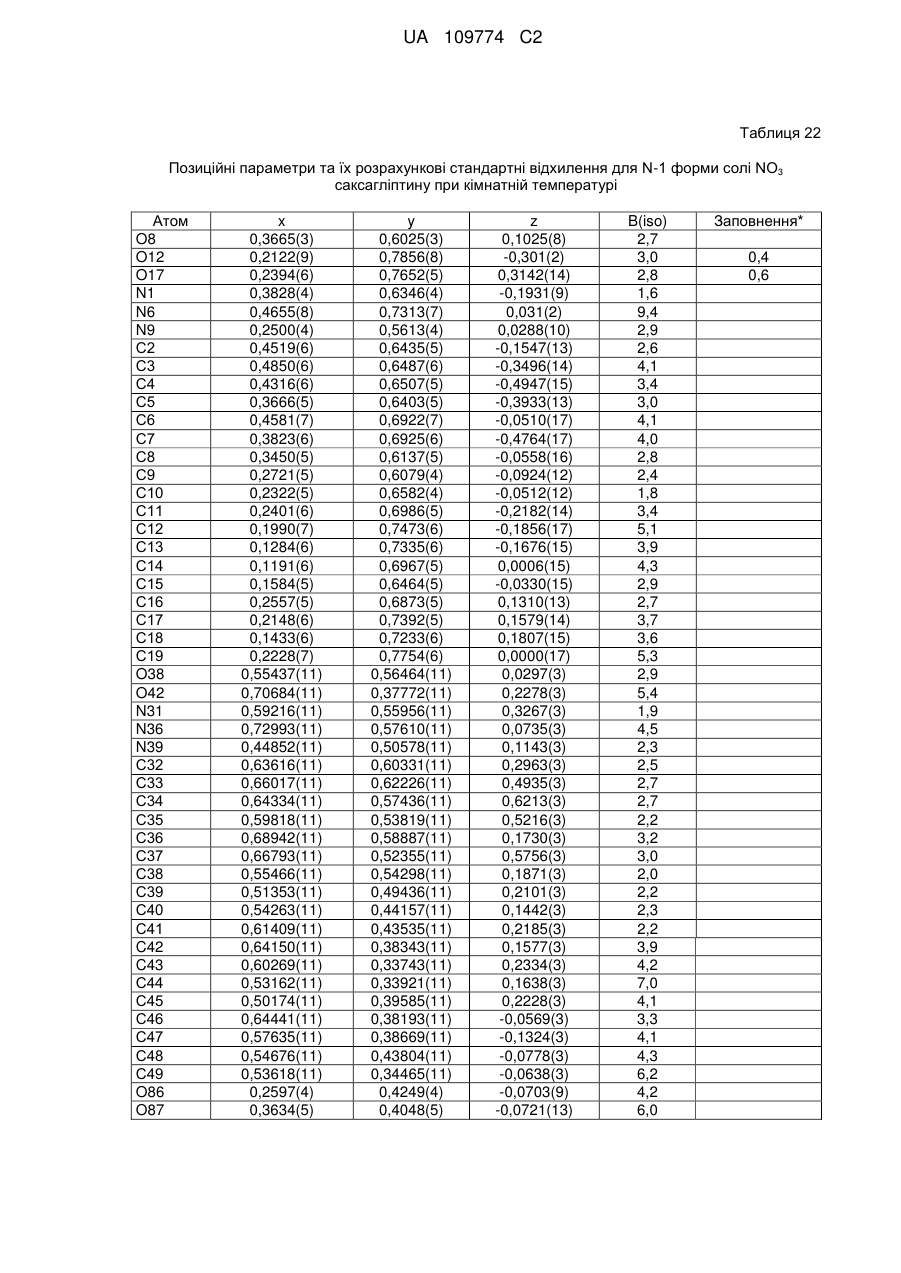
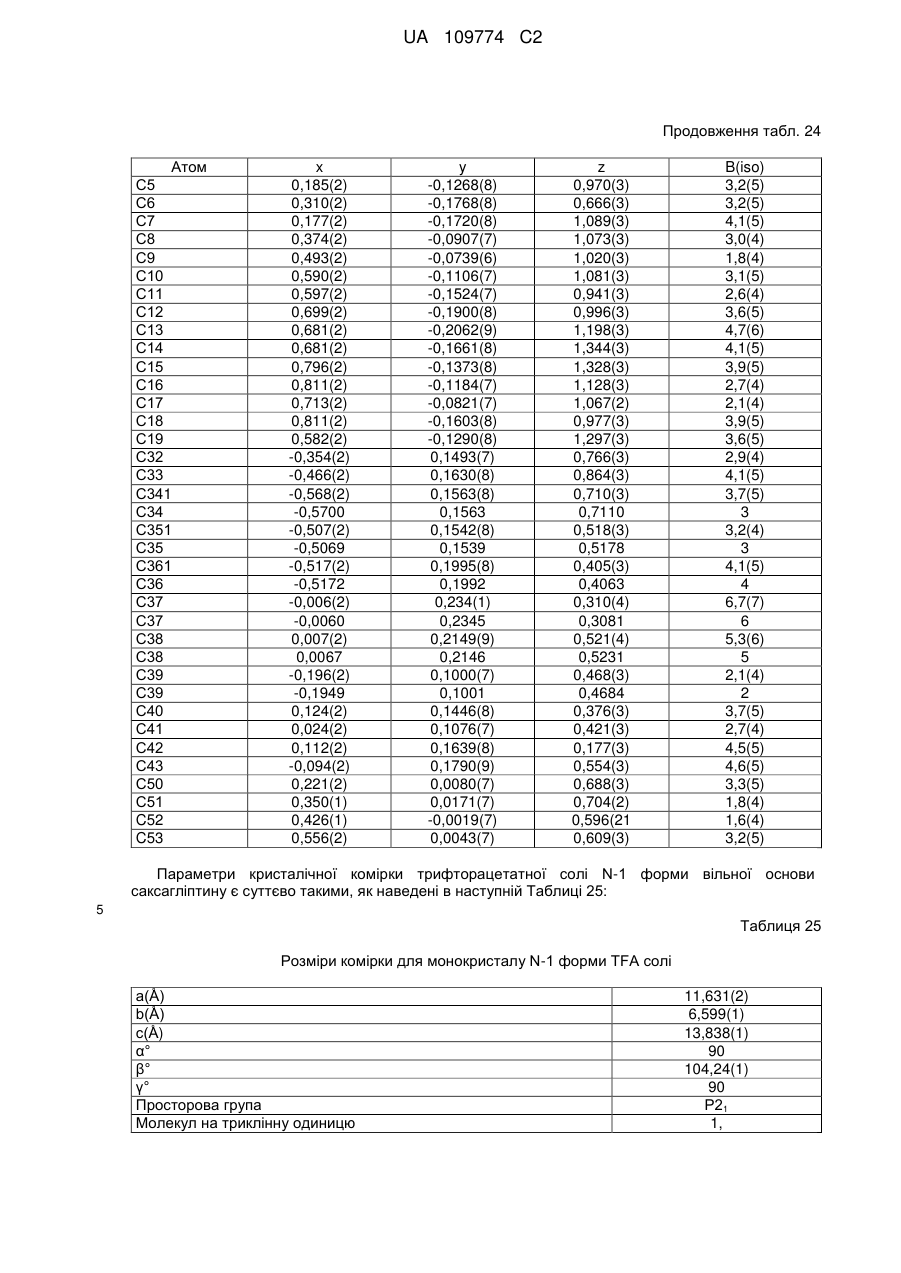
(a) у вигляді N-1 форми солі трифтороцтової кислоти;
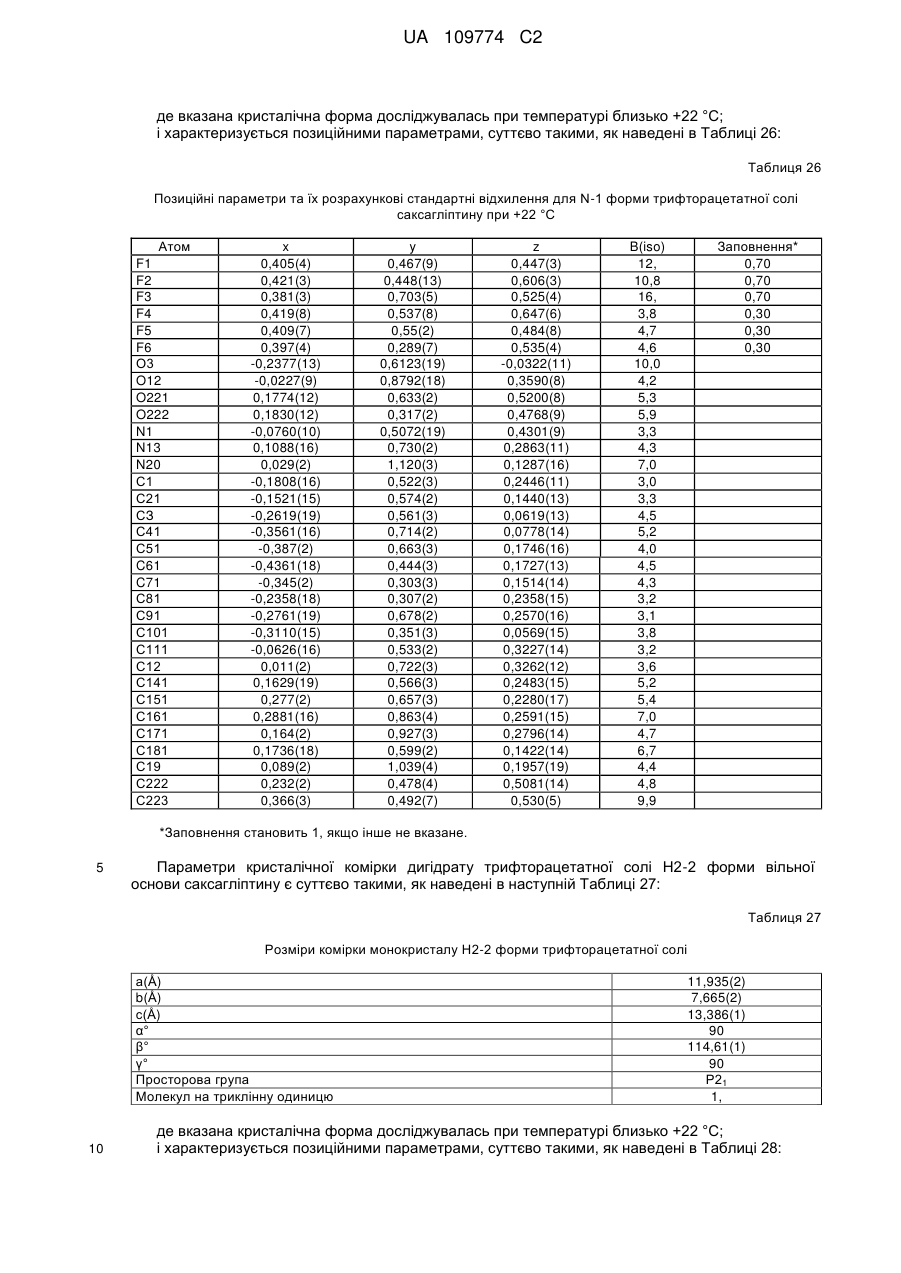
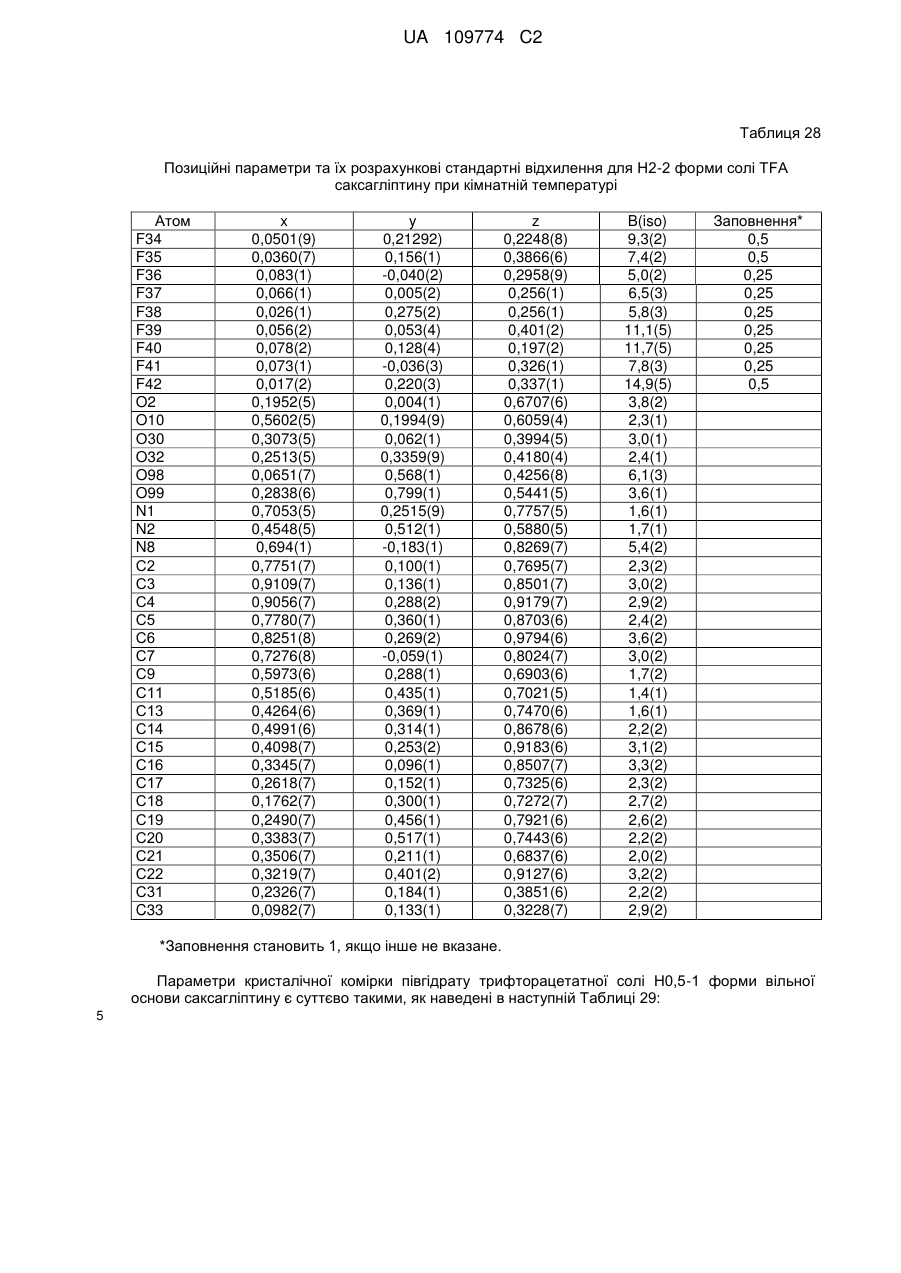
(b) у вигляді Н2-2 форми гідратованої солі трифтороцтової кислоти, що містить 2 еквіваленти Н2О;
(c) у вигляді Н.5-1 форми півгідратованої солі трифтороцтової кислоти, що містить 0,5 еквівалента Н2О;
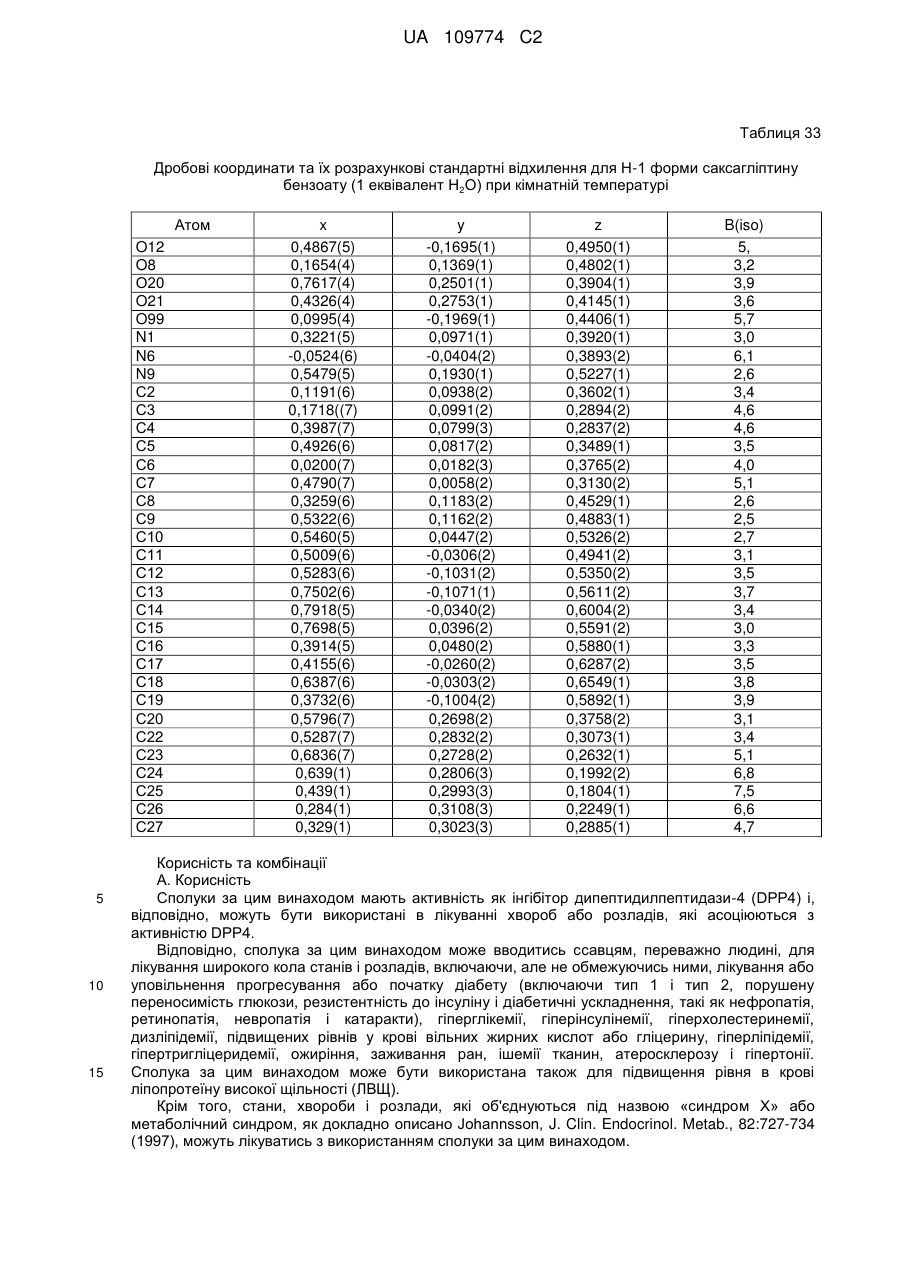
(d) Н-1 форми гідратованої солі бензоату, що містить 1 еквівалент Н2О;
(e) у вигляді моногідрату вільної основи (1 еквівалент Н2О) (Н-1 форма);
(f) у вигляді півгідрату вільної основи (0,5 еквівалента Н2О) (Н.5-2 форма); або
(g) у вигляді вільної основи (N-3 форма).
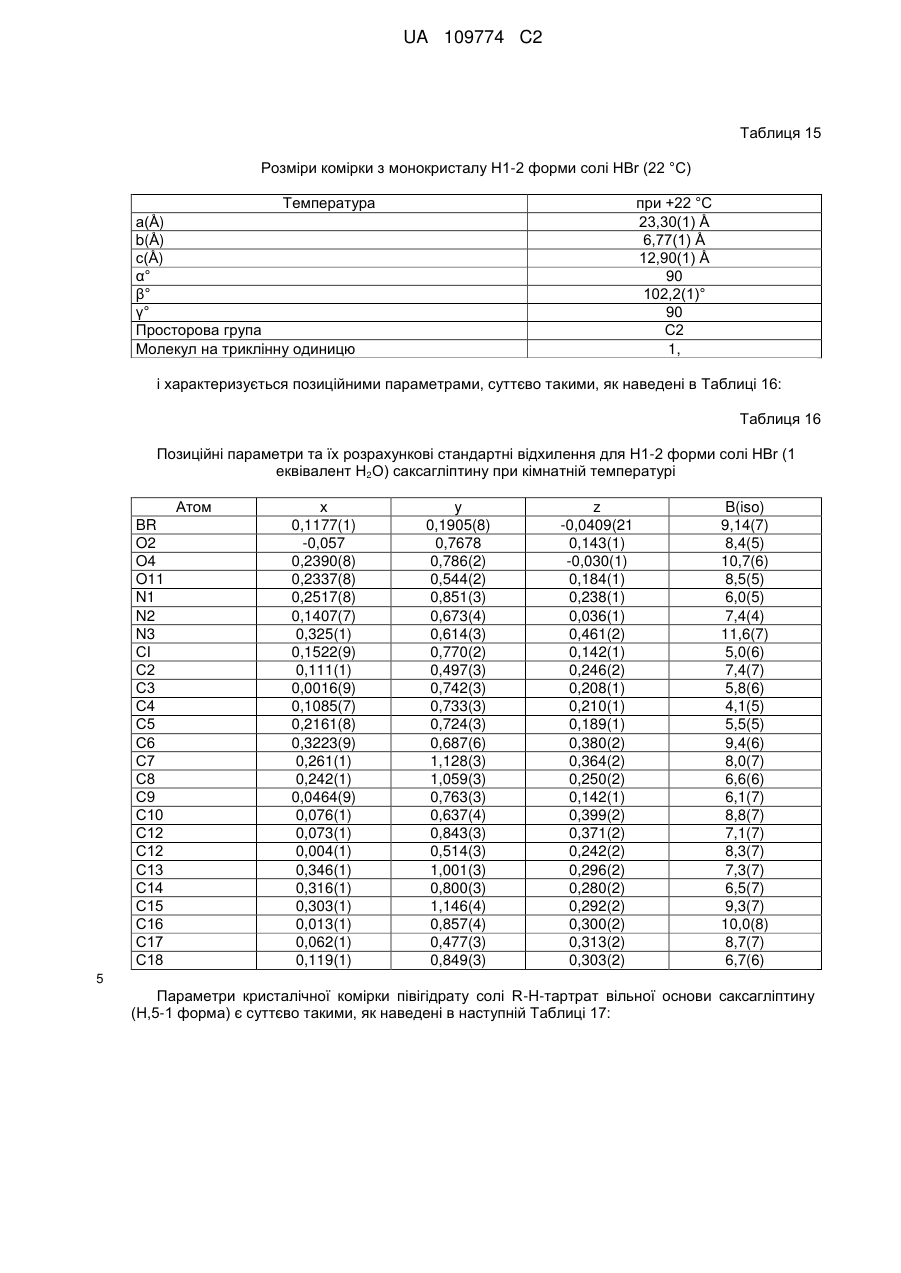
5. Кристалічна форма за пунктом 2, що є моногідратом вільної основи (Н-1 форма), яка характеризується параметрами кристалічної комірки, що є по суті такими, як наступні:
розміри комірки для монокристалу
а=7,270(1) Å,
b=14,234(1) Å,
с=16,929(1) Å,
α=90°,
β=90°,
γ=90°,
просторова група P212121,
молекул на триклінну одиницю: 1,
коли вказана кристалічна форма має температуру близько 22 °С,
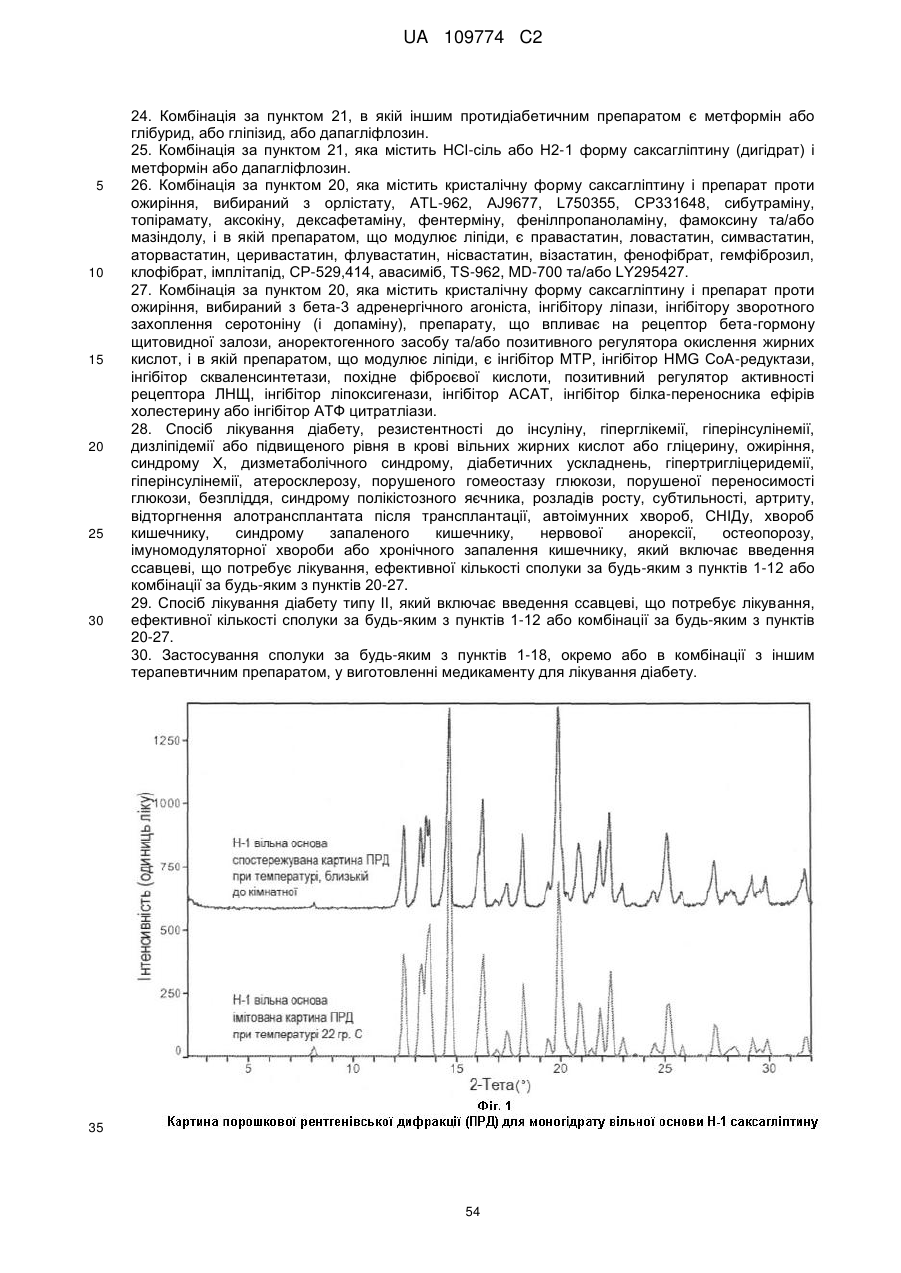
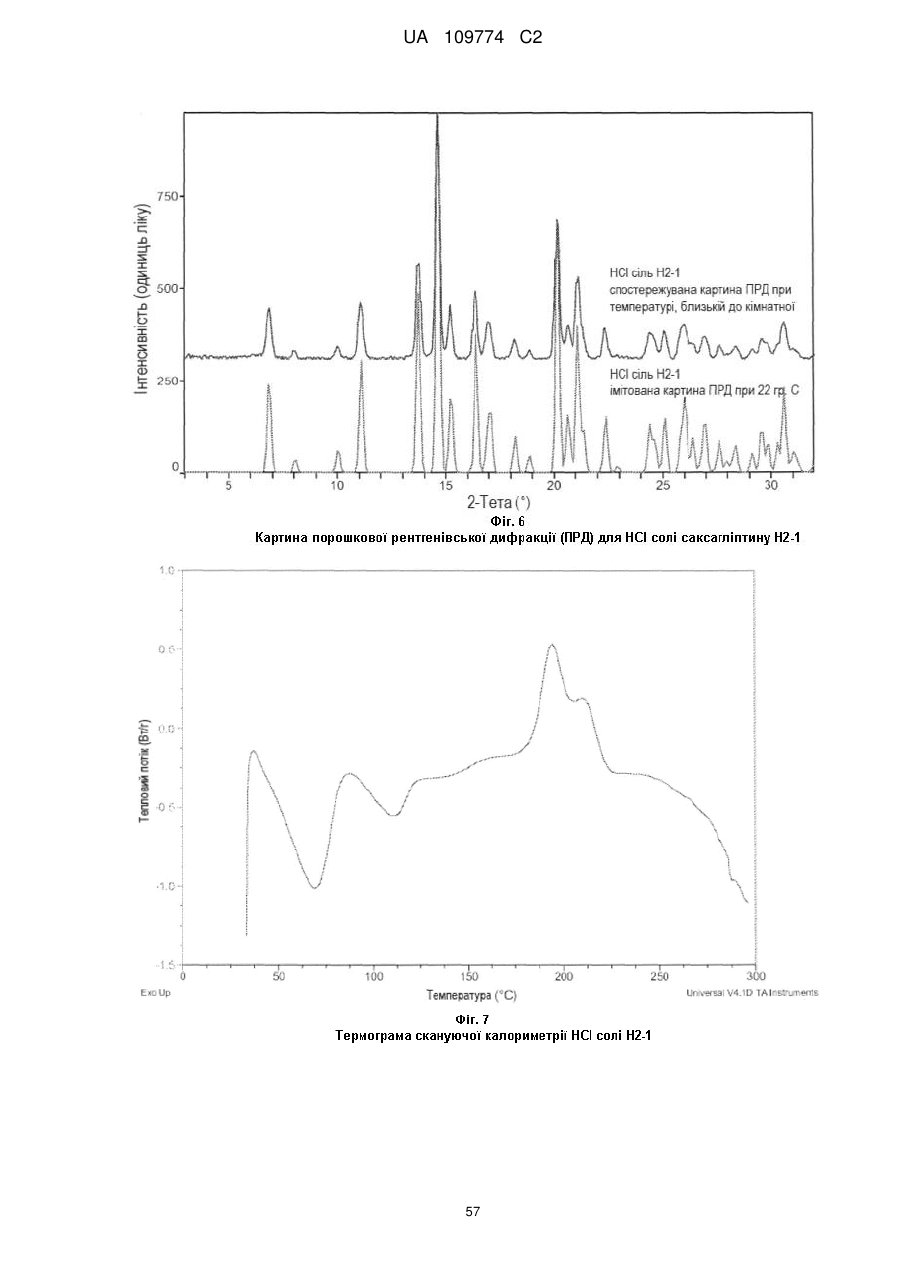
спостережувана і імітована картина порошкової рентгенівської дифракції по суті відповідає тій, яка зображена на Фіг. 1; або
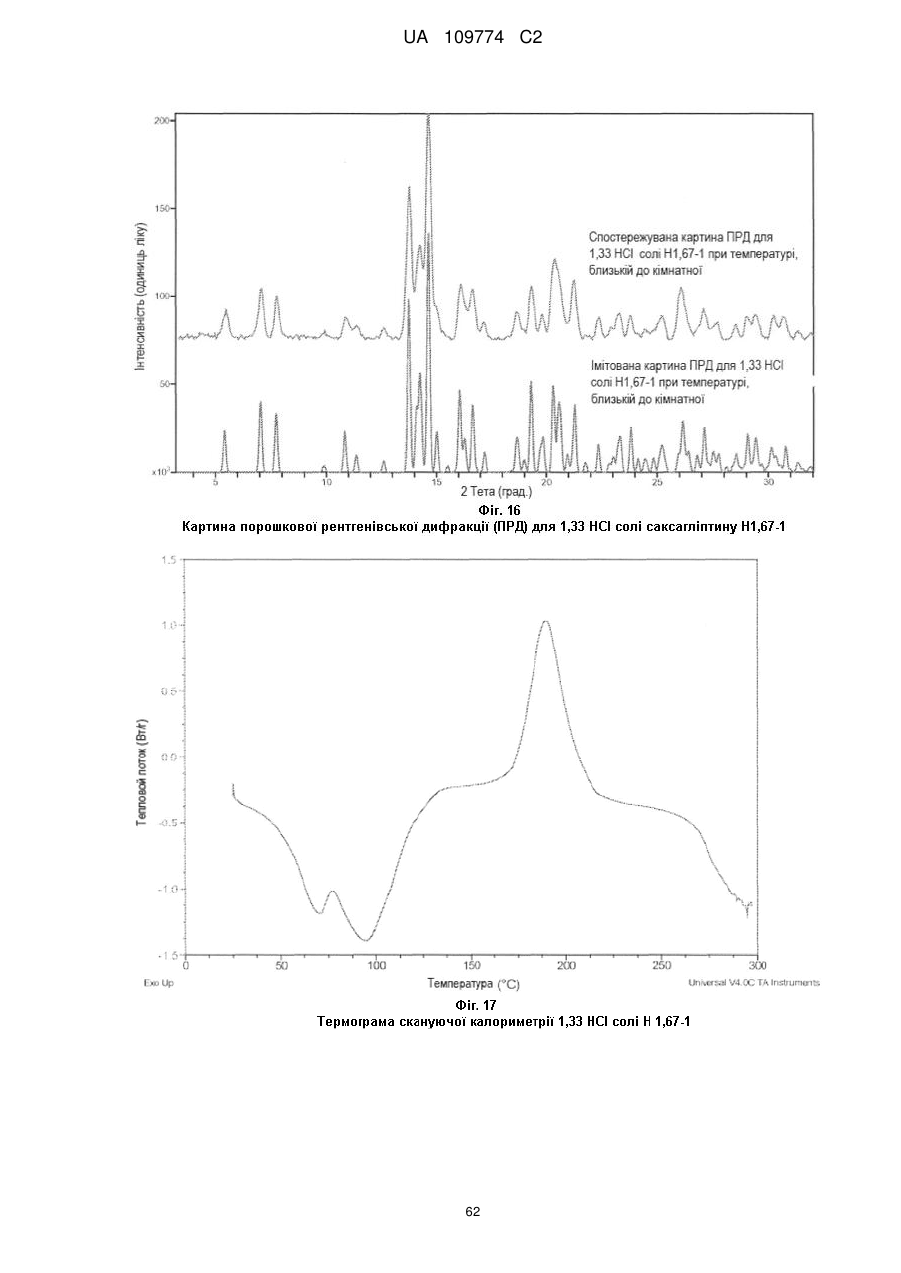
позиції характерних піків картини порошкової рентгенівської дифракції мають наступні значення 2θ (СuKα λ - 1,5418 Å) 12,4±1, 13,3±1, 13,6±1, 14,7±1, 16,2±1, 18,2±1, 19,9±1, 20,9±1, 21,9±1 і 22,4±1 при температурі, близькій до кімнатної; або
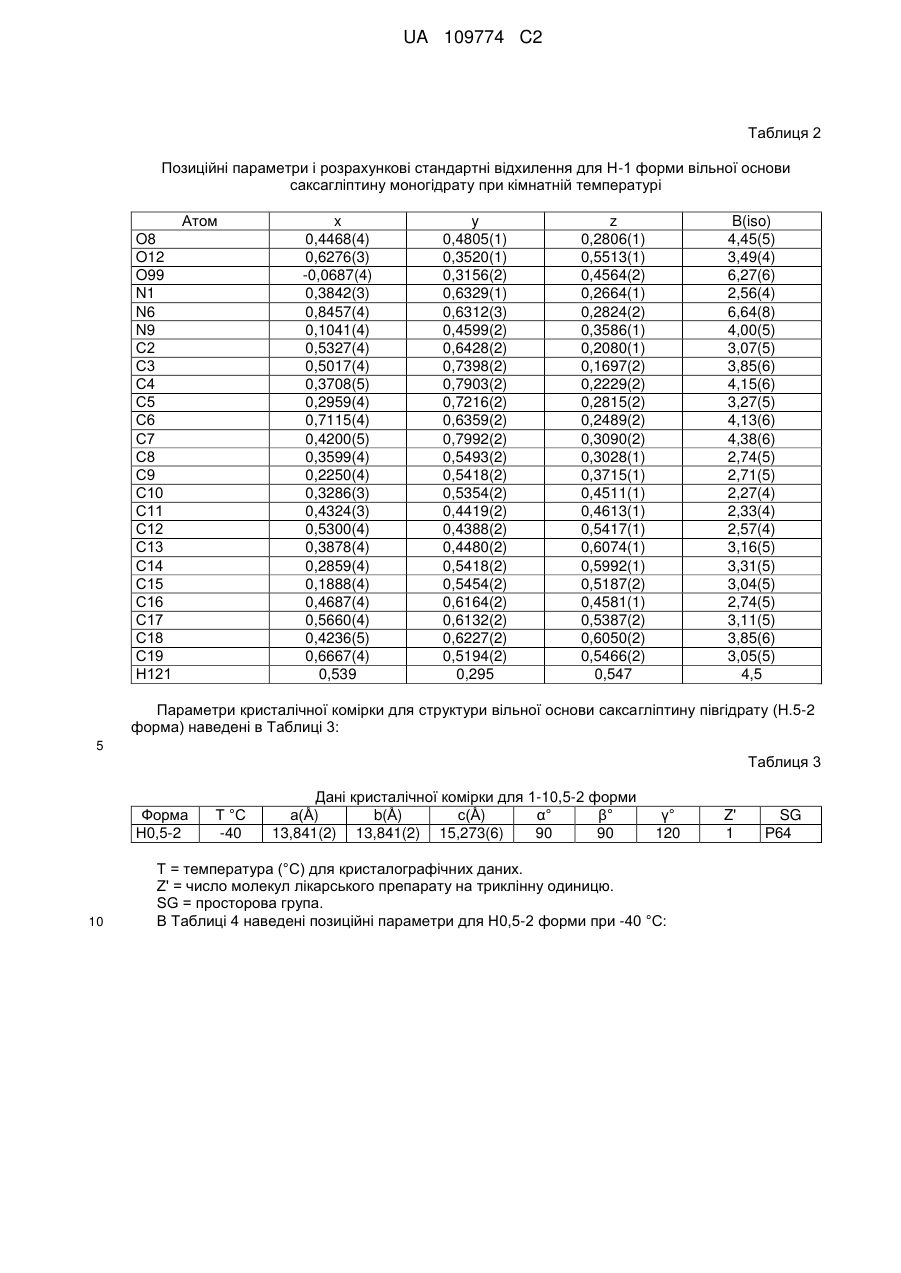
позиційні параметри є по суті такими, як наведені в Таблиці 2; або
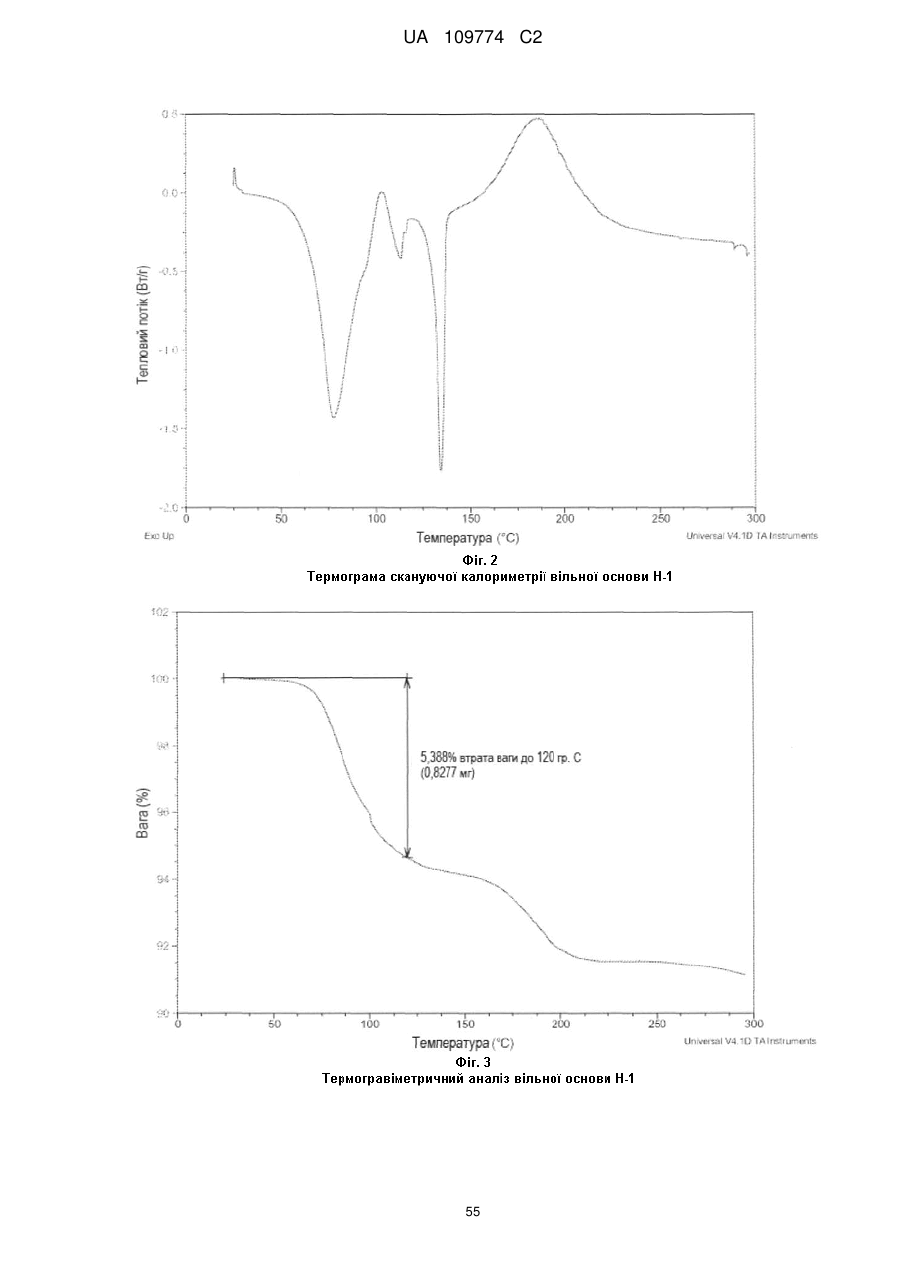
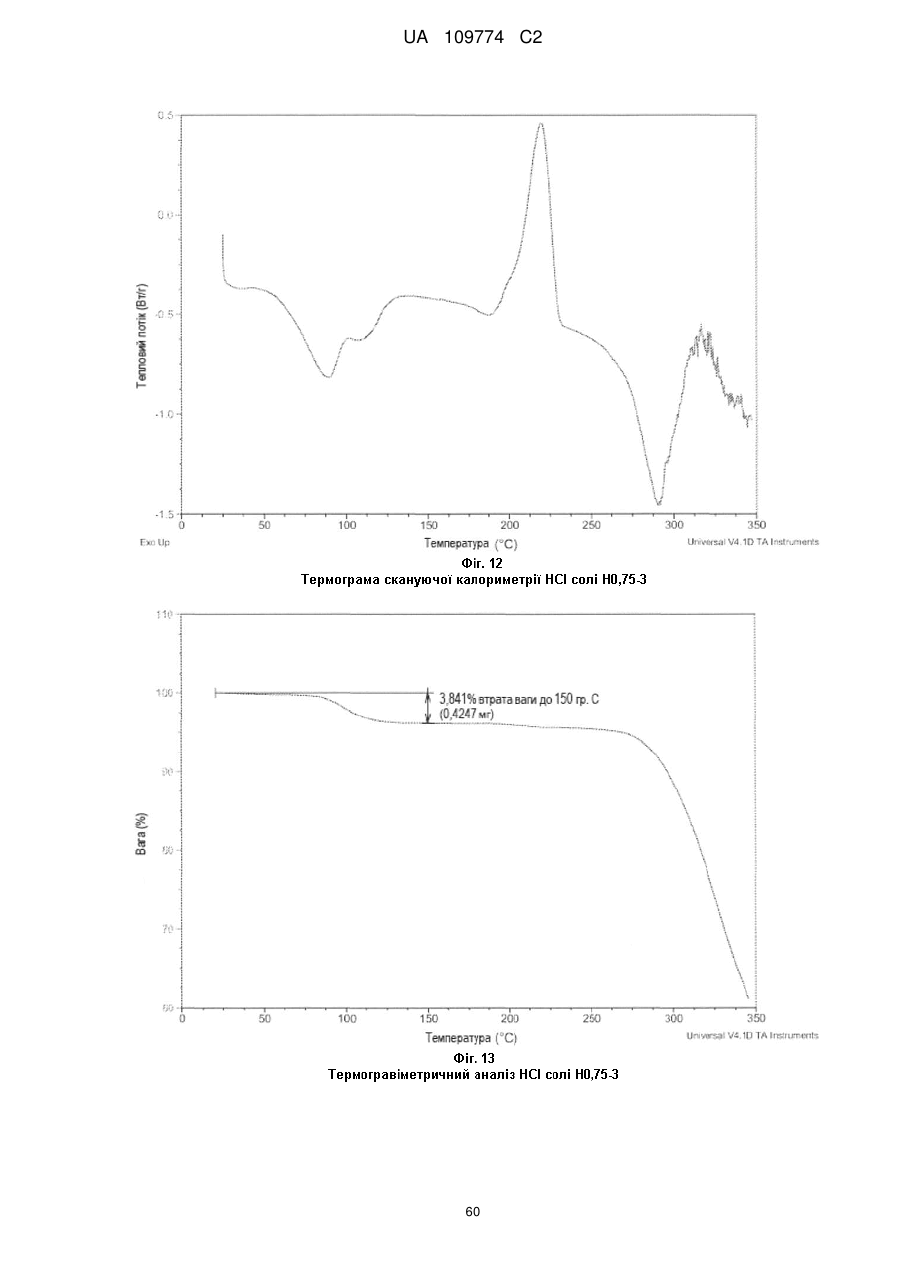
термограма, одержана методом диференційної скануючої калориметрії, по суті відповідає тій, що показана на Фіг. 2, маючи ендотерму в межах від приблизно кімнатної температури до приблизно 120 °С; або
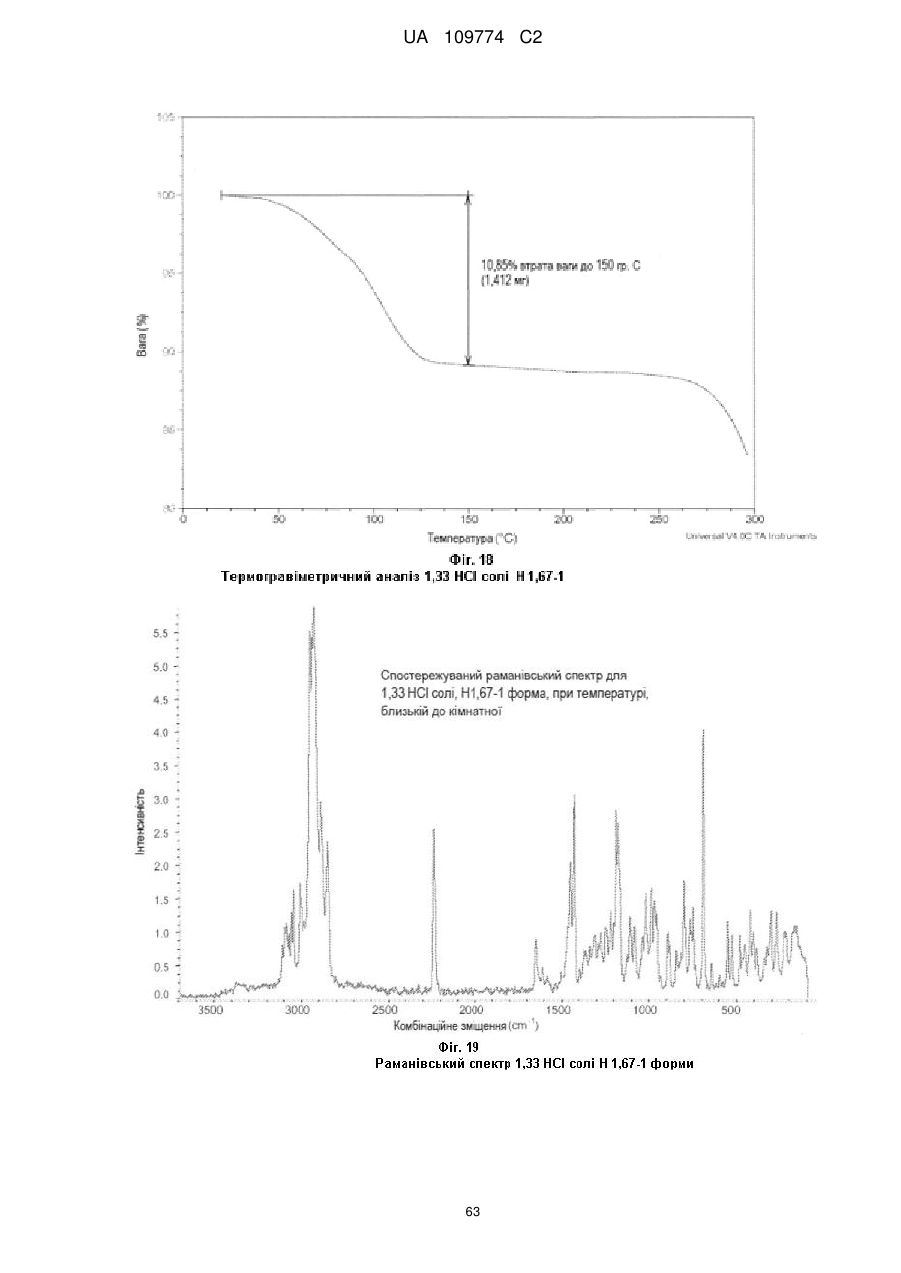
крива термічного гравіметричного аналізу по суті відповідає тій кривій, що показана на Фіг. 3, маючи втрату маси близько 5,4 % до температури близько 120 °С; або
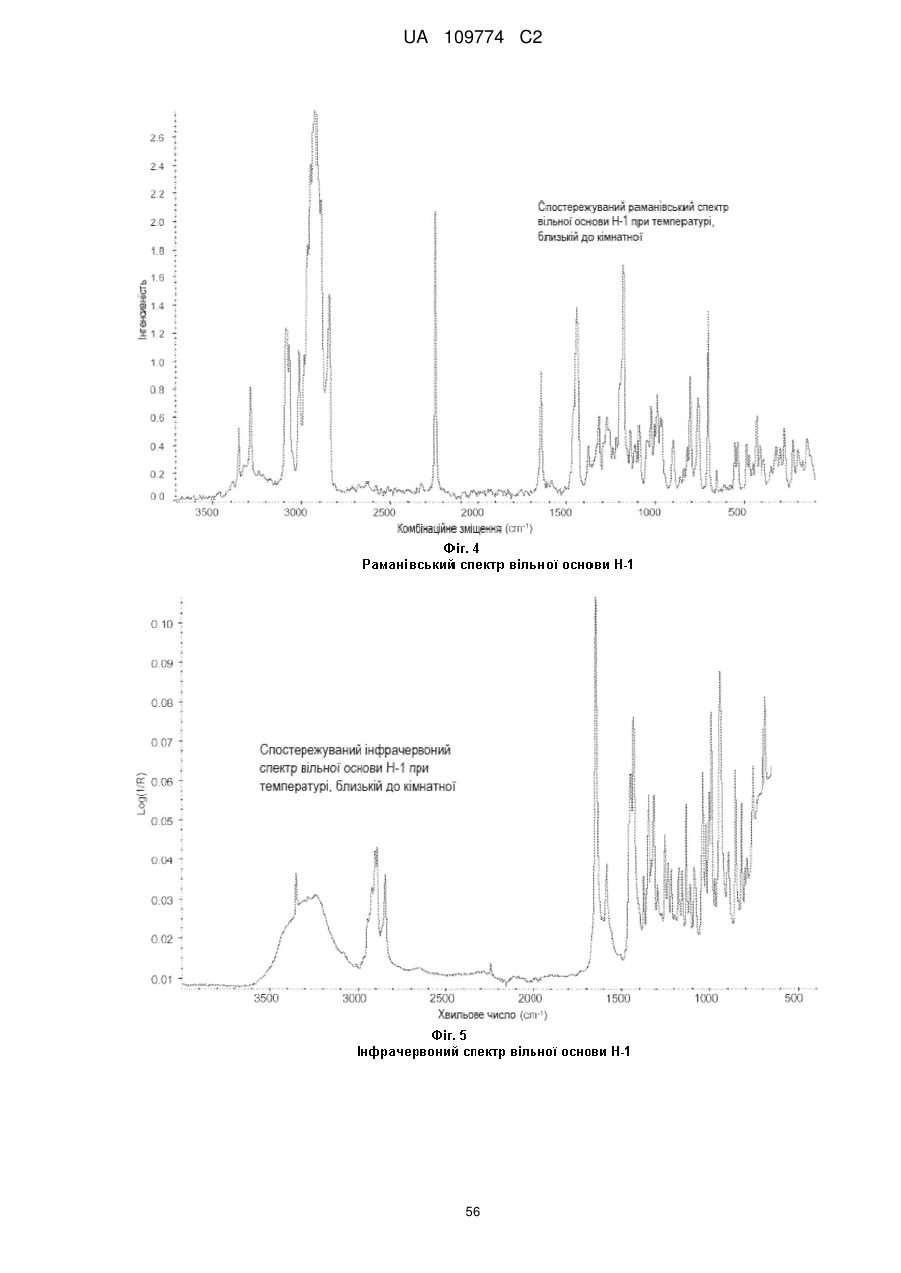
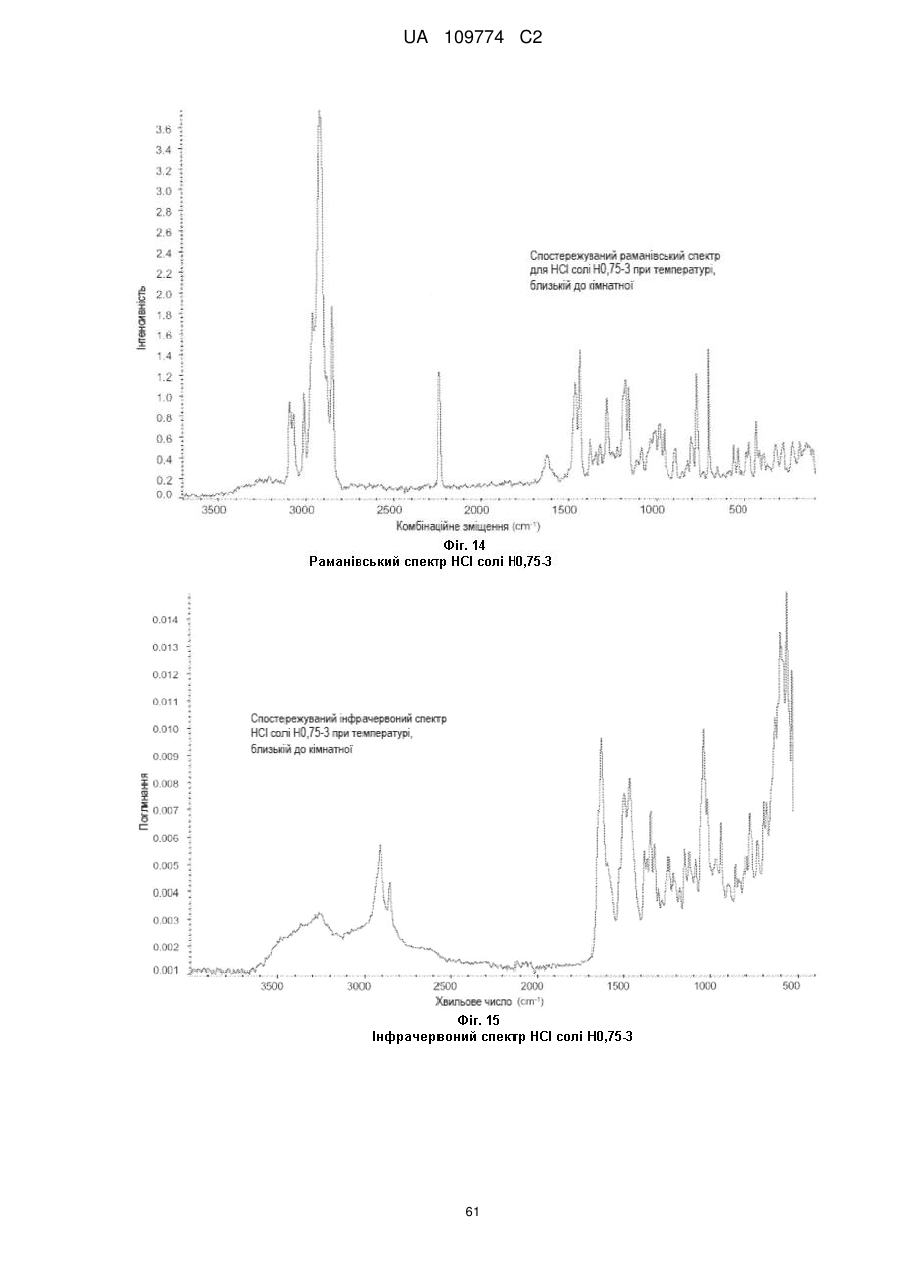
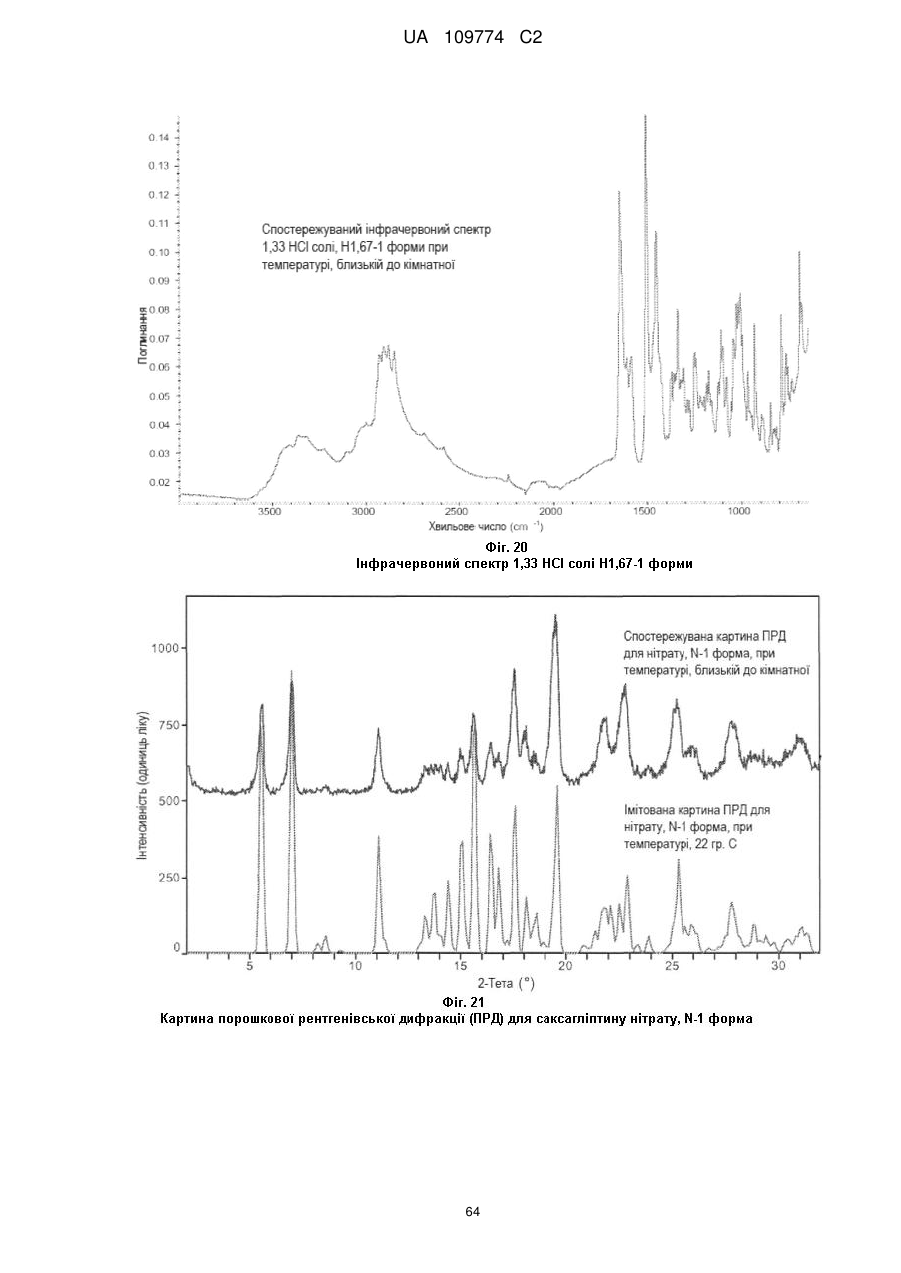
спостережуваний раманівський спектр при кімнатній температурі є по суті таким, як показаний на Фіг. 4; або
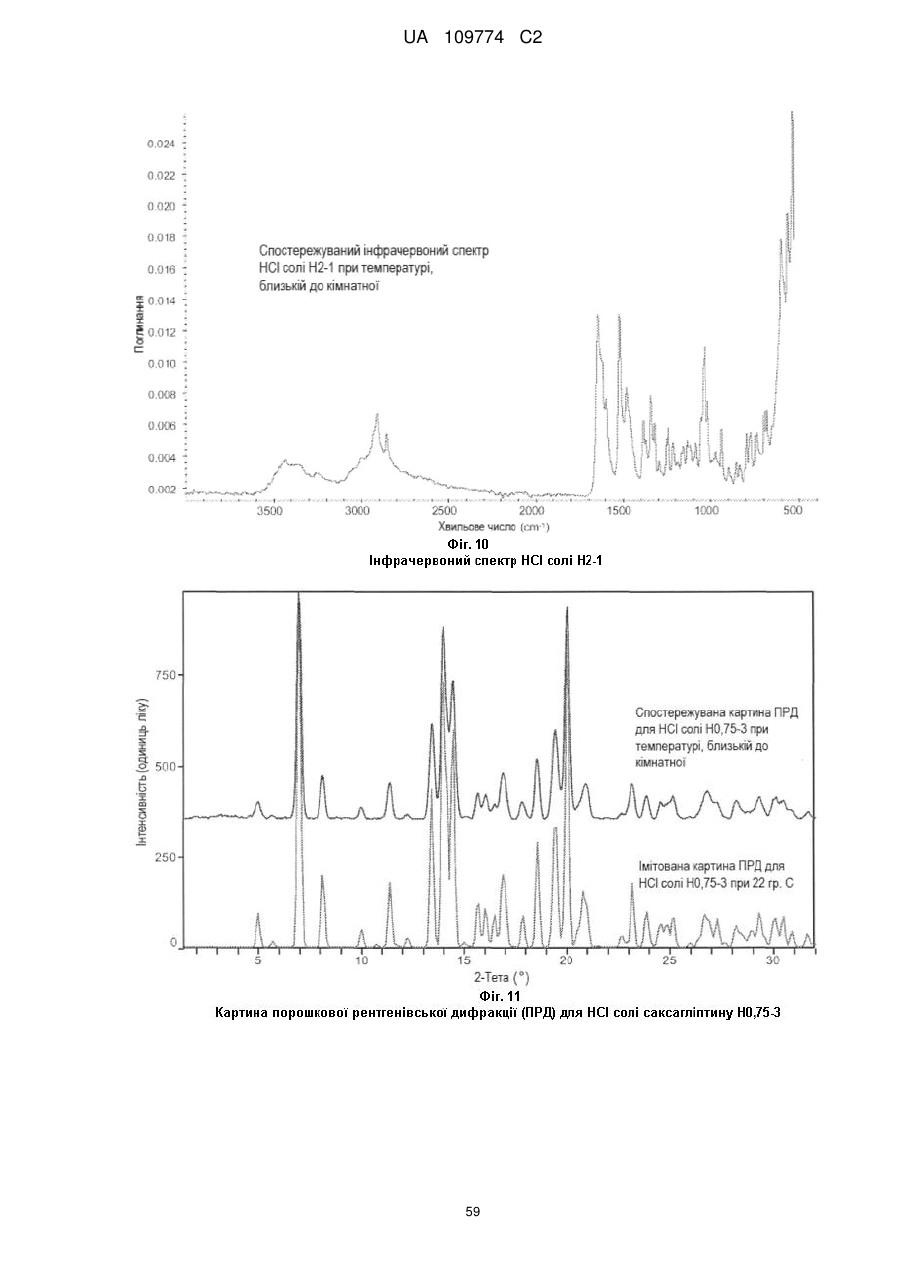
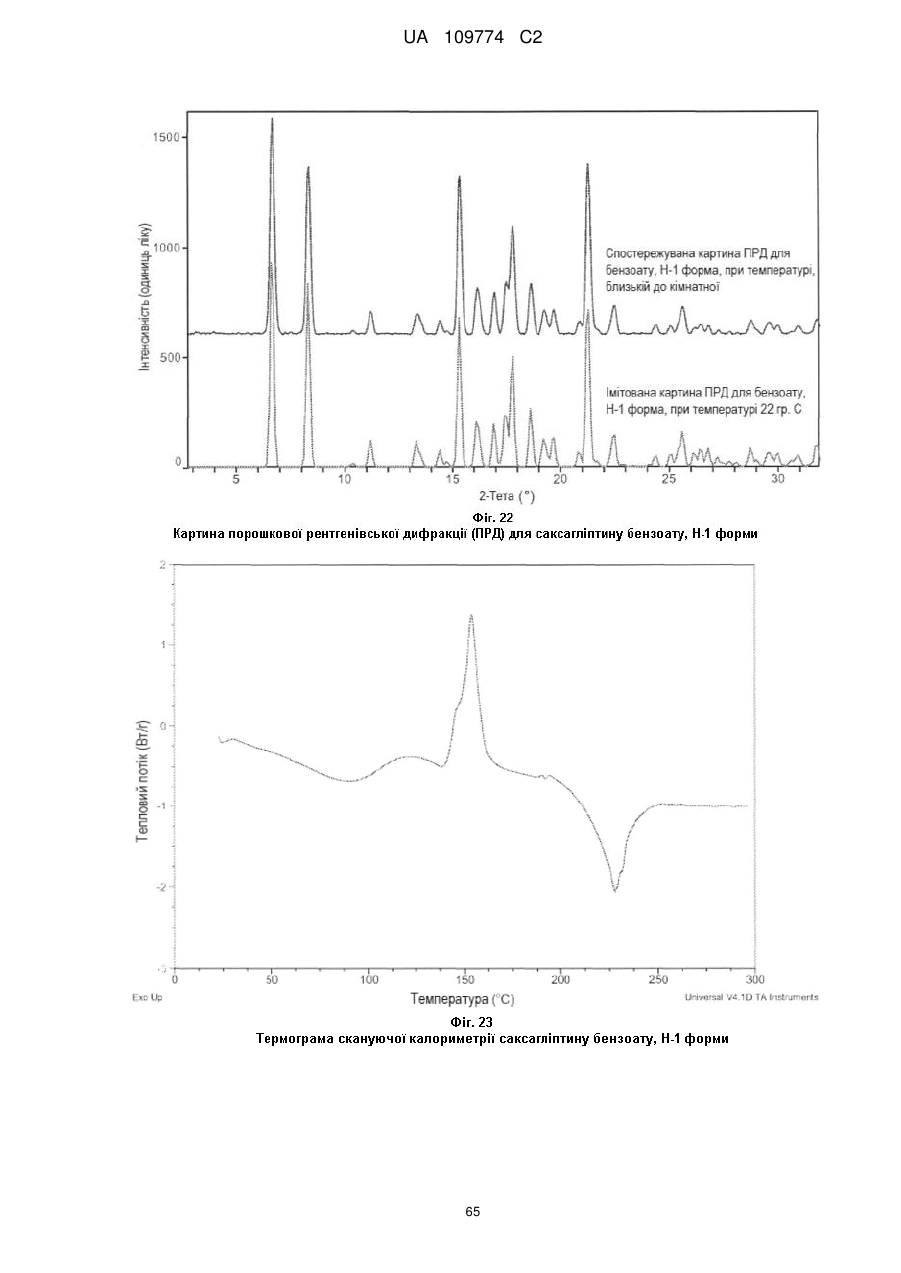
спостережуваний інфрачервоний спектр при кімнатній температурі є по суті таким, як показаний на Фіг. 5; або 0,1 % приріст маси в межах 25-75 % відносної вологості при 25 °С.
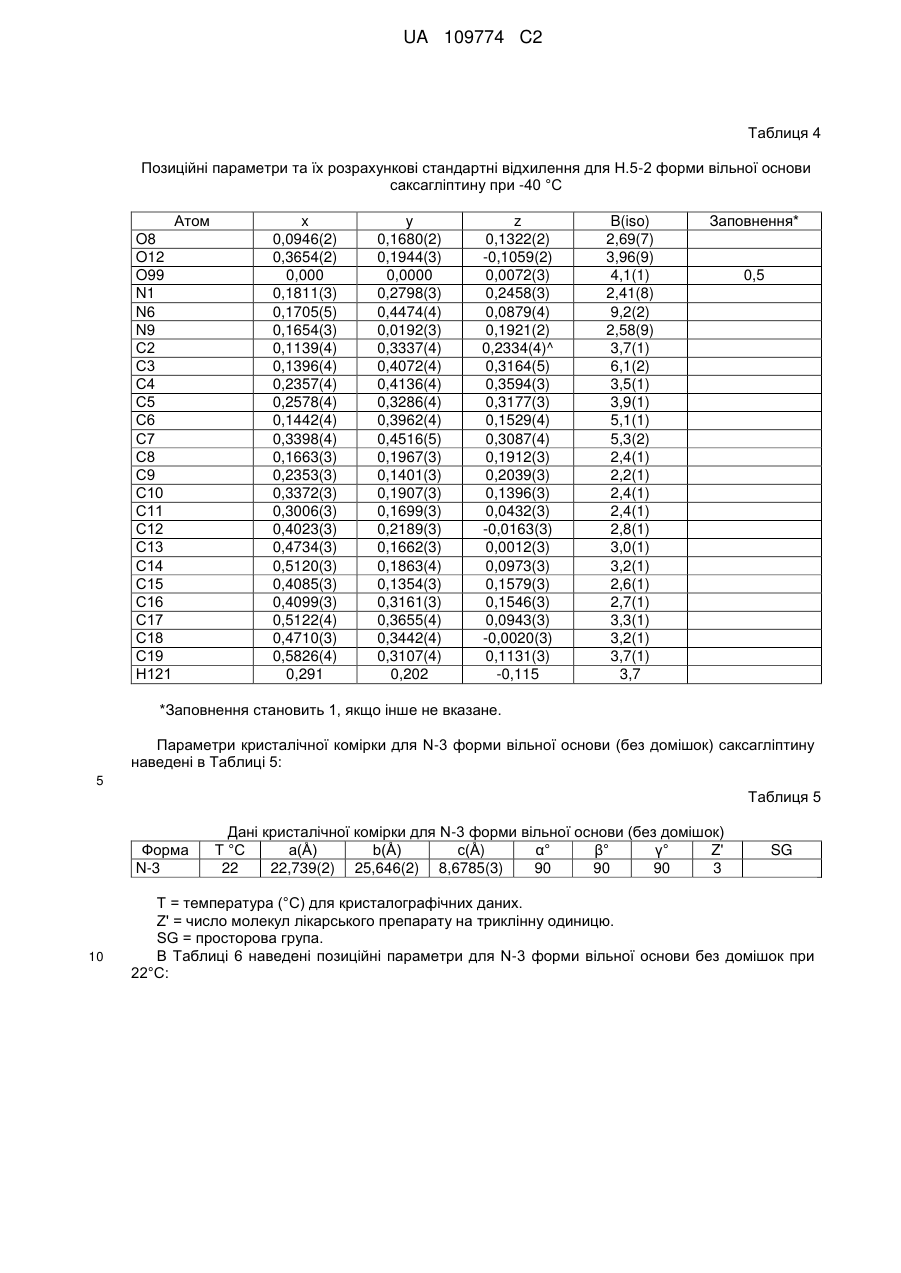
6. Кристалічна форма за пунктом 2, що є півгідратом вільної основи (Н0,5-2), що характеризується параметрами кристалічної комірки, по суті такими, як наступні:
Розміри комірки
а(Å)
13,841(2)
b(Å)
13,841(2)
с(Å)
15,273(6)
α°
90
β°
90
γ°
120
Просторова група
Р64
Молекул на триклінну одиницю
1
Коли кристалічна форма має температуру близько
-40 °С,
або яка характеризується дробовими атомними координатами, що є по суті такими, як наведені в Таблиці 2 (Н0,5-2 форма).
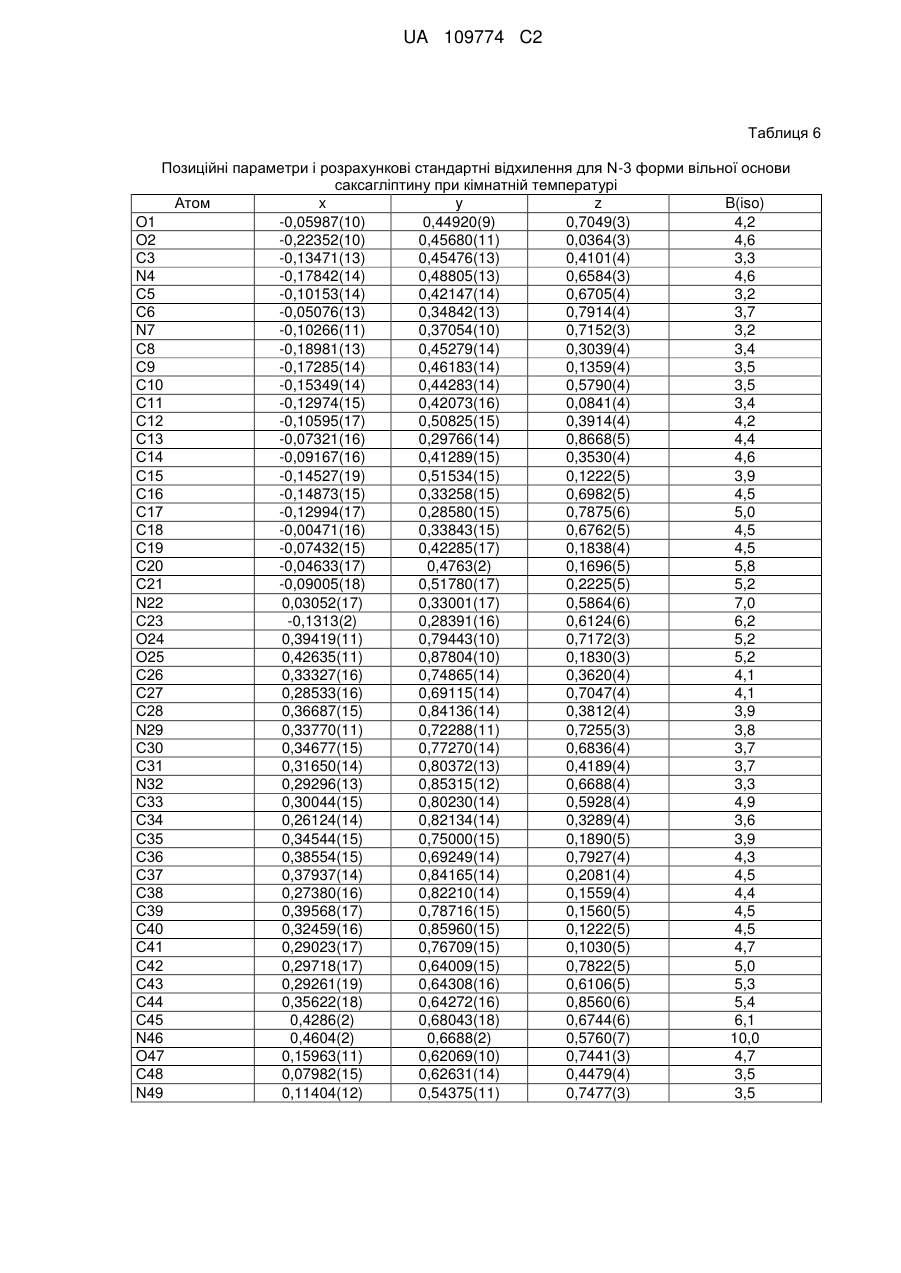
7. Кристалічна форма за пунктом 2, що є вільною основою (N-3 форма), що характеризується параметрами кристалічної комірки, по суті такими, як наступні:
розміри комірки для монокристалу
а=22,739(2) Å,
b=25,646(2) Å,
с=8,6785(3) Å,
α=90°,
β=90°,
γ=90°,
просторова група Р212121,
молекул на триклінну одиницю: 3,
коли вказана кристалічна форма має температуру близько 22 °С,
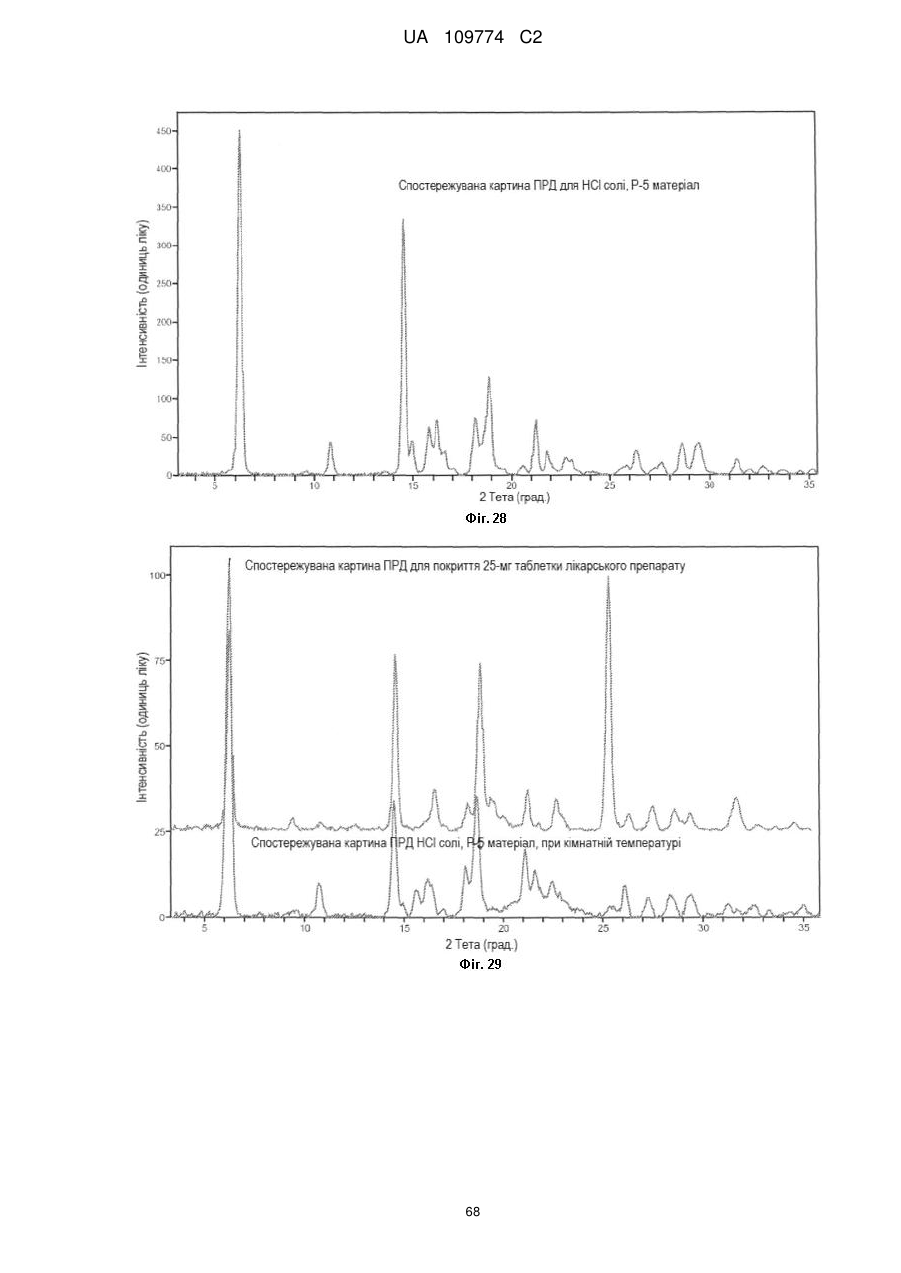
спостережувана і імітована картина порошкової рентгенівської дифракції по суті відповідає тій, яка зображена на Фіг. 25; або
позиції піків порошкової дифракції показані в Таблиці А; або
позиційні параметри є по суті такими, як наведені в Таблиці 5; або
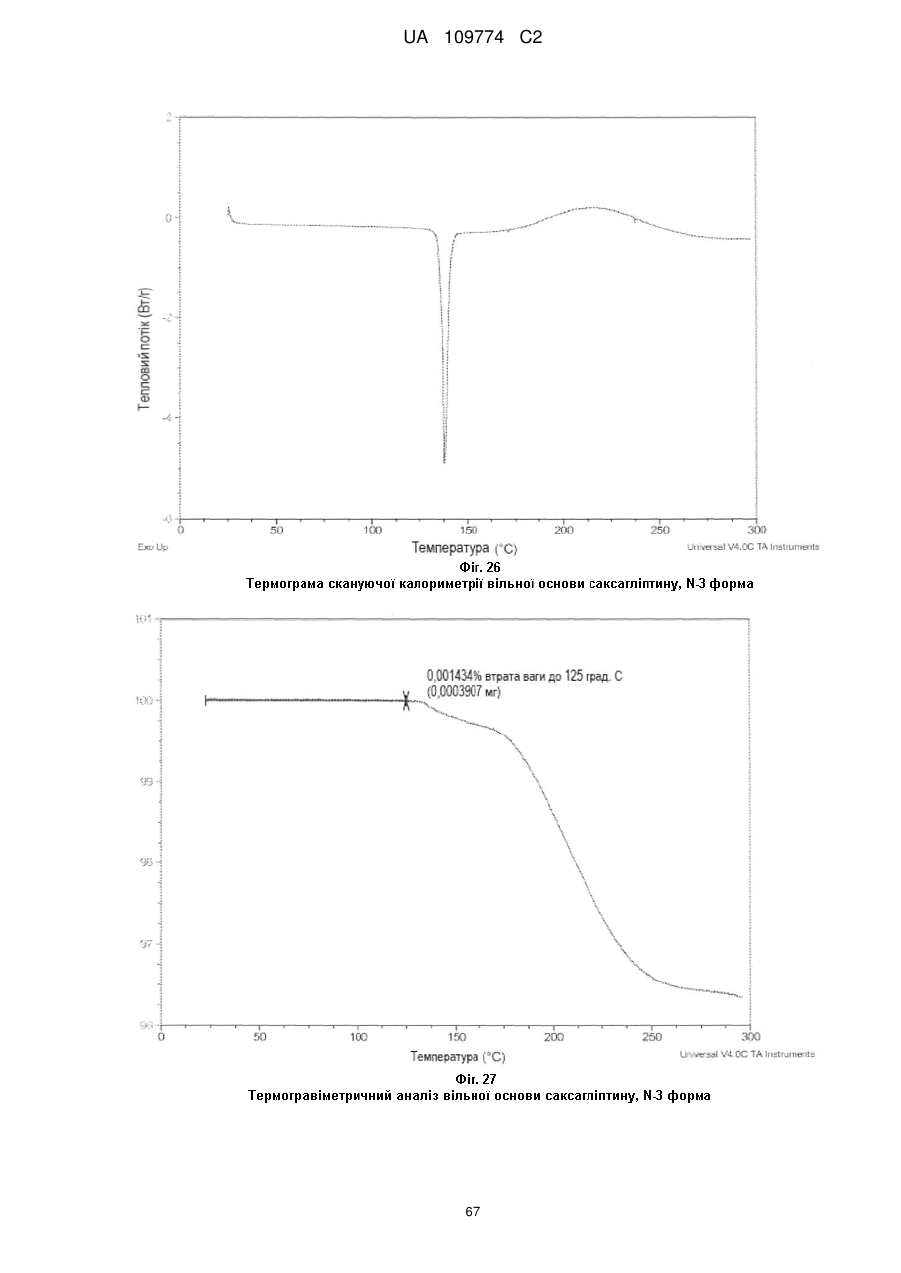
термограма, одержана методом диференційної скануючої калориметрії, по суті відповідає тій, що показана на Фіг. 26; або
крива термічного гравіметричного аналізу (TGA) по суті відповідає тій кривій, що показана на Фіг. 27.
8. Кристалічна форма за пунктом 4, що є трифторацетатною сіллю вільної основи (N-1 форма), яка характеризується параметрами кристалічної комірки, по суті такими, як наступні:
розміри комірки для монокристалу солі TFA (N-1 форма)
а=11,631(2) Å,
b=6,599(1) Å,
с=13,838(1) Å,
α=90°,
β=104,24(1)°,
γ=90°,
просторова група Р21,
молекул на триклінну одиницю: 1;
коли вказана кристалічна форма має температуру близько +22 °С;
або характеризується позиційними параметрами, по суті такими, як наведені в Таблиці 26.
9. Кристалічна форма за пунктом 4, що є дигідратом трифторацетатної солі вільної основи (Н2-2 форма), що характеризується параметрами кристалічної комірки, по суті такими, як наступні:
розміри комірки монокристалу TFA-солі (Н2-2 форма) (2Н2О)
а=11,935(2) Å,
b=7,665(2) Å,
с=13,386(1) Å,
α=90°,
β=114,61(1)°,
γ=90°,
просторова група Р21,
молекул на триклінну одиницю: 1;
коли вказана кристалічна форма має температуру близько +22 °С;
або характеризується позиційними параметрами, по суті такими, як наведені в Таблиці 28.
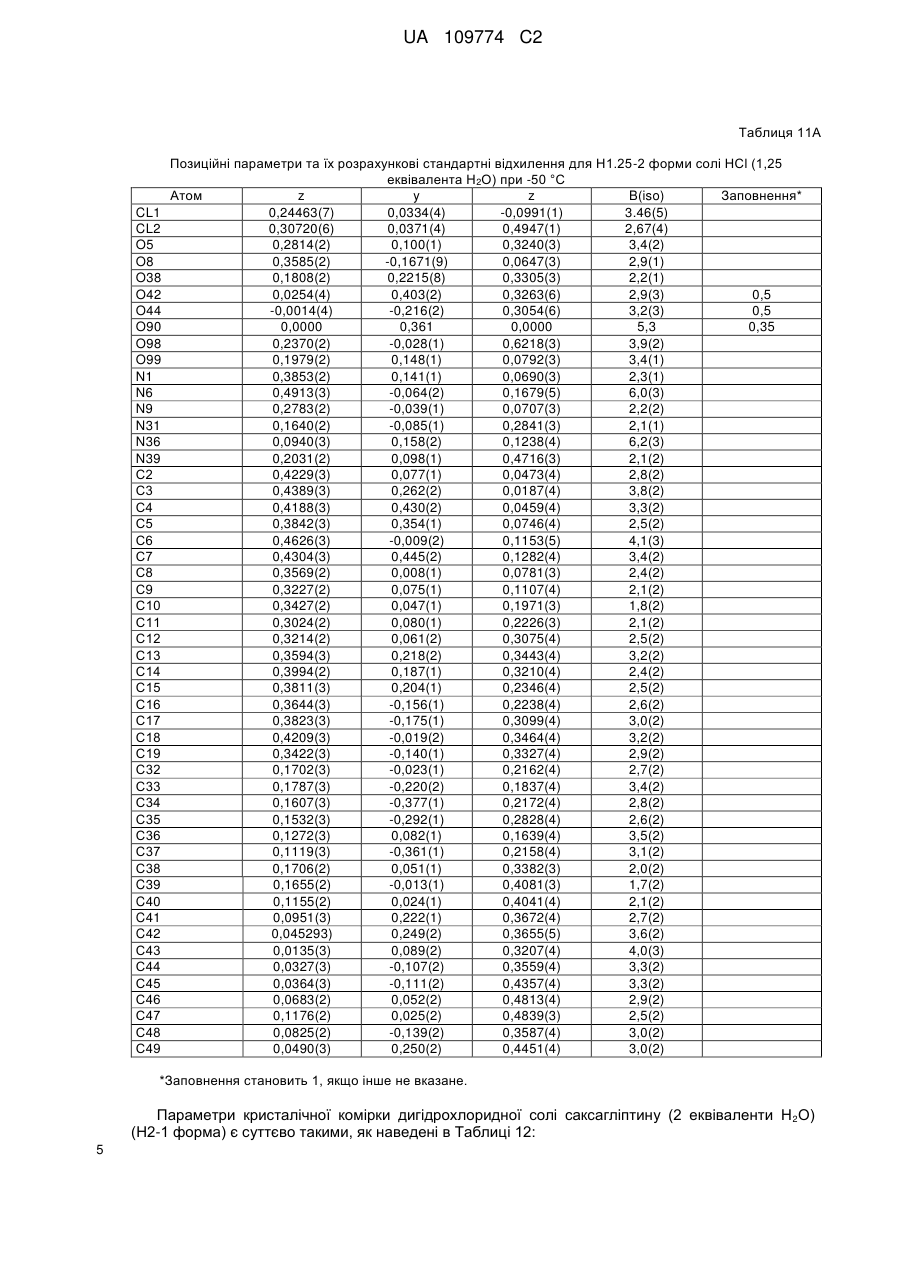
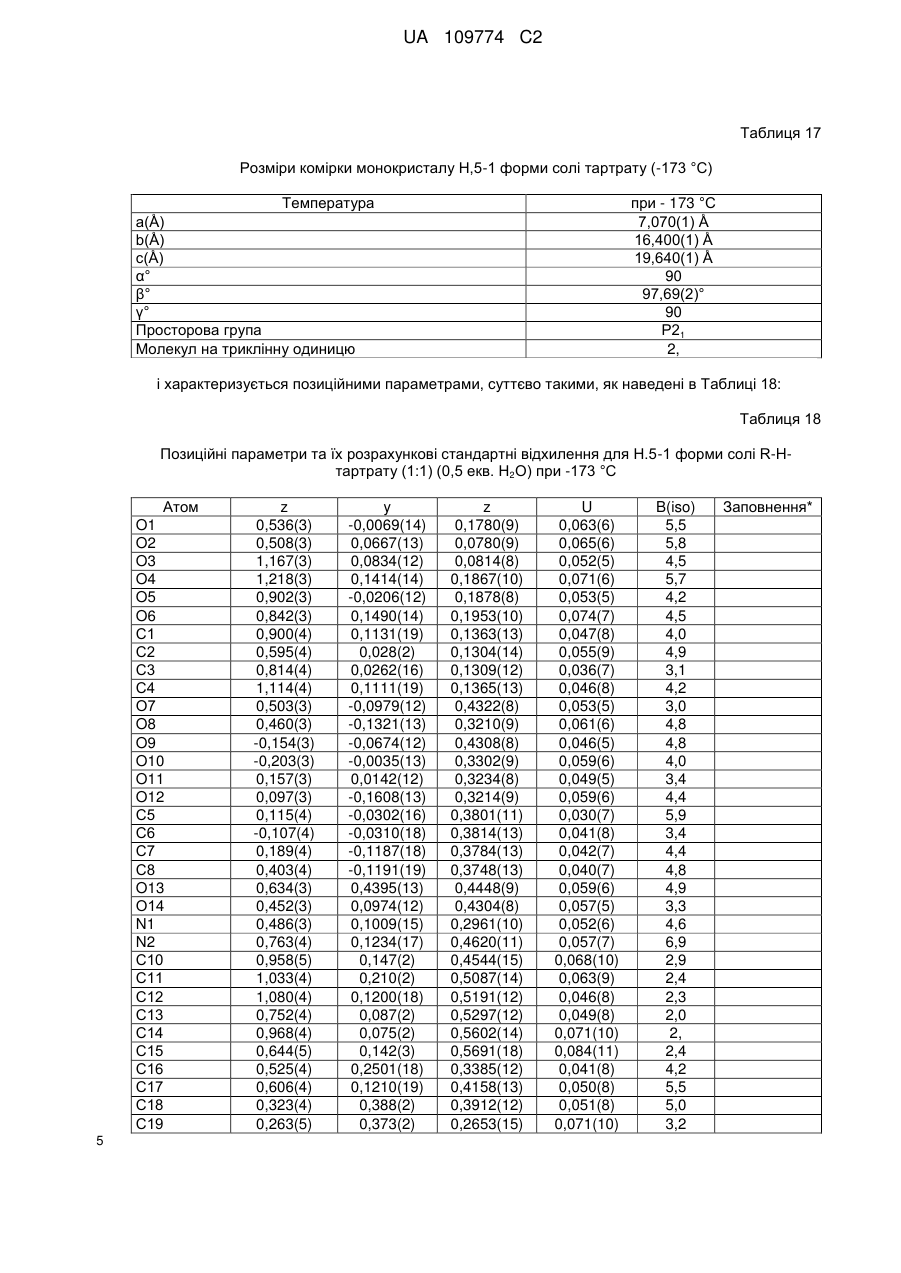
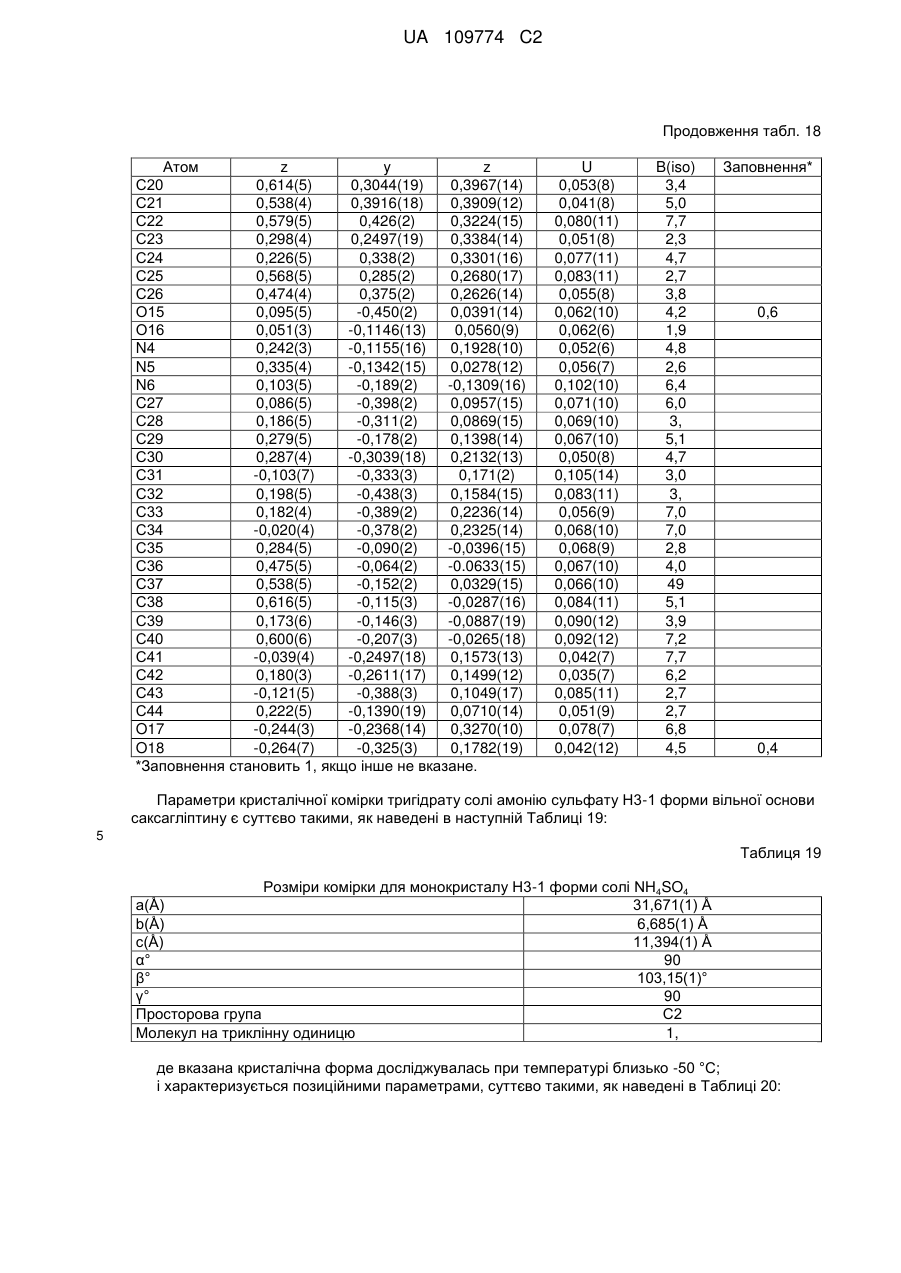
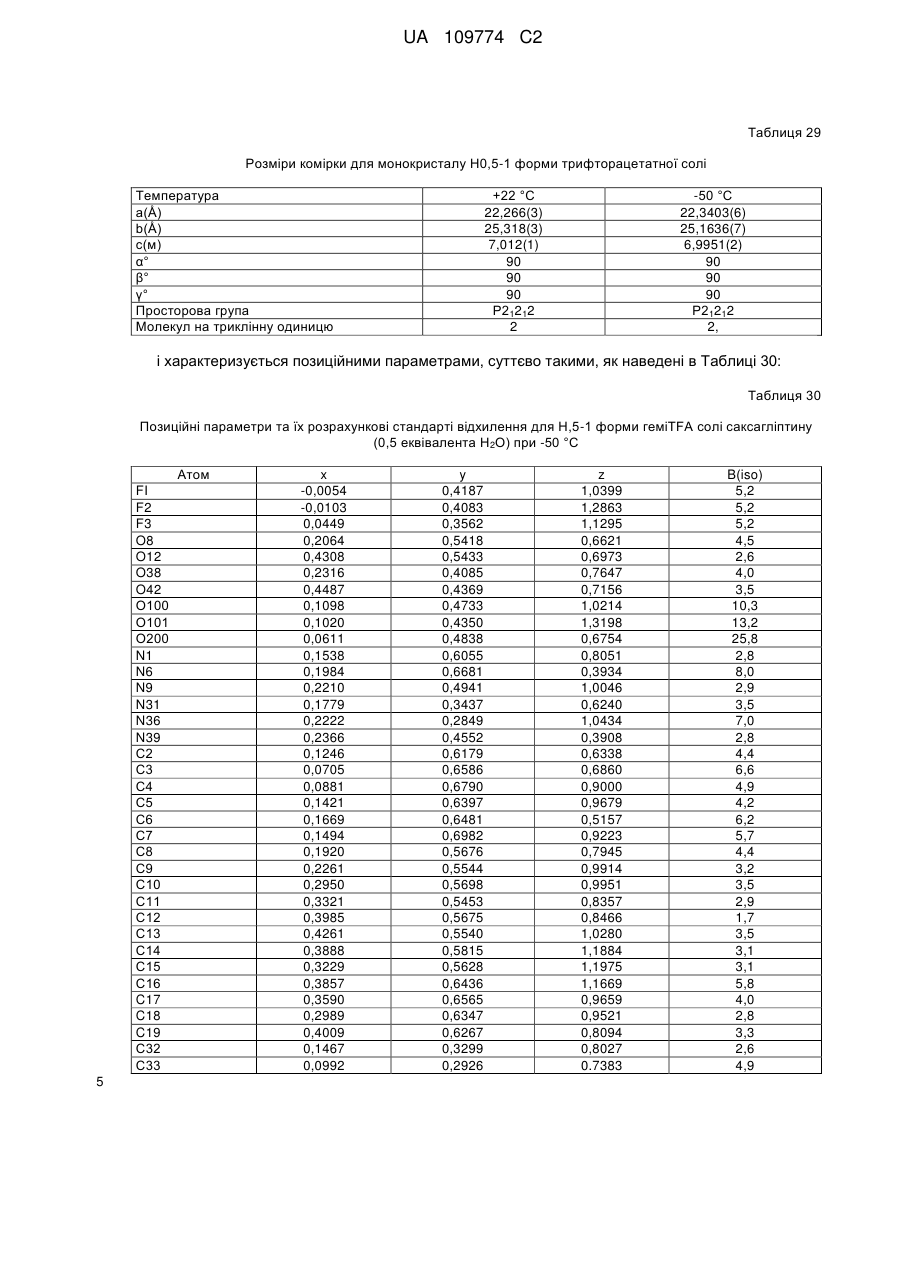
10. Кристалічна форма за пунктом 4, що є півгідратом півтрифторацетатної солі вільної основи Н.5-1 форми, що характеризується параметрами кристалічної комірки, по суті такими, як наступні:
Розміри комірки для монокристалу (Н.5-1 форма) (0,5 Н2О)
Температура °С
При +22 °С
При -50 °С
а(Å)
22,266(3)
22,3403(6)
b(Å)
25,318(3)
25,1636(7)
с(Å)
7,012(1)
6,9951(2)
α°
90
90
β°
90
90
γ°
90
90
просторова група Р21212,
молекул на триклінну одиницю: 2,
коли вказана кристалічна форма має температуру близько -50 °С;
або характеризується позиційними параметрами, по суті такими, як наведені в Таблиці 30.
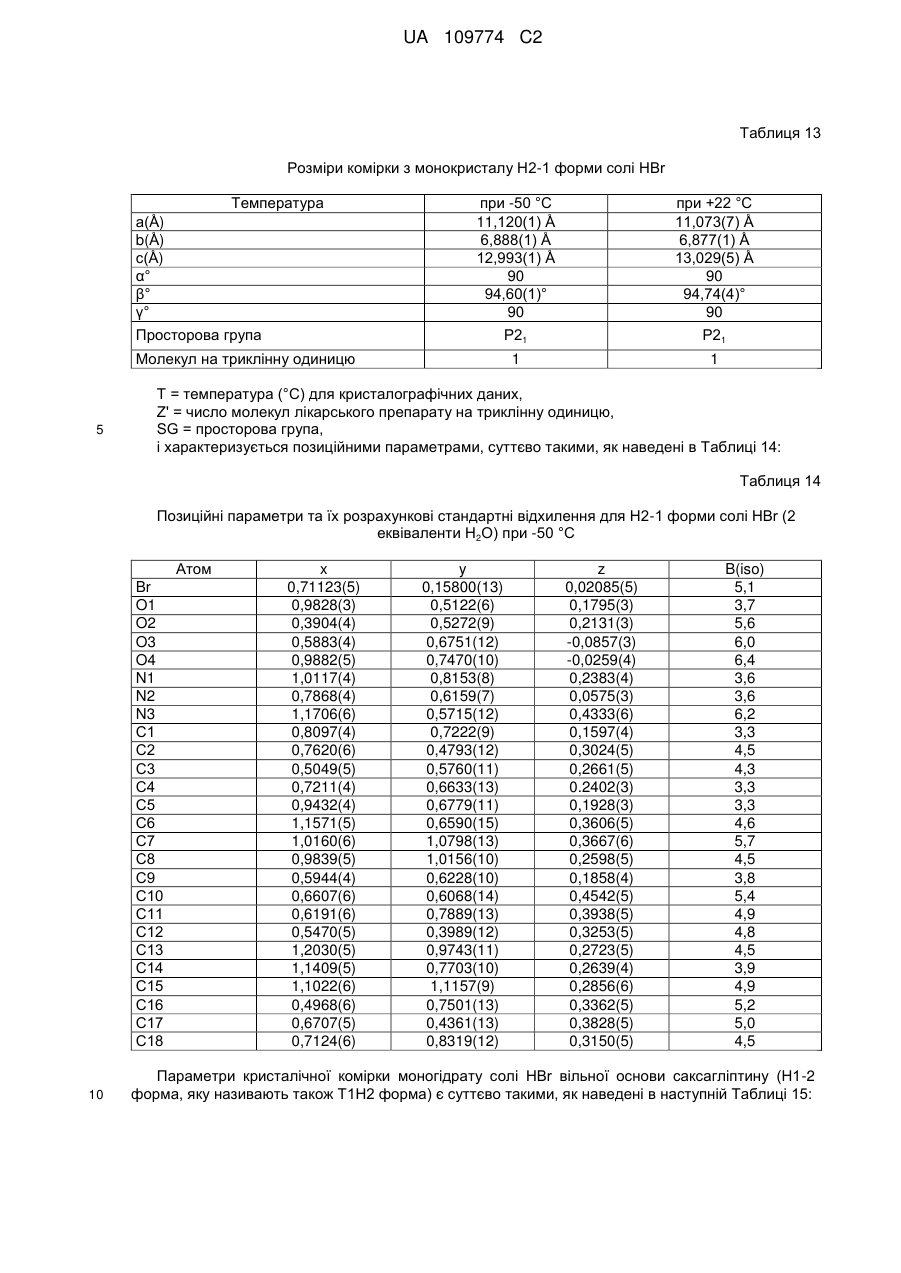
11. Кристалічна форма за пунктом 4, що є гідратованою сіллю бензоату вільної основи (Н-1 форма), що містить 1 еквівалент Н2О і характеризується параметрами кристалічної комірки, по суті такими, як наступні:
Розміри комірки для монокристалу
Температура °С
При -40 °С
При +22 °С
а(Å)
6,4065(2)
6,4316(2)
b(Å)
16,9843(4)
17,0611(4)
с(Å)
21,2504(5)
21,3010(5)
α°
90
90
β°
90
90
γ°
90
90
Просторова група
P212121
P212121
Молекул на триклінну одиницю
1
1,
або тим, що спостережувана і імітована картина порошкової рентгенівської дифракції по суті відповідає тій, яка зображена на Фіг. 22; або
позиції характерних піків картини порошкової рентгенівської дифракції мають наступні значення 2θ (СuKα λ - 1,5418 Å) 6,6±1, 8,3±1, 15,3±1, 16,1±1, 16,9±1, 17,5±1, 17,8±1, 18,6±1 і 21,3±1 при температурі, близькій до кімнатної; або
термограма, одержана методом диференційної скануючої калориметрії, по суті відповідає тій, що показана на Фіг. 23, маючи ендотерму в межах від приблизно кімнатної температури до приблизно 120 °С; або
крива термічного гравіметричного аналізу по суті відповідає тій кривій, що показана на Фіг. 24, маючи втрату маси близько 3,94 % до температури близько 120 °С.
12. Кристалічна форма за пунктом 1 і як її представлено далі:
В = основа = саксагліптин
Назва форми
Препарат(и) в триклінній одиниці
Інші сполуки в триклінній одиниці
Н4-1
2(ВН+) фумарат=
4 Н2О
Н.5-1
2(ВН+R-H-тартрат-)
1 Н2О
Н-1
ВН+бензоат-
1 Н2О
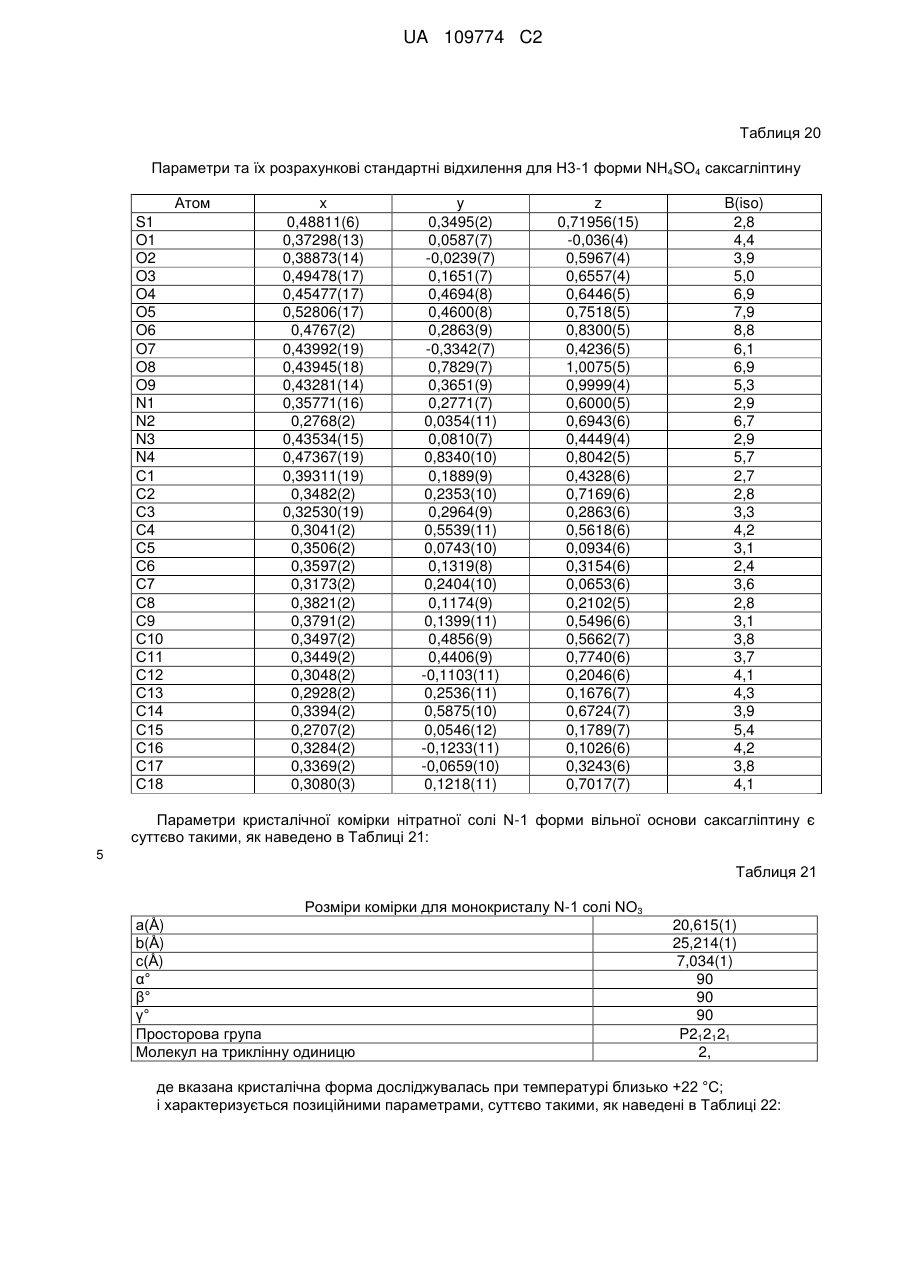
N-1
BH+NO3-
Немає
N-1
ВН+TFA-
Немає
Н2-2
ВН+TFA-
2 Н2О
Н.5-1
**
(ВН+TFA-)+В
1 Н2О
Н-1
В
1 Н2О
Н.5-2
В
0,5 Н2О
N-3
3 В
Немає
** "гіперосновна сіль" - менше ніж одна TFA на препарат.
13. Фармацевтична композиція, яка містить кристалічну форму за будь-яким з пунктів 1-12 і фармацевтично прийнятний носій для неї.
14. Кристалічна форма сполуки за будь-яким з пунктів 1-12 для застосування в лікуванні цукрового діабету.
15. Процес одержання кристалічного саксагліптину у формі моногідрату його вільної основи Н-1 форми за пунктом 2, у якому:
(а) забезпечують Вос-захищену форму саксагліптину, що має структуру
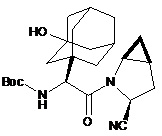 , IA
, IA
(b) розчиняють захищений саксагліптин з етапу (а) в органічному розчиннику;
(c) проводять реакцію розчину з етапу (b) з сильною мінеральною кислотою;
(d) необов'язково, додають органічний розчинник до реакційної суміші з етапу (с);
(e) охолоджують реакційну суміш до температури в межах від приблизно 5 до приблизно 35 °С;
(f) обробляють охолоджену суміш з етапу (e) основою;
(g) фільтрують суміш з етапу (f) для відділення твердої речовини від фільтрату;
(h) необов'язково, промивають тверду речовину органічним розчинником;
(і) об'єднують і концентрують фільтрат;
(j) при необхідності, додають до фільтрату воду;
(k) перемішують фільтрат до утворення кристалів;
(l) необов'язково, повторюють етап (j);
(m) необов'язково, перемішують фільтрат; і
(n) виділяють кристали вільної основи саксагліптину моногідрату (Н-1 форма) у по суті чистому вигляді.
16. Процес одержання кристалічного саксагліптину у формі моногідрату його вільної основи (Н-1 форма) за пунктом 2, у якому:
(a) забезпечують Вос-захищений саксагліптин ІА;
(b) проводять реакцію між Вос-захищеним саксагліптином ІА в органічному розчиннику і спиртовому розчиннику з соляною кислотою з утворенням водної фази і органічної фази;
(c) відділяють водну фазу;
(d) змішують водну фазу з органічним розчинником і водою, а потім з сильною основою для регулювання рН в межах від приблизно 8,8 до приблизно 10,8;
(e) додають до реакційної суміші натрію хлорид;
(f) перемішують реакційну суміш для утворення водної фази і органічної фази;
(g) необов'язково, промивають органічний шар розчином розсолу для утворення водного шару і органічного шару;
(h) обробляють органічний шар органічним розчинником з відгонкою частини цього органічного розчинника;
(і) фільтрують продукт перегонки, що залишився, для видалення натрію хлориду;
(j) концентрують фільтрат;
(k) додають воду до суміші з етапу (j), доки не почнеться кристалізація;
(l) необов'язково, додають додаткову кількість води для утворення суспензії;
(m) необов'язково, перемішують суспензію;
(n) фільтрують суспензію;
(o) необов'язково, промивають одержаний вологий корж органічним розчинником;
(р) сушать вологий корж під вакуумом для одержання кристалічного саксагліптину І у формі моногідрату його вільної основи (Н-1 форма); і
(q) виділяють кристалічний моногідрат Н-1 форми у по суті чистому вигляді;
17. Процес одержання кристалічного саксагліптину у формі моногідрату його вільної основи Н-1 форми за пунктом 2, у якому:
(a) забезпечують Вос-захищену форму саксагліптину (ІА);
(b) нагрівають Вос-захищену форму саксагліптину (ІА) в спиртовому розчиннику і концентрованій мінеральній кислоті при температурі в межах від приблизно 55 до приблизно 75 °С;
(c) додають воду до реакційної суміші;
(d) охолоджують суміш з етапу (с) до температури в межах від приблизно 15 до приблизно 35 °С;
(e) додають до охолодженої суміші органічний розчинник і регулюють рН суміші в межах від приблизно 8 до приблизно 10 за допомогою основи;
(f) розчиняють натрію хлорид в розчині з відрегульованим рН з утворенням двох фаз;
(g) розділяють дві фази і відділяють багату органічну фазу;
(h) концентрують багату органічну фазу для видалення залишкової води;
(і) охолоджують органічну фазу до температури в межах від приблизно 15 до приблизно 35 °С;
(j) додають розчинник до охолодженої суміші;
(k) фільтрують отриманий розчин для видалення залишкового натрію хлориду;
(l) додають воду до цього розчину, в якому після відстоювання утворюються кристали моногідрату вільної основи саксагліптину; і
(m) виділяють кристали моногідрату вільної основи саксагліптину Н-1 форми у по суті чистому вигляді.
18. Процес одержання кристалічного саксагліптину у формі вільної основи (N-3 форма) за пунктом 2, у якому:
(a) забезпечують саксагліптин у формі моногідрату його вільної основи (Н-1 форма);
(b) розчиняють Н-1 форму саксагліптину в органічному розчиннику;
(c) випаровують одержаний на етапі (b) розчин до сухості з утворенням олії;
(d) розчиняють одержану на етапі (с) олію в органічному розчиннику; і
(e) випаровують розчин, одержаний на етапі (d), з утворенням суспензії кристалів вільної основи саксагліптину (N-3 форма).
19. Процес одержання кристалічної вільної основи саксагліптину, яка містить 0,5 еквівалента Н2О (Н.5-2 форма), за пунктом 2, у якому:
(a) розчиняють вільну основу саксагліптину в теплому ксилені з утворенням кристалів солі вільної основи саксагліптину, яка містить 0,5 еквівалента Н2О (Н.5-2 форма); і
(b) виділяють кристали вільної основи саксагліптину (0,5 еквівалента Н2О) Н.5-2 форми з етапу (а).
20. Фармацевтична комбінація, яка містить кристалічну форму саксагліптину за будь-яким з пунктів 1-12 і протидіабетичний препарат, інший, ніж інгібітор DPP4, для лікування діабету і споріднених хвороб, препарат проти ожиріння та/або препарат, що модулює ліпіди.
21. Фармацевтична комбінація за пунктом 20, яка містить вказану кристалічну форму саксагліптину і протидіабетичний препарат.
22. Комбінація за пунктом 21, в якій протидіабетичний препарат є 1, 2, 3 або більше з бігуаніду, сульфонілсечовини, інгібітору глюкозидази, агоніста PPAR γ, інгібітору СТЕР, подвійного агоніста PPAR α/γ, інгібітору SGLT2, інгібітору аР2, інгібітору глікогенфосфорилази, інгібітору АПФ, сенсибілізатора інсуліну, глюкагонподібного пептид-1 (GLP-1) або його подоба, інсулін та/або меглітинід.
23. Комбінація за пунктом 21, в якій протидіабетичним препаратом є 1, 2, 3 або більше з метформіну, глібуриду, глімепіриду, гліпіриду, гліпізиду, хлорпропаміду, гліклазиду, акарбози, міглітолу, піоглітазону, троглітазону, дапагліфлозину, розіглітазону, інсуліну, GI-262570, ізаглітазону, JTT-501, NN-2344, L895645, YM-440, R-119702, AJ9677, репаглініду, натеглініду, KAD1129, APR-HO39242, GW-409544, KRP297, АС2993, Exendin-4, LY307161, NN2211 та/або LY315902.
24. Комбінація за пунктом 21, в якій іншим протидіабетичним препаратом є метформін або глібурид, або гліпізид, або дапагліфлозин.
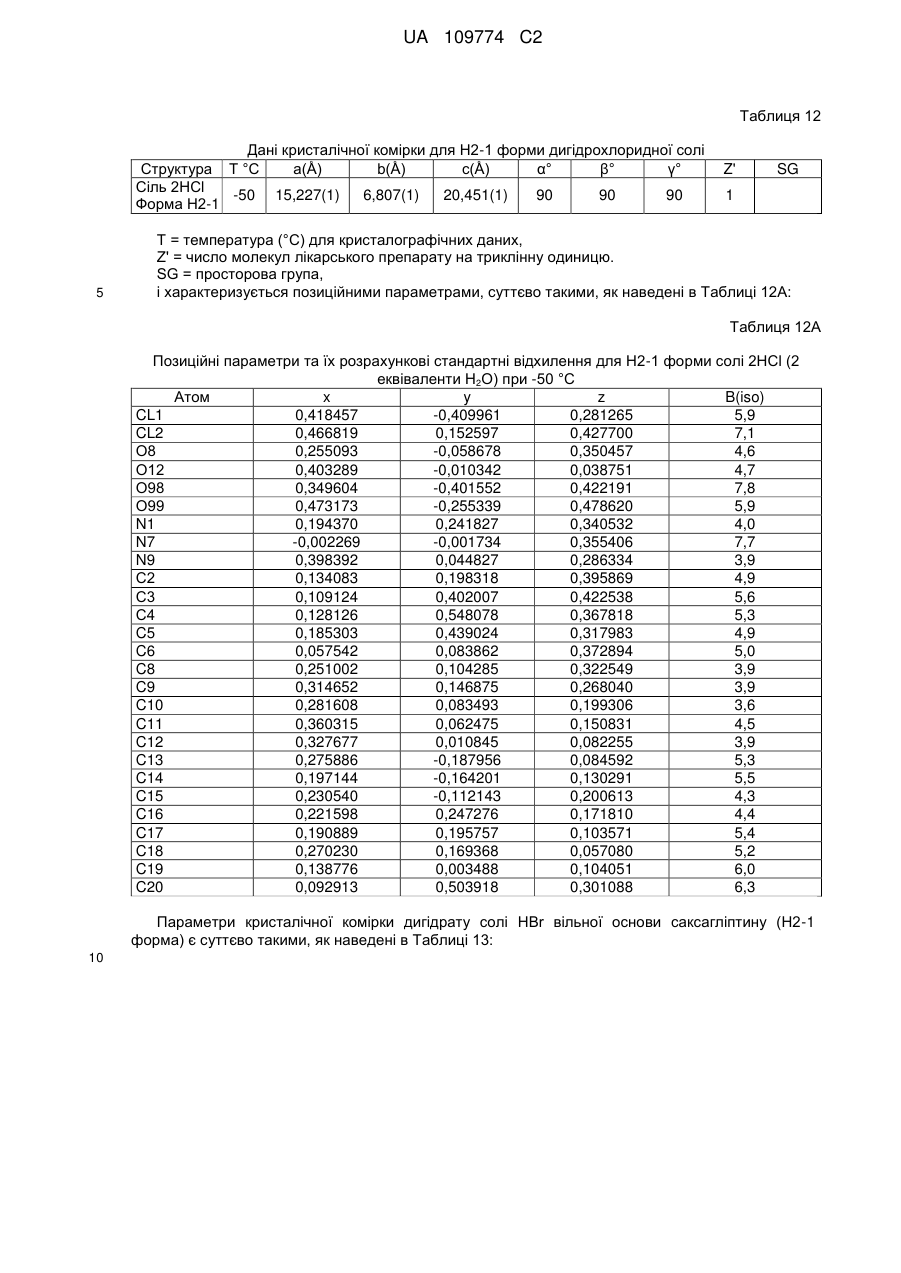
25. Комбінація за пунктом 21, яка містить НСl-сіль або Н2-1 форму саксагліптину (дигідрат) і метформін або дапагліфлозин.
26. Комбінація за пунктом 20, яка містить кристалічну форму саксагліптину і препарат проти ожиріння, вибираний з орлістату, ATL-962, AJ9677, L750355, СР331648, сибутраміну, топірамату, аксокіну, дексафетаміну, фентерміну, фенілпропаноламіну, фамоксину та/або мазіндолу, і в якій препаратом, що модулює ліпіди, є правастатин, ловастатин, симвастатин, аторвастатин, церивастатин, флувастатин, нісвастатин, візастатин, фенофібрат, гемфіброзил, клофібрат, імплітапід, СР-529,414, авасиміб, TS-962, MD-700 та/або LY295427.
27. Комбінація за пунктом 20, яка містить кристалічну форму саксагліптину і препарат проти ожиріння, вибираний з бета-3 адренергічного агоніста, інгібітору ліпази, інгібітору зворотного захоплення серотоніну (і допаміну), препарату, що впливає на рецептор бета-гормону щитовидної залози, аноректогенного засобу та/або позитивного регулятора окислення жирних кислот, i в якій препаратом, що модулює ліпіди, є інгібітор МТР, інгібітор HMG СоА-редуктази, інгібітор скваленсинтетази, похідне фіброєвої кислоти, позитивний регулятор активності рецептора ЛНЩ, інгібітор ліпоксигенази, інгібітор АСАТ, інгібітор білка-переносника ефірів холестерину або інгібітор АТФ цитратліази.
28. Спосіб лікування діабету, резистентності до інсуліну, гіперглікемії, гіперінсулінемії, дизліпідемії або підвищеного рівня в крові вільних жирних кислот або гліцерину, ожиріння, синдрому X, дизметаболічного синдрому, діабетичних ускладнень, гіпертригліцеридемії, гіперінсулінемії, атеросклерозу, порушеного гомеостазу глюкози, порушеної переносимості глюкози, безпліддя, синдрому полікістозного яєчника, розладів росту, субтильності, артриту, відторгнення алотрансплантата після трансплантації, автоімунних хвороб, СНІДу, хвороб кишечнику, синдрому запаленого кишечнику, нервової анорексії, остеопорозу, імуномодуляторної хвороби або хронічного запалення кишечнику, який включає введення ссавцеві, що потребує лікування, ефективної кількості сполуки за будь-яким з пунктів 1-12 або комбінації за будь-яким з пунктів 20-27.
29. Спосіб лікування діабету типу II, який включає введення ссавцеві, що потребує лікування, ефективної кількості сполуки за будь-яким з пунктів 1-12 або комбінації за будь-яким з пунктів 20-27.
30. Застосування сполуки за будь-яким з пунктів 1-18, окремо або в комбінації з іншим терапевтичним препаратом, у виготовленні медикаменту для лікування діабету.
Текст
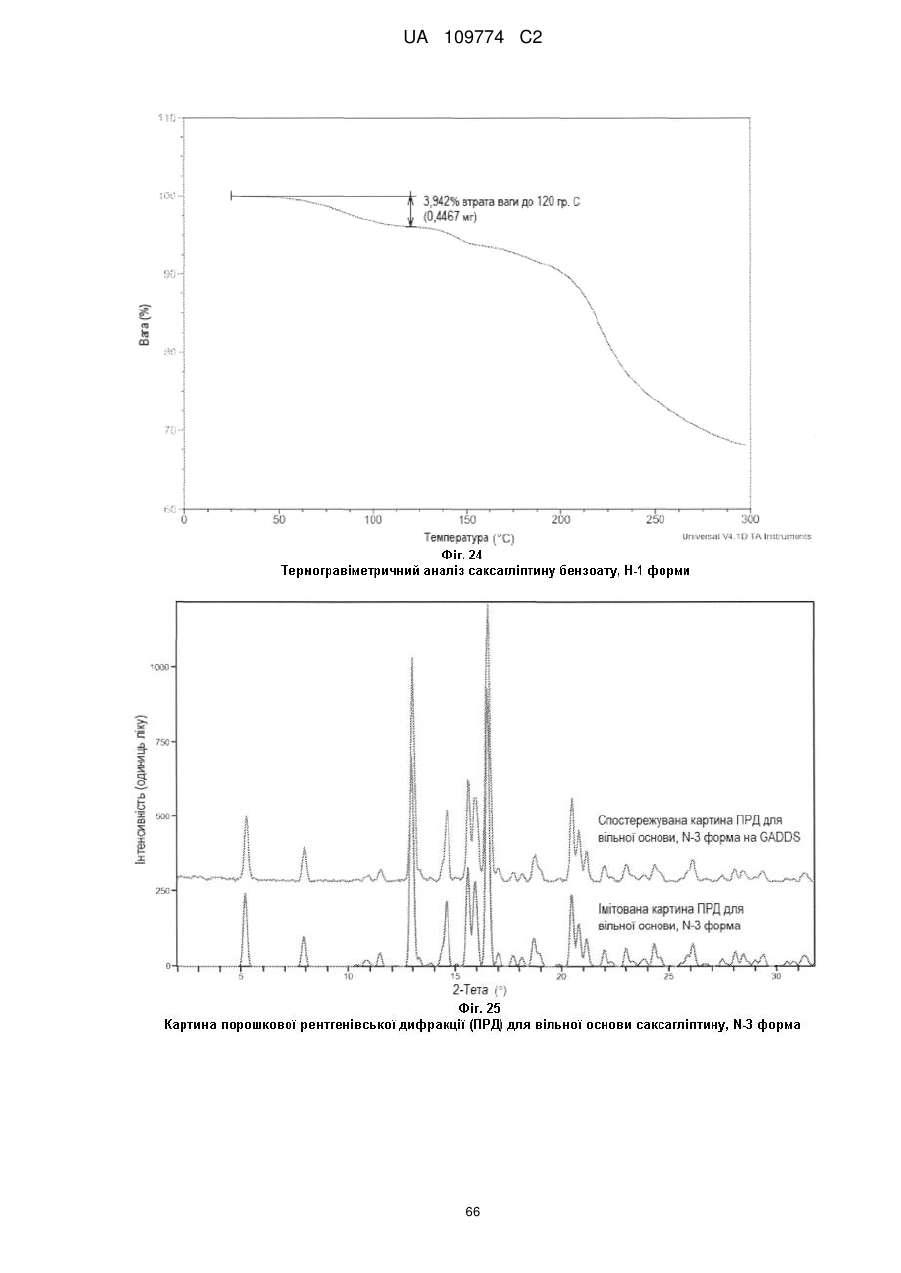
Реферат: Наведені фізичні кристалічні структури сполуки формули (І), які включають моногідрат її вільної основи (Н-1 форма) і її сіль хлористоводневої кислоти, яка може містити 0,75 еквівалента Н2О (Н0,75-3 форма), 2 еквіваленти Н2О (Н2-1 форма) і бути Структурою Р-5, переважно в суттєво чистому вигляді, а також інші форми, як вони описані тут, фармацевтичні композиції, що містять структури сполуки І або ІА, процеси їх одержання, проміжні продукти, що використовуються при їх одержанні, і способи лікування хвороб, таких як діабет, із застосуванням таких структур. UA 109774 C2 (12) UA 109774 C2 Даний винахід стосується поліморфних кристалічних структур саксагліптину, його фармацевтичних композицій, процесу одержання таких кристалічних структур та способів лікування таких розладів як діабет, з його використанням. Сполука структури 5 10 15 20 25 30 35 40 (або її сіль хлористоводневої кислоти, або сіль трифтороцтової кислоти) (далі інгібітор DPP4 або саксагліптин) - це орально активний оборотний інгібітор дипептидилпептидази (DPP4), що є терапевтичним препаратом для лікування цукрового діабету типу 2, ожиріння і пов'язаних хвороб, який описано в патенті США № 6,395,767, Приклад 60. В заявці на патент США № 10/716,012 (публікація № US2005/0090539A1 від 28 квітня 2005 р.) описано процес одержання саксагліптину, який включає використання його солі бензойної кислоти (Схема VII, Приклад 41), вільної основи (Приклад 42), моногідрату його вільної основи (Приклад 42) і його солі хлористоводневої кислоти (Схема VIIB, Приклад 42) і який включено в даний опис за посиланням. У відповідності до даного винаходу, пропонуються кристалічні структури саксагліптину, які мають формулу І: ,I переважно в суттєво чистому вигляді, які включають: А) вільну основу саксагліптину і його гідрати, включаючи: (а) кристалічну вільну основу саксагліптину, яка є N-3 формою, переважно в суттєво чистому вигляді; (b) моногідрат вільної основи саксагліптину, який містить 1 еквівалент Н 2О, який є Н-1 формою, переважно в суттєво чистому вигляді; та/або (c) півгідрат вільної основи саксагліптину, який містить 0,5 еквівалента Н 2О, який є Н.5-2 формою, переважно в суттєво чистому вигляді, В) гідратовану хлористоводневу сіль саксагліптину, яка є (a) Н2-1 формою монохлористоводневої солі, яка містить 2 еквіваленти Н2О переважно в суттєво чистому вигляді; (b) H0,75-3 формою монохлористоводневої солі, яка містить 0,75 еквівалента Н 2О переважно в суттєво чистому вигляді; (c) Н1,25-2 формою монохлористоводневої солі, яка містить 1,25 еквівалента Н 2О переважно в суттєво чистому вигляді; (d) H1,67-1 формою 1,33 хлористоводневої солі, яка містить 1,67 еквівалента Н 2О переважно в суттєво чистому вигляді; (композицією є 3 препарат:4 НСl:5 Н 2О) (е) Н2-1 формою двохлористоводневої солі, 2 еквіваленти Н 2О переважно в суттєво чистому вигляді; (f) хлористоводневою сіллю саксагліптину, яка є Структурою Р-5; або (g) сумішшю двох або більше В)(а), В)(b), В)(с) та/або B)(f), переважно сумішшю В)(а), В)(b) та/або B)(f), або сумішшю В)(а) і B)(f), переважно в суттєво чистому вигляді. С) гідратовану сіль саксагліптину і НВr кислоти, яка є (a) Н2-1 формою, яка містить 2 еквіваленти Н2О, переважно в суттєво чистому вигляді; і (b) Н1-2 формою (яку називають також формою Т1Н2), який містить 1 еквівалент Н 2О, переважно в суттєво чистому вигляді; UA 109774 C2 5 10 15 D) гідратовану сіль саксагліптину і НІ (йодистоводневої) кислоти, яка є Н2-1 формою, що містить 2 еквіваленти Н2О, переважно в суттєво чистому вигляді, E) гідратовану амоній сульфатну (NH 4SO4) сіль саксагліптину, яка є Н3-1 формою, що містить 3 еквіваленти Н2О, переважно в суттєво чистому вигляді. F) нітрат (NO3) саксагліптину (N-1 форма), переважно в суттєво чистому вигляді, G) R-H (1:1)-тартрат, який є Н.5-1 формою, що містить 0,5 еквівалента Н2О, переважно в суттєво чистому вигляді, H) (2:1) фумарат саксагліптину, який є Н4-1 формою, що містить 4 еквіваленти Н 2О, переважно в суттєво чистому вигляді, І) сіль саксагліптину і трифтороцтової кислоти, яка є (a) N-1 формою солі трифтороцтової кислоти у суттєво чистому вигляді; (b) H2-2 формою гідратованої солі трифтороцтової кислоти, що містить 2 еквіваленти Н 2О, переважно в суттєво чистому вигляді; або (c) Н.5-1 формою півгідратованої солі трифтороцтової кислоти, що містить 0,5 еквіваленту Н2О, переважно в суттєво чистому вигляді, J) гідратований бензоат саксагліптину, який є Н-1 формою, що містить 1 еквівалент Н2О, такої структури . 20 в суттєво чистому вигляді. В наступній Таблиці визначена структура для кожної форми від А до J (не включаючи A(f)), описаної вище, у відповідності до даного винаходу. Таблиця 1 В = основа = саксагліптин Назва форми Н2-1 Н0,75-3 Н1,25-2 Н1,67-1 Н2-1 Н2-1 Н1-2 Н2-1 Н3-1 Н4-1 Н.5-1 Н-1 N-1 Препарат(и) в триклінній одиниці + * * Назва форми N-1 Н2-2 H.5-1 Н-1 Н.5-2 N-3 ВН Сl + 2 (ВН Сl ) + 2 (ВН Сl ) + 3 (ВН Сl ) + (ВН Сl ) + ВН Вr + ВН Вr + ВН І + + = (BH )(NH4) (SO4) + = 2 (ВН ) фумарат + 2 (ВН R-H-тартрат ) + ВН бензоат + ВН NO3 Препарат(и) в триклінній одиниці + ** ВН TFA + ВН TFA + (ВН TFA )+В В В 3В Інші сполуки в триклінній одиниці 2 Н2О 0,75 Н2О 1,25 Н2О + Н5О2 +Сl +3 Н2О + Н5О2 +Сl 2 Н2О 1 Н2О 2 Н2О 3 Н2О 4 Н2О 1 Н2О 1 Н2О Немає Інші сполуки в триклінній одиниці Немає 2 Н2О 1 Н2О 1 Н2О 0,5 Н2О Немає * "гіперкислотна сіль" - більше ніж одна НСl на препарат ** "гіперосновна сіль" - менше ніж одна TFA на препарат; TFA = трифтороцтова кислота UA 109774 C2 5 10 15 20 25 Різні кристалічні структури (або поліморфи) саксагліптину за цим винаходом, описані вище, в розчині будуть перетворюватись на вільну основу саксагліптину, яка описана в патенті США № 6,395,767. Будь-яка з кристалічних структур саксагліптину за цим винаходом, описаних вище, може застосовуватись в різних фармацевтичних складах (які будуть описані далі) для використання в лікуванні діабету та споріднених хвороб у відповідності до даного винаходу. Кращими кристалічними структурами саксагліптину за цим винаходом будуть ті, які можна легко приготувати, виробництво яких можна легко налаштувати у великому масштабі, які мають прийнятний термін зберігання і є у вигляді солей, які вважаються прийнятними для використання в фармацевтичних препаратах. Відповідно, загалом перевагу віддають кристалічним солям хлористоводневої кислоти і саксагліптину перед іншими солями, такими як сіль бромисто-водневої кислоти, сіль йодистоводневої кислоти, сіль азотної кислоти, сіль трифтороцтової кислоти, сіль бензойної кислоти, сіль фумарової кислоти, сіль винної кислоти, сіль сульфат амонію. Кращою є Н2-1 форма солі НСl саксагліптину дигідрату - окремо або в комбінації з сіллю НСl структури Р-5. В іншому варіанті здійснення даного винаходу пропонується фармацевтична композиція, яка включає будь-яку з кристалічних форм саксагліптину за цим винаходом, як їх визначено вище, і фармацевтично прийнятний носій для неї. В іншому варіанті здійснення даного винаходу пропонується процес одержання кристалічних форм саксагліптину, включаючи наступні кристалічні солі саксагліптину: НСl, HBr, HI, NH 4SO4, TFA (трифтороцтова кислота), півгідрат (Н.5-2 форма) (0,5 еквівалента Н2О) TFA, NО3, бензоат, (1:1) Н-тартрат і (2:1) фумарат, де сіль трифтороцтової кислоти перетворюється в ці кристалічні солі шляхом іонного метатезису у воді за наступною реакцією: + + + + водний саксагліптин H TFA +R X →саксагліптин Н Х +R TFA , де Х - це аніон солі. Згадані процеси іонного метатезису за цим винаходом підсумовані далі: Водна сіль саксагліптину і TFA + + RX Форма солі Na2 тартрат (1:1) TFA КН2РО4 (1:1) TFA NaCl HCl KBr НВr KI НІ (NH4)2SO4 NH4SO4 Nа3(цитрат) або + Na2 (сукцинат) або + К2НРО4 або + NaF ПівTFA KNO3 NO3 Na бензоат Бензоат NaH тартрат (1:1) Н-тартрат Na2 (фумарат) (2:1) фумарат Форма N-1 Н2-2 Н2-1 Н2-1 Н2-1 Н3-1 Н.5-1 N-1 Н-1 Н.5-1 Н4-1 30 35 40 При здійсненні вищеописаного процесу за цим винаходом TFA сіль саксагліптину розчиняють у теплій воді і додають потрібну сіль з перелічених вище (наприклад, з приблизно 1або 3-кратним надлишком). Кристали нової солі утворюються після відстоювання. В ще іншому варіанті здійснення даного винаходу пропонується процес одержання кристалічного саксагліптину у формі моногідрату його вільної основи (Н-1 форма), як буде описано далі. Перший процес одержання кристалічного саксагліптину у формі моногідрату його вільної основи (Н-1 форма) включає наступні етапи: (а) забезпечення Вос-захищеної форми (Вос = трет-бутоксикарбоніл) саксагліптину, що має структуру UA 109774 C2 Boc 5 10 15 20 25 30 35 40 45 50 ; IA (b) розчинення захищеної форми саксагліптину з етапу (а) в органічному розчиннику, такому як етилацетат, ізопропіл ацетат або метилтетрагідрофуран, а переважно в етилацетаті; (c) реакція розчину з етапу (b) з сильною мінеральною кислотою, такою як соляна кислота, фосфорна кислота або сірчана кислота, переважно з соляною кислотою; (d) при необхідності, додавання органічного розчинника, такого, як описаний на етапі (b), до реакційної суміші з етапу (с); (e) охолодження реакційної суміші до температури в межах від 5 до приблизно 35 °С, переважно від 15 до 25 °С; (f) обробка охолодженої суміші з етапу (e) основою, такою як калію карбонат, калію бікарбонат або гідроокис натрію, переважно безводним калію карбонатом; (g) фільтрування суміші з етапу (f) з метою відділення твердої речовини від фільтрату; (h) необов'язково, промивання твердої речовини органічним розчинником (як визначено на етапі (b)); (і) об'єднання і концентрація фільтрату; (j) при необхідності, додавання до фільтрату води; (k) перемішування фільтрату до формування кристалів; (l) необов'язково, повторення етапу (j); (m) необов'язково, перемішування фільтрату; і (n) виділення кристалів моногідрату вільної основи саксагліптину (Н-1 форма) в суттєво чистому вигляді. Другий процес одержання кристалічного саксагліптину у формі моногідрату його вільної основи (Н-1 форма) включає наступні етапи: (a) забезпечення Вос-захищеної форми (Вос = трет-бутоксикарбоніл) саксагліптину ІА; (b) реакція суміші Вос-захищеного саксагліптину ІА з органічним розчинником, таким як метиленхлорид, 1,2-дихлоретан або хлорбензол, переважно з метиленхлоридом, спиртом, таким як метиловий спирт, етиловий спирт або ізопропіловий спирт, з сильною мінеральною кислотою, такою як соляна кислота, фосфорна кислота або сірчана кислота, переважно з соляною кислотою, під час якої утворюються водна фаза і органічна фаза; (c) відділення водної фази; (d) змішування водної фази з органічним розчинником, таким як використовуваний на етапі (b), переважно метиленхлоридом, водою, а потім з сильною основою, такою як основа лужного металу, наприклад гідроокис натрію або гідроокис калію, переважно гідроокис натрію, щоб відрегулювати рН від приблизно 8,8 до приблизно 10,8, переважно від приблизно 9,0 до приблизно 10,5; (e) додавання до реакційної суміші натрію хлориду; (f) змішування реакційної суміші, в результаті якого утворюються водна фаза і органічна фаза; (g) необов'язково, промивання органічного шару розчином солі або розсолу, таким як розчин розсолу з амонію хлориду, щоб одержати водний шар і органічний шар; (h) обробка органічного шару органічним розчинником, таким як етилацетат, ізопропіл ацетат або метилтетрагідрофуран, переважно етилацетатом, з відгонкою частини органічного розчинника, такого як метиленхлорид; (і) фільтрування продукту дистиляції, що залишився, для видалення натрію хлориду; (j) концентрування фільтрату для одержання приблизно 1 г саксагліптину на 10 мл етилацетату; (k) додавання до суміші з етапу (j) води, аж поки почнеться кристалізація; (l) необов'язково, введення додаткової води для утворення суспензії; (m) необов'язково, перемішування одержаної суспензії; (n) фільтрування суспензії; (о) необов'язково, промивання одержаного вологого коржа органічним розчинником, як це було визначено на етапі (n), переважно етилацетатом; UA 109774 C2 5 10 15 20 25 30 35 40 45 50 55 60 (р) сушіння вологого коржа під вакуумом, щоб одержати кристалічний саксагліптин у формі моногідрату його вільної основи (Н-1 форма); і (q) виділення Н-1 форми кристалічного саксагліптину моногідрату в суттєво чистому вигляді. В ще іншому варіанті здійснення даного винаходу пропонується третій процес одержання кристалічного саксагліптину у формі моногідрату його вільної основи (Н-1 форма), який включає наступні етапи: (a) забезпечення Вос-захищеної форми (Вос = трет-бутоксикарбоніл) саксагліптину (ІА); (b) нагрівання Вос-захищеної форми саксагліптину (ІА) у здатному змішуватись з водою органічному розчиннику, такому як ізопропіловий спирт, метиловий спирт або ацетонітрил, переважно ізопропіловий спирт, воді і концентрованій мінеральній кислоті, такій як соляна кислота, фосфорна кислота або метансульфонова кислота, переважно соляній кислоті, при температурі в межах від приблизно 55 до приблизно 75 °С, переважно від приблизно 60 до приблизно 70 °С; (c) додавання води до нагрітої суміші; (d) охолодження суміші з етапу (с) до температури в межах від приблизно 15 до приблизно 35 °С, переважно від приблизно 20 до приблизно 30 °С; (e) додавання до охолодженої суміші органічного розчинника, такого як метиленхлорид, 1,2дихлоретан або хлорбензол, переважно метиленхлориду, і регулювання рН суміші від приблизно 8 до приблизно 10, переважно від приблизно 8,5 до приблизно 9,5 (з використанням основи, такої як гідроокис лужного металу, наприклад гідроокису натрію або гідроокису калію, переважно гідроокису натрію або калію карбонату); (f) розчинення натрію хлориду в розчині з відрегульованим рН з утворенням двох фаз; (g) розділення цих двох фаз і відділення багатої органічної фази; (h) концентрування багатої органічної фази для видалення залишкової води; (і) охолодження органічної фази до температури в межах від приблизно 15 до приблизно 35 °С, переважно від приблизно 20 до приблизно 30 °С; (j) додавання до охолодженої суміші етилацетату або іншого органічного розчинника, такого як ізопропіл ацетат або метилтетрагідрофуран, переважно етилацетату; (k) фільтрування одержаного розчину для видалення залишкового натрію хлориду; (l) додавання до розчину води, щоб після відстоювання утворились кристали моногідрату вільної основи саксагліптину; і (m) відділення моногідрату вільної основи саксагліптину в суттєво чистому вигляді. Кристали моногідрату вільної основи саксагліптину (Н-1 форма) можуть бути одержані на етапі (І) (дивись вище) шляхом використання наступних етапів: (a) додавання води до продукту, одержаного на етапі (І); (b) здійснення перегонки при постійному об'ємі і при температурі, меншій ніж приблизно 30 °С, з додаванням етилацетату приблизно зі швидкістю перегонки; (c) додавання до суміші з етапу (b) води і охолодження до температури в межах від приблизно 0 до приблизно 15 °С, переважно від приблизно 0 до приблизно 10 °С; (d) відфільтровування твердої речовини з суміші; (e) промивання одержаного коржа сумішшю органічного розчинника, такого як етилацетат, ізопропіл ацетат або метилтетрагідрофуран, переважно етилацетату, і води; (f) сушіння при температурі від приблизно 30 до приблизно 50 °С, переважно від приблизно 35 до приблизно 45 °С, при підтриманні точки роси близько -8 °С; і (g) виділення Н-1 форми кристалічного саксагліптину моногідрату в суттєво чистому вигляді. В ще іншому варіанті здійснення даного винаходу пропонується процес одержання кристалічного саксагліптину у формі вільної основи (Н-1 форма), який включає наступні етапи: (a) забезпечення саксагліптину у формі його моногідрату вільної основи (тобто в Н-1 формі); (b) розчинення Н-1 форми саксагліптину у відповідному органічному розчиннику, такому як метиленхлорид, ізопропіловий спирт або метиловий спирт, переважно у метиленхлориді, або у суміші одного або більше з них, наприклад у суміші метиленлориду і ізопропілового спирту; (c) випаровування одержаного на етапі (b) розчину до сухості з утворенням олії; (d) розчинення одержаної на етапі (с) олії у відповідному органічному розчиннику, такому як етилацетат, ізопропіл ацетат або метилтетрагідрофуран, переважно в етилацетаті; і (e) випаровування одержаного на етапі (d) розчину з утворенням суспензії кристалів вільної основи саксагліптину (N-3 форма). Суспензію N-3 форми вільної основи можна висушити, виділити у суттєво чистому вигляді і зберігати в атмосфері азоту, щоб запобігти регідратації до Н-1 форми моногідрату. В ще іншому варіанті здійснення даного винаходу пропонується процес одержання вільної основи кристалічного саксагліптину у формі його півгідрату (Н.5-2 форма), який включає етап UA 109774 C2 5 10 15 20 25 30 35 40 45 розчинення вільної основи саксагліптину в теплому ксилені з одержанням після відстоювання кристалів 0,5 гідрату вільної основи саксагліптину. В іншому варіанті здійснення даного винаходу пропонується процес одержання кристалічного дигідрохлориду саксагліптину у формі його дигідрату, що є Н2-1 формою, який включає наступні етапи: (a) розчинення моногідрату вільної основи саксагліптину (Н-1 форма) в концентрованій НСl, діоксані і спирті, такому як етиловий спирт; і (b) відділення кристалів Н2-1 форми дигідрохлоридної солі після відстоювання при кімнатній температурі. В ще іншому варіанті здійснення даного винаходу пропонується процес одержання кристалічної моногідрохлоридної солі саксагліптину у формі його дигідрату, яка є Н2-1 формою, який включає наступні етапи: (a) забезпечення саксагліптину у формі його солі трифтороцтової кислоти; (b) розчинення солі з етапу (а) у воді; (c) регулювання рН одержаного водного розчину до значення від приблизно 9 до приблизно 9,8, переважно від приблизно 9,2 до приблизно 9,6, сильною основою, такою як гідроокис лужного металу, наприклад гідроокис натрію або гідроокис калію, переважно гідроокис натрію, з утворенням водної фази і органічної фази; (d) Обробка одержаного на етапі (с) розчину органічним розчинником, таким як метиленхлорид, 1,2-дихлоретан або хлорбензол, переважно метиленхлоридом, для того, щоб відділити водний шар від багатого метиленхлоридного (органічний розчинник) шару; (e) додавання до багатого органічного (метиленхлоридного) шару розчину соляної кислоти; (f) випаровування органічного (метиленхлоридного) розчину до сухості; (g) розчинення одержаної на етапі (f) твердої речовини в спиртовому розчиннику, такому як етиловий спирт, метиловий спирт або ізопропіловий спирт, переважно в етиловому спирті; (h) нагрівання спиртового (етанольного) розчину з етапу (g) до температури в межах від приблизно 35 до приблизно 60 °С, переважно від приблизно 40 до приблизно 50 °С; (і) додавання t-бутилметилового ефіру (МТВЕ) або іншого агенту для суспендування, такого як етилацетат або ізопропіл ацетат, до нагрітого розчину з етапу (h) для утворення суспензії; (j) охолодження одержаної суспензії; (k) фільтрування суспензії; (l) сушіння одержаного вологого коржа з одержанням кристалів саксагліптину дигідрату у формі його гідрохлориду (Н2-1 форма); і (m) виділення кристалів саксагліптину дигідрату з його моно-HCl солі у суттєво чистому вигляді. В ще іншому варіанті здійснення даного винаходу пропонується процес одержання кристалічної 1,33 гідрохлоридної солі саксагліптину у формі його гідрату (Н1,67-1 форма), який включає наступні етапи: (а) забезпечення Вос-захищеної сполуки ; (b) розчинення Вос-захищеної сполуки в органічному розчиннику, переважно в етил ацетаті; (c) реакція Вос-захищеної сполуки з соляною кислотою з утворенням кристалів саксагліптину; і (d) відділення одержаних у такий спосіб кристалів гідратованої 1,33 гідрохлоридної солі саксагліптину, 141,67-1 форма. В іншому варіанті здійснення даного винаходу пропонується процес одержання кристалічної гідрохлоридної солі саксагліптину у формі його гідрату (0,75 еквіваленту Н 2О) (Н0,75-3 форма), який включає наступні етапи: UA 109774 C2 5 10 15 20 25 30 35 40 45 50 55 60 (a) нагрівання моногідрохлоридної солі дигідрату (Н2-1 форма) при температурі від приблизно 25 до приблизно 55 °С впродовж періоду від приблизно 1 години до приблизно 2 годин; і (b) відділення кристалів гідрохлоридом солі, Н0,75-3 форма. В ще іншому варіанті здійснення даного винаходу пропонується процес одержання кристалічної гідрохлоридної солі саксагліптину у формі його 1,25 гідрату (Н1,25-2 форма), який включає етап розчинення вільної основи саксагліптину в соляній кислоті, яка містить від приблизно 5 до приблизно 20 % метилового спирту, переважно від приблизно 8 до приблизно 12 % метилового спирту, що забезпечує після відстоювання утворення кристалів саксагліптину гідрохлориду (1,25 еквіваленту Н2О) (1-11,25-2 форма). В ще іншому варіанті здійснення даного винаходу пропонується процес одержання кристалічної гідрохлоридної солі саксагліптину у формі його тартрату, який містить 1 еквівалент Н2О (Н.5-1 форма), який включає наступні етапи: (a) забезпечення саксагліптину у формі солі трифтороцтової кислоти; (b) розчинення солі з етапу (а) у воді; (c) регулювання рН одержаного водного розчину з етапу (b) до значення в межах від приблизно 9 до приблизно 9,8, переважно від приблизно 9,2 до приблизно 9,6, сильною основою, такою як гідроокис лужного металу, наприклад гідроокис натрію або гідроокис калію, переважно гідроокис натрію; (d) обробка одержаного розчину з етапу (с) органічним розчинником, таким як метиленхлорид, 1,2-дихлорметан або хлорбензол, переважно метиленхлоридом, щоб екстрагувати багатий водний шар з багатого органічного (метиленхлоридного) шару; (e) додавання до багатого органічного (метиленхлоридного) розчину спирту, такого як етиловий спирт, метиловий спирт або ізопропіловий спирт, переважно етилового спирту; (f) нагрівання одержаного розчину з етапу (e) до температури в межах від приблизно 25 до приблизно 45 °С, переважно від приблизно 32 до приблизно 40 °С; (g) обробка одержаного нагрітого розчину з етапу (f) кристалами тартрату саксагліптину; (h) окреме розчинення L-тартрату в спиртовому розчиннику, такому як етиловий спирт, метиловий спирт або ізопропіловий спирт, переважно в етиловому спирті; (і) змішування одержаного розчину тартрату з багатим розчином тартрату саксагліптину (з внесеною в нього затравкою) з етапу (g) з утворенням суспензії; (j) охолодження суспензії з етапу (і); і (k) відділення кристалічного саксагліптину у формі тартрату, переважно в суттєво чистому вигляді. В ще іншому варіанті здійснення даного винаходу пропонується процес одержання гідратованої солі саксагліптину і бромисто-водневої кислоти (НBr), що є Н1-2 формою, яка містить 1 еквівалент Н2О, що включає етапи нагрівання Н2-1 форми НBr солі саксагліптину при температурі від приблизно 25 до приблизно 55 °С впродовж періоду від приблизно 1 години до приблизно 2 годин і відділення кристалів Н1-2 форми НBr солі, яка містить 1 еквівалент Н 2О. В іншому варіанті здійснення даного винаходу пропонується процес одержання моногідрату бензоату саксагліптину, що є Н-1 формою, який включає наступні етапи: (a) забезпечення солі саксагліптину і трифтороцтової кислоти (TFA) в деіонізованій воді; (b) регулювання рН одержаного водного розчину до значення від приблизно 8,5 до приблизно 9,5, переважно до приблизно 9,1, сильною основою, такою як гідроокис лужного металу, наприклад гідроокис натрію або гідроокис калію, переважно гідроокисом натрію, з утворенням водного шару і органічного шару; (c) екстрагування водного шару органічним розчинником, таким як метиленхлорид, 1,2дихлорметан або хлорбензол, переважно метиленхлоридом; (d) сушіння органічного (метиленхлоридного) розчину до сухості; (e) відділення одержаної твердої речовини; (f) розчинення цієї твердої речовини в спиртовому розчиннику, такому як етиловий спирт, метиловий спирт або ізопропіловий спирт, переважно в етиловому спирті; (g) додавання розчину бензойної кислоти переважно в спиртовому розчиннику, такому як етиловий спирт, метиловий спирт або ізопропіловий спирт, переважно в етиловому спирті, до органічного (етанольного) розчину з етапу (f) порціями для утворення суспензії кристалічного матеріалу; (h) необов'язково, перемішування одержаної суспензії; (і) фільтрування суспензії з етапу (g) або (n) для одержання вологого коржа; (j) необов'язково, промивання одержаного вологого коржа спиртовим розчинником, як на етапі (f), переважно етиловим спиртом; UA 109774 C2 5 10 15 20 25 30 35 40 45 50 55 60 (k) сушіння вологого коржа з одержанням кристалів моногідрату бензоату саксагліптину; і (l) відділення кристалів моногідрату бензоату саксагліптину в суттєво чистому вигляді. В ще іншому варіанті здійснення даного винаходу пропонується процес одержання гідрохлориду саксагліптину, що є Структурою Р-5, який включає наступні етапи: (a) отримання суміші Н2-1 форми гідрохлоридом солі саксагліптину (моно-HCl солі дигідрату) в сухому етиловому спирті; (b) нагрівання частини суміші (а) до температури від 40 до 50 °С, переважно до 45 °С, доки вся Н2-1 форма не розчиниться у розчині; і (c) охолодження частини розчину (b) до температури від 28 °С до кімнатної з утворенням кристалів Структури Р-5. Крім того, у відповідності до даного винаходу, пропонується спосіб для лікування діабету, зокрема діабету типу 2, а також порушеного гомеостазу глюкози, порушеної переносимості глюкози, безпліддя, синдрому полікістозного яєчнику, розладів росту, субтильності, артриту, відторгнення алотрансплантату, автоімунних хвороб (таких як склеродерма і множинний склероз), різних імуномодуляторних хвороб (таких як червоний вовчак або псоріаз), СНІДу, хвороб кишечнику (таких як некротизуючий ентерит, мікроворсинкова інклюзивна хвороба або глютенова хвороба), синдрому запаленого кишечнику, викликаної хіміотерапією атрофії або ушкодження слизової оболонки кишечнику, нервової анорексії, остеопорозу, синдрому X, дизметаболічного синдрому, ускладнень діабету, дизліпідемії, гіперінсулінемії, ожиріння, атеросклерозу і споріднених хвороб, а також запальних хвороб кишечнику (таких як хвороба Крона і виразковий коліт), в якому терапевтично ефективна кількість якоїсь форми кристалічного саксагліптину за цим винаходом (яка пригнічує DPP4) вводиться пацієнту, який потребує лікування. Стани, хвороби і розлади, які сукупно називають «Синдромом X» або метаболічним синдромом, докладно описані в публікації Johannsson, J. Clin. Endocrinol. Metab., 82:727734(1997). Крім того, у відповідності до даного винаходу, пропонується спосіб для лікування діабету і споріднених хвороб, як визначено вище і далі, а також будь-яких інших патологічних станів, згаданих вище, в якому терапевтично ефективна кількість комбінації якоїсь форми кристалічного саксагліптину за цим винаходом та один, два, три або більше типів протидіабетичних препаратів (які можуть бути використані для лікування діабету і споріднених хвороб) та/або один, два, три або більше інших типів терапевтичних препаратів вводяться пацієнту, який потребує лікування. Інший варіант здійснення даного винаходу стосується використання сполуки формули І у виготовленні медикаменту для лікування діабету. Інший варіант здійснення даного винаходу стосується використання сполуки формули І за цим винаходом для застосування в лікуванні діабету. Інший варіант здійснення даного винаходу стосується використання сполуки формули І за цим винаходом для застосування в лікуванні діабету у ссавця. Інший варіант здійснення даного винаходу стосується використання сполуки формули І у виготовленні медикаменту для лікування діабету, коли таке лікування включає використання комбінації з іншим терапевтичним препаратом для одночасного або послідовного застосування, у будь-якому порядку. Інший варіант здійснення даного винаходу стосується комбінації сполуки формули І за цим винаходом та іншого терапевтичного препарату як медикаменту для лікування діабету. Термін «діабет і споріднені хвороби» стосується діабету типу II, діабету типу І, порушеної переносимості глюкози, ожиріння, гіперглікемії, синдрому X, дизліпідемії, дизметаболічного синдрому, діабетичних ускладнень і гіперінсулінемії. Стани, хвороби і розлади, які сукупно називають «діабетичними ускладненнями», включають ретинопатію, невропатію і нефропатію, а також інші відомі ускладнення діабету. Термін «інші типи терапевтичних препаратів», як він тут використовується, стосується одного або більше протидіабетичних препаратів (інших, ніж інгібітори DPP4 з якоїсь форми кристалічного саксагліптину за цим винаходом), включаючи інгібітори DPP4 вілдагліптин і сітагліптин, метформін та/або інгібітор SGLT-2 дапагліфтозин, описаний в патенті США № 6,515,117, один або більше препаратів, спрямованих проти ожиріння, та/або один або більше ліпід-модулюючих препаратів (включаючи препарати проти атеросклерозу), та/або один або більше препаратів проти безпліддя, один або більше препаратів для лікування синдрому полікістозного яєчнику, один або більше препаратів для лікування розладів росту, один або більше препаратів для лікування субтильності, один або більше препаратів для лікування артриту, один або більше препаратів для попередження відторгнення алотрансплантату, один UA 109774 C2 5 10 15 20 25 30 35 40 45 50 55 або більше препаратів для лікування автоімунних хвороб, один або більше препаратів для лікування СНІДу, один або більше препаратів для лікування остеопорозу, один або більше препаратів для лікування імуномодуляторних хвороб, один або більше препаратів для лікування хронічної запальної хвороби кишечнику або синдрому хронічного запалення кишечнику, та/або один або більше препаратів для лікування нервової анорексії, які докладно описані в патенті США № 6,395,767. Термін «ліпід-модулюючий» препарат, як він тут використовується, стосується препаратів, які знижують рівень ЛНЩ, та/або підвищують рівень ЛВЩ, та/або знижують рівень тригліцеридів, та/або знижують рівень загального холестерину, та/або інших механізмів для медикаментозного лікування ліпідних розладів. Термін «еквівалент(и)» стосується «молів». У вищенаведених способах за цим винаходом форма кристалічного саксагліптину за цим винаходом буде використовуватись у масовому співвідношенні до протидіабетичного препарату або іншого типу терапевтичного препарату (в залежності від його способу дії) в межах від приблизно 0,01:1 до приблизно 500:1, переважно від приблизно 0,1:1 до приблизно 100:1, а краще від приблизно 0,2:1 до приблизно 10:1. Даний винахід ілюструється посиланням на супроводжуючі Фігури, описані далі. Фіг. 1 показує розрахункову (імітовану при 22 °С) і спостережувану (експериментальну при кімнатній температурі) порошкову рентгенівську дифракційну картину для моногідрату вільної основи кристалічного саксагліптину (Н-1 форма). Фіг. 2 показує термограму диференційної скануючої калориметрії (DSC) для моногідрату вільної основи кристалічного саксагліптину (Н-1 форма). Фіг. 3 показує криву термогравіметричного аналізу (TGA) для моногідрату вільної основи кристалічного саксагліптину (Н-1 форма). Фіг. 4 показує спостережуваний раманівський спектр при кімнатній температурі для моногідрату вільної основи кристалічного саксагліптину (Н-1 форма). Фіг. 5 показує спостережуваний інфрачервоний спектр при кімнатній температурі для моногідрату вільної основи кристалічного саксагліптину (Н-1 форма). Фіг. 6 показує розрахункову (імітовану при 22 °С) і спостережувану (експериментальну при кімнатній температурі) порошкову рентгенівську дифракційну картину для моно-HCl солі кристалічного саксагліптину, яка містить 2 еквіваленти Н2О (Н2-1 форма). Фіг. 7 показує термограму диференційної скануючої калориметрії (DSC) для моно-HCl солі кристалічного саксагліптину, яка містить 2 еквіваленти Н2О (Н2-1 форма). Фіг. 8 показує криву термогравіметричного аналізу (TGA) для моно-HCl солі кристалічного саксагліптину, яка містить 2 еквіваленти Н2О (Н2-1 форма). Фіг. 9 показує спостережуваний раманівський спектр при кімнатній температурі для моноHCl солі кристалічного саксагліптину, яка містить 2 еквіваленти Н2О (Н2-1 форма). Фіг. 10 показує спостережуваний інфрачервоний спектр при кімнатній температурі для солі HCl кристалічного саксагліптину (2 еквіваленти Н2О) (Н2-1 форма). Фіг. 11 показує розрахункову (імітовану при 22 °С) і спостережувану (експериментальну при кімнатній температурі) порошкову рентгенівську дифракційну картину для солі HCl кристалічного саксагліптину, яка містить 0,75 еквівалента Н2О (Н0,75-3 форма). Фіг. 12 показує термограму диференційної скануючої калориметрії (DSC) для солі HCl кристалічного саксагліптину (0,75 еквівалента Н2О) (Н0,75-3 форма). Фіг. 13 показує криву термогравіметричного аналізу (TGA) для солі HCl кристалічного саксагліптину (0,75 еквівалента Н2О) (Н0,75-3 форма). Фіг. 14 показує спостережуваний раманівський спектр при кімнатній температурі для солі HCl кристалічного саксагліптину (0,75 еквівалента Н 2О) (Н0,75-3 форма). Фіг. 15 показує спостережуваний інфрачервоний спектр при кімнатній температурі для солі HCl кристалічного саксагліптину (0,75 еквівалента Н 2О) (Н0,75-3 форма). Фіг. 16 показує розрахункову (імітовану при 22 °С) і спостережувану (експериментальну при кімнатній температурі) порошкову рентгенівську дифракційну картину для солі 1,33 HCl кристалічного саксагліптину, яка містить 1,67 еквівалента Н2О (Н1,67-1 форма). Фіг. 17 показує термограму диференційної скануючої калориметрії (DSC) для солі 1,33 HCl кристалічного саксагліптину (1,67 еквівалента Н2О) (Н1,67-1 форма). Фіг. 18 показує криву термогравіметричного аналізу (TGA) для солі 1,33 HCl кристалічного саксагліптину (1,67 еквівалента Н2О) (Н1,67-1 форма). Фіг. 19 показує спостережуваний раманівський спектр при кімнатній температурі для солі 1,33 HCl кристалічного саксагліптину (1,67 еквівалента Н2О) (Н1,67-1 форма). UA 109774 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 20 показує спостережуваний інфрачервоний спектр при кімнатній температурі для солі 1,33 HCl кристалічного саксагліптину (1,67 еквівалента Н2О) (Н1,67-1 форма). Фіг. 21 показує розрахункову (імітовану при 22 °С) і спостережувану (експериментальну при кімнатній температурі) порошкову рентгенівську дифракційну картину для солі нітрату кристалічного саксагліптину (N-1 форма). Фіг. 22 показує розрахункову (імітовану при 22 °С) і спостережувану (експериментальну при кімнатній температурі) порошкову рентгенівську дифракційну картину для солі бензоату кристалічного саксагліптину (N-1 форма). Фіг. 23 показує термограму диференційної скануючої калориметрії (DSC) для солі бензоату кристалічного саксагліптину (N-1 форма). Фіг. 24 показує криву термогравіметричного аналізу (TGA) для солі бензоату кристалічного саксагліптину (Н-1 форма). Фіг. 25 показує розрахункову (імітовану при 22 °С) і спостережувану (експериментальну при кімнатній температурі) порошкову рентгенівську дифракційну картину для вільної основи (без домішок) кристалічного саксагліптину (N-3 форма). Фіг. 26 показує термограму диференційної скануючої калориметрії (DSC) для вільної основи (без домішок) кристалічного саксагліптину (N-3 форма). Фіг. 27 показує криву термогравіметричного аналізу (TGA) для вільної основи (без домішок) кристалічного саксагліптину (N-3 форма). Фіг. 28 показує спостережувану (експериментальну при кімнатній температурі) порошкову рентгенівську дифракційну картину для Структури Р-5 солі HCl кристалічного саксагліптину (у формі суспензії). Фіг. 29 показує спостережувану (експериментальну при кімнатній температурі) порошкову рентгенівську дифракційну картину для Структури Р-5 солі HCl кристалічного саксагліптину в покривному шарі таблетки саксагліптину (25 мг) (у вигляді суспензії). Фіг. 30 показує Фур'є спектроскопію в ближній ІЧ-області для Структури Р-5 солі HCl кристалічного саксагліптину в покривному шарі таблетки саксагліптину (25 мг) і в 40-мг таблетці плацебо з покриттям. Даний винахід стосується, щонайменше частково, кристалічних структур сполуки І як нового матеріалу. Термін «фармацевтично прийнятний», як він тут використовується, стосується тих сполук, матеріалів, композицій та/або лікарських форм, які, в межах здорового медичного глузду, є придатними для контакту з тканинами людини і тварин без надмірної токсичності, подразнення, алергічної реакції або інших проблемних ускладнень, співставних з виправданим співвідношенням користь/ризик. В певних кращих варіантах здійснення кристалічні структури сполуки І (саксагліптину) за цим винаходом знаходяться у суттєво чистому вигляді. Термін «суттєво чистий», як він тут використовується, означає сполуку, що має чистоту, більшу ніж приблизно 90 %, включаючи, наприклад, приблизно 91 %, приблизно 92 %, приблизно 93 %, приблизно 94 %, приблизно 95 %, приблизно 96 %, приблизно 97 %, приблизно 98 %, приблизно 99 % і приблизно 100 %. Здатність сполуки існувати у формі різних кристалічних структур відома як поліморфізм. Термін «поліморфізм», як він тут використовується, стосується кристалічних форм, які мають той самий хімічний склад, але різну просторову будову молекул, атомів та/або іонів, утворюючих кристал. Хоча поліморфи мають однаковий хімічний склад, вони відрізняються упаковкою і геометричною будовою і можуть демонструвати різні фізичні властивості, такі як температура плавлення, форма, колір, щільність, твердість, здатність деформуватись, стабільність, розчинність і т.п. В залежності від свого співвідношення температура-стабільність два поліморфи можуть бути монотропними або енантіотропними. Для монотропної системи відносна стабільність між двома твердими фазами залишається незмінною, коли температура змінюється. І навпаки, в енантіотропній системі існує температура переходу, при якій стабільність цих двох фаз є оборотною. (Theory and Origin of Polymorphism in "Polymorphism in Pharmaceutical Solids" (1999) ISBN:)-8247-0237). Зразки кристалічних структур за цим винаходом можуть мати суттєво чисту фазову гомогенність, включаючи присутність домінуючої кількості якоїсь одної кристалічної структури і необов'язково незначні кількості однієї або більше інших кристалічних структур. Присутність в зразку більше ніж одної кристалічної структури за цим винаходом можна встановити такими методами, як порошкова рентгенівська дифракція (PXRD) або твердофазна ЯМР спектроскопія (SSNMR). Наприклад, присутність зайвих піків при порівнянні експериментально одержаної картини PXRD (спостережуваної) з імітованою картиною PXRD (розрахунковою) може засвідчувати наявність у зразку більше ніж однієї кристалічної структури. Імітовану PXRD можна UA 109774 C2 5 10 15 20 25 30 35 40 45 50 55 розрахувати за даними рентгенівської дифракції монокристалу (дивись Smith, D.K., "A FORTRAN Program for Calculating X-Ray Powder Diffraction Patterns", Lawrence Radiation Laboratory, Livermore, California, UCRL-7196, квітень 1963; дивись також Yin, S. et al., American Pharmaceutical Review, 6(2):80 (2003)). Переважно, кристалічна структура має суттєво чисту фазову гомогенність, про що свідчить менша за 10 %, краще менша за 5 %, а ще краще менша за 2 % загальна площа зайвих піків на експериментально одержаній картині PXRD, відсутніх на картині імітованої PXRD. Найкращою є кристалічна структура за цим винаходом, яка має суттєво чисту фазову гомогенність з менш ніж 1 % загальною площею зайвих піків на експериментально одержаній картині PXRD, відсутніх на картині iмітованої PXRD. Описані тут різні кристалічні структури за цим винаходом можна відрізнити одну від одної за допомогою різних аналітичних методів, відомих спеціалістам в цій галузі. Такі методи включають, не обмежуючись ними, твердофазну ЯМР спектроскопію (SSNMR), порошкову рентгенівську дифракцію (PXRD), диференційну скануючу калориметрію (DSC), термогравіметричний аналіз (TGA), інфрачервоні спектри (IR) та/або раманівські спектри. Отримання кристалічних структур Кристалічні структури за цим винаходом можуть бути одержані різними методами, як тут описується, включаючи, наприклад, кристалізацію або рекристалізацію з відповідного розчинника, сублімацію, вирощування з розплаву, твердофазний перехід з іншої фази, кристалізацію з суперкритичної рідини і струминне розпилювання. Методи кристалізації або рекристалізації кристалічних структур з суміші розчинників включають, наприклад, випаровування розчинника, зниження температури суміші розчинників, затравка супернасиченої суміші розчинників кристалами з молекул та/або солі, сушіння суміші розчинників виморожуванням і додавання антирозчинників (контр-розчинників) до суміші розчинників. Для одержання кристалічних структур, включаючи поліморфи, можуть бути використані високопродуктивні методи кристалізації. Кристали лікарських препаратів, включаючи поліморфи, способи одержання і характеристики таких кристалів розглядаються в книзі Bryan, S.R. et al., Solid-State Chemistry of nd Drugs, 2 Edition, SSCI, West Lafayette, Indiana, опубл. (1999). Кристали для затравки можуть додаватись до будь-якої кристалізаційної суміші для прискорення кристалізації. Як має бути очевидним для спеціалістів в цій галузі, затравка застосовується як засіб для контролю вирощування конкретної кристалічної структури або як засіб для контролю розподілу часток кристалічного продукту за розмірами. Відповідно, вираховується кількість кристалів, необхідних для затравки, яка залежить від розміру наявних кристалів і бажаного середнього розміру часток у продукті, як описано, наприклад, в публікації Mullin, J.W. et al., "Programmed cooling of batch crystallizers", Chemical Engineering Science, 26:369-377 (1971). Загалом, для ефективного контролю росту кристалів у закладці потрібні кристали малого розміру. Кристали малого розміру для затравки можна одержати просіюванням, розмелюванням або тонким подрібненням більш крупних кристалів або мікрокристалізацією розчинів. Необхідно слідкувати за тим, щоб розмелювання або тонке подрібнення кристалів не призвело до будь-якої зміни в кристалічності від бажаної кристалічної структури (тобто, зміни на аморфну структуру або інший поліморф). Термін «кімнатна температура» або «КТ», як він тут використовується, означає температуру оточуючого середовища від 20 до 25 °С. Фармацевтичні композиції і дозування Форми кристалічного саксагліптину за цим винаходом можуть вводитись для будь-якого із згаданих тут застосувань в різних фармацевтичних композиціях, лікарських формах і схемах дозування, як описано в патенті США № 6,395,767, який включено в даний опис за посиланням. Отже, форми кристалічного саксагліптину за цим винаходом можуть вводитись для будь-якого із згаданих тут застосувань будь-якими придатними засобами, наприклад орально - у формі таблеток, капсул, гранул або порошків; сублінгвально; трансбукально, парентерально - шляхом підшкірної, внутрішньовенної, внутрішньом'язової або інтрастернальної ін'єкції або інфузії (наприклад, у вигляді стерильних ін'єкційних водних або неводних розчинів або суспензій); назально, включаючи нанесення на оболонки носа за допомогою аерозольного інгалятору; місцево - у вигляді крему або мазі; або ректально у формі супозиторіїв; у складі лікарських дозованих препаратів, які містять нетоксичні, фармацевтично прийнятні розчинники або розріджувачі. Кращою лікарською формою є покриті плівкою таблетки саксагліптину, описані в заявці на патент США № 11/137,068 з пріоритетом від 25 травня 2005 p., яку включено в даний опис за посиланням. UA 109774 C2 5 10 15 20 25 30 35 40 45 50 55 60 При здійсненні кращого способу за цим винаходом для лікування будь-якої згаданої тут хвороби, такої як діабет і споріднені хвороби, буде використовуватись фармацевтична композиція, яка містить одну або більше сполук формули І з іншими протидіабетичними препаратами або без таких препаратів, та/або препаратами проти гіперліпідемії, та/або іншим типом терапевтичних препаратів у сполученні з фармацевтичним розчинником або розріджувачем. Така фармацевтична композиція може бути складена із застосуванням звичайних твердих або рідких носіїв або розріджувачів і фармацевтичних добавок, тип яких залежить від бажаного способу введення, таких як фармацевтично прийнятні носії, наповнювачі, зв'язувальні агенти і т.п. Сполука за цим винаходом може вводитись всім видам ссавців, включаючи людей, приматів, собак і т.п., оральним шляхом, наприклад у вигляді таблеток, капсул, кульок, гранул або порошків, або вона може вводитись парентеральним шляхом у вигляді ін'єкційних препаратів, або вона може вводитись інтраназально або у вигляді трансдермальних накладок. Типові тверді препарати будуть містити від приблизно 0,1 мг до приблизно 500 мг кристалічної форми за цим винаходом. Доза для дорослих становить від 1 до 2000 мг на день і може вводитись за один прийом або за 2-4 прийоми впродовж дня. Краще, щоб кристалічна лікарська форма за цим винаходом вводилась в дозі в межах від 2,5 мг до 10 мг на день за один прийом або за 2-4 прийоми впродовж дня. Типовий ін'єкційний препарат можна одержати, помістивши асептично 250 мг сполуки формули І у флакон, асептично висушивши її виморожуванням і закупоривши флакон. Перед використанням вміст флакону змішують з 2 мл фізіологічного сольового розчину і одержують ін'єкційний препарат. Має бути зрозумілим, що конкретний рівень дози і частота введення дози для кожного даного суб'єкту будуть різними і будуть залежати від широкого кола чинників, включаючи активність використовуваної сполуки, метаболічну стабільність і тривалість дії цієї сполуки, вид, вік, масу тіла, загальний стан здоров'я, стать і раціон харчування суб'єкту, спосіб і час введення, швидкість екскреції, комбінацію лікарських препаратів і тяжкість стану, який лікується. Інгібіторну активність сполук за цим винаходом щодо DPP-4 можна оцінити за допомогою системи проб in vitro, які визначають ступінь пригнічення опосередкованого DPP-4 розщеплення відповідного субстрату або псевдосубстрату. Константу пригнічення (Кі) для інгібіторів DPP-4 за цим винаходом можна визначити методом, описаним в експериментальному розділі далі. Випробування Клонування, експресія і очистка DPP-4 людини Для одержання DPP-4 людини було здійснено ПЛР (Red-tag полімераза, Sigma) на кДНК людини з плаценти (Clontech) з використанням двох праймерів -ACGCCGACGATGAAGACA і AGGTAAAGAGAAACATTGTT, на основі нуклеотидної послідовності клону людини (номер доступу М74777). Продукти ПЛР було клоновано у вектор pcDN4/HisMax TOPO (Invitrogene). Для стабільної трансфекції клітин CHO-DG44 DPP4 знову провели через полімеразну ланцюгову реакцію з використанням праймерів GGTACCAGCGCAGAGGCTT і CTCGAGCTAAGGTAAAGAGAAACATTG, щоб створити сайти Kpnl і Xhol. Сайти Kpnl і Xhol були використані для виділення N-термінального гена з Гіс-маркерним знаком. Цей Гіс-маркерний знак, який можна відщепити і видалити ентерокіназою, було включено для забезпечення очистки за допомогою колонки TALON для проведення хроматографії за спорідненістю. Згаданий ген було введено в сайти Kpnl і Xhol вектора pD16 для стабільної трансфекції. Стабільні клітинні лінії були одержані шляхом трансфекції цього вектора експресії в клітини яєчнику китайського хом'яка (СНО-DG44) за допомогою електроімпульсного відкриття клітинних пор (так званої електропорації). Клітинну лінію CHO-DG44 було вирощено на середовищі PFCHO, доповненому НТ (гліцин, гіпоксантин і тимідин, Invitrogene), глютаміном і Рекомбуліном 7 (ICN). Потім зібрали 1×10 клітин/мл, провели трансфекцію, використавши 60 мкг ДНК, за допомогою електропорації при 300 В, після чого перенесли в колбу Т75. На третій день після трансфекції видалили доповнення НТ і почали селекцію метотрексатом (МТХ, 10 нМ, ICN). Ще через 10 днів ці клітини перенесли в індивідуальні лунки 96-лункових планшет. Кожні 10 днів концентрацію МТХ підвищували в 2-3 рази, до максимального рівня 400 нМ. Остаточний відбір стабільної клітинної лінії базувався на виході і активності експресованого білка. Спроба очистити рекомбінантний DPP-4 за допомогою смоли Talon не була успішною, даючи низькі виходи і пропускаючи через колонку більшу частину активності DPP. Тому білок було піддано подальшій очистці з використанням аніонного обміну (Sepharose Q), гельфільтрації (S-200) та колонок MonoQ з високим розкладанням. Остаточний білок давав єдину полосу на SDS-PAGE гелях. Аналіз амінокислотної послідовності виявив дві популяції DPP-4 у зразку. Одна частина цього білка мала 27 амінокислот, відсічених від N-кінця, тоді як в другій UA 109774 C2 5 10 15 20 25 частині відсутніми були 37 амінокислот N-кінця. Можна припустити, що під час виділення весь трансмембранний домен (включаючи Пс маркер) видаляється протеазами, присутніми в клітинах СНО. Загальну концентрацію білка було визначено за допомогою методу Бредфорда, а кількість активного DPP-4 було встановлено шляхом титрування цього ферменту з використанням раніше охарактеризованого інгібітору (Кі=0,4 нМ). Під час інгібування або каталізу не спостерігалось жодних ознак двофазної поведінки, а це дозволяє припустити, що обидві популяції білка є функціонально ідентичними. Тести на пригнічення DPP-4 для саксагліптину і його солей Пригнічення активності DPP-4 людини оцінювалось в умовах стану, що встановився, за підвищенням поглинання при 405 нм після розщеплення псевдосубстрату, Gly-Pro-pNA. Тести проводились на 96-лункових планшетах з використанням зчитувача планшет Thermomax. Типово реакційні суміші містили 100 мкл буферу ATE (100 мМ Aces, 52 мМ Tris, 52 мМ етаноламіну, рН 7,4), 0,45 нМ ферменту, 120 або 1000 мкМ субстрату (SKm, Km=180 мкМ) і перемінну концентрацію інгібітору. Для забезпечення стану, що встановився, для інгібіторів з повільним зв'язуванням фермент попередньо інкубували з даною сполукою впродовж 40 хвилин до додавання субстрату, щоб ініціювати реакцію. Всі серійні розведення інгібітору робились в ДМСО (диметилсульфоксид), і кінцева концентрація не перевищувала 1 %. Активність інгібітору оцінювалась шляхом підгонки даних щодо пригнічення активності до ізотерми зв'язування: ví Діапазон Фон , (1) n v I 1 IC 50 де ví - це початкова швидкість реакції при різних концентраціях інгібітору І; v - це контрольна швидкість за відсутності інгібітору; діапазон - це різниця між швидкістю без пригнічення і фоном; фон - це швидкість спонтанного гідролізу субстрату за відсутності ферменту; n - це коефіцієнт Хілла (характеризує зв'язування молекул субстрату з активними центрами ферменту). Вирахувані ІС50 при кожній концентрації субстрату були трансформовані в Kі в припущенні конкурентного пригнічення у відповідності до: Ki 30 IC50 . (2) S 1 Km Всі інгібітори були конкурентними, про що свідчить дуже добре погодження значень Kі, одержаних в тестах з високими і низькими концентраціями субстрату. У випадках, коли IC50 при низькій концентрації субстрату була близькою до концентрації ферменту, яка використовувалась в даному тесті, такі дані підганяли до рівняння Моррісона (Morrison, J.F. et al., Advances in Enzymology, 61:206 (1988)) для врахування вичерпання вільного інгібітору: E I IC50 ví 1 v0 35 40 45 50 E I IC50 2 4EI 2E , (3) де ví та v0 - це швидкості в стані, що встановився, визначені у присутності і за відсутності інгібітору; Е - це концентрація ферменту. Кожне значення ІС50 далі уточнювалось по Kі для врахування концентрації субстрату в тесті за допомогою рівняння (2). Приклади Наступні приклади призначені для того, щоб описати даний винахід більш докладно. Ці приклади, які являють собою найкращий на сьогодні спосіб, передбачуваний для здійснення цього винаходу, задумані для того, щоб ілюструвати, а не обмежувати даний винахід. Отримання сполук формули І в загальному вигляді описане в патенті США № 6,395,767, Приклад 60, а також в публікації US2005/0090539 А1 від 28 квітня 2005 p., Схеми VII і VIIB та Приклади 41 і 42. Патент США № 6,395,767 і публікація US2005/0090539 А1 в повному об'ємі включені в даний опис за посиланням. Приклад 1 Приготування форми моногідрату вільної основи саксагліптину (Н-1 форма) 18 г Вос-захищеного саксагліптину ІА помістили в колбу з трьома шийками, оснащену механічною мішалкою, термопарою і впускним каналом для газу N 2. Додали етилацетат (180 мл), щоб розчинити Вос-захищений саксагліптин. Потім додали 14,8 мл 37 % соляної кислоти, і суміш перемішували при 23 °С впродовж 4 годин, чого було достатньо, щоб реакція закінчилась. Додали 180 мл етилацетату і охолодили реакційну колбу до 16 °С. UA 109774 C2 5 10 15 20 25 30 35 40 45 50 55 До охолодженої колби з реакційною сумішшю додали безводний калію карбонат (60 г), і одержану суміш перемішували при кімнатній температурі впродовж 2 годин. Тверду речовину, що утворилась, відфільтрували, корж промили 100 мл етилацетату, а фільтрат зібрали і концентрували приблизно до 61 г. По краплі додали до фільтрату 1 мл води, і суміш перемішували, аж поки почали утворюватись кристали. По краплі додали до фільтрату ще 1 мл води, і суміш перемішували при кімнатній температурі впродовж 16 годин. Суміш профільтрували і висушили, одержавши 10,5 г моногідрату вільної основи саксагліптину (Н-1 форма); вихід 77 % (чистота 99,2 АР). Приклад 2 Приготування форми моногідрату вільної основи саксагліптину (Н-1 форма) 300 г (0,723 моль) Вос-захищеного саксагліптину ІА (концентрація 90,6 %) помістили в 12-л колбу з трьома шийками, оснащену механічною мішалкою, щупом і каналом для впуску газу N 2. Додали метиленхлорид (3 л), метиловий спирт (288 мл; 7,23 моль) і 36 % HCl (288 мл; 3,5 моль; 4,8 екв.). Суміш перемішували впродовж 18 годин, чого було достатньо для завершення реакції (Вос-захищений саксагліптин в СН2Сl2 був
ДивитисяДодаткова інформація
Автори російськоюGougoutac, Jack Z., Malley, Mary F., Dimarko, John D., Yin, Xiaotian S., Wei, Chenkou, Yu, Jurong, Vu, Truc Chi, Jones, Gregory Scott, Savage, Scott A.
МПК / Мітки
МПК: C07D 209/52, A61K 31/403, A61P 3/00
Мітки: варіанти, кристалічні, форми, саксагліптину, одержання, процес
Код посилання
<a href="https://ua.patents.su/71-109774-kristalichni-formi-saksagliptinu-ta-proces-jjogo-oderzhannya-varianti.html" target="_blank" rel="follow" title="База патентів України">Кристалічні форми саксагліптину та процес його одержання (варіанти)</a>
Наступний патент: N-вмісні гетероарильні похідні як інгібітори jak3-кінази
Випадковий патент: Напівпровідниковий термоелектричний матеріал