Ліпосоми для постачання ліків
Номер патенту: 86063
Опубліковано: 25.03.2009
Автори: Драммонд Деріл С., Хонг Кілунг, Кірпотін Дмітрій Б.
Формула / Реферат
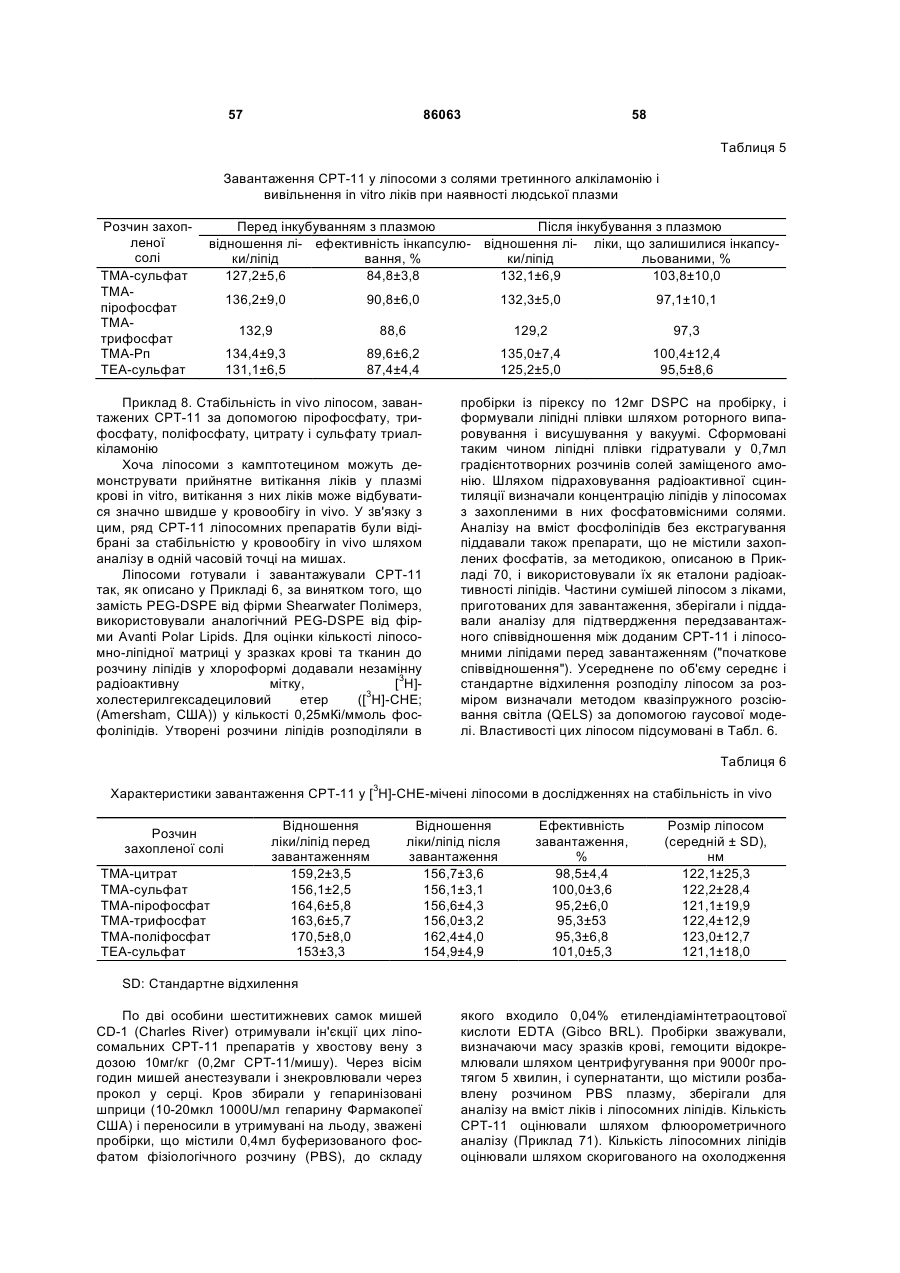
1. Композиція, що містить ліпосому в середовищі, де зазначена ліпосома має внутрішній простір, відокремлений від зазначеного середовища мембраною, що містить один чи більше ліпідів, де внутрішній простір ліпосоми містить заміщений амоній, який має формулу
R1-(R2-)N+(-R3)-R4,
де N є атом азоту амонію,
R1, R2, R3 і R4 кожний незалежно є атом водню або органічна група, яка кожна незалежно має не більше 8 атомів вуглецю, а всі разом мають не більше 18 атомів вуглецю включно, причому принаймні один із R1, R2, R3, R4 є органічною групою;
де органічною групою є незалежно алкіл, алкіліден, гетероциклічний алкіл, циклоалкіл, арил, алкеніл, циклоалкеніл або заміщена гідроксилом похідна того чи іншого із вищезазначеного, необов’язково включаючи атоми S, О або N, що утворюють етерний, естерний, тіоестерний, амінний або амідний зв’язок; і
де принаймні три із R1, R2, R3, R4 є органічними групами; або принаймні одна із органічних груп має вторинний або третинний атом вуглецю, зв’язаний безпосередньо з атомом азоту амонію; і
де зазначений внутрішній простір також містить аніон.
2. Композиція за п. 1, де кожна органічна група незалежно має не більше 6 атомів вуглецю.
3. Композиція за п. 1, де органічні групи разом мають не більше 16 атомів вуглецю.
4. Композиція за п. 1, де органічні групи разом мають не більше 12 атомів вуглецю.
5. Композиція за п. 1, де зазначений заміщений амоній утворює дійсний розчин у воді.
6. Композиція за п. 1, яка практично весь заміщений амоній містить у внутрішньому просторі ліпосоми.
7. Композиція за п. 1, де заміщений амоній є фармацевтично інертний.
8. Композиція за п. 1, де заміщений амоній вибирають із сукупності, яку складають ізопропілетиламоній, ізопропілметиламоній, діізопропіламоній, трет-бутилетиламоній, дициклогексиламоній, морфолін, піридин, піперидин, піролідин, піперазин, трет-бутиламоній, 2-амоній-2-метилпропанол-1,2-амоній-2-метилпропандіол-1,3,трис-(гідроксіетил)-амонійметан, N,N’-діетилетаноламоній, N,N',N"-трис-(2-гідроксіетил)амоній, N,N'-біс-(2-гідроксіетил)етиламоній, триметиламоній, триетиламоній, діетилметиламоній, діізопропілетиламоній, триізопропіламоній, N-метилморфолін, 1-(2-гідроксіетил)піперидин, 1-метилпіролідин, 1,4-диметилпіперазин, тетраметиламоній, тетраетиламоній і тетрабутиламоній.
9. Композиція за п. 1, де концентрація заміщеного амонію у внутрішньому просторі ліпосоми є вище концентрації заміщеного амонію у середовищі, що містить ліпосому.
10. Композиція за п. 1, де концентрація заміщеного амонію у внутрішньому просторі складає принаймні 0,05 М, 0,1 М, 0,2 М, 0,5 М, 0,6 М або 0,7 М.
11. Композиція за п. 1, де концентрація заміщеного амонію у внутрішньому просторі складає приблизно 0,65 М.
12. Композиція за п. 1, де аніоном є двовалентний аніон, тривалентний аніон, полівалентний аніон, полімерний аніон, поліаніонізований поліол або поліаніонізований цукор.
13. Композиція, що містить ліпосому в середовищі, причому зазначена ліпосома має внутрішній простір, відокремлений від середовища мембраною, що містить один чи більше ліпідів, де зазначений внутрішній простір містить аніон, вибраний із сукупності, складовими якої є поліаніонізований поліол або поліаніонізований цукор, і де зазначена ліпосома має трансмембранний градієнт, ефективний для утримування субстанції усередині цієї ліпосоми.
14. Композиція за п. 13, де трансмембранним градієнтом є іонний градієнт, градієнт іона амонію, градієнт рН, градієнт електрохімічного потенціалу, градієнт розчинності або градієнт іона заміщеного амонію, який має принаймні один C-N зв’язок.
15. Композиція за будь-яким із пп. 1-14 де зазначений аніон містить:
(і) поліольну частину, вибрану із сукупності складовими якої є моносахарид, дисахарид, лінійна полігідроксильована сполука, циклічна полігідроксильована сполука, аліфатичний спирт, що має більше однієї гідроксильної групи, аліциклічний спирт, що має більше однієї гідроксильної групи, або гетероциклічний спирт, що має більше однієї гідроксильної групи, і
(іі) зв’язані з зазначеною поліольною частиною принаймні дві сильні аніонні функціональні групи.
16. Композиція за п. 15, де принаймні однією із зазначених сильних аніонних функціональних груп є естер сірчаної кислоти, естер фосфорної кислоти, естер борної кислоти, група сульфонової кислоти, група фосфонової кислоти, група тіокарбонової кислоти, група дитіокарбонової кислоти, похідна або аналог вищезазначеного.
17. Композиція за п. 15, де зазначену поліольну частину вибирають із сукупності, складовими якої є арабіноза, рибоза, ксилоза, глюкоза, галактоза, сорбоза, фруктоза, мальтоза, сахароза, лактоза, трегалоза, етиленгліколь, пропіленгліколь, гліцерин, треїтол, еритритол, пентаеритритол, рибітол, арабітол, сорбітол, манітол, лактитол, мальтитол, фруктитол, глюцитол, ксилітол або інозитол.
18. Композиція за п. 15, де зазначеним поліаніоном є полісульфатована сахароза, яка має від 3 до 8 сульфатних груп на молекулу.
19. Композиція за п. 15, де зазначеною полісульфатованою сахарозою є сахарозаоктасульфат.
20. Композиція за п. 15, де зазначеним поліаніоном є інозитолгексафосфат.
21. Композиція за п. 15, де концентрація аніона усередні ліпосоми складає принаймні 0,05, 0,1, 0,2, 0,5, 0,6, 0,7 або 1,0 грам-еквівалент/л.
22. Композиція за п. 15, де концентрація аніона усередні ліпосоми складає приблизно 0,65 грам-еквівалента/л або приблизно 1,0 грам-еквівалент/л.
23. Композиція за будь-яким із пп. 1-22, яка містить, крім того, субстанцію, відмінну від зазначеного заміщеного амонію і зазначеного аніона.
24. Композиція за п. 23, де субстанцією є глобальна катіонна субстанція, терапевтична субстанція або маркер детектування.
25. Композиція за п. 23, де зазначена субстанція є наявною у зазначеному внутрішньому просторі в концентрації, що перевищує концентрацію цієї субстанції в зазначеному середовищі.
26. Композиція за п. 23, де зазначене середовище практично не містить зазначеної субстанції.
27. Композиція за п. 23, де молярне співвідношення субстанції до загальної кількості зазначених ліпідів складає принаймні 0,05, принаймні 0,1, принаймні приблизно 0,2, принаймні 0,3, принаймні 0,5, принаймні 0,7 або принаймні приблизно 1,0.
28. Композиція за п. 24, де зазначеною терапевтичною субстанцією є протимікробний терапевтичний засіб, антивірусний терапевтичний засіб або антинеопластичний терапевтичний засіб.
29. Композиція за п. 24, де зазначеною терапевтичною субстанцією є аміноглікозидний антибіотик або фторхінолонова сполука.
30. Композиція за п. 28, де зазначену терапевтичну субстанцію вибирають із сукупності, складовими якої є: інгібітор топоізомерази, інгібітор фамезилтрансферази, інгібітор тирозинкінази, інгібітор циклінзалежної кінази, інгібітор фосфатази, інгібітор аврора-кінази, засіб деполімеризації мікроканальців, засіб стабілізації мікроканальців, алкілувальний засіб, фермент, інгібітор ферменту, інгібітор гістондеацетилази, антиметаболіт, рецепторзв’язуючий засіб, гормон, антагоніст гормону, нуклеотид, полінуклеотид, похідна будь-якої із вищеперелічених складових, проліки будь-якої із вищеперелічених складових і аналог будь-якої із вищеперелічених складових.
31. Композиція за п. 28, де зазначений антинеопластичний терапевтичний засіб вибирають із сукупності, складовими якої є антрациклінова сполука, камптотецинова сполука, вінкаалкалоїд, еліптицинова сполука, таксанова сполука, вортманінова сполука, піразолпіримідинова сполука, похідна будь-якої із вищеперелічених складових, проліки будь-якої із вищеперелічених складових та аналог будь-якої із вищеперелічених складових.
32. Композиція за п. 24, де зазначену терапевтичну субстанцію вибирають із сукупності, складовими якої є: доксорубіцин, даунорубіцин, мітоміцин С, епірубіцин, пірарубіцин, рубідоміцин, карциноміцин, N-ацетиладріаміцин, рубідазон, 5-імідодауноміцин, N-ацетилдауноміцин, даунорилін, мітоксантрон, камптотецин, 9-амінокамптотецин, 7-етилкамптотецин, 10-гідроксикамптотецин, 9-нітрокамптотецин, 10,11-метилендіоксикамптотецин, 9-аміно-10,11-метилендіоксикамптотецин, 9-хлор-10,11-метилендіоксикамптотецин, іринотекан, топотекан, луртотекан, силатекан, 7-(4-метилпіперазинометилен)-10,11-етилендіокси-20(S)-камптотецин, 7-(4-метилпіперазинометилен)-10,11-метилендіокси-20(S)-камптотецин, 7-(2-N-ізопропіламіно)етил-(20S)-камптотецин, вінкристин, вінбластин, вінорелбін, вінфлунін, вінпоцетин, віндезин, еліптицин, 6-3-амінопропілеліптицин, 2-діетиламіноетилеліптицин і їхні солі, дателіптій, ретеліптин, паклітаксел, доцетаксел, похідна будь-якої із вищеперелічених складових, проліки будь-якої із вищеперелічених складових та аналог будь-якої із вищеперелічених складових.
33. Композиція за п. 24, де зазначену терапевтичну субстанцію вибирають із сукупності, складовими якої є: антигістамінетилендіамінова похідна, бромфеніфамін, дифенгідрамін, антипротозоалові ліки, хінолон, йодохінол, амідинова сполука, пентамідин, антигельмінтова сполука, пірантел, антишистозомальні ліки, оксамініхін, протигрибкова тризолова похідна, фліконазол, ітраконазол, кетоконазол, міконазол, протимікробний цефалоспорин, цефазолін, цефоніцид, цефотаксим, цефтазимід, цефуоксим, протимікробна похідна бета-лактаму, азтреопам, цефметазол, цефокситин, протимікробні засоби еритроміцинової групи, еритроміцин, азитроміцин, кларитроміцин, олеандоміцин, пеніцилінові сполуки, бензилпеніцилін, феноксиметилпеніцилін, клоксацилін, метицилін, нафцилін, оксацилін, карбеніцилін, тетрациклінові сполуки, новобіоцин, спектиноміцин, ванкоміцин; антимікобактеріальні ліки, амінозаліциклічна кислота, капреоміцин, етамбутол, ізоніазид, піразинамід, рифабутин, рифампін, клофазимін, антивірусні адамантанові сполуки, амантадин, римантадин, хінідинові сполуки, хінін, хінакрин, хлорхін, гідроксихлорхін, примахін, амодіахін, мефлохін, протимікробний хінолон, ципрофлоксацин, еноксацин, ломефлоксацин, налідиксинова кислота, норфлоксацин, офлоксацин, сульфонамід; протимікробний засіб лікування сечових шляхів, нітрофурантоїн, триметоприм; нітроімідазолові похідні, метронідазол, холінергічна сполука четвертинного амонію, амбетиній, неостигмін, фізостигмін, аміноакридин проти хвороби Альцгеймера, такрин, протипаркінсонові ліки, бензтропін, біпериден, проциклідин, тригексилгенідил, антимускариновий засіб, атропін, гіосціамін, скополамін, пропантелін, адренергічна сполука, допамін, серотонін, альбутерол, добутамін, ефедрин, епінефрин, норепінефрин, ізопротеренол, метапроперенол, сальметрол, тербуталін, інгібітор повторного поглинання серотоніну, ерготамінова похідна, міорелаксант ряду кураре, міорелаксант центральної дії, баклофен, циклобензепін, дентролен, нікотин, антагоніст нікотинового рецептора, бета-адреноблокатор, ацебутил, аміодарон, бензодіазепінова сполука, дитіазем, ліки проти аритмії, діізопірамід, енкаїдин, сполука для локальної анестезії, прокаїн, прокаїнамід, лідокаїн, флекаїмід, хінідин; інгібітор АСЕ, каптоприл, енелаприлат, фозинопрол, хінаприл, раміприл; похідна опіату, кодеїн, меперидин, метадон, морфін, протиліпідемічний засіб, флувастатин, гемфіброзил, інгібітор HMG-coA, правастатин, гіпотензивні ліки, клонідин, гуанабенз, празоцин, гуанетидин, гранадрил, гідралазин, некоронарний вазодилататор, дипіридамол, інгібітор ацетилхолінестерази, пілокаприн, алкалоїд, фізостигмін, неостигмін, похідна будь-якої із вищеперелічених складових, проліки будь-якої із вищеперелічених складових та аналог будь-якої із вищеперелічених складових.
34. Композиція за п. 24, де принаймні 90 % зазначеної субстанції залишаються інкапсульованими в ліпосомі через 6 місяців при температурі 2-8 °С.
35. Композиція за п. 24, де принаймні 80% зазначеної субстанції залишаються інкапсульованими в ліпосомі через 2 роки при температурі 2-8 °С.
36. Композиція за п. 24, де зазначена субстанція інкапсульована в ліпосоми зазначеної композиції з першим співвідношенням субстанція/ліпід і де через 24 години після введення зазначеної композиції у кровотік ссавця ця субстанція залишається інкапсульованою в ліпосоми з другим співвідношенням субстанція/ліпід, де друге співвідношення субстанція/ліпід є більше 50 %, принаймні 60 % або принаймні 70 % від першого співвідношення субстанція/ліпід.
37. Композиція за п. 36, де субстанцією є вінкаалкалоїд, аналог вищезазначеного або похідна вищезазначеного.
38. Композиція за п. 36, де субстанцією є вінорелбін.
39. Композиція за п. 36, де ссавцем є щур.
40. Композиція, що містить ліпосому, яка містить один чи більше ліпідів і антинеопластичну терапевтичну субстанцію, інкапсульовану в неї з молярним співвідношенням субстанція/ліпід принаймні 0,10,
де зазначена ліпосомна композиція має in vivo антинеопластичну активність, принаймні в чотири рази вищу за антинеопластичну активність субстанції у вільній, неліпосомальній формі, і
де токсичність зазначеної ліпосомної композиції, введеної ссавцю, дорівнює або є меншою токсичності цієї субстанції, введеної зазначеному ссавцю у вільній, неліпосомальній формі.
41. Композиція за п. 40, де токсичність зазначеної ліпосомної композиції, введеної ссавцю, є принаймні в два рази меншою або принаймні в три рази меншою токсичності зазначеної субстанції, введеної зазначеному ссавцю у вільній, неліпосомальній формі.
42. Композиція за п. 40, де токсичність зазначеної ліпосомноїкомпозиції, введеної ссавцю, є принаймні в чотири рази меншою токсичності зазначеної субстанції, введеної зазначеному ссавцю у вільній, неліпосомальній формі.
43. Композиція за п. 40, де субстанцією є проліки.
44. Композиція за п. 40, де зазначеною субстанцією є інгібітор камптотецинтопоізомерази І, камптотецинові проліки, аналог вищезазначеного або похідна вищезазначеного.
45. Композиція за п. 44, де зазначеними камптотециновими проліками є іринотекан.
46. Композиція за п. 44, де зазначена субстанція, введена у кровотік ссавця, має час напіввивільнення із зазначених ліпосом принаймні 10 годин.
47. Композиція за п. 44, де зазначена субстанція, введена у кровотік ссавця, має час напіввивільнення із зазначених ліпосом принаймні 24 години.
48. Композиція за п. 44, де зазначена ліпосома містить поліаніон, вибраний із сукупності, складовими якої є поліаніонізований цукор і поліаніонізований поліол.
49. Композиція за п. 48, де зазначеним поліаніоном є сахарозаоктасульфат або інозитолгексафосфат.
50. Композиція за п. 44, де зазначена ліпосома містить біорозкладаний поліаніонний полімер.
51. Композиція за п. 50 де біорозкладаним поліаніонним полімером є поліфосфат.
52. Композиція за п. 44, де зазначена ліпосома містить сполуку заміщеного амонію, яка має формулу
R1-(R2-)N+(-R3)-R4,
де N є атом азоту амонію, R1, R2, R3 і R4 кожний незалежно є атом водню або органічна група, яка кожна незалежно має не більше 8 атомів вуглецю, а всі разом мають не більше 18 атомів вуглецю включно, причому принаймні один із R1, R2, R3, R4 є органічною групою;
де органічною групою є незалежно алкіл, алкіліден, гетероциклічний алкіл, циклоалкіл, арил, алкеніл, циклоалкеніл або заміщена гідроксилом похідна того чи іншого із вищезазначеного, необов’язково включаючи атоми S, О або N, що утворюють етерний, естерний, тіоестерний, амінний або амідний зв’язок; і
де принаймні три із R1, R2, R3, R4 є органічними групами; або принаймні одна із органічних груп має вторинний або третинний атом вуглецю, зв’язаний безпосередньо з атомом азоту амонію.
53. Композиція за будь-яким із пп. 40-52, де зазначений інгібітор топоізомерази захоплений у концентрації принаймні 0,30 моль ліків на моль ліпіду.
54. Композиція за будь-яким із пп. 40-53, де зазначений інгібітор топоізомерази захоплений у концентрації в межах приблизно від 0,40 моль ліків на моль ліпіду до приблизно 1,7 моль ліків на моль ліпіду.
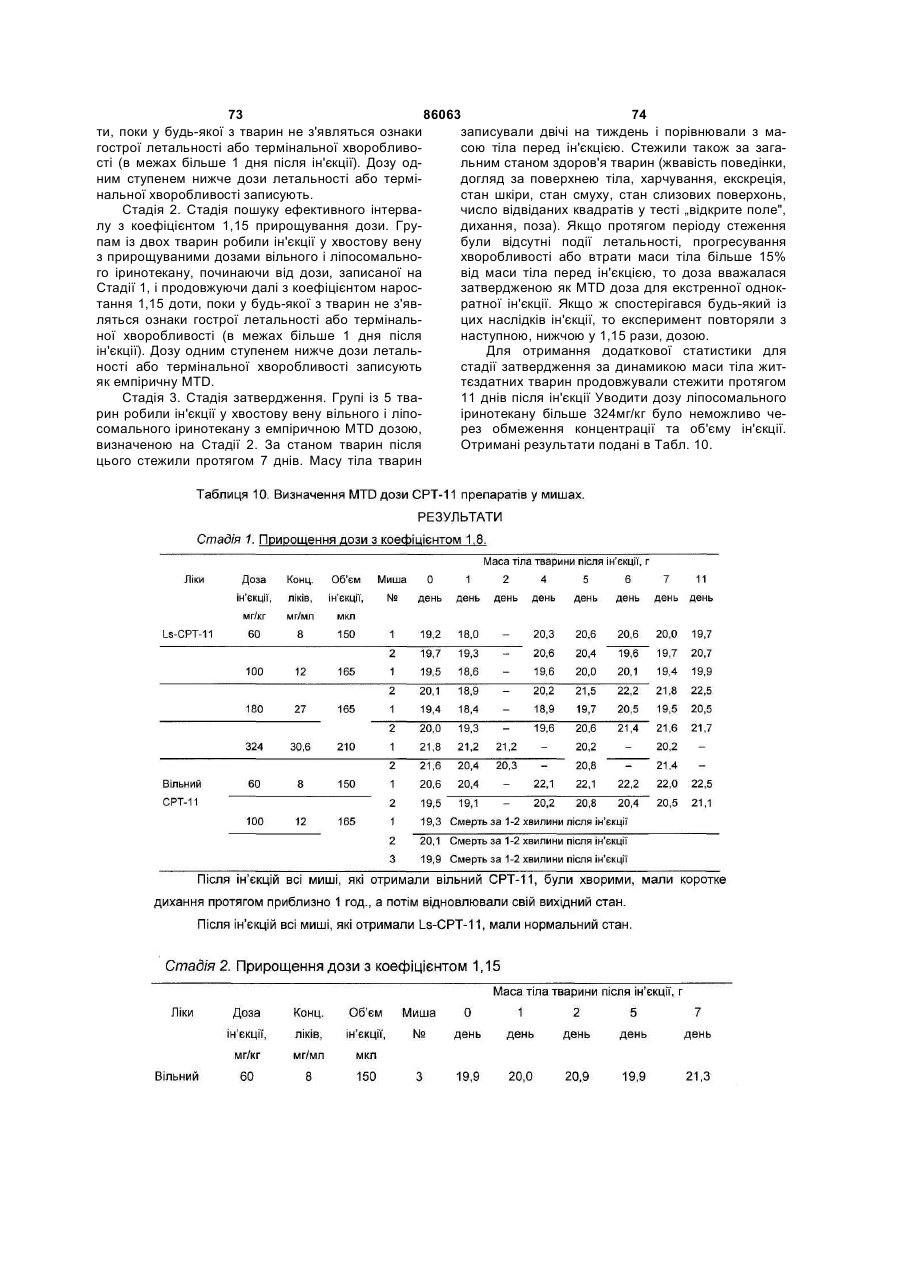
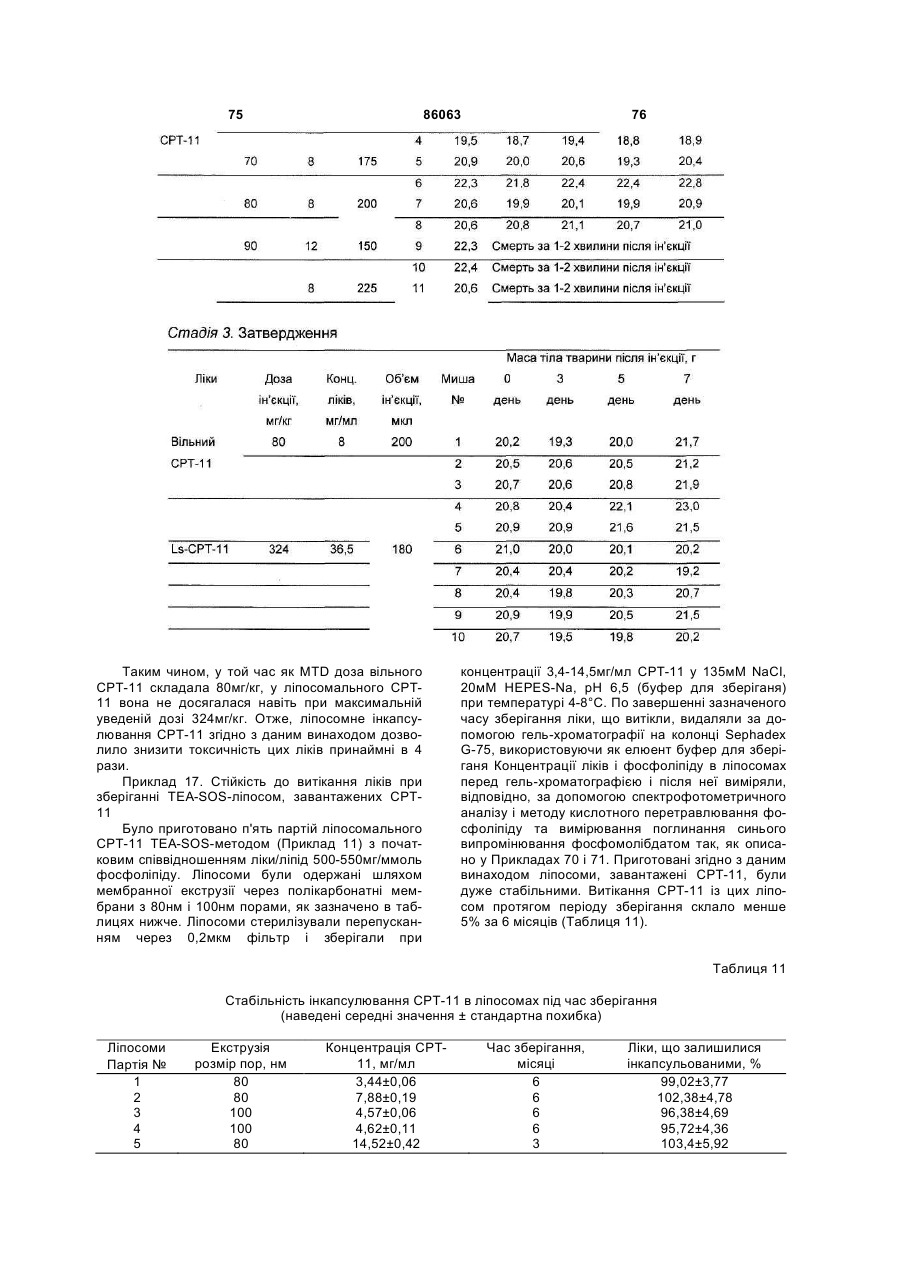
55. Композиція за пп. 40-54, де зазначеним ссавцем є миша.
56. Композиція за будь-яким із пп. 40-55, де зазначену протипухлинну активність визначають in vivo у моделі пухлини НТ-29 або у моделі пухлини ВТ-474.
57. Композиція за пп. 46-47, де зазначеним ссавцем є щур.
58. Композиція для введення вінкаалкалоїдних ліків, яка містить ліпосоми в середовищі, причому зазначені ліпосоми мають внутрішній простір і мембрану, що відокремлює цей внутрішній простір від зазначеного середовища, причому зазначена мембрана містить один чи більше ліпідів, а зазначені ліпосоми містять вінкаалкалоїдні ліки, захоплені в ліпосоми з першим співвідношенням ліки/ліпід, а через 24 години після введення зазначеної композиції у кровотік ссавця вінкаалкалоїдні ліки залишаються захопленими в ліпосоми з другим співвідношенням ліки/ліпід, яке є більше приблизно 50 % від зазначеного першого співвідношення ліки/ліпід.
59. Композиція за п. 58, де зазначене друге співвідношення ліки/ліпід складає принаймні приблизно 60 % зазначеного першого співвідношення ліки/ліпід.
60. Композиція за п. 58, де зазначене друге співвідношення ліки/ліпід складає принаймні приблизно 70 % зазначеного першого співвідношення ліки/ліпід.
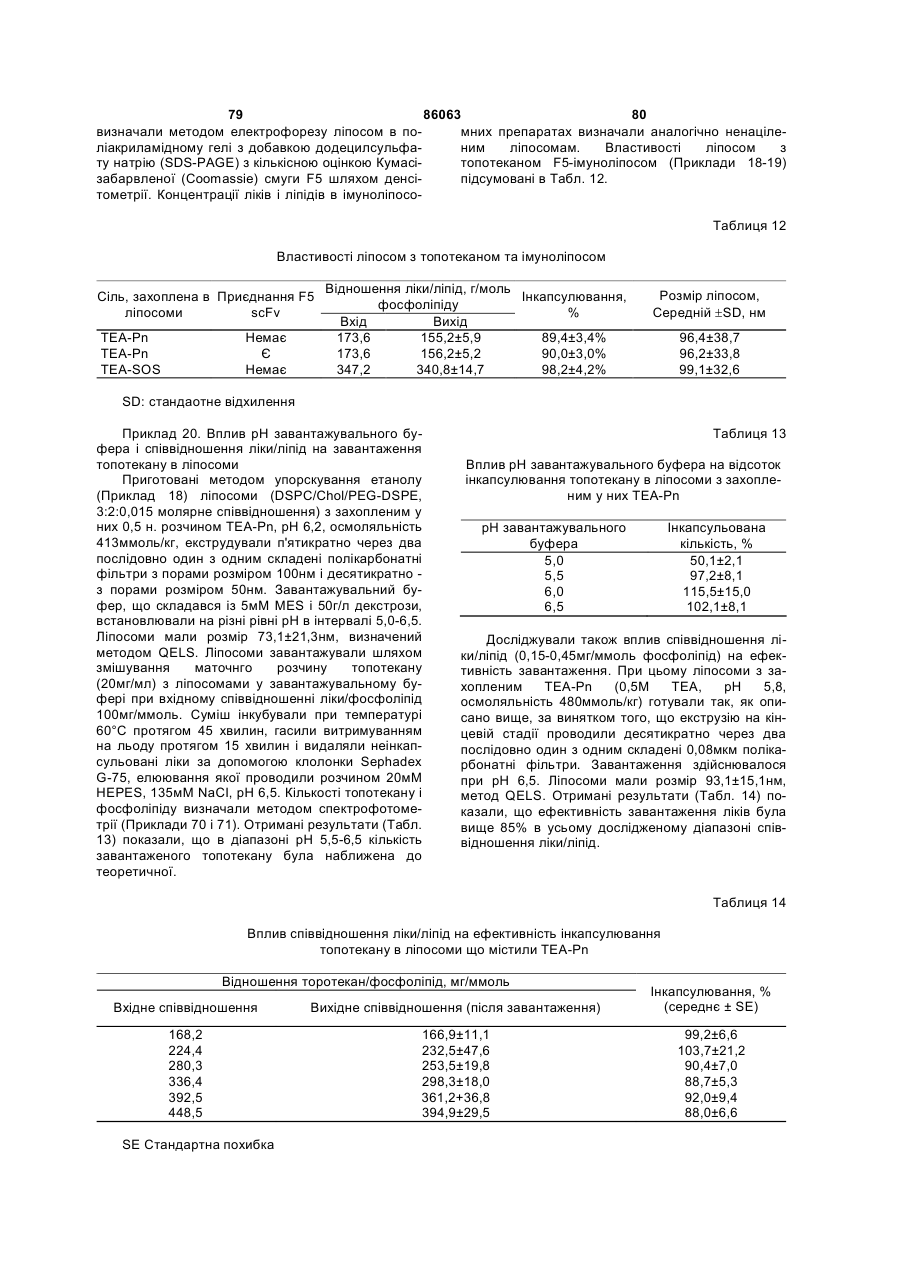
61. Композиція за п. 58-60, де зазначене перше молярне співвідношення ліки/ліпід складає принаймні 0,05, принаймні 0,1 або принаймні 0,2.
62. Композиція за п. 61, де зазначене перше масове співвідношення ліки/ліпід складає принаймні 0,05 мг/ммоль, принаймні 0,1 мг/ммоль або принаймні приблизно 0,3 мг/ммоль.
63. Композиція за будь-яким із пп. 58-62, де зазначені ліпосоми мають спрямований ізсередини назовні трансмембранний іонний градієнт, ефективний для утримування ліків усередині ліпосом.
64. Композиція за будь-яким із пп. 58-63, де зазначений внутрішній простір містить поліаніон, вибраний із сукупності, складовими якої є полімерний поліаніон, поліаніонізований поліол і поліаніонізований цукор.
65. Композиція за п. 63 або 64, де зазначений внутрішній простір містить іон амонію або іон заміщеного амонію.
66. Композиція за п. 65, де іоном заміщеного амонію є іон первинного амонію, вторинного амонію, третинного амонію або четвертинного амонію.
67. Композиція за п. 63 або 64, де зазначений внутрішній простір містить іон заміщеного амонію, який має формулу
R1-(R2-)N+(-R3)-R4,
де N є атом азоту амонію, R1, R2, R3 і R4 кожний незалежно є атом водню або органічна група, яка кожна незалежно має не більше 8 атомів вуглецю, а всі разом мають не більше 18 атомів вуглецю включно, причому принаймні один із R1, R2, R3, R4 є органічною групою;
де органічною групою є незалежно алкіл, алкіліден, гетероциклічний алкіл, циклоалкіл, арил, алкеніл, циклоалкеніл або заміщена гідроксилом похідна того чи іншого із вищезазначеного, необов’язково включаючи атоми S, О або N, що утворюють етерний, естерний, тіоестерний, амінний або амідний зв’язок; і
де принаймні три із R1, R2, R3, R4 є органічними групами; або принаймні одна із органічних груп має вторинний або третинний атом вуглецю, зв’язаний безпосередньо з атомом азоту амонію; і
де зазначений внутрішній простір також містить аніон.
68. Композиція за п. 65, де зазначений поліаніон міститься в зазначеному внутрішньому просторі в концентрації принаймні 0,05 грам-еквівалента/л, принаймні 0,2 грам-еквівалента/л, принаймні 0,5 грам-еквівалентна/літр або принаймні 0,6 грам-еквівалента/л.
69. Композиція за будь-яким із пп. 58-68, де зазначеними вінкаалкалоїдними ліками є вінкристин, вінбластин, вінорелбін, вінфлунін, віндезин, вінпоцетин, аналог вищезазначеного або похідна вищезазначеного.
70. Композиція за п. 69, де зазначений ліпід, що утворює везикулу, містить фосфатидилхолін і холестерин.
71. Композиція за п. 70, де фосфатидилхолін вибирають із сукупності, складовими якої є природний лецитин, гідрогенізований природний лецитин, синтетичний лецитин, 1,2-дистеароїллецитин, 1,2-дипальмітоїллецитин, 1,2-диміристоїллецитин, 1,2-діолеоїллецитин, 1-стеароїл-2-олеоїллецитин і 1-пальмітоїл-2-олеоїллецитин.
72. Композиція за п. 70, де зазначені фосфатидилхолін і холестерин містяться в молярному співвідношенні приблизно 3:2.
73. Композиція за будь-яким із пп. 58-68, де зазначені ліпіди містять нейтральну PEG-ліпідну похідну або аніонну PEG-ліпідну похідну.
74. Композиція за п. 73, де зазначена нейтральна PEG-ліпідна похідна міститься в кількості приблизно від 0,1 мол. % до 10 мол. % від загальної кількості зазначених ліпідів.
75. Композиція за п. 73, де зазначеною нейтральною PEG-ліпідною похідною є PEG-церамід або PEG-діацилгліцерин.
76. Композиція за п. 73, де зазначена аніонна PEG-ліпідна похідна міститься в кількості менше 1мол. % від загальної кількості ліпідів.
77. Композиція за п. 76, де зазначеною аніонною PEG-ліпідною похідною є N-(PEG)-діацилфосфатидилетаноламін.
78. Композиція за будь-яким із пп. 58-77, де зазначеним ссавцем є щур.
79. Композиція для введення вінкаалкалоїдних ліків, яка містить ліпосоми в середовищі, причому ліпосоми мають внутрішній простір і мембрану, що відокремлює цей внутрішній простір від зазначеного середовища, а мембрана містить ліпіди,
де зазначені ліпіди містять лецитин і холестерин у молярному співвідношенні приблизно 3:2; і
де зазначені вінкаалкалоїдні ліки містяться в зазначених ліпосомах у співвідношенні ліки/ліпід приблизно від 0,15 мг/ммоль лецитину до 0,55 мг/ммоль лецитину; і
де зазначений внутрішній простір також містить біорозкладаний поліаніонний полімер, поліаніонізований поліол або поліаніонізований цукор; і
де зазначений полімер або цукор міститься в зазначеному внутрішньому просторі ліпосом у концентрації приблизно від 0,5 грам-еквівалента/л до 1,0 грам-еквівалент/л; і
де зазначеними вінкаалкалоїдними ліками є вінорелбін, вінкристин або вінбластин.
80. Композиція за п. 79, де зазначеним поліаніонізованим цукром є сахарозаоктасульфат.
81. Композиція за п. 80, яка також містить іонно нейтральну полі(етиленгліколь)-ліпідну похідну в кількості приблизно від 0,1 мол. % до 10 мол. % від загальної кількості ліпідів.
82. Композиція за п. 81, де зазначеною полі(етиленгліколь)-ліпідною похідною є полі(етиленгліколь)-діалкілгліцерин, полі(етиленгліколь)-діацилгліцерин або полі(етиленгліколь)-церамід, де молекулярна маса полі(етиленглікольної) частини зазначеної полі(етиленгліколь)-ліпідної похідної складає приблизно від 250 до 10000.
83. Композиція за п. 80, яка також містить аніонну полі(етиленгліколь)-ліпідну похідну в кількості приблизно від 0,1 мол. % до 0,9 мол. % від загальної кількості ліпідів.
84. Композиція за п. 83, де зазначеною аніонною полі(етиленгліколь)-ліпідною похідною є PEG-фосфатидилетаноламін, де молекулярна маса полі(етиленглікольної) частини зазначеної полі(етиленгліколь)-ліпідної похідної складає приблизно від 250 до 10000.
85. Композиція за будь-яким із пп. 79-84, де час напіввивільнення зазначених вінкаалкалоїдних ліків із зазначених ліпосом у кровообігу ссавця складає більше 24 годин.
86. Композиція за п. 85, де ссавцем є щур.
87. Композиція, що містить ліпосому, яка має внутрішній простір і містить таксанову сполуку, практично у внутрішньому просторі зазначеної ліпосоми.
88. Композиція за п. 87, де зазначений таксан є іонно нейтральною молекулою.
89. Композиція за п. 88, де молекулярна структура зазначеного таксану не містить гідрофільної полімерної частини.
90. Композиція за будь-яким із пп. 87-89, де кількість зазначеного інкапсульованого таксану складає принаймні 0,05 моль на моль зазначеного ліпіду.
91. Композиція за п. 89, де кількість зазначеного інкапсульованого таксану складає принаймні 0,1 моль на моль зазначеного ліпіду.
92. Композиція за будь-яким із пп. 87-91, де зазначений внутрішній простір практично не містить солюбілізувальної добавки, вибраної серед міцелоутворювальних поверхнево-активних сполук і циклодекстринових сполук.
93. Композиція за будь-яким із пп. 87-92, де зазначеним таксаном є паклітаксел або доцетаксел.
94. Композиція за будь-яким із попередніх пунктів, де зазначені ліпіди містять ліпід, дериватизований гідрофільним полімером.
95. Композиція за п. 94, де зазначений ліпід, дериватизований гідрофільним полімером, складає до 20 мол. % від загальної кількості зазначених ліпідів.
96. Композиція за п. 94, де зазначений ліпід, дериватизований гідрофільним полімером, складає менше 1 мол. % від загальної кількості зазначених ліпідів.
97. Композиція за п. 94, де зазначена ліпосома має тривалість знаходження у кровообігу ссавця менше, ніж вдвічі вище тривалості знаходження в кровообігу ліпосоми такого ж складу, за винятком відсутності в ньому зазначеного ліпіду, дериватизованого гідрофільним полімером.
98. Композиція за п. 97, де зазначеним ссавцем є щур.
99. Композиція за п. 96 де зазначений ліпід, дериватизований гідрофільним полімером, складає приблизно від 0,1 мол. % до 0,9 мол. % від загальної кількості зазначених ліпідів.
100. Композиція за будь-яким із пп. 94-99, де зазначеним гідрофільним полімером є полі(етиленгліколь) або його похідна.
101. Композиція за будь-яким із пп. 94-100, де зазначеним ліпідом, дериватизованим гідрофільним полімером, є дериватизований полі(етиленгліколем) фосфоліпід, дериватизований полі(етиленгліколем) діацилгліцерин, дериватизований полі(етиленгліколем) діалкілгліцерин, дериватизований полі(етиленгліколем) церамід, дериватизована полі(етиленгліколем) жирна кислота, дериватизований полі(етиленгліколем) жирний спирт або дериватизований полі(етиленгліколем) стерин.
102. Композиція за будь-яким із пп. 94-101, де зазначеним гідрофільним полімером є полі(етиленгліколь), який має принаймні три етиленглікольні блоки.
103. Композиція за будь-яким із пп. 94-101, де зазначеним гідрофільним полімером є полі(етиленгліколь), який має молекулярну масу приблизно від 200 до 10000.
104. Композиція за будь-яким із пп. 94-101, де зазначеним гідрофільним полімером є полі(етиленгліколь), який має молекулярну масу приблизно від 500 до 5000.
105. Композиція за будь-яким із попередніх пунктів, де зазначена ліпосома містить націлювальну частину.
106. Композиція за п. 105, де зазначеною націлювальною частиною є білок, пептид, полісахарид, полінуклеотид, природна мала молекула, синтетична мала молекула, їх комбінація або похідна вищезазначеного.
107. Композиція за п. 105, де зазначеною націлювальною частиною є природно, синтетично або рекомбінантно вироблений білок, який містить антигензв’язуючу послідовність антитіла.
108. Композиція за п. 105, де зазначеною націлювальною частиною є антитіло, його антигензв’язуючий фрагмент, моноланцюговий білок, що містить антигензв’язуючі поліпептидні послідовності антитіла, монодоменне антитіло, аналог будь-якої із вищеперелічених складових або похідна будь-якої із вищеперелічених складових.
109. Композиція за п. 105, де зазначена націлювальна частина зв’язана із зазначеною ліпосомною мембраною і піддається дії зазначеного середовища.
110. Композиція за п. 109, де зазначена зв’язана націлювальна частина містить гідрофільний полімер, який зв’язує зазначену ліпосомну мембрану із зазначеною частиною.
111. Композиція за п. 110, де зазначеним гідрофільним полімером є полі(етиленгліколь).
112. Композиція за п. 111, де зазначений полі(етиленгліколь) має молекулярну масу приблизно від 250 до 30000.
113. Композиція за будь-яким із пп. 104-112, де зазначена націлювальна частина здійснює поглинання зазначеної ліпосоми в клітині.
114. Композиція за будь-яким із пп. 104-112, де зазначена націлювальна частина селективно зв’язується з рецептором тирозинкінази, рецептором фактора росту, рецептором ангіогенного фактора, рецептором трансферину, молекулою клітинної адгезії або рецептором вітаміну.
115. Композиція за п. 114, де зазначеним рецептором тирозинкінази є рецептор фактора росту.
116. Композиція за п. 115, де зазначеним тирозинкіназним рецептором фактора росту є EGFR, ErbB-2 (HER-2), ErbB-3 (HER3) або ErbB-4 (HER4).
117. Композиція за п. 114, де зазначеним рецептором ангіогенного фактора є рецептор bFGF або рецептор VEGF.
118. Композиція за п. 114, де зазначеною молекулою адгезії клітини є інтегрин.
119. Композиція за будь-яким із пп. 113-118, де зазначеною клітиною є злоякісна клітина.
120. Процес інкапсулювання субстанції в ліпосому, в якому здійснюють стадію контактування композиції за будь-яким із пп. 1-22 із субстанцією протягом часу, достатнього для того, щоб зазначена субстанція стала інкапсульованою у зазначену ліпосому.
121. Процес за п. 120, де принаймні частина зазначеної субстанції входить у внутрішній простір ліпосоми.
122. Процес за п. 120, де принаймні 90 % зазначеної субстанції входить у внутрішній простір ліпосоми.
123. Процес за п. 120, де частина зазначеної субстанції, що стає інкапсульованою в ліпосому, є принаймні 80 %-ною, принаймні 90 %-ною або принаймні 95 %-ною.
124. Процес за п. 120, де субстанцією є глобально катіонна субстанція, терапевтична субстанція або маркер детектування.
125. Процес за п. 120, де молярне відношення зазначеної субстанції до загальної кількості зазначених ліпідів складає принаймні 0,05, приблизно 0,1, приблизно 0,2 або приблизно 0,3.
126. Процес за п. 120, де зазначеною терапевтичною субстанцією є протимікробний терапевтичний засіб, антивірусний терапевтичний засіб або антинеопластичний терапевтичний засіб.
127. Процес за п. 120, де зазначеною терапевтичною субстанцією є аміноглікозидний антибіотик або похідна фторхінолону.
128. Процес за п. 124, де зазначену терапевтичну субстанцію вибирають із сукупності, складовими якої є: інгібітор топоізомерази, інгібітор фамезилтрансферази, інгібітор тирозинкінази, інгібітор циклінзалежної кінази, інгібітор фосфатази, інгібітор аврора-кінази, засіб деполімеризації мікроканальців, засіб стабілізації мікроканальців, алкілувальний засіб, фермент, інгібітор ферменту, інгібітор гістондеацетилази, антиметаболіт, рецепторзв’язуючий засіб, гормон, антагоніст гормону, нуклеотид, полінуклеотид, похідна будь-якої із вищеперелічених складових, проліки будь-якої із вищеперелічених складових і аналог будь-якої із вищеперелічених складових.
129. Процес за п. 124, де зазначену терапевтичну субстанцію вибирають із сукупності, складовими якої є антрациклінова сполука, камптотецинова сполука, вінкаалкалоїд, еліптицинова сполука, таксанова сполука, вортманінова сполука, піразолпіримідинова сполука, похідна будь-якої із вищеперелічених складових, проліки будь-якої із вищеперелічених складових та аналог будь-якої із вищеперелічених складових.
130. Процес за п. 124, де зазначену терапевтичну субстанцію вибирають із сукупності, складовими якої є: доксорубіцин, даунорубіцин, мітоміцин С, епірубіцин, пірарубіцин, рубідоміцин, карциноміцин, N-ацетиладріаміцин, рубідазон, 5-імідодауноміцин, N-ацетилдауноміцин, даунорилін, мітоксантрон, камптотецин, 9-амінокамптотецин, 7-етилкамптотецин, 10-гідроксикамптотецин, 9-нітрокамптотецин, 10,11-метилендіоксикамптотецин, 9-аміно-10,11-метилендіоксикамптотецин, 9-хлор-10,11-метилендіоксикамптотецин, іринотекан, топотекан, луртотекан, силатекан, 7-(4-метилпіперазинометилен)-10,11-етилендіокси-20(S)-камптотецин, 7-(4-метилпіперазинометилен)-10,11-метилендіокси-20(S)-камптотецин, 7-(2-N-ізопропіламіно)етил-(20S)-камптотецин, вінкристин, вінбластин, вінорелбін, вінфлунін, вінпоцетин, віндезин, еліптицин, 6-3-амінопропілеліптицин, 2-діетиламіноетилеліптицин і їхні солі, дателіптій, ретеліптин, паклітаксел, доцетаксел, похідна будь-якої із вищеперелічених складових, проліки будь-якої із вищеперелічених складових та аналог будь-якої із вищеперелічених складових.
131. Процес за п. 124, де зазначену терапевтичну субстанцію вибирають із сукупності, складовими якої є: антигістамінетилендіамінова похідна, бромфеніфамін, дифенгідрамін, антипротозоалові ліки, хінолон, йодохінол, амідинова сполука, пентамідин, антигельмінтова сполука, пірантел, антишистозомальні ліки, оксамініхін, протигрибкова тризолова похідна, фліконазол, ітраконазол, кетоконазол, міконазол, протимікробний цефалоспорин, цефазолін, цефоніцид, цефотаксим, цефтазимід, цефуоксим, протимікробна похідна бета-лактаму, азтреопам, цефметазол, цефокситин, протимікробні засоби еритроміцинової групи, еритроміцин, азитроміцин, кларитроміцин, олеандоміцин, пеніцилінові сполуки, бензилпеніцилін, феноксиметилпеніцилін, клоксацилін, метицилін, нафцилін, оксацилін, карбеніцилін, тетрациклінові сполуки, новобіоцин, спектиноміцин, ванкоміцин; антимікобактеріальні ліки, амінозаліциклічна кислота, капреоміцин, етамбутол, ізоніазид, піразинамід, рифабутин, рифампін, клофазимін, антивірусні адамантанові сполуки, амантадин, римантадин, хінідинові сполуки, хінін, хінакрин, хлорхін, гідроксихлорхін, примахін, амодіахін, мефлохін, протимікробний хінолон, ципрофлоксацин, еноксацин, ломефлоксацин, налідиксинова кислота, норфлоксацин, офлоксацин, сульфонамід; протимікробний засіб лікування сечових шляхів, нітрофурантоїн, триметоприм; нітроімідазолові похідні, метронідазол, холінергічна сполука четвертинного амонію, амбетиній, неостигмін, фізостигмін, аміноакридин проти хвороби Альцгеймера, такрин, протипаркінсонові ліки, бензтропін, біпериден, проциклідин, тригексилгенідил, антимускариновий засіб, атропін, гіосціамін, скополамін, пропантелін, адренергічна сполука, допамін, серотонін, альбутерол, добутамін, ефедрин, епінефрин, норепінефрин, ізопротеренол, метапроперенол, сальметрол, тербуталін, інгібітор повторного поглинання серотоніну, ерготамінова похідна, міорелаксант ряду кураре, міорелаксант центральної дії, баклофен, циклобензепін, дентролен, нікотин, антагоніст нікотинового рецептора, бета-адреноблокатор, ацебутил, аміодарон, бензодіазепінова сполука, дитіазем, ліки проти аритмії, діізопірамід, енкаїдин, сполука для локальної анестезії, прокаїн, прокаїнамід, лідокаїн, флекаїмід, хінідин; інгібітор АСЕ, каптоприл, енелаприлат, фозинопрол, хінаприл, раміприл; похідна опіату, кодеїн, меперидин, метадон, морфін, протиліпідемічний засіб, флувастатин, гемфіброзил, інгібітор HMG-coA, правастатин, гіпотензивні ліки, клонідин, гуанабенз, празоцин, гуанетидин, гранадрил, гідралазин, некоронарний вазодилататор, дипіридамол, інгібітор ацетилхолінестерази, пілокаприн, алкалоїд, фізостигмін, неостигмін, похідна будь-якої із вищеперелічених складових, проліки будь-якої із вищеперелічених складових та аналог будь-якої із вищеперелічених складових.
132. Процес за будь-яким із пп. 120-131, де зазначене контактування проводять у водному розчині.
133. Процес за п. 132, де зазначений водний розчин має рН в інтервалі приблизно від 4 до 7.
134. Процес за п. 132, де зазначений водний розчин має іонну силу, еквівалентну або меншу іонної сили 50 мМ хлориду натрію.
135. Процес за п. 132, де зазначений водний розчин має іонну силу, еквівалентну або меншу іонної сили 20 мМ хлориду натрію.
136. Процес за п. 132, де водний розчин має рН у межах приблизно від 6,0 до приблизно 7,0, а субстанцією є вінкаалкалоїд, аналог вищезазначеного або похідна вищезазначеного.
137. Процес за п. 136, де рН водного розчину становить приблизно 6,5, а субстанцією є вінорелбін.
138. Процес за п. 135, де рН водного розчину лежить у межах приблизно від 5 до приблизно 7, а субстанцією є камптотецинова похідна.
139. Процес за п. 139, де рН водного розчину лежить у межах приблизно від 5,0 до приблизно 6,5, а субстанцією є топотекан або іринотекан.
140. Процес за п. 134 або 135, де після зазначеного контактування іонну силу зазначеного водного розчину підвищують до рівня більше іонної сили 50 мМ хлориду натрію.
141. Процес за п. 140, де зазначена іонна сила підвищена принаймні до іонної сили 100 мМ хлориду натрію.
142. Процес за п. 141, де зазначена іонна сила підвищена принаймні до іонної сили 150 мМ хлориду натрію.
143. Процес одержання ліпосоми, що містить інкапсульовану субстанцію, де зазначений процес передбачає стадії:
(a) створення пресубстанції зазначеної субстанції;
(b) інкапсулювання зазначеної пресубстанції в ліпосому, яка має внутрішній простір;
(c) створення умов усередині ліпосоми для перетворення зазначеної інкапсульованої пресубстанції на зазначену субстанцію у внутрішньому просторі зазначеної ліпосоми з одержанням зазначеної субстанції в ліпосомально інкапсульованій формі,
де зазначеною субстанцією є органічна сполука або сполука, що містить координаційний комплекс металу групи платини.
144. Процес за п. 143, де зазначена стадія інкапсулювання передбачає контактування пресубстанції із зазначеною ліпосомою, яка має трансмембранний градієнт протягом часу, достатнього для інкапсулювання зазначеної похідної в зазначену ліпосому.
145. Процес за п. 144, де зазначеним трансмембранним градієнтом є іонний градієнт, градієнт рН, градієнт електрохімічного потенціалу або градієнт розчинності.
146. Процес за п. 144, де зазначеним іоним градієнтом є градієнт іона, вибраного із сукупності іона амонію та іона заміщеної форми амонію, що містить принаймні один C-N зв’язок.
147. Процес за п. 144, де зазначеною пресубстанцією є глобально катіонна похідна субстанції.
148. Процес за п. 143, де зазначеною сполукою є фармацевтичний засіб.
149. Процес за п. 148, де зазначеною органічною сполукою є таксанова сполука.
150. Процес за п. 149, де зазначеною таксановою сполукою є паклітаксел або доцетаксел.
151. Процес за п. 149, де зазначена пресубстанція містить естер гідроксильної групи у будь-якому із положень 2’ або 7’ молекули таксану, де зазначений естер містить амін, що титрується.
152. Процес за п. 151, де зазначеною пресубстанцією є 2’-(2-(N,N’-діетиламіно)пропіоніл)-паклітаксел або 2’-(2-(N,N’-діетиламіно)пропіоніл)-доцетаксел.
153. Процес за п. 143, де зазначеними умовами є зміна рН.
154. Процес за п. 143, де зазначеними умовами є ферментативне розщеплення лабільного зв’язку.
155. Процес за п. 143, де зазначеними умовами є процес гідролізу, фотолізу, радіолізу, міолізу, амонолізу, відновлення, заміщення, окислення або елімінування.
156. Набір для створення ліпосомально інкапсульованої субстанції, який містить композицію за будь-яким із пп. 1-22, інструкцію з використання композиції для інкапсулювання субстанції і, необов’язково, в окремому контейнері, субстанцію.
157. Набір за 156, де субстанцією є глобально катіонна субстанція, терапевтична субстанція або маркер детектування.
158. Композиція за будь-яким із пп. 1-119, де ліпосома містить сполуку заміщеного амонію, яка має у водному розчині при навколишній температурі величину рКа принаймні 8,0, принаймні 8,5, принаймні 9,0, принаймні 9,5 або принаймні 10,0.
159. Процес за будь-яким із пп. 120-142, де композиція, яку приводять в контакт із субстанцією, містить ліпосому, причому зазначена ліпосома містить сполуку заміщеного амонію, що має у водному розчині при навколишній температурі величину рКа принаймні 8,0, принаймні 8,5, принаймні 9,0, принаймні 9,5 або принаймні 10,0.
Текст
1. Композиція, що містить ліпосому в середовищі, де зазначена ліпосома має внутрішній простір, відокремлений від зазначеного середовища мембраною, що містить один чи більше ліпідів, де внутрішній простір ліпосоми містить заміщений амоній, який має формулу R1-(R2-)N+(-R3)-R4, де N є атом азоту амонію, R1, R2, R3 і R4 кожний незалежно є атом водню або органічна група, яка кожна незалежно має не більше 8 атомів вуглецю, а всі разом мають не більше 18 атомів вуглецю включно, причому принаймні один із R1, R2, R3, R4 є органічною групою; де органічною групою є незалежно алкіл, алкіліден, гетероциклічний алкіл, циклоалкіл, арил, алкеніл, циклоалкеніл або заміщена гідроксилом похідна того чи іншого із вищезазначеного, необов’язково включаючи атоми S, О або N, що утворюють етерний, естерний, тіоестерний, амінний або амідний зв’язок; і де принаймні три із R1, R2, R3, R4 є органічними групами; або принаймні одна із органічних груп має вторинний або третинний атом вуглецю, зв’язаний безпосередньо з атомом азоту амонію; і де зазначений внутрішній простір також містить аніон. 2. Композиція за п. 1, де кожна органічна група незалежно має не більше 6 атомів вуглецю. 3. Композиція за п. 1, де органічні групи разом мають не більше 16 атомів вуглецю. 4. Композиція за п. 1, де органічні групи разом мають не більше 12 атомів вуглецю. 5. Композиція за п. 1, де зазначений заміщений амоній утворює дійсний розчин у воді. 2 (19) 1 3 86063 4 градієнт розчинності або градієнт іона заміщеного 29. Композиція за п. 24, де зазначеною терапевтиамонію, який має принаймні один C-N зв’язок. чною субстанцією є аміноглікозидний антибіотик 15. Композиція за будь-яким із пп. 1-14 де зазнаабо фторхінолонова сполука. чений аніон містить: 30. Композиція за п. 28, де зазначену терапевтич(і) поліольну частину, вибрану із сукупності склану субстанцію вибирають із сукупності, складовидовими якої є моносахарид, дисахарид, лінійна ми якої є: інгібітор топоізомерази, інгібітор фамеполігідроксильована сполука, циклічна полігідрокзилтрансферази, інгібітор тирозинкінази, інгібітор сильована сполука, аліфатичний спирт, що має циклінзалежної кінази, інгібітор фосфатази, інгібібільше однієї гідроксильної групи, аліциклічний тор аврора-кінази, засіб деполімеризації мікрокаспирт, що має більше однієї гідроксильної групи, нальців, засіб стабілізації мікроканальців, алкілуабо гетероциклічний спирт, що має більше однієї вальний засіб, фермент, інгібітор ферменту, гідроксильної групи, і інгібітор гістондеацетилази, антиметаболіт, рецеп(іі) зв’язані з зазначеною поліольною частиною торзв’язуючий засіб, гормон, антагоніст гормону, принаймні дві сильні аніонні функціональні групи. нуклеотид, полінуклеотид, похідна будь-якої із 16. Композиція за п. 15, де принаймні однією із вищеперелічених складових, проліки будь-якої із зазначених сильних аніонних функціональних груп вищеперелічених складових і аналог будь-якої із є естер сірчаної кислоти, естер фосфорної кисловищеперелічених складових. ти, естер борної кислоти, група сульфонової кис31. Композиція за п. 28, де зазначений антинеоплоти, група фосфонової кислоти, група тіокарболастичний терапевтичний засіб вибирають із сукунової кислоти, група дитіокарбонової кислоти, пності, складовими якої є антрациклінова сполука, похідна або аналог вищезазначеного. камптотецинова сполука, вінкаалкалоїд, еліптици17. Композиція за п. 15, де зазначену поліольну нова сполука, таксанова сполука, вортманінова частину вибирають із сукупності, складовими якої сполука, піразолпіримідинова сполука, похідна є арабіноза, рибоза, ксилоза, глюкоза, галактоза, будь-якої із вищеперелічених складових, проліки сорбоза, фруктоза, мальтоза, сахароза, лактоза, будь-якої із вищеперелічених складових та аналог трегалоза, етиленгліколь, пропіленгліколь, гліцебудь-якої із вищеперелічених складових. рин, треїтол, еритритол, пентаеритритол, рибітол, арабітол, сорбітол, манітол, лактитол, мальтитол, 32. Композиція за п. 24, де зазначену терапевтичфруктитол, глюцитол, ксилітол або інозитол. ну субстанцію вибирають із сукупності, складови18. Композиція за п. 15, де зазначеним поліаніоми якої є: доксорубіцин, даунорубіцин, мітоміцин ном є полісульфатована сахароза, яка має від 3 С, епірубіцин, пірарубіцин, рубідоміцин, карцинодо 8 сульфатних груп на молекулу. міцин, N-ацетиладріаміцин, рубідазон, 519. Композиція за п. 15, де зазначеною полісульімідодауноміцин, N-ацетилдауноміцин, даунорилін, фатованою сахарозою є сахарозаоктасульфат. мітоксантрон, камптотецин, 9-амінокамптотецин, 20. Композиція за п. 15, де зазначеним поліаніо7-етилкамптотецин, 10-гідроксикамптотецин, 9ном є інозитолгексафосфат. нітрокамптотецин, 10,1121. Композиція за п. 15, де концентрація аніона метилендіоксикамптотецин, 9-аміно-10,11усередні ліпосоми складає принаймні 0,05, 0,1, метилендіоксикамптотецин, 9-хлор-10,110,2, 0,5, 0,6, 0,7 або 1,0 грам-еквівалент/л. метилендіоксикамптотецин, іринотекан, топотекан, 22. Композиція за п. 15, де концентрація аніона луртотекан, силатекан, 7-(4усередні ліпосоми складає приблизно 0,65 грамметилпіперазинометилен)-10,11-етилендіоксиеквівалента/л або приблизно 1,0 грам20(S)-камптотецин, 7-(4еквівалент/л. метилпіперазинометилен)-10,11-метилендіокси23. Композиція за будь-яким із пп. 1-22, яка міс20(S)-камптотецин, 7-(2-N-ізопропіламіно)етилтить, крім того, субстанцію, відмінну від зазначено(20S)-камптотецин, вінкристин, вінбластин, віного заміщеного амонію і зазначеного аніона. релбін, вінфлунін, вінпоцетин, віндезин, еліптицин, 24. Композиція за п. 23, де субстанцією є глобаль6-3-амінопропілеліптицин, 2на катіонна субстанція, терапевтична субстанція діетиламіноетилеліптицин і їхні солі, дателіптій, або маркер детектування. ретеліптин, паклітаксел, доцетаксел, похідна будь25. Композиція за п. 23, де зазначена субстанція є якої із вищеперелічених складових, проліки будьнаявною у зазначеному внутрішньому просторі в якої із вищеперелічених складових та аналог будьконцентрації, що перевищує концентрацію цієї якої із вищеперелічених складових. субстанції в зазначеному середовищі. 33. Композиція за п. 24, де зазначену терапевтич26. Композиція за п. 23, де зазначене середовище ну субстанцію вибирають із сукупності, складовипрактично не містить зазначеної субстанції. ми якої є: антигістамінетилендіамінова похідна, 27. Композиція за п. 23, де молярне співвідношенбромфеніфамін, дифенгідрамін, антипротозоалові ня субстанції до загальної кількості зазначених ліки, хінолон, йодохінол, амідинова сполука, пенліпідів складає принаймні 0,05, принаймні 0,1, тамідин, антигельмінтова сполука, пірантел, антипринаймні приблизно 0,2, принаймні 0,3, принаймшистозомальні ліки, оксамініхін, протигрибкова ні 0,5, принаймні 0,7 або принаймні приблизно 1,0. тризолова похідна, фліконазол, ітраконазол, кето28. Композиція за п. 24, де зазначеною терапевтиконазол, міконазол, протимікробний цефалоспочною субстанцією є протимікробний терапевтичрин, цефазолін, цефоніцид, цефотаксим, цефтаний засіб, антивірусний терапевтичний засіб або зимід, цефуоксим, протимікробна похідна бетаантинеопластичний терапевтичний засіб. лактаму, азтреопам, цефметазол, цефокситин, протимікробні засоби еритроміцинової групи, еритроміцин, азитроміцин, кларитроміцин, олеандомі 5 86063 6 цин, пеніцилінові сполуки, бензилпеніцилін, фено39. Композиція за п. 36, де ссавцем є щур. ксиметилпеніцилін, клоксацилін, метицилін, наф40. Композиція, що містить ліпосому, яка містить цилін, оксацилін, карбеніцилін, тетрациклінові споодин чи більше ліпідів і антинеопластичну терапелуки, новобіоцин, спектиноміцин, ванкоміцин; втичну субстанцію, інкапсульовану в неї з молярантимікобактеріальні ліки, амінозаліциклічна кисним співвідношенням субстанція/ліпід принаймні лота, капреоміцин, етамбутол, ізоніазид, пірази0,10, намід, рифабутин, рифампін, клофазимін, антивіде зазначена ліпосомна композиція має in vivo русні адамантанові сполуки, амантадин, антинеопластичну активність, принаймні в чотири римантадин, хінідинові сполуки, хінін, хінакрин, рази вищу за антинеопластичну активність субсхлорхін, гідроксихлорхін, примахін, амодіахін, метанції у вільній, неліпосомальній формі, і флохін, протимікробний хінолон, ципрофлоксацин, де токсичність зазначеної ліпосомної композиції, еноксацин, ломефлоксацин, налідиксинова кисловведеної ссавцю, дорівнює або є меншою токсичта, норфлоксацин, офлоксацин, сульфонамід; ності цієї субстанції, введеної зазначеному ссавцю протимікробний засіб лікування сечових шляхів, у вільній, неліпосомальній формі. нітрофурантоїн, триметоприм; нітроімідазолові 41. Композиція за п. 40, де токсичність зазначеної похідні, метронідазол, холінергічна сполука четвеліпосомної композиції, введеної ссавцю, є принайртинного амонію, амбетиній, неостигмін, фізостигмні в два рази меншою або принаймні в три рази мін, аміноакридин проти хвороби Альцгеймера, меншою токсичності зазначеної субстанції, введетакрин, протипаркінсонові ліки, бензтропін, біпеної зазначеному ссавцю у вільній, неліпосомальній риден, проциклідин, тригексилгенідил, антимускаформі. риновий засіб, атропін, гіосціамін, скополамін, 42. Композиція за п. 40, де токсичність зазначеної пропантелін, адренергічна сполука, допамін, сероліпосомної композиції, введеної ссавцю, є принайтонін, альбутерол, добутамін, ефедрин, епінефмні в чотири рази меншою токсичності зазначеної рин, норепінефрин, ізопротеренол, метапропересубстанції, введеної зазначеному ссавцю у вільній, нол, сальметрол, тербуталін, інгібітор повторного неліпосомальній формі. поглинання серотоніну, ерготамінова похідна, міо43. Композиція за п. 40, де субстанцією є проліки. релаксант ряду кураре, міорелаксант центральної 44. Композиція за п. 40, де зазначеною субстанцідії, баклофен, циклобензепін, дентролен, нікотин, єю є інгібітор камптотецинтопоізомерази І, камптоантагоніст нікотинового рецептора, бетатецинові проліки, аналог вищезазначеного або адреноблокатор, ацебутил, аміодарон, бензодіапохідна вищезазначеного. зепінова сполука, дитіазем, ліки проти аритмії, 45. Композиція за п. 44, де зазначеними камптотедіізопірамід, енкаїдин, сполука для локальної анециновими проліками є іринотекан. стезії, прокаїн, прокаїнамід, лідокаїн, флекаїмід, 46. Композиція за п. 44, де зазначена субстанція, хінідин; інгібітор АСЕ, каптоприл, енелаприлат, введена у кровотік ссавця, має час напіввивільфозинопрол, хінаприл, раміприл; похідна опіату, нення із зазначених ліпосом принаймні 10 годин. кодеїн, меперидин, метадон, морфін, протиліпіде47. Композиція за п. 44, де зазначена субстанція, мічний засіб, флувастатин, гемфіброзил, інгібітор введена у кровотік ссавця, має час напіввивільHMG-coA, правастатин, гіпотензивні ліки, клонідин, нення із зазначених ліпосом принаймні 24 години. гуанабенз, празоцин, гуанетидин, гранадрил, гід48. Композиція за п. 44, де зазначена ліпосома ралазин, некоронарний вазодилататор, дипіридамістить поліаніон, вибраний із сукупності, складомол, інгібітор ацетилхолінестерази, пілокаприн, вими якої є поліаніонізований цукор і поліаніонізоалкалоїд, фізостигмін, неостигмін, похідна будьваний поліол. якої із вищеперелічених складових, проліки будь49. Композиція за п. 48, де зазначеним поліаніоякої із вищеперелічених складових та аналог будьном є сахарозаоктасульфат або інозитолгексафоякої із вищеперелічених складових. сфат. 34. Композиція за п. 24, де принаймні 90 % зазна50. Композиція за п. 44, де зазначена ліпосома ченої субстанції залишаються інкапсульованими в містить біорозкладаний поліаніонний полімер. ліпосомі через 6 місяців при температурі 2-8 °С. 51. Композиція за п. 50 де біорозкладаним поліані35. Композиція за п. 24, де принаймні 80% зазнаонним полімером є поліфосфат. ченої субстанції залишаються інкапсульованими в 52. Композиція за п. 44, де зазначена ліпосома ліпосомі через 2 роки при температурі 2-8 °С. містить сполуку заміщеного амонію, яка має фор36. Композиція за п. 24, де зазначена субстанція мулу інкапсульована в ліпосоми зазначеної композиції з R1-(R2-)N+(-R3)-R4, першим співвідношенням субстанція/ліпід і де чеде N є атом азоту амонію, R1, R2, R3 і R4 кожний рез 24 години після введення зазначеної композинезалежно є атом водню або органічна група, яка ції у кровотік ссавця ця субстанція залишається кожна незалежно має не більше 8 атомів вуглецю, інкапсульованою в ліпосоми з другим співвідноа всі разом мають не більше 18 атомів вуглецю шенням субстанція/ліпід, де друге співвідношення включно, причому принаймні один із R1, R2, R3, R4 є органічною групою; субстанція/ліпід є більше 50 %, принаймні 60 % де органічною групою є незалежно алкіл, алкіліабо принаймні 70 % від першого співвідношення ден, гетероциклічний алкіл, циклоалкіл, арил, алсубстанція/ліпід. кеніл, циклоалкеніл або заміщена гідроксилом по37. Композиція за п. 36, де субстанцією є вінкаалхідна того чи іншого із вищезазначеного, калоїд, аналог вищезазначеного або похідна винеобов’язково включаючи атоми S, О або N, що щезазначеного. утворюють етерний, естерний, тіоестерний, амін38. Композиція за п. 36, де субстанцією є вінорелний або амідний зв’язок; і бін. 7 86063 8 де принаймні три із R1, R2, R3, R4 є органічними 67. Композиція за п. 63 або 64, де зазначений внугрупами; або принаймні одна із органічних груп трішній простір містить іон заміщеного амонію, має вторинний або третинний атом вуглецю, який має формулу зв’язаний безпосередньо з атомом азоту амонію. R1-(R2-)N+(-R3)-R4, 53. Композиція за будь-яким із пп. 40-52, де зазнаде N є атом азоту амонію, R1, R2, R3 і R4 кожний чений інгібітор топоізомерази захоплений у конценезалежно є атом водню або органічна група, яка нтрації принаймні 0,30 моль ліків на моль ліпіду. кожна незалежно має не більше 8 атомів вуглецю, 54. Композиція за будь-яким із пп. 40-53, де зазнаа всі разом мають не більше 18 атомів вуглецю чений інгібітор топоізомерази захоплений у концевключно, причому принаймні один із R1, R2, R3, R4 є органічною групою; нтрації в межах приблизно від 0,40 моль ліків на де органічною групою є незалежно алкіл, алкілімоль ліпіду до приблизно 1,7 моль ліків на моль ден, гетероциклічний алкіл, циклоалкіл, арил, алліпіду. кеніл, циклоалкеніл або заміщена гідроксилом по55. Композиція за пп. 40-54, де зазначеним ссавхідна того чи іншого із вищезазначеного, цем є миша. необов’язково включаючи атоми S, О або N, що 56. Композиція за будь-яким із пп. 40-55, де зазнаутворюють етерний, естерний, тіоестерний, амінчену протипухлинну активність визначають in vivo ний або амідний зв’язок; і у моделі пухлини НТ-29 або у моделі пухлини ВТде принаймні три із R1, R2, R3, R4 є органічними 474. групами; або принаймні одна із органічних груп 57. Композиція за пп. 46-47, де зазначеним ссавмає вторинний або третинний атом вуглецю, цем є щур. зв’язаний безпосередньо з атомом азоту амонію; і 58. Композиція для введення вінкаалкалоїдних де зазначений внутрішній простір також містить ліків, яка містить ліпосоми в середовищі, причому аніон. зазначені ліпосоми мають внутрішній простір і 68. Композиція за п. 65, де зазначений поліаніон мембрану, що відокремлює цей внутрішній простір міститься в зазначеному внутрішньому просторі в від зазначеного середовища, причому зазначена концентрації принаймні 0,05 грам-еквівалента/л, мембрана містить один чи більше ліпідів, а зазнапринаймні 0,2 грам-еквівалента/л, принаймні 0,5 чені ліпосоми містять вінкаалкалоїдні ліки, захопграм-еквівалента/літр або принаймні 0,6 грамлені в ліпосоми з першим співвідношенням ліеквівалента/л. ки/ліпід, а через 24 години після введення 69. Композиція за будь-яким із пп. 58-68, де зазназазначеної композиції у кровотік ссавця вінкаалкаченими вінкаалкалоїдними ліками є вінкристин, лоїдні ліки залишаються захопленими в ліпосоми з вінбластин, вінорелбін, вінфлунін, віндезин, вінподругим співвідношенням ліки/ліпід, яке є більше цетин, аналог вищезазначеного або похідна вищеприблизно 50 % від зазначеного першого співвідзазначеного. ношення ліки/ліпід. 70. Композиція за п. 69, де зазначений ліпід, що 59. Композиція за п. 58, де зазначене друге співутворює везикулу, містить фосфатидилхолін і ховідношення ліки/ліпід складає принаймні приблизлестерин. но 60 % зазначеного першого співвідношення лі71. Композиція за п. 70, де фосфатидилхолін вики/ліпід. бирають із сукупності, складовими якої є природ60. Композиція за п. 58, де зазначене друге співний лецитин, гідрогенізований природний лецитин, відношення ліки/ліпід складає принаймні приблизсинтетичний лецитин, 1,2-дистеароїллецитин, 1,2но 70 % зазначеного першого співвідношення лідипальмітоїллецитин, 1,2-диміристоїллецитин, 1,2ки/ліпід. діолеоїллецитин, 1-стеароїл-2-олеоїллецитин і 161. Композиція за п. 58-60, де зазначене перше пальмітоїл-2-олеоїллецитин. молярне співвідношення ліки/ліпід складає при72. Композиція за п. 70, де зазначені фосфатидилнаймні 0,05, принаймні 0,1 або принаймні 0,2. холін і холестерин містяться в молярному співвід62. Композиція за п. 61, де зазначене перше масоношенні приблизно 3:2. ве співвідношення ліки/ліпід складає принаймні 73. Композиція за будь-яким із пп. 58-68, де зазна0,05 мг/ммоль, принаймні 0,1 мг/ммоль або причені ліпіди містять нейтральну PEG-ліпідну похідну наймні приблизно 0,3 мг/ммоль. або аніонну PEG-ліпідну похідну. 63. Композиція за будь-яким із пп. 58-62, де зазна74. Композиція за п. 73, де зазначена нейтральна чені ліпосоми мають спрямований ізсередини наPEG-ліпідна похідна міститься в кількості приблиззовні трансмембранний іонний градієнт, ефективно від 0,1 мол. % до 10 мол. % від загальної кільний для утримування ліків усередині ліпосом. кості зазначених ліпідів. 64. Композиція за будь-яким із пп. 58-63, де зазна75. Композиція за п. 73, де зазначеною нейтральчений внутрішній простір містить поліаніон, вибраною PEG-ліпідною похідною є PEG-церамід або ний із сукупності, складовими якої є полімерний PEG-діацилгліцерин. поліаніон, поліаніонізований поліол і поліаніонізо76. Композиція за п. 73, де зазначена аніонна ваний цукор. PEG-ліпідна похідна міститься в кількості менше 65. Композиція за п. 63 або 64, де зазначений вну1мол. % від загальної кількості ліпідів. трішній простір містить іон амонію або іон заміще77. Композиція за п. 76, де зазначеною аніонною ного амонію. PEG-ліпідною похідною є N-(PEG)66. Композиція за п. 65, де іоном заміщеного амодіацилфосфатидилетаноламін. нію є іон первинного амонію, вторинного амонію, 78. Композиція за будь-яким із пп. 58-77, де зазнатретинного амонію або четвертинного амонію. ченим ссавцем є щур. 9 86063 10 79. Композиція для введення вінкаалкалоїдних 92. Композиція за будь-яким із пп. 87-91, де зазналіків, яка містить ліпосоми в середовищі, причому чений внутрішній простір практично не містить ліпосоми мають внутрішній простір і мембрану, що солюбілізувальної добавки, вибраної серед міцевідокремлює цей внутрішній простір від зазначенолоутворювальних поверхнево-активних сполук і го середовища, а мембрана містить ліпіди, циклодекстринових сполук. де зазначені ліпіди містять лецитин і холестерин у 93. Композиція за будь-яким із пп. 87-92, де зазнамолярному співвідношенні приблизно 3:2; і ченим таксаном є паклітаксел або доцетаксел. де зазначені вінкаалкалоїдні ліки містяться в за94. Композиція за будь-яким із попередніх пунктів, значених ліпосомах у співвідношенні ліки/ліпід де зазначені ліпіди містять ліпід, дериватизований приблизно від 0,15 мг/ммоль лецитину до 0,55 гідрофільним полімером. мг/ммоль лецитину; і 95. Композиція за п. 94, де зазначений ліпід, дериде зазначений внутрішній простір також містить ватизований гідрофільним полімером, складає до біорозкладаний поліаніонний полімер, поліаніоні20 мол. % від загальної кількості зазначених ліпізований поліол або поліаніонізований цукор; і дів. де зазначений полімер або цукор міститься в за96. Композиція за п. 94, де зазначений ліпід, деризначеному внутрішньому просторі ліпосом у конватизований гідрофільним полімером, складає центрації приблизно від 0,5 грам-еквівалента/л до менше 1 мол. % від загальної кількості зазначених 1,0 грам-еквівалент/л; і ліпідів. де зазначеними вінкаалкалоїдними ліками є віно97. Композиція за п. 94, де зазначена ліпосома релбін, вінкристин або вінбластин. має тривалість знаходження у кровообігу ссавця 80. Композиція за п. 79, де зазначеним поліаніоніменше, ніж вдвічі вище тривалості знаходження в зованим цукром є сахарозаоктасульфат. кровообігу ліпосоми такого ж складу, за винятком 81. Композиція за п. 80, яка також містить іонно відсутності в ньому зазначеного ліпіду, дериватинейтральну полі(етиленгліколь)-ліпідну похідну в зованого гідрофільним полімером. кількості приблизно від 0,1 мол. % до 10 мол. % 98. Композиція за п. 97, де зазначеним ссавцем є від загальної кількості ліпідів. щур. 82. Композиція за п. 81, де зазначеною по99. Композиція за п. 96, де зазначений ліпід, дерилі(етиленгліколь)-ліпідною похідною є поватизований гідрофільним полімером, складає лі(етиленгліколь)-діалкілгліцерин, поприблизно від 0,1 мол. % до 0,9 мол. % від загальлі(етиленгліколь)-діацилгліцерин або ної кількості зазначених ліпідів. полі(етиленгліколь)-церамід, де молекулярна маса 100. Композиція за будь-яким із пп. 94-99, де заполі(етиленглікольної) частини зазначеної позначеним гідрофільним полімером є полі(етиленгліколь)-ліпідної похідної складає приблі(етиленгліколь) або його похідна. лизно від 250 до 10000. 101. Композиція за будь-яким із пп. 94-100, де за83. Композиція за п. 80, яка також містить аніонну значеним ліпідом, дериватизованим гідрофільним полі(етиленгліколь)-ліпідну похідну в кількості приполімером, є дериватизований поблизно від 0,1 мол. % до 0,9 мол. % від загальної лі(етиленгліколем) фосфоліпід, дериватизований кількості ліпідів. полі(етиленгліколем) діацилгліцерин, дериватизо84. Композиція за п. 83, де зазначеною аніонною ваний полі(етиленгліколем) діалкілгліцерин, дериполі(етиленгліколь)-ліпідною похідною є PEGватизований полі(етиленгліколем) церамід, дерифосфатидилетаноламін, де молекулярна маса ватизована полі(етиленгліколем) жирна кислота, полі(етиленглікольної) частини зазначеної подериватизований полі(етиленгліколем) жирний лі(етиленгліколь)-ліпідної похідної складає прибспирт або дериватизований полі(етиленгліколем) лизно від 250 до 10000. стерин. 85. Композиція за будь-яким із пп. 79-84, де час 102. Композиція за будь-яким із пп. 94-101, де занапіввивільнення зазначених вінкаалкалоїдних значеним гідрофільним полімером є поліків із зазначених ліпосом у кровообігу ссавця лі(етиленгліколь), який має принаймні три етиленскладає більше 24 годин. глікольні блоки. 86. Композиція за п. 85, де ссавцем є щур. 103. Композиція за будь-яким із пп. 94-101, де за87. Композиція, що містить ліпосому, яка має внузначеним гідрофільним полімером є потрішній простір і містить таксанову сполуку, праклі(етиленгліколь), який має молекулярну масу тично у внутрішньому просторі зазначеної ліпосоприблизно від 200 до 10000. ми. 104. Композиція за будь-яким із пп. 94-101, де за88. Композиція за п. 87, де зазначений таксан є значеним гідрофільним полімером є поіонно нейтральною молекулою. лі(етиленгліколь), який має молекулярну масу 89. Композиція за п. 88, де молекулярна структура приблизно від 500 до 5000. зазначеного таксану не містить гідрофільної полі105. Композиція за будь-яким із попередніх пункмерної частини. тів, де зазначена ліпосома містить націлювальну 90. Композиція за будь-яким із пп. 87-89, де кільчастину. кість зазначеного інкапсульованого таксану скла106. Композиція за п. 105, де зазначеною націлюдає принаймні 0,05 моль на моль зазначеного лівальною частиною є білок, пептид, полісахарид, піду. полінуклеотид, природна мала молекула, синтети91. Композиція за п. 89, де кількість зазначеного чна мала молекула, їх комбінація або похідна виінкапсульованого таксану складає принаймні 0,1 щезазначеного. моль на моль зазначеного ліпіду. 107. Композиція за п. 105, де зазначеною націлювальною частиною є природно, синтетично або 11 86063 12 рекомбінантно вироблений білок, який містить 126. Процес за п. 120, де зазначеною терапевтичантигензв’язуючу послідовність антитіла. ною субстанцією є протимікробний терапевтичний 108. Композиція за п. 105, де зазначеною націлюзасіб, антивірусний терапевтичний засіб або антивальною частиною є антитіло, його антинеопластичний терапевтичний засіб. гензв’язуючий фрагмент, моноланцюговий білок, 127. Процес за п. 120, де зазначеною терапевтичщо містить антигензв’язуючі поліпептидні послідоною субстанцією є аміноглікозидний антибіотик вності антитіла, монодоменне антитіло, аналог або похідна фторхінолону. будь-якої із вищеперелічених складових або похі128. Процес за п. 124, де зазначену терапевтичну дна будь-якої із вищеперелічених складових. субстанцію вибирають із сукупності, складовими 109. Композиція за п. 105, де зазначена націлюваякої є: інгібітор топоізомерази, інгібітор фамезилтльна частина зв’язана із зазначеною ліпосомною рансферази, інгібітор тирозинкінази, інгібітор цикмембраною і піддається дії зазначеного середолінзалежної кінази, інгібітор фосфатази, інгібітор вища. аврора-кінази, засіб деполімеризації мікроканаль110. Композиція за п. 109, де зазначена зв’язана ців, засіб стабілізації мікроканальців, алкілувальнацілювальна частина містить гідрофільний поліний засіб, фермент, інгібітор ферменту, інгібітор мер, який зв’язує зазначену ліпосомну мембрану із гістондеацетилази, антиметаболіт, рецепзазначеною частиною. торзв’язуючий засіб, гормон, антагоніст гормону, 111. Композиція за п. 110, де зазначеним гідрофінуклеотид, полінуклеотид, похідна будь-якої із льним полімером є полі(етиленгліколь). вищеперелічених складових, проліки будь-якої із 112. Композиція за п. 111, де зазначений повищеперелічених складових і аналог будь-якої із лі(етиленгліколь) має молекулярну масу приблизвищеперелічених складових. но від 250 до 30000. 129. Процес за п. 124, де зазначену терапевтичну 113. Композиція за будь-яким із пп. 104-112, де субстанцію вибирають із сукупності, складовими зазначена націлювальна частина здійснює поглиякої є антрациклінова сполука, камптотецинова нання зазначеної ліпосоми в клітині. сполука, вінкаалкалоїд, еліптицинова сполука, 114. Композиція за будь-яким із пп. 104-112, де таксанова сполука, вортманінова сполука, піразозазначена націлювальна частина селективно лпіримідинова сполука, похідна будь-якої із вищезв’язується з рецептором тирозинкінази, рецептоперелічених складових, проліки будь-якої із вищером фактора росту, рецептором ангіогенного факперелічених складових та аналог будь-якої із тора, рецептором трансферину, молекулою клівищеперелічених складових. тинної адгезії або рецептором вітаміну. 130. Процес за п. 124, де зазначену терапевтичну 115. Композиція за п. 114, де зазначеним рецептосубстанцію вибирають із сукупності, складовими ром тирозинкінази є рецептор фактора росту. якої є: доксорубіцин, даунорубіцин, мітоміцин С, 116. Композиція за п. 115, де зазначеним тирозинепірубіцин, пірарубіцин, рубідоміцин, карциномікіназним рецептором фактора росту є EGFR, ErbBцин, N-ацетиладріаміцин, рубідазон, 52 (HER-2), ErbB-3 (HER3) або ErbB-4 (HER4). імідодауноміцин, N-ацетилдауноміцин, даунорилін, 117. Композиція за п. 114, де зазначеним рецептомітоксантрон, камптотецин, 9-амінокамптотецин, ром ангіогенного фактора є рецептор bFGF або 7-етилкамптотецин, 10-гідроксикамптотецин, 9рецептор VEGF. нітрокамптотецин, 10,11118. Композиція за п. 114, де зазначеною молекуметилендіоксикамптотецин, 9-аміно-10,11лою адгезії клітини є інтегрин. метилендіоксикамптотецин, 9-хлор-10,11119. Композиція за будь-яким із пп. 113-118, де метилендіоксикамптотецин, іринотекан, топотекан, зазначеною клітиною є злоякісна клітина. луртотекан, силатекан, 7-(4120. Процес інкапсулювання субстанції в ліпосому, метилпіперазинометилен)-10,11-етилендіоксив якому здійснюють стадію контактування компо20(S)-камптотецин, 7-(4зиції за будь-яким із пп. 1-22 із субстанцією протяметилпіперазинометилен)-10,11-метилендіоксигом часу, достатнього для того, щоб зазначена 20(S)-камптотецин, 7-(2-N-ізопропіламіно)етилсубстанція стала інкапсульованою у зазначену (20S)-камптотецин, вінкристин, вінбластин, віноліпосому. релбін, вінфлунін, вінпоцетин, віндезин, еліптицин, 121. Процес за п. 120, де принаймні частина за6-3-амінопропілеліптицин, 2значеної субстанції входить у внутрішній простір діетиламіноетилеліптицин і їхні солі, дателіптій, ліпосоми. ретеліптин, паклітаксел, доцетаксел, похідна будь122. Процес за п. 120, де принаймні 90 % зазначеякої із вищеперелічених складових, проліки будьної субстанції входить у внутрішній простір ліпоякої із вищеперелічених складових та аналог будьсоми. якої із вищеперелічених складових. 123. Процес за п. 120, де частина зазначеної субс131. Процес за п. 124, де зазначену терапевтичну танції, що стає інкапсульованою в ліпосому, є присубстанцію вибирають із сукупності, складовими наймні 80 %-ною, принаймні 90 %-ною або приякої є: антигістамінетилендіамінова похідна, бронаймні 95 %-ною. мфеніфамін, дифенгідрамін, антипротозоалові 124. Процес за п. 120, де субстанцією є глобально ліки, хінолон, йодохінол, амідинова сполука, пенкатіонна субстанція, терапевтична субстанція або тамідин, антигельмінтова сполука, пірантел, антимаркер детектування. шистозомальні ліки, оксамініхін, протигрибкова 125. Процес за п. 120, де молярне відношення тризолова похідна, фліконазол, ітраконазол, кетозазначеної субстанції до загальної кількості зазнаконазол, міконазол, протимікробний цефалоспочених ліпідів складає принаймні 0,05, приблизно рин, цефазолін, цефоніцид, цефотаксим, цефта0,1, приблизно 0,2 або приблизно 0,3. зимід, цефуоксим, протимікробна похідна бета 13 86063 14 лактаму, азтреопам, цефметазол, цефокситин, 138. Процес за п. 135, де рН водного розчину лепротимікробні засоби еритроміцинової групи, ерижить у межах приблизно від 5 до приблизно 7, а троміцин, азитроміцин, кларитроміцин, олеандомісубстанцією є камптотецинова похідна. цин, пеніцилінові сполуки, бензилпеніцилін, фено139. Процес за п. 139, де рН водного розчину лексиметилпеніцилін, клоксацилін, метицилін, жить у межах приблизно від 5,0 до приблизно 6,5, нафцилін, оксацилін, карбеніцилін, тетрациклінові а субстанцією є топотекан або іринотекан. сполуки, новобіоцин, спектиноміцин, ванкоміцин; 140. Процес за п. 134 або 135, де після зазначеноантимікобактеріальні ліки, амінозаліциклічна кисго контактування іонну силу зазначеного водного лота, капреоміцин, етамбутол, ізоніазид, піразирозчину підвищують до рівня більше іонної сили намід, рифабутин, рифампін, клофазимін, антиві50 мМ хлориду натрію. русні адамантанові сполуки, амантадин, 141. Процес за п. 140, де зазначена іонна сила римантадин, хінідинові сполуки, хінін, хінакрин, підвищена принаймні до іонної сили 100 мМ хлохлорхін, гідроксихлорхін, примахін, амодіахін, мериду натрію. флохін, протимікробний хінолон, ципрофлоксацин, 142. Процес за п. 141, де зазначена іонна сила еноксацин, ломефлоксацин, налідиксинова кислопідвищена принаймні до іонної сили 150 мМ хлота, норфлоксацин, офлоксацин, сульфонамід; риду натрію. протимікробний засіб лікування сечових шляхів, 143. Процес одержання ліпосоми, що містить інканітрофурантоїн, триметоприм; нітроімідазолові псульовану субстанцію, де зазначений процес похідні, метронідазол, холінергічна сполука четвепередбачає стадії: ртинного амонію, амбетиній, неостигмін, фізостиг(a) створення пресубстанції зазначеної субстанції; мін, аміноакридин проти хвороби Альцгеймера, (b) інкапсулювання зазначеної пресубстанції в літакрин, протипаркінсонові ліки, бензтропін, біпепосому, яка має внутрішній простір; риден, проциклідин, тригексилгенідил, антимуска(c) створення умов усередині ліпосоми для перетриновий засіб, атропін, гіосціамін, скополамін, ворення зазначеної інкапсульованої пресубстанції пропантелін, адренергічна сполука, допамін, серона зазначену субстанцію у внутрішньому просторі тонін, альбутерол, добутамін, ефедрин, епінефзазначеної ліпосоми з одержанням зазначеної рин, норепінефрин, ізопротеренол, метапропересубстанції в ліпосомально інкапсульованій формі, нол, сальметрол, тербуталін, інгібітор повторного де зазначеною субстанцією є органічна сполука поглинання серотоніну, ерготамінова похідна, міоабо сполука, що містить координаційний комплекс релаксант ряду кураре, міорелаксант центральної металу групи платини. дії, баклофен, циклобензепін, дентролен, нікотин, 144. Процес за п. 143, де зазначена стадія інкапантагоніст нікотинового рецептора, бетасулювання передбачає контактування пресубстаадреноблокатор, ацебутил, аміодарон, бензодіанції із зазначеною ліпосомою, яка має трансмембзепінова сполука, дитіазем, ліки проти аритмії, ранний градієнт протягом часу, достатнього для діізопірамід, енкаїдин, сполука для локальної анеінкапсулювання зазначеної похідної в зазначену стезії, прокаїн, прокаїнамід, лідокаїн, флекаїмід, ліпосому. хінідин; інгібітор АСЕ, каптоприл, енелаприлат, 145. Процес за п. 144, де зазначеним трансмембфозинопрол, хінаприл, раміприл; похідна опіату, ранним градієнтом є іонний градієнт, градієнт рН, кодеїн, меперидин, метадон, морфін, протиліпідеградієнт електрохімічного потенціалу або градієнт мічний засіб, флувастатин, гемфіброзил, інгібітор розчинності. HMG-coA, правастатин, гіпотензивні ліки, клонідин, 146. Процес за п. 144, де зазначеним іоним градієгуанабенз, празоцин, гуанетидин, гранадрил, гіднтом є градієнт іона, вибраного із сукупності іона ралазин, некоронарний вазодилататор, дипіридаамонію та іона заміщеної форми амонію, що місмол, інгібітор ацетилхолінестерази, пілокаприн, тить принаймні один C-N зв’язок. алкалоїд, фізостигмін, неостигмін, похідна будь147. Процес за п. 144, де зазначеною пресубстанякої із вищеперелічених складових, проліки будьцією є глобально катіонна похідна субстанції. якої із вищеперелічених складових та аналог будь148. Процес за п. 143, де зазначеною сполукою є якої із вищеперелічених складових. фармацевтичний засіб. 132. Процес за будь-яким із пп. 120-131, де зазна149. Процес за п. 148, де зазначеною органічною чене контактування проводять у водному розчині. сполукою є таксанова сполука. 133. Процес за п. 132, де зазначений водний роз150. Процес за п. 149, де зазначеною таксановою чин має рН в інтервалі приблизно від 4 до 7. сполукою є паклітаксел або доцетаксел. 134. Процес за п. 132, де зазначений водний роз151. Процес за п. 149, де зазначена пресубстанція чин має іонну силу, еквівалентну або меншу іонної містить естер гідроксильної групи у будь-якому із сили 50 мМ хлориду натрію. положень 2’ або 7’ молекули таксану, де зазначе135. Процес за п. 132, де зазначений водний розний естер містить амін, що титрується. чин має іонну силу, еквівалентну або меншу іонної 152. Процес за п. 151, де зазначеною пресубстансили 20 мМ хлориду натрію. цією є 2’-(2-(N,N’-діетиламіно)пропіоніл)136. Процес за п. 132, де водний розчин має рН у паклітаксел або 2’-(2-(N,N’-діетиламіно)пропіоніл)межах приблизно від 6,0 до приблизно 7,0, а субсдоцетаксел. танцією є вінкаалкалоїд, аналог вищезазначеного 153. Процес за п. 143, де зазначеними умовами є або похідна вищезазначеного. зміна рН. 137. Процес за п. 136, де рН водного розчину ста154. Процес за п. 143, де зазначеними умовами є новить приблизно 6,5, а субстанцією є вінорелбін. ферментативне розщеплення лабільного зв’язку. 155. Процес за п. 143, де зазначеними умовами є процес гідролізу, фотолізу, радіолізу, міолізу, амо 15 86063 16 нолізу, відновлення, заміщення, окислення або у водному розчині при навколишній температурі елімінування. величину рКа принаймні 8,0, принаймні 8,5, при156. Набір для створення ліпосомально інкапсунаймні 9,0, принаймні 9,5 або принаймні 10,0. льованої субстанції, який містить композицію за 159. Процес за будь-яким із пп. 120-142, де компобудь-яким із пп. 1-22, інструкцію з використання зиція, яку приводять в контакт із субстанцією, міскомпозиції для інкапсулювання субстанції і, неотить ліпосому, причому зазначена ліпосома місбов’язково, в окремому контейнері, субстанцію. тить сполуку заміщеного амонію, що має у 157. Набір за 156, де субстанцією є глобально водному розчині при навколишній температурі катіонна субстанція, терапевтична субстанція або величину рКа принаймні 8,0, принаймні 8,5, примаркер детектування. наймні 9,0, принаймні 9,5 або принаймні 10,0. 158. Композиція за будь-яким із пп. 1-119, де ліпосома містить сполуку заміщеного амонію, яка має Дана заявка претендує на корисний ефект від пріоритету попередньої [заявки на патент США №60/567,921 від 3 травня 2004 p.], включеної тут в усій її повноті і для всіх цілей шляхом посилання. Даний винахід в цілому стосується ліпосом, а більш конкретно - ліпосомних композицій, придатних до застосування в постачанні лікувальних або діагностичних субстанцій. Ліпосоми або ліпідні двошарові везикули знаходять різноманітне застосування в дослідженнях, промисловості і медицині, зокрема, в ролі носіїв для діагностичних або лікувальних сполук in vivo, див., наприклад, [Lasic, D. Liposomes: from physics to applications. Elsevier, Amsterdam, 1993. Lasic, D, and Papahadjopoulos, D., eds. Medical Applications of Liposomes. Elsevier, Amsterdam, 1998]. Ліпосоми звичайно характеризуються наявністю у них внутрішнього простору, відділеного від зовнішнього середовища мембраною із одного чи більше шарів, що утворюють мікроскопічний мішечок або везикулу. Двошарові мембрани ліпосом, утворені як правило із ліпідів, тобто амфіфільних молекул штучного або природного походження, складаються із поділених у просторі гідрофільних і гідрофобних доменів [Lasic D., 1993, supra]. Двошарові мембрани ліпосом можуть бути утворені також із амфіфільних полімерів і поверхнево-активних речовин (полімеросом, ніосом). Ліпосому звичайно використовують як носій для субстанції, якою може бути, наприклад, хімічна сполука, комбінація сполук, надмолекулярний комплекс штучного або природного походження, генетичний матеріал, живий організм, частина або похідна того чи іншого із вищезазначеного, що є здатною володіти корисною властивістю або активністю. Для цього ліпосоми готують таким чином, щоб вони могли вміщати у себе потрібну субстанцію у вбудованій у ліпосому формі. Процес вбудовування потрібної субстанції в ліпосому часто зветься "завантаженням". Вбудована в ліпосому субстанція може повністю або частково розташовуватися у внутрішньому просторі ліпосоми, охопленому її двошаровою мембраною, або бути зв'язаною із зовнішньою поверхнею мембрани ліпосоми. Вбудовування субстанцій в ліпосоми зветься також інкапсулюванням або захопленням. Усі три терміни - вбудовування, інкапсулювання та захоплення - використовуються в даному описі взаємозамінним чином в одному і тому ж значенні Інкапсулювання тої чи іншої субстанції в ліпосому часто застосовують з метою захисту цієї субстанції від руйнівної дії навколишнього середовища, надаючи при цьому можливість інкапсульованій субстанції вивільняти свою активність головним чином у місці або в середовищі, де така активність є корисною, і в меншій мірі в інших місцях, де така активність може бути непотрібною або небажаною. Цю функцію загальноприйнято називати „постачанням". Наприклад, лікувальна субстанція усередині ліпосоми може бути захищена від деструкції ферментами в організмі, але отримувати можливість вивільнятися із ліпосоми і чинити лікувальну дію в місці ураження хворобою. В ідеальному випадку ліпосоми можуть готуватися таким чином, щоб уміщати в собі потрібну сполуку: (і) з високою ефективністю завантаження, тобто з високим відсотком інкапсульованої субстанції відносно її кількості, використаної у процесі інкапсулювання, (іі) з великою кількістю інкапсульованої субстанції на одиницю двошарового матеріалу ліпосоми; (ііі) з високою концентрацією інкапсульованої субстанції і (iv) у стабільній формі, тобто з малим вивільненням (витіканням) інкапсульованої субстанції під час зберігання або взагалі до того, як ліпосома потрапить у місце або середовище, де замкнена в ній субстанція повинна чинити очікувану від неї дію. Таким чином, існує потреба у створенні різноманітних ліпосомних композицій, здатних виконувати функцію постачання різноманітних сполук і, зокрема, лікувальних, діагностичних або зображувальних (у візуалізації) субстанцій. В основу даного винаходу покладено встановлення того факту, що заміщені амоній і поліаніон можуть використовуватися для завантаження та утримування субстанцій усередині ліпосоми. У відповідності з цим, даним винаходом пропонуються процеси і ліпосомні композиції, корисні в постачанні різноманітних субстанцій і, зокрема, субстанцій терапевтичного призначення, тобто таких, що є підходящими для застосування в діагностиці, прогнозуванні, випробуваннях, добору, лікуванні або профілактиці небажаних медичних станів, наприклад, хвороби живого організму - людини, рослини або тварини. В одному з варіантів здійснення даного винаходу пропонується композиція, яка містить ліпосому в середовищі, де усередині ліпосоми міститься заміщений амоній 17 86063 18 винаходом, є ліпосомна композиція, що містить камптотецинову сполуку. Така композиція має протиракову активність, яка є принаймні у два, чотири або десять разів вищою, ніж у цієї ж камптотецинової сполуки, введеної аналогічним шляде R1, R2, R3 і R4 кожний незалежно є водень хом, але без композиції за даним винаходом, у той або органічна група, що має разом до 18 атомів час як токсичність зазначеної композиції не перевуглецю, причому принаймні один із R1, R2, R3 і R4 вищує токсичності камптотецинової сполуки і є є органічною групою, де органічною групою незапринаймні у два або чотири рази нижчою, ніж токлежно є вуглеводнева група, яка має до 8 атомів сичність камптотецинової сполуки, введеної анавуглецю, і зокрема є алкільна, алкіліденова, гетелогічним шляхом, але без композиції за даним роциклічна алкільна, циклоалкільна, арильна, алвинаходом. В одному з варіантів здійснення винакенільна або циклоалкенільна група або заміщена ходу камптотециновою сполукою є проліки, що гідроксилом похідна того чи іншого із вищезазнамістяться в ліпосомі в кількості принаймні 0,1мг, ченого, необов'язково включаючи в її вуглеводнепринаймні 0,2мг, принаймні 0,3мг, принаймні 0,5мг вий ланцюг атоми S, О або N, що утворюють в ній або принаймні 1мг на 1мг мембранного матеріалу етерний, естерний, тіоестерний, амінний або амідліпосоми, наприклад, ліпідів. Камптотецинова споний зв'язок, де принаймні три із R1 R2, R3 і R4 є лука у кращому варіанті інкапсульована в ліпосомі органічними групами, або заміщений амоній є степрактично в її внутрішньому просторі В одному з рично утрудненим амонієм, де внаслідок цього, варіантів здійснення винаходу камптотециновою наприклад, принаймні одна органічних груп має сполукою є іринотекан (СРТ-11). вторинний або третинний атом вуглецю, безпосеКрім того, можливим є варіант здійснення виредньо зв'язаний з атомом азоту амонію. У кранаходу, в якому композицією, запропонованою щому варіанті сполука заміщеного амонію, інкапданим винаходом, є ліпосомна композиція із вінкасульована в ліпосоми, має від'ємний логарифм алкалоїду або його похідної. Така композиція константи кислотної (депротонування) дисоціації утримує вміст ліпосоми протягом 24 годин після 24 (рКа), що складає приблизно принаймні 8,0, пригодинної експозиції її в крові ссавця in vivo на рівні наймні 8,5, принаймні 9,0, принаймні 9,5 або припринаймні 50%, принаймні 60% або принаймні наймні 10,0 у разі визначення її у водному розчині 70% від початкового завантаження ліків. Вінкаалпри нормальній температурі. калоїд або його похідна у кращому варіанті інкапВ іншому варіанті здійснення винаходу пропосулюється практично у внутрішньому просторі лінується композиція, яка містить ліпосому в серепосоми. Ссавцями, у котрих спостерігаються такі довищі, де у внутрішньому просторі ліпосоми місрезультати, є, наприклад, щури. Типовими вінкаатиться поліаніон і де цим поліанюном є лкалоїдами та їх похідними є вінкристин, вінбласполіаніонізований полюл або поліаніонізований тин і вінорелбін. цукор. Така ліпосома у кращому варіанті має транВ іншому варіанті здійснення даного винаходу смембранний градієнт, здатний здійснювати завапропонується процес інкапсулювання субстанції в нтаження в неї субстанції. В одному з варіантів ліпосому. Цей процес включає у себе приведення здійснення винаходу трансмембранним градієнтом в контакт ліпосом згідно з винаходом з даною субє градієнт амонію, четвертинного амонію або перстанцією, наприклад, терапевтичного або діагносвинної, вторинної чи третинної заміщеної сполуки тичного призначення. У кращому варіанті операцію амонію, яка в розбавленому водному розчині при приведення в контакт здійснюють в умовах, в яких нормальній температурі має від'ємний логарифм концентрація заміщеного амонію або поліаніона константи кислотної (депротонування) дисоціації згідно з винаходом у даному середовищі є мен(рКа), що складає приблизно принаймні 8,0, пришою їх концентрації у внутрішньому просторі ліпонаймні 8,5, принаймні 9,0, принаймні 9,5, або присоми. В одному з варіантів здійснення винаходу наймні 10,0. У разі потреби захопленою субстанціліпосомну композицію приводять у контакт з даєю в ліпосомі може бути, наприклад, ною субстанцією у водному середовищі. терапевтичний маркер, що детектується, або глоВ іншому варіанті здійснення даного винаходу бально катіонна органічна молекула. пропонується процес інкапсулювання субстанції в Можливим є варіант здійснення винаходу, в ліпосому. Цей процес включає у себе приведення якому запропонована композиція, крім того, місв контакт ліпосомної композиції згідно з винаходом тить субстанцію, інкапсульовану в ліпосомах згідно з пресубстанцією, яка є здатною перетворюватися з винаходом. У кращому варіанті ця субстанція на субстанцію в певних умовах, і створення цих інкапсульована у внутрішньому просторі ліпосоми. умов усередині ліпосоми, внаслідок чого пресубсУ внутрішньому просторі ліпосоми може, крім того, танція перетворюється на субстанцію усередині міститися, наприклад, антинеопластичний терапеліпосоми. В одному з варіантів субстанцією є орвтичний засіб, причому рівень токсичності даного ганічна сполука, а пресубстанцією - її основна поскладу для об'єкта його застосування повинен хідна. дорівнювати рівню токсичності антинеопластичноВ іншому варіанті здійснення даного винаходу го терапевтичного засобу або бути меншим рівня пропонується набір для готування субстанцій, інтоксичності антинеопластичного терапевтичного капсульованих у ліпосоми. До набору входять конзасобу, введеного об'єкту без складу за даним тейнер з ліпосомою згідно з винаходом і як опція винаходом. контейнер з субстанцією, а також інструкції для Можливим є також варіант здійснення винахокористувача, наприклад, як інкапсулювати субстаду, в якому композицією, запропонованою даним нцію. 19 86063 20 Перелік фігур креслення ноліпосомального топотекану (Topotecan) (метод На Фіг.1 показана фармакокінетика в крові ліTEA-SOS) проти клітин SKBr-3 раку молочної запіду ліпосоми (кружальця) і ліків (трикутники) після лози (див. Приклад 32). внутрішньовенного болюсного введення ліпосом, На Фіг.11 показана протипухлинна ефективзавантажених іринотеканом СРТ-11, щурам Заваність різноманітних препаратів топотекану (ТРТ) нтаження ліпосом здійснювалося методом ТЕА-Рn проти ксенотрансплантатів ВТ-474 раку молочної (див. Приклад 9). залози людини в «голих» мишах. Напис «Saline На Фіг.2 показана динаміка співвідношення між control» (Контроль фізіологічним розчином) озналіками і ліпідами ліпосом у крові щура in vivo після чає мишей, яким уводили носій без ліків і ліпосом внутрішньовенного болюсного введення ліпосом, (див. Приклад 29). завантажених іринотеканом СРТ-11, методом На Фіг.12 показана динаміка маси тіла тварин ТЕА-Рn (див. Приклад 9). протягом лікування «голих» мишей з пухлиною ВТНа Фіг.3 показана протипухлинна ефективність 474 вільним топотеканом (ТРТ), ліпосомальним вільного СРТ-11 і ліпосомального СРТ-11 проти топотеканом (Ls-TPT) та анти-HER2 імуноліпосоксенотрансплантатів ВТ-474 раку молочної залози мальним топотеканом (F5 ILs-TPT). Напис людини в „голих" мишах (безтимусних мишах з «Control» (контроль) позначає мишей, яким уводимутацією по гену „nude"). Напис "Control" (контли носій без ліків і ліпосом (див. Приклад 29). роль) позначає мишей, яким уводили носій без На Фіг.13А показана протипухлинна ефективліків і ліпосом (див. Приклад 10). ність препаратів топотекану проти ксенотрансплаНа Фіг.4 показана динаміка маси тіла тварин нтатів ВТ-474 раку молочної залози людини в «гопротягом часу лікування «голих» мишей, що мали лих» мишах. Вільний топотекан (вільний ТРТ) і пухлини ВТ-474, вільним СРТ-11 і ліпосомальним ліпосомальний топотекан (Ls-TPT) уводилися в СРТ-11. Напис «Control» (контроль) позначає мидозах, що становили одну восьму від їхніх максишей, яким уводили носій без ліків і ліпосом (див. мальних толерантних доз. „Вуса" похибки означаПриклад 10). ють стандартне відхилення даних експерименту. На Фіг.5 показана динаміка співвідношення між Напис «Control» (контроль) позначає мишей, яким ліками і ліпідами ліпосом у крові щура in vivo після уводили носій без ліків і ліпосом (див. Приклад внутрішньовенного болюсного введення ліпосом, 31). завантажених іринотеканом СРТ-11, методом На Фіг.13В показана протипухлинна ефективTEA-SOS (див. Приклад 14). ність препаратів топотекану проти ксенотрансплаНа Фіг.6 показана протипухлинна ефективність нтатів ВТ-474 раку молочної залози людини в «говільного і ліпосомального СРТ-11 проти трансплалих» мишах. Вільний топотекан (Free ТРТ) і нтатів НТ-29 раку товстої кишки людини в «голих» ліпосомальний топотекан (Ls-TPT) уводилися в мишах. У написі на графіку вказані використовувадозах, що становили одну четверту від їхніх макний метод завантаження ліків і доза ін'єкції. Напис симальних толерантних доз. «Вуса» похибки озна"Saline control" (Контроль фізіологічним розчином) чають стандартне відхилення даних експерименту. означає мишей, яким уводили носій без ліків і ліНапис «Control» (контроль) позначає мишей, яким посом (див. Приклад 15). уводили носій без ліків і ліпосом (див. Приклад На Фіг.7 показана динаміка маси тіла тварин 31). протягом лікування «голих» мишей з пухлиною НТНа Фіг.13С показана протипухлинна ефектив29 вільними і ліпосомальними препаратами СРТність препаратів топотекану проти ксенотранспла11. „Вуса" похибки означають стандартне відхинтатів ВТ-474 раку молочної залози людини в «голення даних експерименту. Напис «Saline control» лих» мишах. Вільний топотекан (Free ТРТ) і (Контроль фізіологічним розчином) означає миліпосомальний топотекан (Ls-TPT) уводилися в шей, яким уводили носій без ліків і ліпосом (див. дозах, що становили половину їхніх максимальних Приклад 15). толерантних доз. «Вуса» похибки означають станНа Фіг.8А показана фармакокінетика в крові дартне відхилення даних експерименту. Напис ліпідів ліпосом після внутрішньовенного болюсно«Control» (контроль) позначає мишей, яким уводиго введення щурам ліпосом з інкапсульованим у ли носій без ліків і ліпосом (див. Приклад 31). них топотепканом (Topotecan). У написі на графіку На Фіг.13D показана протипухлинна ефективвказані використовуваний метод завантаження і ність препаратів топотекану проти ксенотрансплаліки, що містилися в ліпосомах (див. Приклад 24). нтатів ВТ-474 раку молочної залози людини в «гоНа Фіг.SB показана динаміка співвідношення лих» мишах. Вільний топотекан (Free ТРТ) і між ліками і ліпідами ліпосом у крові щура in vivo ліпосомальний топотекан (Ls-TPT) уводилися в після внутрішньовенного болюсного введення щуїхніх максимальних толерантних дозах дозах. «Вурам ліпосом з інкапсульованим у них топотепкаса» похибки означають стандартне відхилення ном (Topotecan). У написі на графіку вказані викоданих експерименту. Напис «Control» (контроль) ристовуваний метод завантаження і ліки, що позначає мишей, яким уводили носій без ліків і містилися в ліпосомах (див. Приклад 24). ліпосом (див. Приклад 31). На Фіг.9 показана цитотоксичність in vitro вільНа Фіг.14 показана динаміка середньої маси ного, ліпосомального і націленого на HER2 імунотіла протягом лікування ВТ-474 «голих» мишей з ліпосомального топотекану (Topotecan) (метод пухлиною вільним топотеканом (Free ТРТ) і ліпоТЕА-Рn) проти клітин SKBr-З раку молочної залози сомальним топотеканом (Ls-TPT), що вводилися в (див. Приклад 27). їхніх максимальних толерантних дозах дозах. НаНа Фіг.10 показана цитотоксичність in vitro віпис «Control» (контроль) позначає мишей, яким льного, ліпосомального і націленого на HER2 іму 21 86063 22 уводили носій без ліків і ліпосом (див. Приклад люсного введення вінорелбіну, інкапсульованого в 31). ліпосоми (Ls-VRB), та aнти-HER2 імуноліпосоми [0033] На Фіг.15 показана цитотоксичність ві(F5-ILS-VRB) методом TEA-SOS (див. Приклад 46). льного 6-(3-амінопропіл)еліптицину (вільний АЕ), На Фіг.24 показана динаміка співвідношення ліпосомального 6-(3-амінопропіл)еліптицину (Lsміж ліками і ліпідами ліпосом у крові щура in vivo AE) і НЕR2-націленого імуноліпосомального 6-(3після внутрішньовенного болюсного введення віамінопропіл)еліптицину (F5 ІLs-AE)) проти клітин норелбіну, інкапсульованого в ліпосоми (Ls-VRB) ВТ-474 раку молочної залози in vitro (див. Приклад та aнти-HER2 імуноліпосоми (F5-ILS-VRB) мето35). дом TEA-SOS (див. Приклад 46). На Фіг.16 показана цитотоксичність in vitro віНа Фіг.25 показана цитотоксичність in vitro вільного 6-(3-амінопропіл)еліптицину (вільний АРЕ), льного вінорелбіну (вільний VRB), ліпосомального ліпосомального 6-(3-амінопропіл)еліптицину (Lsвінорелбіну (Ls-VRB) і HER2-націленого імуноліпоAPE) і EGFR-націленого імуноліпосомального 6-(3сомального вінорелбіну (F5-lls-VRB) проти клітин амінопропіл)еліптицину (С225-ІLs-APE) проти кліMDA-MB-453 раку молочної залози людини, що тин раку молочної залози з низькою (MCF-7) і венадекспресують HER2 (див. Приклад 48). ликою (MDA-MB468) експресією EGF-рецептора На Фіг.26 показана цитотоксичність in vitro ві(див. Приклад 36). льного вінорелбіну (вільний VRB), ліпосомального На Фіг.17 показані фармакокінетичні характевінорелбіну (Ls-VRB) та НЕR2-націленого імуноліристики в крові ліпосомального 6-(3посомального вінорелбіну (F5-lls-VRB) проти кліамінопропіл)еліптицину (АРЕ): фармакокінетика в тин CaLu-3 недрібноклітинного раку легенів людикрові ліпосомного ліпіду (Графік А, світлі кільця), ни, що надекспресують HER2 (див. Приклад 49). ліків (Графік А, чорні кільця), і динаміка співвідноНа Фіг.27 показана цитотоксичність in vitro вішення ліки/ліпосомний ліпід (Графік В) після внутльного вінорелбіну (вільний VRB), ліпосомального рішньовенного болюсного введення АРЕ-ліпосом вінорелбіну (Ls VRB/SOS-TEA) та HER2щурам (див. Приклад 37). націленого імуноліпосомального вінорелбіну (F5На Фіг.18 показані фармакокінетичні властивоILs VRB/SOS-TEA) проти клітин SKBr-3 раку молості в крові вінорелбіну, інкапсульованого в ліпосочної залози людини, що надекспресують HER2 ми (Ls-VRB) та анти-НЕR2 імуноліпосоми (F5-ILs(див. Приклад 50). VRB): фармакокінетика в крові ліпідів ліпосом На Фіг.28 показана протипухлинна ефектив(Графік А), ліків (Графік В) динаміка співвідношенність вільного вінорелбіну (вільний VRB) та ліпоня між ліками і ліпідами ліпосом (Графік С) після сомального вінорелбіну (Ls VRB) проти трансплавнутрішньовенного болюсного введення ліпосонтата НТ-29 раку товстої кишки людини в «голих» мального вінорелбіну щурам (див. Приклад 43). мишах. Напис «Saline» (Фізіологічний розчин) позНа Фіг.19 показана фармакокінетика в крові ліначає мишей, яких піддавали обробці носієм без підів ліпосом після внутрішньовенного болюсного ліків і ліпосом. «Вуса» похибки означають стандавведення завантажених вінорелбіном ліпосом щуртне відхилення даних експерименту (див. Прикрам. Завантаження ліпосом здійснювалося за долад 51). помогою попередньо захопленого декстрансульНа Фіг.29 показана динаміка середньої маси фату триетиламонію (DS-TEA), декстрансульфату тіла протягом лікування «голих» мишей з пухлиамонію (DS-A) та сульфату амонію (S-A) (див. ною НТ-29 вільним вінорелбіном (вільний VRB), Приклад 44). ліпосомальним вінорелбіном (Ls VRB) та мишей, На Фіг.20 показана динаміка співвідношення що оброблялися одним лише носієм (saline: фізіоміж ліками і ліпідами ліпосом у крові щура in vivo логічний розчин). «Вуса» похибки означають станпісля внутрішньовенного болюсного введення лідартне відхилення даних експерименту (див. Припосом, завантажених вінорелбіном за допомогою клад 51). попередньо захопленого декстрансульфату триеНа Фіг.30 показана протипухлинна ефективтиламонію (DS-TEA), декстрансульфату амонію ність вільного вінорелбіну (вільний VRB) та ліпо(DS-A) і сульфату амонію (S-A) (див. Приклад 44). сомального вінорелбіну (Ls VRB) у синергічній На Фіг.21 показана фармакокінетика в крові лімишачій моделі С-26 раку товстої кишки. Викориспідів ліпосом після внутрішньовенного болюсного товувана доза ліків на ін'єкцію зазначена у вікні введення завантажених вінорелбіном ліпосом щунаписів. «Вуса» похибки означають стандартне рам. Завантаження ліпосом здійснювалося за довідхилення даних експерименту. Написом „Saline" помогою попередньо захопленого сахарозаокта(Фізіологічний розчин) позначені миші, яких піддасульфату триетиламонію (TEA-SOS); середній вали обробці носієм без ліків і ліпосом (див. Прикрозмір ліпосом зазначений у вікні написів на гралад 52). фіку (див. Приклад 45). На Фіг.31 показана динаміка середньої маси На Фіг.22 показана динаміка співвідношення тіла протягом лікування мишей із синергічними між ліками і ліпідами ліпосом у крові щура in vivo пухлинами С-26 раку товстої кишки різноманітнипісля внутрішньовенного болюсного введення зами дозами вільного вінорелбіну (вільний VRB), вантажених вінорелбіном ліпосом. Завантаження ліпосомального вінорелбіну (Ls VRB) та одним ліпосом здійснювалося за допомогою попередньо лише носієм (Фізіологічний розчин). Використовузахопленого триетиламонійцукрооктасульфату вана доза ліків на ін'єкцію зазначена у вікні написів (TEA-SOS); середній розмір ліпосом зазначений у (див. Приклад 52). вікні написів на графіку (див. Приклад 45). На Фіг.32 показана протипухлинна ефективНа Фіг.23 показана фармакокінетика в крові ліність вільного вінорелбіну (Free ліки: Вільні ліки) та підів ліпосом у щура після внутрішньовенного боscFv FS-кон'югованого, aнти-HER2 імуноліпосома 23 86063 24 льного вінорелбіну, приготованого методом TEAНа Фіг.39 показана динаміка співвідношення SOS (F5-ILs-VRB TEA-SOS), aнти-HER2 імуноліпоміж ліками і ліпідами ліпосом у крові щура після сомального вінорелбіну, приготованого методом внутрішньовенного болюсного введення ліпосоTEA-Pn (F5-ILs-VRB TEA-Pn) проти ксенотранспмального вінбластину (див. Приклад 58). лантатів раку молочної залози людини (ВТ-474), На Фіг.40 показана цитотоксичність in vitro віщо надекспресують HER2 в «голих» мишах. Напильного вінкристину (Free VCR), ліпосомального сом «Saline control» (Контроль фізіологічним розвінкристину (Ls-VCR) і НЕР2-націленого імуноліпочином) позначені миші, яких піддавали обробці сомального вінкристину (F5-ILS-VCR) проти клітин одним лише носієм, що не містив ліків і ліпосом SKJBr-3 раку молочної залози людини, що надекс(див. Приклад 53). пресують HER2 (див. Приклад 61). На Фіг.33 показана динаміка середньої маси На Фіг.41 показана фармакокінетика в крові літіла протягом лікування мишей з ксенотранспланпідів ліпосом у щура після внутрішньовенного ботатами раку молочної залози людини (ВТ-474), що люсного введення вінкристину, інкапсульованого в надекспресують HER2 вільним вінорелбіном, scFv ліпосоми різного середнього розміру (зазначений у Р5-кон'югованим, aнти-HER2 імуноліпосомальним вікні написів) (див. Приклад 62). вінорелбіном, приготованим за допомогою методу На Фіг.42 показана динаміка співвідношення TEA-SOS, aнти-HER2 імуноліпосомальним вінореміж ліками і ліпідами ліпосом у крові щура після лбіном, приготованим за допомогою методу ТЕАвнутрішньовенного болюсного введення вінкрисРn та одним лише носієм. Пояснення щодо викотину, інкапсульованого в ліпосоми різного середристовуваної символіки дані у вікні написів на нього розміру (зазначений у вікні написів) (див. Фіг.32. (див. також Приклад 53). Приклад 62). На Фіг.43 показана протипухлинна ефективНа Фіг.34 показана протипухлинна ефективність вільного вінкристину (free VCR), ліпосомальність вільного вінорелбіну (Free ліки: Вільні ліки) і ного вінкристину, приготованого методом триетиscFv F5-кон'югованого, анти-НЕR2 імуноліпосомаламонійцитрату (Ls-VCR Citrate), ліпосомального льного вінорелбіну, приготованого при викорисвінкристину, приготованого методом цукрооктасутанні різних кількостей PEG-ліпіду проти ксенотральфату триетиламонію (Ls-VCR SOS) і scFv F5нсплантатів раку молочної залози людини (ВТкон'югованого, aнти-HER2 імуноліпосомального 474), що надекспресують HER2 в «голих» мишах. вінкристину, приготованого методом цукрооктасу«Вуса» похибки вказують стандартне відхилення льфату триетиламонію (F5 ІLs-VCR SOS) проти даних експерименту. Написом "Vehicle control" ксенотрансплантатів раку молочної залози людини (Контроль носієм) позначені миші, яких обробляли (ВТ-474), що надекспресують HER2, в «голих» одним лише носієм без ліків і ліпосом (див. Прикмишах. Напис «Saline control» (Контроль фізіологілад 54). чним розчином) означає мишей, яким уводили На Фіг.35 показана протипухлинна ефективносій без ліків і ліпосом (див. Приклад 64). ність вільного вінорелбіну (вільний NAV), ліпосомального вінорелбіну (NAV Lip) і FC225Fab'На Фіг.44 показана динаміка середньої маси кон’югованого, анти-EGFR-імуноліпосомального тіла протягом лікування мишей із ксенотранспланвінорелбіну (C225-NAV Lip) проти ксенотрансплантатами раку молочної залози людини (ВТ-474), що татів гліобластоми людини (U87), що надекспренадекспресують HER2, вільним вінкристином (free сують EGFR, в «голих» мишах. Написом «Saline» VCR), ліпосомальним вінкристином, приготованим (Фізіологічний розчин) позначені миші, яких обробметодом триетиламонійцитрату (Ls-VCR Citrate), ляли одним лише носієм без ліків і ліпосом (див. ліпосомальним вінкристином, приготованим метоПриклад 55). дом цукрооктасульфату триетиламонію (Ls-VCR На Фіг.36 показана фармакокінетика в крові ліSOS), scFv FS-кон'югованим, aнти-HER2 імуноліпідів ліпосом і динаміка співвідношення між ліками посомальним вінкристином, приготованим метоі ліпідами ліпосом у крові щура після внутрішньодом цукрооктасульфату триетиламонію (F5 ILsвенного болюсного введення доксорубіцину, інкапVCR SOS), та одним лише носієм (saline control: сульованого в ліпосоми за допомогою сульфату контроль фізіологічним розчином) (див. Приклад триетиламонію (див. Приклад 56). 64). На Фіг.37 показана протипухлинна ефективНа Фіг.45 показана протипухлинна ефективність ліпосомального доксорубіцину (Ls-Dox) і scFv ність вільного вінкристину (vincristine), ліпосомальFS-кон'югованого, aнти-HER2 імуноліпосомальноного вінкристину (nt-vcr) та С225 Fab'го доксорубіцину (F5 ILs-Dox), приготованого при кон'югованого, анти-EGFR імуноліпосомального використанні різних кількостей PEG-ліпіду проти вінкристину (C225-vcr) проти ксенотрансплантатів ксенотрансплантатів раку молочної залози людини раку мозгу людини (U87), що надекспресують (ВТ-474), що надекспресують HER2, в «голих» EGFRvlll, в «голих» мишах. Написом «Saline» (Фімишах. У вікні написів зазначена кількість експрезологічний розчин) позначені миші, яких піддавали сованого PEG-ліпіду, в мол. % від кількості фособробці носієм без ліків і ліпосом (див. Приклад фоліпідів ліпосом. Напис «Saline control» (Конт65). роль фізіологічним розчином) означає мишей, На Фіг.46 показана фармакокінетика СРТ-11 у яким уводили один лише носій без ліків і ліпосом крові і динаміка відсотка СРТ-11, наявного в акти(див. Приклад 57). вній формі (лактону) у крові щура після внутрішНа Фіг.38 показана фармакокінетика в крові ліньовенного болюсного введення ліпосомального посомального вінбластину у щура (див. Приклад СРТ-11 (див. Приклад 69). 58). 25 86063 26 На Фіг.47 показана фармакокінетика СРТ-11 у функціональних груп, що є нестабільними або здакрові і динаміка відсотка СРТ-11, наявного в актитними легко вступати в реакції з компонентами вній формі (лактону) у крові щура після внутрішліпосоми, до числа яких може входити також інканьовенного болюсного введення розчину вільного псульована субстанція. У цьому відношенні автоСРТ-11 (free СРТ-11) (див. Приклад 69). рами винаходу було виявлено, що ліпосомні комДаний винахід в цілому стосується процесів і позиції, які містять в їхньому внутрішньому ліпосомних композицій, придатних до застосуванпросторі незаміщений третинний і четвертинний ня в постачанні різноманітних субстанцій, зокрема, амоній, котрий не має заміщуваного водню, або терапевтичних і зображувальних засобів. Авторастерично утруднений первинний чи вторинний ми винаходу було виявлено, що заміщені амоній і амоній, у котрого доступ до атома водню в амонію поліаніон можуть використовуватися для завантає стерично утрудненим сусідньою об'ємною оргаження й утримування субстанцій, наприклад, спонічною групою, такою, що має один або два втолуки усередині ліпосом. У відповідності з цим, даринні чи третинні атоми вуглецю, зв'язані з азотом ним винаходом пропонуються ліпосомні амонію, демонструють не тільки чудову здатність композиції, набори, до яких входять заміщені амодо завантаження субстанцій, але також підвищену ній і/або поліаніон, і процеси виготовлення зазнастабільність захопленої ліпосомою субстанції, начених ліпосомних композицій. приклад, ліків, запобігаючи таким чином передчасЗгідно з однією із ознак даного винаходу заному вивільненню її із ліпосоми в живому тілі. пропоновано композицію ліпосом, які в їх внутрішВ одному з варіантів здійснення винаходу заньому просторі містять одну чи більше сполук захоплена ліпосомою сполука заміщеного амонію є міщеного амонію, що описуються формулою фармацевтично інертною, тобто не викликає спрямованої проти неї фізіологічної реакції при введенні її живому об'єкту, наприклад, людині або тварині в межах кількості мембранного матеріалу ліпосом, достатньої для постачання ефективної дози захопленої ліпосомами субстанції. В іншому варіанті здійснення винаходу заміщений амоній згідно з винаходом має прийнятний для об'єкта рівень токсичності. При цьому під прийнятним рівде R1, R2, R3 і R4 кожний незалежно є водень нем токсичності звичайно мають на увазі, що токабо органічна група, причому принаймні одним із сична доза, наприклад, максимальна толерантна R1, R2, R3 і R4 є органічна група, зокрема, алкільна, доза (MTD) або доза заміщеного амонію згідно з алкіліденова, гетероциклічна алкільна, циклоалківинаходом, яка викликає 50% летальність (LD50), льна, арильна, алкенільна або циклоалкенільна є принаймні вдвічі, принаймні вчетверо, принаймні група, або заміщена гідроксилом похідна того чи увосьмеро або принаймні вдесятеро вищою за іншого із вищезазначеного, необов'язково вклютоксичну дозу захопленої ліпосомою субстанції, чаючи в її вуглеводневий ланцюг атоми S, О або наприклад, ліків, завантажених усередину ліпосоN, що утворюють в ній, наприклад, етерний (вклюми згідно з винаходом. Наприклад, триетиламонійчаючи ацеталь або кеталь), естерний, сульфідний сульфат має прийнятний рівень токсичності згідно (тіоетерний), амінний або амідний зв'язок. Якщо з винаходом, оскільки його величина LD50 є прибпринаймні три із R1, R2, R3 і R4 є органічними грулизно в 40 вищою величини LD50 доксорубіцину, пами, то згідно з винаходом принаймні одна, а в протиракового засобу. Рівні токсичності сполук кращому варіанті дві із цих органічних груп мають заміщеного амонію або фізіологічні реакції на них, вторинний або третинний атоми вуглецю (тобто, а також субстанцій, що тут розглядаються, якщо атоми вуглецю, що мають 2 або 3 зв'язки вуглецьвони ще не є відомими, можуть бути легко встановуглець, відповідно) зв'язані безпосередньо з азовлені за допомогою звичайних методів, добре вітом амонію, тобто заміщений амоній є стерично домих фахівцям у галузі біомедицини, див., наприутрудненим. У загальному випадку відомо, що наклад, [S.C. Gad. Ліки Safety Evaluation, Wiley, New явність титрованого амонію, а саме іона незаміYork, 2002]. Один із методів кількісної оцінки токщеного амонію (NH4+), а також іонів первинного і сичності вільних ліків і/або ліків у ліпосомальних второнного алкіламонію з лінійним ланцюгом у препаратах, описаний туту Прикладі 16. внутрішньому просторі ліпосоми згідно з винахоВ одному з кращих варіантів здійснення винадом підсилює інкапсулювання слабких амфіфільходу органічні групи-замісники із сукупності R1, R2, них основ, наприклад, за механізмом "активного", R3 і R4 мають розміри та фізико-хімічні властивос"далекого" завантаження або завантаження „під ті, достатні для забезпечення того, щоб заміщений дією трансмембранного градієнта" [Haran, et al., амоній у водному середовищі утворював практичBiochim. Biophys. Ada, 1993, ν.1152, p.253-258; но дійсний (молекулярний) розчин, а не міцели, Maurer-Spurej, et al., Biochim. Biophys. Ada, 1999, двошарові і тому подібні самозібрані структури. v.1416, p.1-10]. Але ці сполуки амонію мають атоТаким чином, заміщений амоній згідно з винахоми водню, які легко вступають у реакції нуклеофідом у кращому варіанті дуже мало або практично льного заміщення або іншим чином хімічно реагузовсім не потрапляє у двошарову частину ліпосом, ють з інкапсульованими в ліпосомах субстанціями, зменшуючи цим до мінімуму ризик дестабілізації, а отже є здатними погіршувати хімічну цілісність солюбілізації та порушення проникності ліпосом, цих субстанцій під час або після процесу завантащо захоплюють заміщений амоній. ження ліпосоми. Таким чином, існує потреба в тоОрганічною групою заміщеного амонію зазвиму, щоб завантажена в ліпосому сполука заміщечай є вуглеводень, що містить, включно, до 8 атоного амонію була більш інертною і не мала 27 86063 28 Можливим є також варіант здійснення винахомів вуглецю, до 6 атомів вуглецю або до 4 атомів ду, в якому заміщеною сполукою амонію згідно з вуглецю, а загалом групи-замісники містять, вклювинаходом є глобально катіонна сполука, тобто чно, до 18, до 16, до 12 або до 9 атомів вуглецю. така, що в умовах її інкапсулювання, зазвичай у Такі вуглеводневі групи-замісники можуть включаводному розчині з рН у межах приблизно від рН 2 ти в себе, в тому числі, будь-яку комбінацію взаєдо рН 8, несе результуючий позитивний заряд, мозв'язаних первинних, вторинних або третинних наприклад, в результаті іонізації (протонування) атомів вуглецю, а також циклоалкільні групи, що атома азоту. зв'язуються їхніми кінцями безпосередньо з азоКрім того, можливим є варіант здійснення витом амонію, утворюючи гетероцикл, або з атомом находу, в якому сполука заміщеного первинного, вуглецю групи, що заміщує водень амонію. Ці завторинного або третинного амонію, інкапсульоваміщені алкільні групи можуть містити в їхньому на в ліпосоми, має від'ємний логарифм константи вуглецевому ланцюзі також гетероатоми, наприкислотної (депротонування) дисоціації (рКа), що клад, кисню, азоту або сірки, що утворюють функскладає приблизно принаймні 8,0, принаймні 8,5, ціональні групи, наприклад, етерну, ацетальну, принаймні 9,0, принаймні 9,5 або принаймні 10,0, амінну або сульфідну групи, а також що утворювизначеної в розбавленому водному розчині при ють функціональні групи, наприклад, гідроксильну, навколишній температурі (зазвичай 25°С). Паразв'язані з вуглецевим ланцюгом алкілу. Органічметр рКа є добре відомою характеристикою споною групою згідно з винаходом можуть бути, налук амонію, які в загальному випадку вирізняються приклад, алкіли, алкілідени, гетероциклічні алкіли, силою їхніх основних властивостей, а методи вициклоалкіли, арили, алкеніли, циклоалкеніли або значення рКа є звичайною практикою для фахівців їхні гідроксил-заміщені похідні, наприклад, гідроку даній галузі. Величини рКа для багатьох амінів сил-заміщений алкіліден, що утворює кільце, та їхніх протонованих форм (амонію) можна легко включаючи N у заміщеному амонію. знайти у відповідних таблицях у книгах з хімії та В іншому варіанті здійснення винаходу заміфармакології, див., наприклад, [IUPAC Handbook щеним амонієм є: гетероциклічний амоній, тобто of Pharmaceutical Salts, ed. by P.H. Stahl and C.G амоній, в якому принаймні два із R1, R2, R3 і R4 утворюють кільце; стерично утруднений первинWermuth, Wiley-VCH, 2002; CRC Handbook of ний амоній або стерично утруднений вторинний Chemistry and Physics, 82nd Edition, ed. by амоній. У загальному випадку стерично утруднеD.R.Lide, CRC Press, Florida, 2001, p.8-44 to 8-56]. ним первинним чи вторинним амонієм може бути У загальному випадку чим вищою є величина рКа, будь-який заміщений амоній, у котрому один або тим сильнішими є основні властивості матеріалу. два із R1, R2, R3 і R4 заміщені алкільними групами, Типові сполуки заміщеного амонію, а також незащо захаращують простір навколо молекули, наміщений амоній (які входять до переліку як їхні приклад, будь-який заміщений амоній, у котрому кон'юговані амінні основи), мають такі значення один або два із R1, R2, R3 і R4 заміщені однією або параметра рКа: піролідин - 11,31; піперидин - 1,12; двома циклоалкільними групами або алкільними діізопропіламін - 11,05; діетиламін - 10,93; триетигрупами, що мають принаймні один вторинний або ламін - 10,75; диметиламін - 10,73; трет-бутиламін третинний атом вуглецю алкілу, зв'язаний з азотом - 10,68; циклогексиламін - 10,66; метиламін - 10,66; заміщеного амонію. Такого типу гетероциклічними, етиламін - 10,65; пропіламін - 10,54; ізопропіламін стерично утрудненими первинними сполуками - 10,53; N-етилпіперидин - 10,45; дициклогексилаамонію і стерично утрудненими вторинними спомін - 10,4; N-метилпіперидин - 10,38; діетилметилуками амонію можуть бути, наприклад, ізопропіламін - 10,35; диметилпропіламін -10,15; триметилетиламоній, ізопропілметиламоній, діізопропілаламін - 9,8; піперазин -9,73 (І) , 5,33 (II); 2-аміно-2моній, трет-бутилетиламоній, метилпропанол - 9,69; Ν,Ν'-диметилпіперазин дициклогексиламоній, протонізовані форми мор9,66 (І), 5,2 (II); діетил-(2-гідроксіетил)амін - 9,58; фоліну, піридину, піперидину, піролідину, піпераетаноламін - 9,5; N-гідроксіетилпіролідин - 9,44; зину, трет-бутиламіну, 2-аміно-2-метилпропанолдіетаноламін - 9,28; аміак - 9,27; диметил-(21,2-аміно-2-метил-пропандіол-1,3 і трисгідроксіетил)амін 8,83; 2-аміно-2(гідроксіетил)амінометан. Ці сполуки заміщеного метилпропандіол-1,3, 8,8; морфолін - 8,5; трисамонію, як правило, є у продажу у формі різнома(гідроксиметил)амінометан - 8,3; N-метилглюкамін нітних солей або можуть бути легко приготовані із - 8,03; триетаноламін - 7,76; N-етилморфолін їхніх відповідних амінів шляхом нейтралізації кис7,67; N-гідроксіетилморфолін - 7,39; імідазол лотами. 7,03; піридин - 5,23. Заміщення водню алкільною Можливим є також варіант здійснення винахоабо циклоалкільною групою у сполуці амонію приду, в якому заміщеним амонієм є третинний або водить, як правило, до підвищення величини рКа. четвертинний амоній, включаючи, наприклад, триПри цьому наявність великої кількості гідроксильметиламоній, триетиламоній, трибутиламоній, діених або етерних функціональних груп в алкільних тилметиламоній, діізопропілетиламоній, триізопгрупах-замісниках або наявність ароматичної часропіламоній, N-метилморфолін, Nтин в азотовмісній гетероциклічній групі помітно гідроксіетилпіперидин, N-метилпіролідин і Ν,Ν'знижує величину рКа відносно аналогічного замідиметилпіперазин, тетраметиламоній, тетраетищеного аміаку без гідроксильних або етерних фунламоній і тетрабутиламоній. Ці сполуки заміщенокціональних груп. Сполуки з більш ніж однією амого амонію, як правило, є у продажу у формі різнонійною групою зазвичай мають значно нижчу манітних солей або можуть бути легко приготовані величину рКа другої і наступної групи амонію, ніж у із їхніх відповідних амінів шляхом нейтралізації першої. Авторами було встановлено, що сполуки кислотами. заміщеного аміаку з більш високими величинами 29 86063 30 рКа, тобто утворені більш сильноосновними амілець) або неорганічний остов і множину аніонних нами, були у стабілізації ліків усередині ліпосоми функціональних груп, тобто функціональних груп, більш ефективними, ніж ті, що були утворені зі здатних іонізуватися з набуттям негативного заряслабкіших амінів. Наприклад, як ІНР, так і SOS ду в нейтральному водному розчині та інтегрувасолі триетиламонію (рКа=10,75) були значно більш тися в остов або приєднуватися збоку до нього. ефективними, ніж відповідні солі триетаноламонію Полімером є природна або синтезована сполука, (рКа=7,76) у стабілізуванні іринотекану усередині яка зазвичай має високу молекулярну масу і склаліпосом in vivo (Приклад 73). дається зі зв'язаних між собою повторюваних блоЗаміщений амоній, що міститься в ліпосомній ків, кожний з яких являє собою відносно легку і композиції згідно з винаходом, може мати будь-яку просту молекулу. Типовими поліанюнними полімепідходящу форму, наприклад, форму солі. До чисрами є поліфосфати, полівінілсульфати, полівінілла підходящих належать фармацевтично прийнятсульфонати, аніонізовані поліакрилові полімери, ні солі, див., наприклад, [P.H.Stahl, C.G. Wermuth аніонізовані, наприклад, полісульфоновані поліа(eds), Handbook of Pharmaceutical Salts, Wiley-VCH, міни, наприклад, полісульфонований поWeinheim, 2002]. В одному з варіантів здійснення лі(етиленімін); полісульфовані, полікарбоксильовинаходу заміщеним амонієм є сіль, що містить вані або поліфосфорильовані полісахариди; кислі один чи більше поліаніонів згідно з винаходом. В поліамінокислоти; полінуклеотиди; інші поліфосоптимальному варіанті протиіон (аніон) у солі зафорильовані, полісульфатовані, полісульфоноваміщеного амонію згідно з винаходом робить цю ні, поліборатовані або полікарбоксильовані полісіль розчинною у воді, є фармацевтично інертним, мери. Такого роду полівалентні аніони і полімери є здатним утворювати осади чи гелі, перебуваючи в добре відомими в даній галузі і багато з них є у контакті з терапевтичною субстанцією або субстапродажу. Полімерний аніон згідно з винаходом у нцією, що детектується, і/або володіє меншою кращому варіанті є біорозкладаним, тобто здатним здатністю проникати через мембрану ліпосоми, розкладатися в живому організмі на нетоксичні ніж заміщений амоній та його недисоційована блоки. Типовим біорозкладаним полімерним аніоамінна форма. У загальному випадку сіль заміщеном є поліфосфат. ного амонію згідно з винаходом утворює дійсний В іншому кращому варіанті здійснення винарозчин в міжліпосомальному, наприклад, водному ходу поліаніоном є поліаніонізований поліол або просторі і не утворює значної кількості сконденсополіаніонізований цукор. Поліолом є органічна ваної фази на зразок міцелової, двошарової, гельмолекула, яка має множину гідроксильних груп, ної або кристалічної фази. Відносна кількість заприєднаних, наприклад, до лінійного, розгалуженоміщеного амонію та солетворного аніона, го або циклічного вуглецевого остову. Отже, інакнаприклад, поліаніона, лежить в точці стехіометше кажучи, поліол можна назвати полігідроксильоричної еквівалентності або поблизу неї, а його рН ваною сполукою. У кращому варіанті більшість звичайно має значення в інтервалі 3-9 і частіше в атомів вуглецю поліолу є гідроксильованими. Поінтервалі рН 4-8 залежно, наприклад, від констанліоли (поліатомні спирти) є добре відомими молети дисоціації кон'югованої основи іона заміщеного кулами. Використовуватися в даному винаході амонію. можуть як прямоланцюгові (лінійні або розгалужеУ загальному випадку заміщений амоній місні), так і циклічні поліоли. Типовими поліолами титься усередині, тобто у внутрішньому просторі згідно з винаходом є, наприклад: етиленгліколь; ліпосоми згідно з винаходом. В одному з варіантів гліцерин, треїтол, еритритол, пентаеритритол, здійснення винаходу заміщений амоній є частково манітол, глюцитол, сорбітол, сорбітан, ксилітол, або практично повністю видалений із зовнішнього лактитол, мальтитол, фруктитол та інозитол. Цусередовища навколо ліпосоми. Таке видалення кор зазвичай містить групу циклічного ацеталю, може досягатися за допомогою будь-яких відомих циклічного кеталю, кетону, альдегідну групу або підходящих методів і засобів, наприклад, розбавпродукт їх приєднання у групі взаємозв'язаних, ляння, іоннообмінної хроматографії, гельпереважно гідроксильованих атомів вуглецю. Цукхроматографії, діалізу, ультрафільтрації, осари звичайно є сполуками природного походження. дження тощо. Гідроліз цукрів у водному середовищі розділяє їх Згідно з іншою ознакою даного винаходу прона блоки, що звуться моносахаридами. Звичайно у понується ліпосомна композиція, до якої входить водному розчині молекула моносахаридного цукру поліаніон. Поліаніоном згідно з винаходом може із п'яти або шести атомів вуглецю утворює циклічбути будь-яка підходяща хімічна субстанція з ну кільцеву структуру - геміацеталь. У кращому більш ніж однією негативно зарядженими групами, варіанті цукрами згідно з винаходом є моносахащо створюють результуючий негативний іонний риди або дисахариди, тобто складаються із одного заряд більш ніж двох блоків усередині ліпосомноабо двох моносахаридних блоків, кожний із яких го, наприклад, водного простору. Поліаніоном згімає від трьох до семи, а в кращому варіанті - від дно з винаходом може бути двовалентний аніон, трьох до шести атомів вуглецю. Типовими цукрами тривалентний аніон, полівалентний аніон, полімезгідно з винаходом є: моносахаридні гексози, тобрний полівалентний аніон, поліаніонізований політо глюкоза (декстроза), галактоза, маноза, фрукол або поліаніонізований цукор. Такими дво- і тритоза; моносахаридні пентози, тобто ксилоза, рибовалентними аніонами можуть бути, наприклад, за, арабіноза; і дисахариди, тобто лактоза, сульфати, фосфати, пірофосфати, тартрати, суктрегалоза, сахароза, мальтоза і целобіоза. Викоцинати, малеати, борати і цитрати. В одному з ристовуватися можуть також сполуки, що складакращих варіантів здійснення винаходу поліаніоном ються із декількох взаємозв'язаних цукрових блоє поліаніонний полімер, який має органічний (вугків, що утворюють кільце (циклодекстрини), та їхні 31 86063 32 похідні. Одним із способів одержання поліолів є і/або цукрів із сірковуглецем при наявності лугу є відновлення цукрів. Кращими при цьому є більш поліаніонізовані (полідитіокарбонізовані, поліксанстабільні "невідновні" і неперетворювані метаболітогенат) похідні. Поліаніонізована поліольна або чно дисахариди такі, як сахароза або трегалоза. У цукрова похідна може бути виділена у формі вільпродажу є різноманітні поліоли, моносахариди і ної кислоти і нейтралізована підходящою основою, дисахариди. наприклад, гідроксидом лужного металу, гідроксиПоліаніонізованим поліолем або цукром є подом амонію або у кращому варіанті - заміщеним ліол або цукор, гідроксильні групи якого повністю аміном, наприклад, аміном, що відповідає заміщеабо частково модифіковані або заміщені аніононому амонію згідно з винаходом, у чистій формі вими групами (аніонізовані). Отже, поліаніонізоваабо у формі заміщеного гідроксиду амонію, перетний поліол або поліаніонізований цукор містить ворюючись на поліаніонну сіль заміщеного амонію поліольну частину або цукрову частину разом з згідно з винаходом. В альтернативному варіанті приєднаними до них аніоновими групами. Типовисіль натрію, калію, кальцію, барію або магнію поліми аніоновими групами є, наприклад, карбоксилааніонізованого поліолу або цукру може бути видіти, карбонати, тіокарбонати, дитіокарбонати, фолена і перетворена на підходящу форму, наприсфати, фосфонати, сульфати, сульфонати, клад, на форму солі заміщеного амонію, будь-яким нітрати і борати. У кращому варіанті принаймні відомим способом, наприклад, іонного обміну. одна аніонна група поліаніонізованого цукру або Поліаніон згідно з винаходом зазвичай має гуполіолу є сильноаніонною групою, тобто у водному стину заряду принаймні двох, трьох або чотирьох середовищі є іонізованою більш, ніж на 50% у шинегативно заряджених груп на блок, наприклад, на рокому діапазоні значень рН, наприклад, рН 3-12, атом вуглецю або кільце у вуглецевому ланцюзі у кращому варіанті рН 2-12, або має логарифм або на моносахаридний блок у цукрі. Поліаніонізоконстанти дисоціації (рКа) не більше 3, а в ще ваний цукор або циклічний поліол згідно з винахокращому варіанті - не більше 2. Поліаніонізація дом у кращому варіанті має принаймні 75% доступоліолу або цукру може здійснюватися за допомопних поліаніонізованих гідроксильних груп, а в гою різноманітних хімічних процесів, добре відокращому варіанті - 100% доступних поліаніонізомих у даній галузі. Наприклад, використовуючи ваних гідроксильних груп. Крім того, поліаніонізареакцію поліолів і/або цукрів з триоксидом сірки ція усередині ліпосом згідно з винаходом є зазвиабо хлорсульфоновою кислотою у піридині або 2чай на рівні, що є сумісним з постачанням і піколіні, естерифікують сірчанокислотними залишвивільненням або полегшує постачання і вивільками (сульфатують) деякі або всі гідроксильні грунення субстанції, захопленої усередині ліпосоми у пи і в результаті отримують полісульфатований місці її цільової дії, але зменшує передчасне вивіцукор або поліол. Типовим сульфатованим цукром льнення захопленої субстанції, тобто вивільнення згідно з винаходом є сульфатована сахароза її до того, як ліпосома досягне місця її цільової дії. включаючи, наприклад, гексасульфат сахарози, Згідно з даним винаходом ступінь поліаніонігептасульфат сахарози та октасульфат сахарози зації усередині ліпосоми може використовуватися [Ochi. К., et al., 1980, Chem. Pharm. Bull., ν.28, для регулювання характеристик вивільнення, наp.638-641]. Подібним чином продуктами реакції з приклад, швидкості вивільнення і кінетики субстаоксихлоридом фосфору або діетилхлорфосфатом нції, захопленої усередині ліпосоми. У загальному при наявності основного каталізатора є поліфосвипадку ступінь поліаніонізації може бути оцінений форильовані поліоли або цукри. Поліфосфориза кількістю поліаніонізованого цукру або поліолу льовані поліоли виділяють також із природних відносно загальної кількості аніона (або аніонів), джерел. Наприклад, інозитолполіфосфати, одним або ж у випадку, коли поліаніон є лише видом анііз яких є інозитолгексафосфат (фітинової кислоти), она - за відсотком поліаніонізації по відношенню виділяють із зерна. Низка різноманітних сульфадо загальної поліаніонізаційної здатності поліаніотованих, сульфонованих і фосфорильованих цукна, наприклад, поліаніонізованого цукру або полірів і поліолів, підходящих для застосування в даолу чи їх суміші усередині ліпосоми згідно з винаному винаході, описана, наприклад, у патентах ходом. В одному з варіантів здійснення винаходу США №№5,783,568 і 5,281,237, включених тут поліаніонізований цукор або поліол змішують з шляхом посилання. Авторами даного винаходу одним чи більше іншими аніонами, і чим менше було виявлено, що поліаніонізовані полігідроксипри цьому буде кількість поліаніонізованого цукру льовані сполуки, що дісоціюються лише сильними чи поліолу перевищувати кількість іншого аніона кислотами, наприклад, групи, що мають рКа мен(чи аніонів), тим швидше субстанція буде вивільше, ніж приблизно 3,0, а в кращому варіанті - менятися із ліпосоми. нше, ніж приблизно 2,0, тобто такі, як сульфатні Зазвичай якщо захоплена субстанція вивільмоноестери (рКа 1,0 і менше), дають ліпосомальне няється із ліпосоми в місці її цільової дії занадто інкапсулювання з кращим утримуванням ліків, ніж повільно, то бажана швидкість вивільнення субсполіаніонізовані полігідроксильовані сполуки, які танції може бути достягнута шляхом використання мають також стадії слабокислотної дисоціації, тобсуміші поліаніонізованого цукру або поліолу з одто такі, як фосфатні моноестери (стадія 1, рКа ним чи більше іншими моновалентними чи поліваприблизно 1,5; стадія 2, рКа приблизно 6,7 [Stahl лентними аніонами, наприклад, хлоридом, сульand Wermuth, Op. cit, 2002]. Цей факт ілюстровано фатом, фосфатом тощо. В альтернативному нижче, у Прикладі 73. Утворення комплексів поліваріанті можна використовувати суміші поліаніоніолів і/або цукрів з більш ніж однією молекулою зованих цукрів або поліолів з різноманітними стуборної кислоти також дає поліаніонізований (поліпенями поліаніонізації. В одному з варіантів здійсборатований) продукт. Продуктом реакції поліолів нення винаходу ступінь поліаніонізації усередині 33 86063 34 ліпосоми згідно з винаходом лежить в інтервалі від В одному з варіантів здійснення винаходу суб0,1% до 99%, від 10% до 90% або від 20% до 80% станцією, що міститься в ліпосомній композиції, є від загальної кількості аніона (або аніонів) усеретерапевтичний засіб. дині ліпосоми, наприклад, із захопленою субстанВ іншому варіанті здійснення винаходу субсцією. танцією, що міститься в ліпосомній композиції, є У загальному випадку ліпосомна композиція субстанція проти раку. Нижче поданий неповний згідно з винаходом може містити один чи більше перелік деяких загальновідомих, допущених до поліаніонів згідно з винаходом у будь-якій підхопродажу (і таких, що перебувають на стадії активдящій формі, наприклад, у формі кислоти або солі, ної розробки) антинеопластичних засобів за защо містить поліаніон і катіон. Кількість поліаніона, пропонованою тут класифікацією. наприклад, поліаніонізованого цукру чи поліолу Класи за структурою. Фторпіримідини - 5-FU, може бути стехіометрично еквівалентною кількості Фтордеоксиуридин, Фторафур, S'катіона або відрізнятися від неї. В одному з варіадеоксифторуридин, UFT, S-1 Капецитабін; піримінтів здійснення винаходу запропонована ліпосомдин-нуклеозиди - Деоксицитидин, Цитозин Арабіна композиція включає у себе одну чи більше понозид, 5-Азацитозин, Гемцитабін, 5-Азацитозинліаніонних солей катіона, де має місце градієнт Арабінозид; Пурини - 6-Меркаптопурин, Тіогуанін, концентрації катіона або градієнт рН через мемАзатюприн, Алопуринол, Кладрибін, Флударабін, брану ліпосоми. В іншому варіанті здійснення виПентостатин, 2-Хлораденозин; Платинові аналоги находу ліпосомна композиція містить один чи бі- Цисплатин, Карбоплатин, Оксаліплатин, Тетрапльше поліаніонних солей заміщеного амонію латин, Платина-DACH, Ормаплатин, СІ-973, JMзгідно з винаходом. Можливий також варіант здій216; Антрацикліни й Антрацендіони - Доксорубіснення винаходу, в якому ліпосомна композиція цин, Даунорубіцин, Епірубіцин, Ідарубіцин, Мітокмістить поліаніон усередині ліпосоми, у той час як сантрон; Епіподофілотоксини - Етопозид, Теніпополіаніон у даному середовищі, в якому містяться зид; Камптотецини - Іринотекан, Топотекан, ліпосоми, частково або практично повністю видаЛуртотекан, Силатекан, 9-Амінокамптотецин, ляється за допомогою підходящих методів і засо10,11-Метилендіоксикамптотецин, 9бів, добре відомих фахівцям у даній галузі, наприНітрокамптотецин, TAS 103, 7-(4клад, розбавляння, іоннообмінної хроматографії, метилпіперазинметилен)-10,11-етилендіоксигель-хроматографії, діалізу, ультрафільтрації, аб20(S)-камптотецин, 7-(2-N-ізопропіламіно)етил)сорбції, осадження тощо. В іншому варіанті ліпо20(S)-камптотецин; Гормони і гормональні аналоги сома із захопленим поліаніоном, наприклад, полі- Діетилстилбестрол, Тамоксифен, Торемефін, аніонізованим поліолом або поліаніонізованим Толмудекс, Тимітак, Флутамід, Бікалутамід, Фінасцукром має також трансмембранний градієнт, що терид, Естрадіол, Триоксифен, Дролоксифен, Меефективно діє на утримування субстанцій усередроксипрогестеронацетат, Мегестеролацетат, дині ліпосоми. Такими трансмембранними градієнАміноглутетимід, Тестолактон та інші; Фермента, тами є, наприклад, градієнт рН, градієнт електробілки й антитіла - аспарагіназа, інтерлейкіни, інтехімічного потенціалу, градієнт іона амонію, рферони, Лейпролід, пегаспаргаза та інші; Вінкааградієнт іона заміщеного амонію, градієнт розчинлкалоїди - Вінкристин, Вінбластин, Вінорелбін, ності тощо. Градієнт заміщеного амонію зазвичай Віндезин; Таксани - Паклітаксел, Доцетаксел. включає заміщену форму іона амонію, що містить Класи за механізмом дії. Антигормональні запринаймні один C-N зв'язок, наприклад, первинсоби - див. класифікацію для гормонів і гормонаний, вторинний, третинний або четвертинний амольних аналогів, Анастрозол; Антифолати - Метотній. Методи створення трансмембранних градієнрексат, Аміноптерин, Триметрексат, Триметоприм, тів є добре відомими в царині ліпосом. Піритрексим,Піриметамін, Едатрексат, MDAM; Згідно з ще однією ознакою даного винаходу Антимікроканальцеві засоби - таксани і вінкаалкаліпосомна композиція включає у себе один або лоїди; Алкілувальні засоби (класичні і некласичні) більше сполук заміщеного амонію і/або поліаніонів азотні мазі (Мехлоретамін, Хлорамбуцил, Мелфазгідно з винаходом і хімічну чи біологічну субстанлан, Урацилова мазь), Оксазафосфорини (Іфосцію, наприклад, терапевтичного або зображувальфамід, Циклофосфамід, Перфосфамід, Трофосного призначення. Наприклад, субстанцією, що фамід), Алкілсульфонати (Бусульфан), міститься в ліпосомній композиції згідно з винахоНітрозсечовини (Кармустин, Ломустин, Стрептозодом, може бути терапевтичний засіб, туш, барвцин), Тіотепа, Дакарбазин та інші; Антиметаболіти ник, магнітна сполука, фертилізатор, засіб при- пурини, піримідини і нуклеозиди, перелічені виваблення, біокаталізатор, коригент смаку або ще; Антибіотики - Антрацикліни та антрацендіони, запаху, відбілювач та інші субстанції, що детектуБлеоміцин, Дактиноміцин, Мітоміцин, Плікаміцин, ються відповідними засобами, добре відомими Пентостатин, Стрептозоцин; Інгібітори топоізомефахівцям у даній галузі, наприклад магніторази - Камптотецини (Торо І), епіподофілотоксини, резонансної візуалізації (MRI), оптичної візуалізаm-AMSA, Еліптицини (Торо II); Антивірусні засоби ції, флюоресцентно! та люмінесцентної візуалізаAZT, Зальцитабін, Гемцитабін, Диданозин, та інші; ції, ядерної візуалізації тощо. У кращому випадку Різноманітні цитотоксичні засоби - Гідроксисечосубстанція, що входить або може бути введена до вина, Мітотан, токсини злиття, PZA, Бріостатин, ліпосомної композиції згідно з винаходом, є сларетиноїди, масляна кислота та її похідні, Пентобоосновною і здатною проникати крізь мембрану зан, Фумагілін та інші. (ліпофільною), наприклад, аміновмісною або азотОкрім перелічених вище, до числа протираконою основною речовиною. вих субстанцій належать будь-які інгібітори інтопоізомерази, вінкаалкалоїди, наприклад, вінкристин, 35 86063 36 вінбластин, вінорелбін, вінфлунін і вінпоцетин, нтадин; похідні хінідину: хлорхін, гідроксихлорхін, засоби деполімеризації або дестабілізації мікрокапромахін, хінон; протимікробні хінолони: ципрофнальців, засоби стабілізації мікроканальців, наприлоксацин, еноксацин, ломефлоксацин, налідиксиклад, таксан, аміноалкілові або аміноацилові ананова кислота, норфлоксацин, офлоксацин; сульлоги паклітакселу та доцетакселу, наприклад, 2'фонаміди; протимікробні засоби для сечових [3-(N,N-діетиламіно)пропіоніл]паклітаксел, 7-(N,Nшляхів: метенамін, нітрофурантоїн, триметоприм; диметилгліцил)паклітаксел і 7-Lнітроімідазоли: метронідазол; холінергічні сполуки аланілпаклітаксел, алкілувальні засоби, рецепторчетвертинного амонію (амбетиній, неостигмін, фізв'язуючі засоби, інгібітори тирозинкінази, інгібітозостигмін); аміноакридини від хвороби Альцгеймери фосфатази, інгібітори циклін-залежної кінази, ра (такрин); ліки від хвороби Паркінсона (бензтроінгібітори ферментів, інгібітори аврора-кінази, нукпін, біпериден, проциклідин, тригексилгенідил); леотиди, полінуклеотиди та інгібітори фамезилтпротимускаринові засоби (атропін, гіосциамін, скорансферази. поламін, пропантелін); адренергічні допаміни В іншому варіанті здійснення винаходу субс(альбутерол, добутамін, ефедрин, епінефрин, нотанцією, що міститься в ліпосомній композиції згірепінефрин, ізопротеренол, метапроперенол, садно з винаходом, є терапевтичний засіб на основі льметрол, тербуталін); похідні ерготаміну; міореантрациклінових сполук або їх похідних, камптотелаксанти або ряди курану; міорелаксанти цинових сполук або їх похідних, еліптицинових центральної дії; баклофен, циклобензепін, дентросполук або їх похідних, вінкаалкалоїдів або їх похіієн; нікотин; бета-адреноблокатори (ацебутил, дних, вортманіну, його аналогів і похідних та пірааміодарон); бензодіазепіни (дитіазем); ліки від золпіримідинових сполук з властивостями інгібуаритмії (діізопірамід, енкаїдин, ряд місцевих анесвання авроракінази. тетиків - прокаїн, прокаїнамід, лідокаїн, флекаїмід), Можливий також варіант здійснення винаходу, хінідин; інгібітори АСЕ: каптоприл, енелаприлат, в якому субстанцією, що міститься в ліпосомній фозинопрол, хінаприл, раміприл; антиліпідемічні композиції згідно з винаходом, є антрациклінові засоби: флувастатин, гемфіброзил, інгібітори ліки, доксорубіцин, даунорубіцин, мітоміцин С, HMG-coA (правастатин); гіпотензивні ліки: клоніепірубіцин, пірарубіцин, рубідоміцин, карциномідин, гуанабенз, празоцин, гуанетидин, гранадрил, цин, N-ацетиладріаміцин, рубідазон, 5гідралазин; і некоронарні судинорозширювальні імідодауноміцин, N-ацетилдауноміцин, даунорилін, засоби: дипіридамол. мітоксантрон; камптотецинова сполука, камптотеЗгідно з даним винаходом субстанцією, що міцин, 9-амінокамптотецин, 7-етилкамптотецин, 10ститься в ліпосомній композиції, може також бути гідроксикамптотецин, 9-нітрокамптотецин, 10,11пресубстанція, наприклад, проліки або засіб, здатметилендіоксикамптотецин, 9-аміно-10,11ний до перетворення його на цільову субстанцію у метилендіоксикамптотецин, 9-хлор-10,11процесі, що складається з однієї чи більше стадій метилендіоксикамптотецин, іринотекан, топотекан, перетворення в умовах змінення рН або ферменлуртотекан, силатекан, (7-(4тативного розщеплення лабільного зв'язку. Таке метилпіперазинометилен)-10,11-етилендіоксиперетворення може відбуватися після вивільнення 20(S)-камптотецин, 7-(4-метилпіперазинопроліків із середини ліпосоми в заданому місці дії метилен)-10,11-метилендіокси-20(S)-камптотецин, ліків і ліпосоми. Проте, пресубстанція може перет7-(2-N-ізопропіламіно)етил)-(20S)-камптотецин; ворюватися на цільову активну субстанцію усерееліптицинова сполука, еліптицин, 6-3дині ліпосоми згідно з винаходом ще до викорисамінопропілеліптицин, 2-діетиламіноетилеліптицин тання ліпосоми як постачального носія, наприклад, та їх солі, дателіптій, ретеліптин. до введення її пацієнту. Субстанція може бути Можливий також варіант здійснення винаходу, змінена на пресубстанцію таким чином, щоб її мов якому субстанцією, що міститься в ліпосомі згіджна було легше завантажувати в ліпосоми, а поно з винаходом, є фармацевтична субстанція, тім, коли вона опиняється усередині ліпосоми згідвключаючи, наприклад, будь-яку із таких речовин: но з винаходом, знов перетворювати на цільову антигістамінетилендіамінові сполуки (бромфенісубстанцію. Що ж стосується субстанцій, до котрих фамін, дифенгідрамін); антипротозоал: хінолони у загальному випадку не може бути застосоване (йодохінол); амідини (пентамідин); антигельмінти завантаження "активним", "дистантним" або іншим (пірантел); антишистосомні ліки (оксамініхін); проградієнтним методом, то вони можуть ефективно тигрибкові тризолові сполуки (фліконазол, ітракозавантажуватися в ліпосоми і, зокрема, у внутрішназол, кетоконазол, міконазол); протимікробні ценій простір ліпосоми в їхній первинній, незміненій фалоспорини (цефазолін, цефоніцид, цефотаксим, формі. цефтазимід, цефуоксим); протимікробні похідні Відомо, що глобально катіонні сполуки, тобто бета-лактаму (азтреопам, цефметазол, цефоксисполуки, здатні набувати результуючий позитивтин); протимікробні засоби групи еритроміцину ний іонний заряд в умовах завантаження в ліпосо(еритроміцин, азитроміцин, кларитроміцин, олеанму, і зокрема сполуки, що містять титрований амін, доміцин); пеніцилін (бензилпеніцилін, феноксимеефективно завантажуються в ліпосоми, які мають тилпеніцилін, клоксацилін, метицилін, нафцилін, трансмембранні іонні градієнти. Якщо даною субсоксацилін, карбеніцилін); тетрацикліни; інші протанцією є органічна сполука і якщо вона не є глотимікробні антибіотики, новобіоцин, спектиномібально катіонною сполукою, яка має титрований цин, ванкоміцин; антимікобактеріальні ліки: аміноамін, то її похідна з потрібними іонними властивосаліцилова кислота, капреоміцин, етамбутол, стями може бути приготована шляхом відповідної ізоніазид, піразинамід, рифабутин, рифампін, кломодифікації, наприклад, у відповідності з методифазим; антивірусні адамантани: амантадин, римаками, описаними в [Woodle et al., WO 96/25147]. 37 86063 38 Наприклад, аміногрупа може вводитися шляхом ного чи природного походження або біосумісні естерифікації гідроксильної групи даної субстанції ліпіди. Ліпосоми згідно з винаходом можуть утвоамінокислотою. В альтернативному варіанті гідрюватися також амфіфільними полімерами і поверофобна група може вводитися у водорозчинну рхнево-активними речовинами, наприклад, полісполуку для сприяння її відділянню в мембрану меросомами та ніосомами. У даному описі ці ліпосоми і наступному проходженню її крізь мемліпосомотворні матеріали звуться також "ліпідабрану у внутрішньоліпосомальну порожнину, тобто ми". усередину ліпосоми. Іншим варіантом модифікації Згідно з даним винаходом, ліпосомами, що міз метою створення здатної завантажуватися в лістяться в ліпосомній композиції згідно з винахопосому пресубстанції є утворення продукту приєддом, можуть бути також націлювальні ліпосоми, нання карбонільної групу, наприклад, гідразону, наприклад, такі, що містять одну чи більше націоксиму, ацеталю або кеталю. Модифікована амілювальних частин або модифікаторів біорозподілу новмісна група може бути гідролізована або іншим по поверхні ліпосом. Націлювальною частиною чином хімічно відщеплена від модифікованої споможе бути будь-який засіб, здатний специфічним луки після завантаження цієї модифікованої спочином зв'язуватися чи взаємодіяти з об'єктомлуки в ліпосому згідно з даним винаходом. Внутмішенню. В одному з варіантів здійснення винахорішньоліпосомальну регенерацію цільової ду націлювальною частиною є ліганд. Ліганд, згідсубстанції із пресубстанції здійснюють, як правило, но з даним винаходом зв'язується і/або вбудовуза допомогою гідролізу, фотолізу, радіолізу, тіоліється у бажану клітину, в котрій захоплена зу, амонолізу, відновлення, заміщення, окисляння ліпосомою субстанція вчиняє бажаний ефект (кліабо видаляння. Ці процеси можуть здійснюватися, тину-мішень). При цьому ліганд зазвичай є членом наприклад, шляхом змінювання рН або за допомозв'язуючої пари, де другий член існує на клітинахгою ферментативної дії. Наприклад, паклітаксел мішенях або в клітинах-мішенях, або в тканині, що або доцетаксел, що є неіонними субстанціями, містить ці клітини-мішені. Підходящими для застоперетворюються на їхні 2'сування в даному винаході лігандами є, напри(діетиламінопропіонілові)або 7'клад: фолієва кислота, білок, наприклад, транс(діетиламінопропіонілові) естери, що є слабкими ферин, фактор росту, фермент, пептид, рецептор, основами (пресубстанції). Після завантаження антитіло або фрагмент антитіла - Fab', Fv, моновідомим способом у ліпосоми, для чого можуть ланцюгове Fv, монодоменне антитіло, або будьвикористовуватися "активний", "дистантний" метоякий інший поліпептид, що містить антигенди, метод "трансмембранного градієнта " або "гразв'язуючі послідовності (CDRs) молекули антитіла. дієнта розчинності " і/або процеси згідно з винахоЛіганд-націлена ліпосома, в котрій націлювальною дом, внутрішньоліпосомальний 2'частиною є антитіло або його цільовий антиген(діетиламінопропіоніл)паклітаксел перетворюється зв'язуючий фрагмент, зветься імуноліпосомою. В на вихідний паклітаксел шляхом стимулювання одному з кращих варіантів здійснення винаходу його гідролізу підвищенням рН до 7,0. Таким чиліпосома, що несе націлювальну частину, наприном, інкапсулювання нейтральної молекули таксаклад, ліганд, засвоюється клітиною-мішенню. Мону у внутрішній простір ліпосоми досягається при жливий також варіант здійснення винаходу, в якоспіввідношенні ліки/ліпід більше 0,05 моль на моль му націлювальною частиною є ліганд, що ліпіду ліпосоми без застосування гідрофільних специфічно взаємодіє з рецептором тирозинкінаковалентних модифікацій молекули таксану (нази, наприклад, з EGFR, HER2, HER3, HER4, PDприклад, приєднуванням PEG), циклодекстринGFR, VEGFR, bFGFR або 1GFR рецептором. В таксанових комплексів або таксаніншому варіанті здійснення винаходу націлювальсолюбілізувальних, міцелотворних поверхневона частина специфічно взаємодіє з рецептором активних речовин. фактора росту, рецептором ангіогенного фактора, Згідно з даним винаходом ліпосомами, що місрецептором трансферину, молекулою адгезії клітяться в ліпосомній композиції, можуть бути будьтини або рецептором вітаміну. які відомі ліпосоми або нові ліпосоми, винайдені Згідно з ще одним варіантом здійснення винаостаннім часом у даній галузі. У загальному випаходу ліпосоми, що містяться в ліпосомній комподку ліпосоми згідно з винаходом можуть мати зиції, мають трансмембранний градієнт концентбудь-яку ліпосомну структуру, наприклад, в котрій рації заміщеного амонію і/або поліаніону згідно з внутрішній простір відділений від зовнішнього севинаходом. У кращому варіанті концентрація є редовища одним чи більше ліпідними подвійними вищою у внутрішньому просторі ліпосоми. Крім шарами, або структуру мікрокапсули, що має напітого, ліпосомна композиція згідно з винаходом впроникну мембрану з ліпофільною центральною може мати один чи більше трансмембранних грачастиною, де мембрана відділяє внутрішній просдієнтів в додаток до градієнта, створеного заміщетір. Ліпідний подвійний шар може складатися із ним амонієм і/або поліаніоном згідно з винаходом. амфіфільних молекул, які мають гідрофільну часНаприклад, ліпосоми, що містяться в ліпосомній тину і гідрофобну частину. Зазвичай амфіфільні композиції згідно з винаходом, можуть додатково молекули у подвійному шарі упорядковані у двох мати трансмембранний градієнт рН, іонний градідвомірних шарах, у котрих гідрофобні частини єнт, градієнт електрохімічного потенціалу і/або орієнтовані усередину шару, а гідрофільні частини градієнт розчинності. - назовні. Амфіфільними молекулами, що утворюЗгідно з ще одним варіантом здійснення даноють ліпосоми згідно з винаходом, можуть бути го винаходу запропонована ліпосомна композиція будь-які відомі або останнім часом винайдені такі може постачатися в наборі, до якого входить конамфіфільні молекули, як, наприклад, ліпіди штучтейнер з ліпосомами і, як опція, контейнер з субс 39 86063 40 танцією та інструкцією з її використання, наприта амфіпатичний полімер. Лецитином, що входить клад, методиками або інформацією щодо викорисдо складу ліпосом згідно з винаходом, може бути тання ліпосомної композиції в певних цілях. Така природний лецитин, гідрогенізований природний інструкція може надаватися на будь-якому підхолецитин, синтетичний лецитин, 1,2-дистеароїлдящому носії, наприклад, на папері, електронному лецитин, дипальмітоїл-лецитин, диміристоїлносії або у формі доступу до бази даних чи веблецитин, діолеоїл-лецитин, 1-стеароїл-2-олеоїлсайту, де ця інструкція міститься. лецитин і 1-пальмітоїл-2-олеоїл-лецитин, а амфіЛіпосомно-мембранна композиція згідно з випатичним полімером може бути поліетиленглікольнаходом може бути приготована будь-яким підхоліпідна сполука, наприклад, поліетиленглікольдящим методом, відомим або останнім часом розфосфатидилетаноламін, поліетиленглікольробленим фахівцями у даній галузі. У загальному діацилгліцерин або поліетиленгліколь-церамід, де випадку для готування ліпосом згідно з винаходом полі(етиленглікольна) частина має молекулярну можуть використовуватися різноманітні ліпідні коммасу приблизно від 250 до 20000, а найчастіше поненти. Ліпідними компонентами зазвичай є, наприблизно від 500 до 5000. В іншому варіанті здійприклад: (1) незаряджені ліпідні компоненти такі, снення винаходу молярне співвідношення між леяк холестерин, церамід, діацилгліцерин, цитином і холестерином у ліпосомах згідно з винаацил(поліетери) або алкілполі(етери); (2) нейтраходом складає приблизно 3:2. Можливий також льні фосфоліпіди, наприклад, діацилфосфатидилваріант здійснення винаходу, в якому амфіпатичхоліни, сфінгомієліни та діацилфосфатидилетаноний полімер у ліпосомах згідно з винаходом склаламіни; (3) аніонні ліпіди, наприклад, дає принаймні 0,1мол.% ліпосомотворного ліпіду. діацилфосфатидилсерин, діацилфосфатидилгліМожливий також варіант здійснення винаходу, в церин, діацилфосфатидат, кардіоліпін, діацилфоякому кількість амфіпатичного полімеру в ліпососфатидилінозитол, діацилгліцерингемісукцинат, мах згідно з винаходом лежить у межах від діацилгліцерингеміглуратат, холестерилгемісукци0,1мол.% до 1мол.% ліпосомотворного ліпіду. У нат, холестерилгеміглутарат і т.п.; (4) полімеркращому варіанті амфіпатичним полімером є нейкон'юговані ліпіди, наприклад, Nтральний полімер, тобто такий, що в умовах зава[метокси(полі(етиленгліколь)нтаження ліків має результуючий іонний заряд, що діацилфосфатидилетаноламін, подорівнює нулю, а саме, наприклад: PEGлі(етиленгліколь)діацилгліцерин, подіацилгліцерин, PEG-діалкілгліцерин або PEGлі(етиленгліколь)-церамід; і (5) катіонні ліпіди, нацерамід. Авторами винаходу було виявлено, що приклад, 1,2,-діацил-3-триметиламонійпропан інклюзія іонно-нейтральних амфіпатичних ліпідів у (DOTAP), диметилдіоктадециламонійбромід кількості відносно вмісту PEG-ліпіду приблизно (DDAB) і 1,2-діацил-sn-гліцеро-3-етилфосфохолін. 5,7мол.% від загального вмісту ліпіду забезпечує Можуть використовуватися також моноацилвисокоефективне завантаження в ліпосоми, назаміщені похідні цих ліпідів та їхні ді- і моноалкільприклад, вінкаалкалоїдів на зразок вінорелбіну, у ні аналоги. той час ефективність завантаження PEG-DSPE з Для виконання, модифікації або надання тих аніонним зарядом при PEG-ліпідному вмісті чи інших бажаних функцій можуть вибиратися різ1,6мол.% і більше значно знижується (Приклад номанітні ліпідні компоненти Наприклад, у ролі 72). основного везикулотворного ліпіду може викорисВ іншому варіанті здійснення винаходу запротовуватися фосфоліпід. Для підтримування жорстпоновані ліпосоми містять сполуку камптотецину, кості мембрани і зменшення витікання ліків може наприклад, камптотецинові проліки такі, як іриновикористовуватися інклюзія холестерину. Кон'юготекан, і складаються із лецитину і холестерину у вані з полімером ліпіди можуть використовуватися молярному співвідношенні, наприклад, приблизно в ліпосомних препаратах для збільшення тривало3:2 та амфіпатичного полімеру в кількості, напристі циркуляції шляхом зниження кліренсу ліпосом клад, принаймні 0,1мол.% або менше 1% від кільпечінкою і селезінкою або для поліпшення стійкоскості ліпосомотворного ліпіду. ті ліпосом до агрегатування під час зберігання за Ліпосоми згідно з винаходом можна готувати відсутності ефекту подовження циркуляції. У той за допомогою будь-яких процесів, що вже є відочас як згідно з відомими оцінками [див, наприклад, мими, або будуть відомими в даній галузі, див. Патент США №5,013,556] інклюзія PEG-ліпідів у наприклад [G. Gregoriadis (видавник), Liposome кількості принаймні 1мол.% від кількості ліпіду ліTechnology, vol.1-3, 1st edition, 1983; 2nd edition, посоми збільшує в декілька разів тривалість цир1993, CRC Press, Boca Raton, FL]. Так, процесами, куляції ліпосом у крові, авторами даного винаходу підходящими для виготовлення ліпосомної компобуло встановлено, що запропоновані тут ліпосоми зиції згідно з винаходом, є екструзія, випаровуванмають достатньо тривалу циркуляцію, а добавня зі зворотною фазою, ультразвукові процеси, ляння PEG-ліпіду до такої ліпосомної композиції, упорскування розчинника (наприклад, етанолу), якщо і збільшує тривалість циркуляції, то менше, мікрофлюїдизація, детергентний діаліз, упорскуніж у два рази. Крім того, для сприяння постачанвання етеру і дегідрування/регідрування. Розмір ню інкапсульованих в ліпосоми субстанцій до циліпосом можна регулювати шляхом регулювання тозольних або ядерних мішеней шляхом полегрозміру пор мембран, використовуваних у процешення деяким класам субстанцій покидати межі сах екструзії низького тиску, або шляхом варіюендосомального шляху можуть використовуватися вання тиску і числа проходів, використовуваних у зарядомодулюючі (титровані) ліпіди. методах мікрофлюїдизації та інших підходящих В одному з варіантів здійснення винаходу заметодах. В одному з варіантів здійснення винахопропоновані ліпосоми містять лецитин, холестерин ду потрібні ліпіди спочатку гідратують тонкоплівко 41 86063 42 вим методом або упорскуванням етанолу, а потім тину здійснюється найкращим чином при значеннадають їм бажаного розміру шляхом екструзії нях рН в інтервалі приблизно 5,0-7,0, а ще краще через мембрани з порами певного розміру, найчапри рН приблизно 6,5. стіше - 0,05мкм, 0,08мкм і 0,1мкм. Згідно з даним винаходом бажана субстанція Ліпосомні композиції, що містять усередині може бути завантажена або захоплена в ліпосоми заміщений амоній і/або поліаніон згідно з винахошляхом інкубування її з ліпосомами згідно з винадом можуть бути виготовлені за допомогою будьходом у водному середовищі при відповідній темяких підходящих процесів, наприклад, шляхом пературі, наприклад, при температурі вище точки утворення ліпосом в умовах наявності заміщеного фазового переходу ліпідного компонента під час амонію і/або поліаніона згідно з винаходом, напризавантаження, який відновлюється при темпераклад, у формі солі. Заміщений амоній і/або поліатурі нижче точки фазового переходу після заванніон зовні ліпосоми може бути видалений або розтаження субстанції. Тривалість інкубування при бавлений після утворення ліпосом або перед цьому залежить, зазвичай, від природи ліпідного завантаженням або захопленням бажаної субстакомпонента, завантаженої в ліпосоми субстанції і нції. В альтернативному варіанті ліпосомна компотемператури інкубування. Звичайно достатньою є зиція, що містить заміщений амоній і/або поліаніон тривалість інкубування від декількох хвилин до згідно з винаходом, може бути одержана шляхом декількох годин. Завдяки високій ефективності іонного обміну безпосередньо або на проміжній захоплювання, що становить при цьому більше стадії обробки вільною кислотою з градієнтом за85% і навіть більше 90%, видаляти незахоплені міщеного амонію згідно з винаходом, наприклад, субстанції зазвичай немає потреби. Проте, якщо солі заміщеного амонію поліаніонізованого цукру така потреба все ж таки виникає, то видаляти нечи поліолу. Такі ліпосоми можуть бути нейтралізозахоплені субстанції із композиції можна за доповані за допомогою аміну або його солі з леткою могою будь-яких підходящих методів, включаючи, кислотою, наприклад, карбонатом. Утворюваний у наприклад, гель-хроматографію, діаліз, ультрафірезультаті ліпосомний розчин може використовультрацію, адсорбцію, осадження тощо. Авторами ватися безпосередньо, або іншим чином сіль, що в винаходу було встановлено, що підтримування ньому містить, може в разі потреби бути видалена, низької іонної сили під час інкубування субстанції і наприклад, шляхом випаровування і кристалізації зокрема, наприклад, похідної камптотецину або з наступним розчинянням у водному середовищі. похідної вінкаалкалоїду, з ліпосомами згідно з виУ кращому варіанті ліпосомна композиція згіднаходом, а після цього - збільшення іонної сили но з винаходом має трансмембранний градієнт наприкінці процесу інкубування дозволяє підвищуконцентрації заміщеного амонію і/або поліаніона, вати ефективність навантажування, поліпшувати наприклад, концентрації солі заміщеного амонію видалення незахоплених ліків і стійкість ліпосом і/або поліаніона усередині ліпосоми, є вищим, задо агрегатування. Зазвичай, інкубування провозвичай принаймні у 100 разів, концентрації замідять, наприклад, у водному розчині з іонною сищеного амонію і/або поліаніона у даному середолою менше еквівалентної 50мМ NaCI, а в кращому вищі зовні ліпосоми. варіанті -менше тої, що є еквівалентною 30мМ В одному з варіантів здійснення винаходу конNaCI. Після інкубування можна добавляти розчин центрація солі заміщеного амонію і/або поліаніона концентрованої солі, наприклад, NaCI, підвищуючи усередині ліпосоми є принаймні у 100 разів вищою таким чином іонну силу до рівня вище 50мМ NaCI, концентрації солі заміщеного амонію і/або поліаніа в кращому варіанті - до рівня вище 100мМ NaCI. она у даному середовищі зовні ліпосоми і складає He звертаючись до теоретичного обґрунтування щонайменше 10мМ, 50мМ, 0,1М, 0,2М, 0,5М, 0,6М, цього явища, автори винаходу припускають, що 0,7Μ і 1,0Μ у розрахунку від молярності заміщенозбільшення іонної сили сприяє дисоціації субстанго амонію. В іншому варіанті здійснення винаходу ції із ліпосомної мембрани, дозволяючи виходити концентрація солі заміщеного амонію і/або поліаназовні практично всій субстанції, інкапсульованій ніона усередині ліпосоми є принаймні у 100 разів у внутрішньому ліпосомальному просторі. вищою концентрації солі заміщеного амонію і/або поліаніона в даному середовищі зовні ліпосоми, а У загальному випадку кількість субстанції відвеличина концентрації складає приблизно 0,65Μ носно ліпіду, наприклад, відносна кількість ліків у або 1,0М. ліпосомах після завантаження в них субстанції Крім того, ліпосомна композиція згідно з виназалежить від кількості субстанції, захопленої усеходом зазвичай має зовні величину рН, сумісну зі редині ліпосоми, концентрації захопленого замістабільністю або сприятливу для підтримання стащеного амонію і/або поліаніона, наприклад, солі, більності бажаної субстанції під час процесу завафізико-хімічних властивостей захопленої субстаннтаження, і разом з цим - високу ефективність зації і типу використовуваного протиіона (аніона), вантаження, наприклад, з більш, ніж 90% наприклад, поліаніона. Завдяки високій ефективзахопленням. Кращою є величина рН в інтервалі ності завантаження, що досягається в композиціях 4-7 або в інтервалі 4,5-6,5. Зокрема, завантаження і/або процесах згідно з винаходом, співвідношення згідно з даним винаходом камптотецинової сполусубстанція/ліпід, що стосується субстанції, захопки, наприклад, топотекану або іринотекану, здійсленої в ліпосоми, складає більше 80%, більше нюється найкращим чином при значеннях рН зов90% і, як правило, більше 95% від величини співнішнього середовища в інтервалі приблизно від рН відношення субстанція/ліпід, обчисленого в розра4,0 до рН 7,0, а в кращому - в інтервалі приблизно хунку від загальної кількості субстанції і ліпосомновід рН 5,0 до рН 6,5. Завантаження вінкапохідної, го ліпіду, прийнятих у процес завантаження наприклад, вінкристину, вінорелбіну або вінблас("вхідного" співвідношення). Дійсно, на практиці 43 86063 44 забезпечується майже 100% (кількісне) інкапсулюодиниці фосфоліпідів ліпосом (у даному прикладі: вання. Співвідношення субстанція/ліпід у ліпосоDSPC і PEG-DSPE) шляхом ділення молярної кімах може виражатися в одиницях маси (маса сублькості даного компонента на суму молярних кільстанції на масу або молярну одиницю ліпосомного костей ліпосомних фосфоліпідів: ліпіду) або в молях (кількість молей субстанції на DSPC 3/(3+0,015) = 0,99502 масу або молярну одиницю ліпосомного ліпіду). Холестерин 2/(3+0,015) = 0,66335 При цьому одиниці вираження співвідношення PG-DSPE 0,015/(3+0,015) = 0,00498 субстанція/ліпід можна перетворювати одні на інші (b) Обчислюють масову кількість загального шляхом звичайного перерахунку, як показано нижліпосомного ліпіду, що відповідає одиничній моляче. Відносна кількість маси субстанції в ліпосомах рній кількості ліпосомного фосфоліпіду і молекузгідно з винаходом зазвичай складає принаймні лярним масам компонентів: 0,05, 0,1, 0,2, 0,35, 0,5 або 0,65мг субстанції на Загальна кількість ліпіду, мг/ммоль фосфоліпіміліграм ліпіду. У молярному вираженні співвідноду = 0,99502x790 + 0,66335x387 + шення субстанція/ліпід згідно з даним винаходом 0,00498x2750=1056,48 приймає значення принаймні приблизно від 0,02, (c) Обчислюють масову кількість ліків на одидо 5, у кращому варіанті принаймні від 0,1 до 2, а в ницю маси загального вмісту ліпіду шляхом діленще кращому варіанті приблизно від 0,15 до 1,5 ня вмісту ліків, вираженого в масових одиницях, моль ліків на моль ліпосомного ліпіду. В одному з що припадає на молярну одиницю фосфоліпіду, варіантів здійснення винаходу співвідношення на відповідну величину, отриману на стадії (b): субстанція/ліпід, наприклад, коефіцієнт завантаДоксорубіцин, мг/мг загального ліпіду = ження ліків, похідної камптотецину, становить 150/1056,48 = 0,14198. принаймні 0,1, наприклад, 0,1 моль похідної камп(d) Обчислюють молярну кількість ліків на тотецину на один моль ліпосомного ліпіду, а в одиницю маси загального вмісту ліпіду шляхом кращому варіанті - принаймні 0,2. В іншому варіанділення величини, отриманої на стадії (с), на моті здійснення винаходу співвідношення субстанлекулярну масу ліків (у даному випадку 543,5): ція/ліпід, наприклад, для завантаження ліків склаДоксорубіцин, ммоль/г загального ліпіду = дає принаймні 300мг субстанції (наприклад, 0,141987543,5x1000 = 0,261. вінкаалкалоїду або його похідної) на міліграм ліпо(e) Обчислюють молярну частину фосфоліпісомотворного ліпіду. Можливий також варіант дів у ліпідній матриці ліпосоми: здійснення винаходу, в якому співвідношення субМолярна частина фосфоліпідів = (сума молей станція/ліпід, наприклад, для завантаження ліків фосфоліпідів)/(сума молей ліпідів) = складає принаймні 500мг субстанції (наприклад, (3+0,015)/(3+2+0,015) = 0,6012. похідної камптотецину або камптотецинових про(f) Обчислюють молярне співвідношення між ліків) на міліграм ліпосомотворного ліпіду. Даний доксорубіцином і загальним ліпідом. винахід забезпечує стабільне і наближене до кільДоксорубіцин, моль/моль загального вмісту лікісного ліпосомальне інкапсулювання ліків на оспіду = (фосфоліпідна молярна частинові камптотецину, наприклад, іринотекану, з вена)´(доксорубіцин, г/моль фосфоліпіличиною співвідношення ліки/ліпід більше 0,8 ду)/(молекулярна маса доксорубіцину) = ммоль субстанції на 1г ліпосомного ліпіду, більше 0,6012´150/543,5=0,166 1,3 ммоль субстанції на 1г ліпосомного ліпіду і Таким чином, взаємозв'язок між вираженими в навіть 1,7 ммоль субстанції на 1г ліпосомного ліпірізноманітних одиницях співвідношеннями ліду (див. Приклад 74). ки/ліпід і ліки/фосфоліпід можна легко встановити. Якщо ліпосома містить фосфоліпід, то вміст Використовуваний тут термін "ліпід" означає будьсубстанції вигідно виражати в масових одиницях який мембранотворний компонент ліпосомної кількості ліків на молярні одиниці ліпосомного фомембрани, наприклад, полімер і/або детергент. сфоліпіду, наприклад, мг ліків/ммоль фосфоліпіду. Захоплений ліпосомою сольовий розчин заміПроте, для фахівця цілком зрозуміло, що вміст щеного амонію і/або поліаніона згідно з винаходом ліків може бути еквівалентним чином виражений зазвичай має осмотичну міцність (осмоляльність), способом, що не залежить від наявності фосфоліщо сприяє підтримуванню стійкості ліпосоми до підів у ліпосомах, і більш того, може бути еквіваосмотичного ушкодження (розбухання і/або розрилентним чином виражений в молярних одиницях вання), не знижуючи при цьому ємності завантакількості ліків на одиницю (масову чи молярну) ження ліпосоми. В одному з варіантів здійснення вмісту ліпосомного ліпіду. Наприклад, ліпосома, винаходу осмоляльність ліпосомної композиції що містить 3 молярні частини дистеароїлфосфазгідно з винаходом лежить в інтервалі від 0,1 до тидилхоліну (DSPC, молекулярна маса 790), 2 1,5моль/кг а в кращому варіанті - від 0,2 до молярні частини холестерину (молекулярна маса 1,0моль/кг. Авторами винаходу було виявлено, що 387) і 0,015 молярної частини похідної поліпосоми згідно з винаходом є стійкими до шкідлилі(етиленгліколю), дистеароїлфосфатидилетанового впливу високої внутрішньоліпосомальної осламіну (PEG-DSPE, молекулярна маса 2750), і як мотичної міцності на завантаження ліків. Внутрішліки - доксорубіцин (молекулярна маса 543,5) зі ньоліпосомальна осмолярність величиною співвідношенням ліки/ліпід = 150мг/ммоль фосфо0,727моль/кг добре переносилася і дозволяла ліпіду, такий самий уміст ліків може бути в еквіваздійснювати завантаження ліків у потрібних кільколентний спосіб виражений у масових одиницях мг стях, що досягали теоретичного максимуму стехіліків/мг загального ліпіду таким чином: ометричного обміну іонів внутрішньоліпосомаль(a) Обчислюють молярні кількості ліпосомноного заміщеного амонію для молекул ліків (у ліпідних компонентів, нормованих до молярної випадку іринотекану одна молекула ліків на один 45 86063 46 іон заміщеного амонію), незважаючи на те, що втичного засобу з низькою токсичністю. У загальосмолярність зовнішньоліпосомального водного ному випадку активність терапевтичної субстанції, середовища під час спільного інкубування ліків і ліпосомально інкапсульованої згідно з даним виліпосом була наближеною до фізіологічного знанаходом, наприклад, антинеопластична активність чення приблизно 0,3моль/кг (Приклад 74). камптотецинової похідної у ссавця принаймні доУ загальному випадку ліпосомна композиція рівнює, або щонайменше удвічі чи навіть учетверо згідно з винаходом є під час зберігання досить перевищує активність терапевтичної субстанції, стабільною, як про це свідчать, наприклад, вимівведеної в такій же кількості, але не в ліпосомальрювання відсотка вивільненої назовні ліпосоми ному препараті, наприклад, без застосування лізахопленої в ній субстанції або субстанції, що посомної композиції згідно з винаходом, у той час утримується усередині ліпосоми по завершенні як токсичність ліпосомально інкапсульованої субспевного періода часу від початкового завантажентанції не перевищує, і є принаймні вдвічі, принайня субстанції усередину ліпосоми згідно з винахомні втричі і навіть принаймні вчетверо нижчою, ніж дом. Наприклад, ліпосомна композиція згідно з токсичність такої самої терапевтичної субстанції, винаходом залишається стабільною при 4°С проуведеній у такій самій дозі і за такою ж схемою, тягом принаймні 6 місяців, вивільняючи менше але у вільній, неінкапсульованій формі. Напри10% захопленої субстанції протягом 6 місяців пісклад, загальновідомо, що ліпосомальне інкапсуля її початкового завантаження. В одному з варіалювання протиракових камптотецинових сполук нтів здійснення винаходу ліпосомна композиція методами інших авторів призводить до підвищензгідно з винаходом залишається стабільною при ня токсичності (зниження максимальної толерант4°С протягом принаймні 2 років, вивільняючи меної дози, зниження дози 50% летальності) порівнше 20% захопленої субстанції протягом 2 років няно із застосуванням неінкапсульованих ліків після її початкового завантаження. [Патент США №6,355,268; Патент США Здатність захопленої ліпосомою субстанції за№6,465,008; Colbern, et al. Clinical Cancer Res. лишатися в інкапсульованому стані доти, поки лі1998, ν.4, p.3077-3082; Tardi, et al. Cancer Res., посома не досягне місця її цільової дії, наприклад, 2000, v.60, p.3389-3393; Emerson, et al. Clinical пухлини при введенні пацієнту ліпосомальних проCancer Res. 2000, v.6, p.2903-2912]. Ліпосомально типухлинних ліків, є дуже корисною. Ліпосоми згідінкапсульовані камптотецинові проліки, наприклад, но з винаходом демонструють на подив чудову іринотекан (СРТ-11), який являє собою розчинні у стійкість щодо вивільнення (витікання) захопленої воді, катіонні камптотецинові проліки, володіють субстанції в умовах in vivo, наприклад у крові ссазначно вищою, наприклад принаймні в 4 рази і вця. Час експозиції, потрібний для 50% вивільненнавіть у 10 разів, протипухлинною активністю, оціня захопленої субстанції, наприклад ліків, із ліпоненою на пухлинній моделі in vivo, ніж ліки за відсоми (час напіввивільнення) у крові щура in vivo сутності ліпосомального препарату, наприклад, у становив більше 24 годин. Зокрема, ліпосоми, завільній формі розчину. Це є ще більш дивним з вантажені вінкаалкалоїдними ліками, наприклад, погляду того, що такі терапевтичні сполуки, як кавінбластином, вінкристином або вінорелбіном, мптотецинові проліки, потребують ферментативпродемонстрували чудову стійкість до витікання ної активації, наприклад, шляхом впливання на ліків in vivo, показавши час напіввивільнення приних ендогенної неспецифічної карбоксилестерази, наймні 24 години, тобто зберігши через 24 години але вони згідно з даним винаходом є доволі надійперебування в крові in vivo інкапсульованими в них но інкапсульованими у внутрішньому просторі лі50% кількості субстанції, яку вони мали перед увепосоми 3 іншого боку, токсичність камптотециноденням. У спостереженнях, де час напіввивільненвих проліків, наприклад, СРТ-11 у ліпосомальній ня, як правило, становив більше 33 годин, кількість формі (масове співвідношення ліки/ліпід більше інкапсульованої субстанції, що залишалася в ній 0,1, наприклад, 0,2-0,6 і більше) згідно з даним протягом 24 годин перебування у крові in vivo, винаходом була на диво малою - більш, ніж у 2 складала принаймні 60%, а де час напіввивільненрази, більш, ніж у 3 рази і навіть більш, ніж у 4 раня становив 46 годин, кількість інкапсульованої зи нижчою токсичності вільних (неінкапсульовасубстанції через 24 години перебування у крові in них) проліків СРТ-11. Крім того, пролонговане виvivo складала принаймні 70% від початкової кільвільнення проліків із завантажених СРТ-11 ліпосом кості перед уведенням. У деяких випадках час наin vivo характеризувалося більш, ніж 50%, і навіть піввивільнення інкапсульованих ліків у крові in vivo більш, ніж 70% (79-86%) кількістю від початкового перевищував 93 години і навіть 120 годин. Ліпосовмісту ліків, що залишалася в ліпосомах через 24 ми, завантажені камптотециновими сполуками, години після їх уведення у кровообіг, і часом напітопотеканом та іринотеканом, також демонструваввивільнення більше 24 годин, а зазвичай більше ли надзвичайно високу стабільність in vivo у крові, 48 годин Пролонговане перебування ліків у ліпозалишаючи інкапсульованими 79-85% початкової сомі in vivo асоціювалося з їхньою більш сильною кількості завантажених ліків протягом 24 годин. протипухлинною дією. При цому було дивно, що При цьому ліпосоми згідно з винаходом, маючи найбільш повільне вивільнення СРТ-11 in vivo і таку малу швидкість вивільнення ліків in vivo у його найвища протипухлинна активність спостерікровообігу, демонстрували доволі значну протипугалися в ліпосомах, що містили низькомолекулярхлинну активність in vivo, яка перевищувала анану поліаніонізовану цукрову сполуку (октасульфат логічну активність вільних ліків (тобто введених у сахарози), а не полімерний аніон (поліфосфат) формі розчину). (Приклад 15). Ліпосоми згідно з винаходом несподівано поЗгідно з ще одним варіантом здійснення винаєднують високу ефективність захопленого терапеходу запропоновані ліпосомні композиції можуть 47 86063 48 мати форму фармацевтичного складу, який місліпідів, можуть розбавлятися до низьких конценттить ліпосомну композицію згідно з винаходом і рацій для зниження запалення у місці введення. носій, наприклад, фармацевтично прийнятний ноКількість призначеної для введення ліпосомної сій. Фармацевтично прийнятними носіями можуть фармацевтичної композиції залежить від даної, бути звичайний фізіологічний розчин, ізотонічна захопленої усередині ліпосоми терапевтичної субдекстроза, ізотонічна сахароза, розчин Рінгера станції, хворого стану, що піддається лікуванню, (Ringer) і розчин Хенкса (Hanks). Відрегулювати рН типу використовуваних ліпосом та особистої думки до рівня, оптимального для забезпечення стабільлікаря-куратора. У загальному випадку кількість ності при зберіганні, можна шляхом добавляння призначеної для введення ліпосомної фармацевбуферної речовини. Наприклад, значення рН в тичної композиції повинна бути достатньою для межах приблизно від 6,0 до 7,5, а в ще кращому постачання терапевтично ефективної дози конкреваріанті рН 6,5 є оптимальними для стабільності тної терапевтичної субстанції. ліпідів ліпосомної мембрани і забезпечують чудові Кількість ліпосомної фармацевтичної компоумови для утримування захопленої субстанцій'. зиції, потрібна для постачання терапевтично ефеПідходящими для цього типовими буферними мактивної дози може бути визначена звичайними теріалами є, наприклад, гістидин, гідроксіетилпіпеметодами in vitro і in vivo, добре відомими в царині разин-етилсульфонат (HEPES), морфолінетилсувипробування ліків, див., наприклад, [D.B. Budman, льфонат (MES), сукцинат, тартрат і цитрат, А.Н. Calvert, Ε.Κ. Rowinsky (видавники). Handbook зазвичай, в концентраціях від 2 до 20мМ. Підхоof Anticancer Drug Development, LWW, 2003]. Терадящими носіями можуть бути також вода, буферипевтично ефективні дози для різноманітних теразований водний розчин, 0,4% NaCI, 0,3% гліцин та певтичних субстанцій є добре відомими фахівцям інші. Додаватися можуть білкові, вуглеводні або у даній галузі, і згідно з даним винаходом терапевполімерні стабілізатори і регулятори тонічності і тична субстанція, що постачається за допомогою зокрема, наприклад, желатин, альбумін, декстран, фармацевтичної ліпосомної композиції згідно з полівінілпіролідон та інші. Тонічність композиції винаходом, забезпечує принаймні таку саму або 2можна встановити на фізіологічний рівень в інтеркратно, 4-кратно чи 10-кратно вищу активність, ніж валі 0,25-0,35моль/кг добавками глюкози або активність, отримувана при введенні такої ж кільбільш інертної сполуки, наприклад, лактози, сахакості терапевтичної субстанції в її звичайному, рози, манітолу або декстрину. Стерилізувати комнеліпосомному препараті. Як правило, дози ліпопозиції можна за допомогою звичайних, добре сомної фармацевтичної композиції згідно з винавідомих методів, наприклад, шляхом фільтрації. ходом лежать у межах приблизно від 0,005 до Приготовані таким чином водні розчини можуть 500мг терапевтичної субстанції на кілограм маси поміщатися у відповідну тару для їх вживання або тіла, а найчастіше - в межах приблизно від 0,1 до піддаватися фільтрації в асептичних умовах і ліо100мг терапевтичної субстанції на кілограм маси філізації, причому перед уведенням ліофілізоватіла. ний препарат об'єднують зі стерильним водним Як правило, ліпосомну фармацевтичну компосередовищем. зицію згідно з винаходом готують для місцевого Фармацевтичні ліпосомні композиції можуть введення або введення шляхом ін'єкцій у формі містити також інші фармацевтично прийнятні дорідкого розчину або суспензії. Проте, рідкі носії поміжні речовини у відповідністю з потребою наможуть бути приготовані перед ін'єкцією також для ближення до фізіологічних умов, наприклад, регутвердих форм, підходящих для розчину або сулятори рН і буферизатори, регулятори тонічності і спензії. Запропоновані композиції можуть бути т.п., наприклад, ацетат натрію, лактат натрію, хлоприготовані також у формі таблеток з ентеросорид натрію, хлорид калію, хлорид кальцію тощо. любільним покриттям або гель-капсул за допомоКрім того, ліпосомна суспензія може містити засогою відомих у даній галузі методів. би захисту ліпідів від впливу вільних радикалів та Ліпосомна композиція згідно з винаходом моушкодження від переокислення при зберіганні. же вводитися будь-яким прийнятним з погляду Підходящими для цього є ліпофільні гасники на медицини способом, що залежить від стану або основі вільних радикалів, наприклад, альфаушкодження, котрі піддаються лікуванню. Таким токоферол, і водорозчинні залізоспецифічні хеласпособом можуть бути ін'єкції, які роблять парентори, наприклад, феріоксамін. теральним шляхом, наприклад, внутрішньом'язоКонцентрація ліпосом згідно з винаходом у рівим, підшкірним, внутрішньовенним, внутрішньоадких фармацевтичних препаратах може варіювати ртеріальним, внутрішньоперитонеальним, в широких межах, тобто від менш, ніж приблизно внутрішньосуглобовим, внутрішньоепідуральним, 0,05%, зазвичай або принаймні 2-10%, до 30внутрішньооболонковим тощо, а також перораль50%(мас.) і вибираються в першу чергу за їхніми не, назальне, офтальмічне, ректальне, вагінальне, об'ємами в рідкому стані, в'язкістю і т.д. у відповідмісцеве або легеневе введення, наприклад, шляності з вибраним способом уведення. Наприклад, хом інгаляції. Для постачання приготованих згідно концентрація може бути збільшена для зниження з винаходом ліпосомальнних ліків у пухлини навантаження рідиною, пов'язаного з лікуванням. центральної нервової системи особливо підходяЦе може бути потрібним особливо для пацієнтів, щим є повільне, пролонговане внутрішньочерепне що страждають на пов'язану з атеросклерозом вливання ліпосом безпосередньо в пухлину (посзастійну серцеву недостатність або важку гіпертетачання, підсилене конвекцією, скорочено CED), нзію. В іншому варіанті ліпосомні фармацевтичні див. [Saito, et al., Cancer Research, vol.64, p.2572композиції, що складаються із подразнювальних 2579, 2004; Mamot, et al, J. Neuro-Oncology, vol.68, p.1-9, 2004]. Композиції згідно з винаходом можуть 49 86063 50 також накладатися безпосередньо на поверхню Приклад 1. Готування розчинів солей заміщетканини. Винаходом передбачається також постаного амонію чання способами пролонгованого вивільнення, рНБули приготовані підходящі для завантажувнзалежного вивільнення та іншими способами ввеня ліків (наприклад, доксорубіцину) в ліпосоми дення з вивільненням ліків, опосередкованим сперозчини сульфатів триалкіламонію і діалкіламонію цифічними хімічними умовами або умовами наметодом розбавляння сірчаної кислоти водою до вколишнього середовища, наприклад, шляхом концентрації 0,25Μ і наступного титрування розчиін'єкції речовин уповільненого всмоктування або за ну сірчаної кислоти одним або декількома різними допомогою імплантатів з легкоруйнівним покритамінами. При цьому використовувалися такі замітям. щені аміни: триетиламін, триметиламін, диметиПриклади ламін, діетиламін та діетаноламін. Після додаванНаведені нижче приклади служать лише як ня амінів утворений розчин розбавляли до кінцевої ілюстративний матеріал і жодним чином, явним чи концентрації 0,2Μ солі заміщеного амонію. Осмонеявним, не обмежують даного винаходу ні за об'ляльність визначали за допомогою конденсаційноємом, ні за формою. Відображаючи типові варіанго (точка роси) осмометра. У Табл. 1 наведені ти здійснення винаходу, вони не виключають завластивості приготованих таким чином розчинів стосування, замість розглянутих, інших процедур, сульфатів заміщеного алкіламонію. методик і засобів, відомих фахівцям у даній галузі. Таблиця 1 Властивості різноманітних розчинів сульфатів діалкіламонію і триалкіламонію Сіль Диметиламонійсульфат Диметилетаноламонійсульфат Діетиламонійсульфат Триметиламонійсульфат Триетиламонійсульфат Приклад 2. Готування ліпосом із захопленими в них солями діалкіламонію і триалкіламонію і завантаження потрібної субстанції в ці ліпосоми Дистеароїлфосфатидилхолін (DSPC), холестерин (Chol), and N-(метоксиполі(етиленгліколь)оксикарбоніл)дистеароїлфосфати дилетаноламін (PEG-DSPE) (приготований із полі(етиленгліколю) з молекулярною масою 2000) спільно розчиняли у хлороформі у молярному співвідношенні 3:2:0,015, і хлороформ видаляли при температурі 55-60°С шляхом роторного випаровування. Після цього висушену ліпідну плівку гідратували у розчині одного із кожних сульфатів діалкіл- або триалкіламонію, перелічених у Прикладі 1, при температурі 60°С протягом 30хв. Ліпідну суспензію екструдували під тиском через два послідовно один з одним складені полікарбонатні з витравленими доріжками мембранні фільтри з порами розміром 0,1мкм (Corning Nuclepore). Розмір ліпосом, визначений методом квазіпружного розсіювання світла, становив приблизно 110120нм. Неінкапсульовані солі, триалкіламоній або діалкіламоній, видаляли із зовнішнього середовища ліпосом шляхом гель-фільтрації за допомогою Осмоляльність, ммоль/кг 472 509 519 497 559 рН 5,65 5,72 5,85 5,81 5,33 колонки зі зшитим декстрановим гелем [Sephadex G-75, Amersham Pharmacia Biotechnology], елюювання якої проводили HEPES-буферизованим фізіологічним розчином, рН 7,2-7,4, і ліпосоми збирали у фракції порожнього об'єму колонки. До ліпосом добавляли доксорубіцингідрохлорид (Фармакопея США) (ліофілізований порошок, що містив 5 масових частин лактози на 1 частину доксорубіцину) в концентрації 150мкг ліків/мкмоль ліпосомного фосфоліпіду. Суміш інкубували при температурі 55°С протягом 45хв., охолоджували на льоду протягом 10хв., і неінкапсульовані ліки видаляли шляхом гель-фільтраційної хроматографії на колонці Sephadex G-75, елюювання якої проводили HEPES-буферизованим фізіологічним розчином, рН7,4. Наявність вільного доксорубіцину (що характеризувався появою забарвленої червоним смуги, яка рухалася більш повільно) візуально не виявлялася. Очищені ліпосоми із завантаженим у них доксорубіцином піддавали аналізу на фосфоліпід і доксорубіцин у відповідності з описаним у Прикладах 70 і 71 (спектрофотометричний метод), відповідно. Отримані в результаті значення ефективності завантаження ліків наведені в Табл. 2. Таблиця 2 Завантаження доксорубіцину в ліпосоми з захопленими в них розчинами солей діалкіл- і триалкіламонію. Вхідне співвідношення ліки/фосфоліпід становило 150мкг/мкмоль. Захоплена в ліпосоми сіль Триметиламонійсульфат Триетиламонійсульфат Діетиламонійсульфат Диметилетаноламонійсульфат Відношення ліки/фосфоліпід у ліпосомах (мкг/мкмоль) 140,74±10,35 163,81±16,41 158,16±18,34 155,08±8,51 Ефективність захоплення,% 93,8±5,7 109,2±11,6 105,4±7,8 103,4±11,6 51 86063 52 Приклад 3. Готування ліпосом, що містять різний в результаті дисперсний розчин ліпіду містив номанітні сульфати діалкіл-, триалкіл- і гетероцикприблизно 10%(об.) етанолу лічного заміщеного амонію, і завантаження доксоДоксорубіцин завантажували шляхом добаврубіцину в ці ліпосоми ляння розчину доксорубіцину (2мг/мл у HEPESТак, як описано в Прикладі 1, були приготовані буферизованому фізіологічному розчині з рН 6,5) у розчини сульфату заміщеного амонію при викориліпосоми при співвідношенні 155мкг ліків/мкмоль станні продажних алкіл-заміщеного, гідроксиалкілліпосомного фосфоліпіду (PL) і гріли при темперазаміщеного і гетероциклічного амінів. Ліпосоми турі 58°С протягом 45хв. в гарячій водяній бані. утворювали так, як описано в Прикладі 1, за виняУтворювані в результаті ліпосоми відокремлювали тком того, що замість стадії гідратації ліпідної пліввід залшків неінкапсульованого доксорубіцину й ки чисті ліпіди розчиняли в етанолі (приблизно аналізували на вміст ліків і ліпідів, як описано в 100мкл етанолу на кожні 50мкмоль фосфоліпіду) і Прикладі 1. Отримані результати наведені в Табл. змішували з розчином солі заміщеного амонію при 3. температурі 60-65°С таким чином, що утворюваТаблиця 3 Завантаження доксорубіцину в ліпосоми з захопленими в них розчинами солей стерично утрудненого заміщеного алкіл-, діалкіл-, триалкіл- і гетероциклічного амонію Амін, використовуваний для готування солі заміщеного амонію Триметиламін Триетиламін Диметилетаноламін Диметиламін Діетиламін Діізопропіламін Трис(гідроксиметил)амінометан 1-Піперидинетанол 4-Метилморфолін Піперидин 1-Метилпіролідин Диметилпіперазин Осмоляльність, ммоль/кг 497 559 509 472 519 533 423 506 465 479 492 378 Приклад 4. Готування розчину триетиламонійполіфосфату (ТЕА-Рn) Лінійний полі(фосфат) натрію, що мав 13-18 фосфатних блоків на молекулу (Фосфатне скло; CALGON®, отримане від фірми Sigma Chemical Company), розчиняли у воді до концентрації приблизно 1,3Μ фосфату. Розчин перепускали через колонку, заповнену 120мл бусинок катіонообмінної смоли із сульфонованого полістиролдивінілбензолового співполімеру (Dowex 50Wx8-200, Dow Хімічн Co.) у водневій формі. Колонку попередньо зрівноважували водним розчином 3-3,6 Μ НСІ для приведення смоли у водневу форму і промивали деіонізованою водою до нейтральної рН. На колонку поміщали п'ятнадцять мілілітрів розчину поліфосфату натрію, й проводили елюювання деіонізованою Н2О. Моніторинг елюенту колонки вели за допомогою детектора електропровідності. Вихідний потік колонки, що відповідав піку електропровідності, титрували чистим триетиламіном до рН 5,5-6,0. Розчин аналізували на залишковий натрій потенціометричним методом за допомогою натрійчутливого скляного електрода і на вміст фосфату шляхом аналізу на неорганічний фосфат, як описано у Прикладі 1. Розчин, який мав уміст залишкового натрію менше 1%, розбавляли до кінцевої концентрації фосфату 0,55 М. Такий розчин, як правило, мав концентрацію триетиламонію (TEA) в інтервалі 0,52-0,55 М, рН в інтервалі 5,5-6,0 і осмоляльність в інтервалі 430-480ммоль/кг. Завантажені ліки, мг/ммоль фосфоліпіду 149,4±7,9 149,6±6,9 163,1+6,6 158,6±7,4 156,7±13,0 159,9±6,2 179,9±15,3 153,5±7,1 152,4±9,8 158,5±12,5 153,6±12,3 158,0±6,5 Ефективність завантаження, % 96,4±4,9 96,5±4,3 105,3±4,5 102,3±4,9 101,1±8,5 103,2±4,1 116,1±11,5 99,0±4,5 983±6,2 102,3±8,2 99,1±7,8 101,9±4,3 Приклад 5. Видалення незахоплених поліфосфатів із ліпосомних препаратів Ліпосоми (розміром 120нм), приготовані згідно з методом, описаним у [Kirpotin, et al., Biochemistiy 36:66-75, 1997], із захопленим у них флюоресцентним маркером 8-гідроксипірентрисульфонатом, змішували з розчином поліфосфату натрію. Цю суміш поміщали на гель-хроматографічні колонки, заповнені бісером зшитого декстрану (Sephadex G-75), 6% агарозним бісером (Сефароза 6B-CL) або 4% агарозним бісером (Sepharose 4В-CL), всі від фірми Amersham Pharmacia, і елюювали MESдекстрозним буферним розчином (рН 5,5). Вихідні потоки колонок аналізували на вміст фосфатів методом Бартлета (Bartlett, 1959) і на вміст ліпосом методом спектрофотометрії. Серед досліджених таким чином гель-хроматографічних носіїв матеріал Сефароза CL-6B давав повне відокремлення поліфосфату від ліпосоми при об'ємному співвідношенні зразок/колонковий шар =13. Приклад 6. Готування розчину триетиламонійсахарозаоктасульфату (TEA-SOS). Натрійсахарозаоктасульфат (еквівалентна маса 144,8) є натрієвою сіллю сахарозної сполуки, в котрій усі гідроксильні групи утворили естери сірчаної кислоти. Натрієева сіль сахарозаоктасульфату (SOS) була одержана від фірми Toronto Research Chemicals, Торонто, Канада, Матеріал №S699020. Шість грамів натрійсахарозаоктасульфату розчиняли в 16,57мл деіонізованої води до 53 86063 54 приблизно 2,5н. кінцевої концентрації сульфатних Потрібні концентрації встановлювали шляхом кисгруп. Приготований розчин піддавали іонообмінній лотного титрування приблизно до 5,9 н. обробці так, як описано в Прикладі 4. Розчин саха6. Триетиламін (TEA), чистотою 99%, HPLC, розаоктасірчаної кислоти, отриманий у формі вивід фірми Fisher (Матеріал №04884). Концентрація хідного потоку іонообмінної колонки, титрували кислотним титруванням становила 6,9-7,1 н. чистим триетиламіном до рН 5,7 (точка нейтраліВоду очищали шляхом зворотного осмосу, зації), і визначали рН і осмоляльність цього розчиіонного обміну і видалення органічних речовин до ну. Утворений розчин мав розрахункову концентдосягнення безорганічного ступеня чистоти "16-18 рацію триетиламонію 0,643 М, рН 5,7 і МОм". осмоляльність 530ммоль/кг. Потенціометричний Водні розчини пірофосфатів, трифосфатів і моніторинг не виявляв наявності залишкового наполіфосфатів готували методом іонного обміну. трію (менше 0,1%). Розчини поліфосфату натрію (3г у 25мл води), Приклад 7. Ліпосоми, завантажені іринотекапірофосфату (4г у 27мл води) і поліфосфату (6,7г ном (СРТ-11) за допомогою солей заміщеного у 30мл води) завантажували на колонку, що містиамонію: готування і вивільнення ліків in vitro в отола 100мл (об'єм шару) іонообмінної смоли, пригоченні плазми крові тованої так, як описано вище. Колонку елюювали У цьому прикладі проводилися дослідження водою, і фракції, що залишилися, збирали. В сульфату, цитрату, пірофосфату, трифосфату і окрему групу відбирали фракції, які показували лінійного поліфосфату (13-18-меру), які викорискислотне значення рН (рН
ДивитисяДодаткова інформація
Назва патенту англійськоюLiposomes useful for drug delivery
Автори англійськоюHong Keelung, Drummond Daryl C., Kirpotin Dmitri B.
Назва патенту російськоюЛипосомы для снабжения лекарств
Автори російськоюХонг Килунг, Драммонд Дерил С., Кирпотин Дмитрий Б.
МПК / Мітки
МПК: A61K 9/127
Мітки: ліків, ліпосоми, постачання
Код посилання
<a href="https://ua.patents.su/72-86063-liposomi-dlya-postachannya-likiv.html" target="_blank" rel="follow" title="База патентів України">Ліпосоми для постачання ліків</a>
Попередній патент: Здатна до тужавіння композиція (варіанти), проникний відносно рідин композиційний матеріал (варіанти) та способи його одержання
Наступний патент: Спосіб контролю роботи підземного сховища газу
Випадковий патент: Робочий орган культиватора