Спосіб визначення радіаційного старіння імунної системи
Номер патенту: 107428
Опубліковано: 10.06.2016
Автори: Логановський Костянтин Миколайович, Ільєнко Ірина Миколаївна, Музалевська Катерина Дмитрівна, Базика Дмитро Анатолійович, Чумак Станіслав Анатолійович
Формула / Реферат
Спосіб визначення радіаційного старіння імунної системи, що включає визначення відносної довжини теломер, дослідження генної експресії, використовуючи полімеразну ланцюгову реакцію (ПЛР) та кількісну оцінку когнітивної функції за шкалою MMSE, який відрізняється тим, що під час дослідження генної експресії за допомогою ПЛР із зворотною транскрипцією вимірюється кількість ампліфікованої ДНК у реальному часі, після кожного циклу ампліфікації.
Текст
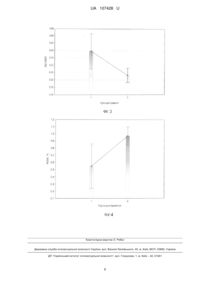
Реферат: Спосіб визначення радіаційного старіння імунної системи включає визначення відносної довжини теломер, дослідження генної експресії, використовуючи полімеразну ланцюгову реакцію (ПЛР) та кількісну оцінку когнітивної функції за шкалою MMSE. Під час дослідження генної експресії за допомогою ПЛР із зворотною транскрипцією вимірюється кількість ампліфікованої ДНК у реальному часі, після кожного циклу ампліфікації. UA 107428 U (12) UA 107428 U UA 107428 U 5 10 15 20 25 30 35 40 45 50 55 60 Спосіб належать до медико-біологічного напрямку, зокрема до радіаційної медицини і молекулярної біології та реалізується встановленням радіаційно-обумовлених клітинних та генетичних індикаторів старіння імунокомпетентних клітин людини та організму в цілому. В якості дослідного матеріалу використані лейкоцити периферичної крові людини. В якості критеріїв радіаційно-обумовленого клітинного старіння використані: відносна довжина теломер, як структура, яка безпосередньо пов'язана із віком людини та є індикатором старіння; відносна експресія гену TERT, який кодує теломеразну зворотну транскриптазу та є регулятором довжини теломер; експресія гістону γ-Н2АХ, як маркеру ушкодження ДНК та клітинної радіочутливості. Факт наявності радіаційно-обумовленого клітинного старіння встановлюють у присутності радіаційної компоненти в анамнезі, віковому діапазоні старше 50 років та комбінації клітинних та генетичних змін: скороченні відносної довжини теломер, зниженні експресії гену TERT та гіперекспресії гістону γ-Н2АХ. Основною задачею способу, який заявляється, є вдосконалення діагностики та підвищення надійності прогнозування радіаційно індукованих патологічних станів в імунній системі, як прояву комплексних клітинно-молекулярних змін, пов'язаних із клітинним старінням. Відомий спосіб визначення захворювань, пов'язаних із старінням, який базується на дослідженні функціонального стану клітин в умовах штучного підвищення їх проліферативної активності шляхом внесення до реакційного середовища біологічно активних субстанцій, які модулюють активність myc-подібного протеїну, з наступним визначенням активності ферменту теломерази, що приймає участь у регуляції довжини теломерів. У якості індукторів використовують L2-myc, N-myc, L-myc білки. За способом можливо також тестувати фармацевтичні препарати, які містять L2-myc протеїн [1]. Недоліком цього способу є можливість визначення тільки тих захворювань, у розвитку яких приймає участь с-тус протеїн, що робить обмеженим його застосування для визначення ефектів іонізуючого опромінення. Відомий спосіб характеристики клітинного старіння як унікального біомаркеру загальної депресії, який базується на визначенні довжини теломер та теломеразної активності. Спосіб дозволяє визначити можливість використання антидепресантного лікування осіб, з метою полегшення перебігу психоневрологічних захворювань. Також метод забезпечує оцінку ефективності лікування та прогнозування ризику розвитку депресії. Даний спосіб не передбачає аналіз генів-регуляторів довжини теломер, а також не пов'язаний із лікуванням осіб із радіаційною компонентною в анамнезі [2]. Відомий спосіб визначення клітинного старіння, який базується на акумуляції клітин на стадії раннього старіння із використанням маркерів ДНК-порушень, асоційованих із віком. Спосіб забезпечується наявністю декількох клітин, а також включає в себе етапи імунодетекції присутності активованих протеїнів-реагування на ДНК ушкодження, які активуються із старінням та інактивованих форм. Недоліком даного способу є багатоетапність та часова затратність [3]. Найближчим аналогом є спосіб аналізу довжини теломер, як маркеру старіння. Винахід у використанні є простим, репродуктивний та швидким, і базується на кількісному аналізі довжини теломер у клінічних зразках. Аналіз довжини теломер проводиться на базі полімеразної ланцюгової реакції, з використанням буферів, ДНК полімерази та відповідних праймерів. Недоліком даного способу є імовірність контамінації зразків. Даний спосіб не передбачає аналіз генів-регуляторів довжини теломер та молекулярно-генетичних маркерів радіаційного опромінення пацієнтів [4]. Поставлена задача вирішується тим. що спосіб визначення радіаційного старіння імунної системи включає визначення відносної довжини теломер, дослідження генної експресії, використовуючи полімеразну ланцюгову реакцію (ПЛР) та кількісну оцінку когнітивної функції за шкалою MMSE, згідно з корисною моделлю, під час дослідження генної експресії за допомогою ПЛР із зворотною транскрипцією вимірюється кількість ампліфікованої ДНК у реальному часі, після кожного циклу ампліфікації. Спосіб визначення радіаційно-обумовленого старіння імунокомпетентних клітин здійснюють шляхом комплексного молекулярно-генетичного аналізу відносної довжини теломер, відносного рівня експресії гену-регулятору довжини теломер TERT та відносного рівня експресії гістону γН2АХ у лейкоцитах периферичної крові УЛНА на ЧАЕС 1986-87 pp. після опромінення у діапазоні малих доз. Для визначення клітинних та генетичних факторів клітинного старіння використані методи flow-FISH, полімеразної ланцюгової реакції у реальному часі та проточна цитометрія. Визначення відносної довжини теломер у лейкоцитах периферичної крові проводилось методом flow-FISH із використанням зв'язаних із флуоресцеїном зразків пептидної нуклеїнової кислоти (PNA). Результати оброблялись за допомогою проточної цитометрії із застосуванням 1 UA 107428 U 5 10 джерела лазерного випромінювання з довжиною хвилі 488 нм. Методика проведення аналізу складалась з декількох етапів, а саме: попередня обробка, денатурація, гібридизація (1-ий день); промивання, фарбування ДНК, аналіз (2-ий день). В якості контролю, була використана культура лейкемічних клітин К-562, які є гіпотриплоїдними та мають довгі теломерні послідовності. У результаті проведеної методики зразки, які гібридизуються із пробою PNA міченою FITC демонструють флуоресцентний сигнал по FL1, який вищий, ніж фоновий/аутофлуоресцентний сигнал, отриманий від зразків таких самих клітин, але гібридизованих за допомогою гібридизаційного розчину без проби. Аналіз проводився у режимі dot plot: FL1-H/FL2-H. Робочі гейти були виділені як для дослідних клітин (лейкоцити людини), так і для контрольних (К-562) клітини у фазі G0/1. Відносна довжина теломерів (RTL) була розрахована за формулою 1: середнє значення FL1 у досдідних клітин зі зразком середнє значення FL1 у досдідних клітин без зразка RTL 100 середнє значення FL1 у контрольних клітин зі зразком середнє значення FL1 у контрольних клітин без зразка . (1) 15 20 25 30 35 40 45 50 55 Дослідження генної експресії проводили за допомогою ПЛР із зворотною транскрипцією у реальному часі. Суть такого методу полягає в тому, що одноланцюгову молекулу РНК перетворюють за допомогою реакції зворотної транскрипції в комплементарну ДНК (кДНК) і потім ампліфікують одноланцюгову молекулу ДНК з використанням ПЛР. Був використаний ПЛР у реальному часі, в основі якого лежать загальні принципи ПЛР, однак відрізняється тим, що вимірюється кількість ампліфікованої ДНК у реальному часі, після кожного циклу ампліфікації. Виділення РНК проводили за допомогою автоматичної станції QIAcube (QIAGENE, Germany) та набору NucleoSpin RNAII (Macherey-Nagel, Germany) для виділення нуклеїнових кислот. Процес запуску системи складається з трьох кроків: завантаження зразків, завантаження буферів, завантаження роторів. Виділення тотальної РНК проводили із лейкоцитів периферичної крові шляхом стабілізації, лізису та гомогенізації клітин, додавання етанолу та зв'язування тотальної РНК, відмивки і DNase обробки та елюції тотальної РНК. Синтез кДНК із зразків виділеної РНК проводився за допомогою High Capacity cDNA Reverse Transcription Kit (Applied Biosystems, USA), що є першим з двох років проведення RT-PCR (ПЛР із зворотною транскрипцією) експерименту. Набір містить реагенти, які при змішуванні формують 2х Reverse Transcription Master Mix (RT-MM). Рівні об'єми зразку РНК (10μl) та RT-MM (10μl) змішували та проводили реакцію зворотної транскрипції за допомогою термошейкеру (Biosan, TS100). Робочі позиції термошейкеру змінювались як продемонстровано у табл. 1. Ампліфікація кДНК є другим кроком у проведенні RT-PCR експерименту, який можна представити за схемою, яка представлена на Фіг.1. Для визначення відносного числа лімфоцитів, які експресують гістон Н2АХ використовували моноклональні антитіла миші anti-H2AX пов'язані з флюорохромом Alexa Fluor 488 (BD, США). Визначення проводили шляхом внутрішньоклітинного забарвлення за наступною методикою: 1) до 50 мкл клітинної суспензії додавали 100 мкл фіксуючого реагенту А та інкубували 15 хвилин при кімнатної температурі; 2) після відмивання у 2 мл фізіологічного розчину шляхом центрифугування відбирали супернатант, додавали 100 мкл реагенту В, що пробиває клітинні мембрани. 3) формували робочий розчин МКАТ Н2АХ шляхом розведення 1:10 (МКАТ: забуфериний фізіологічний розчин). 4) додавали 50 мкл робочого розчину МКАТ Н2АХ до зразка. 3) клітинну суспензію інкубували 60 хвилин при кімнатної температурі. 4) аналізували клітини на лазерному проточному цитофлюориметрі FACScan (BD, США) на 10000 випадків. В основу запропонованого способу лягли проаналізовані та узагальнені результати клінікодіагностичних, імунологічних та молекулярно-генетичних досліджень у 246 УЛНА на ЧАЕС 19861987 pp. чоловічої статі. Загальна когорта обстежених осіб була розподілена на 2 групи, в залежності від віку. І група - УЛНА на ЧАЕС віком до 50 років, II група - УЛНА на ЧАЕС віком старше 50 років. Всі пацієнти мали радіаційний анамнез із документованою дозою (D) зовнішнього опромінення. Характеристика груп обстеження наведена у табл. 2. Відомо, що теломери - унікальні кінцеві ділянки хромосом, які не несуть генетичної інформації, відіграють важливу роль у процесі поділу клітин та забезпечують стабільність геному, захищають хромосоми від деградації та злиття у процесі реплікації, забезпечують структурну цілісність кінцевих ділянок хромосом та захищають клітини від мутацій старіння та 2 UA 107428 U 5 10 15 20 25 30 35 40 45 50 55 60 смерті. При кожному поділі клітини, довжина теломер зменшується і врешті-решт вони досягають критичної довжини, у результаті чого клітина старіє та не може виконувати свої функції. Отже довжина теломер - найбільш точний індикатор біологічного віку, а їх скорочення є основною причиною старіння та пов'язане із вираженими віковими змінами у стані здоров'я [5]. На Фіг.2 представлені результати аналізу відносної довжини теломер у різних вікових групах УЛНА на ЧАЕС 1986-87 pp. Встановлено, що у віковій групі УЛНА на ЧАЕС старше 50 років показник RTL (відносної довжини теломер) знижений (17,11±0,78 (М±m)), порівняно із групою УЛНА на ЧАЕС молодше 50 років (16,07±0,30 (М±m)). Регуляція довжина теломер підтримується теломеразою - ферментом, який здатен добудовувати кінцеві ділянки хромосом шляхом синтезу специфічної послідовності нуклеотидів (ТТАГГ) на кінцевих ділянках хромосом. Вона складається із 2 основних компонентів теломеразної РНК (TER) та звороної транскриптази (TERT) та контролюється геном TERT. У більшості клітин експресія цього гену не виражена, тобто теломераза не активна, а репресія теломерази є характерною рисою клітинного старіння. Теломераза формує матрицю, на основі якої добудовуються критично короткі теломери, попереджає скорочення теломер, захищає клітини від передчасного старіння. Активація теломерази характерна лише для статевих та пухлинних клітин. Отже, вплинути на процес клітинного старіння можна шляхом активації теломерази [6]. На Фіг. 3. представлені результати ПЛР аналізу відносної експресії гену TERT у різних вікових групах УЛНА на ЧАЕС 1986-87 pp. Встановлено, що у віковій групі УЛНА на ЧАЕС старше 50 років показник RQ (відносна генна експресія) знижений (17,11±0,78 (М±m)), порівняно із групою УЛНА на ЧАЕС молодше 50 років (16,07±0,30 (М±m)). У групі осіб старше 50 років встановлена кореляційна залежність між відносною довжиною теломер та відносним рівнем експресії гену TERT. Коефіцієнт кореляції за Пірсоном становив r=0,38. Більшість теорій клітинного старіння припускає, що в його основі лежить реорганізація геному, яка відбувається у результаті скорочення теломер, активації мобільних генетичних елементів та дефектів систем репарації. Поряд із теломерами, ще одним маркером старіння (яке індуковане стресом) є наявність фосфорильованої форми гістону γ-Н2АХ. γ-Н2АХ є маркером ушкодження ДНК та є гіперчутливим до радіаційного ураження та генотоксичних агентів. Визначення γ-Н2АХ може стати потужним інструментом для моніторингу генотоксичного резалтінгу, асоційованого із розвитком раку та прогресією туморогенезу у віддаленому та ранньому періоді після опромінення. Були продемонстровані докази зв'язку експресії γ-Н2АХ гістонів з опроміненням малими дозами радіації [7]. На Фіг.4. представлені результати аналізу внутрішньоклітинної експресії γ-Н2АХ у різних вікових групах УЛНА на ЧАЕС 1986-87 pp. Встановлено, що у віковій групі УЛНА на ЧАЕС старше 50 років відсоток γ-Н2АХ - позитивних клітин підвищений (0,97±0,13 (М±m)), порівняно із групою УЛНА на ЧАЕС молодше 50 років (0,54±0,07 (М±m)). Приклади Приклад № 1. Реєстраційний номер № 186991. УЛНА на ЧАЕС 1986-87 pp. Проходив обстеження 2014 р. Вік - 65 роки. Доза зовнішнього опромінення - 26 сЗв. Відносна довжина теломер - 11 %. Відносний рівень експресії гістону Н2АХ - 4,08 %. Приклад № 2. Реєстраційний номер № 186959. УЛНА на ЧАЕС 1986-87 pp. Проходив обстеження 2014 р. Вік - 54 роки. Доза зовнішнього опромінення - 13,45 сЗв. Відносна довжина теломер - 13 %. Відносний рівень експресії гістону Н2АХ - 1,43 %. Приклад № 3. Реєстраційний номер №187054. УЛНА на ЧАЕС 1986-87 pp. Проходив обстеження 2014 р. Вік - 63 роки. Доза зовнішнього опромінення - 2,2 сЗв. Відносна довжина теломер - 12 %. Відносний рівень експресії гістону Н2АХ - 5,61 %. Приклад № 4. Реєстраційний номер № 182031. УЛНА на ЧАЕС 1986-87 pp. Проходив обстеження 2013 р. Вік - 44 роки. Доза зовнішнього опромінення - 1,829 сЗв. Відносна довжина теломер - 20 %. Відносний рівень експресії гістону Н2АХ - 0,73 %. Приклад № 5. Реєстраційний номер № 181758. УЛНА на ЧАЕС 1986-87 pp. Проходив обстеження 2013 р. Вік - 46 роки. Доза зовнішнього опромінення - 23 сЗв. Відносна довжина теломер - 21 %. Відносний рівень експресії гістону Н2АХ - 0,26 %. Джерела інформації: 1. Method of treating aging-related disorders / Andrews William H. // Патент на винахід № US2003077757 (A1), Індекс МПК: С07К16/00, С12Р21/08, С07К16/00, С12Р21/08, опубліковано 24.04.2003, esp@cenet. 2. Cell aging as a unique biomarker of major depression / Wolkowitz O.M., Mellon S.H., Epel E.S., Lin J. et. al // Патент на винахід № US2013289126 (A1), Індекс МПК: А61К31/135, C12Q1/68, опубліковано 31.10.2013. 3 UA 107428 U 5 10 3. Methods for determining aged based accumulation of senescent cells using senescence specific DNA damage markers / Guy R. Adami, Suchismita Panda // Патент на винахід № US20100086941 (A1), Індекс МПК: GO1N33/53; GO1N33/6893, опубліковано 05.04.2010. 4. Methods of using telomeres as markers for aging / Qin James // Патент на винахід № WO2013101290 (A1), Індекс МПК: C12Q1/68, опубліковано 04.07.2013 5. Telomeres shorten at equivalent rates in somatic tissues of adults / L. Daniali, A. Benetos, E. Susser et al. // Nature Communications. - 2013. - № 4. - doi: 10.1038/ncomms2602. 6. Теломераза: структура, функции и пути регуляции активности / М.Э. Зверева, Д.М. Щербакова, О.А. Донцова // Успехи биологической химии. - 2010. - Т. 50. - С. 155-202. 7. γ-Н2АХ as a biomarker of DNA damage induces by ionizing radiation in human peripheral blood lymphocytes and artificial skin / C.E. Redon, J.S, Dickey. W.M. Bonner, O.A. Sedelnikova // Adv Space Res. - 2009. - № 43, Vol. 8. - P. 1171-1178. Таблиця 1 Робочі позиції термошейкеру при проведенні зворотної транскрипції Температура Час Крок 1 25 °C 10 хв. Крок 2 37 °C 120 хв. Крок 3 85 °C 5 хв. Крок 4 4 °C необмежений час Таблиця 2 Структура розподілу груп дослідження за віком та дозою зовнішнього опромінення. Групи дослідження І - УЛНА на ЧАЕС до 50 років II - УЛНА на ЧАЕС > 50 років Всього кількість (осіб) n Характеристика Вік (роки) Доза (сЗв) М±m М±m 36 47,63±0,28 18,63±1,55 210 59,74±0,42 17,22±0,80 246 15 ФОРМУЛА КОРИСНОЇ МОДЕЛІ 20 Спосіб визначення радіаційного старіння імунної системи, що включає визначення відносної довжини теломер, дослідження генної експресії, використовуючи полімеразну ланцюгову реакцію (ПЛР) та кількісну оцінку когнітивної функції за шкалою MMSE, який відрізняється тим, що під час дослідження генної експресії за допомогою ПЛР із зворотною транскрипцією вимірюється кількість ампліфікованої ДНК у реальному часі, після кожного циклу ампліфікації. 4 UA 107428 U 5 UA 107428 U Комп’ютерна верстка О. Рябко Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
МПК / Мітки
МПК: G01N 33/534, A61B 5/00
Мітки: визначення, спосіб, імунної, старіння, радіаційного, системі
Код посилання
<a href="https://ua.patents.su/8-107428-sposib-viznachennya-radiacijjnogo-starinnya-imunno-sistemi.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення радіаційного старіння імунної системи</a>