1-феніл-4-арил-5,6,7,8-тетрагідро-2,2a,8a-триазациклопента[cd]азулени, що мають протипухлинну активність
Номер патенту: 117545
Опубліковано: 26.06.2017
Автори: Демченко Анатолій Михайлович, Бобкова Людмила Станіславівна, Колесніков Олексій Володимирович, Демченко Сергій Анатолійович
Формула / Реферат
1-Феніл-4-арил-5,6,7,8-тетрагідро-2,2а,8а-триазациклопента[сd]азулени,
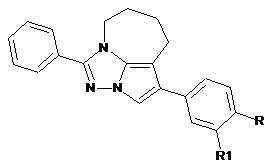
де R, R1=Н, СН3, ОСН3, OC2H5, -ОСН2СН2О-, Сl, Вr,
що мають протипухлинну активність.
Текст
Реферат: 1-Феніл-4-арил-5,6,7,8-тетрагідро-2,2а,8а-триазациклопента[сd]азулени N N N R R1 , де R, R1 = Н, СН3, ОСН3, OC2H5, -ОСН2СН2О-, Сl, Вr, що мають протипухлинну активність. UA 117545 U (12) UA 117545 U UA 117545 U Корисна модель належить до органічної, фармацевтичної хімії та медицини, а саме до одержання біологічно активних похідних 1-феніл-4-арил-5,6,7,8-тетрагідро-2,2а, 8атриазациклопента[сd]азулену, що мають формулу: N N N R R1 5 10 15 20 25 де R, R1 = Н, СН3, ОСН3, ОС2Н5, -ОСН2СН2О, Сl, Вr, які проявляють протипухлинну активність і можуть бути рекомендовані як лікарські субстанції фармацевтичних препаратів, призначених для лікування онкологічних хвороб. На сьогодні для лікування пухлинної хвороби та досягнення паліативного ефекту, що призводить до зменшення пухлини і відповідно до клінічної ремісії, застосовують понад 50 протипухлинних препаратів, активних при різних формах злоякісних утворень. Відомі протипухлинні препарати з різними механізмами дії застосовують в схемах лікування. При цьому виражений клінічний ефект складає від 20 % до 80 %, в окремих випадках ремісія до 2 років, понад 10 % хворих мають ремісію понад 3 роки. Широке застосування набули циклофосфан, метатрексат, вінкристин, адріабластин [1]. Метотрексат у зв'язку з антифолеатним ефектом пригнічує клітинний мітоз, гальмує ріст злоякісних новоутворень та є більше активним по відношенню до клітин, що швидко ростуть. Адріаміцин на сьогодні є єдиним цитостатиком, що проявляє незначну активність по відношенню до печінково-клітинної карциноми (лікувальний ефект складає 3-70 %, найчастіше 36,5 %). Застосуванню цитостатичних препаратів перешкоджає механізм лікарської мультирезистентності. Вказані лікарські засоби мають необхідні лікувальні властивості, але проявляють значні побічні ефекти з боку системи кровотворення (лейкопенія, анемія, тромбоцитопенія), ЦНС (почуття втоми, головокружіння головний біль, афазія, сонливість, судоми), репродуктивної системи (порушення остогенезу та сперматогенезу, олігоспермія, порушення менструального циклу, зниження лібідо, імпотенція), сечовидільної системи (гематурія, цистит, виражені порушення функції нирок, алергічні та дерматологічні реакції, тощо. Протипухлинну дію проявляють також деякі похідні триазолу. Відомий лікарський засіб Летрозол (Фемара) 4,4'-(1H-1,2,4-Триазол-1-ілметилен)дибензонитрил, загальної формули [2], N N N N N 30 Летрозол який використовується як протипухлинний гормональний засіб та антогонист гормонів, при злоякісних новоутворюваннях молочної залози. 1 UA 117545 U N N N N N 5 10 15 20 25 30 Анастрозол Анастрозол [3] проявляє активність проти естроген залежних пухлин молочної залози у жінок. Він є селективним не стероїдним інгібітором ферменту ароматази, який призводить до зниження рівня естрадіолу в периферичних тканинах. Відомо [4], що захворювання на пухлини молочної залози в світі становлять 22.9 % від загальної кількості онкологічних захворювань. При застосуванні анастрозолу та летрозолу може розвиватися анемія, тромбофлебіт та лейкопенія, що є показаннями на відміну препарату. Підвищення ефективності хіміотерапії пухлинної хвороби в першу чергу пов'язано із створенням нових, ефективних протипухлинних препаратів. В основу корисної моделі поставлена задача пошуку нових речовин, що проявляють протипухлинну активність - здатність пригнічувати ріст клітин раку, що охоплюють широкий спектр онкологічних захворювань людини. Поставлена задача вирішується шляхом синтезу нових хімічних речовин -похідних 1-феніл4-арил-5,6,7,8-тетрагідро-2,2а, 8а-триазациклопента[cd]азулену 6 a-g, що проявляють протипухлинну активність, . Заявлені похідні 1-феніл-4-арил-5,6,7,8-тетрагідро-2,2а, 8а-триазациклопе-нта[о/]азулену 6 a-g одержують з високими виходами при використанні відомих синтетичних підходів у декілька стадій, за наступною схемою: Схема 1. Синтез 1-феніл-4-арил-5,6,7,8-тетрагідро-2,2а, 8а-триазациклопента[cd]азулену 6 a-g де 4-6 a: R, R1 = Н, b R = СН3, R1 = Н; с R = ОСН3, R1= Н; d R=OC2H5, R1 = Н; e RR1 = -ОСН2СН2О; f R = СІ, R1=H; g R=Br, R1=H Приклади конкретного виконання. 2-Метокси-3,4,5,6-тетрагідро-7H-азепін 1 одержано алкілуванням капролактаму диметилсульфатом за методом [5]. 3-Феніл-6,7,8,9-тетрагідро-5Н-[1,2,4]триазоло[4,3-а]азепін 3 одержано конденсацією 2метокси-3,4,5,6-тетрагідро-7H-азепіну 1 з гідразидом бензойної кислоти 2 та подальшою циклізацією проміжного продукту за методом [6]. Спектри ПМР були зареєстровані на спектрометрі Bruker VXR-300, робоча частота 299,945 МГц, внутрішній стандарт ТМС. Контроль за чистотою синтезованих сполук 2 UA 117545 U 5 10 15 20 25 30 35 40 45 50 55 60 здійснювався за допомогою ТХС на пластинках Silufol UV-254 в системі хлороформ - метанол 9:1. Приклад 1. 1,4-дифеніл-5,6,7,8-тетрагідро-2,2а, 8а-триазациклопента [сd]азулен 6 а. Суміш 2.13 г (0.01 моля) 3-феніл-6,7,8,9-тетрагідро-5H- [1,2,4] триазоло[4,3-а]азепіну 3 та 1.99 г (0,01 моля) фенацилброміду 4а кип'ятили у 80 мл етил-ацетату 1 годину. Після охолодження розчинник декантували, залишок - четвертинну сіль 5 - промивали етером, доливали 40 мл 5 % розчину NaOH і кип'ятили реакційну суміш 3 години. Після охолодження осад відфільтрували, промивали водою, сушили. Очищали кристалізацією із бензену. Вихід 1.19 г (38 %). Тпл= 1891 191 °C. Знайдено, %: N 13.2, C21H19N3. Розраховано, %: N 13.4. ЯМР Н (δ, м.ч., DMSO-d6): 2.01 (м, 4Н, 6,7-СН2СН2), 2.80 (м, 2Н, 5-СН2), 4.08 (м, 2Н, 8-СН2), 7.24 (с, 1Н, 3-Н), 7.49-7.81 (м, 10Н, 2Ph). Приклад 2. 1-Феніл-4-(пара-толіл)-5,6,7,8-тетрагідро-2,2а, 8а-триазациклопента[cd] азулен 6 b одержано аналогічно прикладу 1 із 2.13 г (0.01 моля) 3-феніл-6,7,8,9-тетрагідро-5Н[1,2,4]триазоло[4,3-а]азепіну 3 та 2.13 г (0.01 моля) α-бром-4-метілацетофенону. Вихід 1.41 г (43 %). Тпл= 190-192 °C (з бензену). Знайдено, %: N 13.1, C22H21N3. Розраховано, %: N 12.8. ЯМР 1 Н (δ, м.ч., DMSO-d6): 2.00 (м, 4Н, 6,7-СН2СН2), 2.31 (с, 3Н, СН3), 2.81 (м, 2Н, 5-СН2), 4.08 (м, 2Н, 8-СН2), 7.17 та 7.37 (д-д, 4Н, С6Н4), 7.22 (с, 1Н, 3-Н), 7.57-7.80 (м, 5Н, Ph). 1 Приклад 3. 1-Феніл-4-(4 -метоксифеніл)-5,6,7,8-тетрагідро-2,2а, 8атриазациклопента[cd]азулен 6 с одержано аналогічно прикладу 1 із 2.13 г (0.01 моля) 3-феніл6,7,8,9-тетрагідро-5Н-[1,2,4]триазоло[4,3-а]азепіну 3 та 2.29 г (0.01 моля) α-бром-4метоксіацетофенону. Вихід 1.75 г (51 %). Тпл = 181-182 °C (з бензену). Знайдено, %: N 12.5, 1 C22H21N3O. Розраховано, %: N 12.2. ЯМР Н (δ, м.ч., DMSO-d6): 2.01 (м, 4Н, 6,7-СН2СН2), 2.78 (м, 2Н, 5-СН2), 3.77 (с, ЗН, ОСН3), 4.08 (м, 2Н, 8-СН2), 6.94 та 7.41 (д-д, 4Н, С6Н4, J=8.7 Гц), 7.21 (с, 1Н, 3-H), 7.56-7.81 (м, 5H, Ph). Приклад 4. 1-Феніл-4-(4'-етоксіфеніл)-5,6,7,8-тетрагідро-2,2а, 8а-триазациклопента[сd]азулен 6 d одержано аналогічно прикладу 1 із 2.13 г (0.01 моля) 3-феніл6,7,8,9-тетрагідро-5Н-[1,2,4]триазоло[4,3-а]азепіну 3 та 2.43 г (0.01 моля) α-бром-4етоксіацетофенону. Вихід 1.32 г (37 %). Тпл= 197-198 °C (з бензену). Знайдено, %: N 12.1, 1 C23H23N3O. Розраховано, %: N 11.8. ЯМР Н (δ, м.ч., DMSO-d6): 1.35 (т, 3Н, СН3), 2.05 (м, 4Н, 6,7СН2СН2), 2.80 (м, 2Н, 5-СН2), 4.05 (кв, 2Н, СН2), 4.08 (м, 2Н, 8-СН2), 6.89 та 7.31 (д-д, 4Н, С6Н4, J=8.4 Гц), 7.09 (с, 1Н, 3-Н), 7.53-7.78 (м, 5Н, Ph). Приклад 5. 1-Феніл-4-(2,3-Дигідробензо[1,4]діоксан-6-їл)-5,6,7,8-тетра-гідро-2,2а, 8атриазациклопента[cd]азулен 6 е одержано аналогічно прикладу 1 із 2.13 г (0.01 моля) 3-феніл6,7,8,9-тетрагідро-5Я-[1,2,4]триазоло[4,3-а] азепіну 3 та 2.57 г (0.01 моля) 2-бром-1-(2,3дігідробензо[1,4]діоксан-6-їл)-етанону. Вихід 1.30 г (35 %). Тпл= 152-153 °C (з бензену). 1 Знайдено, %: N 11.5, C23H21N3O2. Розраховано, %: N 11.3. ЯМР Н (8, м.ч., DMSO-d6): 1.86-2.00 (м, 4Н, 6,7-СН2СН2), 2.75 (м, 2Н, 5-СН2), 3.70 (м, 2Н, 8-СН2), 4.24 (м, 4Н, ОСН2СН2О), 6.80-6.87 (м, 3Н, С6Н3), 7.28 (с, 1Н, 3-Н), 7.40-7.51 (м, 5Н, Ph). 1 Приклад 6. 1-Феніл-4-(4 -хлорфеніл)-5,6,7,8-тетрагідро-2,2а, 8а-триазациклопента[cd]азулен 6 f одержано аналогічно прикладу 1 із 2.13 г (0.01 моля) 3-феніл-6,7,8,9тетрагідро-5Н-[1,2,4]триазоло[4,3-а]азепіну З та 2.33 г (0.01 моля) α-бром-4-хлорацетофенону. Вихід 1.43 г (43 %). Тпл = 208-209 °C (з бензену). Знайдено, %: N 12.2, C21H18C1N3. Розраховано, 1 %: N 12.1. ЯМР Н (δ, м.ч., DMSO-d6): 2.01 (м, 4Н, 6,7-СН2СН2), 2.80 (м, 2Н, 5-СН2), 4.08 (м, 2Н, 8-СН2), 7.36 (с, 1Н, 3-Н), 7.38-7.80 (м, 9Н, C6H4+Ph). 1 Приклад 7. 1-Феніл-4-(4 -бромфеніл)-5,6,7,8-тетрагідро-2,2а, 8а-триазациклопента[cd]азулен 6 g одержано аналогічно прикладу 1 із 2.13 г (0.01 моля) 3-феніл-6,7,8,9тетрагідро-5Н-[1,2,4]триазоло[4,3-а]азепіну З та 2.78 г (0.01 моля) α-4-дібромацетофенону. Вихід 2.31 г (59 %). Тпл = 214-216 °C (з бензену). Знайдено, %: N 10.9, C21H18BrN3. Розраховано, 1 %: N 10.7. ЯМР Н (δ, м.ч., DMSO-d6): 2.00 (м, 4Н, 6,7-СН2СН2), 2.80 (м, 2Н, 5-СН2), 4.07 (м, 2Н, 8-СН2), 7.35 (с, 1Н, 3-Н), 7.46 та 7.51 (д-д, 4Н, С6Н4, J=8.4 Гц), 7.56-7.80 (м, 5Н, Ph). Приклад 8. Визначення цитотоксичного ефекту in vitro. Для визначення протипухлинної активності 1-феніл-4-арил-5,6,7,8-тетрагідро-2,2а, 8а-триаза-циклопента[cd]азулену 6 a-g дослідження проведено in vitro на 60 лініях ракових клітин (лейкемії, легень, товстого кишечнику, ЦНС, меланоми, яєчників, нирок, простати, молочної залози) при дії речовини в -5 концентрації 10 моль/л за стандартною процедурою [7] оцінки мітотичної активності нових потенційних біологічно активних сполук методом флуоресцентного зафарбування (барвник сульфородамін Б), виконаних у Національному інституті раку США (National Cancer Institute of Health, USA) в рамках Development Therapeutic Program. Результат проведених досліджень виражали у відсотках росту клітин раку у порівнянні з контролем - 5-флуорурацилом. У таблиці показано ефективність сполуки є у пригніченні росту ракових клітин у порівнянні з контролем. 3 UA 117545 U 5 Визначення проводили високочутливим флюорометричним методом, кількісно оцінюючи інтенсивність кольору флуоресцентного випромінювання (барвник - сульфородамін Б) через 48 год. опромінення клітини зі сполукою, що тестується. Результат проведених досліджень виражали у відсотках росту клітин раку до контролю. Використана система відбору та вивчення сполук з потенційною протипухлинною активністю in vitro базується на визначенні відсотку росту клітин пухлини (PG) під впливом сполуки, що тестується. -5 В умовах експерименту заявлені сполуки у концентрації 10 моль/л виявили здатність пригнічувати ріст клітин раку, що охоплює практично весь спектр онкологічних захворювань людини (таблиця). 10 Таблиця Протипухлинна активність 1-феніл-4-арил-5,6,7,8-тетрагідро-2,2а, 8атриазациклопента[cd]азуленів 6 a-g in vitro -5 на лініях клітин раку при дії речовин в концентрації 10 моль/л. Лінії ракових клітин CCRF-CEM HL-60(TB) К-562 Лейкемія MOLT-4 RPMI-8226 SR А549/АТСС EKVX НОР-62 НОР-92 Дрібноклітинний NCI-H226 рак легенів NCI-H23 NCI-H322M NCI-H460 NCI-H522 COLO 205 НСС2998 НСТ-116 Рак товстого НСТ-15 кишечнику НТ-29 КМ12 SW-620 SF-268 SF-295 Рак головного SF-539 мозку SNB-19 SNB-75 U251 LOX IMVI MALME-3M М14 Меланома MDA-MB-435 SK-MEL-2 SK-MEL-28 SK-MEL-5 UACC-257 UACC-62 6а 36.45 48.12 32.89 51.99 30.83 65.69 71.48 52.57 70.51 88.55 86.79 122.5 56.98 88.70 35.69 101.5 43.88 57.61 87.21 88.32 73.33 41.17 77.74 86.46 73.57 80.37 74.73 81.81 87.91 81.36 6b 11.08 -1.56 10.27 21.17 17.18 26.07 35.01 14.35 40.83 34.02 42.46 78.19 27.87 -47.03 1.59 77.51 11.54 20.71 21.23 47.78 30.01 63.68 38.36 26.17 22.83 0.27 30.97 22.74 28.90 6.10 24.36 52.61 4 6с -0.36 -20.72 7.22 3.47 15.20 5.40 13.14 7.40 -4.13 21.07 8.91 15.20 35.98 -85.81 21.37 -1.47 39.17 6.95 14.73 23.10 11.63 28.71 10.26 9.87 -11.78 13.72 10.95 0.56 43.24 1.44 18.97 35.89 6d -6.01 45.27 19.60 33.73 25.07 52.47 90.39 103.6 43.08 100.3 90.65 94.91 83.37 98.44 98.45 53.96 104.0 110.4 69.85 85.34 96.28 88.33 92.75 84.26 86.23 91.75 96.74 98.76 102.2 98.92 103.6 93.40 6е 13.38 56.24 56.24 15.08 21.68 47.70 25.00 43.06 39.85 20.16 43.91 72.96 60.15 30.64 69.18 26.94 46.25 11.09 84.59 30.18 35.11 34.70 50.78 35.47 56.30 52.79 54.03 8.45 33.49 16.44 37.57 30.82 63.74 26.83 0.71 49.53 6f 79.98 93.93 82.05 76.61 94.56 78.96 88.58 108.7 95.15 102.5 96.66 95.51 105.4 83.64 104.1 106.1 89.81 94.09 98.02 99.02 111.3 86.45 95.87 87.87 89.97 99.45 105.4 101.1 101.2 102.3 97.28 99.48 93.01 6g 42.33 88.18 79.43 62.86 78.04 88.91 82.41 99.80 79.42 85.72 98.87 117.7 94.93 97.50 103.3 110.4 77.69 97.42 104.1 74.82 105.8 98.63 108.2 90.65 84.64 90.61 90.55 108.3 112.2 108.1 88.50 105.1 93.38 UA 117545 U Продовження таблиці Лінії ракових клітин IGROV1 OVCAR-3 OVCAR-4 Рак яєчників OVCAR-5 OVCAR-8 NCI/ADR-RES SK-OV-3 786-0 A498 ACHN CAKI-1 Рак нирок RXF393 SN12C TK-10 UO-31 PC-3 Рак простати DU-145 MCF7 MDA-MB231/ATCC Рак молочної HS 578T залози BT-549 T47D MDA-MB-468 5 10 15 20 25 30 6а 74.21 59.96 90.97 54.57 100.9 82.60 77.06 112.7 96.22 75.20 38.10 81.52 86.35 81.38 21.85 6b 15.84 -23.00 74.56 29.22 92.18 28.40 50.13 16.73 66.55 45.79 48.84 11.66 50.95 22.90 33.92 -12.82 6с 25.81 -17.59 31.60 36.28 14.31 78.66 27.80 13.82 28.35 5.60 70.01 23.74 15.18 30.75 11.34 9.47 19.78 13.28 6d 98.63 53.10 97.84 86.23 78.65 101.2 99.22 94.03 78.77 80.57 92.04 110.2 91.08 98.02 82.47 19.28 74.58 94.86 6е 56.48 33.80 65.81 99.34 9.22 92.59 82.59 68.63 73.45 55.50 81.67 58.55 24.67 73.20 77.64 9.61 41.00 37.09 6f 94.87 103.8 99.75 88.23 82.38 106.4 96.63 96.04 108.0 94.97 97.62 114.8 90.33 100.2 79.40 83.39 108.6 86.98 6g 99.39 92.40 92.22 87.89 78.95 102.84 102.75 92.30 84.39 88.04 95.19 103.6 86.18 105.6 86.72 72.38 93.58 80.80 79.64 52.47 15.46 95.53 68.38 105.3 88.40 45.83 -15.55 3.71 27.76 -0.58 1.97 -9.61 86.95 73.95 66.14 89.38 27.36 51.29 58.32 18.61 92.79 99.51 82.51 113.4 82.80 88.66 73.93 83.85 Відповідно до наведеної таблиці 1, сполуки з електронодонорними замісниками в четвертому положенні гетероциклічної системи 6 а-е відносно клітин меланоми, лейкемії, дрібноклітинного раку легенів, раку товстого кишечнику, пухлин кори головного мозку, яєчників, нирок, простати та раку молочної залози виявили найбільш високу протипухлинну активність, ніж препарат порівняння - 5-флуороурацил. Сполуки з електроноакцепторними замісниками 6 f, g виявили активність на рівні препарату порівняння. Так, всі сполуки 6 a-g затримували ріст ракових клітин лейкемії CCRF-СЕМ, HL-60(TB), К562, MOLT-4, RPMI-8226 та SR вище стандарту на 11.09-94.60 %. По відношенню до клітин CCRF-CEM дані сполук 6 с та 6 d становлять -0.35 % та -6.01 % відповідно. Тобто, заявлені сполуки не тільки зупиняють ріст і поділ клітин, а й знищують їх. Сполуки 6 с та 6 d зупиняють ріст і поділ клітин COLO 205 раку товстого кишечнику, та знищують їх на -47.03 % та -85.81 % відповідно. Слід відмітити, що ці ж сполуки особливо активні по відношенню до ракових клітин молочної залози MCF7, HS 578T, ВТ-549 та MDA-MB468 із значеннями -12.82 %, -15.55 %, -0.58 % та -9.61 % відповідно. Таким чином, заявлені похідні 1-феніл-4-арил-5,6,7,8-тетрагідро-2,2а, 8атриазациклопента[сd]азулену проявляють доведену протипухлинну активність по відношенню до широкого спектра ракових клітин та можуть стати основою для створення нових ефективних протипухлинних засобів. Джерела інформації: 1. Протипухлинні засоби. Режим доступу: http://dmupharm.pp.ua/index. php/temi/20khimioterapevtichni-zasobi-riznikh-grup/228-protipukhlinni-zaso-bi. 2. Mouridsen H, Giobbie-Hurder A, Goldhirsch A, Thiirlimann В, Paridaens R, Smith I, Mauriac L, Forbes J, Price KN, Regan MM, Gelber RD, Coates AS. Letrozole therapy alone or in sequence with tamoxifen in women with breast cancer/ Engl. J. Med. 2009 Aug 20/ 361(8): P.766-76. 3. M. Baum, J. Cuzick, J. Forbes, J. Houghton, A. Howell (The AT AC Trialists Group): Anastrozole alone or in combination with tamoxifen versus tamoxifen alone for adjuvant treatment of postmenopausal women with early stage breast cancer. Results of the ATAC (Arimidex, Tamoxifen Alone or in Combination) trial efficacy and safety update analyses. Cancer 2003, 98: P. 1802-1810. 5 UA 117545 U 5 10 4. "World Cancer Report". International Agency for Research on Cancer. 2008. Retrieved 201102-26. (cancer statistics often exclude non-melanoma skin cancers such as basal cell carcinoma, which are common but rarely fatal). 5. Граник В.Г., Жидкова A.M., Курятов Н.С. и др. Ацетали лактамов. VII. Исследование алкилирования N-метиллактамов и лактимных эфиров ди-метилсульфатом//ХГС- 1973.-№11.-С. 1532-1535. 6. Siegfried Petersen and Ernst Tietze. Reaktionen Cyclischer Lactimather mit Acylierten Hydrazinderivaten-Chem. Ber. 1957, V.90, Issue 6, P. 909-921. 7. Beverly A. Teicher, Paul A. Andrews. Anticancer drug development guide: pre-clinical screening, clinical. - Medical. - 2004. - V. 1. - 450 p. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 1-Феніл-4-арил-5,6,7,8-тетрагідро-2,2а,8а-триазациклопента[сd]азулени N N N R 15 R1 , де R, R1=Н, СН3, ОСН3, OC2H5, -ОСН2СН2О-, Сl, Вr, що мають протипухлинну активність. Комп’ютерна верстка А. Крижанівський Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 487/00
Мітки: мають, 1-феніл-4-арил-5,6,7,8-тетрагідро-2,2a,8a-триазациклопента[cd]азулени, активність, протипухлинну
Код посилання
<a href="https://ua.patents.su/8-117545-1-fenil-4-aril-5678-tetragidro-22a8a-triazaciklopentacdazuleni-shho-mayut-protipukhlinnu-aktivnist.html" target="_blank" rel="follow" title="База патентів України">1-феніл-4-арил-5,6,7,8-тетрагідро-2,2a,8a-триазациклопента[cd]азулени, що мають протипухлинну активність</a>
Попередній патент: Залізнична вагон-платформа
Наступний патент: Гіперрозгалужений олігоетер з сульфонат діетиламінними групами як протонпровідна сполука
Випадковий патент: Маслоутворювач-вотатор












