Спосіб визначення генотоксичних вихідів при лікуванні імунодефіцитних станів у дітей
Номер патенту: 35319
Опубліковано: 15.03.2001
Автори: Прохоров Євген Вікторович, Сергєєва Любов Анатоліївна, Уманський Володимир Якович, Прилуцький Олександр Сергійович
Формула / Реферат
Спосіб визначення генотоксичних виходів при лікуванні імунодефіцитних станів у дітей шляхом відбору крові і дослідження її плазми у дітей до лікування і через два тижні після проведення антибіотико-, цитостатико-, гормонотерапії, що відрізняється додатковим дослідженням активностей ферментів холінестерази і альфа-амілази і при зниженні холінестерази і підвищенні активності альфа-амілази на 20-40% визначають генотоксичний ефект.
Текст
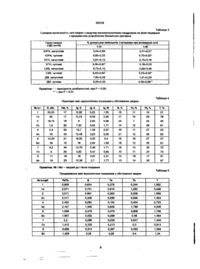
Спосіб визначення генотоксичних виходів при лікуванні імунодефіцитних станів у дітей шляхом відбору крові і дослідження її плазми у дітей до лікування і через два тижні після проведення антибіотико-, цитостатико-. гормонотерапії, що відрізняється додатковим дослідженням активностей ферментів холінестерази і альфа-амілази і при зниженні холінестерази і підвищенні активності альфа-амілази на 20-40% визначають генотоксичний ефект Заявлений спосіб визначення генотоксичних виходів при лікуванні імунодефіцитних станів у дітей відноситься до галузі профілактичної медицини і може мати застосування в клінічній практиці для знижування генотоксичних ускладнень в організмі дітей при впливі мутагенних лікарських засобів, зокрема цитостатичних, гормональних і бактеріцидних препаратів. Відомий спосіб визначення генотоксичних виходів при мутагенному впливі на людину зовнішніх факторів [1. Руководство по изучению генетических эффектов в популяциях человека. - ВОЗ, Женева - 1989], а саме підрахунок хромосомних аберацій в лімфоцитах периферичної крові. Недоліком відомого способу є те, що у даній груп» хворих дітей вказаний метод не має тямкого значення, так як лікування імунодефіцитних станів має напрямок як раз на те, щоб викликать хромосомні перебудови в клітинах імунної системи Стан же других клітин і систем організму, не застосованих в патологічному процесі, після мутагенного впливу лікарських засобів протягом лікування практично залишається невідомим. Найбільш близьким за технічної суті заявляемому способу є спосіб визначення генотоксичності внутрішнього середовища організму по загальній сумарній мутагенності сечі (2. Пилинская М.А. Использование культуры лимфоцитов периферической крови человека для определения мутагенной активности мочи // Цитология и генетика - 1985. Т. 19, Na 3. - С. 183-187} шляхом відбору крові від донора і дослідження генетичного апарату її лейкоцитів після уведення в культуру сечі. Недоліком відомого способу є те, що для визначення сумарної мутагенності сечі потребується особлива стерильність її відбору, донорська кров, а для проведення досліджень необхідна генетична лабораторія, відповідні спеціалісти, та й самий метод - дуже трудомісткий. В основу винаходу поставлено завдання визначення генотоксичних виходів при лікуванні імунодефіцитних станів у дітей шляхом визначення до лікування і через 2 тижні після проведення антибіотико-, цитостатико-, гормонотерапії з мутагенними властивостями, активностей ферментів холінестерази і альфа-амілази. І, якщо холінестеразна активність буде знижена, а альфа-амілазна підвищена на 20-40% враховують проявою мутагенного процесу в здорових тканинах організму дітей в результаті впливу лікарських препаратів, що дає можливість викликати мутації в активних клітинах імунної системи при аутоімунних захворюваннях у дітей і знижувати мутагенні і канцерогенні наслідки від їх застосування в других тканинах, при цьсму обґрунтовуються зміни ходу лікування, схем і доз лікарських засобів. Цей спосіб визначає момент можливих генетичних пошкоджень в соматичних клітинах здорових тканин, що не застосовані в патологічному процесі, що дає можливість профілактичного захисту цих клітин від руйнування або наступної малігнізації. Сутність способу ув'язнюється тим, що визначення генотоксичних наслідків лікування імунодефіцитних захворювань у дітей здійснюється шляхом відбору крові і дослідження її плазми у дітей до лікування і через 2 тижні після проведення о со ю со 35319 антибіотико- цитостатико-, гормонотерапії, і по модифікації мутагенними лікарськими засобами активностей ферментів, які продукують здорові, не застосовані в патологічному процесі, тканини, що вказує на зміни експресії генів і появи пошкоджень в генетичному апараті їх клітин При цьому, альфа-амілазна активність ппазми крові дітей протягом лікування підвищується на 20-40%, а холінестеразна - знижується. Таким високочутливим до мутагенного впливу дітям необхідна індивідуалізація режиму лікування Новим в заявляемому способі є те, що досліджують активність ферментів холінестерази і альфа-амілази і при зниженні хопінестерази і підвищенні активності альфа-амілази на 20-40% визначають генотоксичний ефект проводжуваної терапії у дітей з імунодефіцитними захворюваннями Зростання кількості аутоімунних захворювань є результатом цитогенетичних аномалій в організмі дітей Різноманітні види лікувальних засобів і мутагени в навколишньому середовищі збільшують нестабільність в генетичний апарат клітин організму дитини. Застосування в медицинській практиці імунодепресантів має побочну дію - мутагенну, що може явитися причиною вторинного імунодефіциту Якщо імунокорегуюча терапія даних захворювань спрямована в основному на те, щоб визивати в гіперфункціонуючих популяціях клітин імунної системи, виникає насущна проблема захисту клітинного геному других тканин від мутагенезу і наступного канцерогенезу. Причому, діти з імунопатологією, як раз і складають таку групу "ризику", де зростає кількість злоякісних новоутворень в зв'язку з послабленням імунологічного надзору за генетично чужорідною інформацією. Нами визначені критерії, за допомогою яких можливо зафіксувати початок мутагенного процесу в здорових клітаних організму при лікуванні аутоімунних захворювань. Для проведення клінічного моніторингу визначені тканини печінки і подшлунковоїзалози Розглянемо різновид імунодефіцитних станів, коли в ростучому організмі знижується імунологічний нагляд за вірулентними мікроорганізмами і основну характеристику методів терапії імунодефіцитних станів, що має в спектрі своїх ускладнень мутагенні зміни в органах і тканинах. Вторинні імунодефіцити, не будучи уродженими, виникають впродовж життя внаслідок різних зовнішніх причин, таких як емоційні стреси, інфекції', фізичні й токсичні агенти Сюди входять класичні імунодефіцитні стани і малі (мінорні) аномалії імунно) системи В медицині існує проблема інтерференції ліків та інших факторів на організм, генотоксичних агентів, що містяться в повітрі сучасних індустріальних центрів, деяких продуктів харчування. У зв'язку з цим збільшується кількість аутоімунних захворювань, внаслідок більш частих цитогенетичних аномалій. Багато з імуномодуляторів є одночасно мутагенами і, можливо, саме тому вони ефективні при імунодефіцитних захворюваннях. Процеси зцілення організму повинні базуватися на знищенні генетично чужорідних клітинних популяцій та антимутаген ного захисту інших, непошкоджених і таких, що не беруть участі у патологічних механізмах клітин. Антибіотики, що застосовуються для лікування запальних та імунодефіцитних захворювань (рифаміцини. актиноміцин Д, гентаміцин, стрептоміцин, тетрацикліни та ін), інгібують синтез нуклеїнових кислот за рахунок блокування ДНКполімераз і РНК-полімераз. Імунодепресанти, які застосовані у терапії імунних захворювань, мають побічний вплив - мутагенний, оскільки діють відносно нуклеїнової кислоти' змінюють ДНК, число нуклеотидів, викликають перебудови в хромосомах. В період останніх років увага прикута до циклоспорину С - ефективно використовується в ' трансплантолог»! Одержано дані про його ефективність в процес» лікування деяких форм гломерулонефриту. В нефролопчній практиці знаходять застосування похідні дисхлорметиламіну циклофосфаи, тому широко застосовується при лікуванні . гломерулонефриту у дітей. Як алкілуючі засоби, вони пригнічують клітинний поділ Механізм дії цієї групи піків міститься у приєднанні алкільних груп до важливих біологічних структур, особливо до нуклеїнових кислот. В молекулі ДНК алкілуюча група зв'язується з гуаніном, що призводить до руйнування молекули або її десприралізації. В результаті цього переривається необхідна для клітинного поділу реплікація ДНК. Кортикостероїди також широко використовуються при лікуванні токсичних форм гострої пневмонії та бронхіальної астми для пригнічення системних реакцій на токсини, зменшення неспецифічних клітинних пошкоджень, щоб змінити гемодинаміку та протинабрякову дію. Причиною вторинного імунодефіциту може стати застосуван' ня великих доз кортикостероїдів. Препарати преднизолонового ряду, що призначаються у високих дозах, призводять до зменшення вмісту в крові лімфоцитів (Т-хелперів), пригнічують РБТЛ, знижують продукцію імуноглобулінів, вміст вітаміну С і ДНК в зобнШзалозі, змінює активність ДНК-аз. Є підстава розглядати людей з дефектами імунітету як групу підвищеного ризику до мутагенних впливів та їх лікування супроводжується уведенням поєднань мутагенів: циклофосфану та інших алкілуючих засобів з антибіотиками, кортикостероїдів з антибіотиками, включення до схеми лікування різних імуномодуляторів. Оскільки імунокорегуюча (патогенетична) терапія цих захворювань спрямована в основному на те, щоб викликати мутації в гіперфункціонуючих популяціях клітин імунної системи, у зв'язку з чим і поліпшується стан хворих, постає насущна проблема захисту клітинного генома інших тканин. Застосування відомих антимутагенів - не завжди показане конкретним особам. Тому ми зупинилися на пошуці критеріїв, що визначають небезпечний для мутагенезу стан тканин дитячого організму, які нас зацікавили. Печінка є не тільки біологічним бар'єром на шляху токсинів, а і органом, відповідальним за усі види обміну. Кишкова мікрофлора перетворює хімічні сполуки в канцерогени, мутагени та коканцерогени або промотори пухлин. При цьому детоксикації та кон'югації зазначають фенол, аміак, індол, скатол, де печінка також € центральною лан 35319 кого Кон'югаційні процеси становлять універсальний механізм перетворення молекул, котрі мають катехоламінове кільце з утворенням метаболічно неактивних молекул Тобто в обороні організму від ксенобютиків мають значення мікросомальні ферменти, створюючі нові функціональні групи із збільшенням гідрофільності молекули та ферменти кон'югації ксенобютиків з SH-групами, сірчаною та глюкуроновою кислотами З віком зменшується резервна здатність печінки до метаболізму ксенобютиків а у дітей вона ще не досягла досконалості Зниження синтетичних процесів у гепатоцитах за хронічної дії іепатотоксичних мутагенів відображають ппоальбумшемія, ппохолестеринемія, низька активність холінестераз. зниження протромбінового часу, концентрації фібриногену, підвищення вільного холестерину Тому варіантом вирішення даної ситуації щодо пошуку критеріїв ЯКІ могли б фіксувати вплив терапії на "здорову" клітинну популяцію (тканина) тим більше що у таких хворих вона пперчутлива до мутагенів є функціональний стан печінки Вона не уражена патологічним процесом за даних форм ІДС і починає реагувати на лікувальну процедуру явищами некрозу та регенерації При цьому може відбуватися перепрофілізація її основних ферментних систем залежно від співвідношення (збалансованого чи незбалансованого), яке складалося в н тканині некротичних і мітотичних процесів, а ВІДПОВІДНО І пригнічення тканинного і клітинного диференціювання Оскільки у дітей з ІДС під час лікування відмічалося і підвищення протеолітичної активності сироватки крові, то і стан підшлункової залози хворих фіксувався в клінічному моніторинзі При цьому, визначався спектр активностей ферментів клітин цих органів та закономірності їх змінень у зв'язку з проведеним лікуванням дозами уведених цитостатичних засобів а також враховували загальну чутливість дитячого організму, детерміновану генетичним статусом Реалізують засіб наступним чином одномоментним визначенням в двух пробах плазми крові хворих аутоімунними захворюваннями дітей активностей ферментів холінестерази і альфа-амілази Беруть кров з вени, ВІДДІЛЯЮТЬ плазму і першу пробу (до лікування) зберігають при температурі мінус 20°С Друга проба - через 2 тижні після початку лікування патологічного процесу цитостатиками, гормонами або антибіотиками (мікролідами) При зниженні активності холінестерази і підвищенні активності альфа-амілази на 20-40% - зараховується що в тканинах печінки і підшлункової залози відмічається мутагенний ефект від уводимої терапії, а організм дітей - є високочутливий для мутагенезу і наступного канцерогенезу Після визначення такого стану дітям показана сувора індивідуалізація режиму лікування (зменшення доз, зміна препаратів, перерва в схемі лікування) Приклад 1. До групи обстежених увійшли діти з системними захворюваннями сполучної тканини, ювенільним ревматоїдним артритом (ЮРА), гломерулонефритом, бронхіальною астмою, дерматоміозитом (ДМ) Нечисленна за складом група хворих на системні захворювання сполучної тканини (7 дітей) за своїм КЛІНІЧНИМ проявом, показниками гуморально) та імунологічної активності, СПІЛЬНІСТЮ патогенетичних механізмів і характером використовуваної терапії тісно примикала до групи дітей з суглобово-вісцеральною формою ювенільного ревматоїдного артриту, у зв'язку з чим вони розглядалися в одній групі під час аналізу імунологічних показників У цій групі пацієнтів було 5 хворих на системний червоний вівчак (СЧВ) і 2 - на дерматоміозит Обстежено також 27 дітей, котрі страждають на ювенільний ревматоїдний артрит в тому числі 9 - переважно на суглобову форму захворювання, 18 - суглобово-вісцеральну форму захворювання При всіх нозологічних формах переважали дівчатка співвідношення дівчаток і хлопчаків склало 2,6 1 в групі з суглобово вісцеральною формою ЮРА Вік пацієнтів коливався від 3 5 до 14 років, складаючи пересічно ( 9 5 + 1 ? ) років Давність захворювання на момент обстеження варіювала від декількох МІСЯЦІВ ДО 8 років Дослідження преморбідного фону показало наявність ексудативно-алерпчної діатезу у 38,5% дітей, схильність до частих респіраторних вірусних за хворювань майже у третині хворих У зв'язку з тим що в патогенезі ювенільного ревматоїдного артриту системних захворювань сполучної тканини головну роль відводять порушенням імунологічної реактивності, нами у вищеназваних хворих поряд з проведенням загального аналізу крові вивчено показники клітинної та гуморальної ланок імунної системи Виходячи з КЛІНІЧНИХ даних, результатів лабораторних та інструментальних методів обстеження в залежно від активності патологічного процесу обстеженим дітям призначалася терапія або глюкокортикостероідами або нестероідними протизапальними засобами Схеми лікування з використанням преднизолону призначалися дітям з суглобово-вісцеральними формами ювенільного ревматоїдного артриту а нестероідні протизапальні засоби включались у лікування хворих, з переважно суглобовою формою захворювання і з меншою активністю патологічного процесу Дгги, хворі на системні захворювання сполучної тканини та ювенільний ревматоїдний артрит, характеризуються істотними порушеннями імунологічної реактивності організму Висока активність захворювання залучення до патолопчного процесу різних органів і систем організму визначають резистентні до терапГі зокрема глюкокортикоідної, більш стійкі порушення показників імунологічної реактивності Причому призначення цим дггям стероїдних препаратів, напевне, пригнічує специфічну імунну вщповідь. що важливо в лікуванні аутоімунної патології Найбільш численною була група хворих з БА Тяжкий перебіг спостерігався у 5-ти дітей шкільного віку У 2-х хворих перебіг захворювання розцінено як легкий, у решти - середньої тяжкості Атопічну форму діагностовано у 1/3 обстежених, у решти - інфекційно-алерпчну Обстеження усіх хворих проведено в період приступу (в момент госпіталізації) і через 2-3 тижні після лікування Лікування проведено відповідно до ступінчастої схеми з використанням р-агоністів, інгаляційних кортикостероїдів та фізіотерапевтичних методів 35319 В усіх обстежених відмічено зниження Г-клітинної ланки імунітету, особливо виражене в популяції Т-хелперів і Т-супресорів Майже у половини (46%) виявлено зниження функціональної здатності Т-лімфоцитів у реакції бласної трансформації Поряд з цим виявлено зміни в гуморальній ланці імунітету, що характеризуються підвищен ням IgG і ІдМ у більшості хворих (84 3%) а концентрація ІдА підвищувалася лише у 60% обстежених дітей а у 40% спостерігалося зниження Серед хворих ГГН переважали діти з нефритичним синдромом що розвинувся внаслідок перенесеної стрептококової інфекції (ангіна, стрептодермія та ін - 68%) У однієї дитини д(аг ностовано ГГЧ з нефротичним синдромом і ще у однієї з ізольованим сечовим синдромом Обстеження проводилося в період виражених КЛІНІЧНИХ * проявів, а також в період зворотного розвитку симптомів Усі хворі одержували базисну терапію, і у 1 хворого з нефротичним синдромом обстеження проведено на фоні патогенетичної терапії преднизолоном Двоє хворих з ХГН мали гематуричну форму захворювання (давність процесу 3 роки) Хворих обстежено на фоні лікування, проведеного деланном у період частково» клшіко-лабораторної ремісії захворювання Результати імунологічних досліджень свідчать про односпрямовані дії клітинного імунітету в усіх обстежених, незалежно від клінічної форми захворювання і виражаються пригніченням 1 клітинної ланки з активацією гуморальної Група хворих з СЗСТ складалася з 6 осіб Із них недиференцмований колагеном у 1 дитини, системна склеродермія у 1 хворого і у 4-х - ЮРА В усіх обстежених з ЮРА встановлено суглобововісцеральну форму захворювання з давністю процесу від 3 років до півроку Переважала висока і середня активність процесу » лиаіе у 1 хворого активність розцінено як помірну Із симптомів частіше над усе зустрічався поліартрит колінних, променевозап'ясткових та гомілковостопних суглобів Усі хворі одержували нестероідн» противозапальні засоби троє дітей - преднизолон у поєднанні з лейкераном один - лише преднизолон, незважаючи на те, що група обстежених нечисленна, в процесі дослідження виявлено велику депресію показників клітинного імунітету І факторів неспецифічно» резистентності організму Характерне пригнічення клітинною ланки На фоні проведеного лікування кортикостероїдами через З тижні показники мали тенденцію до нормалізації При ревматоїдному артриті в групі чутливих до терапії дітей активність альфа-амілази підшлункової залози в крові підвищується на 66,6%, а при гломерулонефритах - лише на 11,1%, при системних захворюваннях сполучної тканини - на 44,2%, і при атопічних дерматитах - на 79,3% Причому, індивідуальні коливання можуть заходити за нормальні значення показників Дані свідчать про опасний стан клітин підшлункової залози та посилення цього стану потім Приклад 2. З результатів таблиці 2 випливає, що активність ферменту холінестерази в чутливій до цитостатично* терапп групі хворих дітей при ревматоїдному артриті знижується пересічно на 29,42%, при гломерулонефритах - на 37,7% при системному •червоному вівчаку - на 25,2% і при лікуванні атопічного дерматиту - на 40,8% Індивідуально у кожного хворого зниження вироблення холінестерази печінкою свідчить про порушення й ферментативної системи та подальшої особливості підвищеної чутливості інших клітин організму до цитостатичних засобів, що може мати негативні наслідки для їх генетичного апарату Таким дітям в процес» лікування необхідно призначити антимутагенні засоби, антиоксиданти або змінювати режим застосування лікарських препаратів У групі хворих, котрі слабко реагують на уведення мутагенних ткарсьтх препаратів, напевне ферментативна монооксигеназна активність ферментів пеЧЇНКИ перебуває в резистентному стані, і активність холінестерази пщ час лікування може навіть підвищуватися у ВІДПОВІДЬ на ХІМІЧНИЙ ВПЛИВ СЛІД зазначити, що варіанти початкового рівня досліджуваних ферментів у р»зних нозолопчних формах захворювання з ведучим «мунопатолопчним синдромом були різні а до сформованих груп увійшли хворі з однаковим початковим рівнем Але незалежно від значень даних біохімічних показників при госпіталізації хворих, в групі чутливих до мутагенних факторів дітей (група "ризику") через 2 ТИЖНІ після початку лікування підвищується активність альфа-амілази і знижується активність зцетилхолінестерази Якщо ці зміни відбуваються в межах 20-40%, можна вважати, що клітини організму цієї дитини мають слабкий антимутагенний захист У 2-х сформованих за біохімічним критерієм групах хворих (з враховуванням їх чутливості до проведення хіміотерапії") з метою визначити генотоксичність відбиралися проби сечі після проведеної терапії Оскільки лікування хворих дітей з ведучим імунопатологічним синдромом в основному спрямоване на індукцію мутацій в клітинах імунної системи, ми не мали на меті вивчити за їх допомогою генетичні методики А ось загальна соматична стійкість до лікарських препаратів якраз і виявлялась за допомогою визначення сумарної мутагенності сет» На жаль, даний метод в умовах КЛІНІКИ Є дещо утрудненим А ось критерії бюхімичні що визначалися в крові та сечі дітей, мали кореляційний зв'язок цим параметром Приклад 3. Хворі з встановленої "групи ризику" (високочутливий до мутагенних впливів організм з пригніченою АМС) 1 Ревва А Діагноз ЮРА, суглобововісцеральна форма, поліартрит Одержала 1030 ВИСОКІ дози П+Ц Преднизолон по ЗО мг. гепарин протягом 1 міс цитостатик лейкеран 1 2 мг ДВІЧІ на день із зменшенням дози преднизолону на 5 мг Альфа-амілаза портняно з початковим рівнем активносте зросла на 145%, а холінестеразна активність знизилася на 33,4% 2 Шазизов Р 8 років (м Маріуполь) Діагноз ЮРА, суглобово-вісцеральна форма поліартрит, 3-ій ст активи Одержував преднизолон 40 мг 5 тижнів, ПОТІМ по спадаючій дозі»метотрексат 1 раз в тиждень Високі П+Ц=6400 Холінестераза знизила свою активність на 45% 3 івахненко Т (Ясинуватський р-он, селище Очеретино) Діагноз ЮРА, суглобово-вісцеральна 35319 форма, 2-ий ступінь активності. Предниэолон по 35 мг на добу і після цього + метотрексат 980 мг; 980 П+Ц Холінестераза знизилася на 25,7%, альфа-амілаза зросла на 26,9% 4. Бондаренко К. (Зугрес). Діагноз Дерматоміозит Преднизолон 40 мг 6 тижнів з гепарином 4 тижні, потім по спадаючому дозуванні. Високі дози П - сумарно - 1680 мг Альфа-амілазна активність - зросла на 53,6%, а ХЕ пригнічувалась - на 38,9%. 5 Яворська С - Системний червоний вівчак Преднизолон 60 мг на добу впродовж 6 тижнів і циклофосфан за класичною схемою 2520 мг П+Ц Альфа-амшазна активність збільшувалась на 74,5%, ХЄ пригнічувалася на 24,5%. В контрольній групі хворих - ці показники не змінювалися Мутагенність сечі хоча і була вищою, ніж у здорових осіб, все таки складала істотну відмінність з групою "ризику" (див табл 4) 6 Перцева М Діагноз системний червоний вівчак. З контрольної групи Одержала 2640 високі дози преднизолону, 60 мг щодня протягом 3 місяців і циклофосфан по 200 мг двічі на тиждень протягом 6 тижнів. 7. Шелудько О. 9 років, м. Артемівськ Діагноз* ЮРА, суглобово-вісцеральна форма Преднизолон 50 мг/добу впродовж 6 тижнів. 2100 П. 8 Нікітіна А (Селідовський р-он, м. Курахове) 10 років. Діагноз: ЮРА, суглобово-вісцеральна форма, поліартрит. Преднизолон 8 тижнів по 50 мг на добу 2800 П 9 Танич Л ЮРА, 14 років Діагноз: суглобово-вісцеральна форма Полівалентна алергія. Преднизолон у дозі 35 мг на добу протягом 6 тижнів 1470 високі П. Як тільки на фоні лікарських мутагенів відбувається зрив антимутагенної системи соматичних клітин дитячого організму, так і ферментативна активність тканин проходить стадію перепрофілізацн, яку можна зафіксувати за допомогою біохімічних тестів, що сигналізує про можливі несприятливі для генома наслідки такої перебудови Тож, щодо застосування мутагенних лікарських засобів при імунодефіцитних станах у дітей, терапія не повинна стосуватися клітин інших органів і тканин і викликати в них мутації або процеси апоптозу; в будь-якому випадку вона спрямована тільки на клітини імунної системи. Інформація. 1 Руководство по изучению генетических эффектов в популяциях человека. - РОЭ, Женева -1989. 2 Пилинская М А. Использование культуры лимфоцитов периферической крови человека для определения мутагенной активности мочи // Цитология и генетика - 1985. - Т. 19, Ne 3. - С. 183187. ° Зміни активності альфа-амілази (мкат/л) в чутливих та нечутливих до цитостатичної, антибіотико- і гормональної терапії групах дітей Групи хворих з ЩС (п«10) хгн ЮРА Таблиця 1 ям СКВ До лі к-я Чеиээ 2тиж. До лік-я Через 2тиж. До лік-я Через 2тиж. До лік-я Через 2тиж. до терапії 2,986 2,766 2,890 2,453 2,427 2,285 2,765 2,501 Чутливі 2,169 3,613 2,213 2,677 2,871 4,139 2,985 5.352 Нечутливі Примітка: * - вірогідність розбіжностей відносно групи хворих до лікування; ** - вірогідність розбіжностей* відносно групи нечутливих до терапії хворих, при pU
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for determination of geno-toxic results at treatment of immunodeficiency conditions in children
Автори англійськоюUmanskyi Volodymyr Yakovych, Prokhorov Yevhen Viktorovych, Serheieva Liubov Anatoliivna, Prylutskyi Oleksandr Serhiyovych
Назва патенту російськоюСпособ определения генотоксических выходов при лечении иммунодефицитных состояний у детей
Автори російськоюУманский Владимир Яковлевич, Прохоров Євгений Викторович, Сергеева Любовь Анатольевна, Прилуцкий Александр Сергеевич
МПК / Мітки
МПК: C12Q 1/44, G01N 33/50, C12Q 1/40
Мітки: генотоксичних, вихідів, дітей, станів, лікуванні, імунодефіцитних, спосіб, визначення
Код посилання
<a href="https://ua.patents.su/8-35319-sposib-viznachennya-genotoksichnikh-vikhidiv-pri-likuvanni-imunodeficitnikh-staniv-u-ditejj.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення генотоксичних вихідів при лікуванні імунодефіцитних станів у дітей</a>
Попередній патент: Спосіб визначення жувального тиску та датчик для його здійснення
Наступний патент: Спосіб хірургічного лікування перфоративної гастродуоденальної виразки
Випадковий патент: Універсальний модифікований сфероглобоїдний сухарний синхронний карданний шарнір