Фармацевтична композиція, що містить тіагабінгідрохлорид, та спосіб її одержання
Номер патенту: 43402
Опубліковано: 17.12.2001
Автори: Йорт Тюге Боруп, Нюгор Ларс, Свенссон Йорген Рюхль, Андерсен Тіна Мейнерц, Вейбел Хелле
Формула / Реферат
1. Фармацевтична композиція, що включає
(а) тіагабін або його фармацевтичне прийнятну сіль,
(б) один або кілька фармацевтичне прийнятних антиоксидантів у кількості, достатній для стабілізації тіагабіну або його фармацевтично прийнятної солі та
(в) фармацевтичне прийнятний носій на вибір.
2. Композиція за п. 1, яка відрізняється тим, що вона являє собою порошок або таблетку.
3. Композиція за п. 1 або 2, яка відрізняється тим, що у ній антиоксидант вибрано з групи, що складається з розчинних у жирі антиоксидантів.
4. Композиція за п. 1, 2 або 3, яка відрізняється тим, що у ній антиоксидантом є a-токоферол.
5. Композиція за п. 1 або 2, яка відрізняється тим, що у ній антиоксидантом є аскорбінова кислота.
6. Композиція за. п. 1 або 2, яка відрізняється тим, що у ній антиоксидантом є суміш розчинного у жирі й розчинного у воді антиоксидантів.
7. Композиція за п. 6, яка відрізняється тим, що у ній антиоксидантом є суміш a-токоферолу та аскорбілпальмінату.
8. Композиція за п. 1-7, яка відрізняється тим, що у ній кількість антиоксиданту складає 5-25 масових частин на 100 частин тіагабінгідрохлориду.
9. Спосіб одержання композиції за п. 1 або 2, який включає формування суміші з:
(а) тіагабіну або його фармацевтичне прийнятної солі,
(б) одного або кількох фармацевтичне прийнятних антиоксидантів у кількості, достатній для стабілізації тіагабіну або його фармацевтичне прийнятної солі, та
(в) фармацевтичне прийнятного носія.
10. Спосіб одержання композиції по п. 1 або 2, який включає:
(а) формування суміші за п. 9.
(б) здійснення грануляції суміші шляхом розтоплення з використанням зв'язуючих речовин, що розтоплюються при низькій температурі.
11. Спосіб за п. 9 або 10, який відрізняється тим, що його етапи здійснюються під низьким тиском водяної пари та низьким тиском кисню.
Текст
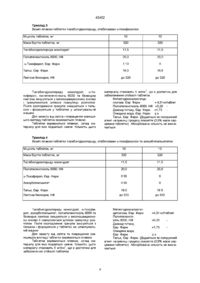
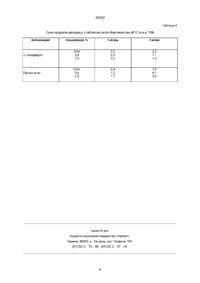
1 Фармацевтична композиція, що включає (а) тіагабін або його фармацевтично прийнятну сіль, (б) один або кілька фармацевтично прийнятних антиоксидантів у КІЛЬКОСТІ, достатній для стабілізації тіагабшу або його фармацевтично прийнятної солі та (в) фармацевтично прийнятний носій на вибір 2 Композиція за П 1, яка відрізняється тим, що вона являє собою порошок або таблетку 3 Композиція за п 1 або 2, яка відрізняється тим, що у ній антиоксидант вибрано з групи, що складається з розчинних у жирі антиоксидантів 4 Композиція за П 1,2 або 3, яка відрізняється тим, що у ній антиоксидантом є а-токоферол 5 Композиція за п 1 або 2, яка відрізняється тим, що у ній антиоксидантом є аскорбінова кислота 6 Композиція за п 1 або 2, яка відрізняється тим, що у ній антиоксидантом є суміш розчинного у жирі й розчинного у воді антиоксидантів 7 Композиція за п 6, яка відрізняється тим, що у ній антиоксидантом є суміш а-токоферолу та аскорбілпальмінату 8 Композиція за п 1-7, яка відрізняється тим, що у ній КІЛЬКІСТЬ антиоксиданту складає 5-25 масових частин на 100 частин тіагабшпдрохлориду 9 Спосіб одержання композиції за п 1 або 2, який включає формування суміші з (а) тіагабшу або його фармацевтично прийнятної солі, (б) одного або кількох фармацевтично прийнятних антиоксидантів у КІЛЬКОСТІ, достатній для стабілізації тіагабшу або його фармацевтично прийнятної солі та (в) фармацевтично прийнятного носія 10 Спосіб одержання композиції по п 1 або 2, який включає (а) формування суміші за п 9, (б) здійснення грануляції суміші шляхом розтоплення з використанням зв'язуючих речовин, що розтоплюються при низькій температурі 11 Спосіб за п 9 або 10, який відрізняється тим, що його етапи здійснюються під низьким тиском водяної пари та низьким тиском кисню Предметом цього винаходу є нова фармацевтична композиція, що містить тіагабшпдрохлорид як активний інгредієнт, та спосіб її одержання В цьому винаході R ізомер І\І-(4,4-ди(3-метилтієн-2-ил)бут-3-енил-ніпекотинова кислота використовується під своєю родовою назвою (INN) тіагабін, який є медикаментом, що легко переноситься хворим, і має протиепілептичну дію Склад ^(4,4-ди(3-метилтієн-2-ил)бут-3-енил-ніпекотинової кислоти розкривається в Патенті США №5,010,090 Для приготування препаратів на основі тіагабінпдрохлориду були запропоновані різні розчини Метою цього винаходу є забезпечення нової сполуки з метою приготування тіагабшпдрохлориду з підвищеною СТІЙКІСТЮ, зокрема у дозованій твердій формі Було фактично з'ясовано, що тіагабшпрохлорид розкладається у безпосередній близькості з киснем та водою і при контакті з ними Таким чином, по-перше, предметом цього винаходу є фармацевтична композиція для приготування препарату у дозованих формах, зокрема у твердій дозованій формі, що містить достатню КІЛЬКІСТЬ тіагабшпдрохлориду або однієї з його фармацевтично прийнятних солей як активного інгредієнта, і що характеризується тим, що містить ю О о ^ со 43402 принаймні один фармацевтично прийнятний антиоксидант у КІЛЬКОСТІ, достатній для стабілізації активного інгредієнта Таким чином, цей винахід базується на несподіваному виявленні того факту, що СТІЙКІСТЬ тіагабшпдрохлориду або однієї з його фармацевтично прийнятних солей може бути значно підвищена у препаратах, що містять тіагабшпдрохлорид або його фармацевтично прийнятні солі та антиоксидатний агент Тіагабшпдрохлорид разом з загальноприйнятим допоміжним засобом, антиоксидатним носієм або розріджувачем та, в разі потреби, його фармацевтично прийнятною кислотною сіллю може існувати у формі його фармацевтичних композицій або окремих доз, і такі композиції можуть використовуватися у твердій формі, наприклад таблетки або капсули з твердим наповнювачем, або як рідини, такі, як розчини, суспензії, емульсії, еліксири або капсули з зазначеними рідкими наповнювачами, всі для внутрішнього застосування, у формі супозиторіїв для ректального застосування, або як песарм для вапнального застосування, або у формі стерильного розчину для ІН'ЄКЦІЙ ДЛЯ парентерального (включаючи підшкірне) застосування В межах представленого опису та його формул під назвою "порошок" мається на увазі будь-яка суміш компонентів, гранульована чи не гранульована, для приготування розчину та/або суспензії у воді, або для приймання всередину безпосередньо чи якимось іншим способом, наприклад, у суміші з харчовими продуктами ВІДПОВІДНО ДО ОДНІЄЇ З характеристик винахо ду здійснюється грануляція, а саме - грануляція розтопом ВІДПОВІДНО ДО ІНШОЇ характеристики ця ком позиція також містить фармацевтично прийнятні розріджувачі ВІДПОВІДНО ДО ОДНІЄЇ З характеристик винахо ду, вищезазначений агент вибирається з числа нижчеподаних а-токоферол, у-токоферол, 5-токоферол, екстракти натурального походження, багаті на токоферол, L-аскорбшова кислота та и натрієві або кальцієві солі, аскорбілпальмітат, пропілгалат (PG), октилгалат, додецилгалат, бутильований пдроксианізол (ВНА) та бутильований гідро кситолуол (ВНТ) Як антиоксидантний агент із зазначеного списку найкраще відповідає вимогам а-токоферол ВІДПОВІДНО ДО ІНШОЇ характеристики винахо ду розріджувачем є лактоза та/або поліетилен гліколь Однак можуть використовуватися й будь-які ІНШІ фармацевтично прийнятні розріджувачі КІЛЬКІСТЬ розріджувача легко визначається досвідченим спеціалістом і, звичайно, залежить від потрібної кінцевої фармацевтичної форми Взагалі, сполука, що відповідає вимогам цього винаходу і яка призначена для приготування таблеток, може містити, на 100 масових частин тіагабшпдрохлориду або однієї з його фармацевтично прийнятних солей, таку КІЛЬКІСТЬ ВІД 100 до 4000 масових частин безводної лактози, від 1 до 100 масових частин антиоксиданту, якщо це а-токоферол, найкраще - від 1 до 50 масових частин, від 50 до 500 масових частин попередньо желатинованого крохмалю, від 1000 до 10000 масових частин мікрокристалічної целюлози, від 10 до 500 масових частин кросповідону, від 10 до 500 масових частин дюксиду кремнію, від 10 до 500 масових частин гідрованої рослинної олії, від 10 до 500 масових частин стеарату магнію, від 10 до 500 масових частин пдроксипропілової метилцелюлози, від 10 до 500 масових частин пдроксипропілової целюлози, від 1000 до 10 000 масових частин маніту, від 10 до 500 масових частин стеаринової кислоти, від 10 до 500 масових частин дюксиду титану Усі ексципієнти - фармацевтично прийнятного класу Згідно З ЦИМ винаходом перевага віддається композиції, в якій КІЛЬКІСТЬ антиоксиданту складає від 1 до 50 масових частин на 100 масових частин тіагабшпдрохлориду Згідно З ЦИМ винаходом більша перевага віддається композиції, в якій тип антиоксиданта вибрано поміж розчинних у жирах антиоксидантів, і найкращою формою є а-токоферол Згідно З ЦИМ винаходом перевага віддається ексципієнтові з дуже низьким вмістом води Якщо точніше, то вміст води у розріджувачі має бути дуже низьким для того, щоб мінімізувати вміст води у фармацевтичній композиції Використовується лактоза у безводній формі Крім того, всі ексципієнти можуть застосовуватися у сухому виді, краще, якщо перед змішуванням ексципієнти піддавалися нагріванню для мінімізації вмісту води у фармацевтичній композиції Згідно З ІНШИМ аспектом предметом цього винаходу є приготування фармацевтичного препарату у формі таблеток або порошку, що характеризується тим, що він містить, як було означено раніше, композицію, що з'єднується, в разі потреби, принаймні з одним звичайним додатком, вибраним поміж підсолоджувачів, ароматизаторів, барвників та мастил Вибір та визначення КІЛЬКОСТІ ЦИХ додатків легко здійснюється досвідченим спеціалістом Згідно З винаходом перевага при приготуванні фармацевтичної композиції віддається процесові змішування тіагабшпдрохлориду, одного чи кількох антиоксидантів та інших фармацевтичних ексципієнтів після грануляції розтопом у глибокому міксері Можна використовувати поліетиленгліколі, віск, стеаринову кислоту або ІНШІ зв'язуючі речовини, що розтоплюються при низькій температурі Гранулами можна наповнювати капсули, формувати з них таблетки або використовувати в інших фармацевтичних дозованих формах Перевага віддається виробничому процесові безпосереднього штампування таблеток, перед яким змішуються тіагабшпдрохлорид, один або кілька антиоксидантів та ІНШІ ексципієнти, придатні для безпосереднього штампування 43402 Втім, ще одним прийнятним виробничим процесом є грануляція, коли гранули отримуються шляхом змішування тіагабінгідрохлориду в рідкому виді разом з одним або кількома антиоксидантами та іншими ексципієнтами Найбільша перевага віддається процесові, що включає етап грануляції розтопом, при якому тіагабшпдрохлорид перебуває в умовах низького тиску водяної пари Підсолоджувачем може бути натуральний цукор, такий як цукроза або сорбіт, або синтетич ний продукт, такий як сахарин або аспартам Перевага віддається сахаринові Якщо вибраним антиоксидантом є а-токоферол, який є гідрофобним, його варто емульгувати у придатному для цього розчиннику, яким, наприклад, є вода, або в органічному розчиннику, сумісному з тіагабшпдрохлоридом Для створення такої емульсії можуть також використовуватися різні емульгатори, які звичайно використовуються у фармацевтиці Цей винахід ілюструють подані нижче приклади, які не можна вважати вичерпними Приклад 1 Таблетки тіагабінгідрохлориду, стабілізовані а-токоферолом 8 8 Маса брутто таблеток, мг 320 320 Тіагабінгідрохлориду моногідрат 8 35 8 35 Поліетиленгліколь 6000, НФ 160 160 Лактоза безводна, НФ 279 279 0 800 0 160 168 МІЦНІСТЬ таблеток, мг а-Токоферол, Євр Фарм Тальк, Євр Фарм Тіагабінгідрохлориду моногідрат, а-токоферол, поліетиленгліколь 6000 та безводна лактоза змішуються у високошвидкісному міксері і піддаються грануляції розтопом Після охолодження гранули змішуються з тальком і формуються у таблетки на штампувальній машині СТІЙКІСТЬ таблеток покращується через додавання а-токоферолу Про це свідчать досліди, у яких міра деградації тіагабінгідрохлориду виражена як загальна сума продуктів деградації Результати показано у Таблиці 1 Таблиця 1 СТІЙКІСТЬ таблеток тіагабінгідрохлориду Сума продуктів деградації після 18 МІСЯЦІВ зберігання при 25°С/60% в в Таблетки з а-токоферолом 0,5% Таблетки без а-токоферолу 1,9% Приклад 2 Таблетки тіагабінгідрохлориду, стабілізовані а-токоферолом та аскорбілпальмгтатом 8 8 Маса брутто таблеток, мг 320 320 Тіагабінгідрохлориду моногідрат 8,35 8,35 Поліетиленгліколь 6000, НФ 160 160 Лактоза безводна, НФ 279 279 а-Токоферол, Євр Фарм 0,400 0 Аскорбілпальмітат 0,400 0 Тальк, Євр Фарм 16,0 16,8 МІЦНІСТЬ таблеток, мг Тіагабінгідрохлориду моногідрат, а-токоферол, аскорбілпальмітат, поліетиленгліколь 6000 та безводна лактоза змішуються у високошвидкісному міксері і гранулюються шляхом грануляції роз топом Після охолодження гранули змішуються з тальком і формуються у таблетки на штампувальній машині 43402 Приклад 3 Вкриті плівкою таблетки тіагабінгідрохлориду, стабілізовані а-токоферолом 10 10 Маса брутто таблеток, мг 320 320 Тіагабшпдрохлорида моногідрат 11,5 11,5 Поліетиленгліколь 6000, НФ 20,0 20,0 а-Токоферол, Євр Фарм 1,10 0 16,0 16,8 до 320 до 320 МІЦНІСТЬ таблеток, мг Тальк, Євр Фарм Лактоза безводна, НФ Тіагабінгідрохлориду моногідрат, а-токоферол, поліетиленгліколь 6000 та безводна лактоза змішуються у високошвидкісному міксері і гранулюються шляхом грануляції розтопом Після охолодження гранули змішуються з тальком і формуються у таблетки у штампувальній машині Для захисту від світла і покращення зовнішнього вигляду таблетки вкриваються плівкою Таблетки вкриваються плівкою, склад матеріалу для якої подається нижче КІЛЬКІСТЬ ЦЬОГО матеріалу становить 5 мг/см , що є достатнім для забезпечення СТІЙКОСТІ таблеток Метил пдроксипропілцелюлоза, Євр Фарм «4,31 мг/габлет Поліетиленгліколь 6000, НФ «5,20 Дюксид титану, Євр Фарм «1,73 Очищена вода, Євр Фарм q s Тальк, Євр Фарм (Додається як поліруючий агент наприкінці процесу покриття (0,5% маси серцевини таблетки) Абсорбована КІЛЬКІСТЬ не визначається Приклад 4 Вкриті плівкою таблетки тіагабінгідрохлориду, стабілізовані а-токоферолом та аскорбілпальмітатом 10 10 Маса брутто таблеток, мг 320 320 Тіагабінгідрохлориду моногідрат 11,5 11,5 Поліетиленгліколь 6000, НФ 20,0 20,0 а-Токоферол, Євр Фарм 0 55 0 Аскорбілпальмітат 0 55 0 МІЦНІСТЬ таблеток, мг Тальк, Євр Фарм Лактоза безводна, НФ Тіагабінгідрохлориду моногідрат, а-токоферол, аскорбілпальмітат, поліетиленгліколь 6000 та безводна лактоза змішуються у високошвидкісному міксері й гранулюються шляхом грануляції розтопом Після охолодження гранули змішуються з тальком і формуються у таблетки на штампувальній машині Для захисту від світла та покращення зовнішнього вигляду таблетки вкриваються плівкою Таблетки вкриваються плівкою, склад матеріалу для якої подається нижче КІЛЬКІСТЬ ЦЬОГО матеріалу становить 5 мг/см2, що є достатнім для забезпечення СТІЙКОСТІ таблеток 160 160 до 320 до 320 Метил пдроксипропілцелюлоза, Євр Фарм «4,31 мг^аблет Поліетиленгліколь 6000, НФ «5,20 Дюксид титану, Євр Фарм «1,73 Очищена вода, Євр Фарм qs Тальк, Євр Фарм (Додається як поліруючий агент наприкінці процесу покриття (0,5% маси серцевини таблетки) Абсорбована КІЛЬКІСТЬ не визначається 43402 Приклад 5 Таблетки тіагабінпдрохлориду, стабілізовані а-токоферолом та цитратом натрію як хелатоутворюючим агентом 8 8 Маса брутто таблеток, мг 320 320 Тіагабінпдрохлориду моногідрат 8 35 8 35 Полієтиленгліколь 6000, НФ 160 160 Лактоза безводна, НФ 279 279 а -Токоферол, Євр Фарм 0 400 0 Цитрат натрію 0 400 0 160 168 МІЦНІСТЬ таблеток, мг Тальк, Євр Фарм Тіагабінпдрохлориду моногідрат, а-токоферол, натрія цитрат, полієтиленгліколь 6000 та безводна лактоза змішуються у високошвидкюному міксері й гранулюються шляхом грануляції розто пом Після охолодження гранули змішуються з тальком і формуються у таблетки на штампувальній машині Приклад 6 Таблетки тіагабінпдрохлориду,стабілізованіа-токоферолом та EDTA (*) як хелатоутворюючим агентом 8 8 Маса брутто таблеток, мг 320 320 Тіагабінпдрохлориду моногідрат 8,35 8,35 Полієтиленгліколь 6000, НФ 16,0 16,0 Лактоза безводна, НФ 279 279 а-Токоферол, Євр Фарм 0,270 0 EDTA (*) 0,530 0 16,0 16,8 МІЦНІСТЬ таблеток, мг Тальк, Євр Фарм Тіагабінпдрохлориду моногідрат, а-токоферол, EDTA(*), полієтиленгліколь 6000 та безводна лактоза змішуються у високошвидкюному міксері й гранулюються шляхом грануляції розтопом Після охолодження гранули змішуються з тальком і формуються в таблетки на штампувальній машині (*) EDTA у формі динатрійедєтату Приклад 7 Розчин, що містить тіагабшпдрохлорид Склад Тіагабшпдрохлорид 1,14 мг Моногідрат глюкози 55,0 мг Гідроксид натрію 2N qs Вода до 1,00 мл а-токоферол 0,250 мг Цитрат натрію 0,250 мг Аскорбілпальмітат 0,250 мг Метод виробництва Тіагабінпдрохлорид, цитрат натрію та антиоксиданти змішуються у колбі з водою кімнатної тем ператури при помішуванні, доки речовина не розчиниться (приблизно п'ять хвилин) До розчину при кімнатній температурі протягом двох хвилин домішується моногідрат глюкози Нарешті, рівень рН доводиться до 7 4 і розчин розріджується водою Розчин використовується для ІН'ЄКЦІЙ тіагабінпдрохлориду та для внутрішньовенного вливання Формула також використовується для введення у ніс та легені, а також як розчин або мікстура для перорального приймання Приклад 8 Розчин, що містить тіагабшпдрохлорид Склад Тіагабшпдрохлорид 1,14 мг Моногідрат глюкози 55,0 мг Гідроксид натрію 2N qs Вода стерильна до 1,00 мл а-токоферол 0,250 мг Аскорбілпальмітат 0,250 мг EDTA (динатрійедетат) 0,250 мг 43402 Метод виробництва Тіагабшпдрохлорид, антиоксиданти та хелатоутворюючий агент змішуються у колбі з водою кімнатної температури при помішуванні, доки речовина не розчиниться (приблизно п'ять хвилин) До розчину при кімнатній температурі протягом двох хвилин домішується моногідрат глюкози Нарешті, рівень рН доводиться до 7 4 і розчин розріджується водою Розчин використовується для ІН'ЄКЦІЙ тіагабшпдрохлориду та для внутрішньовенного вливання, формула також використовується для введення у ніс та легені, а також як розчин або мікстура для перорального приймання Приклад 9 Гель, що містить тіагабшпдрохлорид Склад Тіагабшпдрохлорид 1,14 мг Карбомер 940 5,00 мг Гідрохлорид натрію 2N qs Вода до 1,00 мл а-токоферол 0,250 мг Цитрат натрію 0,250 мг Аскорбілпальмітат 0,250 мг Метод виробництва Тіагабшпдрохлорид, цитрат натрію та антиоксиданти змішуються у колбі з водою кімнатної температури при помішуванні, доки речовина не розчиниться (приблизно 5 хвилин) Під час помішування малу помалу додається карбомер Для створення оптимальної в'язкості додається гідроксид натрію при помішуванні протягом п'яти хвилин Гель використовується для шкірного, вагшальногота ректального введення Приклад 10 Гель, що містить тіагабшпдрохлорид Склад Тіагабшпдрохлорид 1,14 мг Карбомер 940 5,00 мг Гідрохлорид натрію 2N qs Вода до 1,00 мл а-токоферол 0,250 мг Аскорбілпальмітат 0,250 мг EDTA (динатрійедетат) 0,500 мг Метод виробництва Тіагабшпдрохлорид, антиоксиданти та хелатоутворюючий агент змішуються у колбі з водою кімнатної температури при помішуванні, доки речовина не розчиниться (приблизно 5 хвилин) Під час помішування помалу додається карбомер Для створення оптимальної в'язкості додається гідроксид натрію при помішуванні протягом п'яти хвилин Гель використовується для шкірного, вагшальногота ректального введення Приклад 11 Вплив ІОНІВ металів, хелатоутворювача та антиоксидантів на СТІЙКІСТЬ тіагабшпдрохлориду у розчинах Вступ Низька СТІЙКІСТЬ медикаментів у дозованих формах часто виявляється після зберігання протягом кількох МІСЯЦІВ Цей факт і став передумовою для запропонування моделі швидкої оцінки ефекту різних ексципієнтів Вступні досліди показали, що зразок речовини, яку було вибрано для роботи (C20H26NO2S2CI, тіагабшпдрохлорид), може окислюватися Таким чином, як оксидант було вибрано перекис водню для сприяння процесові окислення Експериментальні методи * ХІМІЧНІ препарати Для експериментів використовувався тіагабінпдрохлорид, Lot № 2908L 315 (NN) Усі ІНШІ використовувані ХІМІЧНІ препарати піддавалися аналізу * Аналггичний метод Були здійсненні аналізи HPLC з використанням насосів моделі Waters 501 та 516, обладнаних ультрафіолетовим детектором Waters 490 Е UV та автошжектором Waters 700 WISP Колонка 125 мм/4 мм, була набита нуклеосилом С-із (5 мкм) Рухома фаза складала 0,1% трифгорооцтової кислоти в ацетонітрилі/воді (35 65) Швидкість потоку складала 1,0 мл/хв, об'єм впорскування 50 мкл, при температурі оточення колонки та довжині хвилі детектора 250 нм * Деградація тіагабшпдрохлориду у рекомендованих розчинах Досліджувався розчин тіагабшпдрохлориду (100 мкг/мл (0,2 мкмоль/мл)), що містив 60% v/v етанолу у воді Для започаткування деградації тіагабшпдрохлориду до розчину додали 1% v/v перекису водню HPLC-пляшки були щільно закриті і деградація тіагабшпдрохлориду відбувалася при кімнатній температурі або 50°С 3 належними інтервалами для визначення КІЛЬКОСТІ HPLC здійснювалися впорскування * Деградація тіагабшпдрохлориду в присутності ІОНІВ металів ± хел ато утворювач В деяких експериментах до контрольного розчину додавалися іони металів для вивчення спроможності ІОНІВ металів каталізувати деградацію тіагабінпдрохлориду Додавалися іони металів, КІЛЬКІСТЬ яких відповідала 35 млн"1 (« 0,6 мкмоль/мл) катіонів Cr 2 + Fe 3 + Zn 2 + ,Ni 2 + ,Mg 2 + ,Cu 2 + a6oCo 2 + В інших експериментах додавався хелатоутворювач 250 мкг/мл («0,9 мкмоль/мл) цитрат натрія для запобігання каталізуючому ефектові ІОНІВ металів *' Деградація тіагабшпдрохлориду в присутності антиоксидантів До контрольних розчинів здійснювалося додавання антиоксидантів для запобігання деградації тіагабшпдрохлориду Концентрація вибраних антиоксидантів була максимально високою для етанол-водного середовища Антиоксиданти випробувалися у розчинах тіагабшпдрохлориду окремо або у поєднанні з іншими антиоксидантами Розрахунки Кінетика деградації йшла в усіх випадках за кінетикою нульового порядку, тому константа швидкості Kobs була розрахована як падіння кривої, що представляє зниження ефективності тіагабшпдрохлориду як функції часу Результати та обговорення Деградація тіагабшпдрохлориду в присутності ІОНІВ металів ± хел ато утворювач Значення, подані у Таблиці 2, показують константи швидкості (KObs) нульового рівня для деградації тіагабшпдрохлориду у розчинах Fe3+ та Сг2+ виступали як каталізатори деградації тіагабшпдрохлориду, тоді я к 2 п 2 + або Ni 2+ не мали ніякого помітного впливу на процес деградації Експеримент показав, що каталізуючий ефект Сг2+ та Fe3+ знижувався через додавання цитрату натрію 43402 Таблиця 2 Деградація 100 мкг/мл тіагабшпдрохлориду в 1%-ному розчині перекису водню та 60%-ному 1 розчині етанол/вода шляхом додавання 35 млн юнів-металів, RT Kobs ( М К Г - М Л Еталон Іон металу 2+ Сг 3+ Fe 2+ Ni 2+ Zn •Г ) Kobs ( М К Г - М Л Г ) + цитрат натрію -0,1 -8,8 -6,1 -0,2 -0.7 Додавання Cu 2+ або Со 2+ не досліджувалося, оскільки ці іони спричинювали випадіння осаду в розчинах Деградація тіагабшпдрохлориду в присутності антиоксидантів Таблиця 3 показує константи швидкості нульового порядку для деградації тіагабшпдрохлориду в розчинах, що містять різні антиоксиданти Для досліджені було вибрано ефект, який -1,0 -2,0 -0,1 справляє комбінація ВНТ, ВНА та PG, оскільки відомо, що ці три речовини мають синергетичний антиокислювальний ефект у продуктах харчування (Пос 1) Антиокиснювальний ефект а-токоферолу перевищував антиокислювальний ефект аскорбінової кислоти та "ВНТ, ВНА та PG" Присутність бісульфггу натрію знижувала СТІЙКІСТЬ тіагабшпдрохлориду у розчинах Таблиця З Деградація 100 мкг/мл (0,2 мкмоль/мл) тіагабшпдрохлориду у 1% розчині перекису водню та 60%-ному розчині етанол/вода через додаванні антиоксидантів при 50°С мкмоль/мл гталон ВНТ ВНА PG а-то кофе рол Аскорбінова кислота Бісульфіт натрію ВНТ ВНА PG Аскорбінова кислота а-то кофе рол Аскорбілпальмітат Kobs (МКГ • М Л 1 • Г 1 ) -0,12 0,45 0,55 0,47 0,53 14,0 14,0 0,45 0,55 0,47 14,0 0,53 0,60 Сполучення розчинних у воді і розчинних у ліпідах антиоксидантів не покращувало СТІЙКОСТІ тіагабшпдрохлориду Сполучення а-токоферолу з аскорбілпальмггатом забезпечувало СТІЙКІСТЬ тіа габшпдрохлориду на протязі періоду випробування 3 інших систем відомий взаємно підсилюючий ефект двох антиоксидантів (Пос 2) Висновок Було запропоновано модель оцінки впливу ІОНІВ різних металів, хелатоутворювача та антиоксидантів на СТІЙКІСТЬ тіагабшпдрохлориду у розчинах за 24 години Дослідження показує, що додавання до тіагабшпдрохлориду цитрату натрію як хелатоутворювача і а-токоферолу та аскорбілпальмггату як антиоксидантів у ВІДПОВІДНИХ дозах підвищує СТІЙКІСТЬ Започатковуючи рецептуру тіагабшпдрохлориду у ВІДПОВІДНІЙ дозованій формі, модель дозво -0,05 -0,08 0,11 0,34 -0,09 під час випробування зберігає СТІЙКІСТЬ ляє швидко оцінити показники впливу хелатоутворювачів та антиоксидантів на СТІЙКІСТЬ тіагабшпдрохлориду Посилання [1] Т Е Funs Handbook of Food Additives 2nd Edition Volume I CRC Press [2] Marmova & Yamshhevd Fat Sci Technol 94 Jahrgang no 12 1992 Page 448-452 Приклад 12 Таблетки, що містили ВІДПОВІДНО 0,04%, 0,4% та 1,0% від маси брутто таблетки (320 мг) а-токоферолу та пропілгалату відп , були приготовані як описано у Прикладі 1 СТІЙКІСТЬ таблеток була випробувана зберіганням при 40°С та ВІДНОСНІЙ ВОЛОГОСТІ 75% Результати показані у Таблиці 4, в якій продукти деградації зображені як у Таблиці 1 43402 Таблиця 4 Сума продуктів деградації у таблетках після зберігання при 40°Ста в в 75% Антиоксидант Концентрація, % 1 місяць 3 місяці а -токоферол 0,04 0,4 1,0 0,5 0,3 0,3 2,2 1,1 1,3 Пропілгалат 0,04 0,4 1,0 0,4 1,2 1,1 1,5 4,1 3,9 Тираж 50 екз Відкрите акціонерне товариство «Патент» Україна, 88000, м Ужгород, вул Гагаріна, 101 (03122) 3 - 7 2 - 8 9 (03122) 2 - 5 7 - 0 3
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61K 31/375, A61K 31/355, A61K 31/445, A61P 25/08
Мітки: тіагабінгідрохлорид, спосіб, композиція, фармацевтична, одержання, містить
Код посилання
<a href="https://ua.patents.su/8-43402-farmacevtichna-kompoziciya-shho-mistit-tiagabingidrokhlorid-ta-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція, що містить тіагабінгідрохлорид, та спосіб її одержання</a>
Попередній патент: Спосіб підйому пульпи
Випадковий патент: Сталеполімерний анкер