Ін’єкційна форма препарату, що проявляє протиішемічну активність
Номер патенту: 43797
Опубліковано: 17.12.2001
Автори: Піотровська Ала Георгієвна, Манорик Петро Андрійович, Кутняк Віктор Павлович, Хованська Наталія Петрівна, Липкан Георгій Миколайович, Георгієвський Віктор Петрович
Формула / Реферат
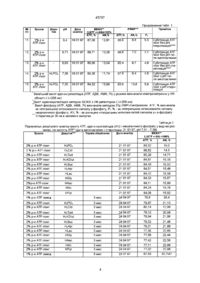
1. Ін'єкційна форма препарату, що проявляє протиішемічну активність, на основі аденозин-5'-трифосфату в ізотонічному розчині, яка відрізняється тим, що як джерело аденозин-5'-трифосфату містить трикалієву сіль аденозин-5'-трифосфатогістидинатомагній (ІІ) октагідрат і додатково містить фармацевтично прийнятну органічну або неорганічну кислоту, або їх солі в кількості, яка необхідна для досягнення рН 7,0-7,4, при наступному співвідношенні компонентів на 1000 мл ізотонічного розчину:
- трикалієва сіль аденозин-5'-трифосфатогістидинатомагній (ІІ) октагідрат 10-20 г
- фармацевтично прийнятна органічна або неорганічна кислота або їх солі в кількості, необхідній для досягнення рН 7,0-7,4.
2. Ін‘єкційна форма препарату, за п. 1, яка відрізняється тим, що як фармацевтично прийнятну органічну кислоту вона містить лимонну кислоту в кількості 0,6-1,2 г.
Текст
1 Ін'єкційна форма препарату, що проявляє протиішемічну активність, на основі аденозин-5'трифосфату в ізотонічному розчині, яка відрізняється тим, що як джерело аденозин-5'-трифосфату містить трикалієву сіль аденозин-5' трифосфатопстидинатомагній (II) октапдрат і додатково містить фармацевтично прийнятну органічну або неорганічну кислоту, або їх солі в КІЛЬКОСТІ, яка необхідна для досягнення рН 7,0-7,4, при наступному співвідношенні компонентів на Винахід має відношення до медицини, зокрема, до фармакології і може бути використаний при отриманні лікарських засобів, які мають протиішемічну активність, і профілактиці та лікуванні ішемічної хвороби серця Препарати, що відрізняються біологічною активністю і використовуються для профілактики і лікування ішемічної хвороби серця, застосовуються як у вигляді таблеток, капсул, порошків, так і у вигляді ІН'ЄКЦІЙ, причому часто ін'єкційна форма препарату в силу найбільш сильного і активного впливу на ішемічне ушкодження міокарду, є більш переважною На цей час відомо, що аденозин-5'-трифосфати металів, зокрема, натрію, бюметалів, мають властивість досить ефективно захищати міокард від ішемічного ушкодження (ас СРСР 1300910, п СРСР755201 та інш ) Проте, існують певні проблеми, пов'язані з одержанням їх ін'єкційної форми необхідної активності Найбільш близьким до об'єкту, що заявляється, є ін'єкційна форма протиішемічного препарату, яка містить як активний компонент (субстанцію) дінатрієву сіль аденозин-5'-трифосфату Відомий засіб має мембранно-стабілізуючу, енергозберігаючу дію і в значно меншій мірі проявляє протиішемічну активність При лікуванні ішемічної хвороби відомий засіб в ІН'ЄКЦІЙНІЙ формі використовують в комплексі інших препаратів Проте слід зауважити, що засіб-прототип не вичерпує всі можливості захисту міокарду від ішемічного ушкодження, що свідчить про його недостатню біологічну активність При розчиненні (Na2 ATF) у воді рН розчину складає 4,0 - 4,5, що тягне за собою подальше підлуження розчину до рН 7,0 - 7,4 В процесі стерилізації та зберігання відомого препарату в ІН'ЄКЦІЙНІЙ формі відбувається помітне зменшення ATF за рахунок його гідролізу до аденшнуклеотидів і неорганічного фосфору, що в кінцевому результаті призводить до деякої втрати активності лікарської форми Задачею цього винаходу є створення ін'єкційної форми препарату, який має протиішемічну дію, шляхом сполучення більш біологічно активної субстанції та ВІДПОВІДНИХ додатків, внаслідок чого досягається висока лікувально-профілактична дія ін'єкційної форми препарату і збільшується строк м зберігання Поставлена задача вирішується тим, що ін'єкційна форма препарату, який проявляє протиішемічну активність, на основі аденозин-5'-трифосфату в ізотонічному розчині, згідно винаходу, як джерело аденозин-5'-трифосфату, містить три (Na2 ATF), і ІЗОТОНІЧНИЙ розчин Концентрація ак тивного компоненту складає 1% (Машковський М Д Лекарственные средства Минск, "Белорусь", ч2, 1988, с 125) Зоя 1000 мл ІЗОТОНІЧНОГО розчину - трикалієва сіль аденозин-5'-трифосфатопстидинатомагній (II) октапдрат 10-20 г - фармацевтично прийнятна органічна або неорганічна кислота або їх солі в КІЛЬКОСТІ, необхідній для досягнення рН 7,0-7,4 2 Ін'єкційна форма препарату за п 1, яка відрізняється тим, що як фармацевтично прийнятну органічну кислоту вона містить лимонну кислоту в КІЛЬКОСТІ 0,6-1,2 г со 43797 калієву сіль аденозин-5'-трифосфатопстидинатомагній (II) октапдрат і додатково містить фармацевтично прийнятну органічну або неорганічну кислоту, або їх солі в КІЛЬКОСТІ, яка необхідна для досягнення рН 7,0 - 7,4, при наступному співвідношенні компонентів на 1000 мл ІЗОТОНІЧНОГО розчину - трикалієва сіль аденозин-5'-трифосфатопстидинатомагній (II) октапдрат 10-20 г, фармацевтично органічна або неорганічна кислота або їх солі в КІЛЬКОСТІ, необхідній для досягнення рН 7,0 - 7,4 Авторами цього винаходу запропоновано використовувати як активний компонент близьку до (Na2 ATF) по ХІМІЧНІЙ природі сполуку такої формули K2Mg(His)(ATF), яка далі буде називатися ATFлонг, і в якому His-анюн гістидину, ATF-анюн аденозин-5'-трифосфату Проте сукупність лігандів і біологічно активних металів - калію та магнію значно розширила спектр дії на ішемічне ушкодження міокарду, тим самим визначивши більш високу лікувальну ефективність указаної координаційної сполуки І хоча ця сполука була описана (див Рішення про видачу патента України по заявці № 96124897), автори визначили ВІДПОВІДНІ додатки, які виконують роль буфера, що дозволяють підвищити гідролітичну стабільність активної сполуки Ці додатки, що представляють собою органічні кислоти або неорганічні кислоти, або їх солі, добре поєднаються з ATF-лонг і забезпечують рН ІН'ЄКЦІЙНОГО розчину (1-2 %) у діапазоні 7,0 - 7,4 Указані додатки не знизили біологічної активності препарату і не погіршили його властивості Як видно з даних, наведених в табл 1, у комерційних препаратах (субстанціях) ATF (дінатрієва сіль аденозин-5'-трифосфату) вміст ATF складає від 99 до 95 % (№ 1, 3, 5) В результаті стерилізації згідно ВФС 42 У (на 1% розчин ATF для ІН'ЄКЦІЙ) 1% дінатрієвої солі ATF при рН 7,0 - 7,4 (доводиться рН розчином NaOH згідно ВФС) на протязі ЗО хвилин у запаяних ампулах (табл 1, № 2, 4, 6) біля 10% ATF пдролізує до аденіннуклеотидів (головним чином, АДФ, АМФ) і неорганічного фосфату (Рі), те ж саме відбувається при приготуванні лікарської форми в заводських умовах (табл 1, № 8) В процесі зберігання вміст ATF у препараті зменшується і збільшується вміст аденіннуклеотидів і неорганічного фосфату (табл 1, № 9) При розчиненні субстанції ATF - лонг у воді та отриманні 1% (табл 1, №10) або 2% (табл 1, № 12) розчину рН розчину складає ВІДПОВІДНО 8,5 і 8,7 При стерилізації таких розчинів (ЗО хв) втрати ATF складають усього декілька процентів (табл 1, № 11, 13) Тому для приготування ін'єкційної форми ATF-лонг 2% розчину (рН 7,0 - 7,4) необхідна часткова нейтралізація кислотою При нейтралізації, наприклад, фосфорною кислотою вміст ATF у розчині практично не змінюється (табл 1, № 14), а при стерилізації зменшуються всього на 5% (табл 1, № 15) на відміну від дінатрієвої солі ATF Був випробуваний ряд органічних трьохосновних, двухосновних кислот як додаток для нейтралізації розчину ATF-лонг і отримання 2% розчину ATF-лонг для ІН'ЄКЦІЙ З рН 7,0 - 7,4 Результати наведені в табл 2 Як видно з даних, наведених в табл 2, усі випробувані додатки придатні для отримання ін'єк ційної форми ATF-лонг, оскільки в процесі стерилізації виготовлених з використанням додатків розчинів вміст ATF у розчині змінюється всього на декілька процентів порівняно з вмістом ATF у ВИХІДНІЙ субстанції ATF-лонг і близькі до ВІДПОВІДНИХ величин для дінатрієвої солі ATF (табл 1) Завдяки введенню додатків кислот або и кислих солей (ортофосфорної кислоти або її кислих солей, лимонної кислоти або и кислих солей, яблучної, винної, бурштинової і т д ) досягається огтгимізація рН-розчину для ІН'ЄКЦІЙ (рН 7,0 - 7,4) Ці буферуючі і комплексуючі додатки інгібують процеси гідролізу ATF як при кімнатній температурі, так і в умовах стерилізації Найкращі результати отримані для розчинів, які містять як додаток лимонну та винну кислоти Найважливішою перевагою лимонної кислоти, як додатку, є не тільки те, що необхідні КІЛЬКОСТІ для доведення рН мінімальні (оскільки вона є трьохосновною кислотою з достатньо низькими рК) і після стерилізації препарат містить найбільшу КІЛЬКІСТЬ ATF, але й те, що цитрат, як відомо, є достатньо ефективним антикоагулянтом і дезагрегантом крові і тому попереджує згусткоутворення Тому найбільший інтерес з точки зору практичного застосування представляє додаток лимонної кислоти В процесі зберігання отриманих розчинів субстанції ATF - лонг (табл 2) швидкість зменшення вмісту в них ATF менше в порівнянні з 1% розчином дінатрієвої солі (табл 2) Порівняльне вивчення зберігання 1% розчину Na2ATF і запропонованих ІН'ЄКЦІЙНИХ розчинів (табл 2) показало, що в запропонованих розчинах ATF, довше зберігається у вигляді ATF, що відкриває можливість збільшення терміну придатності запропонованої ін'єкційної форми в порівнянні з 1% Na2ATF Зважаючи на ту обставину, що в субстанції препарату ATF - лонг вміст ATF (в т ч аденшнуклеотидів) складає біля 46%, у 2% розчині препарату ATF - лонг склад ATF приблизно такий же, як у 1% розчині дінатрієвої солі ATF Разом з тим, результати багаточисельних біологічних випробувань показали, що ATF - лонг значно ефективніший (табл 3, 4) Навіть при введенні в однаковій дозі (0, 3 мг/кг маси тварин) дінатрієвої солі ATF і ATF -лонг (в цьому випадку вміст ATF у розчині ATF - лонг у два рази менше, ніж у розчині Na2ATF) біологічні ефекти у випадку ATF - лонг були значно вищі Нижче наведені деякі порівняльні дані для розчинів Na2ATF ( 1% розчин з додатком цитрата, рН 7, 37) З наведених даних видно, що ІН'ЄКЦІЙНИЙ розчин ATF - лонг виявляє яскраво виражений енергозберігаючий, а також мембраностабілізуючий ефект Попереднє введення в перфузійну рідину ATF - лонг також попереджує виникнення або знижує ступінь вираженості зсувів енергетичного або іонного метаболізму міокарду в умовах ішемії і гіпоксії (табл 4) Це виявляється, наприклад, в запобіганні зниження рівня фосфоліпідів мембран (на 35% від контролю) і накопиченні в них вільних жирних кислот (102 % від контролю), що можна оцінити як мембраностабілізуючий ефект Відпо 43797 ВІДНІ показники при введенні Na2ATF складають 73 і 119% При цьому проникність мембран для ІОНІВ кальцію у випадку ATF - лонг вірогідно не відрізняється від контролю (у випадку Na2ATF вона на 22% вище контролю) Завдяки збереженню ЛІПІДНОГО шару мембран при введенні ATF - лонг на постійному рівні (97 % від контролю) підтримуєть+ ся активність мембранозв'язаного фермента Na , + К , -ATF-ази сарколеми (для Na2ATF цей показник складає всього 76%) Під впливом ATF - лонг зовнішня мембрана кардюмюціту зберігає здатність зв'язувати іони кальцію (95%), тобто покращуються процеси енергозабезпечення іонного транспорту в клітинах У випадку Na2ATF цей показник на 22% нижче контролю Склад ATF і глікогену в сердцевому м'язі при введенні ATF - лонг складає ВІДПОВІДНО 90 і 95 % від вихідного рівня, що вище, ніж у випадку Na2ATF (79 і 72 % ВІДПОВІДНО) Завдяки отриманим ефектам Na2ATF - лонг у період постішемічної реперфузм перебігає більш ефективно і показники енергетичного і іонного метаболізму серця до ЗО хвилин, в основному нормалізуються і вірогідно не відрізняються від вихідних величин (табл 4) При цьому відзначається незначний вихід КФК у перфузійну рідину і зниження у № пп ній концентрації ІОНІВ кальцію, що вказує на збереження бар'єрних властивостей мембран і менший ступінь їх уражень в умовах реперфузм Із даних, наведених в табл 3, 4, видно, що ATF - лонг ІН'ЄКЦІЙНИЙ розчин (1 і 2%) має виражену антиішемічну дію, яка значно більше у порівнянні з 1 % розчином Na2ATF для ІН'ЄКЦІЙ Винахід пояснюється прикладом конкретного виконання Приклад. 10 г ATF - лонг вмістили в 1 л ІЗОТОНІЧНОГО розчину (9 г NaCI в 1 л дистильованої води), після чого додали лимонної кислоти в КІЛЬКОСТІ 0, 8 Г, В результаті чого розчин набув рН 7, 2 Потім отриманий розчин помістили в ампули по 0, 2 мл, ампули запаяли і провели їх стерилізацію Властивості отриманого препарату підтверджуються даними, наведеними в табл 1-4 Таким чином, запропонована ін'єкційна форма препарату, який має протиішемічну активність, проявляє високі лікувальні і профілактичні властивості, відрізняється високими біохімічними показниками, необхідною стабільністю і, ВІДПОВІДНО, підвищеними в декілька разів строками зберігання Таблиця 1 Порівняльні результати аналізу вмісту ATF, аденіннуклеотидів (AN) і неорганічного фосфату у водних розчинах, що містять ATF Зразок Дода Дата ВЕЖХ** РЯМР*** Примітка PH ток аналізу S(ATF++AN)=100% ATF, % AN,% ATF,% AN,% Pi 1 1% P-HATF NaOH 7,38 15 01 97 99,1 0,9 98,7 0,8 0,5 Субстанція (Na 2 H 2 ATF) без стерилізації 2 1% р-н ATF NaOH 7,37 15 01 97 87,32 12,68 86,1 9,0 4,9 Субстанція (Na 2 H 2 ATF) стерилізація**** NaOH 7,36 15 01 97 94,68 4,32 94,3 3,6 2,1 Субстанція (Reanal) без стерилізації 4 1% р-н ATF NaOH 7,34 15 01 97 84,81 15,19 84,1 9,7 6,2 Субстанція (Reanal) стерилізація 5 1% P-HATF NaOH 7,35 15 01 97 98,0 2,0 97,7 1,5 0,8 Субстанція (Na 2 H 2 ATF) без стерилізації 6 1% р-н ATF NaOH 7,35 15 01 97 86,28 14,72 85,1 9,8 5,1 Субстанція (Na 2 H 2 ATF) стерилізація**** 7 1% р-н ATF 4,25 15 01 97 94,71 4,29 94,4 3,5 2,1 Субстанція (Reanal) без стерилізації та дод 8 1% р-н ATF NaOH 7,36 15 01 97 90,1 9,9 88,9 6,0 3,9 7,27 09 07 97 58,67 41,33 58,3 27,6 141 Аптечний (дата вигот 09 01 97) Аптечний (дата вигот 09 01 97) 8,5 16 01 97 89,92 10,08 89,31 6,5 4,2 3 1% р-н ATF 9 1% р-н ATF 10 1% р-н ATF-лонг NaOH Субстанція ATF лонг без рН після виготовлення 43797 Продовження табл 1 № пп Зразок Додаток Дата аналізу РН ВЕЖХ** S(ATF++AN)=100% ATF, % AN,% РЯМР*** Примітка ATF,% AN,% Pi 11 1% р-н ATF-лонг 8,4 16 01 97 87,09 12,91 85,9 8,8 5,3 Субстанція ATF лонг без рН, стерилізація**** 12 2% р-н АТР-лонг 8,71 16 01 97 89,71 10,29 88,9 7,0 4,1 Субстанція ATF лонг без рН після виготовлення 13 2% р-н ATF-лонг 8,63 16 01 97 86,96 13,04 85,4 9,7 4,9 Субстанція ATF лонг без рН стерилізація**** 14 2% р-н ATF-лонг Н 3 РО 4 7,36 16 01 97 88,36 11,74 87,8 8,4 4,8 Субстанція ATF лонг з рН після виготовлення 15 2% р-н ATF-лонг Н 3 РО 4 7,35 16 01 97 84,32 15,68 83,6 10,8 5,6 Субстанція ATF лонг з рН стерилізація Загальний вміст аденшнуклеотидів (ATF, АДФ, АМФ, Рі) у розчині визначали спектрометрично у УФобласті (Я,=258 нм) Вміст аденшнуклеотидів методом ВЕЖХ з УФ-детектором ( Я,=258 нм) tt * * Вміст фосфору (ATF, АДФ, АМФ, Рі) визначали методом 31 р ЯМР-спектроскопм ATF, % визначали * за інтегральною інтенсивністю сигналу у-фосфату, Рі, % - за інтегральною інтенсивністю сигналу неорганічного фосфату, AN, % - за різницею інтегральних інтенсивностей сигналів у-і а-фосфату Стерилізація ЗО хв в запаяних ампулах Таблиця 2 Порівняльні результати аналізу вмісту ATF, аденшнуклеотидів (AN) і неорганічного фосфату у водних розчинах, які містять ATF* (дата виготовлення і стерилізації 21 01 97, рН 7,31 - 7,39) Зразок Додаток*** Термін зберігання Дата аналізу ВЕЖХ** S(ATF + AN)=100% ATF, % AN, % 2% р-н ATF-лонг НзРО 4 21 01 97 84,32 2 % р-н ATF-лонг H 3 Citr 21 01 97 86,62 14,3 2% р-н ATF-лонг H2Tart 21 01 97 85,29 14,71 2% р-н ATF-лонг H 2 KGIut 21 01 97 84,67 15,33 2% р-н ATF-лонг 2% р-н ATF-лонг H 2 Suc 21 01 97 21 01 97 84,48 84,51 15,52 15,49 2% р-н ATF-лонг 2% р-н ATF-лонг HLac HGly 21 01 97 21 01 97 84,42 84,33 15,58 15,67 2%р-н ATF-лонг HAsc 21 01 97 84,11 15,89 2% р-н ATF-лонг HAc 21 01 97 84,24 15,76 2% р-н ATF-лонг HPyr H 2 Apl 15,0 21 01 97 84,08 15,92 3 мес 1% р-н ATF завод 24 04 97 79,6 20,4 2% р-н ATF-лонт 2% р-н ATF-лонг H3PO4 H 3 Citr 3 мес 3 мес 24 04 97 24 04 97 78,97 80,14 21,13 12,86 2% р-н ATF-лонг 2% р-н ATF-лонг H2Tart H 2 KGIut 3 мес 3 мес 24 04 97 24 04 97 79,12 78,94 20,88 21,06 HGly 3 3 3 3 24 24 24 24 04 97 04 97 04 97 04 97 78,52 78,31 77,35 77,56 21,48 21,69 22,65 22,44 2% р-н ATF-лонг HAsc 3 мес 24 04 97 77,42 22,58 2% р-н ATF-лонг 2% р-н ATF-лонг HAc HPyr 3 мес 3 мес 24 04 97 24 04 97 77,11 77,02 22,89 22,98 6 мес 23 07 97 67,53 32,7\47 2% 2% 2% 2% р-н р-н р-н р-н ATF-лонг ATF-лонг ATF-лонг ATF-лонг 1% р-н ATF завод H 2 Suc H 2 Apl HLac мес мес мес мес 43797 Зразок Додаток*** Термін зберігання Дата аналізу Продовження табл 2 ВЕЖХ** S(ATF + AN)=100% ATF, % AN, % 2 % р-н ATF-лонг Н 3 РО 4 6 мес 23 07 97 71,2 41,33 2% р-н ATF-лонг H3Citr 6 мес 23 07 97 73,5 26,5 2% р- н ATF-лонг H2Tart 6 мес 23 07 97 70,90 29,1 2% р-н ATF-лонг H2KGIut 6 мес 23 07 97 69,8 30,2 2%р-н ATF-лонг H2Suc 6 мес 23 07 97 69,5 30,5 2% р-н ATF-лонг H2Apl 6 мес 23 07 97 69,6 30,4 2% р-н ATF-лонг 2% р-н ATF-лонг HLac HGly 6 мес 6 мес 23 07 97 23 07 97 69,11 68,73 30,89 31,27 2% р-н ATF-лонг HAsc 6 мес 23 07 97 68,41 31,59 2% р-н ATF-лонг HAc 6 мес 23 07 97 67,92 32,08 2% р-н ATF-лонг HPyr 6 мес 23 07 97 68,13 31,87 9 мес 22 10 97 58,67 41,33 1%р-н ATF завод 2% р-н ATF-лонг H3PO4 9 мес 22 10 97 61,89 38,11 2%р-н ATF-лонг H3Citr 9 мес 22 10 97 65,13 34,87 2%р-н ATF-лонг H2Tart 9 мес 22 10 97 63,91 36,08 2% р-н ATF-лонг H2KGIut 9 мес 22 10 97 63,62 36,48 2% р-н ATF-лонг H2Suc 9 мес 22 10 97 63,03 36,97 2% р-н ATF-лонг H2Apl 9 мес 22 10 97 62,83 37,17 2% р-н ATF-лонг HLac 9 мес 22 10 97 63,07 36,93 2%р-н ATF-лонг HGly 9 мес 22 10 97 62,91 37,09 2% р-н ATF-лонг HAsc 9 мес 22 10 97 62,87 37,13 2% р-н ATF-лонг HAc 9 мес 22 10 97 61,56 38,44 2% р-н ATF-лонг HPyr 9 мес 22 10 97 61,4 38,6 12 мес 21 01 98 49,42 50,58 1 % р-н ATF завод 2%р-н ATF-лонг H3PO4 12 мес 21 01 98 57,32 42,78 2%р-н ATF-лонг H3Citr 12 мес 21 01 98 59,89 40,11 2% р-н ATF-лонг H2Tart 12 мес 21 01 98 57,91 42,09 2%р-н ATF-лонг H2KGIut 12 мес 21 01 98 57,67 42,33 2%р-н ATF-лонг H2Suc 12 мес 21 01 98 57,11 42,19 2%р-н ATF-лонг H2Apl 12 мес 21 01 98 57,52 42,48 2%р-н ATF-лонг HLac 12 мес 21 01 98 57,18 42,82 2% р-н ATF-лонг HGly 12 мес 21 01 98 57,26 42,76 2% р-н ATF-лонг HAsc 12 мес 21 01 98 57,39 42,61 2% р-н ATF-лонг HAc 12 мес 21 01 98 56,12 43,88 2%р-н ATF-лонг HPyr 12 мес 21 01,98 56,98 43,02 Загальний вміст аденіннуклеотидів у розчині визначали спектрометрично в УФ-області (Я,=258 нм) Вміст аденіннуклеотидів методом ВЕЖХ визначали з УФ -детектором ( Я,=258 нм) Додатки фосфорна (Н3РО4), лимонна (H3Citr), щавлева (H2Tart), кетоглютарова (H2KGIy), аскорбінова (HFsc), оцтова (НАс), піридинова (НРуг) кислоти та H2Suc - винна кислота 43797 Таблиця З Вплив (в % відносно контролю) Na2ATF (І) і ATF - лонг (II) на метаболічні процеси в мітохондріях міокарду при гострій ішемії (контроль - інтактні тварини) Біохімічні показники Гостра ішемія Na2ATF ATF -лонг Активність а-кетоглутаратдепдрогенази 97 98 101 Активність сукцинатде 82 89 99 Споживання кисню міокардом 78 82 103 Швидкість фосфорилювання Активність креатинфосфокінази 72 82 91 88 102 102 Вміст фосфоліпідів 69 79 91 пдрогенази Вміст ВІЛЬНИХ жирних кислот 138 126 101 Активність фосфоліпази 145 132 101 Вміст ІОНІВ кальцію 127 118 96 Таблиця 4 Вплив (у % по відношенню до контролю - адекватної перфуцм) Na2ATF(l, 1 % розчин) і KjMgfHis) (ATF)8H2O (11, 1 % розчин з додатком цитрату) на показники іонного і енергетичного обміну серцевого м'язу в умовах гострої ішемії і наступної реперфузм Біохімічні Перфузія Репер фузія показники І II І II Гостра ішемія Гостра ішемія Активність Na+, K+, -ATF-ази 64 76 97 72 79 95 Зв'язування ІОНІВ Caz+ на поверхні сарколеми 72 78 95 86 87 108 Проникність мембра 185 122 102 120 118 102 63 73 95 68 74 97 127 119 102 115 120 103 Активність а-кетоглютаратде гідро ге нази 54 63 108 92 91 101 Активність сукцинатдепдрогенази 63 69 99 94 95 100 Вміст ІОНІВ кальцію 132 86 102 113 107 101 106 103 97 183 138 113 320 180 105 111 103 102 77 86 92 26 78 97 60 79 95 70 79 93 45 72 95 80 77 98 ни для ІОНІВ кальцію Вміст фосфоліпідів у мембрані Вміст ВІЛЬНИХ жир них кислот у мембрані в мітохондріях Активність креатинфосфокінази в мітохондріях Концентрація мочної кислоти в перфузаті Концентрація ІОНІВ кальцію Вміст ATF в тканині міокарду Вміст глікогена в тканині міокарду 43797 Тираж 50 екз Відкрите акціонерне товариство «Патент» Україна, 88000, м Ужгород, вул Гагаріна, 101 (03122) 3 - 7 2 - 8 9 (03122) 2 - 5 7 - 0 3 43797
ДивитисяДодаткова інформація
Назва патенту англійськоюInjection form of the preparation, which manifests the anti-ischemic activity
Автори англійськоюHeorhiievskyi Viktor Petrovych, Petrovska Ala Heorhiivna, Khovanska Nataliia Petrivna, Kutniak Viktor Petrovych, Manoryk Petro Andriiovych, Manoryk Petro Andriovych, Lypkan Heorhii Mykolaiovych
Назва патенту російськоюИнъекционная форма препарата, проявляющего противоишемическую активность
Автори російськоюГеоргиевский Виктор Петрович, Петровская Алла Георгиевна, Хованская Наталья Петровна, Кутняк Виктор Павлович, Манорик Петр Андреевич, Липкан Георгий Николаевич
МПК / Мітки
МПК: A61K 31/7076, A61K 31/194
Мітки: форма, активність, протиішемічну, проявляє, ін'єкційна, препарату
Код посилання
<a href="https://ua.patents.su/8-43797-inehkcijjna-forma-preparatu-shho-proyavlyaeh-protiishemichnu-aktivnist.html" target="_blank" rel="follow" title="База патентів України">Ін’єкційна форма препарату, що проявляє протиішемічну активність</a>
Попередній патент: Привідний барабан стрічкового конвеєра
Наступний патент: Спосіб розмелення матеріалу та млин для його здійснення
Випадковий патент: Молочно-морквяна запіканка