Похідні 17,20-епоксипрегнану, спосіб їх одержання, спосіб одержання похідних кортизону і проміжні сполуки
Формула / Реферат
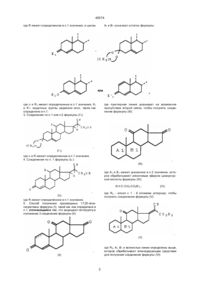
1, Производные 17,20-эпоксипрегнана формулы (I):
где R - радикал оксо или ß-гидрокси и циклы А и В означают остаток формулы:
где К - радикал оксо или группа защищающая радикал оксо, формулы:
n равно 2 или 3 и R1 - остаток эфира или сложного эфира, К' - радикал оксо или защитная группа типа оксима, гидразона или семикарбазона, и волнистые линии обозначают смесь изомеров.
2. Соединения по п.1 формулы (її):
где R имеет определенное в п.1 значение, и циклы A1 и B1 означают остаток формулы:
где n и R1 имеют определенные в п.1 значения, К1 и К'1 защитные группы радикал оксо, такие как определено в п.1.
3. Соединения по п.1 или п.2формулы(I'1)
где n и R имеют определенные в п.1значения. 4. Соединения по п. 1 формулы (І2 ):
где R имеет определенное в п.1 значение.
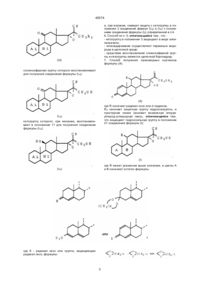
5. Способ получения производных 17,20-эпоксипрегнана формулы (I), такой как она определена в п.1, отличающийся тем, что защищают кетогруппу в положении 3 соединения формулы (II):
где пунктирная линия указывает на возможное присутствие второй связи, чтобы получить соединение формулы (III):
где A1 и В1 имеют указанное в п.2 значение, которое обрабатывают алкиловым эфиром циануксусной кислоты формулы (IV):
N=С-СН2-СО2 R 2 , (IV)
где R2 - алкил с 1 - 6 атомами углерода, чтобы получить соединение формулы (V):
где. R2, A1, B1 и волнистые линии определены выше, которое обрабатывают эпоксидирующим средством для получения соединения формулы (VI):
сложноэфирную группу которого восстанавливают для получения соединения формулы (l1a):
кетогруппу которого, при желании, восстанавливают в положении 11 для получения соединения формулы (I1b):
и, при желании, снимают защиту с кетогруппы в положении 3 соединений формул (l1a) и (I1b) с получением соединения формулы (I2), определенной в п.4.
6. Способ по п. 5. отличающийся тем , что :
- кетофуппу в положении 3 защищают в виде алкиленкеталя;
- эпоксидирование осуществляют перекисью водорода в щелочной среде;
- средством восстановления сложноэфирной группы и кетогруппы является щелочной борогидрид.
7. Способ получения производных кортизона формулы (А):
где R означает радикал оксо или р-гидрокси,
Rз означает защитную группу гидроксигруппы, и пунктирная линия означает возможную вторуюуглерод-углеродную связь, отличающийся тем, что защищают гидроксильную группу в положении 21 соединения формулы (I):
где R имеет указанное выше значение, а циклы А и В означают остаток формулы:
где К - радикал оксо или группа, защищающая радикал оксо, формулы:
n равно 2 или 3 и R1 - остаток эфира или сложного эфира, К' - радикал оксо или
защитная группа, такая как оксим, гидразон или семикарбазон, и волнистые линии обозначают смесь изомеров, с получением соединения формулы (VII):
где R, Rз, А и В имеют уже определенное выше значение, нитрильную группу которого гидратируют, чтобы получить соединение формулы (VIII):
которое подвергают реакции разложения Гофманна, чтобы получить соединение формулы (IX):
в котором, по желанию, снимают защиту с кетогруппы в положении 3, для получения целевого соединения формулы (А).
8. Способ по п.7, отличающийся тем, что ведут разложение без промежуточного выделения амида формулы (VIII).
9. Способ по п.7 или п.8, отличающийся тем, что группой, защищающей гидроксильный радикал, является остаток эфира и, в частности, радикал алкил, содержащий 1-6 атомов углерода.
10. Способ по любому из п.п.7-9, отличающийся тем, что гидратацию нитрильной группы осуществляют водным раствором минерального основания в среде полярного растворителя.
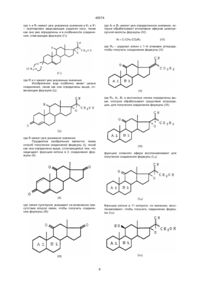
11. Производные прегнона формулы:
где А1, В1, В2 и волнистые линии определены в п.5 и R4 и R5 образуют вместе связь углерод-углерод или эпокси в положении α, в качестве промежуточных соединений.
12. Производные 17,20-эпоксипрегнана формулы:
где А, В, R и волнистые линии определены в п.1, R3 - определена в п.7 и R6 - радикал циано или радикал карбамоил, в качестве промежуточных соединений. 13. Производные прегнола формулы:
где А1, В1, и R определены в п.2 и R3 определена в п.7, в качестве промежуточных соединений.
Текст
1. Производные 17,20-эпоксипрегнана формулы (I): , (I) где R - радикал оксо или b-гидрокси и циклы А и В означают остаток формулы: UA (11) 40574 (13) C2 (21) 94005054 (22) 12.01.1994 (24) 15.08.2001 (31) 93 00290 (32) 14.01.1993 (33) FR (46) 15.08.2001, Бюл. № 7, 2001 р. (72) Жан Бюандіа, FR, Ремі Шовен, FR, Мішель Віва, FR (73) ХЬОХСТ МАРІОН РУССЕЛЬ, FR (56) Патент US 3 960 842, 1976. Патент US 4 257 948, 1981. Патент US 4 600 538, 1986. Патент US 5 187 273, 1993. Патент US 5 294 704, 1994. n равно 2 или 3 и R1 - остаток эфира или сложного эфира, К' - радикал оксо или защитная группа типа оксима, гидразона или семикарбазона, и волнистые линии обозначают смесь изомеров. 2. Соединения по п.1 формулы (I1): Ю (19) где К - радикал оксо или группа защищающая радикал оксо, формулы: (I1) , 40574 где R имеет определенное в п.1 значение, и циклы A1 и B1 означают остаток формулы: где n и R1 имеют определенные в п.1 значения, К1 и К'1- защитные группы радикала оксо, такие как определено в п.1. 3. Соединения по п.1 или п.2 формулы (I'1): где пунктирная линия указывает на возможное присутствие второй связи, чтобы получить соединение формулы (III): (I’1) , где n и R имеют определенные в п.1 значения. 4. Соединения по п. 1 формулы (І2 ): , (III) где A1 и В 1 имеют указанное в п.2 значение, которое обрабатывают алкиловым эфиром циануксусной кислоты формулы (IV): N º С-СН2-СО2R 2 , , (I2) где R имеет определенное в п.1 значение. 5. Способ получения производных 17,20-эпоксипрегнана формулы (I), такой как она определена в п.1, отличающийся тем, что защищают кетогруппу в положении 3 соединения формулы (II): (IV) где R2 - алкил с 1 - 6 атомами углерода, чтобы получить соединение формулы (V): , (V) где R2, A1, B1 и волнистые линии определены выше, которое обрабатывают эпоксидирующим средством для получения соединения формулы (VI): , (II) 2 40574 и, при желании, снимают защиту с кетогруппы в положении 3 соединений формул (l1a) и (I1b) с получением соединения формулы (I2), определенной в п.4. 6. Способ по п. 5, отличающийся тем , что : - кетогруппу в положении 3 защищают в виде алкиленкеталя; - эпоксидирование осуществляют перекисью водорода в щелочной среде; - средством восстановления сложноэфирной группы и кетогруппы является щелочной борогидрид. 7. Способ получения производных кортизона формулы (А): , (VI) сложноэфирную группу которого восстанавливают для получения соединения формулы (l1a): (A) где R означает радикал оксо или b-гидрокси, RЗ означает защитную группу гидроксигруппы, и пунктирная линия означает возможную вторую углерод-углеродную связь, отличающийся тем, что защищают гидроксильную группу в положении 21 соединения формулы (I): , (I1a) , кетогруппу которого, при желании, восстанавливают в положении 11 для получения соединения формулы (I1b): (I) , , где R имеет указанное выше значение, а циклы А и В означают остаток формулы: (I1b) где К - радикал оксо или группа, защищающая радикал оксо, формулы: 3 40574 n равно 2 или 3 и R1 - остаток эфира или сложного эфира, К' - радикал оксо или защитная группа, такая как оксим, гидразон или семикарбазон, и волнистые линии обозначают смесь изомеров, с получением соединения формулы (VII): является остаток эфира и, в частности, радикал алкил, содержащий 1-6 атомов углерода. 10. Способ по любому из пп.7-9, отличающийся тем, что гидратацию нитрильной группы осуществляют водным раствором минерального основания в среде полярного растворителя. 11. Производные прегнона формулы: , (VII) где R, Rз, А и В имеют уже определенное выше значение, нитрильную группу которого гидратируют, чтобы получить соединение формулы (VIII): , где А1, В 1, В2 и волнистые линии определены в п.5 и R4 и R5 образуют вместе связь углерод-углерод или эпокси в положении α, в качестве промежуточных соединений. 12. Производные 17,20-эпоксипрегнана формулы: , (VIII) которое подвергают реакции разложения Гофманна, чтобы получить соединение формулы (IX): , где А, В, R и волнистые линии определены в п.1, R3 определена в п.7 и R6 - радикал циано или радикал карбамоил, в качестве промежуточных соединений. 13. Производные прегнола формулы: , (IX) в котором, по желанию, снимают защиту с кетогруппы в положении 3, для получения целевого соединения формулы (А). 8. Способ по п.7, отличающийся тем, что ведут разложение без промежуточного выделения амида формулы (VIII). 9. Способ по п.7 или п.8, отличающийся тем, что группой, защищающей гидроксильный радикал, , где А1 , В1 и R определены в п.2 и R 3 определена в п.7, в качестве промежуточных соединений. ______________________________ 4 40574 Предметом данного изобрете ния являются новые производные 17,20-эпоксидов прегнана, их получение, их применение для получе ния кортизонных производных и промежуточных соединений. Таким образом, изобретение имеет целью соединения формулы (I): Когда R1 –остаток эфира, то может еще касаться силилированной группировки, например, груп пировки триалкилсилил, та кой как триметилсилил, третичный бутил, ди метилсилил или еще например группировки триарилсилил, такая как трифенилсилил или диарилалкилсилил, такой как дифенил третичный бутилсилил. Когда R1 – остаток сложного эфи ра, то может касаться всякого остатка, известного специалистам, могущего блокировать положение 3 в этом виде и в частности может касаться остатка -COR 1, причем R1 – радикал алкил, арил или аралкил, такой как он определен выше. Когда K' – защи щающая груп пировка, типа оксим или семикарбазон, то касается, например, остатка формулы =N-OX, где Х – атом водорода, радикала алкил с 1–6 атомами углерода, предпочтительно метила, радикала ацил с 1–10 атомами углерода, предпочтительно ацетила или бензоила или радикала арил с 6–12 атомами углерода, или остатка =N-NH-CO-Y, где Y – радикал амино или груп пировка (I) где R – радикал оксо или b-гидрокси и циклы А и В – остаток: Z1, Z2 и Z3 – радикалы алкил с 1–6 атомами углерода или образуют вместе с атомом азота радикал пиридил и Наl – атом галогена, предпочтительно хло ра или брома. В частности, изобретение имеет целью соединения, такие как они определены выше, отвечающие фор муле (I1): где К – радикал оксо или группировка, защи щающая радикал оксо формулы: n равнo 2 или 3 и R1 – остаток эфи ра или сложного эфира, K' – радикал оксо или защищающая группировка, типа оксим, гидразон или семикарбазон и волнистые ли нии символи зир уют смесь изомеров. Когда R1 – оста ток эфира, то может касаться всякого остатка знакомого специалистам, что бы блокировать положение 3 в этом виде и в частности может касаться радикала алкил, с 1–6 атомами углерода, радикала алкоксиалкоксиалкила с 3–8 атомами углерода, радикала арил с 6–10 атомами углерода или радикала aралкил с 7–12 атомами углерода. Когда R1 – радикал алкил, то касается, например, радикала метил, этил, пропил, изопропил, н-бутил, вто ричный бутил, тре тичный бутил, пентил или гексил. Когда R1 – радикал алкоксиалкоксиалкил, то касается, например, радикала метоксиэтоксиметила. Когда R1 – радикал аралкил, то касается. например, радикала бензил или фенетил. Когда R1 – радикал арил, то касается, например, радикала фенил или радикала фенил, замещенного, в частности, одним или несколькими радикалами алкил. (I1) где R имеет значение, уже определенное выше и циклы А1 и В1 – остаток: 5 40574 где n и R1 имеют уже указанное значение и К1 и К'1 – группировки защи щающие радикал оксо, такие как они уже определены и в особенности соединения, отвечающие фор муле (I'1): где А1 и В1 имеют уже определенное значение, которое обрабатывают алкиловым эфи ром цианоуксусной кислоты фор мулы (IV): N º C-CH2-CO2R2 (IV) где R2 – радикал алкил с 1–6 атомами углерода, чтобы получить соединение формулы (V): (I’1) где R и n имеют уже указанные значения. Изобретение еще особенно имеет целью соединения, такие как они определены выше, отвечающие фор муле (I2): (V) где R2, А1, В1 и волнистые линии определены выше, кото рое обрабатывают средством эпоксидации, для получения соединения формулы (VI): (I2) где R имеет уже указанное значение. Предметом изобретения является также способ получения соединений формулы (I), та кой как она определена выше, отличающийся тем, что защи щают функцию кетона в 3, соединения формулы (II): функцию сложного эфира восстанавливают для получения соединения формулы (I1a): (II) (I1a) где линия пунктиром указывает на возможное присутствие второй связи, чтобы получить соединение формулы (III): Функцию кетона в 11 которого, по желанию, восстанавливают, чтобы получить соединение формулы (I1б ): (III) (I1б ) (VI) 6 40574 Эта реакция эпоксидации a, b-этиленового нитрила, проявляет оригинальный и неожиданный ха рактер, тем, что нитрил сохранен, что, априорно, не очевидно. Восстановление функции сложного эфи ра ведется действием щелочного борогидрида в спирте, в среде органического растворителя, например, борогидрида или лития, в смеси эта нола и толуо ла. Можно еще употреблять гидрид, например, двойной гидрид лития и алюминия, гидрид диэтилнатрияалюминия, гидрид диизобутиалюминия или еще дигидробис(2-метокси этокси) алюмината натрия. Тогда действуют, например, в то луоле или тетрагидрофуране. Восстановление функции кетона ведется по одной или другой вышеупомянутых реакций, в условиях указанных растворителей. Надо заметить, что оба восстановления ведутся в обратном порядке, по сравнению с тем, который встречается обычно, т.е. восстановление сложного эфира в 21 происхо дит до восстановления кетона в 11. Это также является неожиданностью способа. Ясно, что не выходя из рамок изобретения, можно вести оба восстановления одновременно, без выделения промежуточного соединения 11-оксо. Такой пример нахо дится в опытной части. Возможное освобождение функции кето на в 3 ве дется средствами, подхо дящи ми природе защи ти тельной группировки. Употребляют кислотное средство в присутствии воды или смеси вода-спирт, в случае кеталя. Касается, например, минеральной или органической кислоты, та кая как соляная кислота, бромистый водород, серная кислота, хлорная кислота, азотная, паратолуолсуль фо кислота, ук сусная кислота, ща ве левая кислота или смесь кислот, или е ще кислая смола, например, сульфоновая смола. В случае тиокеталя или смешанного кеталя, снятие защи ты функции 3-оксо ведется действием иода в присутствии основа ния, например, щелочного би карбоната, или действием иода в каталитическом количестве, в присутствии окислите ля, в частности перекиси во дорода, действием иодида метила, глиоксиловой кислотой или еще солями металлов, та ких как ртуть или кадмий. Обычно, можно действовать в раство рите ле, та кой как низший алканол, например метанол или этанол, в смеси с галоге нированным растворителем, например, хло ристый метилен, в присутствии воды. В случае смешанного кеталя, снятие защи ты е ще ведется, например ртутной солью, та кая как хлорная ртуть в присутствии буфе ра уксусная кислота / ацетат калия при около 100оС, никелем Ранея в те х же условиях, которые указаны выше или смесью соляная кислота – ук сусная кислота в го рячем виде. В случае, когда R1 – остаток эфира или сложного эфи ра, то то же употребляют обработку кислотой, в частности, в условиях, описанных выше для кеталя. Тоже касается освобождения функции кетона, защи щенной в виде оксима или семикарбазона. Данное изобретение имеет также целью применение соединений формулы (I), та кой как она определена выше, для получения соединений формулы (A): в соединениях формул (I1a) и (I1б ) освобождают функцию кетона в 3, по желанию, что бы получить соединение формулы (I2), такое как оно определено выше. Защи та функции кетона в 3, ведется способами, известными специалистам. Таким образом можно употреблять в частности диол, дитиол или смешенный тиол формулы HO-(CH2)n-OH, HS-(CH2)n-SH или HO-(CH2)n-SH, в кислой среде, например в присутствии концентрированной соляной кислоты или концентрированного бромистого во дорода, в каталити ческих количества х, пара-толуолсульфо кислоты, или е ще в при сутствии кислоты Левис, та кая как хлористый цинк, тетрахлорид тита на или трифторида бора, предпочтительно в ви де эфирной вытяжки. Можно еще употреблять метилэтил диоксолан в присутствии кислоты, например одной из тех, кото рые упомянуты вы ше. Можно еще употреблять галогенид алкила, алкоксиалкоксиалкила аралкила или арила, в присутствии основания, образующе го промежуточно энолат, например гидрид, алкоголят или щелочной гидроксил. Можно еще употреблять галогенид триалкила, триарила или диарилалкилсилила в щелочной среде, как это указано выше. Мож но еще уп отреб лять подхо дя щий хлорид кислоты , действуя в при сутствии основания, кото рым может быть азотное осно вание, например, три эти ламин, пири дин, ди мети ламинопиридин или ми неральное основа ние, в частности ги дрид, а лкого лят или ще лочной гидроксид. Можно еще употреблять подхо дящий гидроксиламин, могущий быть в виде хлоргидрата или другой соли, или семикарбазид или подхо дящее производное, также в виде хлоргидрата или другой соли. Действие алкилового эфи ра циануксусной кислоты предпочтительно ведется в безводной среде, в присутствии первичного амина, например, гексиламина или низшего гомолога и слабого кислого катализатора, например кислоты Левис, кислой смолы, бензойной кислоты или еще пара толуолсульфо кислоты. Действуют в среде органического растворителя, такой как растворитель ароматического соединения, например, бензол, толуол или ксилол, или циклогексан. Средством эпоксидации является средство, которое должно соблюдать группировку нитрила. Предпочитают перекись водорода, употребляемую одну или в присутствии переходного металла, такой как титан, вольфрам или молибден, например в виде гидратированной соли. Действуют предпочти тельно в щелочной среде, в частности в присутствии карбоната, бикарбоната или щелочной гидроокиси или щелочно-земельной гидроокиси, в среде растворите ля, которым может быть алканол, предпочтительно в смеси с сорастворителем, в частности растворитель галогенированный. Можно еще употреблять щелочной гипохлорит, с нейтральным рН илис рН близким нейтральности. 7 40574 в условиях способа и особенно разложение Гофманна, т.е. остаток эфира и прежде всего радикал алкил с 1–6 атомами углерода, в частности радикал метил, этил, пропил. Такие эфиры получаются в частности действием соответствующего галогенида, в присутствии ще лочи, например действием подхо дяще го иодида или бромида, в присутствии сильного основания, такого как гидрид, амид щелочного металла или щелочной алкоголят, действуют в сре де растворите ля, которым может быть в частности эфир, такой как тетрагидрофуран или диоксан, диметилформамид, диметилсульф оксид. Гидратация функции нитрила ведется действием водного минерального основания и в частности действием щелочной гидроокиси такая как гидроокись натрия, калия или лития. Действуют в присутствии органического растворителя, предпочти тельно полярного, как то тетрагидрофуран, диоксан, диметилформамид, диэтилсульфоксид или еще ацетонитрил. Разложение амида ведется действием щелочного или ще лочноземельного ги погалогенита, в частности ги похлорита или ги побромита натрия, при случае образованного "на месте". Действуют в среде растворителя, которым может быть предпочтительно один из тех, которые указаны выше, и в присутствии воды. Изобретение распространяется на применение, такое как оно определено выше, отличающееся тем, что разложение ведется без промежуточного выделения амида формулы (VIII). Возможное освобождение функции кетона производится в условиях, указанных выше. Наконец, изобретение имеет целью в качестве промышленных новых продуктов: – соединения формулы: (A) где R – имеет определенное выше значение, R3 – группировка, защищающая радикал гидрокси и линия пунктиром – возможная вторая связь углерод-углерод отличающееся тем, что защищают функцию гидрокси в 21 соединения формулы (I), чтобы получить соединение формулы (VII): (VII) где R, R3 , А и В и меют уже указанное значение, функцию нитрила которого гидратируют для получения соединения формулы (VIII): (VIII) которое подвергают реакции разложения Гофманна для получения соединения формулы (IX): где А1, В1 , R2 и волнистые линии определены выше, и R4 и R5 образуют вместе связь углерод-углерод или эпокси в положении a, – соединения формулы: (IX) функцию кетона которого, при желании, освобождают (в положении 3), для получения целевого соединения формулы (А). Под группировкой, защи щающей радикал гидрокси, подразумевают гр уппировку, устойчивую 8 40574 где А, В, R, R3 и волнистые линии определены выше, и R6 – ра дикал циано или радикал карбамоил, – соединения формулы: ных растворов на двуокиси кремния, и элюируя смесью циклогексан-толуол-эти ловый эфир уксусной кислоты (2-2-1), получают 2,75 г добавочного целевого продукта. ИК спектр (CHCl3) Поглоще ния при 2226 см –1 (С º N), 1725– 1707 см –1 (С=О и сопряженный сложный эфир ), 1611 см –1 (С=С). ЯМР спектр (CDCl3, 300 Мгц, чнм) 1,01 : СН3 в 18; 1,23 : СН3 в 19; 1,34 (т) : СН3 сложного эфи ра; 3,94 : СН2 ацеталя, 4,27 (q) : СН2 сложного эфи ра; 5,36 : Н в 6. Стадия В: Этиловый эфир 20-циано 3,3-(1,2этан диил бис окси) 11-оксо 17,20-эпокси пренг-5ен-21-кислоты. В инертной атмосфере смешивают 0,255 г полученного в стадии Б продукта, 1 см 3 хло ристого метилена и 4 см 3 этанола. При 20оС прибавляют к раствору 0,2 см 3 50%-ой перекиси водорода. Затем прибавляют насыщенный раствор бикарбоната калия в 50%-ом этаноле до рН 9, а затем выдерживают при перемешивании при постоянном рН 3 часа 30 минут. Затем прибавляют 0,5 см 3 10%-ой уксусной кислоты, а затем концентрируют досуха под уменьшенным давлением при 25оС. Остаток забирают в смесь воды и хлористого мети лена, декантируют и концентрируют до суха органический слой. Оста ток хроматографи руют на двуо киси кремния, элюируя смесью хлористый метилен - этиловый эфир уксусной кислоты (95-5) и получают 0,236 г це левого продукта. ИК спектр (СНСl3) Поглоще ние при 1764 см –1 и 1740 см –1: карбонил; 1707 см –1: 11-кето; 2243–2235 см –1: С º N не сопряженный; 1672 см –1: С=С. ЯМР спектр (CDCl3, 300 Мгц, чнм) 1,05 (S) (3Н): 18–СН3; 1,22 (S) (3Н): 19-СН3; 3,95 (м) (4Н) : кеталь; 5,30 (м) (1Н): Н в 6; 1,37 (3Н); 4,35 (2Н) : -СН2-СН3-. Стадия Г: Циклический 3,3-(1,2-этан диил) ацеталь 17,20-эпокси- 20-циано 21-гидрокси прегн5-ен-3,11-диона. В инертном газе смешивают 4,36 г продукта, полученного как это описано, в стадии В, 44 см 3 толуола и 44 см 3 этанола. К раствору прибавляют 0,195 г борогидрида натрия. Выдерживают перемешивание 2 часа при 20о, а затем охлаждают до 0оС, прибавляют 0,097 г борогидрида натрия и продолжают перемешивание 2 ч при 0оС. Потом прибавляют 5 см 3 20%-го хлористого аммония, перемешивают 30 минут при 10оС, а затем концентрируют до полу-объема. Прибавляют 50 см 3 воды и 50 см 3 этилового эфи ра уксусной кислоты, перемешивают смесь и декантируют. Сушат органический слой и концентрируют досуха. Остаток хроматографи руют на двуокиси кремния, элюируя смесью хлористый метилен – этиловый эфир уксусной кислоты (8-2). Получают 3,17 г целевого продукта. ИК спектр: (СНСl3) Поглоще ния при 3605 см –1 (ОН), 2242 см –1 (-С º N), 1705 см –1 (С=О), 1670 см –1 (С=С). ЯМР спектр (CDCl3, 200 Мгц, чнм) 1,01 : СН3 в 18; 1,22 : СН3 в 19; 3,81 : СН2 в 21; 3,95 : СН2 ацеталя; 5,35 : Н в 6. Пример 2 : Циклический 3,3-(1,2-этан диил) ацеталь 11b,21- дигидрокси 17-20-эпокси 20-циано прегн-5-ен 3-он. где А1, В1, R и R3 определены выше. Соединения формулы (А) являются обычно известными соединениями, например американским патентом US 2648688 или ссылками J. Org. Chem. 26,4153-5 (1961) и 26, 5046-52 (1961) или как промежуточные соединения синтеза, или как биологически активные соединения. Соединение формулы (II) описано, например, в патенте US 2844600. Следующие примеры иллюстрируют изобретение, но не ограничивают его. Пример 1 : Циклический 3,3-(1,2-этан диил)ацеталь 17,20-эпокси 20-циано 21-гидрокси прегна-5-ен 3,11-диона. Стадия А: Циклический 3,3-(1,2-этан диил)ацеталь андрост 5-ен 3,11,17-триона. В инертном газе смешивают 10 г адреностерона и 150 см 3 метилэтилдиоксолана, нагревают с рефлюксом 30 минут, прибавляют 0,033 г п-толуолсульфо кислоты и продолжают нагревание с рефлюксом 6 часов 30 минут. Охлаждают до около 50оС, прибавляют 0,5 см 3 триэтиламина и концентрируют досуха под уменьшенным давлением. Полученный продукт пе рекристаллизуют в эта ноле, отсасывают и промывают хо лодным этанолом, а затем смесью этанол-вода и сушат. Получают 6,35 г целевого продукта. Пл. = 196–198оС Спектр ИК (СHCl3) Поглоще ние при 1740 см –1 (17 С=О) и 1706 –1 см (11=О). ЯМР спектр (CDCl3, 250 Мгц, ч.н.м.) 0,86 : 18-СН3; 3,95 : СН2 кеталя; 5,38 : Н в 6. Стадия Б: Этиловый эфир 20-циано 3,3-(1,2этан диил бис окси) 11-оксо прегн-5,17(20)-диен21-кислоты. В инертном газе смешивают 6,25 г полученного в стадии А продукта, 100 см 3 ксилола, 6,2 см 3 этилового эфи ра циануксусной кислоты, 3,1 см 3 гексиламина и 0,31 г бензойной кислоты. Нагревают с рефлюксом 24 часа, уда ляя воду, образованную во время реакции, а затем охлаждают до около 15оС и прибавляют 5 см 3 водного раствора в 10% бикарбоната натрия. Перемешивают 1 час, а затем деканти руют, промывают водой органический слой и концентрируют под уменьшенным давлением. Получают кристаллический продукт, кото рый перекристаллизовывают в этиловом эфире уксусной кислоты. После промывания кристаллов в гексане и сушки получают 3,42 г целевого продукта. Хроматографией маточ 9 40574 В инертном газе смеши вают 5,9 г продукта, полученного в ста дии В примера 1, 120 см 3 этанола и 1,2 г борогидрида натрия, а затем перемешивают 45 минут при комнатной температуре. Затем смесь нагревают до 45оС и прибавляют 0,6 г борогидрида натрия, спустя 1 час 30 минут, а затем заново после 3 часов. По истечении 4 часов 30 минут охлаждают до 0–5оС, медленно прибавляют 200 см 3 насыщенного раствора хлористого аммония, выдерживая реакционную температуру ни же 15оС. Перемешивают, а затем прибавляют смесь вода - эти ловый эфир уксусной кислоты, сушат органический слой и концентрируют его досуха. Остаточный продукт очищают хроматографией на двуо киси кремния, элюируя смесью циклогексанэтиловый эфир уксусной кислоты (1-1) и получают 3 г целевого продук та. ИК спектр (CHCl3) Поглоще ния при 3614 см –1 (ОН), 2240 см –1 (-С= ), отсутствие С=О. ЯМР спектр (CDCl3, 200 Мгц, чнм) 1,28 (S) : CH 3 в 18; 1,32 (S) : СН3 в 19; 3,76 и 3,87 (d-J = 12) : СН2 в 21; 3,95 : СН2 кеталя; 4,5 : Н в 11; 5,25 : Н в 6. Пример 3: 17a-гидрокси 21-метокси прегн-4ен 3,11,20-трион. Стадия А: Циклический 3,3-(1,2-этан диил) ацеталь 17,20-эпокси 20-циано 21-метокси прегн5-ен 3,11-диона. В инертном газе смешивают 20 см 3 безводного тетрагидрофурана и 0,668 г 50%-го гидрида натрия в масле. Прибавляют в 5 мин. при перемешивании и 20–22 оС, раствор 4,21 г продукта, полученного в примере 1 в 30 см 3 тетрагирлфурана. Перемешивают 40 мин. при 20,22оС, а затем прибавляют 3 см 3 иодистого метила и продолжают перемеши вание 1 час. Таким образом полученный раствор выливают в смесь 50 см 3 20%-го водного раствора хлористого аммония и 50 г льда. Экстрагируют эти ловым эфиром уксусной кислоты, сушат органический слой и концентрируют до суха. Получают 4,61 г сырого продукта, кото рый очищают сгуще нием в смеси изопропиловый эфир – эти ловый эфир уксусной кислоты. После сушки получают 4,03 г це левого продукта. Пл. # 256оС. ИК спектр (CНCl3) Поглощения при 2248 см –1 (-С º N); 1706 см –1 (С=О), 1670–1637 см –1 (С=С), отсутствие ОН. ЯМР спектр (CDCl3, 300 Мгц, чнм) 1,00 (S) : CH3 в 18; 1,22 (S) : СН3 в 19; 3,47 (S) : О-СН3; 3,57 : -СН2 в 21; 3,95 : СН2 кеталя; 5,35 : Н в 6. Стадия Б: Циклический 3,3-(2,1-этан диил) ацеталь 17,20-эпокси 20-карбамоил 21-метокси прегн-5-ен 3,11-диона. 0,37 г продукта полученного в стадии А и 0,049 ггидроокиси лития растворяют в 7,5 см 3 диоксана и 2,5 см 3 воды. Нагревают с рефлюксом 2 часа. Охлаждают до комнатной температуры, а затем разбавляют 0,2 н.-ой соляной кислотой. Экстрагируют хло ристым метиленом, сушат органический слой и концентрируют досуха. Получают 0,378 г целевого продук та, который, употребляемый в данном виде, может быть обработан по способу разложения Гофманна, как это указано в следующей ста дии. ЯМР спектр (CDCl3, 200 Мгц, чн.м.) 0,88 (S) : СН3 в 18; 1,17 (S) : СН3 в 19; 3,24 (1Н, d, J = 11 гц) и 4,18 (1Н, d, J = 11 гц) : СН2 в 21; 3,39 (3Н, S) : О-СН3; 5,37 (1Н, dd, J = 2,5 гц и J = 7,5 гц) : Н в 6; 5,67 (1Н, d, J = 4 гц) и 6,19 (1Н, d, J = 4 гц) : -NH 2Стадия В: Циклический 3,3-(1,2-этан диил) ацеталь 17a-гидрокси 21-метокси прегн-5-ен 3,11,20-триона. В инертном газе смешивают 0,36 г полученного в стадии А продукта и 0,049 г гидроокиси лития. Прибавляют 5 см 3 диоксана и 1 см 3 воды, затем нагревают до рефлюкса 3 часа. Раствор охлаждают ледяной баней и прибавляют 0,5 см 3 15%-го гипохлорита натрия и перемешивают 3 часа при 0–20оС, прибавляя два раза 1 см 3 гипохлорита натрия (15%-го). Разбавляют водой, экстрагируют эфиром, сушат и концентрируют до суха органический слой. Остаток хроматографи руют на двуо киси кремния, элюируя смесью этиловый эфир ук сусной кислоты – циклогексан (15-85, а затем 50-50) и получают 0,073 г целевого продукта, который перекристаллизуют по желанию в смеси хло ристый метилен-гексан. Пл. = 236 оС ИК спектр (CHCl3) Поглоще ния при 3610 см –1 : ОН, 1703 см –1 и 1670 см –1: СО= и С=С. ЯМР спектр: (CDCl3, 200 Мгц, чнм) 0,63 (S, 3H) : CH3 в 18; 1,21 (S, 3H) : CH3 в 19; 3,45 (S, 3H) : O-CH 3; 3,95 (4H) : -CH2 ацета ля, 4,17 (d, J = 18 гц, 1Н) и 4,36 (d, J = 18 гц, 1Н) : СН2 в 21, 5,36 (м, 1Н) : Н в 6. Стадия Г: 17a-гидрокси 21-метокси прегн-4ен 3,11,20-трион. В инертном газе смеши вают 0,036 г продукта, полученного в стадии В, с 1 см 3 метанола и 0,2 см 3 2н.-ой соляной кислоты. Выдерживают перемешивание 4 часа, отсасывают осадок и сушат его. Получают 0,012 г целевого продукта. Концентрацией маточных растворов получают снова целевой продукт. ИК спектр (CHCl3) Поглоще ния при 3610–3480 см –1 : 17-ОН, 1706 см –1 11 С=О и 20 С=О; 1667 см –1 : 3-С=О сопряженные; 1617 см –1 D4,5. ЯМР спектр (CDCl3, 200 Мгц, чнм) 0,67 (S) : СН3 в 18; 1,41 (S) : СН3 в 19; 3,44 (S) : О-СН3; 3,47 (S) : ОН в 17; 4,19 (d) и 4,31 (d) : СН2 в 21, 5,74 : Н в 4. Пример 4: 17a-гидрокси 21-метокси прегн-4ен 3,11,20-трион Стадия А: 17,20-эпокси 20-циано 21-гидрокси прегн-4-ен 3,11-дион. В инертном газе 4,1 г продукта , полученного как это описано в примере 1, смеши вают с 80 см 3 мета нола и 7 см 3 хлористого мети лена. Прибавляют 20 см 3 2н.-ой со ляной кисло ты и перемеши вают при комнатной температуре 4 часа. Отсасывают образованные кристаллы, промывают и х смесью мета нол-во да (8-2), а затем во дой. Кон центрацией маточных ра ство ров вы деляют до баво чный продукт. После сушки очищают продукт хро матографией на двуо киси кремния, элюи руя смесью хло роформ – изопропанол (95-5) и по лучают 3 ,3 г це лево го продукта. Пл. = 256 оС. ИК спектр: (CHCl 3) 10 40574 Поглоще ния при 3310 см –1 : ОН, 1703 и 1654 см : С=О; 1612 см –1 : С=С. ЯМР спектр (CDCl3, 300 Мгц, чнм) 1,04 (S) : СН3 в 18; 1,42 (S) : СН3 в 19; 3,84 (сист АВ): -СН2ОН; 5,74 (S) : Н в 4. Анализ: С22H27O4N (369,52) C% H% N% Вычислено 71,4 7,3 3,8 Найдено 71,3 7,3 3,5 Стадия Б: 17,20-эпокси 20-циано 21-метокси прегн-4-ен 3,11-дион Эфир в 21 приготовляют по способу, описанному в стадии А примера 5, исхо дя из продукта, полученного выше в стадии А. Стадия В: 17a-гидрокси 21-метокси прегн-4ен 3,11,20-трион. На исходе употребляют соединение, полученное выше в стадии Б, либо как это указано в стадии Б примера 3, вы деляя промежуточный продукт 17,20-эпокси 20-карбамоил 21-метокси прегн4-ен 3,11-диона, а затем обрабатывая это соединение раствором гипохлорита натрия по принципу разложения Гофманна, либо, как это указано в стадии В примера 3, т.е. производя это разложение без промежуточного выделения соединения 20-карбамоила. Получают целевой продукт, та кой же как полученный в ста дии Г примера 3. Пример 5: 11b, 17a-дигидрокси 21-метокси прегн-4-он 3,20-дион. Стадия А: Циклический 3,3-(1,2-этан диил) ацеталь 11b-гидрокси 17,20-эпокси 20-циано 21метокси прегн-5-ен 3-она. Действуют как в стадии А примера 3, исхо дя из продук та, полученного в примере 2 и получают целевой продукт. Стадия Б: Циклический 3,3-(1,2-этан диил) ацеталь 11b,17a-дигидрокси 21-метокси прегн-5ен 3,20-диона. Действуют на исхо де с продуктом, полученным выше в стадии А, либо как указано в стадии Б примера 3, выделяя промежуточно циклический 3,3-(1,2-этан диил) ацеталь 11b-гидрокси 17,20эпокси 20-карбамоил 21-метокси прегн-5-ен-3-она, а затем обрабатывая это соединение раствором гипохлорита натрия, по принципу разложения Гофманна, либо, как это указано в стадии В примера 3, т.е. проделывая это разложение без выделения соединения 20-карбамоила. Стадия В: 11b-, 17a-дигидрокси 21-метокси прегн-4-ен 3,20-дион Действуют как это указано в ста дии Г примера 3, исхо дя из соединения, полученного вы ше в стадии Б. Получают целевой продукт. Пример 6 : 11b, 17a-гидрокси 21-метокси прегн-4-ен 3,20-дион Стадия А: 11b, 21-дигидрокси 17,20-эпокси 20-циано прегн-4-ен 3-он. В инертном газе смеши вают 3 г продукта, полученного в при мере 2, 66 см 3 метанола и 10 см 3 хло ристо го метилена. Прибавляют 15 см 3 2н.-ой соляной кислоты и перемеши вают при комнатной температуре 2 часа. Отсасывают кристаллы, промывают и х смесью мета нол – вода (75–25), а затем водой, отсасывают оса дившие ся кристаллы, промывают и х водой, и наконец концентрируют маточные растворы, отсасывают заново образовавшие ся кристаллы и промывают их водой. С ушат все кристаллы и перекристаллизуют их в мета ноле. Получают 1 г це левого продук та. ИК спектр: (CHCl3) Поглоще ния при 3485 см –1 : область ОН/NH, 2240 см –1 : C º N, 1628 и 1616 см –1 : С =О сопряженный. ЯМР спектр (CDCl3, 300 Мгц, чнм) 1,34 (S) : СН3 в 18; 1,50 (S) : СН3 в 19; 3,81 (d) : ОН в 11; 3,76 и 3,88 (-сист АВ) : СН2 в 21; 4,45 : Н в 11; 5,69 (S) : Н в 4; 7,18 : подвижной Н. Анализ: С22H29O4N (371,52) С% Н% N% Вычислено 71,12 7,86 3,77 Найдено 71,00 7,90 3,70 Стадия Б: 11b-гидрокси 17,20-эпокси 20-циано 21-метокси прегн-4-ен 3-он. Приготовляют эфир в 21 по способу, описанному в ста дии А примера 3, исхо дя из продукта, полученного в предыдущей стадии А. Стадия В: 11b, 17a-дигидрокси 21-метокси прегн-4-ен 3,20-дион Исходят из продукта, полученного в предыдущей стадии Б, либо, как это указано в стадии Б примера 3, выделяя промежуточно 11b-гидрокси 17,20-эпокси 20-карбамоил 21-метокси прегн-4-ен 3-он, а затем обрабатывая это соединение раствором гипохлорита натрия по принципу разложения Гофманна, либо, как это указано в стадии В примера 3, т.е. проделывая это разложение без выделения промежуточного соединения 20-карбамоила. Получают целевой продукт, такой же как и тот который получен в стадии В примера 5. –1 Тираж 50 екз. Відкрите акціонерне товариство «Патент» Україна, 88000, м. Ужгород, вул. Гагаріна, 101 (03122) 3 – 72 – 89 (03122) 2 – 57 – 03 11
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of i 17,20-epoxypregnane, a process for obtaining thereof, a process for obtaining derivatives of cortisone and intermediary compounds
Автори англійськоюJean Buandia, Remi Shovin, Michel Viva
Назва патенту російськоюПроизводные 17,20-эпоксипрегнана, способ их получения, способ получения производных кортизона и промежуточные соединения
Автори російськоюЖан Бюандиа, Реми Шовен, Мишель Вива
МПК / Мітки
МПК: C07J 75/00, C07J 5/00, C07J 41/00, C07J 7/00, C07J 21/00
Мітки: кортизону, 17,20-епоксипрегнану, сполуки, проміжні, спосіб, одержання, похідні, похідних
Код посилання
<a href="https://ua.patents.su/11-40574-pokhidni-1720-epoksipregnanu-sposib-kh-oderzhannya-sposib-oderzhannya-pokhidnikh-kortizonu-i-promizhni-spoluki.html" target="_blank" rel="follow" title="База патентів України">Похідні 17,20-епоксипрегнану, спосіб їх одержання, спосіб одержання похідних кортизону і проміжні сполуки</a>
Попередній патент: Похідні 2-ціано-3-гідроксипропенаміду, спосіб їх одержання (варіанти) та фармацевтична композиція на їх основі
Наступний патент: Гідразид 1н-індол-3-оцтової кислоти (варіанти) як інгібітор spla2 та фармацевтична композиція
Випадковий патент: Гідростатичний гранулятор