Похідні еритроміцину, спосіб їх одержання, фармацевтична композиція на їх основі та аміни як проміжні сполуки
Номер патенту: 51618
Опубліковано: 16.12.2002
Автори: Агурідас Константін, Гуен Д'Амбрієр Солянж, Ле Мартре Оділь, Дені Алексіс, Шанто Жан-Франсуа
Формула / Реферат
1. Производные эритромицина формулы (I):
, (І)
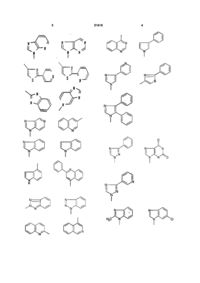
в которой R представляет радикал , в котором n представляет число 3, 4 или 5 и Ar представляет гетероциклический радикал, несущий, в случае необходимости, один или несколько заместителей, представляющих собой алкил, алкокси, трифторметокси или галоген, и выбираемый в группе радикалов:
и Z представляет атом водорода или остаток кислоты, а также их соли присоединения с кислотами.
2. Соединения формулы (I) по пункту 1, в которых Z представляет атом водорода.
3. Соединения формулы (I) по п. 1 или 2, в которых n представляет число 4.
4. Соединения формулы (I) по любому из пп. 1, 2 или 3, в которых Аr представляет радикал
,
в случае необходимости замещенный.
5. Соединения формулы (I) по любому из пп. 1, 2 или 3, в которых Аr представляет радикал:
,
в случае необходимости замещенный.
6. Соединения формулы (I) по любому из пп. 1, 2 или 3, в которых Аr представляет радикал:
или
, или
,
в случае необходимости замещенный.
7. Соединения формулы (I) по любому из пп. 1, 2 или 3, в которых Аr представляет радикал:
,
в случае необходимости замещенный.
8. Соединения формулы (I) по п. 1, представляющие собой следующие соединения:
11,12-дидеокси-3-де((2,6-дидеокси-3-С-метил-3-O-метил-альфа-L-рибогексопиранозил)окси)-6-O-метил-3-оксо-12,11-(оксикарбонил((4-(4-фенил-1Н-имидазол-1-ил)бутил)имино))эритромицин,
11,12-дидеокси-3-де((2,6-дидеокси-3-С-метил-3-O-метил-альфа-L-рибогексопиранозил)окси)-6-O-метил-3-оксо-12,11-(оксикарбонил((4-(3Н-имидазо[4,5-b]пиридин-3-ил)бутил)имино))эритромицин,
11,12-дидеокси-3-де((2,6-дидеокси-3-С-метил-3-O-метил-альфа-L-рибогексопиранозил)окси)-6-O-метил-3-оксо-12,11-(оксикарбонил((4-(1Н-имидазо[4,5-b]пиридин-1-ил)бутил)имино))эритромицин,
11,12-дидеокси-3-де((2,6-дидеокси-3-С-метил-3-O-метил-альфа-L-рибогексопиранозил)окси)-6-O-метил-3-оксо-12,11-(оксикарбонил((4-(4-(4-хлорфенил)-1Н-имидазол-1-ил)бутил)имино))эритромицин,
11,12-дидеокси-3-де((2,6-дидеокси-3-С-метил-3-O-метил-альфа-L-рибогексопиранозил)окси)-6-O-метил-3-оксо-12,11-(оксикарбонил((4-(4-(2-метоксифенил)-1Н-имидазол-1-ил)бутил)имино))эритромицин,
11,12-дидеокси-3-де((2,6-дидеокси-3-С-метил-3-O-метил-альфа-L-рибогексопиранозил)окси)-6-O-метил-3-оксо-12,11-(оксикарбонил((4-(4-(4-фторфенил)-1Н-имидазол-1-ил)бутил)имино))эритромицин,
11,12-дидеокси-3-де((2,6-дидеокси-3-С-метил-3-O-метил-альфа-L-рибогексопиранозил)окси)-6-O-метил-3-оксо-12,11-(оксикарбонил((4-(7-метокси-4-хинолинил)бутил)имино))эритромицин,
11,12-дидеокси-3-де((2,6-дидеокси-3-С-метил-3-O-метил-альфа-L-рибогексопиранозил)окси)-6-O-метил-3-оксо-12,11-(оксикарбонил((4-(2-(2-пиридинил)-4-тиазолил)бутил)имино))эритромицин,
11,12-дидеокси-3-де((2,6-дидеокси-3-С-метил-3-O-метил-альфа-L-рибогексопиранозил)окси)-6-O-метил-3-оксо-12,11-(оксикарбонил((4-(3-(3-пиридинил)-1Н-1,2,4-триазол-1-ил)бутил)имино))эритромицин.
9. Соединение формулы (1) по пункту 1, представляющее собой:
11,12-дидеокси-3-де((2,6-дидеокси-3-С-метил-3-O-метил-альфа-L-рибогексопиранозил)окси)-6-O-метил-3-оксо-12,11-(оксикарбонил)-((4-(4-(3-пиридинил)-1Н-имидазол-1-ил)бутил)имино))эритромицин.
10. Соединения формулы (I) по любому из пунктов 1-7 или их соли присоединения с фармацевтически приемлемыми кислотами в качестве лекарственного средства.
11. Соединения формулы (I) по пункту 8 или их соли присоединения с фармацевтически приемлемыми кислотами в качестве лекарственного средства.
12. Соединение формулы (I) по пункту 9 или его соль присоединения с фармацевтически приемлемыми кислотами в качестве лекарственного средства.
13. Фармацевтическая композиция, содержащая в качестве действующего начала, по меньшей мере, одно производное эритромицина по любому из пунктов 1-9.
14. Способ получения соединений формулы (I), определенных в пункте 1, отличающийся тем, что соединение формулы (II):
, (II)
в котором Z' обозначает остаток кислоты, подвергают взаимодействию с соединением формулы (III):
, (III)
в которой R имеет определенное в пункте 1 значение, с получением соединения формулы (ІА):
, (IА)
в которой R и Z' имеют указанное выше значение, затем в случае необходимости, соединение формулы (IА) подвергают действию агента снимающего защиту с гидроксила в положении 2’ и/или, в случае необходимости, действию кислоты с получением соли.
15. Амины формулы (III), в которой R имеет значение, указанное в пункте 1, в качестве промежуточных соединений синтеза, описанного в пункте 14.
16. Амины формулы (III) по пункту 15, которые представляют собой:
4-фенил-1Н-имидазол-1-бутанамин,
3Н-имидазо[4,5-b]пиридин-3-бутанамин,
1Н-имидазо[4,5-b]пиридин-1-бутанамин,
2-фенил-4-хинолинбутанамин,
1Н-бензотриазол-1-бутанамин,
2Н-бензотриазол-2-бутанамин,
1-метил-1Н-имидазо[4,5-с]пиридин-2-бутанамин,
3-метил-3Н-имидазо[4,5-с]пиридин-2-бутанамин,
5-хлор-1Н-бензоимидазол-1-бутанамин,
7-метоксихинолин-4-бутанамин,
1Н-имидазо[4,5-с]пиридин-1-бутанамин,
9Н-пурин-9-бутанамин,
1-метил-1Н-индол-4-бутанамин,
3-фенил-1Н-1,2,4-триазол-1-бутанамин(хлоргидрат),
5-фенил-1Н-тетразол-1-бутанамин(хлоргидрат),
2-бензотиазолбутанамин,
тиено[2,3-b]пиридин-4-ил-бутанамин,
5,6-диметил-1Н-бензимидазол-1-бутанамин,
3-хинолинбутанамин,
2-хинолинбутанамин,
5Н-имидазо[4,5-с]пиридин-5-бутанамин,
1-метил-1Н-бензимидазол-2-бутанамин,
6-хлор-1Н-бензимидазол-2-бутанамин,
2-метил-1Н-бензимидазол-2-бутанамин,
4-(4-хлорфенил)-1Н-имидазол-1-бутанамин,
2-(3-пиридинил)тиазол-5-бутанамин,
4-(4-фторфенил)-1Н-имидазол-1-бутанамин,
4-(2-метоксифенил)-1Н-имидазол-1-бутанамин,
3-(3-пиридинил)-1Н-1,2,4-триазол-1-бутанамин,
4-(3-пиридинил)-1Н-имидазол-1-бутанамин,
2-(2-пиридинил)тиазол-4-бутанамин,
2-фенилтиазол-4-бутанамин,
4-(4-метоксифенил)-1Н-имидазол-1-бутанамин,
изохинолин-4-бутанамин,
хиназолин-4-бутанамин,
4,5-дифенил-1Н-имидазол-1-бутанамин,
4-(3-метоксифенил)-1Н-имидазол-1-бутанамин,
4-(4-(трифторметокси)фенил)-1Н-имидазол-1-бутанамин,
1,2,3,6-тетрагидро-1,3-диметил-2,6-диоксо-7Н-пурин-7-бутанамин,
2-(4-пиридинил)тиазол-4-бутанамин,
1Н-индол-1-бутанамин,
2-(3-пиридинил)тиазол-4-бутанамин,
а также их соли присоединения с кислотами.
Текст
1 Производные эритромицина формулы (I) -Г • . /г\ О 00 (О в которой R 0 2 , (і) представляет ю радикал — ( С Н 2 ) П — А г , в котором п представляет число 3, 4 или 5 и Аг представляет гетероциклический радикал, несущий, в случае необходимости, один или несколько заместителей, представляющих собой С : — С б алкил, С : — С б алкокси, триф торметокси или галоген, и выбираемый в группе радикалов 51618 КX J \ \ N 0 N N H N C з і N N-CH2-CH2, 7,06 (t) >CH-F, 7,22 (m) CH—c — , 7,49 (S) H2 имидазола, 7,15 (S) H5 имидазола Пример 32 11,12-дидеокси-3-де((2,6-дидеокси-3-С-метил3-О-метил-альфа-І_-рибогексопиранозил) окси) 6О-метил-3-оксо-12,11-(оксикарбонил ((4-(7метокси-4-хинолинил)-бутил)имино))эритромицин Нагревают до 50°С в течение 53 часов 706мг исходного соединения примера 29 в 4мл ацетонитрила и 1,43г 4-7-МЄТОКСИХИНОЛИН-4бутанамина Оставляют до возвращения к комнатной -температуре, выливают в раствор гидрофосфата натрия (0,5М) , экстрагируют дихлорметаном, промывают водой, сушат, выпаривают растворитель, получают 1,09г продукта, ацетилированного в положении 2' Добавляют 10мл метанола, перемешивают в течение 16 часов, выпаривают растворитель, хроматографируют остаток на двуокиси кремния (элюант СН2СІ2-Ме0Н 95-5) и кристаллизуют из простого эфира Получают 295мг ожидаемого продукта Т пл«110°С ЯМР CDCI3 ппм 3 06 (ш) -(СН2)2-СНСН2-(СН2)з, 3,05 (t) CH2-NH2, 3,95 (S) O-CH3, 7,10 (d,J=4,5)-7,21 (dd)-7,92 (d)-8,71 (d,J=4,5) хинолин Пример 33 11,12-дидеокси-3-де((2,6-дидеокси-3-С-метил3-О-метил-альфа-І_-рибогексопиранозил) окси) 6О-метил-3-оксо-12,11-(оксикарбонил ((4-(2-(2пиридинил) 4-тиазолил) бутил) имино))эритромицин Нагревают при 60°С в течение 5 часов 705мг исходного соединения примера 29 (полученного как указано в примере 1С европейской заявки на патент ЕР О 596 802) в Змл ацетонитрила и 0,705г 2-(2-пиридинил)-тиазол)-4-бутанамина Оставляют до возвращения к комнатной температуре, выливают в воду, экстрагируют етилацетатом, промывают водой, сушат, выпаривают растворитель, получают 1,8г продукта, ацетилированного в положении 2' Добавляют 15мл метанола, нагревают до температуры кипения в течение 2 часов, выпаривают растворитель, хроматографируют остаток на двуокиси кремния (элюент CbbC 51618 28 95-5-0,3, затем AcOEt-TEA 9-1) и кристаллизуют из простого эфира Получают 194мг целевого продукта Т пл=157-159°С ЯМР (CDCI3) ппм 1 33 и 1,47 6 и 12 Me, 2,26 (S) N(CH3)2, 2,86 СН, -с (t) СН, 3,12 (q шир) -N С Ню, 3,60 (S) Н и, О 3,66 (m) ^ , 7,03 (S) Н5 тиазола, 7,27 (ddd) He, пиридина, 7,77 (d,t), H4 пиридина, 8,18 (dd) Нз пиридина, 8,53 (ddd) Нє пиридина Приготовление 2-(2-пиридинил) тиазол-4-бутанамина, используемого в качестве исходного в примере 33 Стадия А 2-аминокарбонилпиридин Прикалывают 50мл раствора диазометана (0,4М/л) в раствор, содержащий 2г пиколиновой кислоты, 20мл дихлорметана и 5мл метанола После 30 минут перемешивания при комнатной температуре выпаривают растворитель при пониженном давлении, хроматографируют остаток на двуокиси кремния (петролейный эфир (60-80)AcOEt 5-5) и рекуперируют 1,48г метилового эфира Нагревают до 50°С в течение 4 часов 1,42г сложного эфира в 5мл гидрата окиси аммония, оставляют до возвращения к комнатной температуре, экстрагируют простым эфиром, промывают водой, сушат, выпаривают растворитель и рекуперируют 1,05г ожидаемого продукта Т пл =105°С Стадия В 2-пиридинкарботиоамид Медленно добавляют 43г петнасульфида фосфора к 46,8г амида, полученного на стадии А, в 700мл тетрагидрофурана Перемешивают 4 часа при комнатной температуре, выливают в воду, экстрагируют простым эфиром, сушат и выпаривают растворитель при пониженном давлении После хроматографии на двуокиси кремния (элюант СНгСЬ-АсОЕ! 8-2) извлекают Юг ожидаемого продукта Т пл=137°С Стадия С 2-(2-пиридинил) 4-тиазолэтилкарбоксилат Прикалывают 16,3мл этилбромпирувата к 15,9г продукта, полученного как на стадии В, в 250мл этанола и нагревают 5 часов при рефлюксе Выпаривают растворитель при пониженном давлении, хроматографируют остаток на двуокиси кремния (элюант гексан-AcOEt 1-1) и получают 10,2г целевого продукта Т пл=69,1°С Стадия D 2-(2-пиридинил) 4-тиазолметанол Медленно добавляют 40мл метанола в смесь, содержащую 9,Зг сложного эфира, полученного на стадии С, и 4,1 г /боргидрида натрия в 100мл тетрагидрофурана и нагревают 2 часа при рефлюксе Оставляют до возвращения к комнатной температуре, выливают в воду, нейтрализуют при помощи 1 н соляной кислоты, экстрагируют дихлорметаном, сушат органическую фазу и выпаривают растворитель при пониженном давлении, хроматографируют остаток на двуокиси кремния 1 (элюант АсОЕЮНгСЬ 1-1) и получают 5,8г ожидаемо 29 го продуїсга Т пл =100°С Стадия Е 2-(2-пиридинил) 4-тиазолкарбоксальдегид Поддерживают 2 часа при рефлюксе 5,8г продуїсга, полученного на стадии D, в 60мл толуола в присутствии 13г описи марганца, фильтруют и выпаривают растворитель при пониженном давлении Получают 5г ожидаемого продуїсга Т пл =131 °С Стадия F (Z) 2-(4-(2-(2-пиридинил) тиазол)3-бутенил)1Низоиндол-1,3(2Н)-дион Работают как на стадии В приготовления примера 32, использую 5,70г альдегида, полученного на стадии Е, и 15,9г соли трифенилфосфония 3бромпропилфталимида и 3,70г третбутилата калия Получают 8,73г целевого продукта Т пл =139-141 °С Стадия G 2-(4-(2-(2-пиридинил) тиазол) бутил) 1Низоиндол 1,3(2Н)-дион Работают как на стадии С приготовления примера 32, используя в качестве исходного 7,22г продукта, полученного на стадии F, и 1,5г палладия на активированном угле, гидрогенируя 2 часа при 1800мбар Получают 6,33г целевого продукта Т пл =119-121 °С Стадия Н 2-(2-пиридинил) тиазол-4-бутанамин Работают как на стадии D приготовления примера 32, используя 5,45г продукта полученного выше на предыдущей стадии и 1,6мл гидразингидрата, и нагревают 6 часов при флегме Выпаривают растворитель, поглощают этилацетатом, промывают водой, сушат, выпаривают растворитель, хроматографируют остаток на двуокиси кремния (элюант CH2CI2-MeOH-NH4OH 9-1-0,03) и получают 1,65г ожидаемого продукта ЯМР (CDCI3) ппм 1,50 (гтО-1,82 (ш) центральные СН2, 2,76 (t)2,85 (t), СН2-С= и CH2-NH2, 7,85 (S) Н5 тиазола, 7,31 (m) H'5l 7,78 (dt) H'4, 8,18 л л ) Н'3, 3,61 (ddd) Н'6, 1,40(S), NH2 Пример 34 11,12-дидеокси-3-де((2,6-дидеокси-3-С-метил~ О-метил-альфа-І_-рибогексопиранозил) окси) 6-0метил-3-оксо 12,11-(оксикарбонил ((4-(4-(3пиридинил) 1Н-имидазол-1-ил)бутил) имино)) эритромицин Нагревают при 70°С в течение 20 часов 1г исходного соединения примера 29 в 4мл ацетонитрила и 936мг 4-(4-(3-пиридинил)-1Н-имидазол-1ил)бутанамина Оставляют до возвращения к комнатной температуре, выливают в воду, экстрагируют этилацетатом, промывают водой, сушат, выпаривают растворитель, получают 1,34г продукта, ацетилированного в положении 2' Добавляют туда 40мл метанола, перемешивают в течение 2 часов, выпаривают растворитель, хроматографируют остаток на двуокиси кремния (элюант CH2CI2-MeOH-NH4OH 95-5-0,4) и кристаллизуют из простого эфира Получают 310мг целевого продукта Т пл=187-188°С ЯМР (CDCI3) ппм 0,83 (t) СН3-СН2, 1,01 (сО-1,17 (d)-1,25 (d)-1,31 (d) 1,38 (d) СНз-СН, 1,34 (S)-1,47 (S) 6 и 12 Me, ЗО 51618 2,27 (S) N(Me)2, 2,45 (m) H'3, 2,62 (S) 6-OMe, 2,60 (m), H8, 2,85-3,25 H4 и Ню, Н'2, 3,52 (m) H'5, 3,56 NC (S) Ни, 3,60-3,85 (m) CH 2 , 4,23 (d) H5, 4,27 (d) H'i , 4,93 (dd) Н13 7,29 (ddd) H3 пиридина, 8,08 (dt) H4 пиридинила, 8,45 (dd) Нє пиридина, 8,97 (dd) H2 пиридина, 7,35 (d) и 7,53 (d) H2 и Hs имидазола Приготовление 4-(3-пиридинил) 1Нимидазол-1-бутанамина, используемого в качестве исходного в примере 34 Стадия А 2-(4-(3-пиридинил) 1 Н-имидазол-1 -ил) бутил1 Н-изоиндол-1,3(2Н)-дион Работают как на стадии А приготовления примера 1, используя 290мг З-пиридинил-1 Нимидазола, полученного как указано в J Спет Soc , 753-5 (1938), 115мг гидрида натрия и 633мг N-4-бромбутилфталимида Получают 277мг ожидаемого продукта Т пл=150-152°С Стадия В 4-(3-пиридинил) 1 Н-имидазол-1-бутанамин Работают как на стадии В приготовления примера 1, используя 1,66г продукта, полученного на стадии А, и 0,46мл гидразингидрата в 30мл этанола Получают 936мг продукта, используемого как таковой для синтеза ЯМР(СОСІз) ппм 1,49 (т)-1,89 (т) центральные СН2, 2,75 (t) СН, CH2-CH2-N, 4,01 (t) -СН, —° 7,29 (d,J=1)-7,55 (d,J=1) H2 и Н5, 7,30 (в замаскированной части) Н'5, 8,09 (d,J=8 и 2) Н'4, 8,47 (d,J=5 и 2) Н'6, 8,96 (d,j=2) H'2, 1,49 (S шир) «2Н подвижные Пример 35 11,12-дидеокси-3-де((2,6-дидеокси-3-С-метил3-О-метил-альфа-І_-рибогексопиранозил) окси) 6О-метил-3-оксо-12,11-(оксикарбонил ((4-(3-(3пиридинил) 1Н-1,2,4-триазол-1-ил) бутил) имино)) эритромицин Нагревают при 75°С в течение 8 часов 1г исходного соединения примера 29 в 4мл ацетонитрила и 1,21г 4-(3-(3-пиридинил)-1Н-1,2,4-триазол1-ил) бутанамина Оставляют до возвращения к комнатной температуре, выливают в воду, экстрагируют етилацетатом, промывают водой, сушат, выпаривают растворитель, получают 2г продукта, ацетилированного в положении 2' Добавляют 40мл метанола, перемешивают в течение 16 часов, выпаривают растворитель, хроматографируют остаток на двуокиси кремния (элюант СН 2 Cl2MeOH-NH4OH 90-10-0,04) и кристаллизуют из простого эфира Получают 292мг ожидаемого продукта Т пл=190-192°С ЯМР (CDCI3) ппм 0,84 (t) СН3-СН2, 1,01 (d) OMe, 1,16 (d) 8 Me, 1,25 (d) 5 Me, 1,30 (d) 4 Me, 1,34 (d) 2 Me, 1,33 (S) и 1,47 (S) 6 и 12 Me, 1,67 (m)-1,99 (m) центральные CH2, 2,26 (S) N (Me)2, 2,44 (m) H'3 2,58 (m) H8, 2,61 (S) 6-OMe, 3,06 (m) H4, 3,12 (q) Ню, 3,17 (dd) H'2, 3,52 (m) H'5 , 3,56 (S) Нц, 3,64 31 CHJSIC 3,75(-) CbLNC О 3,85 (q) H , около 4,25 2 32 51618 H'i , H5 и 4,91 (dd), His, 8,15 (S) H триазола 7,35 (dd) H5 пиридина, 8,34 (dt) ЬЦ пиридина, 8,62 (dd) Нб пиридина, 9,31 (d шир) ЬЬ пиридина Приготовление 3-(3-пиридинил)-1 Н-1,2,4триазол-1-бутанамина, используемого в качестве исходного в примере 35 Стадия А 2-(4-(3-(3-пиридинил)-1Н-1,2,4-триазол-1-ил) бутил 1Н-изоиндол-1,3(2Н)-дион Работают как на стадии А приготовления 1 примера 1, используя 2,1 г 3-пиридинил-1Н-1,2,4триазола, полученного как указано в J Org Chtm , (44) №33, 4160-4164 (1979), 1,02г гидрида натрия и 4,13г N-4-бромбутилфталимида Получают 2,4г целевого продукта Т пл=150-152°С Стадия В З-(З-пиридинил) 1Н-1,2,4-триазол-1-бутанамин (фу марат) Работают как на стадии В Приготовления 1 примера 1, испольузя 3,46г продукта, полученного на стадии А, и 1мл гидразингидрата в 50мл этанола Получают 2,1 г сырого продукта, который превращают в фумарат, как указано в приготовлении примера 30, и получают 1,13г фумарата ожидаемого продукта Т пл=190-192°С ЯМР (CDCI3) ппм 1,50 (гтО-2,01 (ш) центральные СН2, 2,76 (t) NH2-CH2 4,24 - N-N-CH2, 7,37 (ddd) H5, 8,35 (dt) Н4, 8,63 (dd) Н 6і 9,32 (dd) H2, 8,12 (S) =СН триазол Работают как указано выше, но используя соответствующие амины, получают следующие продукты Пример 36 11,12-дидеокси-3-де(2,6-дидеокси-3-С-метил3-О-метил-альфа-І_-риаогексопиранозил) окси) 6О-метил-3-оксо-12,11-(оксикарбонил ((4-(3хинолинил) бутил) имино)) эритромицин Т пл =190-192°С Пример 37 1112-дидеокси 3-де((2,6-дидеокси-3-С-метил3-О-метил-альфа-І_-рибогексопиранозил) окси) 6О-метил 3-оксо 12,11-(оксикарбонил ((4-(4-(4метоксифенил) 1Н-имидазол-1-ил) бутил) имино)) эритромицин F=152-154°C Пример 38 11,12-дидеокси 3-де((2,6-дидеокси-3-С-метил3-О-метил-альфа-І_-рибогексопиранозил) окси) 6О-метил 3-оксо 12,11-(оксикарбонил ((4-(2-фенил 4-тиазолил) бутил) имино)) эритромицин F=141143°С Пример 39 11,12-дидеокси 3-де((2,6-дидеокси-3-С-метил3-О-метил-альфа-І_-рибогексопиранозил) окси) 6О-метил 3-оксо 12,11-(оксикарбонил ((4-(4-(3метоксифенил) 1 Н-имидазол-1 -ил)бутил) амино)) эритромицин F=144-146°C Пример 40 11,12-дидеокси 3-де((2,6-дидеокси-3-С-метил3-О-метил-альфа-І_-рибогексопиранозил) окси) 6 О-метил 3-оксо 12,11-(оксикарбонил ((4-(4,5дифенил) 1 Н-имидазол-1-ил) бутил) имино)) эритромицин F=180-182°C Пример 41 11,12-дидеокси 3-де((2,6-дидеокси-3-С-метил3-О-метил-альфа-І_-рибогексопиранозил) окси) 6О-метил 3-оксо 12,11-(оксикарбонил ((4-(4хиназолинил) бутил) имино)) эритромицин F=212214°С Пример 42 11,12-дидеокси 3-де((2,6-дидеокси-3-С-метил3-О-метил-альфа-І_-рибогексопиранозил) окси) 6О-метил 3-оксо 12,11-(оксикарбонил ((4-(2-(4пиридинил) 4-тиазолил) бутил) имино)) эритромицин F=192-194°C Пример 43 11,12-дидеокси 3-де((2,6-дидеокси-3-С-метилЗ-О-метил-альфа-Ь-рибогексопиранозил) окси) 6О-метил 3-оксо 12,11-(оксикарбонил ((4-(1,2,3,6тетрагидро-1,3-диметил 2,6-диоксо 7Н-пурин-7-ил) бутил) имино)) эритромицин F=251-253°C Пример 44 11,12-дидеокси 3-де((2,6-3-С-метил-3-Ометил-альфа-І_-рибогесопиранозил) окси) 6-Ометил 3-оксо 12,11-(оксикарбонил ((4-(4-(4тр и фтор мето кс и) фенил) 1Н-имидазол-4-ил) бутил) имино)) эритромицин F=168-170°C Амины, используемые как исходные продукты, получают следующими методами А - Когда цепь связана с углеродом, например, можно исходить из соответствующих альдегидов ~ С И = С Й [ С Р ; ) , —Я Амины, используемые для получения продуктов примеров 4,8,11,12,18,19,23 и 24, получали этим способом В - Когда цепь связана с азотом, можно получать амины следующим способом Леї ЛН З Г І С Н , ) , — й, 33 Амины, используемые для получения продуктов примеров 1,2,3,5,9,13,14,15,16,17,20,21,22,25,26 и 28 получали этим способом С - Некоторые амины получают особым способом образуют гетероцикл и одновременно вводят цепь (примеры 6,7,10 и 27) Примеры фармацевтических составов Получали соединения, содержащие Продукт примера 1 150мг Эксципиент, в достаточно количестве 1г Части эксципиента крахмал, тальк, стеарат магния Продукт примера 2 150 мг Эксципиент, в достаточном количестве 1г Части эксципиента крахмал, тальк, стеарат магния Продукт примера 3 150 мг Эксципиент, в достаточно количестве 1г Prod u its Staphylococcus aureusO11UC4 Staphylococcus aureus011G025l Staphylococcus epidermidis 012G011I Streptococcus pyogenes groupe A 02A1UC1 Streptococcus agalactiae groupe В 02B1HT1 Streptococcus faecahs groupe D 02D2UC1 34 51618 Части эксципиента крахмал, тальк, стеарат магния Фармалогическое исследование продуктов по изобретению Метод растворения в жидкой среде Приготовляют серию пробирок, в которые помещают одинаковое количество стерильной питательной среды лРаспределяют в каждую пробирку возрастающие количества исследуемого продукта, затем каждую пробирку засевают бактерийным штаммом После инкубации в течение 24 часов в сушильном шкафу при 37ЛС оценивают торможение роста просвечиванием, которое позволяет определять минимальные концентрации торможения (С М I) , выраженные в микрограмм/см3 Были получены следующие результаты Штаммы грам положительных бактерий Пр1 Пр 2 ПрЗ Пр 29 Пр31 Пр 32 Пр 34 Пр 35 0,04 0,04 0,08 0,04 0,04 0,08 0,04 0,08 0,08 0,15 0,15 0, 15 0,08 0, 15 0,08 06 0,08 0,04 0,15 0,04 0,4 0,08 0,04 0,04
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of erythromycin, a method of their producing, a pharmaceutic composition on their base and amines as intermediate compounds
Автори англійськоюChanto Jean-Francois, Denis Alexis
Назва патенту російськоюПроизводные эритромицина, способ их получения, фармацевтическая композиция на их основе и амины как промежуточные соединения
Автори російськоюШАНТО Жан-Франсуа, Дени Алексис
МПК / Мітки
МПК: A61K 31/7048, A61K 31/04, C07H 17/08
Мітки: аміни, основі, проміжні, фармацевтична, композиція, еритроміцину, сполуки, одержання, спосіб, похідні
Код посилання
<a href="https://ua.patents.su/18-51618-pokhidni-eritromicinu-sposib-kh-oderzhannya-farmacevtichna-kompoziciya-na-kh-osnovi-ta-amini-yak-promizhni-spoluki.html" target="_blank" rel="follow" title="База патентів України">Похідні еритроміцину, спосіб їх одержання, фармацевтична композиція на їх основі та аміни як проміжні сполуки</a>
Попередній патент: Похідні піразолу, проміжні сполуки для їх одержання та гербіцид на їх основі
Наступний патент: Спосіб переробки цукру-сирцю на сироп
Випадковий патент: Люнет