Фармацевтична композиція, що містить кристалічний напівгідрат метансульфонату сибутраміну
Номер патенту: 76913
Опубліковано: 15.09.2006
Автори: Лі Гван-Сун, Лі Дзає-Хеон, Чанг Янг-Кіл, Лі Дзає-Чеол, Кім Хан-Кіунг, Парк Га-Сеунг
Формула / Реферат
1. Фармацевтична композиція для лікування або профілактики ожиріння, яка містить кристалічний напівгідрат метансульфонату сибутраміну формули (І)
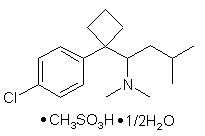 (I).
(I).
2. Фармацевтична композиція за п.1, в якій ![]() величини основних піків спектра рентгенівської дифракції кристалічного напівгідрату метансульфонату сибутраміну мають наступні значення:
величини основних піків спектра рентгенівської дифракції кристалічного напівгідрату метансульфонату сибутраміну мають наступні значення:
8,2±0,2, 10,8±0,2, 11,7±0,2, 12,0±0,2, 12,3±0,2, 15,8±0,2, 16,4±0,2, 17,4±0,2, 17,8±0,2, 19,0±0,2, 21,2±0,2, 21,9±0,2, 22,2±0,2, 22,8±0,2, 23,3±0,2, 24,4±0,2, 24,9±0,2, 25,3±0,2, 25,6±0,2 і 26,8±0,2.
3. Фармацевтична композиція за пп.1 або 2, що додатково містить фармацевтично прийнятний носій, розріджувач або наповнювач.
4. Фармацевтична композиція за п.1, в якій кристалічний напівгідрат метансульфонату сибутраміну формули (І) присутній в кількості 1-50 мг.
5. Кристалічний напівгідрат метансульфонату сибутраміну формули (І)
 (I).
(I).
6. Кристалічний напівгідрат метансульфонату сибутраміну формули (І) за п. 5, в якому ![]() величини основних піків спектра рентгенівської дифракції мають наступні значення:
величини основних піків спектра рентгенівської дифракції мають наступні значення:
8,2±0,2, 10,8±0,2, 11,7±0,2, 12,0±0,2, 12,3±0,2, 15,8±0,2, 16,4±0,2, 17,4±0,2, 17,8±0,2, 19,0±0,2, 21,2±0,2, 21,9±0,2, 22,2±0,2, 22,8±0,2, 23,3±0,2, 24,4±0,2, 24,9±0,2, 25,3±0,2, 25,6±0,2 і 26,8±0,2.
7. Спосіб отримання кристалічного напівгідрату метансульфонату сибутраміну вказаного в пп.5 або 6, при якому здійснюють взаємодію сибутраміну формули (II) з метансульфокислотою, розчиненою в суміші органічного розчинника і води
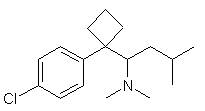 (II).
(II).
8. Спосіб за п.7, в якому метансульфокислоту використовують в кількості 1-2 мольних еквівалентів з розрахунку на 1 моль сибутраміну формули (II).
9. Спосіб за п.7, в якому воду використовують в кількості 0,5-5 мольних еквівалентів з розрахунку на 1 моль сибутраміну формули (II).
10. Спосіб за п.7, в якому органічний розчинник являє собою складний ефір, вибраний з групи, що складається з етилацетату, н-пропілацетату, ізопропілацетату і н-бутилацетату; простий ефір, вибраний з групи, що складається з діетилового ефіру, діізопропілового ефіру і трет-бутилметилового ефіру; кетон, вибраний з групи, що складається з ацетону, метилетилкетону; або їх суміші.
11. Спосіб отримання кристалічного напівгідрату метансульфонату сибутраміну, вказаного в пп.5 або 6, при якому здійснюють
(і) взаємодію сибутраміну формули (II)
 (II)
(II)
з метансульфокислотою в середовищі безводного органічного розчинника з утворенням безводного метансульфонату сибутраміну формули (III)
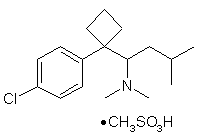 (III); і
(III); і
(іі) контактування метансульфонату формули (III) з водою в середовищі органічного розчинника.
12. Спосіб за п.11, в якому метансульфокислоту використовують в кількості 1-2 мольних еквіваленти з розрахунку на 1 моль сибутраміну формули (II).
13. Спосіб за п.11, в якому воду використовують в кількості 0,5-5 мольних еквівалентів з розрахунку на 1 моль безводного метансульфонату сибутраміну формули (III).
14. Спосіб за п.11, в якому безводний органічний розчинник на стадії (і) являє собою складний ефір, вибраний з групи, що складається з етилацетату, н-пропілацетату, ізопропілацетату і н-бутилацетату; кетон, вибраний з групи, що складається з ацетону, метилетилкетону і метилізобутилкетону; і простий ефір, вибраний з групи, що складається з етилового ефіру, ізопропілового ефіру і трет-бутилметилового ефіру, толуолу; або їх суміші.
15. Спосіб за п.11, в якому органічний розчинник на стадії (іі) являє собою складний ефір, вибраний з групи, що складається з етилацетату, н-пропілацетату, ізопропілацетату і н-бутилацетату; простий ефір, вибраний з групи, що складається з діетилового ефіру, діізопропілового ефіру і трет-бутилметилового ефіру; кетон, вибраний з групи, що складається з ацетону, метилетилкетону і метилізобутилкетону; або їх суміші.
16. Застосування кристалічного напівгідрату метансульфонату сибутраміну формули (І)
 (I)
(I)
для виробництва лікарського засобу, призначеного для лікування або профілактики ожиріння.
Текст
1. Фармацевтична композиція для лікування або профілактики ожиріння, яка містить кристалічний напівгідрат метансульфонату сибутраміну формули (І) 2 3 76913 4 11. Спосіб отримання кристалічного напівгідрату 14. Спосіб за п.11, в якому безводний органічний метансульфонату сибутраміну, вказаного в пп.5 розчинник на стадії (і) являє собою складний ефір, або 6, при якому здійснюють вибраний з групи, що складається з етилацетату, (і) взаємодію сибутраміну формули (II) н-пропілацетату, ізопропілацетату і нбутилацетату; кетон, вибраний з групи, що складається з ацетону, метилетилкетону і метилізобутилкетону; і простий ефір, вибраний з групи, що склаN дається з етилового ефіру, ізопропілового ефіру і Cl (II) трет-бутилметилового ефіру, толуолу; або їх суз метансульфокислотою в середовищі безводного міші. органічного розчинника з утворенням безводного 15. Спосіб за п.11, в якому органічний розчинник метансульфонату сибутраміну формули (III) на стадії (іі) являє собою складний ефір, вибраний з групи, що складається з етилацетату, нпропілацетату, ізопропілацетату і н-бутилацетату; простий ефір, вибраний з групи, що складається з N Cl діетилового ефіру, діізопропілового ефіру і третCH3SO3H (III); і бутилметилового ефіру; кетон, вибраний з групи, (іі) контактування метансульфонату формули (III) з що складається з ацетону, метилетилкетону і меводою в середовищі органічного розчинника. тилізобутилкетону; або їх суміші. 12. Спосіб за п.11, в якому метансульфокислоту 16. Застосування кристалічного напівгідрату метавикористовують в кількості 1-2 мольних еквіваленнсульфонату сибутраміну формули (І) ти з розрахунку на 1 моль сибутраміну формули (II). 13. Спосіб за п.11, в якому воду використовують в N Cl кількості 0,5-5 мольних еквівалентів з розрахунку CH3SO3H 1/2H2O на 1 моль безводного метансульфонату сибутра(I) міну формули (III). для виробництва лікарського засобу, призначеного для лікування або профілактики ожиріння. Даний винахід відноситься до фармацевтичної композиції, призначеної для лікування або профілактики ожиріння, що включає кристалічний напівгідрат кислотно-адитивної солі сибутраміну. Сибутрамін, Ν,Ν-диметил-1-[(1-(4-хлорфеніл)циклобутил]-3-метилбутиламін формули (II) риду сибутраміну в фармацевтичній композиції виявляється важким. Для розв'язання вказаних проблем був розроблений негігроскопічний моногідрат гідрохлориду сибутраміну формули (IV) [див. GB Patent №2184122 і Korean Patent Publication №94-08913], призначений для лікування ожиріння. (II) може використовуватися для профілактики або лікування депресії, хвороби Паркінсона і ожиріння [див. GB Patent №2098602, Korean Patent Publication Nos.90-00274 і 99-164435, а також International Publication №WO 88/06444]. Крім цього, сибутрамін може використовуватися для зниження резистентності до інсуліну і підвищення резистентності до цукру, а також для профілактики або лікування таких захворювань як подагра, гіперурикемія, гіперліпемія, остеоартрит, стан тривоги, розлад сну, сексуальні порушення, синдром хронічної втоми і холелітіаз [див. US Patent Nos.6174925, 5459164, 6187820, 6162831, 6232347, 6355685, 6365631, 6376554, 6376551 і 6376552]. Оскільки сибутрамін має низьку температуру плавлення з фармацевтичною метою його використовують у вигляді кислотно-адитивної солі. [У GB Patent №2098302 і Korean Patent Publication No.90-00274] розкриваються способи отримання сибутраміну і його безводного гідрохлориду як фармацевтично застосовної кислотноадитивної солі. Однак, безводний гідрохлорид сибутраміну являє собою високогігроскопічну сполуку. Відповідно використання безводного гідрохло (IV) Однак, моногідрат гідрохлориду сибутраміну формули (IV), призначений для лікування ожиріння, наприклад, Meridia і Reductil, володіє відносно низькою розчинністю у воді, наприклад, 2,9мг/мл при рН5,2, що не задовольняє нижчій межі бажаної розчинності активного інгредієнта фармацевтичної композиції [див. Merck Index, 13th Ed, p.1522]. Відповідно, є потреба в розробці нової солі або гідрату кристалічного сибутраміну, придатного для використання в фармацевтичній композиції. Автори даного винаходу зробили спробу розробки напівгідрату метансульфонату сибутраміну, що володіє високою розчинністю у воді і є негігроскопічною речовиною, стійкою в умовах високих температур і високій вологості. Таким чином, мета даного винаходу полягає в створенні фармацевтичної композиції, призначеної для лікування або профілактики ожиріння, що включає кислотно-адитивну сіль сибутраміну, що володіє високою розчинністю у воді і стійкістю в умовах високих температур і високій вологості. Іншою метою даного винаходу є розробка спо 5 76913 6 собу отримання вказаної речовини. ють до субстрату, який може являти собою чистий Вказані вище і інші цілі даного винаходу стасибутрамін або його розчин в органічному розчиннуть очевидними з спільного розгляду наведеного нику. нижче опису винаходу і прикладених малюнків, що Як органічний розчинник може використовувавідповідно зображають наступне: тися простий ефір, складний ефір, кетон або їх Фіг.1-3: спектри порошкової рентгенівської суміш. Складний ефір може вибиратися з групи, дифракції кристалічного напівгідрату метансульщо складається з етилацетату, н-пропілацетату, фонату сибутраміну формули (І) даного винаходу, ізопропілацетату і н-бутилацетату; простий ефір безводного метансульфонату сибутраміну формуможе бути вибраний з групи, що складається з ли (II) і моногідрату метансульфонату сибутраміну діетилового ефіру, діізопропілового ефіру і третформули (IV), відповідно; бутилметилового ефіру; а кетон може бути вибраФіг.4 і 5: термограми диференціальної скануюний з групи, що складається з ацетону, метилетилчої калориметрії кристалічного напівгідрату метанкетону, і метилізобутилкетону. У тому випадку, сульфонату сибутраміну формули (І) даного винаколи використовують суміш кетону і простого ефіходу і безводного метансульфонату сибутраміну ру, співвідношення між кетоном і простим ефіром, формули (II), відповідно. переважно, становить 1:0,5-1:1,5, більш переважДаний винахід розкриває фармацевтичну комно, 1:2-1:3. позицію для лікування або профілактики ожиріння, У способі, що розглядається, вода може викояка містить новий кристалічний напівгідрат метанристовуватися в кількості 0,5-5 мольних еквіваленсульфонату сибутраміну формули (І), що володіє тів з розрахунку на 1моль сибутраміну формули високою розчинністю у воді і високою стабільністю (II), а реакцію проводять при температурі в інтерв умовах підвищеної вологості/температури. валі від 0°С до температури кипіння розчинника, переважно при 15-35°С, протягом 0,5-5 годин після додання метансульфокислоти. Згідно з іншим аспектом винаходу, кристаліч(I) ний напівгідрат метансульфонату сибутраміну формули (І) може бути отриманий (і) взаємодією сибутраміну формули (II) з метансульфокислотою Крім цього, даний винахід представляє крисв середовищі безводного органічного розчинника з талічний напівгідрат метансульфонату сибутраміутворенням безводного метансульфонату сибутну формули (І), а також спосіб його отримання. раміну формули (III); і (іі) взаємодією метансульЯкщо не обумовлено особливо, то термін «сифонату сибутраміну формули (III) з водою в серебутрамін», що використовується в тексті опису, довищі органічного розчинника (далі «спосіб 2»). відноситься до рацемічного сибутраміну. Кристалічний напівгідрат метансульфонату сибутраміну формули (І) володіє високою розчинністю у воді, стійкістю в умовах високої вологості/температури і є негігроскопічною речовиною, що робить його придатною сполукою для використання в фармацевтичній композиції. У рентгенограмі кристалічного напівгідрату метансульфонату сибутраміну формули (І) даного винаходу спостерігаються основні піки з наступними значеннями 2 : 8,2±0,2, 10,8±0,2, 11,7±0,2, 12,0±0,2, 12,3±0,2, 15,8±0,2, 16,4±0,2, 17,4±0,2, 17,8±0,2, 19,0±0,2, 21,2±0,2, 21,9±0,2, 22,2±0,2, 22,8±0,2, 23,3±0,2, 24,4±0,2, 24,9±0,2, 25,3±0,2, 25,6±0,2 і 26,8±0,2. Даний винахід також представляє два способи отримання кристалічного напівгідрату метансульфонату сибутраміну формули (І). Згідно з першим аспектом винаходу, кристалічний напівгідрат метансульфонату сибутраміну формули (І) може бути отриманий взаємодією сибутраміну формули (II) з розчином метансульфокислоти в суміші органічного розчинника з водою (далі в тексті, «спосіб 1»). (II) Згідно з способом 1, метансульфокислота може використовуватися в кількості 1-2 мольних еквівалента, переважно 1-1,2 мольних еквівалента, з розрахунку на 1 моль сибутраміну формули (II). Звичайно, метансульфокислоту по краплях дода (II) (III) У способі 2 метансульфокислоту можна використати в кількості 1-2 мольних еквіваленти, переважно 1-1,2 мольних еквіваленти з розрахунку на 1моль сибутраміну формули (II). Звичайно метансульфокислоту по краплях додають до чистого сибутраміну формули (II) або його розчину в органічному розчиннику. Як органічний розчинник може використовуватися складний ефір, кетон, простий ефір, толуол або їх суміш. Складний ефір може вибиратися з групи, що складається з етилацетату, нпропілацетату, ізопропілацетату, і н-бутилацетату; кетон вибирають з групи, що складається з ацетону, метилетилкетону і метилізобутилкетону; простий ефір вибирають з групи, що складається з етилового ефіру, ізопропілового ефіру і третбутилметилового ефіру. У тому випадку, коли органічний розчинник являє собою суміш кетону і простого ефіру, співвідношення між кетоном і простим ефіром, переважно, становить 1:0,5-1:1,5, більш переважно, 1:2-1:3. У способі 2 вода може використовуватися в кількості 0,5-5 мольних еквівалентів з розрахунку на 7 76913 8 1 моль сибутраміну формули (II), а реакцію прововикористанням такої домішки, як носій, розріджудять при температурі в інтервалі від 0°С до темпевач і наповнювач. ратури кипіння розчинника, переважно при 15Переважна ефективна кількість кристалічного 35°С, протягом 0,5-5 годин після додання метаннапівгідрату метансульфонату сибутраміну форсульфокислоти. Переважно, щоб безводний метамули (І) в фармацевтичній композиції даного винансульфонат сибутраміну формули (III) взаємодіяв ходу становить 1-50 масових частин з розрахунку з водою протягом часу від 2 годин до 5 днів. на 250 масових частин композиції. Кристалічний напівгідрат метансульфонату Так, наприклад, може бути отримана фармасибутраміну формули (І), отриманий 1-им або 2-им цевтична композиція, що містить 10мг кристалічноспособом, володіє високою розчинністю у воді, не го напівгідрату метансульфонату сибутраміну фоє гігроскопічним матеріалом і характеризується рмули (І), 115мг кристалічної целюлози, 115мг високою стійкістю в умовах високої вологослактози, 5мг діоксиду кремнію і 5мг стеарату магті/температури. нію. Однак потрібно мати на увазі, що реально Було проведене порівняльне дослідження з застосовувану кількість активного інгредієнта виметою з'ясування можливості отримання кристалізначають з урахуванням релевантних факторів, які чного напівгідрату метансульфонату сибутраміну з включають стан пацієнта, його вік і масу, а також енантіомерів сибутраміну, (+)- і (-)- сибутраміну. тяжкість симптомів захворювання; в зв'язку з чим Однак було встановлено, що кристалічний напівгівказане вище дозування композиції жодним чином драт метансульфонату сибутраміну не може бути не розглядаються, як обмежуючі сферу винаходу. отриманий з (+)- і (-)-сибутраміну. Кристалічний напівгідрат метансульфонату Було проведено спеціальне дослідження, сибутраміну даного винаходу може використовуспрямоване на з'ясування можливості отримання ватися для лікування або профілактики ожиріння. кристалічного напівгідрату метансульфонату сибуНаступні нижче приклади, що не обмежують траміну з (+) - і (-)-сибутраміну, виділеного з рацесферу винаходу, приведені для додаткової його мічного сибутраміну. Рацемічний сибутрамін піділюстрації. давали оптичному розщепленню з отриманням (+)Препаративний приклад 1: і (-)- сибутраміну у відповідності до способу, [опиОтримання моногідрату гідрохлориду сибутсаного в US Patent Publication US раміну формули (IV) No.2002/0006963, 2002/0006964 або International Безводний гідрохлорид сибутраміну отримуPatent publication No.WO 00/10551]. Після цього як вали за способом, [описаним в GB Patent (+)-, так і (-)-сибутрамін піддавали обробці згідно з No.2098602, або Korean Patent Publication No.90способом даного винаходу з метою встановлення 00274], і 10г отриманого продукту розчиняли в киможливості отримання з них кристалічного напівгіплячій суміші ацетону (110мл) і води (1,2мл), фільдрату метансульфонату. трували в гарячому стані і переганяли з метою Було встановлено, що спосіб даного винаходу концентрації фільтрату у відповідності до способу, не забезпечує отримання кристалічного напівгід[розкритого в GB Patent No.2184122 або Korean рату метансульфонату з (-)- або (+)- сибутраміну. Patent Publication No.94-08913]. Відповідно, фахівцеві в даній галузі важко заздаОтриманий концентрат охолоджували і фільтлегідь передбачити можливість отримання кристарували з утворенням кристалів, які сушили у вакулічного напівгідрату метансульфонату сибутраумі з отриманням 9,2г вказаної в заголовку сполуміну. ки (Вихід: 87%). Даний винахід представляє фармацевтичну Препаративний приклад 1: композицію для лікування ожиріння і споріднених Отримання моногідрату гідрохлориду сибутзахворювань, що містить як активний інгредієнт раміну формули (І) способом 1 кристалічний напівгідрат метансульфонату сибут1-1) Методика 1 раміну формули (І) і фармацевтично застосовний 30,0г сибутраміну формули (II) розчиняли в носій, розріджувач, наповнювач або інші домішки. 120мл ізопропілацетату, додавали 1,94мл води, Переважну фармацевтичну композицію даного після чого по краплях додавали 10,9г метансульвинаходу застосовують у вигляді пероральної рефокислоти. Реакційну суміш перемішували протяцептури в формі таблетки або капсули. гом 1 години, охолоджували до 0°С, знов переміТаблетки можуть бути приготованізмішуваншували протягом 2 годин і потім фільтрували з ням активного інгредієнта з носієм, розріджувачем утворенням кристалів. Отримані кристали посліабо наповнювачем. Прикладами носія, наповнюдовно промивали 30мл ізопропілацетату і 30мл вача і розріджувача, що використовується в фарізопропілового ефіру, і потім сушили при 50°С з мацевтичній композиції даного винаходу, може отриманням 38,46г вказаної в заголовку сполуки у служити дезінтегратор (наприклад, крохмаль, цувигляді білої твердої речовини (Вихід: 92,5%). кор і маніт); наповнювач або розріджувач (наприТемпература плавлення: 164~165°С (усадка клад, фосфат кальцію і похідні силікату); зв'язуюча приблизно при 130°С). речовина (наприклад, карбоксиметилцелюлоза і її Вміст води: 2,35% (теоретичне значення: похідні, желатин, і полівінілпіролідон); а також ма2,34%); і 1 стильний матеріал (наприклад, тальк, стеарат каH-ЯМР (δ, DMSO-d6): 8,5 (1H, уш.с), 7,7-7,2 льцію і стеарат магнію, а також поліетиленглі(4Н, дд), 3,7 (1Н, т), 2,8 (3Н, д), 2,5 (2Н, д), 2,4 (3Н, коль(лі)). с), 2,3 (2Н, д), 2,1 (3Н, д), 1,9 (1H, м), 1,7-1,6 (2Н, У відповідності до традиційного способу, тверм), 1,3 (2Н, т), 1,0 (6H, т). ді або м'які капсули, що містять активний інгреді1-2) Методика 2 єнт, можуть бути виготовлені за відсутності або з 10,0г сибутраміну формули (II) розчиняли в 9 76913 10 суміші з 40мл етилацетату і 40мл третбутилметистановив 2,27% (теоретичне значення: 2,34%), лового ефіру, додавали 0,97мл води, після чого по причому його температура кипіння і спектр 1H-ЯМР краплях додавали 3,8г метансульфокислоти. Реабули такими ж, що і в методиці 2-1-1). кційну суміш перемішували протягом 1 години, 2-2) Отримання напівгідрату метансульфонату охолоджували до 0°С, знов перемішували протясибутраміну формули (І) (стадія 2 способу 2) гом 2 годин і потім фільтрували з утворенням кри2-2-1) Методика 1 сталів. Отримані кристали послідовно промивали 5,0г безводного метансульфонату сибутраміну 30мл ізопропілацетату і 30мл ізопропілового ефіформули (III), отриманого за будь-яким з пунктів 2ру, і потім сушили при 50°С з отриманням 12,1г 1-1) або 2-1-3), розчиняли в суміші з 50мл ефіру і вказаної в заголовку сполуки у вигляді білої твер25мл ацетону, після чого додавали 0,72мл води. дої речовини (Вихід: 88%). Отриманий продукт Реакційну суміш перемішували протягом 18 годин містив 2,38% води (теоретичне значення: 2,34%), при кімнатній температурі і потім фільтрували з мав ту ж температуру плавлення і той же спектр утворенням кристалів. Отримані кристали проми1 H-ЯМР, що приведені в методиці 1-1). вали 10мл суміші з ефіру і ацетону (2:1, об./об.), 1-3) Методика 3 сушили при 50°С з отриманням 3,89г вказаної в 11,7г вказаної в заголовку сполуки отримували заголовку сполуки у вигляді білого твердого матеповторенням методики, описаної вище в 1-2) (виріалу (вихід: 16%). Вміст води в отриманій сполуці хід: 85%) за винятком того, що використали 30мл становив 2,30% (теоретичне значення: 2,34%), ацетону і 60мл трет-бутилметилового ефіру запричому її температура кипіння і мість 40мл етилацетату і 40мл третбутилметило10 спектр Н-ЯМР були такими ж, що спостерівого ефіру. Вміст води у вказаній в заголовку спогалися вище в 1-1). луці становив 2,27% (Теоретичне значення: 2-2-2) Методика 2 2,34%), причому його температура кипіння і спектр 10,0г безводного метансульфонату сибутрамі1 H-ЯМР були такими ж, що і в методиці 1-1). ну формули (III), отриманого за будь-яким з пунктів Приклад 2: 2-1-1) або 2-1-3), розчиняли в суміші з 100мл ефіру Отримання напівгідрату метансульфонату сиі 40мл метилізобутилкетону, після чого в суміш бутраміну формули (І) способом 2 додавали 1,44мл води. Реакційну суміш перемішу2-1) Отримання безводного метансульфонату вали протягом 24 годин при кімнатній температурі сибутраміну формули (III) (стадія 1 способу 2) і потім фільтрували з утворенням кристалів. Отри2-1-1) Методика 1 мані кристали промивали 30мл суміші з ефіру і 10,0г сибутраміну формули (II) розчиняли в метилетилкетону (2:1, об./об.), сушили при 50°С з 70мл ацетону і потім, при кімнатній температурі по використанням теплого повітря з отриманням 7,5 г краплях додавали 3,75г метансульфокислоти. Ревказаної в заголовку сполуки у вигляді білого твеакційну суспензію перемішували протягом 1 годирдого матеріалу (вихід: 73%). Вміст води в отрини, охолоджували до 0°С, знов перемішували проманій сполуці становив 2,32% (теоретичне значентягом 2 годин і потім фільтрували з утворенням ня: 2,34%), причому його температура кипіння і кристалів. Отримані кристали промивали 30мл спектр 1Н-ЯМР були такими ж, що спостерігалися ефіру і потім сушили при 50°С з отриманням 11,7г в пункті 1-1). вказаної в заголовку речовини у вигляді білого Приклад 3: твердого матеріалу (Вихід: 88%). Якісний аналіз структури кристалічного напівТемпература плавлення: 164-165°С гідрату метансульфонату сибутраміну формули (І) Вміст води: 0,2% і З даних порошкової рентгенівської дифракції і 1 H-ЯМР (δ, DMSO-d6): 8,5 (1Н, уш.с), 7,5 (4Н, термограми диференціальної скануючої калоридд), 3,7 (1Н, т), 2,8 (ЗН, д), 2,5 (2Н, д), 2,4 (3Н, с), метрії виходить, що структура напівгідрату метан2,3 (2Н, д), 2,1 (3Н, д), 1,9 (1Н, м), 1,7-1,6 (2Н, м), сульфонату сибутраміну формули (І) відрізняється 1,4 (2Н, т), 1,0 (6Н, т). від моногідрату гідрохлориду сибутраміну форму2-1-2) Методика 2 ли (IV) (див. Фіг.1-5). 10,0г сибутраміну формули (II) розчиняли в Порошкова рентгенограма напівгідрату метан80мл толуолу і потім, при кімнатній температурі по сульфонату сибутраміну формули (І) містить харакраплях додавали 3,75г метансульфокислоти. Ректеристичні піки (Фіг.1), представлені в Таблиці 1. акційну суспензію перемішували протягом 2 годин, У Таблиці 1, позначення «29», «d» і «І/Іо» відноохолоджували до 0°С, знов перемішували протясяться до кутів дифракції, відстані між гранями гом 2 годин і потім фільтрували з утворенням крикристала і відносної інтенсивності піка, відповідно. сталів. Отримані кристали промивали 20мл ефіру і Таблиця 1 потім сушили при 50°С з отриманням 12,8г вказаної в заголовку речовини у вигляді білого твердого d Ι/Ιο d Ι/Ιο 2 ( 0,2) 2 матеріалу (Вихід: 95%). Вміст води у вказаній в 8,2 10,8 868 21,2 4,19 785 заголовку сполуці становив 0,1%, причому його 10,8 8,17 218 21,9 4,06 646 температура кипіння і спектр 1H-ЯМР були такими 11,7 7,53 210 22,2 4,00 315 ж, що спостерігалися вище в 2-1-1). 12,0 7,36 276 22,8 3,90 286 2-1-3) Методика 3 12,3 7,19 661 23,3 3,81 456 12,5г вказаної в заголовку сполуки у вигляді 15,8 5,61 716 24,4 3,65 537 білої твердої речовини отримували повторенням 16,4 5,39 725 24,9 3,58 596 методики, описаної вище в 2-1-2) (Вихід: 93%) за 17,4 5,10 792 25,3 3,52 322 винятком того, що замість толуолу використали 17,8 4,97 498 25,6 3,47 351 ізопропілацетат. Вміст води в отриманому продукті 19,0 4,68 556 26,8 3,33 1000 11 76913 12 Експериментальний приклад 1: Як випливає з Таблиці 2, напівгідрат метансуРозчинність у воді льфонату сибутраміну формули (І) володіє істотно Напівгідрат метансульфонату сибутраміну більш високою розчинністю у воді ніж моногідрат формули (І) і моногідрат гідрохлориду сибутраміну гідрохлориду сибутраміну формули (IV). розчиняли до точки насичення при рН5,2 і потім Експериментальний приклад 2: аналізували методом високоефективної рідинної Стійкість в умовах високої вологосхроматографії (ВЕРХ) з метою визначення розчиті/температури неної кількості речовини (в розрахунку на безводУ цьому експерименті порівнювали термостаний сибутрамін). Отримані результати представбільність кристалічного напівгідрату метансульфолені в Таблиці 2. нату сибутраміну формули (І) і моногідрату гідрохлориду сибутраміну формули (IV) в ході тривалого Таблиця 2 зберігання. Кількості кристалічного напівгідрату метансульфонату формули (І) і моногідрату гідроРозчинність у воді хлориду сибутраміну формули (IV), що не зазнали Сполука (мг/мл, рН 5,2) змін при 60°С через 1, 2, З і 6 місяців приведені в Моногідрат гідрохлориду сибутраміну Таблиці 3. формули (IV) Напівгідрат метансульфонату сибутраміну формули (І) 2,8 2500 Таблиця 3 Початкова кількість Сполука Моногідрат гідрохлориду сибутраміну формули (IV) Напівгідрат метансульфонату сибутраміну формули (І) Кількість, що залишилася через 1 місяць Кількість, що залишилася через 2 місяці 1,000 1,000 0,999 0,999 0,992 1,000 1,001 0,999 0,999 1,000 З представлених вище результатів витікає, що кристалічний напівгідрат сибутраміну володіє такою ж стабільністю, що і моногідрат гідрохлориду сибутраміну. Експериментальний приклад 3: Тест на відсутність гігроскопічності Кожну з речовин, які являють собою кристалічний напівгідрат метансульфонату сибутраміну формули (І), моногідрат гідрохлориду сибутраміну (IV) і безводний метансульфонат сибутраміну, піддавали впливу високої температури/вологості, Кількість, що за- Кількість, що залишилася через лишилася через 6 3 місяці місяців при 40°С і відносній вологості 75%, протягом 1, 2 і 5 днів і їх вологовміст вимірювали з використанням аналізатора вологості Kaal-Fisher. Отримані результати представлені в Таблиці 4. Аналогічні серії експериментів проводили при 40°С і відносної вологості 10% з метою з'ясування стійкості відповідних сполук у відносно сухих умовах. Таблиця 4 Вміст води (% мас.) Таблиця 4 Температура (°C) Відносна вологість (%) 40°C 75% 40°C 10% Час зберігання (дні) 1 2 5 1 2 5 Метансульфонат сибут- Моногідрат гідрохлориду Безводний метансульфонат раміну формули (І) сибутраміну формули (IV) сибутраміну формули (IІ) 2,27 5,40 0,60 2,30 5,45 2,20 2,30 5,48 2,25 2,27 5,40 0,60 2,25 5,36 0,71 2,26 5,36 0,70 Як випливає з Таблиці 4, кристалічний напівгідрат метансульфонату сибутраміну формули (І) не виявляє гігроскопічності в умовах високої вологості, при цьому він не виділяє кристалізаційну воду в сухих умовах. Експериментальний приклад 4: Вплив на втрату маси У експерименті використали 16 Zuker щурів (fa/fa) з надмірною масою і таку ж кількість худих Zuker щурів (Fa/Fa), яких поділяли на групу, що приймала ліки, і контрольну групу (по 8 щурів в кожній групі) і перед випробуванням вимірювали масу кожного щура. Щодня, протягом 21 дня, на кожному щурі з груп, що одержують ліки, застосовували 3 мг/кг кристалічного напівгідрату метансульфонату сибутраміну, в той час, як тваринам з контрольної групи вводили індиферентну зв'язуючу речовину. Протягом випробувального періоду щури мали вільний доступ до їжі з високим вмістом жирів, після чого визначали середню масу тварин з групи, що приймала ліки, і контрольної групи з метою підрахунку збільшення і втрати маси. 13 76913 14 Таблиця 5 Середня маса випробування до (г: А) Середня маса після випробування (г: В) Приріст маси (г: В-А) Ефект втрати маси (г: (приріст маси в контрольній групі) - (приріст маси в лікувальній групі) Zuker щури з надмірною масою Група, що прийКонтрольна мала ліки група 332,2 333,2 455,6 486,2 123,4 153,0 Худі Zuker щури Група, що прийКонтрольна мала ліки група 245,0 244,8 303,4 323,6 58,4 78,8 29,6 20,4 Як видно з даних, представлених в Таблиці 5, група, що приймала кристалічний напівгідрат метансульфонату формули (І), демонструвала помітну втрату маси в порівнянні з контрольною групою. Таким чином, продемонстровано, що кристалічний напівгідрат метансульфонату формули (І) корисний в лікуванні або профілактиці ожиріння. Порівняльний приклад: Невдале отримання напівгідрату метансульфонату (+)- і (-)- сибутраміну (І) Оптичне розщеплення сибутраміну формули (її) (отримання (+)- і (-)-сибутраміну формули (II)) 12,3г рацемічного сибутраміну розчиняли в 85мл етилацетату і в суміш додавали розчин LDBTA в 85мл етилацетату. Реакційну суміш нагрівали із зворотним холодильником, охолоджували до кімнатної температури і відфільтровували з утворенням кристалів (в межах помилки близько 85%). Після цього отримані кристали суспендували в 220мл етилацетату і суміш нагрівали із зворотним холодильником з отриманням твердої речовини. Тверду речовину перекристалізовували з 450мл ізопропілового спирту з отриманням LDBTA солі (-)-сибутраміну (в межах помилки:>99,3). L-DBTA сіль (-)-сибутраміну нейтралізували насиченим розчином бікарбонату натрію і потім екстрагували хлороформом з отриманням ()-сибутраміну у вигляді вільної основи. Фільтрат, отриманий фільтрацією після реакції з L-DBTA, нейтралізували до рН 8,5 за допомогою гідроксиду натрію і потім екстрагували хлороформом з отриманням (+)-сибутраміну, що являє собою практично чистий (+)-ізомер. Для отримання кристалів додавали D-DBTA і отримані кристали перекристалізовували з 450мл ізопропілового спирту з отриманням D-DBTA солі (+)-сибутраміну (в межах помилки; >99,3%). D-DBTA сіль (-)сибутраміну нейтралізували до рН8,5 за допомо гою насиченого розчину бікарбонату натрію і потім екстрагували хлороформом з утворенням (+)сибутраміну у вигляді вільної основи. (2) Отримання метансульфонату (+) і (-)сибутраміну (+)- і (-)-сибутрамін у вигляді вільних основ, отриманих вище в (1), обробляли по методиці, описаній в пункті 2-1-2) Прикладу 2 з отриманням відповідного безводного метансульфонату. Метансульфонат (+)-сибутраміну: т.пл. 156,5~157,5°С, вміст води 0,30%; Метансульфонат (-)-сибутраміну: т.пл. 156,5~157,5°С, вміст води 0,05%. (3) Спроба отримання напівгідрату метансульфонату (+)- і М-сибутраміну Безводний метансульфонат (+)- і (-)-сибутраміну, отриманий в (2), обробляли за тією ж методикою, що описана в пункті 2-2) Прикладу 2. Однак утворення кристалів не спостерігалося. З метою індукції кристалоутворення розчинник для метансульфонату (+)- або (-)-сибутраміну замінювали на толуол. Однак отримані кристали мали таку ж температуру плавлення і той же вміст води, що і кристали безводного метансульфонату (+)- і (-)-сибутраміну, отримані вище у (2), відповідно. Крім цього, кожний безводний метансульфонат (+)- і (-)-сибутраміну витримували протягом 1 дня при кімнатній температурі і відносній вологості 75%. Кожний із зразків розплавлявся за 2 години, і за 1 день перетворювався в прозору рідину. Отримані результати показують, що напівгідрат метансульфонату сибутраміну не може бути отриманий з будь-якого енантіомеру. Хоча даний винахід описаний з посиланням на спеціальні втілення, очевидно, що фахівець в даній галузі зможе виробити різні модифікації і зміни даного винаходу, які охоплюються сферою винаходу визначеною в прикладеній формулі винаходу. 15 Комп’ютерна верстка Т. Чепелева 76913 Підписне 16 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition comprising crystalline sibutramine methanesulfonate hemihydrate
Автори англійськоюChang Young-Kil, Lee, Gwan-Sun
Назва патенту російськоюФармацевтическая композиция, содержащая кристаллический полугидрат метансульфоната сибутрамина
Автори російськоюЧанг Янг-Кил
МПК / Мітки
МПК: A61K 31/135, A61P 3/04, C07C 211/63, A61K 31/205
Мітки: містить, кристалічний, композиція, метансульфонату, сибутраміну, напівгідрат, фармацевтична
Код посилання
<a href="https://ua.patents.su/8-76913-farmacevtichna-kompoziciya-shho-mistit-kristalichnijj-napivgidrat-metansulfonatu-sibutraminu.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція, що містить кристалічний напівгідрат метансульфонату сибутраміну</a>
Попередній патент: Спосіб контролю дводротяних ланцюгів дистанційного керування електричними апаратами
Наступний патент: Залізобетонна колона в ґрунтовій виїмці і спосіб її зведення
Випадковий патент: 1-ацетил-5-[(4-хлоро-1н-імідазол-5-іл)метилен]-2-тіоксо-імідазолідин-4-они, які виявляють гіпоглікемічну активність












