Кристалічна кальцієва сіль (2:1) [r-(rr)]-2-(4-фторфеніл)-b,d-дигідрокси-5-(1-метилетил)-3-феніл-4-[(феніламіно)карбоніл]-1н-піролгептанової кислоти
Формула / Реферат
1. Сполука, що має кристалічну форму Fa аторвастатину кальцію, або її псевдополіморф.
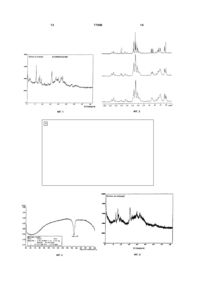
2. Сполука за п. 1, яка відрізняється тим, що має характер розсіювання рентгенівського випромінення, що має принаймні одне з наступних 2![]() значень, які вимірювали, використовуючи джерело опромінення
значень, які вимірювали, використовуючи джерело опромінення ![]() приблизно 10,2, приблизно 11,3 або приблизно 18,9.
приблизно 10,2, приблизно 11,3 або приблизно 18,9.
3. Сполука за п. 1, яка відрізняється тим, що має твердофазний 13С ЯМР-спектр, що має принаймні один хімічний зсув за приблизно 20,7, приблизно 23,3, приблизно 24,5 або приблизно 26,1 млн-1.
4. Сполука за п. 3, яка відрізняється тим, що твердофазний 13С ЯМР-спектр також включає принаймні один хімічний зсув за приблизно 64,4, приблизно 67,6, приблизно 70,0 і приблизно 72,6 млн-1.
5. Сполука за п. 1, яка відрізняється тим, що калориметрична крива диференційного сканування вищезгаданої сполуки включає єдиний перехід між 154°С і 155°С.
6. Сполука, що має кристалічну форму Je аторвастатину кальцію, або її псевдополіморф.
7. Сполука за п. 6, яка відрізняється тим, що має характер розсіювання рентгенівського випромінення, що має принаймні одне з наступних 2![]() значень, які вимірювали, використовуючи джерело опромінення
значень, які вимірювали, використовуючи джерело опромінення ![]() приблизно 9,5, приблизно 11,1, приблизно 11,7, приблизно 12,7 і приблизно 19,3.
приблизно 9,5, приблизно 11,1, приблизно 11,7, приблизно 12,7 і приблизно 19,3.
8. Сполука за п. 6, яка відрізняється тим, що має твердофазний 13С ЯМР-спектр, що має принаймні один хімічний зсув за приблизно 20,2, приблизно 23,4 і приблизно 26,2 млн-1.
9. Сполука за п. 6, яка відрізняється тим, що калориметрична крива диференційного сканування вищезгаданої сполуки включає єдиний перехід між 162°С і 163°С.
10. Спосіб одержання кристалічних форм Fa і Je аторвастатину кальцію або їх псевдополіморфів, при якому здійснюють етапи суспендування водного осаду кальцієвої солі аторвастатину в неводному, неполярному розчинникові й нагрівання суміші вище 90°С.
11. Спосіб одержання кристалічних форм Fa і Je аторвастатину кальцію або їх псевдополіморфів, при якому здійснюють:
а) гідратацію аморфного аторвастатину кальцію;
б) суспендування гідратованого аторвастатину кальцію в неводному, неполярному розчинникові;
в) нагрівання до температури й протягом часу, достатніх для утворення кристалічної форми Fa аторвастатину кальцію або Je, або суміші кристалічної форми Fa і Je; і
г) виділення вищезгаданої кристалічної форми аторвастатину кальцію з суспензії.
12. Спосіб за п. 11, який відрізняється тим, що гідратацію аморфного аторвастатину кальцію виконують при температурі вище 90°С.
13. Спосіб одержання кристалічної форми Fa або Je аторвастатину кальцію , при якому здійснюють:
а) суспендування аторвастатину кальцію в неводному, неполярному розчинникові;
б) суспендування гідратованого аторвастатину кальцію в неводному, неполярному розчинникові;
в) нагрівання до температури й протягом часу, достатніх для утворення кристалічної форми Fa або Je аторвастатину кальцію , або суміші кристалічної форми Fa і Je; і
г) виділення вищезгаданої кристалічної форми аторвастатину кальцію з суспензії.
14. Спосіб очищення кристалічних форм Fa і Je аторвастатину кальцію шляхом видалення залишкових розчинників, води чи інших домішок аторвастатину кальцію дистиляцією або азеотропною дистиляцією цих розчинників з аторвастатину кальцію, суспендованого в неводних розчинниках.
15. Спосіб за будь-яким з пп. 10, 11, 13 або 14, який відрізняється тим, що в неводному, неполярному розчинникові є принаймні один вуглеводень.
16. Спосіб за будь-яким з пп. 10, 11, 13 або 14, який відрізняється тим, що неводний, неполярний розчинник вибраний із групи, що складається з гексану, гептану, октану, ізооктану, циклогексану, метилциклогексану та їх сумішей.
17. Фармацевтична композиція, що містить сполуку за п. 1 або 6 разом з фармацевтично прийнятним носієм, ад'ювантом або наповнювачем.
18. Спосіб лікування гіперліпідемії та гіперхолестеринемії шляхом введення терапевтично ефективної кількості сполуки за п. 1 або 6.
Текст
УКРАЇНА (19) UA (11) 77990 (13) C2 (51) МПК (2006) A61K 31/40 A61P 3/06 (2007.01) A61P 43/00 C07D 207/337 (2007.01) C07D 207/34 (2007.01) МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ДЕРЖАВНИЙ Д ЕПАРТАМЕНТ ІНТЕЛ ЕКТУАЛЬНОЇ ВЛАСНОСТІ ОПИС ДО ПАТЕНТУ НА ВИНАХІД (54) КРИСТАЛІЧНА КАЛЬЦІЄВА СІЛЬ (2:1) [R-(R*,R*)]-2-(4-ФТОРФЕНІЛ)- , -ДИГІДРОКСИ-5-(1МЕТИЛЕТИЛ)-3-ФЕНІЛ-4-[(ФЕНІЛАМІНО)КАРБОНІЛ]-1H-ПІРОЛГЕПТАНОВОЇ КИСЛОТИ C2 (13) 77990 (11) 8. Сполука за п.6, яка відрізняється тим, що має твердофазний 13С ЯМР-спектр, що має принаймні один хімічний зсув за приблизно 20,2, приблизно 23,4 і приблизно 26,2 млн -1. 9. Сполука за п.6, яка відрізняється тим, що калориметрична крива диференційного сканування вищезгаданої сполуки включає єдиний перехід між 162°С і 163°С. 10. Спосіб одержання кристалічних форм Fa і Je аторвастатину кальцію або їх псевдополіморфів, при якому здійснюють етапи суспендування водного осаду кальцієвої солі аторвастатину в неводному, неполярному розчинникові й нагрівання суміші вище 90°С. 11. Спосіб одержання кристалічних форм Fa і Je аторвастатину кальцію або їх псевдополіморфів, при якому здійснюють: а) гідратацію аморфного аторвастатину кальцію; б) суспендування гідратованого аторвастатину кальцію в неводному, неполярному розчинникові; в) нагрівання до температури й протягом часу, достатніх для утворення кристалічної форми Fa аторвастатину кальцію або Je, або суміші кристалічної форми Fa і Je; і г) виділення вищезгаданої кристалічної форми аторвастатину кальцію з суспензії. 12. Спосіб за п.11, який відрізняється тим, що гідратацію аморфного аторвастатину кальцію виконують при температурі вище 90°С. 13. Спосіб одержання кристалічної форми Fa або Je аторвастатину кальцію, при якому здійснюють: а) суспендування аторвастатину кальцію в неводному, неполярному розчинникові; б) суспендування гідратованого аторвастатину кальцію в неводному, неполярному розчинникові; в) нагрівання до температури й протягом часу, достатніх для утворення кристалічної форми Fa або Je аторвастатину кальцію , або суміші кристалічної форми Fa і Je; і г) виділення вищезгаданої кристалічної форми аторвастатину кальцію з суспензії. 14. Спосіб очищення кристалічних форм Fa і Je UA (21) 20040604498 (22) 11.12.2002 (24) 15.02.2007 (86) PCT/US02/39512, 11.12.2002 (31) 60/341,133 (32) 12.12.2001 (33) US (46) 15.02.2007, Бюл. № 2, 2007 р. (72) Фаустманн Іржі, CZ, Єгоров Алєксандр , CZ (73) ІВАКС ФАРМАСЬЮТІКАЛС С.Р.О., CZ (56) WO 9703958 US 6 121 461 (57) 1. Сполука, що має кристалічну форму Fa аторвастатину кальцію, або її псевдополіморф. 2. Сполука за п.1, яка відрізняється тим, що має характер розсіювання рентгенівського випромінення, що має принаймні одне з наступних 2 q значень, які вимірювали, використовуючи джерело опромінення CuKa : приблизно 10,2, приблизно 11,3 або приблизно 18,9. 3. Сполука за п.1, яка відрізняється тим, що має твердофазний 13С ЯМР-спектр, що має принаймні один хімічний зсув за приблизно 20,7, приблизно 23,3, приблизно 24,5 або приблизно 26,1млн-1. 4. Сполука за п.3, яка відрізняється тим, що твердофазний 13С ЯМР-спектр також включає принаймні один хімічний зсув за приблизно 64,4, приблизно 67,6, приблизно 70,0 і приблизно 72,6млн -1. 5. Сполука за п.1, яка відрізняється тим, що калориметрична крива диференційного сканування вищезгаданої сполуки включає єдиний перехід між 154°С і 155°С. 6. Сполука, що має кристалічну форму Je аторвастатину кальцію, або її псевдополіморф. 7. Сполука за п.6, яка відрізняється тим, що має характер розсіювання рентгенівського випромінення, що має принаймні одне з наступних 2 q значень, які вимірювали, використовуючи джерело опромінення CuKa : приблизно 9,5, приблизно 11,1, приблизно 11,7, приблизно 12,7 і приблизно 19,3. 2 (19) 1 3 77990 4 аторвастатину кальцію шляхом видалення залишрозчинник вибраний із групи, що складається з кових розчинників, води чи інши х домішок аторвагексану, гептану, октану, ізооктану, циклогексану, статину кальцію дистиляцією або азеотропною метилциклогексану та їх сумішей. дистиляцією цих розчинників з аторвастатину 17. Фармацевтична композиція, що містить сполукальцію, суспендованого в неводних розчинниках. ку за п.1 або 6 разом з фармацевтично прийнят15. Спосіб за будь-яким з пп.10, 11, 13 або 14, який ним носієм, ад'ювантом або наповнювачем. відрізняє ться тим, що в неводному, неполярному 18. Спосіб лікування гіперліпідемії та гіперхолесрозчинникові є принаймні один вугле водень. теринемії шляхом введення терапевтично ефекти16. Спосіб за будь-яким з пп.10, 11, 13 або 14, який вної кількості сполуки за п.1 або 6. відрізняє ться тим, що неводний, неполярний Ця заявка заявляє перевагу попередньої [патентної заявки США №60/341133, поданої 12 грудня 2001 року], яка включена до цього документа шляхом посилання. Винахід стосується Fa і Je кристалічних форм аторвастатину кальцію, а також способів їх одержання. Нові кристалічні форми є корисними як інгібітори фермента 3-гідрокси-3-метилглутарилкофермент А редуктази (HMG-CoA редуктази). Таким чином, кристалічні сполуки винаходу є корисними як агенти для лікування гіперліпідемії та гіперхолестеринемії. Даний винахід стосується кристалічних форм Fa і Je аторвастатину кальцію, тобто, кальцієвої солі (2:1) [R-(R*,R*)]-2-(4-фторфеніл)-(b,dдигідрокси-5-(1-метилетил)-3-феніл-4[(феніламіно)-карбоніл]-1Н-пірол-гептанової кислоти, також відомої як аторвастатин кальцію, способів їх одержання та виділення, фармацевтичних композицій, які включають кристалічні форми Fa і Je, фармацевтично прийнятного носія та способу введення терапевтичної кількості фармацевтичної композиції для лікування гіперліпідемії та гіперхолестеринемії. Аторвастатин одержують як кальцієву сіль (2:1), оскільки кальцієва сіль є бажаною для рецептур аторвастатину, таких як таблетки, капсули, порошки тощо, для орального введення. Способи одержання аторвастатину кальцію та ключових проміжних речовин [описані в патентах США №:4681893, 5003080; 5097045; 5103024; 5124482; 5149837; 5155251; 5216174; 5245047; 5248793; 5273995, 5280126; 5342952; і 5397792], які включені до цього документа шляхом посилання. Аторвастатин кальцію може існувати як аморфна форма або в кількох кристалічних формах. Є добре відомим можливе існування різних кристалічних форм або аморфних твердих речовин, як можуть впливати на стабільність, фармакокінетичні параметри та біодоступність різних дозованих форм [Вуrn S.R., Solid-State Chemistry of Drugs, Academic Press, New York, стор.79-148 (1982)]. Різні кристалічні форми мають різні властивості в результаті різного розташування молекул у кристалічній структурі, різну щільність пакування та/або різну мережу водневих зв'язків. Відповідно, індивідуальні кристалічні форми можуть вважатися окремими твердими речовинами, які мають окремі переваги та/або недоліки у фізичних властивостях порівняно з іншими формами. Аморфний аторвастатин кальцію може бути одержаний [згідно з патентами США №6087511 і 6274740] шляхом розчинення аторвастатину кальцію в негідроксильному розчинникові з послідовним видаленням розчинника. Як альтернатива, аморфний аторвастатин кальцію може бути одержаний [згідно з WO 01/42209] шляхом осадження аторвастатину кальцію з розчинників, у яких аторвастатин кальцію є розчинним, додавання розчинника, у якому аторвастатин кальцію є нерозчинним. Аморфний аторвастатин кальцію також може бути одержаний у водному розчині, наприклад, шляхом реакції натрієвої солі аторвастатину й придатної кальцієвої солі при температурі навколишнього середовища. Оскільки такі розчини важко фільтрувати, були розроблені різні способи одержання кристалічного аторвастатину кальцію. Кристалічні форми І, II, III, і IV аторвастатин у кальцію [описані в патентах США №5969156 і 6121461] разом з їх псевдополіморфними гідратами, які можуть відрізнятися вмістом води у певній кристалічній формі. Форма V аторвастатину кальцію, [описана у WO 01/36384], і таке саме позначення використано для форм, [описаних у WO 02/057274 і WO 02/057229]. Інші форми, позначені як форми VI, VII, VIII, IX, X і XI, [описані у WO 02/43732]. Ще інші форми, позначені як форми X, А, В1, В2, С, D і Е, [описані у WO 02/051804]. Усі ці форми характеризуються їх окремим типом розсіювання рентгенівського випромінення, описаного як список 2q значень, одержаних з певного джерела рентгенівського опромінення, які можуть бути легко підраховані для будь-якого іншого джерела опромінення рівнянням Брега. У той час як винахідники цих патентів патентують певні способи обробки й терапевтичні переваги їх форм, ці переваги можуть бути втілені іншими, досі не відкритими формами аторвастатину кальцію. Було виявлено, що певними недоліками принаймні деяких із цих форм є або велика площа поверхні аморфної або напівкристалічної форми, та/або високий ступінь сольватації/гідратації, що веде до нестабільності аторвастатину кальцію, що може спричинити утворення продуктів деградації аторвастатину, а саме утворення лактону, окиснення, видалення води з його структури та/або їх комбінації. У даному винаході запропоновано нові кристалічні форми Fa і Je аторвастатину кальцію, які 5 77990 6 відрізняються способом розсіювання рентгенівсьсилань було спеціально й окремо вказано для кого випромінення, 13С ЯМР-спектром твердої фавключення шляхом посилання. Будь-який конфлікт зи, а також калориметричними кривими диференміж будь-якими посиланнями, цитованими в цьому ційного сканування. документі, і певними положеннями цього опису В іншому аспекті в даному винаході запроповинаходу мають бути вирішені на користь останновано нові способи одержання кристалічних нього. Подібним чином, будь-який конфлікт між форм Fa і Je аторвастатину кальцію. зрозумілим у галузі визначенням слова або фрази В іншому аспекті у винаході запропоновано й визначенням слова або фрази, яке спеціально фармацевтичні композиції та дозовані форми, що визначене у цьому описі винаходу, має бути вирімістять кристалічні форми Fa і Je аторвастатину шено на користь останнього. кальцію. Технічні та наукові терміни, використані в цьоПодальшим втіленням цього винаходу є спосіб му документі, мають значення звичайно зрозумілі лікування гіперліпідемії або гіперхолестеринемії фа хівцям у галузі, яких стосується цей винахід, фармацевтичними композиціями, які містять тераякщо не зазначено інше. Посилання в цьому докупевтично ефективну кількість кристалічних форм менті робляться на різні методики та матеріали, Fa і Je аторвастатину кальцію. відомі фахівцям у галузі. До стандартних посиВинахід надалі описаний нижченаведеними лань, у яких висвітлені загальні принципи фарманеобмежуючими прикладами, які посилаються на кології, належать Goodman і Gilman's Pharmacolвідповідні Фіг.1 - 7, які коротко описані нижче. ogical Basis of Therapeutics, 10th Ed., McGraw Hill Фіг.1 це характерна діаграма дифракції крисCompanies Inc., New York (2001). талічної форми Fa аторвастатину кальцію, одерПри використанні в цьому описі винаходу фожана, використовуючи джерело опромінення рми однини також означають форми множини термінів, яких вони стосуються, якщо зміст чітко не СuKa. означає інше. Фіг.2 це порівняння характерних твердофазТермін "приблизно" при використанні в цьому них 13С ЯМР-спектрів кристалічної форми І атордокументі означає: в межах, у діапазоні, грубо або вастатину кальцію (вгорі), кристалічної форми Fa близько. Коли термін "приблизно" використовуєть(посередині) і кристалічної форми Je (внизу). Фіг.3 це детальне зображення твердофазного ся стосовно числового діапазону, він змінює цей 13 діапазон, розширюючи кордони вище й нижче наС ЯМР-спектра кристалічної форми Fa аторвасведених числових значень. Загалом, термін "притатину кальцію. близно" використовується в цьому описі для моФіг.4 це характерна калориметрична крива дифікації числового значення вище й нижче диференційного сканування аторвастатину кальцію форми Fa. наведеного значення з відхиленням у 20%. При використанні в цьому винаході або в пеФіг.5 це характерна діаграма дифракції аторрехідній фразі, або у формулі винаходу, терміни вастатину кальцію кристалічної форми Je, одер"містить(ять)" і "що містить (включає)" потрібно жаної, використовуючи джерело опромінення розуміти як такі, що мають відкриті значення. Це СuKa. означає, що терміни потрібно розуміти синонімічно Фіг.6 це детальне зображення твердофазного 13 з фразами "що мають принаймні" або "що вклюС Я МР-спектра кристалічної форми Je аторвасчають принаймні". При використанні в контексті татину кальцію. способу термін "що містить (включає)" означає, що Фіг.7 це характерна калориметрична крива спосіб включає принаймні перераховані етапи, але диференційного сканування кристалічної форми може включати додаткові етапи. При використанні Je аторвастатину кальцію. в контексті сполуки або композиції, термін "що місНесподівано було виявлено, що аторвастатин тить (включає)" означає, що сполука або композиможе бути одержаний у додатковій кристалічній ція включає принаймні перераховані ознаки або формі. Таким чином, у цьому винаході запропонокомпоненти, але може також включати додаткові вано аторвастатин кальцію (2:1) у дво х нових криознаки або компоненти. сталічних формах, позначених як кристалічна фоВ описі та формулі винаходу, що додається, рма "Fa" і кристалічна форм "Je". однина включає множину, якщо в контексті чітко не Кристалічні форми Fa і Je виявляють різні фізазначено інше. зичні властивості порівняно з попередньо описаБудь-які придатні матеріали та/або способи, ними формами, основаними на їх характерах розвідомі фахівцям у галузі, можуть бути використані сіювання рентгенівського випромінення, у втіленні цього винаходу. Однак, у цьому винаході твердофазних 13С ЯМР і калориметричних кривих описані оптимальні матеріали та способи. Матерідиференційного сканування. Крім того, процес али, реактиви і т.п., на які зроблено посилання в синтезування форм Je і Fa надає додаткову перенаступному описі та прикладах, можна одержати з вагу у видаленні полярних залишкових розчинникомерційних джерел, якщо не зазначено інше. ків з кінцевого кристалічного аторвастатину кальНадалі в цьому описі робляться детальні поцію, таким чином надаючи кращої стабільності силання на конкретні втілення винаходу. Хоча виаторвастатину кальцію стосовно можливих вищенахід буде описано стосовно цих конкретних втізгаданих процесів деградації. лень, має бути зрозуміло, що це не має наміру Патенти, опубліковані заявки та наукова літеобмежити винахід такими конкретними втіленнями. ратура, на які робиться посилання у цьому винаНавпаки, є намір включити альтернативи, модифіході, встановлюють знання фахівців у галузі та кації та еквіваленти, які можуть бути включені в включені до цього документа шляхом посилання в межах сутності та об'єму винаходу, як визначено їх цілісності таким чином, начебто кожне з цих по 7 77990 8 формулою винаходу, що додається. У наступному тини на мільйон (млн-1), що вимірювали на Bruker описі наводяться численні конкретні деталі для DSX 200 спектрометрі (Карлсруе, Німеччина) з того, щоб забезпечити чітке розуміння даного випараметрами 50,33МГц і 200,14МГц для 13С і 1Н, находу. Даний винахід може бути втілений без відповідно. Спектр кристалічної форми Fa аторвадеяких або всіх із цих конкретних деталей. В інших статину кальцію наведений як середня діаграма на випадках добре відомі операції не були детально Фіг.2, яка показує порівняння кристалічної форми описані для того, щоб не перешкоджати ясності Fa з кристалічною формою І (верх) і кристалічною цього винаходу. формою Je (внизу). Детальне зображення спектра Цей винахід стосується кристалічних форм Fa й значень хімічних зсувів наведені на Фіг.3. Поріві Je кальцієвої солі (2:1) [R-(R*,R*)]-2-(4няно з іншою кристалічною формою кристалічна форма Fa виявляє сигнали за приблизно 20,7, фтор феніл)-b,d-дигідрокси-5-(1-метилетил)-3приблизно 23,3, приблизно 24,5 і приблизно феніл-4-[(феніламіно)-карбоніл]-1Н-піролгептанової кислоти, що мають наступну загальну 26,1млн -1. Окрім того, порівняно з іншими формами кристалічна форма Fa виявляє численні піки у хімічну стр уктуру: 30-50млн-1 ділянці й у 60-75млн -1 ділянці зі специфічними сигналами за приблизно 64,4, приблизно 67,6, приблизно 70,0 і приблизно 72,6млн -1. Кристалічна форма Fa аторвастатину кальцію також характеризується своєю калориметричною кривою диференційного сканування. На відміну від інших кристалічних форм, особливо різних сольватів і гідратів, жодної значної активності не було помічено між 100°С і 140°С. Кристалічна форма Fa характеризується одиничним зміщенням між 154°С Винахід також стосується способів одержання і 155°С. Калориметричні дані наведені на Фіг.4. й виділення форм Fa і Je, фармацевтичних компоКристалічна форма Je зицій, які включають кристалічні форми Fa і Je, Форма Je аторвастатину кальцію характеризуфармацевтично прийнятного носія та способу ється за її типом розсіювання рентгенівського вивведення терапевтичної кількості фармацевтичної промінення, що вимірювали на XRD 3000P дифракомпозиції для лікування гіперліпідемії та гіперхоктометрі Seifert з джерелом опромінення СuKa. У лестеринемії. Кристалічні форми Fa і Je аторвастаблиці 2 нижче подано 2q значення, d-відстані та татину кальцію є корисними як інгібітори ферменту приблизно відносна інтенсивність дифрактограми, 3-гідрокси-3-метилглутарил-кофермент редуктази наведеної на Фіг.5. і, таким чином, є корисними як агенти для лікування гіперліпідемії та гіперхолестеринемії. Таблиця 2 Кристалічні форми Fa і Je характеризуються за їх певним типом розсіювання рентгенівського 2q Кут (градуси) d-відстані Відносна інтенсиввипромінення, спектром твердофазного 13С ядерність но-магнітного резонансу (ЯМР) і даними диферен5,66 18,133 186 ційної скануючої калориметрії. Ці форми відрізня9,47 10,839 1000 ються від інших форм, відомих у попередньому 11,14 9,223 328 рівні техніки. 11,69 8,791 460 Кристалічна форма Fa 12,70 8,095 306 Форма Fa аторвастатину кальцію характеризу19,26 5,351 680 ється за її типом розсіювання рентгенівського ви21,95 4,702 310 промінення, що вимірювали на XKD 3000P дифра22,70 4,548 200 ктометрі Seifert з джерелом опромінення СuKa. У 23,46 4,403 299 таблиці 1 нижче подано 2q значення, d-відстані та 25,04 4,129 356 приблизно відносна інтенсивність дифрактограми, 26,09 3,966 392 наведеної на Фіг.1. Таблиця 1 2q Кут (градуси) d-відстані 10,21 11,34 11,94 12,99 18,87 23,14 25,04 10,058 9,060 8,610 7,913 5,461 4,462 4,129 Відносна інтенсивність 725 712 374 169 1000 316 273 Кристалічна форма Fa аторвастатину кальцію також характеризується її твердофазним 13С ЯМРспектром, в якому хімічний зсув виражений як час Кристалічна форма Je аторвастатину кальцію також характеризується її твердофазним 13С ЯМРспектром, в якому хімічний зсув виражений як частини на мільйон (млн-1), що вимірювали на Bruker DSX 200 спектрометрі (Карлсруе, Німеччина) з параметрами 50,33МГц і 220,14МГц для 13С і 1Н, відповідно. Спектр кристалічної форми Fa аторвастатину кальцію наведений як середня діаграма на Фіг.2, яка показує порівняння кристалічної форми Fa з кристалічною формою І (верх) і кристалічною формою Fa (всередині). Детальне зображення спектра й значень хімічних зсувів наведені на Фіг.6. Порівняно з іншими формами форма Je виявляє типові сигнали за приблизно 20,2, приблизно 23,4 і приблизно 26,2млн-1. Порівняно з іншими 9 77990 10 формами кристалічна форма Je виявляє широкої аторвастатину кальцію з визначеною кількістю форми піки у 30-50млн-1 ділянці й у 60-75млн -1 води й визначеним розміром часток, які можуть ділянці, що є протилежним чіткій структурі, показабути легко виділені фільтрацією. За контрольованій для кристалічної форми І та кристалічної форних умов може бути виділена чиста кристалічна ми Fa. форма Fa аторвастатину кальцію. До таких умов Форма Je аторвастатину кальцію також харакналежать використання нижчої температури для теризується її калориметричною кривою диференкристалізації, коротшого часу кристалізації й в опційного сканування, наведеною на Фіг.7. На відмітимальному варіанті використання метилциклогекну від інших кристалічних форм, особливо різних сану або ізооктану. При підвищенні температури сольватів і гідратів, жодної значної активності не кристалічна форма Fa аторвастатину кальцію стає спостерігали між 100°С і 150°С. Кристалічна форметастабільною й рекристалізується у форму Je ма Je характеризуються одиничним температураторвастатину кальцію. Такий перехід характериним зміщенням між 162°С і 163°С. зуються за зсувом перших дво х інтенсивних ліній Що стосується диференційної скануючої калодифракції у зразках розсіювання рентгенівського риметрії (DSC), оскільки існують природні варіації випромінення і за характерними змінами у ділянміж незалежними зразками, способом одержання ках 15-30млн -1 в 13С ЯМР-спектрі. За цими змінами зразка, розмірами частки та її можливої мікронізаможна спостерігати. Однак, цей перехід можна ції, то положення ліній дифракції, особливо їх інлегше спостерігати за допомогою DSC. Перехід із тенсивність, можуть злегка відрізнятися поміж інкристалічної форми Fa на кристалічну форму Je дивідуальними зразками. Крім того, на положення супроводжується зменшенням інтенсивності піку максимуму на кривій DSC може злегка впливати при приблизно 155°С, підвищенням інтенсивності використана програма температури. піку при приблизно 163°С, і зрештою зникненням Спосіб одержання кристалічних форм Fa I Je цього дублету й утворенням одиничного піку при У даному винаході також запропоновано споприблизно 163°С. Утворення одиничного піку при сіб одержання кристалічних форм Fa і Je аторвасприблизно 163°С може бути використано як кінцетатину кальцію (2:1). Спосіб складається з піддава точка для спостерігання за переходом криставання аторвастатину температурним умовам, які лічної форми Fa аторвастатину кальцію на кристаприводять до утворення кристалічних форм Fa лічну форму Je. або Je. Точні умови, за яких утворюються форми Таким чином, за контрольованих умов може Fa і Je, можуть бути визначені емпірично. бути виділена чиста кристалічна форма Je аторКристалічні форми Fa і Je аторвастатину вастатину кальцію. До таких умов належать викокальцію можуть бути одержані шляхом кристалізаристання вищої температури, довшого часу крисції за контрольованих умов. Зокрема, вони можуть талізації та/або використання гептану або октану бути одержані шляхом кристалізації з неводних, як розчинників порівняно з процесом одержання неполярних розчинників при температурі ви ще кристалічної форми Fa. Виділені кристали можуть 90°С. До придатних неводних, неполярних розчинбути висушені загальноприйнятими способами. В ників належать, окрім іншого, вуглеводні, наприоптимальному варіанті спосіб виконують в інертній клад, октан, гептан, ізооктан, метилциклогексан атмосфері за інертного газу, наприклад, азоту, тощо, та їх суміші. аргону і т.п. В одному втіленні осад аморфного аторвастаСпособи цього винаходу призначені для викотину утворюється у водному середовищі осадженристання для будь-якого суб'єкта, який може поням аторвастатину розчинною сіллю, наприклад требувати використання способів винаходу. Таким лужною сіллю аторвастатину, придатною кальцієчином, згідно з винаходом, до "суб'єктів" належать вою сіллю, такою як ацетат кальцію. Осад безполюди, а також тварини, особливо домашні тварисередньо змішують з неводним, неполярним розни. чинником. Кристалізацію потім виконують при Слід розуміти, що суб'єкт, якому вводять спотемпературі вище 90°С. луку винаходу, не обов'язково має страждати на В іншому втіленні аморфний аторвастатин специфічну хворобу. Насправді, сполуки винаходу кальцію суспендують у воді та гідратують. Воду можуть бути введені профілактично перед будьзаміщують на неводний розчинник і розчин піддаяким розвитком симптомів. Термін "терапевтичють азеотропній дистиляції при температурі вище ний," "терапевтично," а також перестановки цих 90°С для утворення кристалічної форми аторвастермінів використано для означення терапевтичтатину кальцію даного винаходу. У ще одному втіного, полегшувального, а також профілактичного ленні кристалічну форму аторвастатин у кальцію І використання. Таким чином, при використанні в суспендують у неводних розчинниках і розчин, що цьому описі "лікування або полегшення симптомів" утворився, нагрівають до температури вище 90°С означає зменшення, запобігання та/або обернення для викликання кристалізації та утворення кристасимптомів індивіда, якому вводили сполуку виналічної форми аторвастатину кальцію даного винаходу, порівняно з симптомами індивіда, якому не ходу. проводили таке введення. Підвищена температура для кристалізації стаТермін "терапевтично ефективна кількість" виновить в оптимальному варіанті вище 90°С, а найкористаний для означення лікування з викорискраще - між 90° і 120°С. Таких температур можна танням доз, ефективних для одержання потрібного досягти також з розчинниками, що мають низьку терапевтичного результату. Крім того, фахівець у точку кипіння, таку як має гексан за підвищеного галузі зрозуміє, що терапевтично ефективна кільтиску. Зокрема, спосіб може бути використано для кість сполуки винаходу може бути знижена або того, щоби одержати кристалічні форми Fa і Je підвищена чітким розрахунком та/або введенням 11 77990 12 більш ніж однієї сполуки винаходу або уведенням зможуть встановити, використовуючи тільки звисполуки винаходу з іншою сполукою. Винахід, тачайні дослідження, численні еквіваленти конкретким чином, забезпечує спосіб підлаштування ввених сполук і процедур, описаних у цьому винаході. дення/лікування до певної необхідності, специфічПриклад 1 ної для даного ссавця. Як показано в наступних Аморфний аторвастатин кальцію (20г) суспенприкладах, терапевтично ефективна кількість модували у воді (160мл) і гідратували 20 хвилин при же бути легко визначена, наприклад емпірично, 100°С. Воду заміщували на ізооктан (160мл) і крипочинаючи від відносно низької кількості й послісталізацію виконували протягом 6 годин при 99°С. довно підвищуючи її з одночасною оцінкою корисПісля охолодження до температури між 20° і 30°С ного ефекту. суміш фільтрували, а кінцеву тверду речовину Сполуки згідно з винаходом за бажанням зависушували при 100°С протягом 30 годин за атмостосовуються у фармацевтично прийнятному носісферного тиску й у потоці азоту з утворенням криєві з будь-яким із добре-відомих фармацевтично сталічної форми Fa аторвастатину кальцію (17,3г). прийнятних носіїв, включаючи розчинники та наПриклад 2 повнювачі [див. Remington's Pharmaceutical SciКристалічну форму аторвастатину кальцію І ences. 18th Ed., Gennaro, Mack Publishing Co., (10г) суспендували в н-октані (200мл) і суміш наEaston, PA 1990 і Remington: Science and Practice грівали з перемішуванням до 120°С протягом 30 of Pharmacy. Lippincott, Williams & Wilkins, 1995]. хвилин у потоці азоту. Після охолодження до темТоді як тип фармацевтично прийнятного ноператури між 20° і 30°С суміш фільтрували, просія/наповнювача для використання в утворенні мивали петролейним етером і кінцеву тверду рекомпозицій винаходу змінюватиметься залежно від човину висушували при 50°С у вакуумі протягом 2 способу введення композиції ссавцеві, загалом годин з утворенням кристалічної форми Je аторфармацевтично прийнятні носії є фізіологічно іневастатину кальцію (9,1г). ртними та нетоксичними. Рецептури композицій Приклад 3 згідно з винаходом можуть містити більш ніж один Напівкристалічний осад аторвастатину кальтип сполуки винаходу, а також будь-який інший цію одержували реакцією 10г натрієвої солі аторфармакологічно активний інгредієнт, корисний для вастатину й еквімолярної кількості ацетату кальцію лікування потрібного симптому/стану. в 5% розчині водного метанолу. Осад фільтруваКристалічні сполуки цього винаходу можуть ли, промивали водним метанолом і розчинник забути одержані як фармацевтичні композиції шляміщували н-октаном (250мл). Суміш нагрівали з хом змішування сполуки з фармацевтично прийняперемішуванням до 120°С протягом 30 хвилин у тним носієм, ад'ювантом або наповнювачем. Кінпотоці азоту з азеотропною дистиляцією води. цеві фармацевтичні композиції можуть вводитись Після охолодження до температури між 20° і 30°С у великій кількості дозованих форм, наприклад, суміш фільтрували, промивали петролейним етеоральних, місцевих, парентеральних тощо. Є очером і остаточну тверду речовину висушували при видним для фахівців у галузі, що такі дозовані фо50°С у вакуумі протягом 2 годин з утворенням крирми, наприклад, порошки, таблетки, пілюлі, капсусталічної форми Je аторвастатину кальцію (7,7г). ли, агрегати, супозиторії, гранули і т.п., або рідкі Приклад 4 форми, наприклад, розчини, суспензії або емульсії Аморфний аторвастатин кальцію (20г) суспенможуть містити активний компонент цього винаходували у воді (160мл) і гідратували 20 хвилин при ду. У твердій дозованій формі кристалічна форма 100°С. Гідратований аторвастатин кальцію висуFa аторвастатину кальцію або Je розподіляється шували протягом 2 годин при 100°С. До висушеноабо дрібно змішується з одним або кількома неакго аторвастатину кальцію додавали воду (13г) з тивними інгредієнтами, які можуть діяти як неактинаступним додаванням н-гептану (160мл). Суміш вні наповнюючі матеріали, смакові або ароматичні піддавали азеотропній дистиляції протягом 6 гододатки, хімічні консерванти, солюбілізатори, дин при кінцевій температурі 98,5°С. Спостеріганзмащувачі, тощо. У рідкій формі кристалічну форня реакції DSC виявило, що кристалічна форма Fa му Fa аторвастатин у кальцію або Je суспендують, аторвастатину кальцію утворювалась у чистому емульсифікують або розчиняють у придатних носістані в межах однієї години. Після двох годин ях, що містять різні неактивні компоненти, наприутворювалась суміш кристалічної форми Fa аторклад, розчинники, буфери, стабілізатори, барвнивастатину кальцію і Ja (приблизно 1:1). Після 3 ки, ароматизатори, тощо. Кращі дозовані одиниці годин продукт був майже повністю кристалічною фармацевтичної композиції цього винаходу типово формою Je аторвастатину кальцію. Після охоломістять від 0,5 до 100мг кристалічної форми Fa дження до температури між 20°С і 30°С суміш фіаторвастатину кальцію або Je або суміш кристалільтрували й решту твердої речовини висушували чної форми Fa і Je. при 100°С протягом 30 годин за атмосферного Наступні приклади призначені для подальшої тиску та в потоці азоту з утворенням кристалічної ілюстрації певних оптимальних втілень винаходу й форми Je аторвастатину кальцію (18,3г). не є обмежуючими. Фахівці в галузі визначать або Хоча основні ознаки були проілюстровані й зможуть встановити, використовуючи тільки звиописані стосовно конкретних втілень, має бути чайні дослідження, численні еквіваленти конкреточевидно, що модифікації можуть бути зроблені в них сполук і процедур, описаних у цьому винаході. межах сутності й об'єму винаходу, й, отже, не має Приклади наміру обмежити винахід до точних деталей, які Наступні приклади призначені для подальшої було показано та описано. ілюстрації певних оптимальних втілень винаходу й не є обмежуючими. Фахівці в галузі визначать або 13 77990 14 15 Комп’ютерна в ерстка Т.Чепелева 77990 Підписне 16 Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCrystalline calcium salt of (2:1) [r-(rr)]-2-(4-fluorophenyl)-b,д-dihydroxy-5-(1-methylethyl)-3-phenyl-4-[(phenylamino)carbonyl]-1h-pyrroleheptanic acid
Назва патенту російськоюКристаллическая кальциевая соль (2:1) [r-(rr)]-2-(4-фторфенил)-b,д-дигидрокси-5-(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1н-пирролгептановой кислоты
МПК / Мітки
МПК: C07D 207/337, A61P 43/00, C07D 207/34, A61P 3/06, A61K 31/40
Мітки: кальцієва, 2:1, кристалічна, сіль, r-(rr)]-2-(4-фторфеніл)-b,d-дигідрокси-5-(1-метилетил)-3-феніл-4-[(феніламіно)карбоніл]-1н-піролгептанової, кислоти
Код посилання
<a href="https://ua.patents.su/8-77990-kristalichna-kalciehva-sil-21-r-rr-2-4-ftorfenil-bd-digidroksi-5-1-metiletil-3-fenil-4-fenilaminokarbonil-1n-pirolgeptanovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Кристалічна кальцієва сіль (2:1) [r-(rr)]-2-(4-фторфеніл)-b,d-дигідрокси-5-(1-метилетил)-3-феніл-4-[(феніламіно)карбоніл]-1н-піролгептанової кислоти</a>
Попередній патент: Застосування мутанта сс-хемокіну при лікуванні розсіяного склерозу
Наступний патент: Укладальна головка прокатного стана з сегментним кільцевим напрямним пристроєм
Випадковий патент: Спосіб будівництва корнійця в.і.