4-гідрокси-4-метилпіперидин-1-карбонової кислоти (4-метокси-7-морфолін-4-ілбензотіазол-2-іл)-амід
Номер патенту: 87142
Опубліковано: 25.06.2009
Автори: Моро Жан-Люк, Стюард Люсінда, Флор Александер, Полі Соня Марія, Рімер Клаус
Формула / Реферат
1. Сполука формули
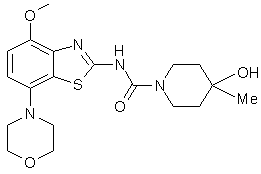 , I
, I
що є 4-гідрокси-4-метилпіперидин-1-карбонової кислоти (4-метокси-7-морфолін-4-ілбензотіазол-2-іл)-амідом, і її фармацевтично прийнятні кислотно-адитивні солі.
2. Медикамент, що містить сполуку за п. 1 і фармацевтично прийнятні наповнювачі.
3. Медикамент за п. 2 для лікування або попередження захворювань, які пов’язані з аденозиновими рецепторами.
4. Медикамент за п. 3 для лікування або попередження захворювань, які пов’язані з аденозиновим рецептором А2А.
5. Медикамент за п. 4 для лікування або попередження хвороби Альцгеймера, хвороби Паркінсона, хвороби Гентингтона, нейропротективної дії, шизофренії, тривожності, болю, порушень дихальної функції, депресії, ADHD (гіперактивність, пов'язана з дефіцитом уваги), залежності від амфетамінів, кокаїну, опіоїдів, етилового спирту, нікотину, канабіноїдів або для лікування астми, алергічних реакцій, гіпоксії, ішемії, епілептичного нападу, зловживання алкоголем або наркотиками, або для використання як м'язових релаксантів, нейролептиків, антиепілептиків, антиконвульсантів і кардіопротекторних агентів.
6. Медикамент за п. 5 для лікування або попередження хвороби Паркінсона, ADHD (гіперактивність, пов'язана з дефіцитом уваги), депресивних розладів і наркоманії.
7. Спосіб для отримання сполуки формули І за п. 1, при якому проводять
реакцію сполуки формули
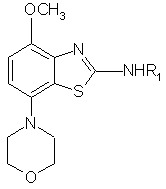
зі сполукою формули
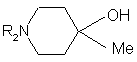
з отриманням сполуки формули
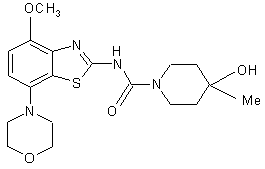 , І
, І
де R1 являє собою Н або COL, причому L є відхідною групою, такою як галоген, -О-феніл, -О-нітрофеніл або -О-нижчий алкіл,
R2 являє собою Н або СОСl,
і, необов’язково, перетворення отриманих сполук у фармацевтично прийнятні кислотно-адитивні солі.
8. Сполука за п. 1, що отримана способом за п. 7 або рівноцінним способом.
9. Застосування сполуки за п. 1 для лікування або попередження захворювань, які пов'язані з аденозиновим рецептором А2А.
10. Застосування сполуки за п. 1 для виготовлення відповідних медикаментів для лікування або попередження хвороби Альцгеймера, хвороби Паркінсона, хвороби Гентингтона, нейропротективної дії, шизофренії, тривожності, болю, порушень дихальної функції, депресії, ADHD (гіперактивність, пов'язана з дефіцитом уваги), залежності від амфетамінів, кокаїну, опіоїдів, етилового спирту, нікотину, канабіноїдів або для лікування астми, алергічних реакцій, гіпоксії, ішемії, епілептичного нападу, зловживання алкоголем або наркотиками, або для використання як м'язових релаксантів, нейролептиків, антиепілептиків, антиконвульсантів і кардіопротекторних агентів.
11. Застосування за п. 10 для виготовлення відповідних медикаментів для лікування хвороби Паркінсона.
12. Застосування за п. 10 для виготовлення відповідних медикаментів для лікування ADHD (гіперактивність, пов'язана з дефіцитом уваги).
13. Застосування за п. 10 для виготовлення відповідних медикаментів для лікування депресії.
14. Застосування за п. 10 для виготовлення відповідних медикаментів для лікування залежності від амфетамінів, кокаїну, опіоїдів, етилового спирту, нікотину і канабіноїдів.
Текст
1. Сполука формули 2 (19) ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ 3 87142 4 9. Застосування сполуки за п.1 для лікування або попередження захворювань, які пов'язані з аденозиновим рецептором А2А. 10. Застосування сполуки за п.1 для виготовлення відповідних медикаментів для лікування або попередження хвороби Альцгеймера, хвороби Паркінсона, хвороби Гентингтона, нейропротективної дії, шизофренії, тривожності, болю, порушень дихальної функції, депресії, ADHD (гіперактивність, пов'язана з дефіцитом уваги), залежності від амфетамінів, кокаїну, опіоїдів, етилового спирту, нікотину, канабіноїдів або для лікування астми, алергічних реакцій, гіпоксії, ішемії, епілептичного нападу, зловживання алкоголем або наркотиками, або для використання як м'язових релаксантів, нейролеп тиків, антиепілептиків, антиконвульсантів і кардіопротекторних агентів. 11. Застосування за п.10 для виготовлення відповідних медикаментів для лікування хвороби Паркінсона. 12. Застосування за п.10 для виготовлення відповідних медикаментів для лікування ADHD (гіперактивність, пов'язана з дефіцитом уваги). 13. Застосування за п.10 для виготовлення відповідних медикаментів для лікування депресії. 14. Застосування за п.10 для виготовлення відповідних медикаментів для лікування залежності від амфетамінів, кокаїну, опіоїдів, етилового спирту, нікотину і канабіноїдів. Даний винахід має відношення до 4-гідрокси-4метил-піперидин-1-карбонової кислоти (4-метокси7-морфолін-4-іл-бензотіазол-2-іл)-аміду, який являє собою сполуку формули циклазної ефекторної системи, яка використовує сАМР як вторинний месенджер. Рецептори А1 і А3, зв'язані з білками Gі, інгібують аденілат-циклазу, що приводить до зниження клітинних рівнів сАМР, в той час, як рецептори А2А і А2 зв'язуються з білками Gs і активують аденилат-циклазу, що приводить до підвищення клітинних рівнів сАМР. Відомо, що система рецептору А1 активує фосфоліпазу С і модулює як калієві, так і кальцієві іонні канали. Підтип А3, крім своєї асоціації з аденілатциклазою, також симулює фосфоліпазу С і активує кальцієві іонні канали. Рецептор А1 (амінокислоти 326-328) був клонований з різних видів (представник родини собачих, людина, щур, собака, курка, корова, морська свинка) з 90-95% ідентифікацією послідовності у цих видів ссавців. Рецептор А2А (амінокислоти 409412) був клонований з представника родини собачих, щура, людини, морської свинки і миші. Рецептор А2В (амінокислоти 332) був клонований з людини і миші і демонструє 45% гомології з рецепторами А1 і А2А людини. Рецептор А3 (амінокислоти 317-320) був клонований з людини, щура, собаки, кроля і вівці. Припускають, що підтипи рецепторів А1 і А2 грають взаємодоповнюючі ролі у аденозиновій регуляції постачання енергії. Аденозин, що є продуктом метаболізму АТР, дифундує з клітини і діє локально для активації аденозинових рецепторів для того, щоб знизити потребу у кисні (А1) або підвищити надходження кисню (А2А), і, таким чином, відновлює баланс постачання енергії: потребу в межах тканини. Дії обох підтипів направлені на збільшення кількості доступного до тканини кисню і захист клітини від порушень, спричинених короткочасним дисбалансом кисню. Однією з важливих функцій ендогенного аденозину є попередження порушень при таких пошкодженнях, як гіпоксія, ішемія, гіпотонія і епілептичний напад. Крім того, відомо, що зв'язування агоніста аденозинового рецептору з тучними клітинами, що експресують А3 рецептор щура, приводить до підвищення концентрацій інозитол трифосфату і внутрішньоклітинного кальцію, що підсилює індуковану антигеном секрецію медіаторів запалення. Таким чином, рецептор А3 відіграє роль в опосе і її фармацевтично прийнятні кислотноадитивні солі. Було з'ясовано, що сполука формули І є високо спорідненим, високо селективним антагоністом аденозинового рецептору А2А, що проявляє сильний і пролонгований антагонізм при пероральному введенні in vivo по відношенню до стану, що спричинений агоністом рецептору А2А Дана сполука в основному включена в заявку [W0 01/097786]. Аденозин модулює широкий ряд фізіологічних функцій за допомогою взаємодії зі специфічними рецепторами на поверхні клітини. Можливість того, що аденозинові рецептори виступають в якості мішеней для лікарських засобів, вперше була розглянута в 1982р. Аденозин відносять як за структурою, так і метаболізмом до біоактивних нуклеотидів трифосфату аденозину (АТР), дифосфату аденозину (ADP), монофосфату аденозину (AMP) і циклічного монофосфату аденозину (сАМР); до біохімічного агенту S-аденозил-L-метіону (SAM), що метилює; і за структурою відносять до коензимів NAD (нікотинамідаденіндинуклеотид), FAD (флавінаденіндинуклеотид) і коензиму А, а також до РНК. Аденозин разом з даними зв'язаними сполуками є важливим у регуляції багатьох аспектів клітинного метаболізму та в модуляції різних видів активності центральної нервової системи. Аденозинові рецептори були класифіковані як А1 А2А, А2В і А3 рецептори, що належать до родини рецепторів, зв'язаних з G-білком. Активація аденозинових рецепторів аденозином ініціює механізми передачі сигналу. Дані механізми залежать від G білка, зв'язаного з рецептором. Кожен з підтипів аденозинового рецептору є типовим для аденілат 5 редкуванні нападів астми та інших алергічних реакцій. Аденозин являє собою нейромедіатор, що здатний модулювати багато аспектів психологічної функції мозку. Ендогенний аденозин, центральна ланка між енергетичним метаболізмом і нейрональною активністю, змінюється згідно з формою поведінки і (пато)фізіологічними умовами. За умов підвищеної потреби і зниженої доступності енергії (наприклад, при гіпоксії, гіпоглікемії та/або надмірній нервовій активності), аденозин забезпечує сильний захисний зворотній механізм. Взаємодія з аденозиновими рецепторами представляє перспективну мішень для терапевтичного втручання при деяких неврологічних і психіатричних захворювань, таких як епілепсія, порушення сну, руху (хвороби Паркінсона або Гентингтона), хвороба Альцгеймера, депресія, шизофренія або згубні звички. Підвищення вивільнення нейромедіатору спостерігається після таких пошкоджень, як гіпоксія, ішемія і епілептичні напади. Дані нейромедіатори зрештою є відповідальними за нервову дегенерацію і відмирання нервової системи, що спричиняють пошкодження мозку або смерть індивідууму. Агоністи аденозину А1 відтворюють центральні інгібіторні ефекти аденозину і можуть, таким чином, використовуватись як нейропротекторні агенти. Аденозин був запропонований як ендогенний протиконвульсивний агент, що інгібує вивільнення глутамату зі збуджуючих нейронів і інгібує нейрональне запалення. Таким чином, агоністи аденозину можуть застосовуватись як антиепілептичні агенти. Більш того, доведено, що антагоністи є ефективними в якості підсилюючих агентів у процесі пізнання. Селективні антагоністи А2А мають терапевтичну здатність лікувати різні форми деменції, наприклад, хворобу Альцгеймера і нейродегеративні захворювання, наприклад, параліч. Антагоністи аденозинового рецептору А2А модулюють активність стріарних ГАМК-ергічних нейронів і регулюють повільні і добре координовані рухи, таким чином ці антагоністи пропонують потенційну терапію симптомів паркінсонізму. Аденозин також бере участь у певній кількості фізіологічних процесів, що пов'язані із заспокоєнням, гіпнозом, шизофренією, тривожністю, болем, диханням, депресією і наркоманією (залежністю від амфетаміну, кокаїну, опіоїдів, етанолу, нікотину, канабіноїдів). Таким чином, дія лікарських засобів на рецептори аденозину має терапевтичну активність в якості седативних засобів, м'язових релаксантів, нейролептиків, анксіолітиків, анальгетиків, стимуляторів дихання, антидепресантів і для лікування станів при наркотичній залежності. Також вони можуть використовуватись у лікуванні ADHD (гіперактивність, пов'язана з дефіцитом уваги). Аденозин відіграє важливу роль у серцевосудинній системі в якості кардіопротекторного агенту. Рівні ендогенного аденозину підвищуються у відповідь на ішемію та гіпоксію і захищають серцеву тканину протягом і після травми (попередня адаптація). Дією на рецептор А1 агоністи аденозину А1 можуть захищати від пошкодження, спричиненого міокардіальною ішемією і реперфузією. 87142 6 Модулюючий вплив рецепторів А2А на адренергічну функцію може мати наслідки для різних порушень, таких як захворювання коронарної артерії та серцева недостатність. Антагоністи А2А можуть бути терапевтично вигідними у ситуаціях, де необхідна посилена антиадренергічна відповідь, наприклад протягом гострої міокардіальної ішемії. Селективні антагоністи А2А рецепторів можуть також підсилювати ефективність аденозину наприкінці суправентрикулярної аритмії. Аденозин модулює багато аспектів ниркової функції, включаючи вивільнення реніну, швидкість клубочкової фільтрації і нирковий кровотік. Сполуки, що протидіють нирковим порушенням, спричиненим аденозином, можуть бути використані в якості ниркових захисних агентів. Більш того, антагоністи аденозину А3 та/або А2В можуть використовуватись для лікування астми та інших алергічних реакцій, а також для лікування цукрового діабету та ожиріння. Значна кількість документів описують рівень техніки щодо аденозинових рецепторів, наприклад, наступні публікації: [Bioorganic & Medicinal Chemistry, 6, (1998), 619-641, Bioorganic & Medicinal Chemistry, 6, (1998), 707-719, J. Med. Chem., (1998), 41,2835-2845, J. Med. Chem, (1998), 41, 3186-3201, J. Med. Chem, (1998), 41, 2126-2133, J. Med. Chem, (1999), 42, 706-721, J. Med. Chem, (1996), 39,1164-1171, Arch. Pharm. Med. Chem, 332, 39-41, (1999), Am. J. Physiol, 276, HI 113-1116, (1999) або Naunyn Schmied, Arch. Pharmacol. 362, 375381, (2000)]. Об'єктами даного винаходу є сполука формули І по суті, використання даної сполуки та її фармацевтично прийнятих солей для виготовлення медикаментів для лікування захворювань, пов'язаних з аденозиновим рецептором А2A, її виготовлення, медикаменти, основані на сполуці згідно винаходу та її виготовлення, а також використання сполуки формули І у контролі або попередженні хвороб, що основані на модуляції аденозинової системи, таких як хвороба Альцгеймера, хвороба Паркінсона, хвороба Гентингтона, нейропротективна дія, шизофренія, тривожність, біль, порушення дихальної функції, депресія, наркоманія, а саме, амфетамінова, кокаїнова, опіоїдна, алкогольна, нікотинова, канабіноїдна, або проти астми, алергічних реакцій, гіпоксії, ішемії, нападу і зловживання алкоголем або наркотиками. Більш того, сполуки за даним винаходом можуть використовуватись як седативні засоби, м'язові релаксанти, нейролептики, антиепілептики, антиконвульсанти і кардіопротекторні агенти для таких порушень, як захворювання коронарної артерії та серцева недостатність. Більш переважними показаннями згідно даного винаходу є ті, що основані на антагоністичній активності рецептора А2A і які включають порушення центральної нервової системи, наприклад лікування або попередження хвороби Альцгеймера, депресивних розладів, наркоманії, 7 нейропротективної дії і хвороби Паркінсона, а також ADHD. Як тут зазначено, термін "нижчий алкіл" означає насичену нерозгалужену або розгалужену алкільну групу, що містить від 1 до 6 атомів вуглецю, наприклад метил, етил, пропіл, ізопропіл, n-бутил, і-бутил, 2-бутил, t-бутил і подібне. Переважно, нижчі алкільні групи - це групи з 1-4 атомами вуглецю. Термін "галоген" означає хлор, йод, фтор і бром. Термін "фармацевтично прийнятні кислотноадитивні солі" охоплює солі неорганічних і органічних кислот, таких як соляна кислота, азотна кислота, сірчана кислота, фосфорна кислота, лимонна кислота, мурашина кислота, фумарова кислота, малеїнова кислота, оцтова кислота, бурштинова кислота, винна кислота, метансульфонова кислота, р-толуолсульфонова кислота і подібне. Дана сполука формули І та її фармацевтично прийнятні солі можуть бути отримані способами, що відомі у техніці, наприклад, способами, що описані нижче, де спосіб включає: а) реакцію сполуки формули 87142 8 де L являє собою відхідну групу, таку як галоген, -О-феніл, -О-нітрофеніл або -О-нижчий алкіл, і, якщо необхідно, перетворення отриманих сполук у фармацевтично прийнятні кислотноадитивні солі. Сполуки формули І можуть бути отримані згідно варіантів процесу а) або b). Більш того, у прикладах 1-7 і у наступних схемах 1, 2 і 3 отримання сполуки формули І описано більш детально. Вихідними матеріалами є відомі сполуки або вони можуть бути отримані згідно способів, відомих із рівня техніки. Отримання сполук формули І Одним способом отримання сполуки формули (І) згідно наступної схеми 1, є наступний: до розчину проміжної речовини 7-(морфолін-4-іл)-4метокси-бензотіазол-2-іламін (II), яка може бути отримана згідно схеми 3, у дихлорметані, послідовно додають основу, наприклад піридин або діізопропіл-етиламін і сполуку формули (III), отриманий розчин перемішують приблизно протягом 45 хвилин при температурі зовнішнього середовища. Додають насичений водний гідрокарбонат натрію, органічну фазу відділяють і висушують. зі сполукою формули для отримання сполуки формули або b) реакцію сполуки формули Інший спосіб отримання сполуки формули (І) є наступний: до розчину сполуки формули (IV), яка може бути отриманий згідно способів, що добре відомі з рівня техніки, і яка описана у [WO 01/97786], в інертному розчиннику, наприклад у дихлорметані, послідовно додають основу, наприклад, піридин або діізопропілетиламін і сполуку формули (V), отриманий розчин перемішують приблизно протягом 45 хвилин при 45°С. Після охолодження до температури навколишнього середовища додають насичений водний розчин гідрокарбонату натрію, органічну фазу відділяють і висушують. зі сполукою формули для отримання сполуки формули де L являє собою відхідну групу, таку як галоген, -О-феніл, -О-нітрофеніл або -О-нижчий алкіл. 9 а являє собою морфолін, Pd(Ac)2, 2-біфенілдициклогексил фосфін, К3РО4, DME (диметоксіетан); b являє собою Н2, Pd на вуглецю, метанол; с являє собою бензоїл ізотіоціанат, ацетон; d являє собою метанольний метанолат натрію; е являє собою бром у трихлорметані; Ізоляція і очищення сполук Ізоляція і очищення сполуки і проміжних речовин, що описані тут, можуть бути здійснені, якщо бажано, за будь-якою необхідною процедурою розділення і очищення, такою як, наприклад, фільтрація, екстракція, кристалізація, колонкова хроматографія, тонкошарова хроматографія, товстошарова хроматографія, хроматографія під низьким або високим тиском або комбінацією даних процедур. Специфічні ілюстрації відповідних процедур розділення та ізоляції можуть бути отримані з посиланням на виготовлення і приклади, викладені нижче. Проте, звичайно, також може застосовуватись інший еквівалент процедур розділення і очищення. Солі сполук формули І Перетворення на відповідну кислотноадитивну сіль завершується обробкою щонайменше стехіометричною кількістю відповідної кислоти, такої як соляна кислота, бромоводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота і подібне, та органічними кислотами, такими як оцтова кислота, пропіонова кислота, гліколева кислота, піровиноградна кислота, щавелева кислота, яблучна кислота, малонова кислота, бурштинова кислота, малеїнова кислота, фумарова кислота, винна кислота, лимонна кислота, бензойна кислота, корична кислота, мигдальна кислота, метансульфонова кислота, етансульфонова кислота, р-толуолсульфонова кислота, саліцилова кислота і подібне. Типово вільна основа розчиняється в інертному органічному розчиннику, такому як діетиловий ефір, етилацетат, хлороформ, етанол або метанол і у подібному, а кислота додана у подібний розчинник. Температуру підтримують між 0°С і 50°С. Отримана сіль спонтанно випадає в осад або цю сіль можна видалити з розчину менш полярним розчинником. 87142 10 Кислотно-адитивні солі основних сполук формули І можуть перетворюватись у відповідні вільні основи за допомогою обробки щонайменше стехіометричним еквівалентом відповідної основи, такої як гідроксид натрію або калію, карбонат калію, бікарбонат натрію, аміак і подібне. Сполука формули І та її фармацевтично придатні адитивні солі володіють цінними фармакологічними властивостями. Головним чином, було з'ясовано, що сполука за даним винаходом являє собою ліганд аденозинового рецептору і має високу спорідненість до аденозинового рецептора А2А. Сполуки досліджувались згідно з тестами, що представлені нижче. Спорідненість 4-гідрокси-4-метил-піперидин-1карбоксильної кислоти (4-метокси-7-морфолін-4іл-бензотіазол-2-іл)-аміду до рецептору А2А оцінювалась на рецепторах А2А людини, рекомбінантно експресованих у клітинах яєчника китайського хом'яка (СНО), застосовуючи системи експресії вірусу лісу Семліки. Клітини зібрали, двічі відмили центрифугуванням, гомогенізували і знову відмили центрифугуванням. Осад після центрифугування суспендували у трис-буфері (50 мМ) , що містить 120мМ NaCl, 5мМ СаСl2 і 10мМ MgCl2 (pH 7,4) (буфер А). 3Н SCH-58261 (Dionisotti et al., 1997, Br J Pharmacol 121, 353; 1нМ) аналіз зв'язування проводився у 96-лункових планшетах у присутності приблизно 2,5мкг мембранного білку, 0,5мг мікрокульок Ysi-полі-L-лізіну для проведення SPAаналізу і 0,1 одиниці деамінази аденозину в кінцевому об'ємі буферу 200мкл. За допомогою застосування представника групи аміна ксантина (ХАС; 2мкМ) були виявлені неспецифічні компоненти, що зв'язують. Сполуки досліджувались при 10 концентраціях від 10мкМ до 0,3нМ. Усі аналізи проводились в двох паралелях і повторювались щонайменше двічі. Планшети аналізу інкубувались протягом 1 години при кімнатній температурі до центрифугування, і потім зв'язаний ліганд досліджувався, застосовуючи сцинтиляторний лічильник Packard Topcount. Значення ІС50 були розраховані, використовуючи відповідну програму нелінійної кривої, і значення Кi були розраховані, використовуючи рівняння Ченга-Прюссова. Результати тесту 11 Було з'ясовано, що 4-гідрокси-4-метилпіперидин-1-карбоксильної кислоти (4-метокси-7морфолін-4-іл-бензотіазол-2-іл)-амід є високо спорідненим, сильним і селективним антагоністом рекомбінантних рецепторів аденозину А2A людини. Він має спорідненість (рКi) 8,3 для А2A рецептора людини зі значенням селективності вище на два порядки для рецептору А2A порівняно з рецепторами А1 А2В і А3. Подальші дослідження визначили селективність 4-гідрокси-4-метил-піперидин-1карбоксильної кислоти (4-метокси-7-морфолін-4іл-бензотіазол-2-іл)-аміду по відношенню до численних нейротрансмедіаторних транспортерів, іонних каналів і мішеней ферментів. 4-Гідрокси-4метил-піперидин-1-карбоксильної кислоти (4метокси-7-морфолін-4-іл-бензотіазол-2-іл)-амід проявляє більш ніж у 1000 разів вищу селективність для рецептору А2A, ніж для інших мішеней, що були проаналізовані. Активність in vitro була встановлена вивченням здатності сполуки протидіяти NECAстимульованому (неспецифічний агоніст аденозинового рецептору) потоку Са2+ у клітинах СНО, що експресують рецептори А2A людини, зв'язані з G білком Ga16. 4-гідрокси-4-метил-піперидин-1 карбоксильної кислоти (4-метокси-7-морфолін-4іл-бензотіазол-2-іл)-амід інгібував Агдопосередковані реакції при рІС50 8,83 (коефіцієнт Хілла 0,6). 4-гідрокси-4-метил-піперидин-1карбоксильної кислоти (4-метокси-7-морфолін-4іл-бензотіазол-2-іл)-амід протидіяв NECAстимульованому потоку Са2+ у клітинах СНО, що експресують рецептори А] людини, зв'язані з G протеїном Ga16 при рІС50 5,22 (коефіцієнт Хілла 0,7). Таким чином, у даному функціональному аналізі, 4-гідрокси-4-метил-піперидин-1карбоксильної кислоти (4-метокси-7-морфолін-4іл-бензотіазол-2-іл)-амід проявляє селективність більш ніж у 4000 разів вищу для А2A рецептору людини, ніж для А1 рецептору людини. Було з'ясовано, що in vivo 4-гідрокси-4-метилпіперидин-1-карбоксильної кислоти (4-метокси-7морфолін-4-іл-бензотіазол-2-іл)-амід є сильним антагоністом пролонгованої дії, активним при пероральному введенні. Він протидіє зниженій локомоції, індукованій у щурів з підшкірними ін'єкціями 0,01мг/кг АРЕС (2-([2-аміноетиламіно) карбонілетилфенілетиламіно]-5'-Nетилкарбоксамідоаденозин), агоніста аденозинового рецептора А2A - Доза цієї сполуки для перорального введення, розрахована для інгібування 50% АРЕС-індукованої зниженої локомоції, складала 0,5мг/кг. Концентрація сполуки в плазмі, що становила 290нг/мл, була необхідною для повної протидії даній АРЕС-індукованій зниженій локомоції. Такий антагонізм утримувався декілька годин і мав функціональний період напіврозпаду приблизно 8 годин у даній моделі. Фармакокінетичні параметри оцінювались у щурів і собак. Після внутрішньовенного введення щурам період напіврозпаду сполуки складав 4 години, кліренс - 11мл/хв/кг, об'єм розподілення 1,4 л/кг; пероральна біодоступність при введенні щурам 5мг/кг складає 77%. Після внутрішньовенного введення собакам період напіврозпаду моле 87142 12 кули складає 2,2 години, кліренс - 8мл/хв/кг, об'єм розподілення 1,2л/кг; пероральна біодоступність при введенні 5мг/кг складає 88%. З'ясовано, що 4-гідрокси-4-метил-піперидин-1карбоксильної кислоти (4-метокси-7-морфолін-4іл-бензотіазол-2-іл)-амід є високо спорідненим, високо селективним антагоністом аденозинового рецептору А2A, що проявляє сильний і пролонгований антагонізм при пероральному введенні in vivo по відношенню до реакції, яка спричинена агоністом рецептору А2A. Сполука формули І і фармацевтично прийнятні солі сполуки формули І можуть застосовуватися як медикаменти, наприклад, у формі фармацевтичних препаратів. Фармацевтичні препарати можуть бути введені перорально, наприклад, у формі таблеток, покритих таблеток, драже, твердих і м'яких желатинових капсул, розчинів, емульсій або суспензій. Проте, введення може здійснюватися також ректально, наприклад, у формі супозиторіїв, а також парентально, наприклад, у формі розчинів для ін'єкцій. Сполуки формули І можуть бути оброблені фармацевтично інертними, неорганічними або органічними носіями для виготовлення фармацевтичних препаратів. Лактоза, кукурудзяний крохмаль або його похідні, тальк, стеаринові кислоти або їх солі і подібне можуть використовуватись, наприклад, як носії для таблеток, покритих таблеток, драже, твердих желатинових капсул. Відповідними носіями для м'яких желатинових капсул є, наприклад, рослинні олії, воски, жири, напівтверді і рідкі поліоли і подібне. Проте, у випадку м'яких желатинових капсул в залежності від природи активної речовини звичайно немає потреби в будьякому носії. Відповідними носіями для виготовлення розчинів і сиропів є, наприклад, вода, поліоли, гліцерин, рослинна олія і подібне. Відповідними носіями для супозиторіїв є, наприклад, природні і гідрогенізовані олії, воски, жири, напіврідкі і рідкі поліоли і подібне. Крім того, фармацевтичні препарати можуть містити консерванти, солюбілізатори, стабілізатори, зволожуючі агенти, емульгатори, підсолоджувачі, барвники, ароматизатори, солі для зміни осмотичного тиску, буфери, агенти, що маскують смак та запах, або антиоксиданти. Також вони можуть містити ще інші терапевтично корисні речовини. Медикаменти, що містять сполуку формули І або її фармацевтично прийнятні солі і терапевтично інертні носії, також є об'єктом даного винаходу, як і спосіб їх виготовлення, що включає введення однієї або декількох сполук формули І і/або фармацевтично прийнятих кислотно-адитивних солей і, якщо необхідно, однієї або декількох терапевтичних активних речовин до галенового препарату з одним або декількома терапевтично інертними носіями. Згідно винаходу сполука формули І, а також її фармацевтично прийнятні солі корисні для лікування або попередження хвороб, що у своїй основі мають активність антагоністу аденозинового рецептору А2A, таких як хвороба Альцгеймера, хвороба Паркінсона, хвороба Гентингтона, нейропротекти 13 вна дія, шизофренія, тривожність, біль, порушення дихальної функції, депресія, ADHD (гіперактивність, пов'язана з дефіцитом уваги), наркотична залежності від амфетамінів, кокаїну, опіоїдів, етилового спирту, нікотину, канабіноїдів, або для лікування астми, алергічних реакцій, гіпоксії, ішемії, епілептичного нападу і зловживання алкоголем або наркотиками, або для використання в якості м'язових релаксантів, нейролептиків, антиепілептиків, антиконвульсантів і кардіопротекторних агентів. Більш переважними показаннями згідно даного винаходу є ті, що включають порушення центральної нервової системи, наприклад, лікування або попередження хвороби Паркінсона, ADHD, депресивних порушень і наркоманії. Дозування може варіювати у широких межах і буде, звичайно, підібрано згідно індивідуальної необхідності у кожному окремому випадку. У випадку перорального введення дозування для дорослих може варіювати приблизно від приблизно 0,01мг до приблизно 1000мг на день сполуки загальної формули І або відповідної кількості її фармацевтично прийнятої солі. Щоденне дозування може бути введено у формі однієї дози або поділених доз, і, до того ж, може бути перевищена зазначена верхня межа, якщо це було показано. Наступні виготовлення і приклади ілюструють винахід, але не направлені на обмеження його обсягу. Приклад 1 4-Гідрокси-4-метил-піперидин-1-карбоксильної кислоти (4-метокси-7-морфолін-4-іл-бензотіазол-2іл)-амід (І) До розчину (4-метокси-7-морфолін-4-ілбензотіазол-2-іл)-карбамінової кислоти фенільного ефіру (3,2г, 8,3ммоль) і N-етил-діізопропіламіну (4,4мл, 25ммоль) у трихлорметані (50мл) додають розчин 4-гідрокси-4-метил-піперидину у трихлорметані (3мл) і тетрагідрофурані (3мл) і отриману суміш дефлегмують протягом 1 години. Потім реакційну суміш охолоджують до температури навколишнього середовища і екстрагують насиченим водним карбонатом натрію (15 мл) і водою (2 по 5мл). Залишок висушують сульфатом магнію, і за допомогою випарювання розчинника і перекристалізації з етанолу отримують зазначену сполуку у вигляді білих кристалів (вихід 78%), т.пл. 236°С. MS (мас-спектрометрія): m/е=407(М+Н+). Приклад 2 (4-метокси-7-морфолін-4-іл-бензотіазол-2-іл)карбамінової кислоти фенільний ефір (VI) Суспензію 4-метокси-7-морфолін-4-ілбензотіазол-2-іламіну (26,5г, 100ммоль) у дихлорметані (56мл) і піридин (56мл, 700ммоль) додають до фенілхлорформіату (15,7мл, 125ммоль) при 05°С і реакційну суміш нагрівають до температури навколишнього середовища. Після 1 години додають воду (7,2мл, 400ммоль) і реакційну суміш нагрівають протягом 1 години до 45°С. Потім додають етилацетат (250мл) і 2М HCL (125мл) і відділяють органічну фазу. Після видалення розчинника і перекристалізації з трет 87142 14 бутилметилового ефіру і наприкінці з етанолу була отримана зазначена сполука у вигляді білої твердої речовини (80% виходу), т.пл. 166-168°С. MS: m/e=386(M+H+). Приклад 3 4-метокси-7-морфолін-4-іл-бензотіазол-2-іламін(II) (2-Метокси-5-морфолін-4-іл-феніл)тіосечовину (5,0г, 19ммоль) у хлороформі (130мл) обробляють бромом (960мкл) і суміш дефлегмують протягом 18 годин. Після видалення летких компонентів під вакуумом, продукт рекристалізують з THF (тетрагідрофуран) (2,8г, 57%). MS: m/e=266 (M+). Приклад 4 (2-метокси-5-морфолін-4-іл-феніл)тіосечовина 1-бензоїл-3-(2-метокси-5-морфолін-4-ілфеніл)-тіосечовину (8,0г, 21ммоль), суспендований у метанолі (260 мл), обробляють 6мл метанолату натрію (5,4М у метанолі) і суміш перемішують до утворення білого осаду. Суміш концентрують під вакуумом, кристали відділяють фільтрацією і промивають метанолом і гексаном (5,0г, 86%). MS: m/e=268 (М+). Приклад 5 1-бензоїл-3-(2-метокси-5-морфолін-4-ілфеніл)-тіосечовина До розчину 2-метокси-5-морфолін-4-ілфеніламіну (4,6г, 22ммоль) в ацетоні (140мл) додають розчин бензоїлізотіоціанату (3,4мл, 25ммоль) в ацетоні (80мл) і реакційну суміш перемішують наступні 30 хвилин при температурі навколишнього середовища. Після видалення летких компонентів під вакуумом, продукт відділяють флеш-хроматографією (кремнезем, елюент - ацетат/n-гексан 1:4, потім 1:2) у вигляді жовтої твердої речовини (8,0г, 97%). MS: m/e=272 (М+). Приклад 6 2-метокси-5-морфолін-4-іл-феніламін 4-(4-метокси-3-нітрофеніл)-морфолін (6г) гідрогенізують у дихлорметані (100мл) і метанолі (600мл), використовуючи паладій на вуглецю (10%, 600мг) протягом 12 годин. Каталізатор видаляють фільтрацією і розчин випаровують під вакуумом. Очищенням хроматографією (кремнезем, елюент - етилацетат/n-гексан 1:1) отримують продукт у вигляді брудно-білої твердої речовини (4,6г, 88%). MS: m/e=209 (М+Н+). Приклад 7 4-(4-метокси-3-нітро-феніл)-морфолін 4-бром-2-нітроанізол (8,5г, 36ммоль), морфолін (3,8мл, 44ммоль), фосфат калію (11г, 51ммоль), 2-біфеніл-дициклогексил фосфін (960мг, 2,7ммоль) і паладій (II) ацетат (411мг, 1,8ммоль) розчиняють у диметоксіетані (80мл) і перемішують при 80°С протягом 96 годин. Потім суміш охолоджують до кімнатної температури, розбавляють етилацетатом (50мл) і відфільтровують крізь дикаліт. Флеш-хроматографією на кремнеземі (елюент дихлорметан/метанол 99:1) отримують продукт у вигляді червоної твердої речовини (6,0г, 69%). MS: m/e= 238 (М+). 15 87142 16 Приготування таблетки (волога грануляція) Пункт 1 2 3 4 5 Інгредієнти 5мг 5 125 6 30 1 167 Сполука формули І Безводна лактоза DTG Sta-Rx 1500 (крохмаль) Мікрокристалічна целюлоза Стеарат магнію Загальна кількість Методика виготовлення 1. Змішати інгредієнти пунктів 1, 2, 3 і 4 і гранулювати з очищеною водою. 2. Висушити гранули при 50°С. мг/таблетка 25мг 100мг 25 100 105 30 6 6 30 30 1 1 167 167 500мг 500 150 30 150 1 831 3. Пропустити гранули крізь помольне обладнання. 4. Додати інгредієнт пункту 5 і змішувати протягом трьох хвилин; стиснути під відповідним тиском. Приготування капсули Пункт 1 2 3 4 5 Інгредієнти 5мг 5 159 25 10 1 200 Сполука формули І Водна лактоза Кукурудзяний крохмаль Тальк Стеарат магнію Загальна кількість Методика виготовлення 1. Змішати інгредієнти пунктів 1, 2 і 3 у відповідному змішувачі протягом 30хвилин. Комп’ютерна верстка Н. Лиcенко мг/капсула 25мг 100мг 25 100 123 148 35 40 15 10 2 2 200 300 500мг 500 70 25 5 600 2. Додати інгредієнти пунктів 4 і 5 і змішувати протягом 3 хвилин. 3. Заповнити у відповідну капсулу. Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською4-hydroxy-4-methyl-piperidine-1-carboxylic acid (4-methoxy-7-morpholin-4-yl-benzothiazol-2-yl)-amide
Автори англійськоюFlohr Alexander, Moreau Jean-Luc, Poli Sonia Maria, Riemer Claus, Steward Lucinda
Назва патенту російською4-гидрокси-4-метилпиперидин-1-карбоновой кислоты (4-метокси-7-морфолин-4-илбензотиазол-2-ил)-амид
Автори російськоюФлор Александер, Моро Жан-Люк, Поли Соня Мария, Ример Клаус, Стюард Люсинда
МПК / Мітки
МПК: A61P 25/36, C07D 417/12, A61K 31/454, A61P 25/28
Мітки: 4-гідрокси-4-метилпіперидин-1-карбонової, кислоти, 4-метокси-7-морфолін-4-ілбензотіазол-2-іл)-амід
Код посилання
<a href="https://ua.patents.su/8-87142-4-gidroksi-4-metilpiperidin-1-karbonovo-kisloti-4-metoksi-7-morfolin-4-ilbenzotiazol-2-il-amid.html" target="_blank" rel="follow" title="База патентів України">4-гідрокси-4-метилпіперидин-1-карбонової кислоти (4-метокси-7-морфолін-4-ілбензотіазол-2-іл)-амід</a>
Попередній патент: Імідазольні різновиди як модулятори рецептора гамк для лікування шлунково-кишкових розладів
Наступний патент: Пристрій для очищення палива
Випадковий патент: Реагент для промивних рідин












