Застосування пептидів, виділених з ланцюга bb
Формула / Реферат
1. Застосування пептиду загальної формули II
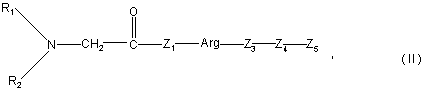
де
R1 та R2, однакові або різні, представляють водень, насичену або ненасичену вуглеводневу частину, яка містить від 1 до 10 атомів вуглецю,
Z1 - гістидинова або пролінова частина,
Arg - аргінінова частина,
Z3 - пролінова або валінова частина,
Z4 - лейцинова або валінова частина,
Z5 - пептидна частина, одержана з ланцюга Вβ фібрину,
причому пептид біологічно здатний відповідати індукованій зв'язуючій VE-кадгерин частині ланцюга Вβ (тобто Вβ15-42) людського фібрину, для виготовлення фармацевтичного препарату для лікування шоку.
2. Застосування за п. 1, де насичена або ненасичена вуглеводнева частина у значенні R1 містить від 1 до 3 атомів вуглецю.
3. Застосування за будь-яким з пп. 1 або 2, яке відрізняється тим, що Z5 - пептидна частина містить послідовність амінокислот
Asp-Lys-Lys-Arg-Glu-Gly-Ala-Pro-Ser-Leu-Arg-Pro-Ala-Pro-Pro-Pro-Ile-Ser-Gly-Gly-Gly-Туr-Arg,
Z1 - гістидинова частина,
Arg - аргінінова частина,
Z3 - пролінова частина, та
Z4 - лейцинова частина.
4. Застосування пептиду, який має N-термінальну послідовність Gly-His-Arg-Pro-Leu-Asp-Lys-Lys-Arg-Glu-GIu-Ala-Pro-Ser-Leu-Arg-Pro-Ala-Pro-Pro-Pro-Ile-Ser-Gly-Gly-Gly-Tyr-Arg та біологічно здатний відповідати індукованій зв'язуючій VE-кадгерин частині ланцюга Вβ (тобто Вβ15-42) людського фібрину, для виготовлення фармацевтичного препарату для лікування шоку.
5. Застосування за п. 4, яке відрізняється тим, що пептид являє собою послідовність GIy-His-Arg-Pro-Lcu-Asp-Lys-Lys-Arg-Glu-Glu-Ala-Pro-Ser-Leu-Arg-Pro-Ala-Pro-Pro-Pro-Ile-Ser-Gly-Gly-GIy-Tyr-Arg.
6. Застосування за будь-яким з пп. 1-5, при якому шок пов'язаний з одним або кількома факторами з групи, що містить бактеріальні токсини, розсіяну внутрішньосудинну коагулопатію, некротизуючий фасціїт, геморагічний шок внаслідок вірусної інфекції, зокрема, спричиненої філовіpycoм, аренавіридами, буньявіридами, флавівірусом, лихоманкою денге, гострою геморагічною респіраторною недостатністю від інфекційного агента або аутоімунного походження, відмовою органа після травми, зокрема, інфаркту міокарда, операціями на судинах, затисканням органів, геморагічним шоком, інфарктом легенів, інфарктом печінки, інфарктом кишечнику, хірургічними процедурами та інсультом, а також дисфункцією пересаджених органів.
Текст
1. Застосування пептиду загальної формули II C2 (21) a200604047 (22) 24.06.2005 (24) 10.08.2010 (86) PCT/AT2005/000228, 24.06.2005 (31) A 1087/2004 (32) 25.06.2004 (33) AT (31) A 40/2005 (32) 13.01.2005 (33) AT (46) 10.08.2010, Бюл.№ 15, 2010 р. (72) ПЕТЦЕЛЬБАУЕР ПЕТЕР, AT/AT, ЗАХАРОВСКІ КАЙ, DE/DE (73) ФІБРЕКС МЕДІКЕЛ РІСЬОЧ & ДЕВЕЛОПМЕНТ ГЕЗМБХ, AT (11) UA Asp-Lys-Lys-Arg-Glu-Gly-Ala-Pro-Ser-Leu-Arg-ProAla-Pro-Pro-Pro-Ile-Ser-Gly-Gly-Gly-Туr-Arg, Z1 - гістидинова частина, Arg - аргінінова частина, Z3 - пролінова частина, та Z4 - лейцинова частина. 4. Застосування пептиду, який має N-термінальну послідовність Gly-His-Arg-Pro-Leu-Asp-Lys-Lys-ArgGlu-GIu-Ala-Pro-Ser-Leu-Arg-Pro-Ala-Pro-Pro-Pro-IleSer-Gly-Gly-Gly-Tyr-Arg та біологічно здатний відповідати індукованій зв'язуючій VE-кадгерин частині ланцюга Вβ (тобто Вβ15-42) людського фібрину, для виготовлення фармацевтичного препарату для лікування шоку. 5. Застосування за п. 4, яке відрізняється тим, що пептид являє собою послідовність GIy-His-Arg-ProLcu-Asp-Lys-Lys-Arg-Glu-Glu-Ala-Pro-Ser-Leu-ArgPro-Ala-Pro-Pro-Pro-Ile-Ser-Gly-Gly-GIy-Tyr-Arg. 6. Застосування за будь-яким з пп. 1-5, при якому шок пов'язаний з одним або кількома факторами з групи, що містить бактеріальні токсини, розсіяну (19) де R1 та R2, однакові або різні, представляють водень, насичену або ненасичену вуглеводневу частину, яка містить від 1 до 10 атомів вуглецю, Z1 - гістидинова або пролінова частина, Arg - аргінінова частина, Z3 - пролінова або валінова частина, Z4 - лейцинова або валінова частина, Z5 - пептидна частина, одержана з ланцюга Вβ фібрину, причому пептид біологічно здатний відповідати індукованій зв'язуючій VE-кадгерин частині ланцюга Вβ (тобто Вβ15-42) людського фібрину, для виготовлення фармацевтичного препарату для лікування шоку. 2. Застосування за п. 1, де насичена або ненасичена вуглеводнева частина у значенні R1 містить від 1 до 3 атомів вуглецю. 3. Застосування за будь-яким з пп. 1 або 2, яке відрізняється тим, що Z5 - пептидна частина містить послідовність амінокислот 91497 R2 3 91497 4 внутрішньосудинну коагулопатію, некротизуючий походження, відмовою органа після травми, зокрефасціїт, геморагічний шок внаслідок вірусної інфема, інфаркту міокарда, операціями на судинах, кції, зокрема, спричиненої філовіpycoм, аренавіризатисканням органів, геморагічним шоком, інфаркдами, буньявіридами, флавівірусом, лихоманкою том легенів, інфарктом печінки, інфарктом кишечденге, гострою геморагічною респіраторною недонику, хірургічними процедурами та інсультом, а статністю від інфекційного агента або аутоімунного також дисфункцією пересаджених органів. Передумови створення винаходу Винахід стосується фармаційного препарату для лікування шоку. Шок - це гостре ускладнення багатьох різних патологічних станів, яке відрізняється неспроможністю серцево-судинної системи підтримувати належний тиск кровотоку. Інфекційні агенти можуть прямо або посередньо спричинювати відмову серцево-судинної системи. Бактерії, бактеріальні токсини, віруси і, не в останню чергу, неадекватна реакція клітинного або гуморального реципієнта з виникненням запалення або коагуляції здатні приводити до втрати судинного тону, втрати бар'єрної функції судин, втрати стискуваності міокарда і втрати функції органа, що нарізно або у сукупності призводить до шоку й кінець-кінцем до летального кінця. Антибіотики, якими лікують бактеріальні інфекції, вбивають бактерій, але не можуть упоратися з токсинемією і не виправляють неадекватну клітинну або гуморальну реакцію. У грамнегативних бактерій відповідальність за грамнегативний шок несуть ліпополісахариди (ЛПС або ендотоксини). Грам-позитивні бактерії можуть спричинювати множинну відмову органів та септичний шок без ендотоксемії, але стінки клітин грампозитивних бактерій також містять токсини на кшталт ліпотейхоєвої кислоти (LTA) та пептидоглікану (PepG). LTA та PepG при спільній дії вивільняють цитокіни, наприклад, фактор пухлинного некрозу (TNF) та інтерферон (IFN) , які спричинюють iNOS, що призводить до шоку та відмови органа. Ендотоксемія, сепсис та септичний шок пов'язані з виробленням у великій кількості окису азоту (NO). Надмірну вазодилатацію та гіпореактивність судин на дію факторів тиску, пов'язану з шоком кровообігу, можна зупинити за допомогою інгібіторів індукованої ізоформи NO-синтази (iNOS) (Southan and Szabo, Biochem.Pharmacol. 1996, 51 : 383-394; Thiemermann, Gen.Pharmacol. 1997, 29 : 159-166), але інгібітори iNOS не лікують пошкодження органа, спричинене токсинами (Wray et al., Shock 1998, 9 : 329-335). Лікувати шок, спричинений вірусами, ще складніше, оскільки проти вірусних інфекцій ефективних ліків майже не існує. Ліків, спрямованих на знищення лише інфекційного агента, недостатньо для хворих з шоком, спричиненим цим агентом, бо вторинні агенти, які з'явилися завдяки інфекційному агенту, що викликав запалювальну реакцію та зміни у системі коагуляції, можуть зробитися незалежними та призвести до смерті хворого незалежно від того, нейтралізований початковий інфекцій ний агент чи ні. Специфічних ліків проти них не існує, отже, існуючі методики скеровані на зняття симптомів шляхом механічної вентиляції, заміни рідин в організмі, застосування серцевих стимуляторів, суворого контролю насичення киснем, гемоглобіном, глюкозою та функції нирок. Контроль лише запалювальної реакції, наприклад, за допомогою великих доз стероїдів або інгібування коагуляції антитромбіном, не призводить до поліпшення або одужання. Єдиною молекулою, що на даний час довела свою ефективність для зниження смертності, є "активований протеїн С", який взаємодіє з процесами коагуляції-фібролізу та запалення. Шок при інфекції здебільшого пов'язується з відкритими або прихованими змінами у фібриногені плазми, які супроводжуються утворенням фібрину та збільшенням фрагментів фібрину. Ця активація скипання крові та кількості шляхів фібринолізу може призвести до відкритої або прихованої розсіяної внутрішньо судинної коагуляції (DIC), що веде до закупорки судин та пошкодження кінцівок, а також до засвоєння факторів коагуляції, які викликають кровотечу. Найпоширенішою причиною DIC є сепсис. Треба зазначити, що фібриноген, фібрин та фрагменти фібрину не лише відіграють роль у скипанні крові, але й утворюють кілька байтів для зв'язування клітинних та матричних протеїнів, що дозволяє останнім взаємодіяти з клітинами крові, тромбоцитами, ендотеліальними клітинами та матричними структурами. Це призводить до активації клітин, міграції клітин, вивільнення цитокінів і, нарешті, запалювальної реакції. Роль фібриногену або фібрину у запаленні широко освічена у літературі (огляди див. Altieri, Thromb.Haemost. 82 : 781-786; Herrick et al, Int.J.Biochem.Crll.Biol. 31 : 741-746). Регіон D цієї молекули містить багато сайтів зв'язування матричних молекул, ендотеліальних клітин, тромбоцитів та запалювальних клітин. Регіон Ε фібрину прив'язується до CD11с (Loike et al., Proc.Natl.Acad.Scie. USA 88 : 1044-1048). Ми нещодавно описали нову роль послідовності В бета15-42 фібрину у запаленні (WO 02/48180). Ця послідовність також розташована у регіоні Ε фібрину й активується лише при подрібненні фібринопептиду. Фрагменти фібрину, що містять цю послідовність на своєму вільному N-закінченні бета-ланцюга, прив'язуються до ендотелію та спричинюють запалення, а пептид, що відповідає амінокислотам 15-42 В бета-ланцюга фібрину, блокує прив'язування фрагментів фібрину до ендотеліальних поверхонь і блокує запалення in vitro 5 91497 6 (WO 02/48180). Цей пептид in vivo попереджує запалення міокарду та обмежує поширення інфаркту міокарду при ішемії /реперфузії (WO 02/48180). Фрагменти фібрину з'являються при будь-якій перешкоді утворенню фібрину та фібринолізу. Зоде крема, при інфекційному шоку перешкоди фібриZ1 - гістидинова або пролінова частина, ноутворенню та фібринолизу становлять серйозну Arg - аргінінова частина, проблему. Для багатьох хвороб задокументована Z3 - пролінова або валінова частина, пряма кореляція між виходом хвороби та перешZ4 - лейцинова або валінова частина, кодами фібриноутворенню / фібринолізу, наприZ5 - пептидна частина або протеїнова частина, клад, при лихоманці денге (van Gorp et al., зокрема, з 2-30 амінокислотами, або спиртова чаJ.Med.Virol. 2002, 67 : 549-554; Mairuhu et al., стина, що містить від 1 до 10, зокрема, від 1 до 3, Lancer Inf.Dis. 2003, 3 : 33-41). Синдром гострого атомів вуглецю, або частина органічної або неорреспіраторного розладу дорослих (ARDS) - це госганічної основи. тре легеневе захворювання, яке відрізняється інДалі, переважно застосовують пептид, у якому тенсивним осадженням позасудинного фібрину Z5 - пептидна частина, одержана з ланцюга А (Idell, Am.J.Respir.Med. 2002, 1 : 383-391). При альфа або В бета фібрину. ARDS також спостерігаються тромбоз пульмонарБільш того, переважно застосовують пептид, у них судин та розсіяна внутрішньосудинна коагуляякому Z5 - пептидна частина, що містить послідовція. ність амінокислот Причини існування та всесвітнього поширення Asp Lys Lys Arg Glu Gly Ala Pro Ser Leu Arg Pro лихоманки денге (DF) та геморагічної лихоманки Ala Pro Pro Ile Ser Gly Gly Gly Tyr Arg денге (DHF) - серйозної проблеми світової медиΖ1 - гістидинова частина, цини - є складні, заходи векторного контролю проArg - аргінінова частина, ти них не дали наслідків. Зараз державні асигнуZ3 - пролінова частина, вання на дослідження лихоманки Денге (які у 2001 Z4 - лейцинова частина. р. оцінювалися у 15 мільйонів доларів) зосереДалі, переважно застосовують пептид, у якому джені на молекулярній епідеміології, імунній патоZ5- пептидна частина, що містить послідовність фізіології, пошуках вакцин другого покоління, ноамінокислот вих або удосконалених підходах до векторного Glu Arg His Gin Ser Ala Cys Lys Asp Ser Asp Trp контролю. Pro Phe Cys Ser Asp Glu Asp Trp Asn Tyr Lys Кілька кандидатур на вакцини проходять клініZ1 - пролінова частина, чні випробування у США й Таїланді, але поки що Arg - аргінінова частина, немає доступних ліків для інфікованих хворих, Z3 - валінова частина, гірше того, невідомо про будь-які серйозні хіміотеZ4 - валінова частина. рапевтичні дослідження. Світова організація охоДалі, винахід стосується застосування пептирони здоров'я видала стратегічні директиви з боду, який показує на N-закінченні послідовність ротьби проти DF/DHF, де пріоритетними Gly-His-Arg-Pro-Leu-Asp-Lys-Lys-Arg-Glu-Gluнапрямками визначені розробка противірусних Ala-Pro-Ser-Leu-Arg-Pro-Ala-Pro-Pro-Pro-Ile-Ser-Glyзасобів, націлених на протеазу та інші погано виGly-Gly-Tyr-Arg вчені ферменти, та розвиток антимедіаторів, націта біологічно спроможний відповідати індуколених на причини підвищеної проникності судин ваній зв'язуючій VE-кадгерин частині ланцюга B або зміненого гемостазу. (тобто B15-42) людського фібрину, для виготовСутність винаходу лення фармаційного препарату для лікування шоВинахід стосується застосування пептиду заку. гальної формули І У ще одному переважному варіанті застосування згідно з винаходом відрізняється тим, що пептид являє собою послідовність Gly-His-Arg-Pro-Leu-Asp-Lys-Lys-Arg-Glu-GluAla-Pro-Ser-Leu-Arg-Pro-Ala-Pro-Pro-Pro-Ile-SerGIy-Gly-Gly-Tyr-Arg. де Показано, що зазначені пептиди здатні лікуваR1 та R2, однакові або різні, представляють ти, зокрема, шокові стани, спричинені одним або водень, насичену або ненасичену вуглеводневу кількома факторами з групи, що містить бактеріачастину, яка містить від 1 до 10, зокрема, від 1 до льні токсини, розсіяну внутрішньосудинну коагуло3, атомів вуглецю, патію, некротизуючий фасціїт, геморагічний шок Z1 - гістидинова або пролінова частина, внаслідок вірусної інфекції, зокрема, спричиненою Z2 - аргінінова частина, пептидна частина або філовірусом, аренавіридами, буньявіридами, флапротеїнова частина, що містить вихідну аргінінову вівірусом, лихоманкою денге, гострою геморагіччастину, зокрема, з 2-30 амінокислот, ною респіраторною недостатністю від інфекційного причому пептид біологічно спроможний відпоагента або аутоімунного походження, відмовою відати індукованій зв'язуючій VE-кадгерин частині органа після травми, зокрема, інфарктом міокарду, ланцюга B (тобто Β15-42) людського фібрину, для операціями на судинах, затисканням органів, гевиготовлення фармаційного препарату для лікуморагічним шоком, інфарктом легенів, інфарктом вання шоку. Переважно застосовують пептид запечінки, інфарктом кишковика, хірургічними прогальної формули II 7 91497 8 цедурами та інсультом, а також дисфункцією перистовували рекомбінантний VE-кадгерин ресаджених органів. (Gorlatov and Medved, Biochemistry, 41 : 4107Докладний опис винаходу 4116). Інші дослідники за допомогою твердофазноПептиди та протеїни го імуноферментного аналізу виявляли фрагменти Пептиди одержують твердофазним синтезом фібрину в крові, переважно з використанням антита очищують високоефективною рідинною хроматіл, щоб вирізняти послідовності у молекулі фібритографією з колонками Nucleosil 100-10С 18 (фірногену, що містять антитіла до виразу В бета15-42 ми PiChem, Грац, Австрія). Треба зазначити, що (огляд див. Fareed et al., Clin.Chem., 8:1845-1853). регіон бета 15-42 на 100% однаковий серед видів, Ми модифікували твердофазний імунофермещо дозволяє консервативні заміни амінокислот. нтний аналіз за тими самими принципами, що й Дісульфідний вузол N-закінчення фібриногену попередники, але маючи на меті не кількісне визначення продуктів розпаду фібрину, а пошук про(NDSK) у складі амінокислот А1-51, B1-118 та теїнів, пептидів або сполук, які втручаються до 1-78 готують, як описано у попередній заявці (WO зв'язування між послідовністю В бета15-42 та VE02/48180). Дісульфідний вузол N-закінчення фібкадгерином. Ми виходили з того, що VE-кадгерин, рину (NDSK-II, без вмісту фібринів А та В) у складі або як зрізаний протеїн, або як цілий протеїн чи у амінокислот Α17-51, Β15-118 та 1-78 готують сполученні з іншими протеїнами, котрі не зачіпаобробкою NDSK тромбіном (20 од./1 мг NDSK) ють сайт зв'язування В бета15-42, може вступати до протягом 3 годин при 37°С. Залишковий тромбін взаємодії з послідовністю В бета15-42 фібрину. До нейтралізують 10 мМ діізопропілфторфосфату цієї системи можна впровадити будь-яку іншу ре(фірми Fluka, Мілвокі, штат Вісконсин) протягом 3 човину й провести вимірювання, якщо ця речовина годин при 37°С. Після того всі продукти діалізують інгібує зв'язування VE-кадгерин-В бета15-42. 96 у фосфат-буферному розчині (PBS). планшетів з лунками для іммобілізації протеїнів Твердофазний імуноферментний аналіз (фірми Exiqon, м.Ведбек, Данія) покривають роз(ELISA) чином рекомбінантного людського VE-кадгерину у Пептид B15-42 прив'язується до VE-кадгерину. пептидильованому FC протеїні (8 нМ/мл, фірми Взаємодія ланцюга В бета (В бета15-42) фібриR&D Systems, Мінеаполіс, США) у буфері PBS та ну з ендотеліальними клітинами спричинює морзалишають на ніч при 4°С. Далі планшети промифологічні зміни (Bunce et al., J.Clin.Invest, 89 : 842вають та інкубують з пептидом В бета15-42 850; Bach et al., Exp.Cell Res., 238 : 324-334; (GHRPLDKKREEAPSLRPAPPPISGGGYR), маркіChalupowicz et al, J.Cell Biol., 130 : 207-215; рованим прапорцевою послідовністю Hamaguchi et al., Blood, 81 : 2348-2356; Francis et (DYKDDDDK) на С-закінченні пептиду, або з маркіal., Blood cells, 19 : 291-306), проліферацію (Sporn рованим прапорцем довільним пептидом et al., Blood, 86 : 1802-1810), виділення фактора (DRGAPAHRPPRGPISGRSTPEKEKLLPG) у концефон Віллебранда (Ribes et al., J.Clin.Invest, 79, нтрації 0-80 мкМ. Після промивки маркірований 117-123; Ribes et al., J.Clin.Invest., 84 : 435-442; прапорцем пептид виявляють інкубацією з міченим Erban and Wagner, J.Biol.Chem., 267,2451-1458), пероксидазою антитілом до прапорця (фірми можливо, також IL-8 (Qi et al., Blood, 90 : 3593Sigma, Сент-Луіс, США) та хромогенним субстра3602) та експресію мембран CD54 (Harley et al., том. Art. Thromb.Vasc.Biol., 20 : 652 - 658). Виявлено, Оптичну щільність визначають зчитувачем що VE-кадгерин є зв'язувальним лігандом посліпланшетів для твердофазного імуноферментного довності В бета15-42, і виконано твердофазний імуаналізу, настроєним на довжину хвилі 450 нм. Дані ноферментний аналіз, щоб продемонструвати цю представляють середню величину трьох незалежвзаємодію ендотеліальних клітин та/або VEних дослідів, кожний з яких повторюють тричі. Никадгерину з фібрином або фрагментами фібрину. жченаведена таблиця свідчить, що зв'язування Мартінес та ін. використали антитіла до панкадгепептиду В бета15-42 з VE-кадгерином залежить від рину для витягнення кадгеринів з ендотеліальних концентрації. Навпаки, зв'язування з довільним клітин з подальшою інкубацією з фібрином пептидом дуже незначне. (Martinez et al., Ann.NY Acad.Sci., 936 : 386-405), Залежне від дози зв'язування пептиду В бенаклали на моношари ендотеліальних клітин людта15-42 з VE-кадгерином ської пупкової вени (з яких відбувається експресія VE-кадгерину) радіомічені фрагменти фібрину або пептид В бета15-42 (), а Горлатов та Медведь викомкМ 15-42 з прапорцем Довільний з прапорцем середнє стандартне відхилення середнє стандартне відхилення 0 0 0 0,23 0,01 0,01 0,7 0,02 0,01 2,3 0,08 0,03 7 0,33 0,17 14 0,92 0,19 21 1,3 0,2 0 0,01 0 0,01 0,03 0,12 0 0,01 0 0,01 0,02 0,04 Пептид В бета15-42 та фрагменти фібрину конкурують за зв'язування з VE-кадгерином. 35 1,5 0 46 1,93 0 70 2,1 0 0,2 0,35 0,5 0,1 0 0 На наступному етапі ми аналізували, чи придатна ця методика для відсіву інших пептидів або сполук, що конкурують зі зв'язуванням пептиду В 9 91497 10 бета15-42 з VE-кадгерином. Як і очікувалося, пептид Immunology and Medical Microbiology, 35, 33-423). В бета15-42 повністю інгібує зв'язування міченого 10% суспензії мозку зберігають як запас вірусу при прапорцем пептиду В бета15-42 і слугує засобом -40°С. Вірус визначають послідовним розбавленпозитивного контролю, а довільні пептиди або роням суспензії мозку. Суспензію інокулюють внутзчинник не мають на це жодного впливу й викорирішньочеревно групам по 10 мишей (у 4стовуються як засоби негативного контролю. Коротижневому віці, лінія BALB/c) та фіксують процент тші пептиди частково інгібують зв'язування смертності. Розрахунковий титр вірусу становить міченого прапорцем пептиду В бета15-42 з VE7,4 пг ЛД50/мл. Усі роботи з заразливим вірусом кадгерином. NDSK-II інгібує зв'язування пептиду В виконують з дотриманням 3-го рівня безпеки (BSLбета15-42 у залежності від концентрації. Рівновага 3) у максимально захищеній лабораторії ДНДЦ ВБ між В бета15-42 та NDSK-II (інгібування 50%) дося"Вектор" (Росія). гається при молярному співвідношенні 24 : 1. Тварини NDSK не справляє ніякої або майже ніякої дії. Інбредні самці мишей BALB/c у чотирьохтижVE-кадгерин наносять на пластикову поверхневому віці (гаплотип H-2d) одержано з віварію ню в концентрації 8 нМ. Далі додають наведені Державного науково-дослідного центру вірусології нижче пептиди у концентрації 200 мкМ, a NDSK та біотехнології "Вектор". Тварин тримають у або NDSK-II - у зазначених концентраціях. Зв'язуокремих клітках з необмеженим запасом харчу та вання міченого прапорцем пептиду В бета15-42 (12 води. мкМ) визначають, як описано вище. Кров у мишей відбирають під метилоксіфлуБлокувальний реагент % інгібування прив'язуванрановою анестезією з орбітального синуса до та ня міченого 15-42 до VЕ-кадгерину після інфікування DEN-2. У кожний даний момент Середня веберуть кров у трьох мишей. личина ± стаЦиркулюючі тромбоцити (PLT), еритроцити ндартне від(RBC), лейкоцити (WBC), гемоглобін (HGB) та гехилення матокрит (НСТ) визначають на гематологічному Пептид 15-42 (28-мер) 100±10 аналізаторі Cell-Dyn 900 (фірми Sequoia-Turner, Пептид довільний (4-мер) 3±3 Каліфорнія, США). Пептид довільний (28-мер) 10±3 Частину зібраної крові центрифугують для Розчинник 0+0 одержання сироватки, яку витримують при Пептид 15-18 (4-мер) 200 мкМ 65±12 -80°С до кінця експерименту. Рівні цитокінів у Пептид 15-126 (12-мер) 200 мкМ 64±10 крові визначають наборами для імуноферментного Пептид 15-30 (16-мер) 200 мкМ 61±13 аналізу фірми R&D Systems (Мінеаполіс, США) Пептид 15-34 (20-мер) 200 мкМ 67±17 згідно з інструкцією виробника. Межі визначення Пептид 15-37 (24-мер) 200 мкМ 17±19 такі: TNF- менше 5 пг/мл; інтерлейкін (IL)- 3,0 Пептид 16-42 (27-мер) 200 мкМ 55±13 пг/м; IL-6 3,1 пг/мл; ΙΡΝ - менше 20 пг/мл. Пептид 15-18 (4-мер) 12 мкМ 7±2 Вірус денге у крові тварин визначають метоПептид 15-126 (12-мер) 12 мкМ 6±1 дом RT-PCR, описаним раніше (Harris et al, Пептид 15-30 (16-мер) 12 мкМ 6±3 J.Clin.Microbiology, 36,2634-2639). Сумарну РНК Пептид 15-34 (20-мер) 12 мкМ 7±1 виділяють з крові за допомогою набору фірми Пептид 15-37 (24-мер) 12 мкМ 7±2 Quiagen (Німеччина). Праймери наступні: верхній Пептид 16-42 (27-мер) 12 мкМ 5±2 5'AATATGCTGAAACGCGAGAAACCG (позиція 136NDSK-II 0,06 мкМ 1+0 161), нижній 5'AAGGAACGCACCAAGGCCATG (поNDSK-II0,12mkM 39+18 зиція 237-258), посилення на 119 пунктів. Для кільNDSK-II 0,20 мкМ 42+14 кісного визначення вірусного навантаження DEN-2 NDSK-II 0,60 мкМ 52+16 титрують на культурах клітин Vero Е6, як описуваNDSK-II 1,2 мкМ 63+13 лося раніше (Harris et al., J.Clin.Microbiology, 36, NDSK-II 2,4 мкМ 79+9 2634-2639). На 0-й та 22-й день після інфікування NDSK-II 4,0 мкМ 82+12 кров тих мишей, що вижили, перевіряють на антиNDSK 0,06 мкМ 0+0 тіла до DEN-2 (IgG) твердофазним імуноферментNDSK 0,12 мкМ 2+1 ним аналізом, як описано раніше (Ignatyev et al., NDSK 0,20 мкМ 1+1 J.Biotechmology, 44, 111-118). NDSK 0,60 мкМ 7+6 Планування експерименту NDSK 1,2 мкМ 15+13 Інбредних самців мишей BALB/c у чотиритижNDSK 2,4 мкМ 16+9 невому віці поділяють на 6 основних груп по 50 NDSK 4,0 мкМ 20+10 мишей у кожній. Усім тваринам прищеплюють внуАнти-VЕ-кадгерин трішньочеревно (і.р.) адаптований до мишей штам 2+1 (TEA 1/31, 1 мг/мл) Р23085 вірусу (як описано вище) у дозі 1 ЛД50 та Ефективність пептиду В бета15-42 при лікуванні щодня перевіряють на ознаки морбидності. Миші з мишей, інфікованих вірусом денге перших підгруп усіх основних груп (A1-F1) слугуМатеріали та методика ють для контролю смертності. Кожна підгрупа місВірус. Вірус денге типу 2 (DEN-2), штам тить по 20 мишей. У тварин других підгруп (A2-F2) Р23085, одержано з Державної колекції вірусів у одержують зразки сироватки. Кожна підгрупа місМоскві у вигляді ліофілізованої суспензії мозку тить по 30 мишей. інфікованих ICR мишей. Одержаний вірус денге Опис групи n=50 у кожній групі проходить пасаж у мозку сисунців-мишей ICR, як Контрольна група одержує лише вірус. описувалося раніше (Atrashevskaya et al., FEMS 11 91497 12 До трахеї вставляють канюлю для полегшення Лікування пептидом B15-42 провадять двічі на дихання, а ректальну температуру підтримують на день дозами по 4800 мкг/кг шляхом внутрішньочерівні 37°С за допомогою гомеотермічної ковдри. ревного впорскування з 3-го по 8-й день після інфіПраву сонну артерію катетеризують та приєднукування. ють до датчика тиску для вимірювання фазового Зразки крові та сироватки беруть у визначені та середнього артеріального тиску (МАР) і частоти строки: 1-й, 3-й, 5-й, 7-й, 11-й, 22-й день після інфісерцебиття (HR), які відтворює система збору дакування. них (MacLab 8е фірми ADI Instruments, Німеччина), Провадять статистичний аналіз з використанвстановлена на комп'ютері. До правої яремної веням тесту Студента або Чі-квадратичного тесту. ни вставляють канюлю для введення ліків. Січовий Значущими вважають величини Р
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of peptides derived from the a alpha or b beta chain of human fibrinogen for the treatment of shock
Автори англійськоюPetzelbauer Peter, Zacharowski Kai
Назва патенту російськоюПрименение пептидов, выделенных из цепи bb человеческого фибриногена, для лечения шока
Автори російськоюПетцельбауер Петер, Захаровски Кай
МПК / Мітки
МПК: A61P 9/00, A61P 7/00, A61K 38/36
Мітки: пептидів, виділених, застосування, ланцюга
Код посилання
<a href="https://ua.patents.su/8-91497-zastosuvannya-peptidiv-vidilenikh-z-lancyuga-bb.html" target="_blank" rel="follow" title="База патентів України">Застосування пептидів, виділених з ланцюга bb</a>
Попередній патент: Спосіб одержання 4,5,6,7-тетрагідроізоксазоло[5,4-с9]піридин-3-олу (тнір),
Наступний патент: Пристрій для поліпшення передачі обслуговування між секторами і/або між стільниками в системі безпровідного зв’язку з декількома несучими (варіанти)
Випадковий патент: Літолітичний засіб "калькуліз" для консервативного лікування хронічного простатиту, ускладненого конкрементами в передміхуровій залозі












