Спосіб отримання ефірів 2,4,6-заміщених хіназолініл (1,2-дегідро-4н) оцтової-3 кислоти
Формула / Реферат
1. Спосіб отримання ефірів 2,4,6-заміщенних хіназолініл(1,2-дегідро-4Н)-оцтової-3 кислоти загальної формули 1
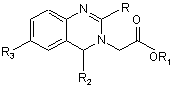 , (1)
, (1)
де R означає метил СН3, етил СН2СН3, феніл С6Н5, (пара-бром)феніл п-ВrС6Н4, (орто-бром)феніл о-ВrС6Н4, (пара-хлор)феніл п-СlС6H4, (орто-хлор)феніл о-СlС6Н4, (мета-хлор)феніл м-СlС6Н4, (пара-метокси)феніл п-ОСН3С6Н4, (3,4,5-триметокси)феніл 3,4,5-ОСН3С6Н2, морфолінометилен CH2N(CH2)4O, морфоліноетилен СН2СН2NСН2)4O; R1 - метил, етил; R2 - феніл С6Н5, (орто-хлор)феніл о-СlС6Н4; R3 - бром, хлор або метил, який включає ефіри формули 2 як вихідні продукти, який відрізняється тим, що до розчину ефіру формули 2, де R1, R2 і R3 указані вище
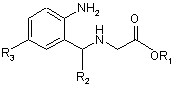 (2)
(2)
в хлороформі додають хлорангідрид формули RCOC1 (3), де R указаний вище, в співвідношенні 1:1, перемішують 15-20 хвилин, закінчення реакції контролюють тонкошаровою хроматографією, до реакційної суміші додають 5-6 % водний аміак до рН 7,1-7,3, хлороформний розчин промивають водою до рН 7, обезводнюють сульфатом натрію, до хлороформного розчину додають оцтову кислоту в співвідношенні оцтова кислота-хлороформ 1:5-6, кип’ятять 2-2,5 години, закінчення реакції контролюють тонкошаровою хроматографією, хлороформ упарюють в вакуумі, залишок охолоджують до 8-10°С, додають 25 % водний аміак до рН 7,5-8, осад відфільтровують, промивають водою до рН 7, висушують при 20-23°С і очищають із органічних розчинників.
2. Спосіб по п. 1, який відрізняється тим, що реакційну суміш в хлороформі після кип’ятіння 2-2,5 години, охолоджують до 8-10 °С, додають 25 % водний аміак до рН 7,5-8, хлороформний розчин промивають водою до рН 7, обезводнюють сульфатом натрію, упарюють в вакуумі, залишок очищають із органічних розчинників.
Текст
Винахід відноситься до галузі біологічно активних похідних хіназоліна, конкретно до способу отримання ефірів хіназолінил(1,2-дегідро-2R-4Н-4R2-6R3)оцтової-3 кислоти загальної формули 1 R N O R3 N OR1 (1) R2 де R означає метил СН 3, етил СН2СН3, феніл С6Н5, (пара-бром)феніл п-ВrС 6Н4, (орто-бром)феніл о-ВrС 6Н4, (пара-хлор)феніл п-СlС 6H4, (орто-хлор)феніл о-СlС 6Н4, (мета-хлор)феніл м-СlС 6Н4, (пара-метоксі)феніл пОСН3С6Н4, (3,4,5-триметоксі)феніл 3,4,5-ОСН3С6Н2, морфолінометилен CH2N(CH2)4O, морфоліноетилен СН2СН2N(СН2)4O; R1 - метил, етил; R2 - феніл С6Н5, (орто-хлор)феніл о-СlС 6Н4; R3 - бром, хлор або метил, який може бути використаним в синтезі анальгетичних та протизапальних лікарських речовин. Рівень техніки в даній галузі характеризується слідуючим. Відомий спосіб отримання ефірів хіназолінон-2-(1,4-дігідро-4-феніл)оцтової-3 кислоти загальної формули 4 (схема 1), (А. с. СССР, №707191, 1979), де в якості вихідного продукта використовують е фіри N-(2амінобензгідрил)гліцина формули 2 і його взаємодію з алкіл- або бензилхлоркарбонатом формули 5 в присутності триетиламіна H NH 2 O N R 5OCOCl O O H (5) N N R3 OR 1 R3 OR 1 R2 R2 (2) (4) де R1 означає метил СН 3, етил СН2СН3, R2 - феніл С6Н5, R3 - бром, хлор, метил, R5 - бензил С 6Н5СН2 або ізобутил СН3СН2СНСН3. Схема 1 В основу винаходу поставлено задачу розробки способа отримання ефірів 2,4,6-заміщених хіназолінил(1,2дегідро-4Н)оцтової-3 кислоти з використанням ефірів N-(2-амінобензгідрил)гліцина в якості вихідних продуктів. Досягаємий технічний результат - це синтез ефірів 2,4,6-заміщених хіназолінил(1,2-дегідро-4Н)оцтової-3 кислоти шляхом взаємодії ефірів N-(2-амінобензгідрил)гліцина з хлорангідридами органічних кислот і послідуючою каталітичною дією оцтової кислоти на створений проміжний продукт. Цей технічний результат досягається описуваним способом отримання ефірів 2,4,6-заміщених хіназолінил(1,2-дегідро-4Н)оцтової-3 кислоти загальної формули 1 R N O R3 N OR1 (1) R2 де R означає метил СН 3, етил СН2СН3, феніл С6Н5, (пара-бром)феніл п-ВrС 6Н4, (орто-бром)феніл о-ВrС 6Н4, (пара-хлор)феніл п-СlС 6H4, (орто-хлор)феніл о-СlС 6Н4, (мета-хлор)феніл м-СlС 6Н4, (пара-метоксі)феніл пОСН3С6Н4, (3,4,5-триметоксі)феніл 3,4,5-ОСН3С6Н2, морфолінометилен CH2N(CH2)4O, морфоліноетилен СН2СН2N(СН2)4O; R1 - метил, етил; R2 - феніл С6Н5, (орто-хлор)феніл о-СlС6Н4; R3 - бром, хлор або метил, згідно якому до розчину ефіра N-(2-амінобензгідрил)гліцина загальної формули 2, NH2 O H N (2) R3 OR1 R2 де R1, R2 і R3 указані вище, в хлороформі прибавляють хлорангідрид загальної формули RCOCl (3), де R указаний вище, в співвідношенні 1:1, реакційну суміш перемішують 15-20хв. і закінчення реакції контролюють тонкошаровою хроматографією (ТШХ). Потім до реакційної суміші прибавляють 5-6% водний аміак до рН7,1-7,3, хлороформний розчин промивають водою до рН7 і обезводнюють сульфатом натрія. До хлороформного розчину прибавляють оцтову кислоту в співвідношенні оцтова кислота - хлороформ 1:5-6 і кип’ятять 2-2,5 години. Закінчення реакції контролюють ТШХ. Хлороформ упарюють в вакуумі, залишок охолоджують до 8-10°С і прибавляють 25% водний аміак до рН7,5-8. Осад відфільтровують, промивають водою до рН7, висушують при 20-23°С і очищають із органічних розчинників. Крім того, виділення цілевого продукта проводять і слідуючим чином. Реакційну суміш в хлороформі після її кип’ятіння 2-2,5 години, охолоджують до 8-10°С, прибавляють 25% аміак до рН7,5-8, хлороформний розчин промивають водою до рН7, обезводнюють сульфатом натрія, упарюють в вакуумі, а залишок очищають із органічних розчинників. Суттєва особливість заявлюваного способа заключається в тому, що в описуваних умовах взаємодія ефірів формули 2 (схема 2) з хлорангідридами формули 3 протікає виключно по первинній аміногрупі ефірів 2 внаслідок блокування вторинної аміногрупи проміжного продукта 6 хлористим воднем. Внаслідок виключення стадії виділення із реакційного середовища проміжного продукта 7 (сx.2), процес отримання цілевого продукта 1 проводять в однореакторному режимі. Пояснення процеса отримання з обґрунтуванням граничних значень режима і параметрів процеса: До розчину ефіра 2 (сx.2) в хлороформі, (R1, R2 і R3 указані вище), прибавляють хлорангідрид формули 3, (R указаний вище), в співвідношенні 1:1 і перемішують 15-20 хвилин. Закінчення реакції контролюють ТШХ. Надлишок хлорангідрида 3, наприклад при співвідношенні 1:1,2, особливо відносно стійкого в водному середовищі, приводить до ацилювання вторинної аміногрупи проміжного продукта 7, що понижує ви хід цілевого продукта 1 і затруднює його очищення. До реакційної суміші прибавляють 5-6% водний аміак до рН7,1-7,3, хлороформний розчин промивають водою до рН7. При цьому хлоргідрат 6 перетворюється в проміжний продукт 7. O NH 2 H N O R3 RCOCl (3) OR1 R2 R NH R3 NH4 OH O H N . HCl OR1 R2 (2) O (6) R NH H N R3 CH3 COOH O OR1 R2 R N O N R3 OR1 R2 (7) (1) де R, R1, R2 і R3 указані вище. Схема 2. Хлороформний розчин обезводнюють сульфатом натрія, до нього прибавляють оцтову кислоту в співвідношенні оцтова кислота - хлороформ 1:5-6 і кип’ятять 2-2,5 години. Закінчення реакції контролюють ТШХ. При співвідношенні оцтова кислота - хлороформ, наприклад, 1:4 або 1:7, відповідно збільшується час кип’ятіння до 3-3,5 годин, або зменшується ви хід цілевого продукта на 6-8%. Потім хлороформ упарюють в вакуумі, залишок охолоджують до 8-10°С і прибавляють 25% водний аміак до рН7,5-8. При цьому утворюється осад, який відфільтровують, промивають водою до рН7, висушують при 20-23°С і очищають із органічних розчинників. Другий варіант виділення цілевого продукта 1 слідуючий. Реакційну суміш в хлороформі після кип’ятіння 2-2,5 години, охолоджують до 8-10°С і прибавляють 25% аміак до рН7,5-8. Хлороформний розчин промивають водою до рН7, обезводнюють сульфатом натрія, упарюють в вакуумі, а залишок очищають із органічних розчинників. Приклад 1 Метиловий ефір хіназолінил[1,2-дегідро-2-(41-бром)феніл-4Н-4-феніл-6-бром]-оцтової-3 кислоти. До розчину 6,98г (0.02 моль) метилового ефіра N-(2-аміно-5-бромбензгідрил)гліцина в 30мл хлороформа прибавляють 4,15г (0,02 моль) (пара-бром)бензоїлхлорида і перемішують 15-20 хвилин. Закінчення реакції контролюють тонкошаровою хроматографією (ТШХ). До реакційної суміші прибавляють 5-6% водний аміак до рН7,1-7,3. Хлороформний шар промивають водою до рН7 і обезводнюють сульфатом натрія. До хлороформного розчину прибавляють 6мл оцтової кислоти і кип’ятять 2 години із зворотним холодильником. Закінчення реакції контролюють ТШХ. Після цього, хлороформ упарюють в вакуумі, а залишок охолоджують до 8-10°С і по частинам прибавляють 25% водний аміак до рН7,5-8. Осад, що утворився, відфільтровують на фільтрі Шотта і промивають водою до рН7. Промитий водою осад висушують при 20-23°С і розчиняють при кип’ятінні в 95мл хлороформметанола (1:3). Розчин фільтрують через паперовий фільтр і упарюють до залишка 60-65мл. Після викристалізації продукт відфільтровують, його промивають 6-8мл метанола, висушують при 20-23°С 2-3год., 33,5год. при 65-70°С до постійної ваги і отримують 8,4г (82%) цілевого продукта. Т. пл. 173-174°С. Знайдено, %: С 53,81; Н 3,61; N 5,51. C 23H18Br2N2 O2. Розраховано, %: С 53,72; Н 3,53; N5,45. ПМР-спектр, ( d , м.д.): 6,94-7,56 (12Н, феніл); 5,59 (1Н, СН); 3,74-4,04 (2Н, СН2); 3,60 (3Н, ОСН3). Приклад 2 Метиловий ефір хіназолінил(1,2-дегідро-2-метил-4Н-4-феніл-6-бром)оцтової-3 кислоти. До розчину 6,98г (0,02 моль) метилового ефіра N-(2-аміно-5-бромбензгідрил)гліцина в 30мл хлороформа прибавляють 1,43мл (0,02 моль) ацетилхлорида і перемішують 10-15хв. Закінчення реакції контролюють ТШХ. До реакційної суміші прибавляють 5-6% водний аміак до рН7,1-7,3, хлороформний розчин промивають водою до рН7 і обезводнюють сульфатом натрія. До хлороформного розчину прибавляють 6мл оцтової кислоти і кип’ятять із зворотним холодильником 2,5 години. Закінчення реакції контролюють ТШХ. Хлороформний розчин охолоджують до 8-10°С і по частинам прибавляють 25% водний аміак до рН7,5-8. Хлороформний розчин промивають водою до рН7, обезводнюють сульфатом натрія і упарюють в вакуумі. Залишок кристалізують із діетилового ефіра і отримують 6,42г (86%) цілевого продукта. Т.пл. 118-119°С. Знайдено, %: С 57,84; Н 4,48; N 7,62. C18H17BrN2 О2. Розраховано, %: С 57,92; Н 4,59; N 7,51. ПМР-сп.; ( d , м.д.): 6,78-7,38 (8Н, феніл); 5,54 (1Н, СН); 3,75-4,16 (2Н, СН2); 3,61 (3Н, ОСН3); 2,10 (3Н, СН3). В аналогічних умовах прикладів 1 або 2 отримують: Метиловий ефір (ME) хіназолінил(1,2-дегідро-2,4-діфеніл-4Н-6-6ром)оцтової-3 кислоти із метилового ефіра N(2-аміно-5-бромбензгідрил)гліцина (ME БГГ, 5-бром) і бензоїлхлорида. Вихід 82%. Т. пл. 161-162°С (із метанола). Знайдено, %: С 63.51; Н 4.36; N 6.51; C23H19BrN2O2 . Розраховано, %: С 63.46; Н 4.40; N 6.44; ПМР-сп., ( d , м.д.): 6.98-7.44 (13Н, феніл); 5.64 (1Н, СН); 3.75-4.08 (2Н, СН2); 3.58 (3Н, ОСН3). ME хіназолінил(1,2-дегідро-2,4-діфеніл-4Н-6-хлор)оцтової-3 кислоти із ME БГГ (5-хлор) і бензоїлхлорида. Вихід 79%. Т.пл. 135-136°С (із метанола) Знайдено, %: С 70.76; Н 4.88; N 7.23. C23H19ClN2O2 . Розраховано, %: С 70.68; Н 4.90; N 7.17. ПМР-сп., ( d , м.д.): 6.93-7.43 (13Н, феніл); 5.68 (1Н, СН); 3.80-4.08 (2Н, СН2); 3.58 (3Н, ОСН3). ME хіназолінил(1,2-дегідро-2,4-діфеніл-4Н- 6-метил)оцтової-3 кислоти із ME БГГ (5-метил) і бензоїлхлорида. Вихід 73%. Т.пл. 144-145°С (із метанол-ефіра 1:6). Знайдено, %: С 77.93; Н 5.88; N 7,61. С24Н22Н2O 2. Розраховано, %: С 77.81; Н 5.99; N 7.56. ПМР-сп., ( d , м.д.): 6.67-7.43 (13Н, феніл); 5.58 (1Н, СН); 3.75-4.04 (2Н, СН2); 3.57 (3Н, ОСН3); 2.23 (3Н, СН3). Етиловий ефір (ЕЕ) xiнaзoлiнил[1,2-дeгiдpo-2-(4 1-бpoм)фeнiл-4H-4-фeнiл-6-бpoм]-оцтової-3 кислоти із ЕЕ БГГ (5-бром) і (пара-бром)бензоїлхлорида. Вихід 68%. Т.пл. 102-103°С (із метанол-ефіра 1:4).3найдено, %: С 54.63; Н 3.76; N 5.38. С24Н20Вr2N2 O2 . Розраховано, %: С 54.57;Н 3.82; N 5.30. ПМР-сп., ( d , м.д.): 6.98-7.56 (12Н, феніл); 5.63 (1Н, СН); 3.73-4.12 (4Н, 2СН2); 1.12-1.19 (3Н, СН3). ME хіназолінил[1,2-дегідро-2-(2-бром)феніл-4Н-4-феніл-6-бром]оцтової-3 кислоти із ME БГГ (5-бром) і (ортобром)бензоїлхлорида. Вихід 43%. Т.пл. 124-125°С (із ефіра). Знайдено, %: С 53.78; Н 3.49; N 5.51. C23H18Br2N2 O2. Розраховано, %: С 53.72; Н 3.53; N 5.45. ME xiнaзoлiнил[1,2-дeгiдpo-2-(21-xлop)фeнiл-4H-4-фeнiл-6-бpoм]oцтoвoї-3 кислоти із ME БГГ (5-бром) і (ортохлор)бензоїлхлорида. Вихід 44%. Т.пл. 119-120°С (із ефіра). Знайдено, %: С 58.88; Н 3.84; N 6.01. С23Н18ВrСlN2O2. Розраховано, %: 58.81; Н 3.86; N 5.96. ME хіназолінил[1,2-дегідро-2-(3-хлор)феніл-4Н-4-феніл-6-хлор]оцтової-3 кислоти із ME БГГ (5-хлор) і (метахлор)бензоїлхлорида. Вихід 81%. Т.пл. 149-150°С (із метанола). Знайдено, %: С 64.98; Н 4.32; N 6.64, С23Н18Сl2N2O 2. Розраховано, %: С 64.95; Н 4.27; N 6.59 ПМР-сп., ( d , м.д.): 6.80-7.45 (12Н, феніл); 5.60 (1Н, СН); 3.76-4.05 (2Н, CH2); 3.59 (3Н, ОСН3). ME xiнaзoлiнил[1,2-дeгiдpo-2-(4 1-xлop)фeнiл-4H-4-фeнiл-6-бpoм]oцтoвoї-3 кислоти із ME БГГ (5-бром) і (парахлор)бензоїлхлорида. Вихід 91%. Т. пл. 154-155°С (із хлороформ-метанола 1:2). Знайдено, %: С 58.94; Н 3.81; N 6.01. С23Н18ВrСlN2O2 . Розраховано, %: С 58.81; Н 3.86; N5.96. ME xiнaзoлiнил[1,2-дeгiдpo-2-(41-xлop)фeнiл-4H-4-фeнiл-6-xлop]oцтoвoї-3 кислоти із ME БГГ (5-хлор) і (парахлор)бензоїлхлорида. Вихід 86%. Т.пл. 130-131°С (із хлороформ-метанола 1:3). Знайдено, %: С 64.93; Н 4.18; N 6.61. С23Н18Сl2N2O 2. Розраховано, %: С 64.89; Н 4.23; N 6.58. ПМР-сп., ( d , м.д.): 6.80-7.42 (12Н, феніл); 5.58 (1Н, СН); 3.75-4.04 (2Н, СН2); 3.58 (3Н, ОСН3). ЕЕ xiнaзoлiнил[1,2-дeгiдpo-2-(4 1-хлор)фeнiл-4H-4-фeнiл-6-бpoм]oцтoвoї-3 кислоти із ЕЕ БГГ (5-бром) і (парахлор)бензоїлхлорида. Вихід 53%. Т.пл. 94-95°С (із гексан-ефіра 1:1). Знайдено,%: С 59.63; Н 4.13; N 5.83. С24Н20ВrСlN2O2 . Розраховано, %: С 59.58; Н 4.17; N 5.79. ME xiнaзoлiнил[1,2-дeгiдpo-2-(41-метокси)фeнiл-4H-4-фeнiл-6-бром]oцтoвoї-3 кислоти із ME БГГ (5-бром) і (пара-метоксі)бензоїлхлорида. Вихід 56%. Т.пл. 76-77°С (із метанол-ефіра 1:4). Знайдено,%: С 61.98; Н 4.49; N 6.08. С24Н21ВrN2 O3. Розраховано, %: С 61.95; Н 4.55; N 6.02. ПМР-сп., ( d , м.д.): 6.84-7.41 (12Н, феніл); 5.56 (1Н, СН); 3.81-4.16 (2Н, СН2); 3.56-3.80 (6Н, 20СН3). ME xiнaзoлiнил[1,2-дeгiдpo-2-(41-метокси)фeнiл-4H-4-фeнiл-6-xлop]oцтoвoї-3 кислоти із ME БГГ (5-хлор) і (пара-метоксі)бензоїлхлорида. Вихід 51%. Т.пл. 73-74 °С (із хлороформ-ефіра 1:6). Знайдено, %: С 68.54; Н 5.06; N 6.72. С24Н21СlN2O3. Розраховано, %: С 68.49; Н 5.03; N 6.66. ПМР-сп., ( d , м.д.): 6.83-7.40 (12Н, феніл); 5.60 (1Н, СН); 3.80-4.20 (2Н, СН2); 3.53-3.84 (6Н, 20СН3). ME хіназолінил[1,2-дегідро-2-(31,41,51-триметоксі)феніл-4Н-4-феніл-6-бром]-оцтової-3 кислоти із ME БГГ (5бром) і (3,4,5-триметоксі)бензоїлхлорида. Вихід 84%. Т.пл. 169-170°С (із метанола). Знайдено, %: С 59.49; Н 4.78; N 5.38. С26Н25ВrN2 O. Розраховано, %: С 59.44; Н 4.80; N5.33. EE хіназолінил[1,2-дегідро-2-(31,41,51-триметоксі)феніл-4Н-4-феніл-6-бром]-оцтової-3 кислоти із ЕЕ БГГ (5бром) і (3,4,5-триметоксі)бензоїлхлорида. Вихід 78%. Т.пл. 148-149 °С (із метанола). Знайдено, %: С 60.01; Н 4.99; N 5.23. C 27H27BrN2O 5. Розраховано, %: С 60.06; Н 5.01; N 5.19. ПМР-сп, ( d , м.д.): 6.73-7.42 (10Н, феніл); 5.67 (1Н, СН); 3.88-4.12 (4Н, 2СН2); 3.74-3.84 (9Н, 30СН3); 1.11-1.14 (3Н, СН3). ME хіназолінил[1,2-дегідро-2-(31,41,51-триметоксі)феніл-4Н-4-феніл-6-хлор]-оцтової-3 кислоти із ME БГГ (5хлор) і (3,4,5-триметоксі)бензоїлхлорида. Вихід 81%.Т. пл. 166-167°С (із метанола). Знайдено, %: С 64.98; Н 5.19; N 5.87. С26Н25СlN2O5. Розраховано, %: С 64.93; Н 5.24; N 5.82. ПМР-сп., ( d , м.д.): 6.68-7.40 (10Н, феніл); 5.60 (1Н, СН); 3.69-4.10 (2Н, СН2); 3.60-3.82 (12Н, 40СН3). ME хіназолінил[1,2-дегідро-2-(31,41,51-триметоксі)феніл-4Н-4-феніл-6-метил]-оцтової-3 кислоти із ME БГГ (5метил) і (3,4,5-триметоксі)бензоїлхлорида. Вихід 83% Т.пл. 167-168°С (із метанола). Знайдено,%: С 70.48; Н 6.06; N 6.11. C27H28N2О 5. Розраховано, %: С 70.42; Н 6.13; N 6.08. ПМР-сп., ( d , м.д.): 6.56-7.39 (10Н, феніл); 5.49 (1Н, СН); 3.69-4.02 (2Н, СН2); 3.53-3.81 (12Н, 40СН3); 2.20 (3Н, СН3). ME хіназолінил(1,2-дегідро-2,6-діметил-4Н-4-феніл)оцтової-3 кислоти із ME БГГ (5-метил) і ацетилхлорида. Вихід 63%. Т.пл. 113-114°С (із гексан-ефіра 1:1). Знайдено, %: С 74.06; Н 6.49; N 9.13. C19H20N2О2. Розраховано, %: С 74.00; Н 6.54; N 9.08. ME xiнaзoлiнил[l,2-дeгiдpo-2-мeтил-4H-4-(2 1-xлop)фeнiл-6-бpoм]oцтoвoї-3 кислоти із ME N-(2-аміно-21-хлор-5бромбензгідрил)гліцина і ацетилхлорида. Вихід 73%. Т пл. 141-142°С (із метанол-ефіра 1:4). Знайдено,%: С 53.07; Н 3.91; N 6.92. С18Н16ВrСlН2O2 . Розраховано, %: С 53.03; Н 3.96; N 6.87. ME хіназолінил(1,2-дегідро-2-метил-4Н-4-феніл-6-хлор)оцтової-3 кислоти із ME БГГ (5-хлор) і ацетилхлорида. Вихід 76%. Т.пл. 109-110°С (із метанол-ефіра 1:8). Знайдено, %: С 65.76; Н 5.11; N 8.58. C18H17ClN2O2. Розраховано, %: С 65.70; Н 5.17; N 8.52. ПМР-сп., ( d , м.д.): 6.65-7.32 (8Н, феніл); 5.52 (1Н, СН); 3.71-4.15 (2Н, СН2); 3.64(3Н, ОСН3); 2.10 (3Н, СН3). ЕЕ хіназолінил(1,2-дегідро-2-метил-4Н-4-феніл-6-бром)оцтової-3 кислоти із ЕЕ БГГ (5-бром) і ацетилхлорида. Вихід 63%. Т.пл. 86-87°С (із ефіра). Знайдено, %: С 58.98; Н 4.91; N 7.29. C19H19BrN2O2 . Розраховано, %: С 58.93; Н 4.95; N 7.23. ПМР-сп., ( d , м.д.): 6.74-7.36 (8Н, феніл); 5.51 (1Н, СН); 3.68-4.09 (4Н, 2СН2); 1.15-2.06 (6Н, 2СН3). ME хіназолінил(1,2-дегідро-2-етил-4Н-4-феніл-6-бром)оцтової-3 кислоти із ME БГГ (5-бром) і пропіонилхлорида. Вихід 43%. Т.пл. 98-99°С (із метанол-ефіра 1:8). Знайдено, %: С 58.96; Н 4.99; N 7.27. C19H19BrN2 O2. Розраховано, %: С 58.93; Н 4.95; N 7.23. МЕ хіназолінил(1,2-дегідро-2-морфолінометилен-4Н-4-феніл-6-бром)оцтової-3 кислоти із ME БГГ (5-бром) і морфоліноацетилхлорида. Вихід 79%.Т.пл. 153-154°С (із метанола). Знайдено, %: С 57.68; Н 5.23; N 9.21. C22H24BrN3 O3. Розраховано, %: С 57.65; Н 5.28; N 9.17. ПМР-сп., ( d , м.д.): 6.82-7.37 (8Н, феніл); 5.60 (1Н, СН); 3.58-4.56 (2Н, CH2); 3.71 (3Н, ОСН3); 3.50 (4Н, CH2ОCH2); 3.08-3.36 (2Н, CH2); 2.38-2.46 (4Н, CH2NCH2). ME хіназолінил(1,2-дегідро-2-морфоліноетилен-4Н-4-феніл-6-бром)оцтової-3 кислоти із ME БГГ (5-бром) і морфолінопропіонилхлорида. Вихід 44%. Т.пл. 124-125°С (із хлороформ-ефіра 1:5). Знайдено, %: С 58.52; Н 5.51; N 8.93. C23H26BrN 3O3 . Розраховано, %: С 58.48; Н 5.55; N 8.90. П МР-сп., ( d , м.д.): 6.76-7.31 (8Н, феніл); 5.51 (1Н.СН); 3.69-4.19 (2Н, СН2); 3.63 (3Н, ОСН3); 3.55 (4Н, СН2OСН2); 2.42-2.69 (4Н, 2СН2); 2.34-2.39 (4Н, CH2NCH2); Примітка: ТШХ означає тонкошарову хроматографію, використані пластинки "Silyfol UV-254". ME або ЕЕ БГГ - метиловий або етиловий ефір N-(2-аміно-5-R3-бензгідрил)гліцина, де R3 - бром, хлор або метил. ПМР-спектри в ДМСО-d6 на приладі "Varian" з робочою частотою 400MHz. .
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for producing ethers of 2,4,6-substituted quinazolinyl (1,2-dehydro-4н) acetic-3 acid
Автори англійськоюRudenko Oleh Pavlovych
Назва патенту російськоюСпособ получения эфиров 2,4,6-замещенных хиназолинил (1,2-дегидро-4н) уксусной -3 кислоты
Автори російськоюРуденко Олег Павлович
МПК / Мітки
МПК: C07D 239/82, A61K 31/505
Мітки: отримання, 1,2-дегідро-4н, 2,4,6-заміщених, хіназолініл, ефірів, спосіб, оцтової-3, кислоти
Код посилання
<a href="https://ua.patents.su/4-70501-sposib-otrimannya-efiriv-246-zamishhenikh-khinazolinil-12-degidro-4n-octovo-3-kisloti.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання ефірів 2,4,6-заміщених хіназолініл (1,2-дегідро-4н) оцтової-3 кислоти</a>
Попередній патент: Пристрій для завадостійкого передавання інформації по лініях зв’язку
Наступний патент: Спосіб спільного використання ресурсу цифрової системи
Випадковий патент: Клиновий пас








