Спосіб отримання заміщених адамантиларилмагнієвих галідів
Номер патенту: 97507
Опубліковано: 27.02.2012
Автори: Лабейш Владімір, Калвіньш Іварс, Чернобровійс Алєксандрс, Трібуловіч Вячеслав
Формула / Реферат
1. Спосіб отримання заміщених адамантиларилмагнієвих галідів, при якому здійснюють реакцію заміщеного адамантиларилгаліду з магнієм в апротонному інертному розчиннику (пряма реакція Гриньяра) в присутності безводної солі літію.
2. Спосіб за пунктом 1, в якому реакцію здійснюють при температурі від приблизно -70 °С до приблизно 80 °С, переважно від приблизно 20 °С до приблизно 70 °С.
3. Спосіб за будь-яким з пунктів 1 або 2, в якому апротонним інертним розчинником є тетрагідрофуран.
4. Спосіб за будь-яким з пунктів від 1 до 3, в якому безводна сіль літію є безводним хлоридом, бромідом, йодидом, сульфатом, перхлоратом, тетрафторборатом, переважно безводним літію хлоридом.
5. Спосіб за будь-яким з пунктів від 1 до 4, в якому безводну сіль літію використовують в стехіометричному співвідношенні із заміщеним адамантиларилгалідом в межах від 0,1 до 5,0 моль на моль.
6. Спосіб за будь-яким з пунктів від 1 до 5, в якому безводну сіль літію використовують в оптимальному стехіометричному співвідношенні з заміщеним адамантиларилгалідом в межах від 1,2 до 1,5 моль на моль.
7. Спосіб отримання сполуки формули (І)
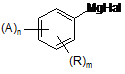 , (I)
, (I)
в якій:
А - це (1-адамантил) чи (2-адамантил), який може бути факультативно заміщеним від нуля до шести заміщень, кожне з яких незалежно вибирають з OR1, NR1R2, алкілу, алкенілу, алкінілу, циклоалкілу, циклоалкілалкілу, біциклоалкілу, біциклоалкілалкілу, алкілтіоалкілу, арилалкілтіоалкілу, циклоалкенілу, арилу, аралкілу, гетероарилу, гетероарилалкілу, циклогетероалкілу і циклогетероалкілалкілу;
R1 і R2, кожний незалежно, вибирають з алкілу, алкенілу, алкінілу, арилу і гетероарилу;
Hal - це Сl, Br чи І, краще Br;
R є:
Н, Сl, F, CF3 чи фторований С1-С10алкіл, С1-С10алкілС2-С10алкеніл, С2-С10алкініл, C1-С10алкокси, або дві групи R3, взяті разом, утворюють групу алкілендіокси, -OSiR3R4R5, -(СН2)t(С6-С10арил), -(СН2)t(4-10-членна гетероциклічна сполука), де t - це ціле число від 0 до 5; вказана алкільна група факультативно включає гетероскладові, вибрані з О, S і -N(R6), де R3, R4, R5, кожний незалежно, є С1-С10алкілом,
вказані R, арильна і гетероциклічна групи можуть бути факультативно конденсованими до С6-С10арильної групи, насиченої С5-С8циклічної групи чи 5-10-членної гетероциклічної групи,
-(СН2)t-cкладові вказаних R груп факультативно включають подвійний чи потрійний зв'язок вуглець-вуглець, де t - це ціле число від 2 до 5; і вказані R групи, крім Н, є факультативно заміщеними 1-3 групами R6; R6 є С1-С10алкілом чи С1-С10алкокси;
n - це 1 чи 2;
m приймає значення від 0 до 3;
при якому здійснюють реакцію сполуки формули (II)
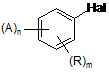 , (II)
, (II)
в якій A, Hal, R, n і m є такими, як було визначено для формули (І), з магнієм в апротонному інертному розчиннику (пряма реакція Гриньяра) в присутності безводної солі літію.
Текст
1. Спосіб отримання заміщених адамантиларилмагнієвих галідів, при якому здійснюють реакцію заміщеного адамантиларилгаліду з магнієм в апротонному інертному розчиннику (пряма реакція Гриньяра) в присутності безводної солі літію. 2. Спосіб за пунктом 1, в якому реакцію здійснюють при температурі від приблизно -70 °С до приблизно 80 °С, переважно від приблизно 20 °С до приблизно 70 °С. 3. Спосіб за будь-яким з пунктів 1 або 2, в якому апротонним інертним розчинником є тетрагідрофуран. 4. Спосіб за будь-яким з пунктів від 1 до 3, в якому безводна сіль літію є безводним хлоридом, бромідом, йодидом, сульфатом, перхлоратом, тетрафторборатом, переважно безводним літію хлоридом. 5. Спосіб за будь-яким з пунктів від 1 до 4, в якому безводну сіль літію використовують в стехіометричному співвідношенні із заміщеним адамантиларилгалідом в межах від 0,1 до 5,0 моль на моль. 6. Спосіб за будь-яким з пунктів від 1 до 5, в якому безводну сіль літію використовують в оптимальному стехіометричному співвідношенні з заміщеним адамантиларилгалідом в межах від 1,2 до 1,5 моль на моль. 7. Спосіб отримання сполуки формули (І) 2 3 в якій A, Hal, R, n і m є такими, як було визначено для формули (І), з магнієм в апротонному інертно Даний винахід стосується тонкого органічного синтезу, зокрема способу отримання заміщених адамантиларилмагнієвих галідів. Магній-органічні сполуки є особливо важливими в сучасній препаративній органічній хімії. З часу відкриття Грин'яра в 1900 p., способи отримання і подальшого перетворення цих синтетичних проміжних продуктів знаходяться в постійному розвитку і розширенні. Стандартний препаративний спосіб отримання магній-органічних сполук (реактивів Грин'яра) являє собою пряму взаємодію органічних галідів з металічним магнієм в апротонному полярному розчиннику, такому як тетрагідрофуран (ТГФ) чи діетиловий ефір [С.Т. Йоффе, А.Н. Несмеянов, Методы элементо-органической химии. Магний, бериллий, кальций, стронций, барий. Изд. AH CCCP, М. 1963, 14-27]. Метою даного винаходу є розробка способу для отримання заміщених адамантиларилмагнієвих галідів, який задовольняв би наступним вимогам: - стабільний високий вихід продукту, можливість суттєвого збільшення масштабу виробництва; - проста технологія. Сполуки, отримувані за цим способом, є активними проміжними продуктами, які можуть взаємодіяти з різними електрофільними агентами з утворенням субстратів, що використовуються для синтезу широкого кола біологічно активних сполук [Charpentier, В.; Bernardon, J.-M.; Eustache, J. et al. Synthesis, structure-affinity relationships, and biological activities of ligands binding to retinoic acid receptor subtypes. J. Med. Chem. 1995, 38 (26), 4993-5006; Cincinelli, R.; Dallavalle, S.; Nannei, R. Synthesis and structure-activity relationships of a new series of retinoid-related biphenyl-4-ylacrylic acids endowed with antiproliferative and proapoptotic activity. J. Med. Chem. 2005, 48 (15), 4931-4946; Pfahl, M.; Tachdjian, C. et al. Heterocyclic derivatives for the treatment of cancer and other proliferative diseases. US 2002/0143182 A1]. Важливим представником заміщених адамантиларилмагнієвих галідів є 3-(1-адамантил)-4метоксифенілмагнію бромід який використовується для синтезу 6-[3-(1адамантил)-4-метоксифеніл]-2-нафтойної кислоти (адапалену): 97507 4 му розчиннику (пряма реакція Гриньяра) в присутності безводної солі літію. Адапален є фармацевтичним препаратом, який широко застосовується в дерматології як ефективний засіб для лікування acne vulgaris [Waugh, J.; Noble, S.; Scott, L. Spotlight on adapalene in acne vulgaris. J. Am. J. Clin. Dermatol. 2004, 5 (5), 369-371; Jain, S. Topical tretinoin or adapalene in acne vulgaris: an overview. J. Dermatol. Treat. 2004, 15 (4), 200-207]. He менш важливим представником є 3-(1адамантил)-4-(tert-бутилдиметил силілокси)фенілмагнію бромід або 3-(1-адамантил)-4-бензилоксифенілмагнію бромід який використовується в синтезі 6-[3-(1адамантил)-4-гідроксифеніл]-2-нафтойної кислоти (AHPN, CD 437): 3-(1-Адамантил)-4-(tert-бутилдиметил силілокси)фенілмагнію бромід або 3-(1-адамантил)-4бензилоксифенілмагнію бромід можуть використовуватись також для синтезу 4-[3-(1-адамантил)-4гідроксифеніл]-3-хлоркоричної кислоти (3-СІАНРС): 5 97507 яку, подібно до 6-[3-(1-адамантил)-4гідроксифеніл]-2-нафтойної кислоти (AHPN, CD 437), запатентовано в якості протипухлинного препарату [Dawson, M.; Fontana, J.; Zhang, X. et al. Induction of apoptosis in cancer cells. WO 03/048101 A1]. Синтез заміщених адамантиларилмагнієвих галідів, що містять електродонорні заміщення в ароматичному кільці, класичним методом, тобто шляхом взаємодії арилгаліду з металічним магнієм в апротонному полярному розчиннику, такому як ТГФ чи діетиловий ефір, дає виходи, які не перевищують 11 %. Головний продукт реакції є результатом відновлення арилгаліду. Так, 2-(1адамантил)-4-броманізол дає 2-(1адамантил)анізол з 78 % виходом (дивись Приклад 1). 6 Зміна температури і тривалості реакції при приготуванні реактиву Грин'яра практично не приводять до скільки-небудь суттєвих змін у складі продуктів реакції (дивись Приклад 4). Метод додавання (одночасне додавання вихідного арилброміду і диброметану) [D.E. Pearson et al., J. Org. Chem., 24, 504 (1959)] не дав позитивного результату (дивись Приклад 5). Зміна органічного електрофільного агенту суттєво не змінює співвідношення між продуктами: продукт відновлення/заміщений адамантиларилмагнієвий бромід (дивись Приклад 6). Використання неорганічного електрофільного агенту, такого як D2SO4-D2O, усувало можливу взаємодію між адамантиларилмагнієвим галідом і органічним електрофільним агентом, але давало схожий результат. Так, розкладання реактиву Грин'яра, отриманого з 2-(1-адамантил)-4-броманізолу і суміші D2SO4-D2O, дало суміш продуктів, в якій вміст дейтерованого 2-(1-адамантил)-анізолу, який в цьому випадку був кінцевим продуктом, становив 9 % (дані ЯМР, дивись Приклад 7). Газохроматографічний аналіз реакційної суміші підтвердив повне перетворення 2-(1адамантил)-4-броманізолу. Це означає, що вихідний матеріал дуже ефективно реагує з металічним магнієм в умовах класичної реакції Грин'яра. Подібні експерименти з 2-(1-адамантил)-5броманізолом дали схожі результати (дивись Приклад 2), Головний продукт як і з 3-(1-адамантил)-5-бромвертролом (дивись Приклад 3) Головний продукт Зменшення виходу адамантиларил галіду як головного продукту реакції вихідного матеріалу в умовах реакції Грин'яра може бути результатом нестабільності адамантиларилмагнієвого галіду чи наслідком низької реактивності реактиву Грин'яра з електрофільним агентом, що використовується. Ці результати показують, що реактив Грин'яра, отриманий з 2-(1-адамантил)-4-броманізолу, є нестабільною субстанцією і піддається формальному відновленню раніше, ніж вступає у взаємодію з будь-яким електрофільним агентом. Найближчим аналогом винаходу, що заявляється, є обмінний метод для приготування магнійорганічного реактиву [Krasovskiy, A.; Knochel, P. A LiCI-mediated Br/Mg exchange reaction for the preparation of functionalized aryland heteroarylmagnesium compounds from organic bromides. Angew. Chem. Int. Ed. 2004, 43 (25), 3333-3336; Knochel, P.; Krasovskiy, A. Method of preparing organomagnesium compound. EP 1582523 (2005); Krasovskiy, A.; Straub, B.F.; Knochel, P. Highly efficient reagents for Br/Mg exchange. Angew. Chem. Int. Ed. 2006, 45 (1), 159-162]. Цей метод базується на отриманні комплексів AlkMgCILiCI чи Alk2MgLiCI та їх взаємодії з заміщеними галоїдарилом чи галоїдгетероарилом. Тим не менш, реакція 2-(1-адамантил)-4броманізолу (дивись Приклад 8 - згідно з відомим методом) і 3-(1-адамантил)-5-бромвератролу (дивись Приклад 9 - згідно з відомим методом) з ізоPrMgCI LiCI в умовах, наведених у відомих методах, дала конверсію від 6 до 9 % в межах 2денного періоду часу. Отже, експериментальні дані підтвердили як нестабільність заміщеного адамантиларилмагнієвого галіду, так і низьку реактивність заміщеного адамантиларилмагнієвого галіду в реакції обмінного синтезу з використанням ізо-PrMgCI LiCI. 7 Досліджуючи отримання арилмагнієвих галідів з електродонорними заміщеннями в кільці, деякі автори [Krasovskiy, A.; Straub, B.F.; Knochel, P. Highly efficient reagents for Br/Mg exchange. Angew. Chem. Int. Ed. 2006, 45 (1), 159-162] використовували для синтезу магній-органічних сполук реактиви з підвищеною реактивністю, тому рівновага в рівнянні Шленка 2 iso-PrMgCI LiCI iso-Pr2MgCI+MgCl2+LiCI зміщувалась до ізо-Pr2МgСІ LiCI чи похідного диалкілмагнію як результат захоплення MgСІ2 різними реактивами, такими як діоксан. Використання цього методу отримання магнійорганічного похідного з 2-(1-адамантил)-4броманізолу (дивись Приклад 10 - згідно з відомим методом) дало 13 % конверсію після 2-денного періоду часу. Отримані результати показують, що найактивнішим реактивом в приготуванні металоорганічних похідних з адамантиларилгалідів є металічний магній, але отриманий адамантиларилмагнієвий галід необхідно стабілізувати, щоб попередити подальші небажані реакції. Вказана вище мета, а саме розробка ефективного і технологічно здійсненного способу для отримання заміщених адамантиларилмагнієвих галідів, була досягнута шляхом використання літію хлориду в процесі синтезування реактиву Грин'яра під час реакції металічного магнію з заміщеними адамантиларилгалідами в безводному тетрагідрофурані під захистом аргону (дивись Приклади 10-41). Запропонований спосіб для отримання заміщених адамантиларилмагнієвих галідів базується на тому припущенні, що в стандартних умовах магній-органічного синтезу, тобто при дії арилгалідами на металічний магній, додавання літію хлориду стабілізує заміщений адамантиларилмагнієвий галід за рахунок утворення комплексу і запобігає подальшим небажаним реакціям, але фатально не пригнічує реактивність цього заміщеного адамантиларилмагнієвого галіду. Спосіб згідно з даним винаходом ілюструється наступними прикладами. Приклад 1 В 1-л колбі, обладнаній мішалкою, зрошувальним конденсатором і крапельною воронкою, змішали 8 г (0,33 М) ошурок магнію і 200 мл сухого тетрагідрофурану. Додали 8 г (0,19 М) порошкоподібного безводного літію хлориду. Повітря в колбі витіснили аргоном і всі подальші операції здійснювали під легким струменем цього інертного газу. При інтенсивному перемішуванні додали 11 г (5 мл; 0,06 М) 1,2-диброметану як одну порцію. Після стихання активної реакції гарячу реакційну суміш обробили розчином 50 г (0,16 М) 2-(1-адамантил)4-броманізолу в 400 мл тетрагідрофурану з такою швидкістю, щоб підтримувався незначний рефлюкс. Після додавання розчину 2-(1-адамантил)-4броманізолу реакційну суміш перемішували і нагрівали до повільного рефлюксу ще 30 хвилин. Потім перемішування припиняли і отриманий у такий спосіб реактив Грин'яра злили з залишкового магнію в конічну колбу, попередньо продуту аргоном, закрили притертою пробкою. 97507 8 Для подальших реакцій функціоналізації використовувався триметилборат, який є стандартним реактивом для приготування фенілборинових кислот. В 1-л колбі, обладнаній мішалкою, зрошувальним конденсатором і крапельною воронкою, приготували розчин з 33 г (36 мл; 0,35 М) триметилборату в 100 мл сухого тетрагідрофурану. Отриманий розчин охолодили до -50 °C і при інтенсивному перемішуванні додали за 30 хвилин реактив Грин'яра при температурі від -40 до -50 °C. Для розкладання реакційної суміші було використано розчин 50 мл соляної кислоти в 50 мл води при інтенсивному перемішуванні без зовнішнього охолодження. Суміш перенесли в розділювальну воронку і розділили на водний і органічний шари. До водного шару додали 200 мл води і двічі екстрагували, використовуючи 100 мл діетилового ефіру. Об'єднані органічні розчини висушили на безводному натрію сульфаті, розчинники видалили під вакуумом при температурі близько 50 °C у водяній ванні. Залишок обробили 200 мл гексану і залишили на ніч в холодильнику. Осад відфільтрували, промили холодним етилацетатом і висушили при 100 °C. Отримали 3-(1-адамантил)-4метоксифенілборинову кислоту, 2,5 г (5,7 %) з температурою плавлення ~300 °C. Газохроматографічний аналіз реакційної суміші показав один головний продукт. Вихід за даними газової хроматографії становить 78 %. Сполуку було виділено та ідентифіковано як 2(1-адамантил)анізол. Препаративний вихід становить 67 %, температура плавлення 100-102 °C. Приклад 2 Реакція здійснюється, як описано в Прикладі 1. В якості адамантиларилгаліду використано 50 г (0,16 М) 2-(1-адамантил)-5-броманізолу. Отримано 4-(1-адамантил)-3-метоксифенілборинову кислоту, 3 г (6,8 %) За даними газової хроматографії вихід 2-(1-адамантил)анізолу становив 81 %. Продукт формального відновлення 2-(1адамантил)-5-броманізолу було виділено, і його тотожність з 2-(1-адамантил)анізолом, отриманим в Прикладі 1, було підтверджено, тим самим підтвердивши приписану йому структуру. Приклад 3 Реакція здійснюється, як описано в Прикладі 1. В якості адамантиларилгаліду використано 56 г (0,16 М) 3-(1-адамантил)-5-бромвератролу. Отримано 3-(1-адамантил)-4,5-метоксифенілборинову кислоту, 3,7 г (7,3 %). За даними газової хроматографії вихід 3-(1-адамантил)вератролу становив 74 %. Приклад 4 Реакція здійснюється, як описано в Прикладі 1. Зміна температури і тривалості реакції не впливала на результат. 9 Приклад 5 Реакція здійснюється, як описано в Прикладі 1. Одночасне додавання арилгаліду і 1,2диброметану не впливало на результат. Використання бензальдегіду в якості електрофільного агенту, який кількісно реагує з арилмагнієвим галідом з утворенням арилфенолметанолу, дало той самий результат. За даними газової хроматографії реакційна суміш містить 70-75 % похідного адамантилбензолу і 3-11 % очікуваного арилфенілметанолу. Приклад 6 Реактив Грин'яра було отримано з 51 г (0,16 М) 2-(1-адамантил)-4-броманізолу, як в Прикладі 1. На наступному етапі в 1-л колбу, обладнану мішалкою, зрошувальним конденсатором і крапельною воронкою, помістили 17 г (16,5 мл; 0,16 М) бензальдегіду і 100 мл сухого тетрагідрофурану. Отриманий розчин охолодили до 0 °C і при перемішуванні впродовж 10 хвилин додали реактив Грин'яра. Реакційну суміш залишили на 16 годин в холодильнику при температурі біля 0 °C. Для розкладання реакційної суміші було використано розчин 25 мл соляної кислоти в 25 мл води при інтенсивному перемішуванні без зовнішнього охолодження. Суміш перенесли в розділювальну воронку і розділили на водний і органічний шари. Водний шар двічі екстрагували, використовуючи 100 мл діетилового ефіру. Об'єднані органічні розчини висушили на безводному натрію сульфаті. Вихід 3-(1-адамантил)-4метоксифенілметанолу за даними газової хроматографії склав 11 %. Приклад 7 Реактив Грин'яра було отримано з 10 г (0,032 М) 2-(1-адамантил)-4-броманізолу, як в Прикладі 1. В якості електрофільного агенту для функціоналізації і ідентифікації було використано суміш D2SO4-D2O. Для розкладання реакційної суміші було використано розчин 2 мл D2SO4 в 10 мл важкої води при інтенсивному перемішуванні без зовнішнього охолодження. Суміш перенесли в розділювальну воронку і розділили на водний і органічний шари. Водний шар двічі екстрагували, використовуючи 50 мл діетилового ефіру. Об'єднані органічні розчини висушили на безводному натрію сульфаті, а розчинник повністю видалили під вакуумом. Приклад 8 (згідно з відомим способом) В 200-мл колбу з магнітною мішалкою і крапельною воронкою помістили 5,14 г (0,016 М) 2-(1 97507 10 адамантил)-4-броманізолу і 60 мл сухого тетрагідрофурану. Повітря з колби витіснили аргоном і всі подальші операції здійснювали під легким струменем цього інертного газу. Реакційну суміш охолодили до -5 °C і додали 3 еквіваленти 0,5 М розчину ізо-PrMgCI LiCI в тетрагідрофурані, підтримуючи температуру реакції в межах від -5 до 0 °C. Розчин ізо-PrMgCI LiCI в тетрагідрофурані було приготовлено завчасно, його концентрацію визначали титруванням згідно з [Krasovskiy, A.; Knochel, P. Convenient titration method for organometallic zinc, magnesium, and lanthanide reagents. Synthesis 2006, 5, 890-891]. Після додавання розчину ізо-PrMgCI LiCI в тетрагідрофурані реакційну суміш витримали впродовж 1 години при 0 °C і залишили при кімнатній температурі на 48 годин. За даними газової хроматографії конверсія 2(1-адамантил)-4-броманізолу склала 9 % Приклад 9 (згідно з відомим способом) Реакція здійснюється, як описано в Прикладі 8. В якості адамантиларилгаліду використовуються 5,62 г (0,016 М) 3-(1-адамантил)-5-бромвератролу. За даними газової хроматографії конверсія 3(1-адамантил)-5-бромвератролу склала 6 %. При здійсненні цієї реакції в суміші тетрагідрофурану і діоксану (діоксан 10 % о/о) конверсія адамантиларилгаліду збільшується тільки в незначній мірі. Приклад 10 (згідно з відомим способом) Реакція здійснюється, як описано в Прикладі 8. В якості розчинника для 5,14 г (0,016 М) 2-(1адамантил)-4-броманізолу використовується суміш 54 мл тетрагідрофурану і 6 мл діоксану. За даними газової хроматографії конверсія 2(1-адамантил)-4-броманізолу склала 13 %. Приклад 11 В 100-мл колбу, обладнану магнітною мішалкою, зрошувальним конденсатором і крапельною воронкою, помістили 1 г (0,042 М) ошурок магнію і додали 20 мл сухого тетрагідрофурану. Потім додали 0,81 г (0,019 М) порошкоподібного безводного літію хлориду. Повітря з колби витіснили аргоном і всі подальші операції здійснювали під легким струменем цього інертного газу. При інтенсивному перемішуванні додали 1,1 г (0,5 мл; 0,006 М) 1,2диброметану. Коли бурхлива реакція стихла, гарячу реакційну суміш обробили, додаючи краплями впродовж 30 хвилин, 5,14 г (0,016 М) 2-(1адамантил)-4-броманізолу в 40 мл сухого тетрагідрофурану, підтримуючи реакційну суміш при 5560 °C. Потім суміш витримали ще 30 хвилин в стані незначного рефлюксу. Перемішування припинили, і розчин реактиву Грин'яра злили з залишкового магнію в конічну колбу з притертою пробкою, попередньо продувши її аргоном. Колбу закрили пробкою і тримали при 0 °C впродовж 2 годин. В 250-мл колбу, обладнану магнітною мішалкою, зрошувальним конденсатором і крапельною воронкою, помістили розчин 3,4 г (3,3 мл; 0,032 М) бензальдегіду в 20 мл сухого тетрагідрофурану і охолодили до 0 °C. Потім при постійному перемішуванні впродовж 10 хвилин додали реактив Грин'яра. Реакційну суміш залишили в холодильнику на 16 годин при температурі біля 0 °C. 11 97507 Для розкладання реакційної суміші використали розчин 5 мл соляної кислоти в 5 мл води при інтенсивному перемішуванні без зовнішнього охолодження. Суміш перенесли в розділювальну воронку і розділили на водний і органічний шари. Водний шар двічі екстрагували, використовуючи 50 мл діетилового ефіру. Об'єднані органічні розчини висушили над безводним натрію сульфатом. Отримали 3-(1-адамантил)-4метоксифеніл)фенілетанол, 88 % (за даними газової хроматографії). 12 Експериментальним шляхом було визначено, що оптимальне співвідношення заміщеного адамантиларилгаліду і літію хлориду становить 1:1,2. Результати, наведені в Таблиці 1 (Приклади 4, 10, 11-12), показують, що при збільшенні молярної частки літію хлориду від 0,1 до 1,2 вихід реактиву Грин'яра зростає, але подальше збільшення до 2 еквівалентів суттєво не збільшує вихід реактиву Грин'яра. Таблиця 1 Вплив співвідношення арилгаліду і літію хлориду на вихід арил магнієвого галіду Без LiCI 0,1 екв. LiCI 0,5 екв. LiCI Вихід, % 1,0 екв. LiCI 1,2 екв. LiCI 1,5 екв. LiCI 2,0 екв. LiCI 1 11 16 30 75 88 87 85 2 13 18 34 74 89 89 84 № Арилгалід 1 еквівалент Приклад 12 Реакція здійснюється, як описано в Прикладі 11. Реактив Грин'яра отримали з 0,07 г (0,0016 М, 1 екв.) порошкоподібного безводного літію хлориду. Молярне співвідношення субстрат:LiCI становить 1:0,1. За даними газової хроматографії вихід становить 16 %. Приклад 13 Реакція здійснюється, як описано в Прикладі 11. Реактив Грин'яра отримали з 0,34 г (0,008 М) порошкоподібного безводного літію хлориду. Молярне співвідношення субстрат:LiCI становить 1:0,5. За даними газової хроматографії вихід становить 30 %. Приклад 14 Реакція здійснюється, як описано в Прикладі 11. Реактив Грин'яра отримали з 0,68 г (0,016 М) порошкоподібного безводного літію хлориду. Молярне співвідношення субстрат:LiCI становить 1:1. За даними газової хроматографії вихід становить 75 %. Приклад 15 Реакція здійснюється, як описано в Прикладі 11. Реактив Грин'яра отримали з 1,02 г (0,024 М) порошкоподібного безводного літію хлориду. Молярне співвідношення субстрат:LiCI становить 1:1,5. За даними газової хроматографії вихід становить 87 %. Приклад 16 Реакція здійснюється, як описано в Прикладі 11. Реактив Грин'яра отримали з 1,36 г (0,032 М) порошкоподібного безводного літію хлориду. Мо лярне співвідношення субстрат:LiCI становить 1:2. Заданими газової хроматографії вихід становить 85 %. Приклад 17 Реакція здійснюється, як описано в Прикладі 11. В якості вихідного адамантиларилгаліду використовуються 5,58 г (0,016 М) 2-(3,5диметиладамантил)-4-броманізолу. Реакція здійснювалась без додавання літію хлориду. Було отримано (3-[1-(3,5-диметиладамантил)-4метоксифеніл]феніл етанол, 13 % (за даними газової хроматографії). Приклад 18 Реакція здійснюється, як описано в Прикладі 11. В якості вихідного адамантиларилгаліду використовуються 5,58 г (0,016 М) 2-(3,5диметиладамантил)-4-броманізолу. В реакції Грин'яра було використано 0,07 г (0,0016 М) порошкоподібного безводного літію хлориду. Молярне співвідношення субстрат:LiCI становить 1:0,1. Вихід за даними газової хроматографії становить 18 %. Приклад 19 Реакція здійснюється, як описано в Прикладі 18. Реактив Грин'яра отримали з 0,34 г (0,008 М) порошкоподібного безводного літію хлориду. Молярне співвідношення субстрат:LiCI становить 1:0,5. За даними газової хроматографії вихід становить 34 %. Приклад 20 Реакція здійснюється, як описано в Прикладі 18. Реактив Грин'яра отримали з 0,68 г (0,016 М) 13 97507 порошкоподібного безводного літію хлориду. Молярне співвідношення субстрат:LiCI становить 1:1. За даними газової хроматографії вихід становить 74 %. Приклад 21 Реакція здійснюється, як описано в Прикладі 18. Реактив Грин'яра отримали з 0,81 г (0,019 М) порошкоподібного безводного літію хлориду. Молярне співвідношення субстрат:LiCI становить 1:1,2. Заданими газової хроматографії вихід становить 89 %. Приклад 22 Реакція здійснюється, як описано в Прикладі 18. Реактив Грин'яра отримали з 1,02 г (0,024 М) порошкоподібного безводного літію хлориду. Молярне співвідношення субстрат:LiCI становить 1:1,5. За даними газової хроматографії вихід становить 89 %. 14 Приклад 23 Реакція здійснюється, як описано в Прикладі 18. Реактив Грин'яра отримали з 1,36 г (0,032 М) порошкоподібного безводного літію хлориду. Молярне співвідношення субстрат:LіCI становить 1:2. За даними газової хроматографії вихід становить 84 %. Запропонований спосіб отримання адамантиларилмагнієвих галідів було випробувано з різними субстратами. Використовуване молярне співвідношення адамантиларилгаліду і літію хлориду становило 1:1,2. В якості електрофільного агенту застосовувався бензальдегід. Вихід визначався за допомогою газової хроматографії (Приклади 11, 21, 24-43). Отримані результати наведені в Таблиці 2. Таблиця 2 Вихід адамантиларилгаліду при молярному співвідношенні адамантиларилгаліду і літію хлориду 1:1,2 (за даними газової хроматографії) № Приклад Арилмагнієвий галід Арилфенілкарбінол Вихід, % 1 11 88 2 21 89 3 24 84 4 25 92 5 26 91 6 27 90 15 97507 16 Продовження таблиці 2 7 28 92 8 29 90 9 30 88 10 31 92 11 32 87 12 33 88 13 34 79 14 35 80 17 97507 18 Продовження таблиці 2 15 36 76 16 37 74 17 38 81 18 39 84 19 40 79 20 41 82 21 42 77 Приклад 24 Реакція здійснюється, як описано в Прикладі 11. В якості вихідного адамантиларилгаліду вико ристовуються 5,36 г (0,016 М) 2-[2-(2метиладамантил)]-4-броманізолу. Вихід за даними газової хроматографії становить 84 %. 19 Приклад 25 Реакція здійснюється, як описано в Прикладі 11. В якості вихідного адамантиларилгаліду використовуються 5,14 г (0,016 М) 2-(1-адамантил)-5броманізолу. Вихід за даними газової хроматографії становить 92 %. Приклад 26 Реакція здійснюється, як описано в Прикладі 11. В якості вихідного адамантиларилгаліду використовуються 5,6 г (0,016 М) 2-[1-(3,5диметиладамантил)]-5-броманізолу. Вихід за даними газової хроматографії становить 91 %. Приклад 27 Реакція здійснюється, як описано в Прикладі 11. В якості вихідного адамантиларилгаліду використовуються 5,36 г (0,016 М) 2-[2-(2метиладамантил)]-5-броманізолу. Вихід за даними газової хроматографії становить 90 %. Приклад 28 Реакція здійснюється, як описано в Прикладі 11. В якості вихідного адамантиларилгаліду використовуються 6,35 г (0,016 М) 3-(1-адамантил)-4бензилоксибромбензолу. Вихід за даними газової хроматографії становить 92 %. Приклад 29 Реакція здійснюється, як описано в Прикладі 11. В якості вихідного адамантиларилгаліду використовуються 6,8 г (0,016 М) 3-[1-(3,5диметиладамантил)]-5-бензилоксибромбензолу. Вихід за даними газової хроматографії становить 90 %. Приклад 30 Реакція здійснюється, як описано в Прикладі 11. В якості вихідного адамантиларилгаліду використовуються 6,58 г (0,016 М) 3-[2-(2метиладамантил)]-4-бензилоксибромбензолу. Вихід за даними газової хроматографії становить 88 %. Приклад 31 Реакція здійснюється, як описано в Прикладі 11. В якості вихідного адамантиларилгаліду використовуються 6,35 г (0,016 М) 3-бензилокси-4-(1адамантил)бромбензолу. Вихід за даними газової хроматографії становить 92 %. Приклад 32 Реакція здійснюється, як описано в Прикладі 11. В якості вихідного адамантиларилгаліду використовуються 6,8 г (0,016 М) 3-бензилокси-4-[1(3,5-диметиладамантил)]бромбензолу. Вихід за даними газової хроматографії становить 87 %. Приклад 33 Реакція здійснюється, як описано в Прикладі 11. В якості вихідного адамантиларилгаліду використовуються 6,58 г (0,016 М) 3-бензилокси-4-[2(2-метиладамантил)]бромбензолу. Вихід за даними газової хроматографії становить 88 %. 97507 20 Приклад 34 Реакція здійснюється, як описано в Прикладі 11. В якості вихідного адамантиларилгаліду використовуються 6,74 г (0,016 М) 3-(1-адамантил)-4[1-(tert-бутилдиметилсилілокси)]бромбензолу. Вихід за даними газової хроматографії становить 79 %. Приклад 35 Реакція здійснюється, як описано в Прикладі 11. В якості вихідного адамантиларилгаліду використовуються 7,18 г (0,016 М) 3-[1-(3,5диметиладамантил)]-4-(tertбутилдиметилсилілокси)бромбензолу. Вихід за даними газової хроматографії становить 80 %. Приклад 36 Реакція здійснюється, як описано в Прикладі 11. В якості вихідного адамантиларилгаліду використовуються 6,74 г (0,016 М) 3-(tertбутилдиметилсилілокси)-4-(1адамантил)бромбензолу. Вихід за даними газової хроматографії становить 76 %. Приклад 37 Реакція здійснюється, як описано в Прикладі 11. В якості вихідного адамантиларилгаліду використовуються 7,18 г (0,016 М) 3-(tertбутилдиметилсилілокси)-4-[1-(3,5диметиладамантил)бромбензолу. Вихід за даними газової хроматографії становить 74 %. Приклад 38 Реакція здійснюється, як описано в Прикладі 11. В якості вихідного адамантиларилгаліду використовуються 5,36 г (0,016 М) 3,4-метилендиокси)5-(1-адамантил)бромбензолу. Вихід за даними газової хроматографії становить 81 %. Приклад 39 Реакція здійснюється, як описано в Прикладі 11. В якості вихідного адамантиларилгаліду використовуються 5,81 г (0,016 М) 3,4-метилендиокси)5-[1-(3,5-диметиладамантил)]бромбензолу. Вихід за даними газової хроматографії становить 84 %. Приклад 40 Реакція здійснюється, як описано в Прикладі 11. В якості вихідного адамантиларилгаліду використовуються 5,58 г (0,016 М) 3,4-метилендиокси)5-[2-(2-метиладамантил)]бромбензолу. Вихід за даними газової хроматографії становить 79 %. Приклад 41 Реакція здійснюється, як описано в Прикладі 11. В якості вихідного адамантиларилгаліду використовуються 5,62 г (0,016 М) 3-(1-адамантил)-5бромвератролу. Вихід за даними газової хроматографії становить 82 %. Приклад 42 Реакція здійснюється, як описано в Прикладі 11. В якості вихідного адамантиларилгаліду використовуються 5,84 г (0,016 М) 3-[2-(2метиладамантил)]-5-бромвератролу. 21 97507 Вихід за даними газової хроматографії становить 77 %. Вищенаведені результати показують, що використання літію хлориду в реакції отримання адамантиларилмагнієвих галідів шляхом дії металічного магнію на адамантиларилгалід в сухому 22 тетрагідрофурані забезпечує стабільний і високий вихід бажаного продукту. Запропонований спосіб для отримання заміщених адамантиларилмагнієвих галідів характеризується стабільним і високим виходом, технологічною здійсненністю і можливістю нарощування об'єму реакційної суміші. Комп’ютерна верстка М. Ломалова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for preparing of substituted adamanty-larylmagnesium halides
Автори англійськоюKalvinsh, Ivars, Chernobrovijs, Aleksandrs, Tribulovich, Vyacheslav, Labeish, Vladimir
Назва патенту російськоюСпособ получения замещенных адамантиларилмагниевых галидов
Автори російськоюКалвиньш Иварс, Чернобровийс Александрс, Трибулович Вячеслав, Лабейш Владимир
МПК / Мітки
МПК: C07F 3/00
Мітки: адамантиларилмагнієвих, заміщених, галідів, отримання, спосіб
Код посилання
<a href="https://ua.patents.su/11-97507-sposib-otrimannya-zamishhenikh-adamantilarilmagniehvikh-galidiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання заміщених адамантиларилмагнієвих галідів</a>
Попередній патент: Інгібітори полі(adp-рибозо)полімерази
Наступний патент: Спосіб отримання 6-[3-(1-адамантил)-4-метоксифеніл]-2-нафтойної кислоти
Випадковий патент: Спосіб видобутку нафти турівненка і.п.