Спосіб отримання фібробластоподібних клітин із пуповинного канатика новонарожденого
Номер патенту: 98681
Опубліковано: 11.06.2012
Автори: Пріходько Алєксандр Вікторовіч, Кошелєва Настасья Владіміровна, Ісаєв Артур Алєксандровіч, Лагарькова Марія Андрєєвна, Сабуріна Іріна Ніколаєвна, Кісєльов Сєргєй Львовіч, Мєліхова Варвара Сєргєєвна
Формула / Реферат
1. Спосіб отримання фібробластоподібних клітин з пуповинного канатика новонародженого, що передбачає підготовку фрагмента пуповинного канатика людини, виділення фібробластоподібних клітин обробкою розчином колагенази типу І і центрифугуванням, який відрізняється тим, що підготовлений фрагмент пуповинного канатика гомогенізують, а обробку гомогенату проводять розчином, що містить колагеназу типу І і колагеназу типу IV при співвідношенні ферментів 1:1 у пропорції гомогенату до розчину ферментів 1:5.
2. Спосіб за п. 1, який відрізняється тим. що в процесі підготовки фрагменту пуповинного канатика виділяють ендотеліальні клітини з вени пуповинного канатика.
Текст
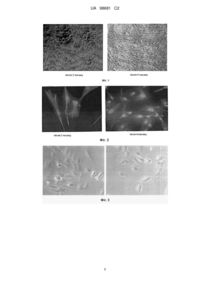
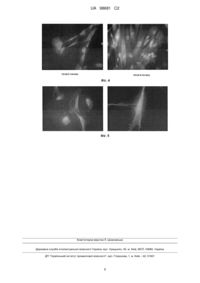
Реферат: Винахід належить до способу отримання фібробластоподібних клітин з пуповинного канатика новонародженого, що включає гомогенізацію фрагмента пуповинного канатика та обробку гомогенату розчином, що містить колагеназу типу І і колагеназу типу IV при співвідношенні ферментів 1:1 у пропорції гомогенату до розчину ферментів 1:5. UA 98681 C2 (12) UA 98681 C2 UA 98681 C2 5 10 15 20 25 30 35 40 45 50 55 Область техніки Винахід відноситься до біотехнології, а саме - до способу отримання фібробластоподібних клітин з пуповинного канатику і їх застосування. Отримані фібробласти можуть знайти широке застосування в медичній практиці. В даний час пуповинний канатик вважається джерелом отримання декількох типів клітин, серед яких ендотеліальні клітини вени пуповинного канатику людини (HUVEC) і фібробласти (FPC). HUVEC представляють собою модель, що широко використовується великою кількістю дослідницьких груп в усьому світі. Для фармакологічних, фармакокінетичних та інших досліджень використовують ендотеліальні клітини, як правило, нульового пасажу (не пасеровані). Попередній рівень техніки Відомий спосіб отримання алогенних фібробластів з пуповини новонародженого після нормальних пологів, для чого готують фрагмент пуповини. Вени пуповини канюлюють з обох сторін і промивають спочатку розчином Хенкса, а потім - 0,1 %-ним розчином колагенази 1 типу, приготованим на середовищі DMEM, і інкубують при 37 °C протягом 30 хв, потім здійснюють механічний вплив на тканини пуповини, збирають клітини, що відокремилися, промиваючи їх розчином Хенкса. Отриману після механічного впливу і промивання суспензію клітин центрифугують при 1000 об/хв протягом 5 хв. отримуючи осад клітин, який ресуспензують в ростовому середовищі DMEM, що містить 10 % фетальної сироватки великої рогатої худоби. 100 од./мл пеніциліну, 100 од./мл стрептоміцину, 2 мМ глютаміну, 1 мМ пірувату натрію, 10 нг/мл основного фактору росту фібробластів bFGF. Ресуспензований осад клітин в ростовому середовищі DMEM переносять в культуральні чашки і культивують до формування моношару. змінюючи ростове середовище DMEM 2 рази на тиждень, і при досягненні моношару клітини - пересівають у співвідношенні 1:3. Даний спосіб описаний в RU 2308957, 27.10.2007 і прийнятий нами в якості найближчого аналогу. До недоліків способу слід віднести: по-перше, низький вихід отриманих фібробластів, по-друге, вдається отримати тільки фібробласти вени пуповинного канатику, що є обмеженням на їх подальші диференціювальні здібності і застосування. Короткий опис фігур. Фіг. 1 Культура фібробластоподібних клітин А - після 2 пасажу і Б - після 4 пасажу. Фіг. 2 Експресія віментину в клітинах А - після 2 пасажу і Б - після 4 пасажу. Фіг. 3 Первинна культура клітин HUVEC на 7-й день культивування. Фіг. 4 Експресія колагену 1 типу в клітинах А - після 2 пасажу і Б - після 4 пасажу. Фіг. 5 Експресія колагену 4 типу в клітинах після 4 пасажу. Розкриття винаходу Нами була поставлена задача розробити простий метод отримання фібробластоподібних клітин з усієї тканини пуповинного канатика, що дозволяє виділити як фібробласти з вени, так і мезенхімальні, дермальні і стромальні фібробласти. У результаті проведеної роботи було запропоновано спосіб отримання фібробластоподібних клітин з пуповинного канатику новонародженого, сутність якого полягає в поведінці наступних етапів: 1. Підготовки фрагменту пуповинного канатика; 2. Гомогенізації підготовленого фрагменту; 3. Обробці гомогенату розчином, що містить ферменти: колагеназу типу І і колагеназу типу IV, при співвідношенні ферментів 1:1, у пропорції гомогенату до розчину ферментів 1:5; 4. Фільтрування та центрифугування фільтрату з отриманням осаду фібробластоподібних клітин. Запропонований нами спосіб отримання фібробластоподібних клітин дозволяє не тільки підвищити вихід фібробластів, тим самим забезпечити ефективне використання дорогої сировини - пуповинного канатику, але й отримати широкий спектр ембріональних фібробластоподібних клітин, таких як мезенхімальні, стромальні і дермальні фібробласти. Широкий спектр виділених клітин дозволяє надалі проводити їх диференціювання в клітини мезенхімального ряду, такі як, наприклад, кардіоміоцити. Стромальні фібробласти можуть диференціюватися в подальшому під впливом доданих факторів в клітини хряща, м'язів, кістки та інші, такі як нейрональні або інсулін-продукуючі. Ембріональні дермальні фібробластоподібні клітини можуть диференціюватися в кератиноцити і фібробласти шкіри. Таким чином, запропонований спосіб і отримані клітини можуть бути використані для отримання перерахованих вище клітин. 1 UA 98681 C2 5 10 15 20 25 30 35 40 45 50 55 60 Етап підготовки фрагменту пуповинного канатику, як окремий випадок, може передбачати додаткове виділення з вени пуповинного канатику ендотеліальних клітин. При цьому може бути отримано 2 і більше типів клітин з одного зразка. Спосіб здійснюють наступним чином. Пуповинний канатик людини отримують після нормальних пологів у пологових будинках після добровільної інформованої згоди породіллі. Забір біоматеріалу здійснюють з дотриманням всіх правил асептики і антисептики після проведення попереднього обов'язкового аналізу крові на ВІЛ, RW і маркери гепатиту В і С отримання негативних аналізів на інфікованість. Протипоказанням до забору матеріалу є інфікованість по одному з агентів. Вся подальша робота з біоматеріалом ведеться в лабораторії, яка призначена тільки для роботи з людським біоматеріалом. Робота з людським біоматеріалом повинна здійснюється відповідно до рекомендацій "Інструкції з контролю стерильності консервованої крові, її компонентів, препаратів консервованого кісткового мозку, кровозамінників та консервуючих розчинів" - МОЗ № 4-42-4-85 від 17.09.1985 р. Всі роботи з біоматеріалом проводяться в стерильних умовах ламінарного боксу ІІ-го класу біологічного захисту. Підготовка фрагменту пуповинного канатику зазвичай передбачає наступні процедури. 1. Відмивання його від згустків крові і слизу в розчині Хенкса. 2. Промивання вени пуповинного канатику за допомогою шприца розчином Хенкса з додаванням антибіотика і фунгізона. 3. Розрізання пуповинного канатику на шматки по 2 см довжиною. Кожен з отриманих шматків розрізають повздовж, промивають розчином Хенкса. Виділення фібробластоподібних клітин з пуповинного канатика проводять наступним чином: 1. Гомогенізують підготовлені фрагменти пуповинного канатика. 2. Переносять отриману масу в пробірки, додають суміш робочих розчинів колагенази І і колагенази IV (співвідношення ферментів 1:1) в пропорції 1:5. 3. Ферментують матеріал, періодично перемішуючи вміст пробірок. Тривалість інкубації залежить від концентрації ферментів у розчині і від їх активності. 4. Суспензію після ферментування пропускають через подвійне сито для очищення від залишків неферментованих шматків тканини і надлишку колагену. 5. Переносять отриману після фільтрування суспензію в центрифужні пробірки і центрифугують з отриманням осаду фібробластів. Доцільно при підготовці фрагменту пуповинного канатику виділити ендотеліальні клітини. Для цього можна після відмивання пуповинного канатику і промивання вени додатково провести наступні етапи: 1. Зафіксувати один край пуповини, заповнити вену розчином ферменту (розчин діспази 2,5 мг/мл). Другий кінець також зафіксувати, перевіряючи герметичність вени. 2. Помістити в СО2 інкубатор на 15 хвилин. 3. Масажувати пуповину для поліпшення доступу ферменту до всіх ділянок венозної стінки. 4. Вміст вени промити двічі стерильним розчином Хенкса, а потім - ростовим середовищем. 5. Отриману суспензію клітин піпетувати і потім центрифугувати з отриманням осаду ендотеліальних клітин. Можливість здійснення способу підтверджують наступні приклади його конкретного виконання. Приклад 1. Отримання фібробластоподібних клітин. У стерильних умовах ламінарного боксу перекладають привезений пуповинний канатик (фрагмент 7-10 см) з контейнера у вітчизняну чашку Петрі з розчином Хенкса (фірми ПанЕко або аналогічний) з додаванням антибіотика і фунгізона. Відмивають матеріал від згустків крові і слизу в розчині Хенкса (фірми ПанЕко або аналогічний), змінюючи розчин три рази. Визначивши розташування вени пуповинного канатика, розширюють її краї стерильним пінцетом і вводять у вену носик шприца об'ємом 2 мл з розчином Хенкса. Двічі промивають вену стерильним розчином Хенкса (фірми ПанЕко або аналогічний) з додаванням антибіотика і фунгізона. Розрізають пупковий канатик на шматки по 2 см довжиною. Кожен з отриманих шматків розрізають повздовж, промивають розчином Хенкса і подрібнюють гомогенізатором до однорідної маси. Переносять отриману масу в 2 центрифужні пробірки по 15 мл (або 1 центрифужну пробірку по 50 мл) і додають суміш 0,075 % робочих розчинів колагенази І і колагенази IV (1:1) в пропорції 1:5. Для отримання робочих розчинів ферменти розводять в рідкому ростовому середовищі DMEM без сироватки і глутаміну (фірми ПанЕко або 2 UA 98681 C2 5 10 15 20 25 30 35 40 45 50 55 60 аналогічний). Ферментують матеріал протягом 8-10 годин при 37 С, періодично перемішуючи вміст пробірок. Ступінь повноти обробки ферментами визначають по зміні в'язкості суспензії, інкубування необхідно припинити після значного збільшення в'язкості. Момент різкого зростання в'язкості суспензії визначають візуально. Суспензію після ферментування пропускають через подвійне сито для очищення від залишків неферментованих шматків тканини і надлишку колагену. Промивають пробірку і сито розчином Хенкса (фірми ПанЕко або аналогічний). Переносять отриману після фільтрування суспензію в нові 15 мл центрифужні пробірки (або 50 мл центрифужну пробірку) і центрифугують 8 хвилин, 1000 об/хв, g=90. У результаті отримують осад фібробластоподібних клітин. Приклад 2. Послідовне отримання ендотеліальних і фібробластоподібних клітин. Проводять етапи як описано в прикладі 1. Додатково після промивання вени пупкового канатика фіксують один край пуповини корнцангом. Обережно беруть зразок, заповнюють вену розчином ферменту (розчин діспази - 2,5 мг/мл). Для отримання розчину фермент розводять ростовим середовищем без сироватки та глутаміну. Другий кінець також фіксують, перевіряючи герметичність вени. Поміщають зразок у вітчизняну чашку Петрі і переносять в СО 2 інкубатор на 15 хвилин. Кожні 5 хвилин пуповину масажують для поліпшення доступу ферменту до всіх ділянок венозної стінки. Через 15 хвилин зразок переносять в ламінар, знімають корцанги, а вміст вени промивають двічі стерильним розчином Хенкса (фірми ПанЕко або аналогічний), а потім - ростовим середовищем. Отриману суспензію клітин піпетують і потім центрифугують протягом 5 хв при 1000 об/хв. Отримують осад ендотеліальних клітин. Фрагмент пуповинного канатика, що залишився після виділення ендотеліальних клітин, перекладають у нову стерильну чашку Петрі з розчином Хенкса (фірми ПанЕко або аналогічний) з додаванням антибіотика і фунгізона. Відмивають у розчині Хенкса, змінюючи розчин два рази. Розрізають пуповинний канатик на шматки по 2 см довжиною. Далі проводять виділення фібробластів, як описано в прикладі 1. Слід зазначити, що тривалість обробки ферментами залежить від концентрації ферментів у розчині, від активності ферментних препаратів різних виробників і ряду інших чинників. Примітним є те, що обробку припиняють у момент, коли візуально визначається різке зростання в'язкості суспензії. Приклад 3. Культивування фібробластів та ендотеліальних клітин. Осад клітин, отриманий після центрифугування, ресуспендують в ростовому середовищі, підраховують кількість виділених клітин за допомогою камери Горяєва. Поміщають отримані суспензії в чашки Петрі Greiner або Corning. Для культивування фібробластоподібних клітин, виділених з пуповинного канатика, може бути використане будь-яке придатне для цього ростове середовище, наприклад, наступного складу: рідке середовище DMEM/F12 1:1 (фірми ПанЕко або, аналогічне), сироватка Fetal Clone 1-10 % (фірма Hyclone або аналогічна), 1Х ITS (фірма Hyclone або аналогічна), bFGF 1 нг/мл (фірми Chemicon або аналогічний), гепарин 5U/мл (фірми ПанЕко або аналогічний), гентаміцин 50 мг/мл (фірми ПанЕко або аналогічний). Всі компоненти вносять з розрахунку на 1 л середовища DMEM/F12. Для культивування ендотеліальних клітин, виділених з вени пуповинного канатика, може бути використане будь-яке придатне для цього ростове середовище, наприклад, наступного складу: Середовище 199 з солями Ерла (фірми ПанЕко або аналогічне), сироватка Fetal Clone 1-20 % (фірма Hyclone або аналогічна), антибіотик-1 % (фірми ПанЕко або аналогічний), епідермальний фактор росту - 2,5 нг/мл (фірми Chemicon або аналогічний), розчин HEPES (фірми ПанЕко або аналогічний), 7 % розчин NaHCO3 (фірми ПанЕко або аналогічний). 3 2 Ендотеліальні клітини висівають у щільності 5*10 клітин/см , а фібробластоподібні клітини 2 у щільності 10 тис клітин/см . Культивують клітини в стандартних умовах: при 37 °C та 5 % СО2 зі зміною середовища кожні 2-3 дні. Культури пасерують при досягненні клітинами 70-80 % конфлюентності. Перед пасируванням зливають середовище, 3 рази промивають чашку розчином Версена (фірми ПанЕко або аналогічним). На 4-7 хвилин заливають вміст чашки 0,25 % розчином трипсину. Отриману суспензію клітин, рівномірно перемішавши, розподіляють на нові чашки Петрі Greiner або Corning в щільності 8-15 тис клітин/см2. Перше пасирування проводять через 12-14 днів після посадки. Надалі подвоєння кількості фібробластоподібних клітин відбувається кожні 48-72 години. Відповідно, починаючи з другого пасажу, між пасажами проходить 2-3 діб. Фібробластоподібні клітини в культурі ростуть тільки в прикріпленому до поверхні культурального посуду (чашки Петрі або культуральні флакони) стані. На всіх строках культивування зберігають диплоїдний каріотип і високу проліферативну активність протягом 4-6 пасажів (фіг. 1). 3 UA 98681 C2 5 10 15 20 25 30 35 40 Культивовані фібробластоподібні клітини, отримані з пуповинного канатика людини, експресують віментин, колаген 1 і 4 типу (Фіг. 2, 4, 5), альфа актин і ін. (хондроітину сульфат, еластин, фібронектин, кератин 18, кератин 19, гепарину сульфат), не експресують CD45, CD11b, CD14, мають низьку експресію антигенів гістосумісності. Як правило, використовують ендотеліальні клітини вени пуповинного канатику нульового пасажу (не пасеровані). Ендотеліальні клітини характеризуються ростом в культурі тільки в прикріпленому до поверхні культурального посуду (чашки Петрі або культуральні флакони) стані і мають характерний для ендотеліоцитів фенотип фіг. 3). Приклад 4. Кріоконсервація фібробластів. Після досягнення культурою фібробластоподібних клітин четвертого пасажу, клітини заморожують у кріопробірках по 10 мільйонів. Щоб повністю виключити ризик можливого інфікування бактеріальними та вірусними агентами перед кріоконсервацією, частина клітин піддається ретельному бактеріологічному і вірусологічному контролю (вихідний інфекційний контроль), решту - заморожують. Тестування проводиться на: - Стерильність клітин щодо бактерій; - Стерильність клітин щодо мікроскопічних грибів; - Наявність у клітинах ДНК вірусу гепатиту В; - Наявність у клітинах РНК вірусу гепатиту С; - Наявність у клітинах провірусної ДНК вірусу імунодефіциту людини 1-го типу; - Наявність у клітинах провірусної ДНК вірусу імунодефіциту людини 2-го типу; - Наявність у клітинах ДНК вірусу простого герпесу 1-го типу; - Наявність у клітинах ДНК вірусу простого герпесу 2-го типу; - Наявність у клітинах ДНК цитомегаловірусу; - Наявність у клітинах ДНК токсоплазми; - Наявність у клітинах ДНК мікоплазми. Для заморожування з чашок Петрі з конфлюентною моношаровою культурою відбирають конденсоване середовище. Культуру клітин три рази відмивають розчином Версена і тріпсинізують при 37 °C, 5 % СО2 10 хвилин. Отриману в результаті суспензію гомогенізують і здійснюють підрахунок клітин за допомогою камери Горяєва. Гомогенат центрифугують протягом 10 хв при 1000 об/хв. Надосадову рідину видаляють, клітини ресуспендують в середовищі для заморожування (сироватка пуповинної крові людини Феталклон 1+7 % диметилсульфоксиду) в концентрації 10 млн клітин в 1 мл середовища для, заморожування. Клітинну суспензію переносять у 2 мл кріопробірки за допомогою 5 мл піпетки. Кріопробірки маркують згідно з установленим зразком. Клітинний матеріал піддається програмному заморожуванню в спеціальній установці до -80С і переноситься потім на зберігання в Дюари з рідким азотом у кріосховище. З 7-10 см пуповини можна на 4-му пасажі отримати до 200 млн фібробластоподібних клітин. Отримання і кріоконсервування 200 млн фібробластоподібних клітин можна здійснити приблизно через 25-30 днів після надходження матеріалу до лабораторії. ФОРМУЛА ВИНАХОДУ 45 50 1. Спосіб отримання фібробластоподібних клітин з пуповинного канатика новонародженого, що передбачає підготовку фрагмента пуповинного канатика людини, виділення фібробластоподібних клітин обробкою розчином колагенази типу І і центрифугуванням, який відрізняється тим, що підготовлений фрагмент пуповинного канатика гомогенізують, а обробку гомогенату проводять розчином, що містить колагеназу типу І і колагеназу типу IV при співвідношенні ферментів 1:1 у пропорції гомогенату до розчину ферментів 1:5. 2. Спосіб за п. 1, який відрізняється тим, що в процесі підготовки фрагменту пуповинного канатика виділяють ендотеліальні клітини з вени пуповинного канатика. 4 UA 98681 C2 5 UA 98681 C2 Комп’ютерна верстка Л. Ціхановська Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for production of fibroblast-like cells from neonatal cord
Автори англійськоюPrikhodko Alieksandr Viktorovich, Isaiev Artur Alieksandrovich, Kisieliov Siergey Lvovich, Laharkova Maria Andrieievna, Koshelieva Nastasia Vladimirovna, Saburina Irina Nikolaievna, Mielikhova Varvara Siergeievna
Назва патенту російськоюСпособ получения фибробластоподобных клеток из пуповинного канатика новорожденного
Автори російськоюПриходько Александр Викторович, Исаев Артур Александрович, Киселев Сергей Львович, Лагарькова Мария Андреевна, Кошелева Настасья Владимировна, Сабурина Ирина Николаевна, Мелихова Варвара Сергеевна
МПК / Мітки
МПК: C12N 5/071
Мітки: пуповинного, канатика, фібробластоподібних, отримання, клітин, спосіб, новонарожденого
Код посилання
<a href="https://ua.patents.su/8-98681-sposib-otrimannya-fibroblastopodibnikh-klitin-iz-pupovinnogo-kanatika-novonarozhdenogo.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання фібробластоподібних клітин із пуповинного канатика новонарожденого</a>
Попередній патент: Комбінована сонячна енергоустановка
Наступний патент: Спосіб приготування білково-вітамінного корму
Випадковий патент: Сіль 3-метиламіносульфолану та п-толоксиоцтової кислоти, що має властивості регулятора росту рослин