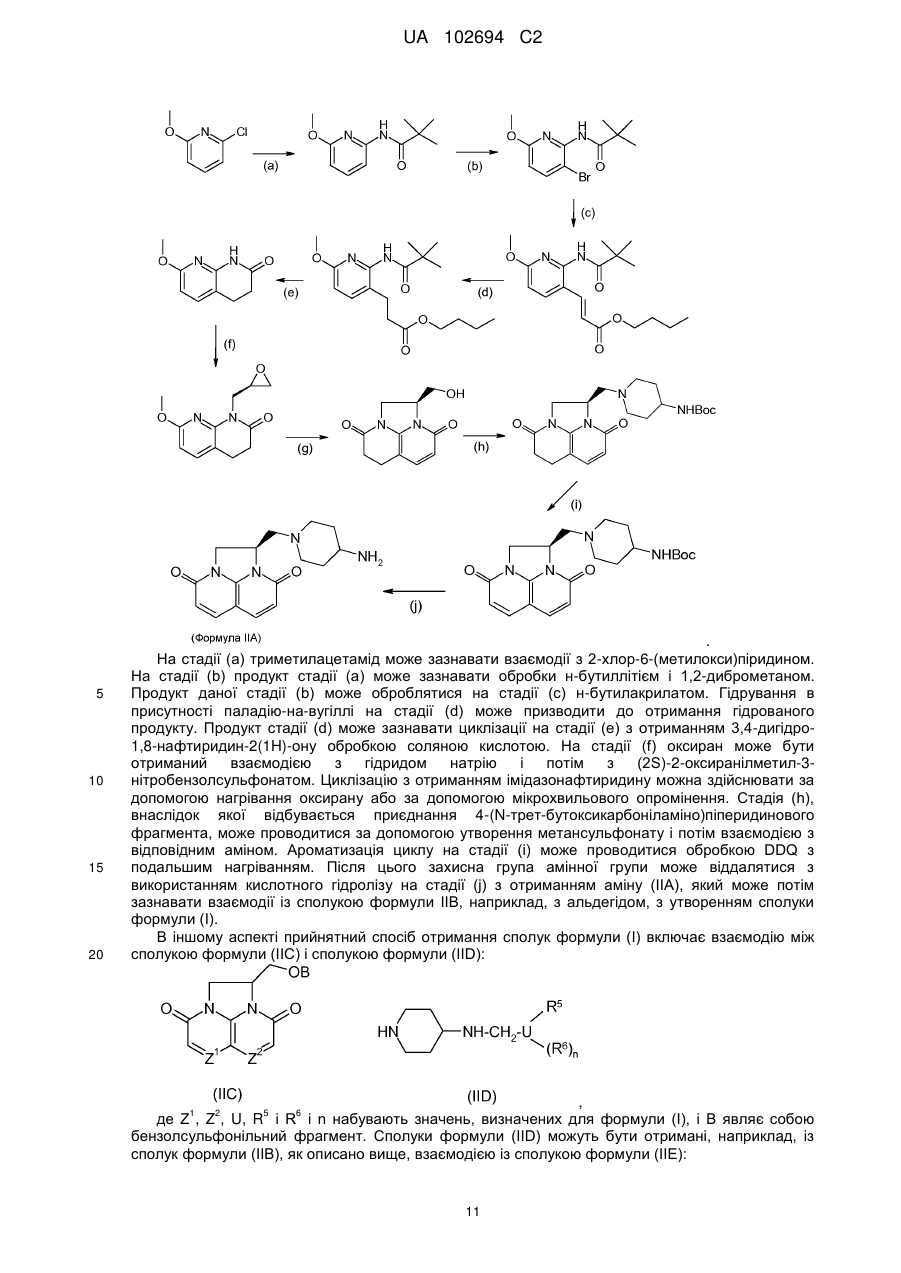
Трициклічні азотвмісні сполуки і їх застосування як бактерицидних засобів
Номер патенту: 102694
Опубліковано: 12.08.2013
Автори: Ремуінан-Бланко Модесто Хесус, Фіандор Роман Хосе Марія, Баррос-Агірре Давід, Алемпарте-Галлардо Карлос, Пірсон Нейл Девід, Качо-Іскердо Моніка, Хеннессі Алан Джозеф, Барфут Крістофер
Формула / Реферат
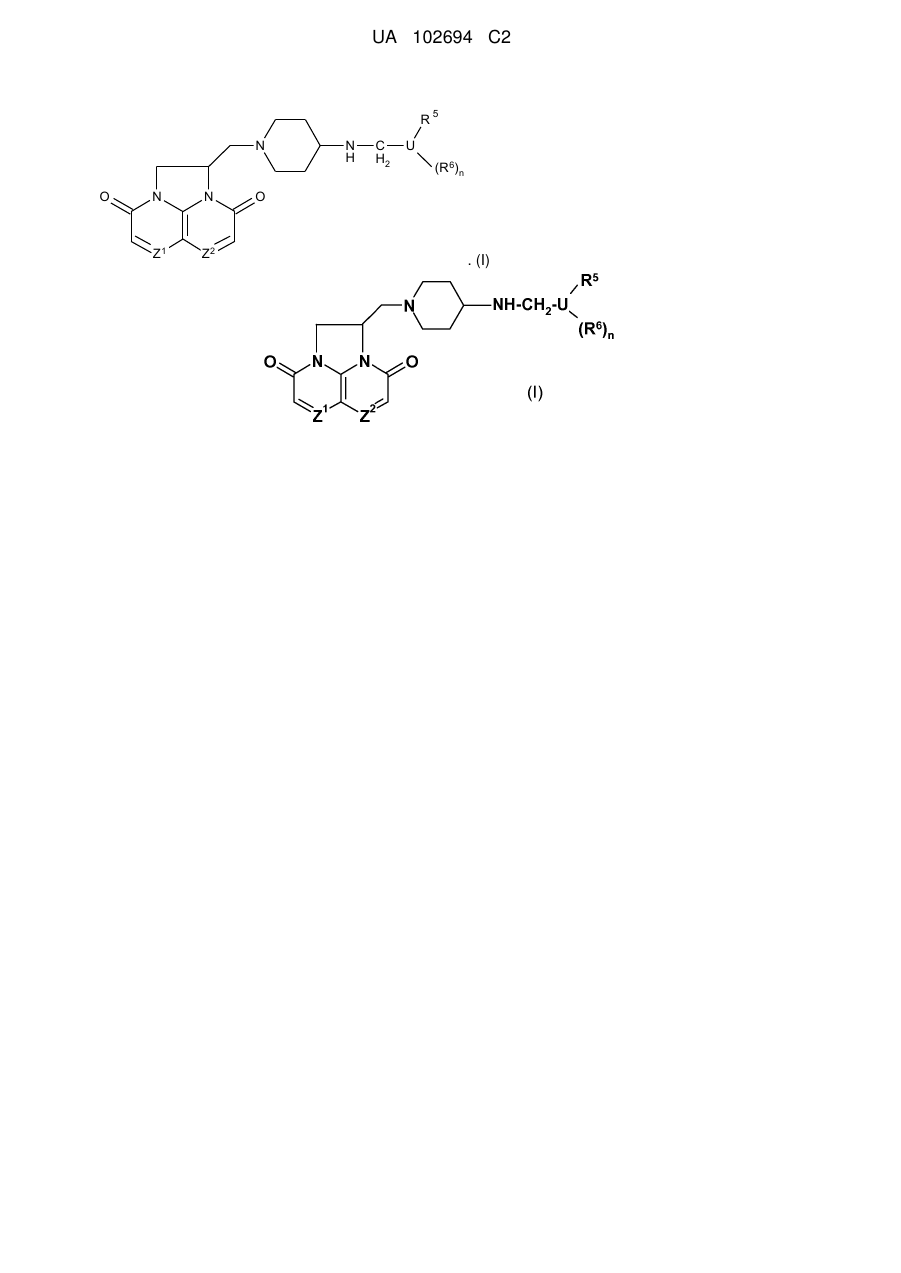
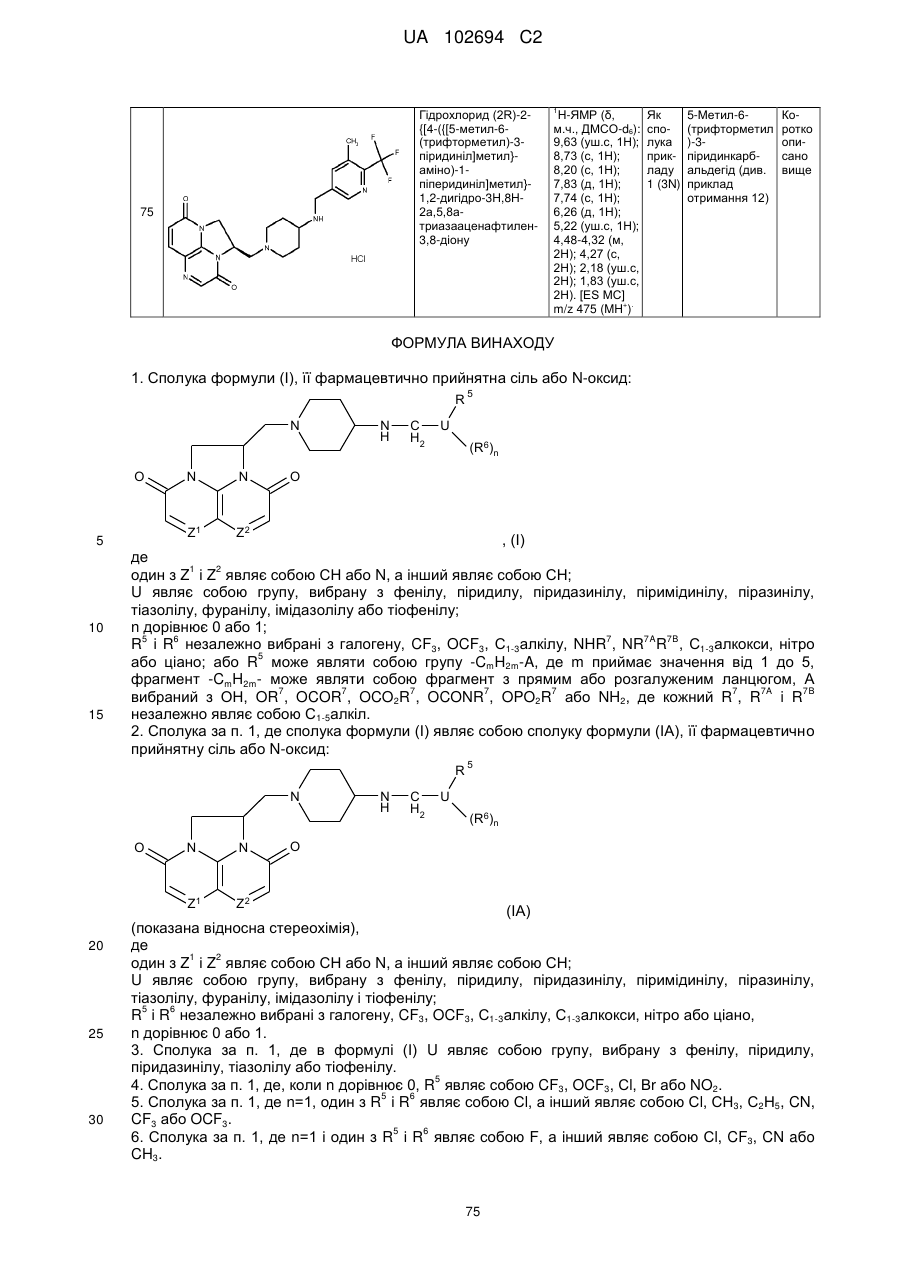
1. Сполука формули (І), її фармацевтично прийнятна сіль або N-оксид:
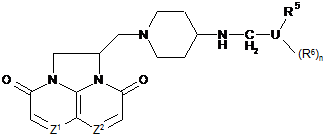 , (І)
, (І)
де
один з Z1 і Z2 являє собою СН або N, а інший являє собою СН;
U являє собою групу, вибрану з фенілу, піридилу, піридазинілу, піримідинілу, піразинілу, тіазолілу, фуранілу, імідазолілу або тіофенілу;
n дорівнює 0 або 1;
R5 і R6 незалежно вибрані з галогену, CF3, OCF3, С1-3алкілу, NHR7, NR7AR7B, С1‑3алкокси, нітро або ціано; або R5 може являти собою групу -CmH2m-A, де m приймає значення від 1 до 5, фрагмент -CmH2m- може являти собою фрагмент з прямим або розгалуженим ланцюгом, А вибраний з ОН, OR7, OCOR7, OCO2R7, OCONR7, OPO2R7 або NH2, де кожний R7, R7A i R7B незалежно являє собою С1-5алкіл.
2. Сполука за п. 1, де сполука формули (І) являє собою сполуку формули (ІА), її фармацевтично прийнятну сіль або N-оксид:
 (ІА)
(ІА)
(показана відносна стереохімія),
де
один з Z1 і Z2 являє собою СН або N, а інший являє собою СН;
U являє собою групу, вибрану з фенілу, піридилу, піридазинілу, піримідинілу, піразинілу, тіазолілу, фуранілу, імідазолілу і тіофенілу;
R5 і R6 незалежно вибрані з галогену, CF3, OCF3, С1-3алкілу, С1-3алкокси, нітро або ціано,
n дорівнює 0 або 1.
3. Сполука за п. 1, де в формулі (І) U являє собою групу, вибрану з фенілу, піридилу, піридазинілу, тіазолілу або тіофенілу.
4. Сполука за п. 1, де, коли n дорівнює 0, R5 являє собою CF3, OCF3, Сl, Вr або NO2.
5. Сполука за п. 1, де n=1, один з R5 і R6 являє собою Сl, а інший являє собою Сl, СН3, С2Н5, CN, CF3 або OCF3.
6. Сполука за п. 1, де n=1 і один з R5 і R6 являє собою F, а інший являє собою Сl, CF3, CN aбo CH3.
7. Сполука за п. 1, де n=1 і один з R5 і R6 являє собою СН3, а інший являє собою Br, CH3, CF3, CN або NO2.
8. Сполука за п. 1, де R5 являє собою -СН2-ОН, n дорівнює 1, R6 являє собою Сl.
9. Сполука за п. 1, де U вибраний з групи, що включає феніл, піридил і піридазиніл, n дорівнює 0, R5 знаходиться в пара-положенні U відносно зв'язку між U і групою СН2, до якої він приєднаний.
10. Сполука за п. 1, де U вибраний з групи, що включає феніл і піридил, n дорівнює 1, один з R5 і R6 знаходиться в пара-положенні, а інший знаходиться в мета-положенні U відносно зв'язку між U і групою СН2, до якої він приєднаний.
11. Сполука за п. 1, де абсолютна стереохімія сполуки формули (І) представлена формулою (IB):
 . (IB)
. (IB)
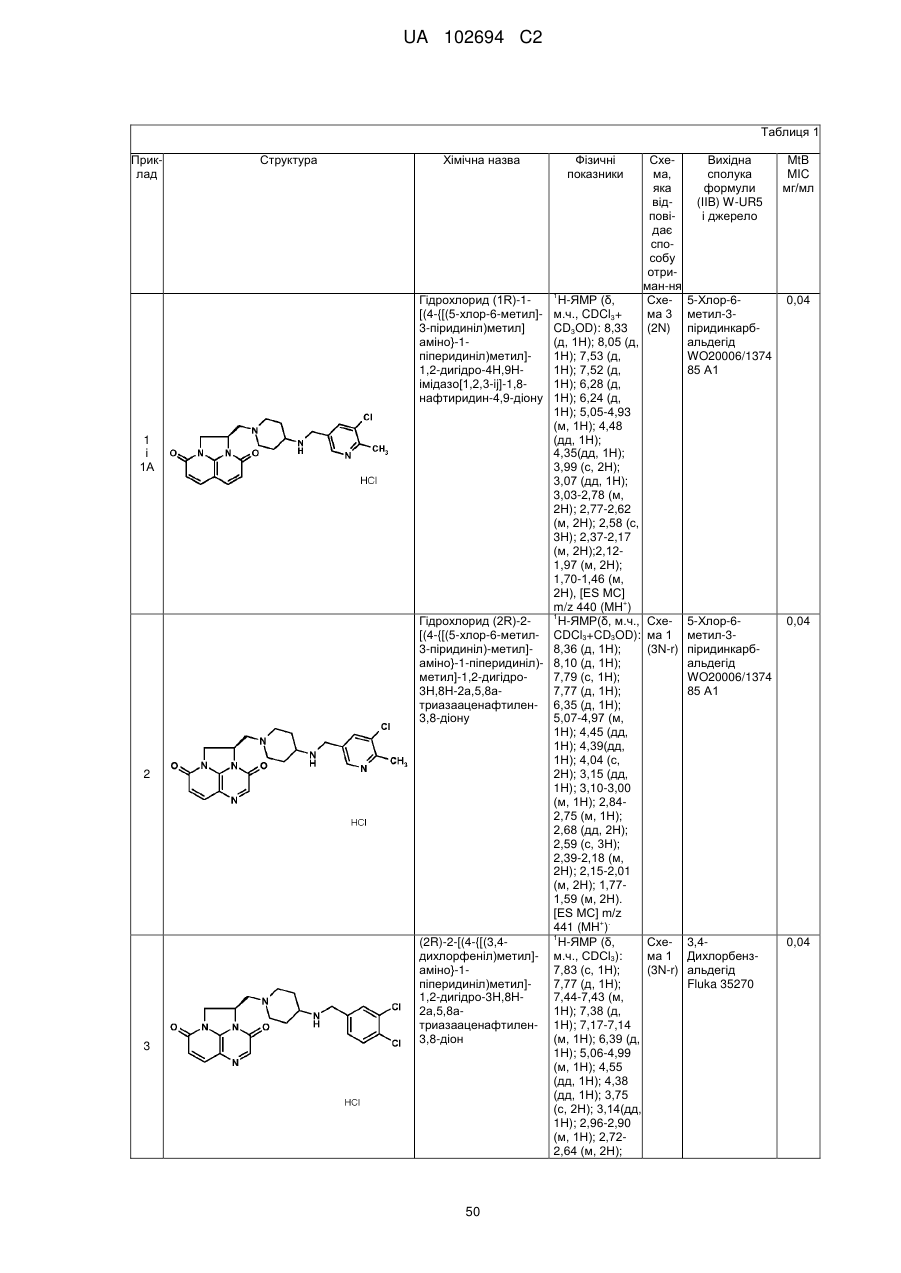
12. Сполука, яка вибрана з групи, що складається з наступних сполук:
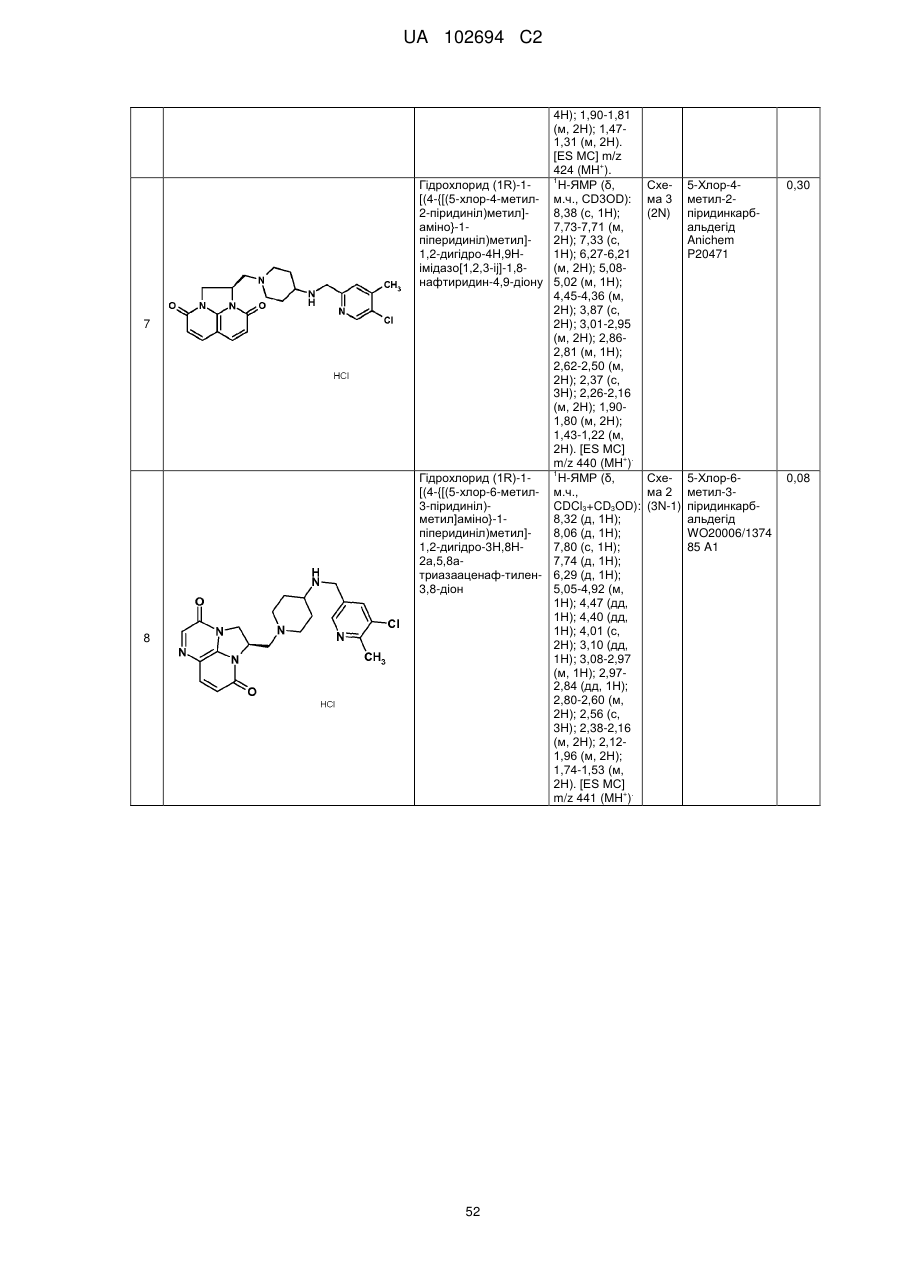
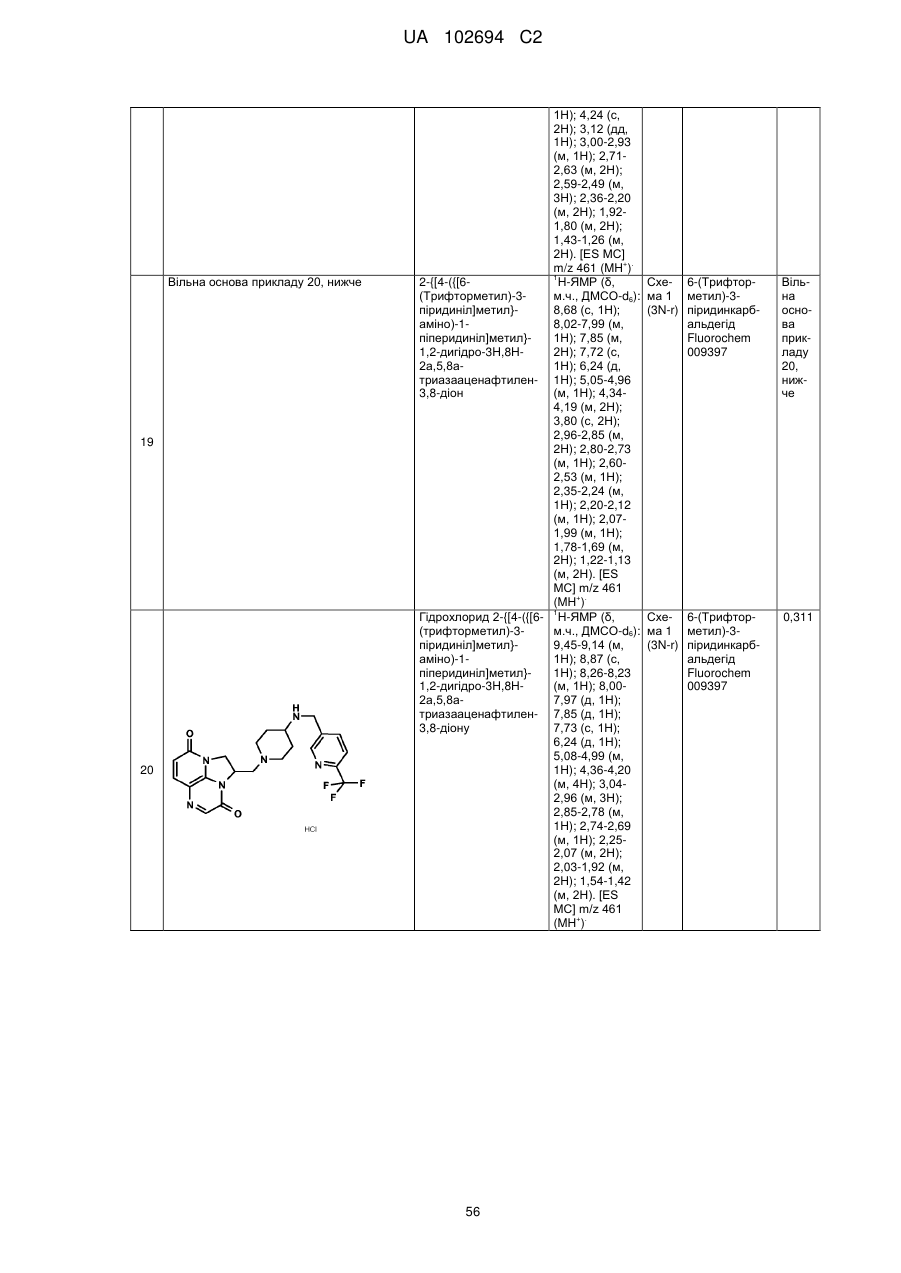
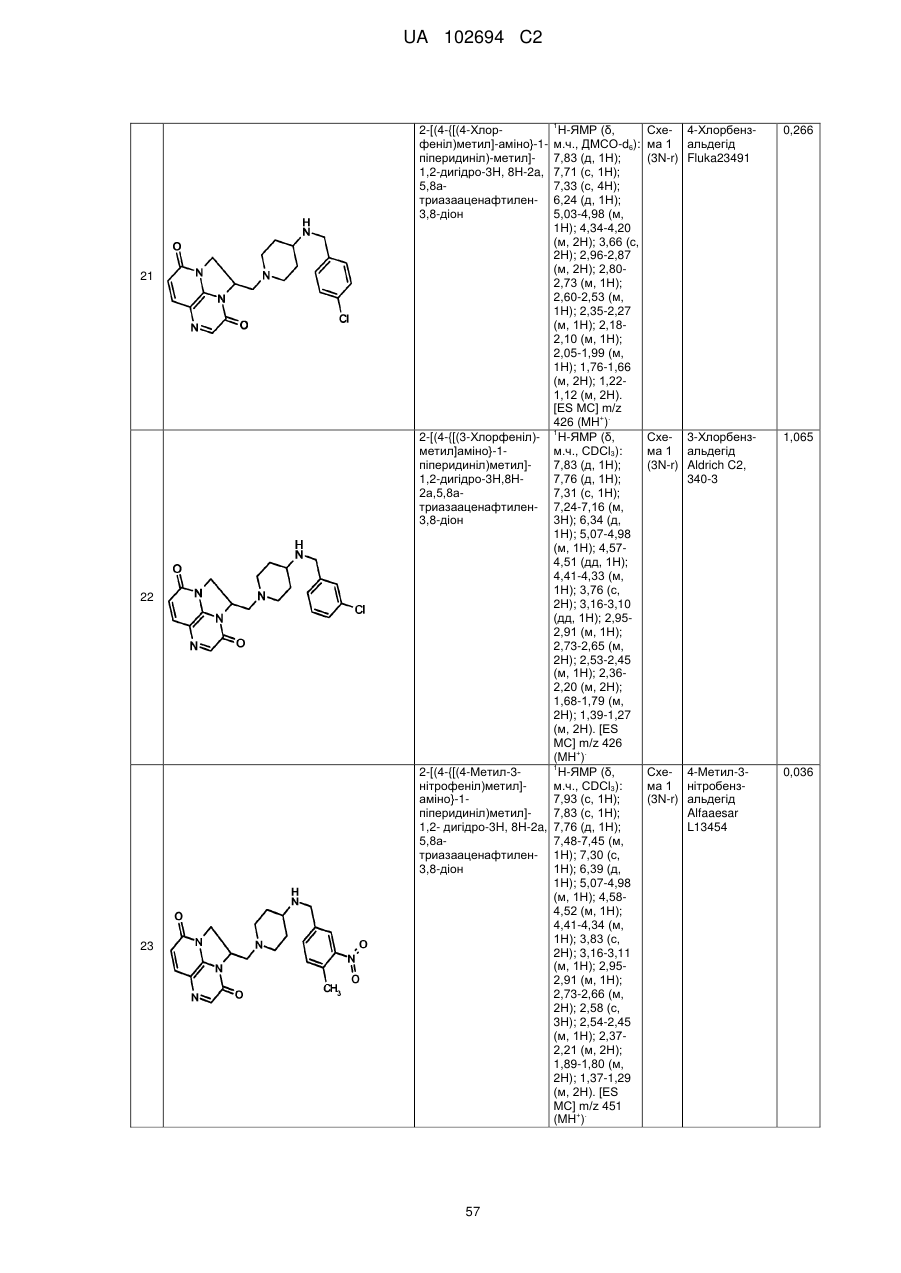
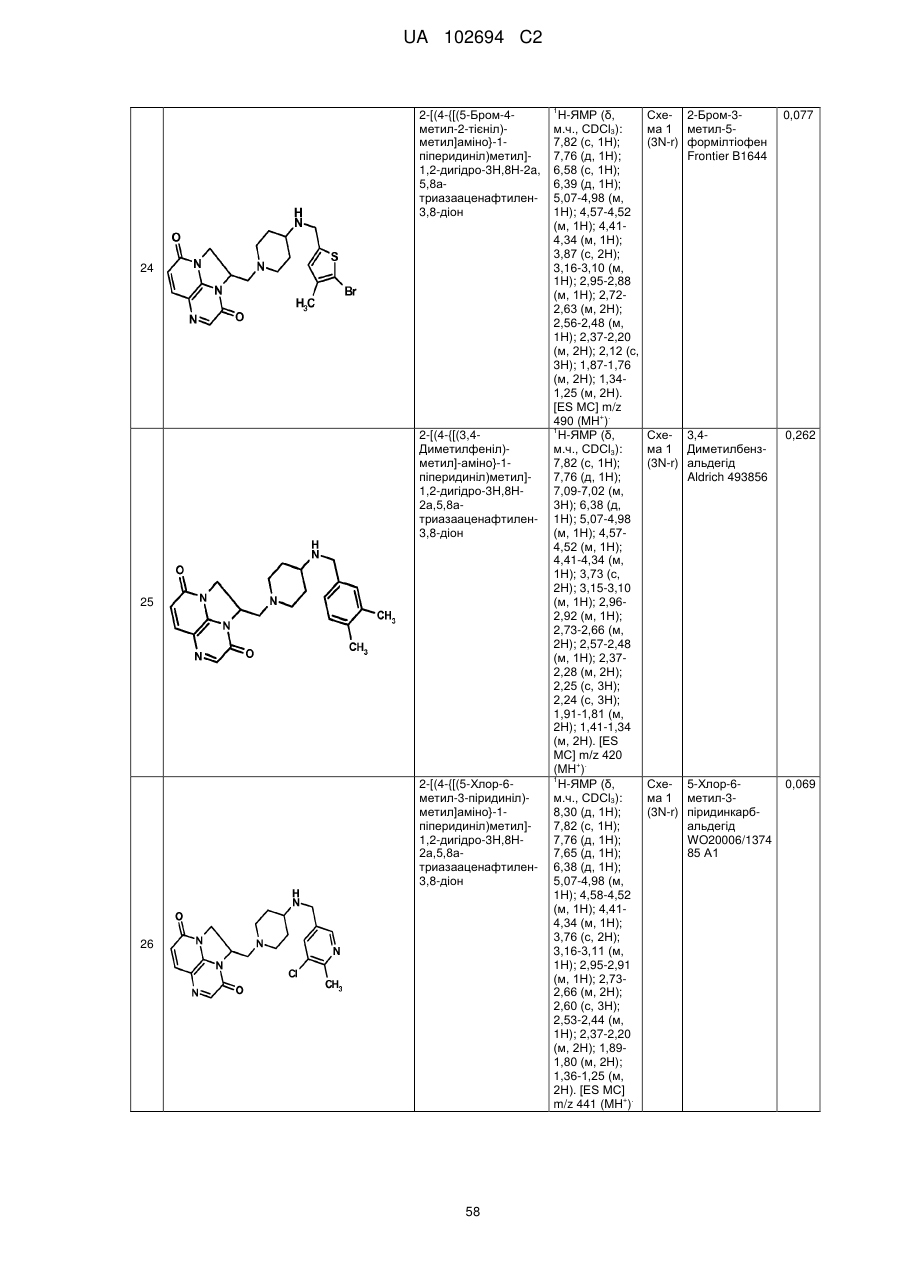
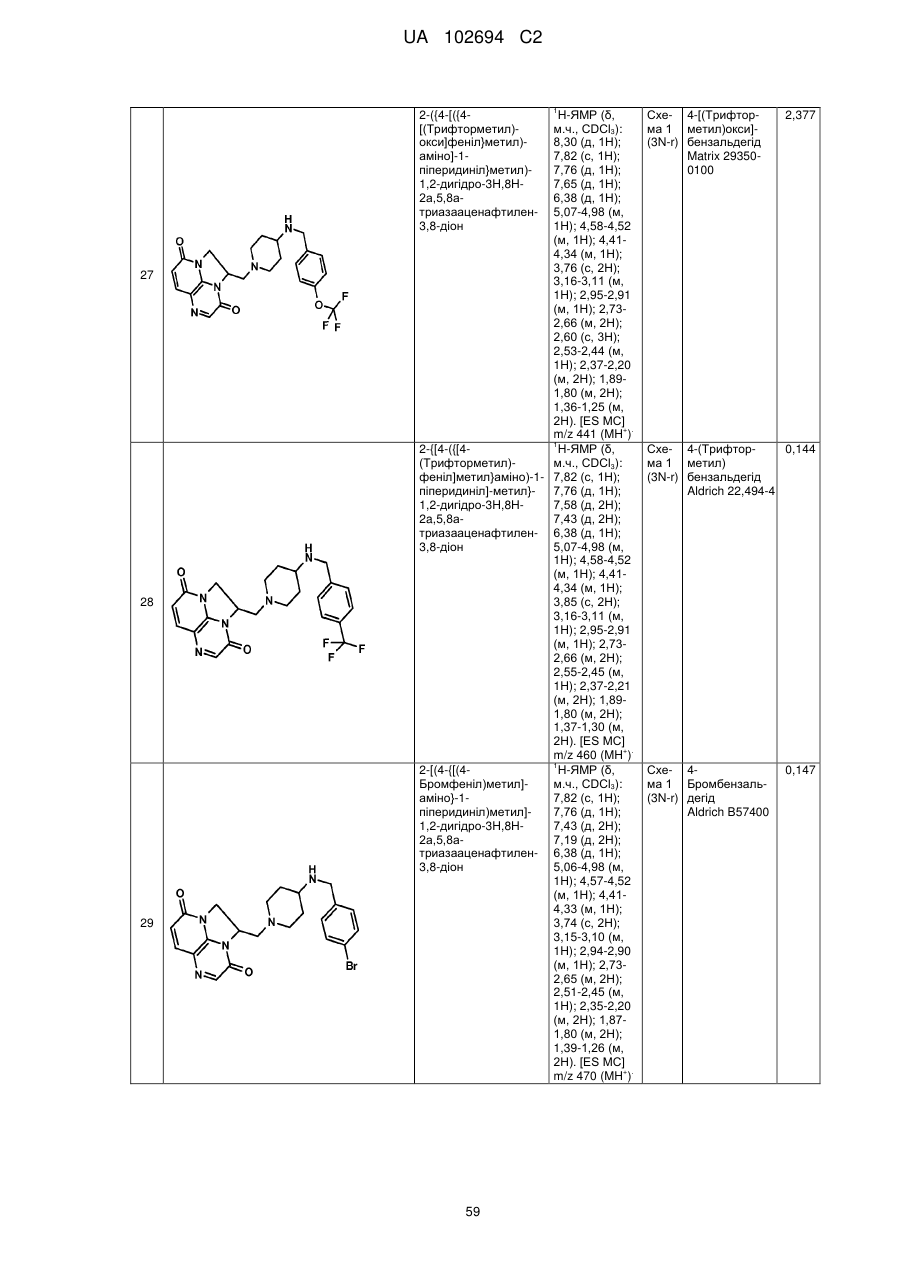
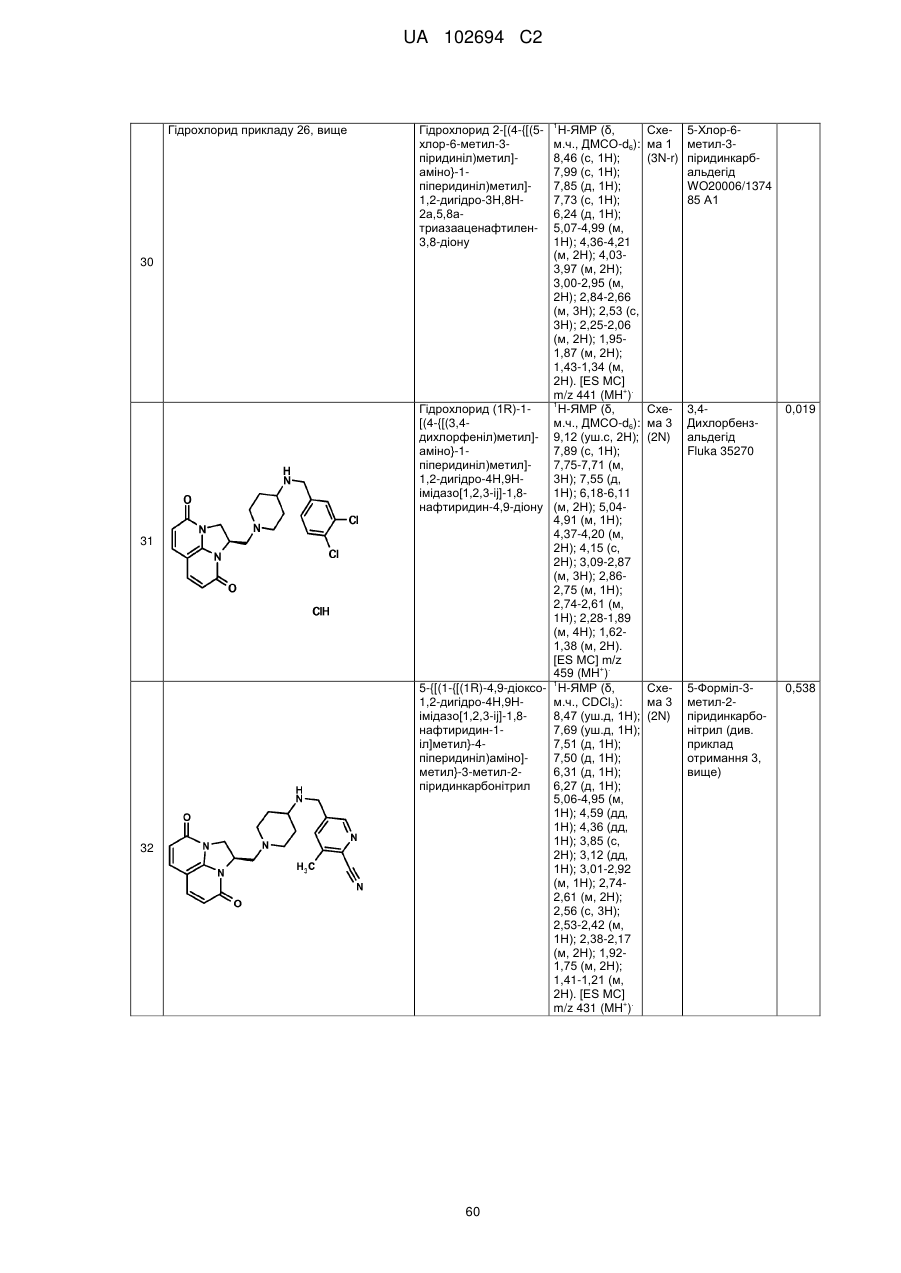
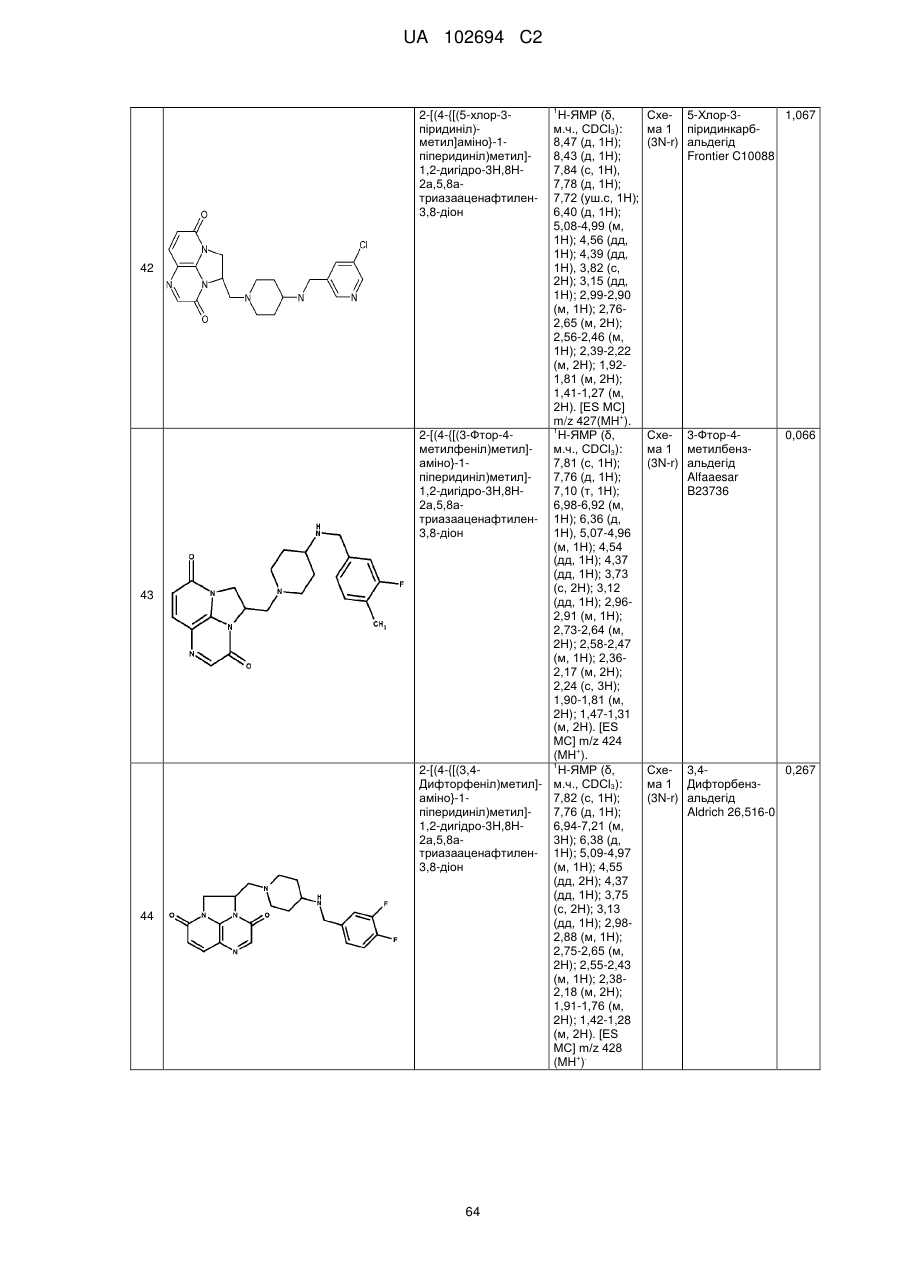
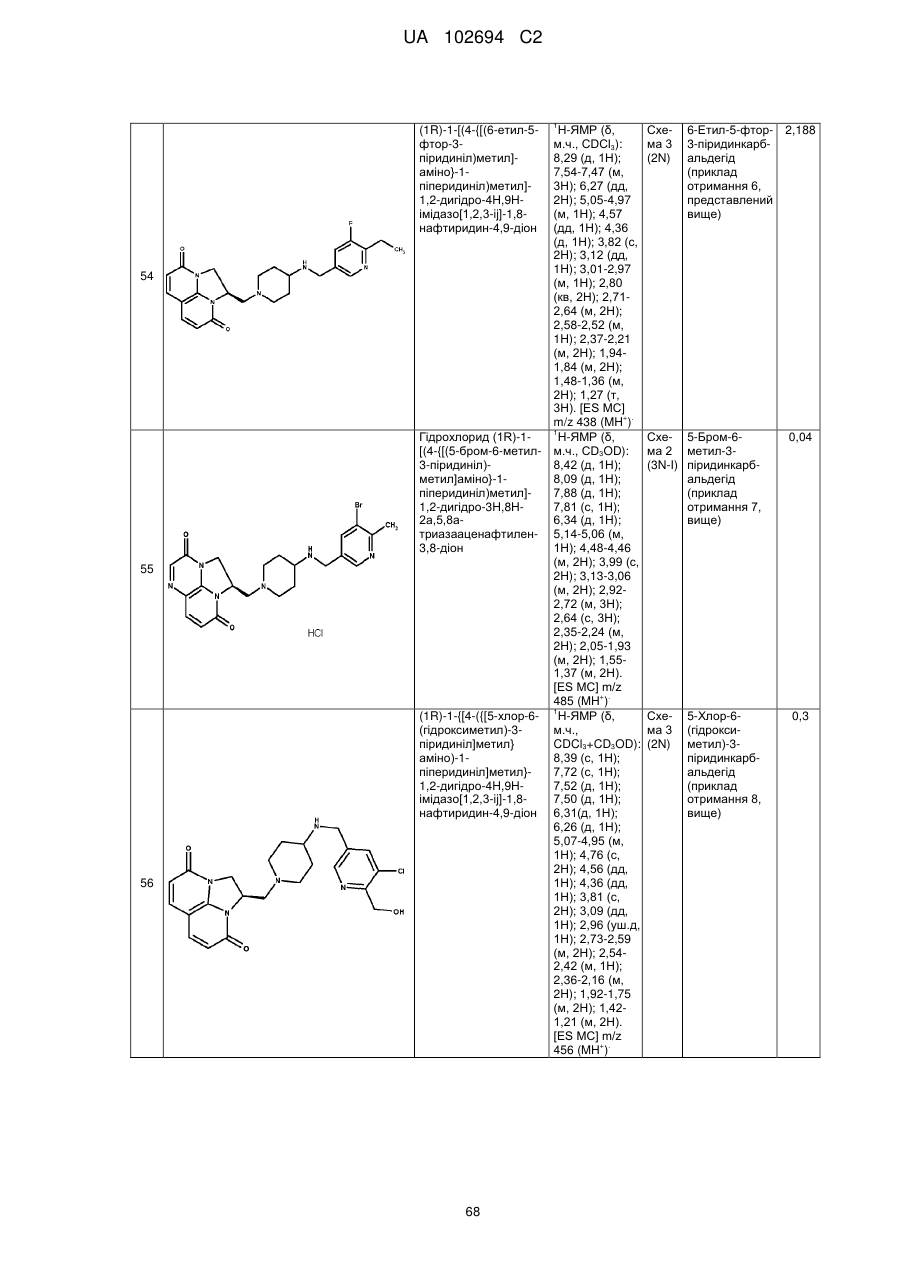
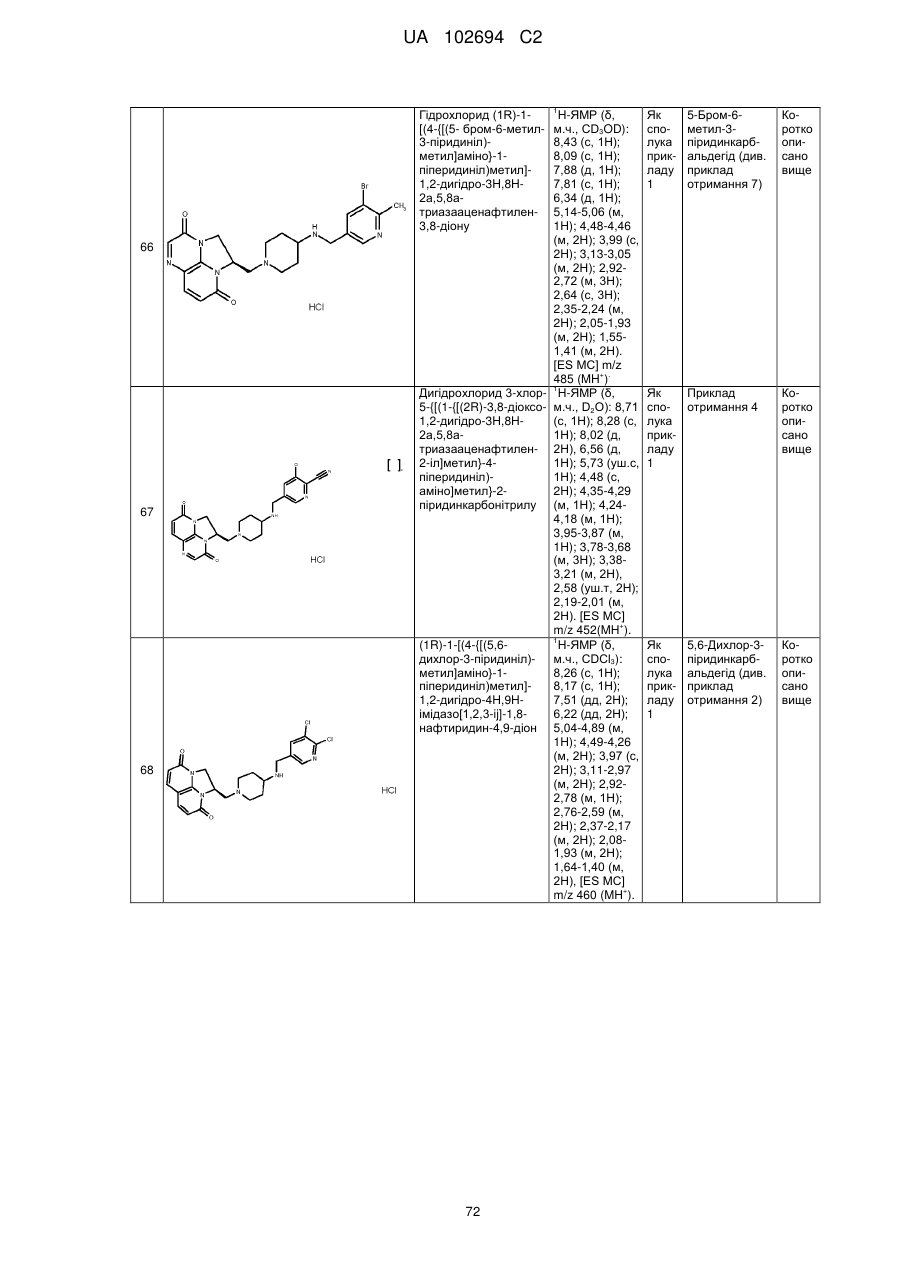
(1R)-1-[(4-{[(5-хлор-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону;
(2R)-2-[(4-{[(5-хлор-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
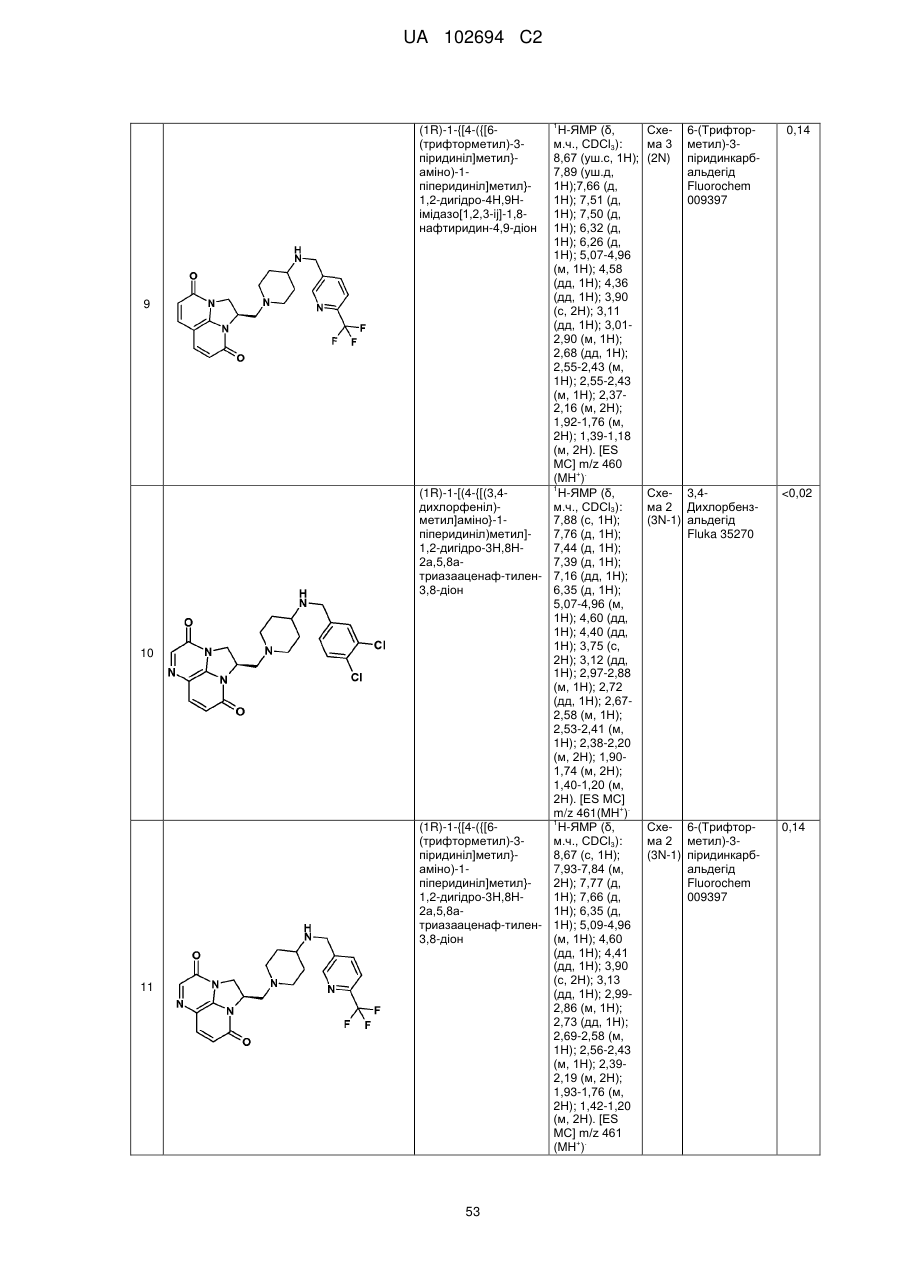
(1R)-1-{[4-({[6-(трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону;
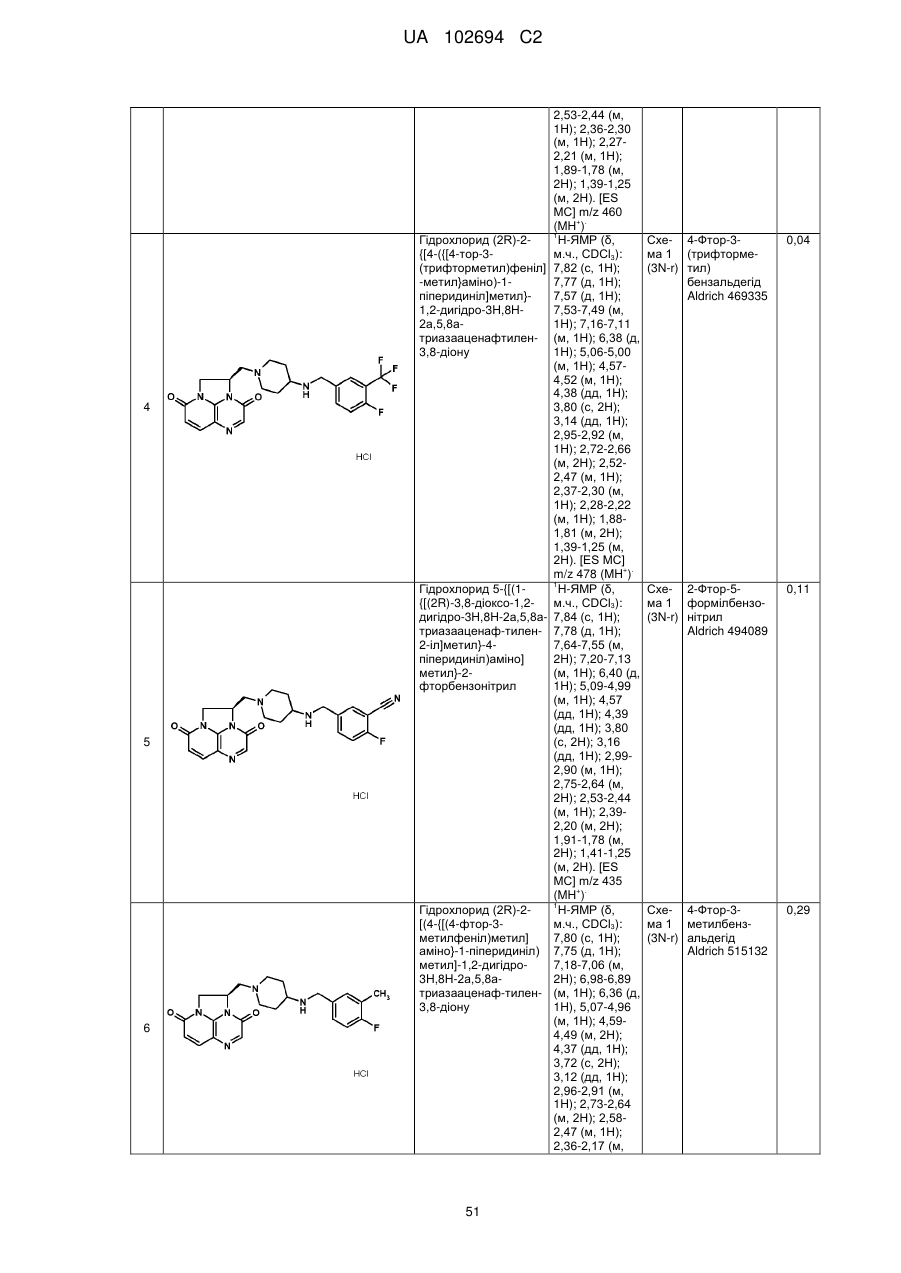
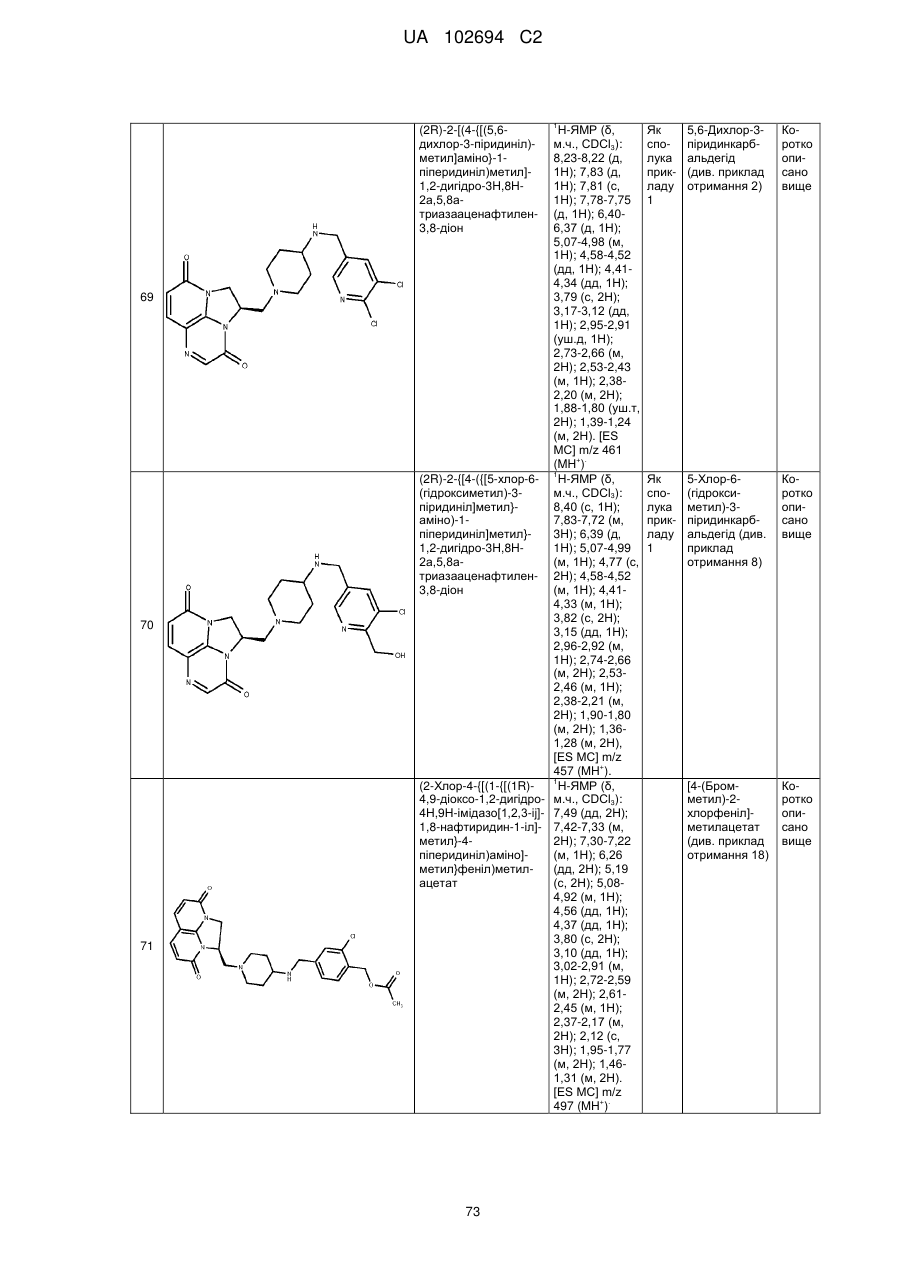
(2R)-2-[(4-{[(3,4-дихлорфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
(2R)-2-{[4-({[4-фтор-3-(трифторметил)феніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
5-{[(1-{[(2R)-3,8-діоксо-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-2-іл]метил}-4-піперидиніл)аміно]метил}-2-фторбензонітрилу;
(2R)-2-[(4-{[(4-фтор-3-метилфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
(1R)-1-[(4-{[(5-хлор-4-метил-2-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону;
(1R)-1-[(4-{[(5-хлор-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
(1R)-1-{[4-({[6-(трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
(1R)-1-{[4-({[6-(трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
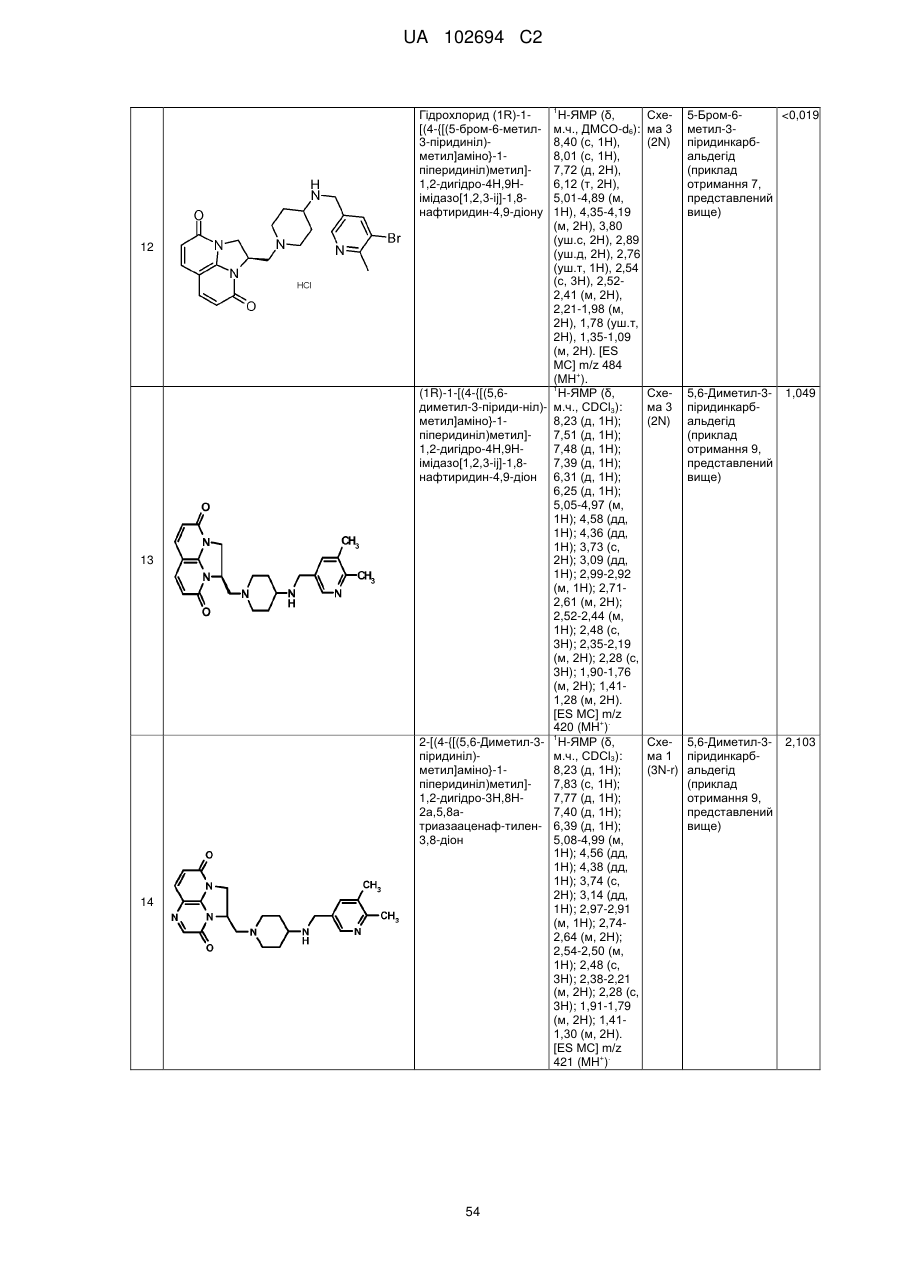
(1R)-1-[(4-{[(5-бром-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону;
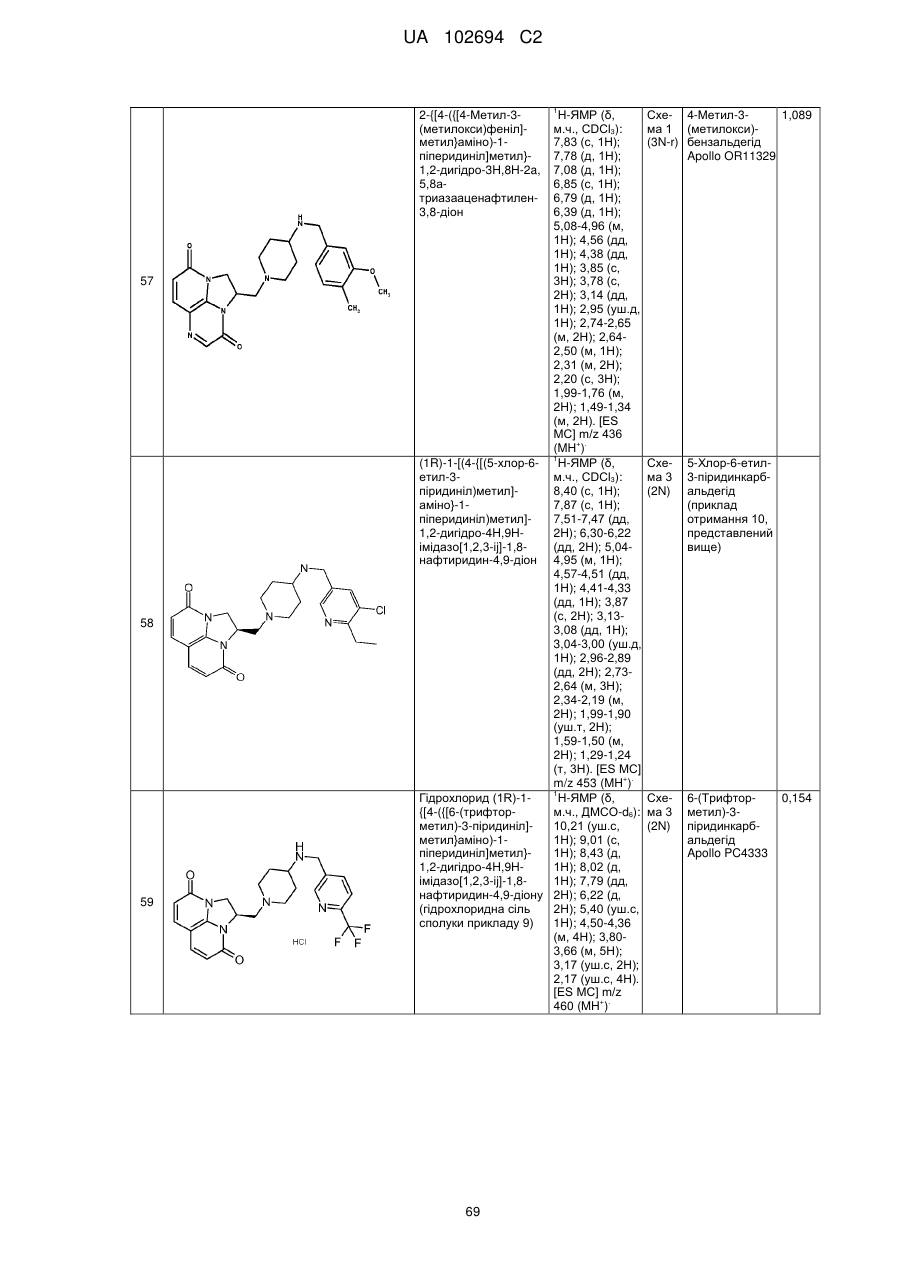
(1R)-1-[(4-{[(5,6-диметил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону;
2-[(4-{[(5,6-диметил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
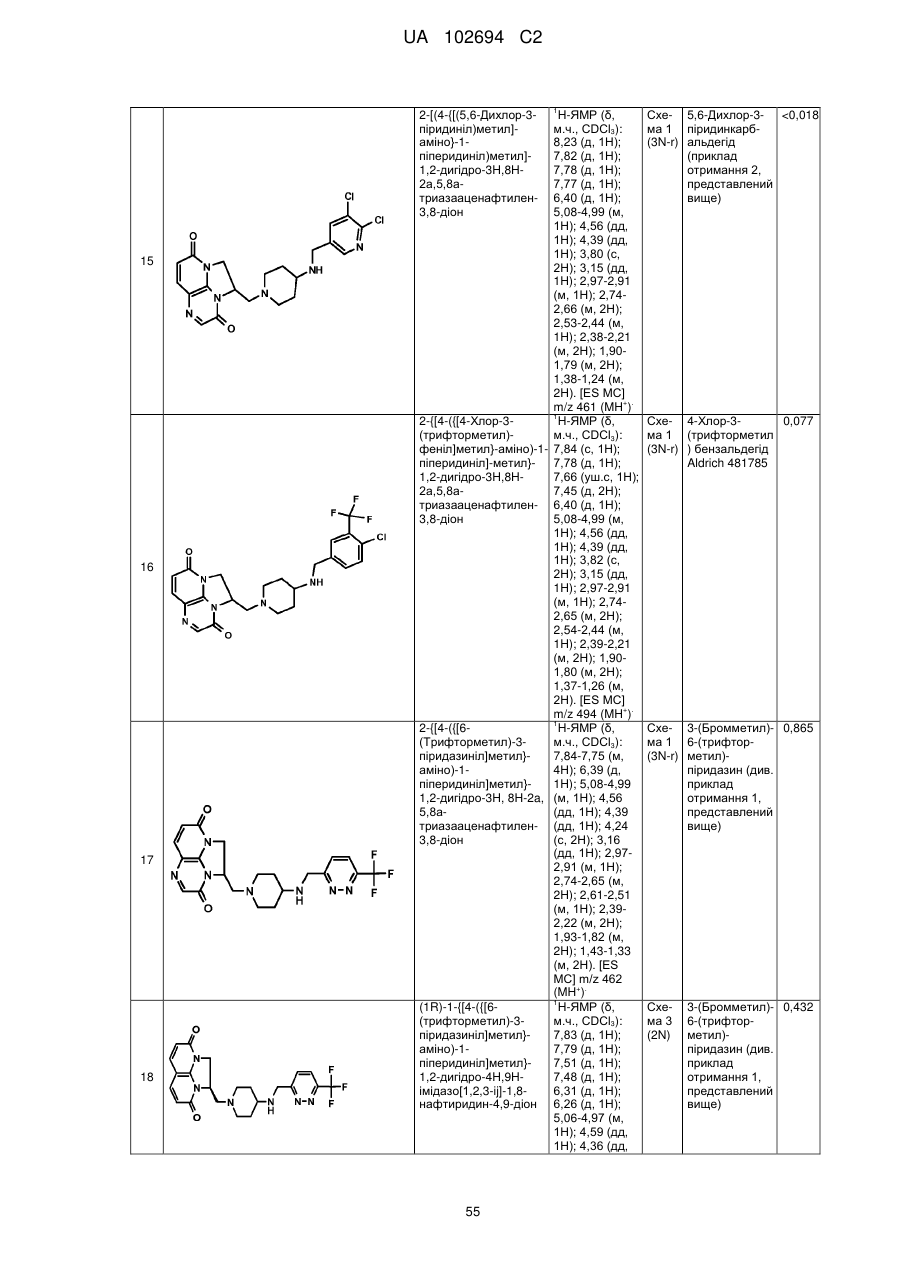
2-[(4-{[(5,6-дихлор-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-{[4-({[4-хлор-3-(трифторметил)феніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-{[4-({[6-(трифторметил)-3-піридазиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
(1R)-1-{[4-({[6-(трифторметил)-3-піридазиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону;
2-{[4-({[6-(трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-{[4-({[6-(трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-[(4-{[(4-хлорфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-[(4-{[(3-хлорфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-[(4-{[(4-метил-3-нітрофеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-[(4-{[(5-бром-4-метил-2-тієніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-[(4-{[(3,4-диметилфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-[(4-{[(5-хлор-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-({4-[({4-[(трифторметил)окси]феніл}метил)аміно]-1-піперидиніл}метил)-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-{[4-({[4-(трифторметил)феніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-[(4-{[(4-бромфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-[(4-{[(5-хлор-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
(1R)-1-[(4-{[(3,4-дихлорфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону;
5-{[(1-{[(1R)-4,9-діоксо-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-1-іл]метил}-4-піперидиніл)аміно]метил}-3-метил-2-піридинкарбонітрилу;
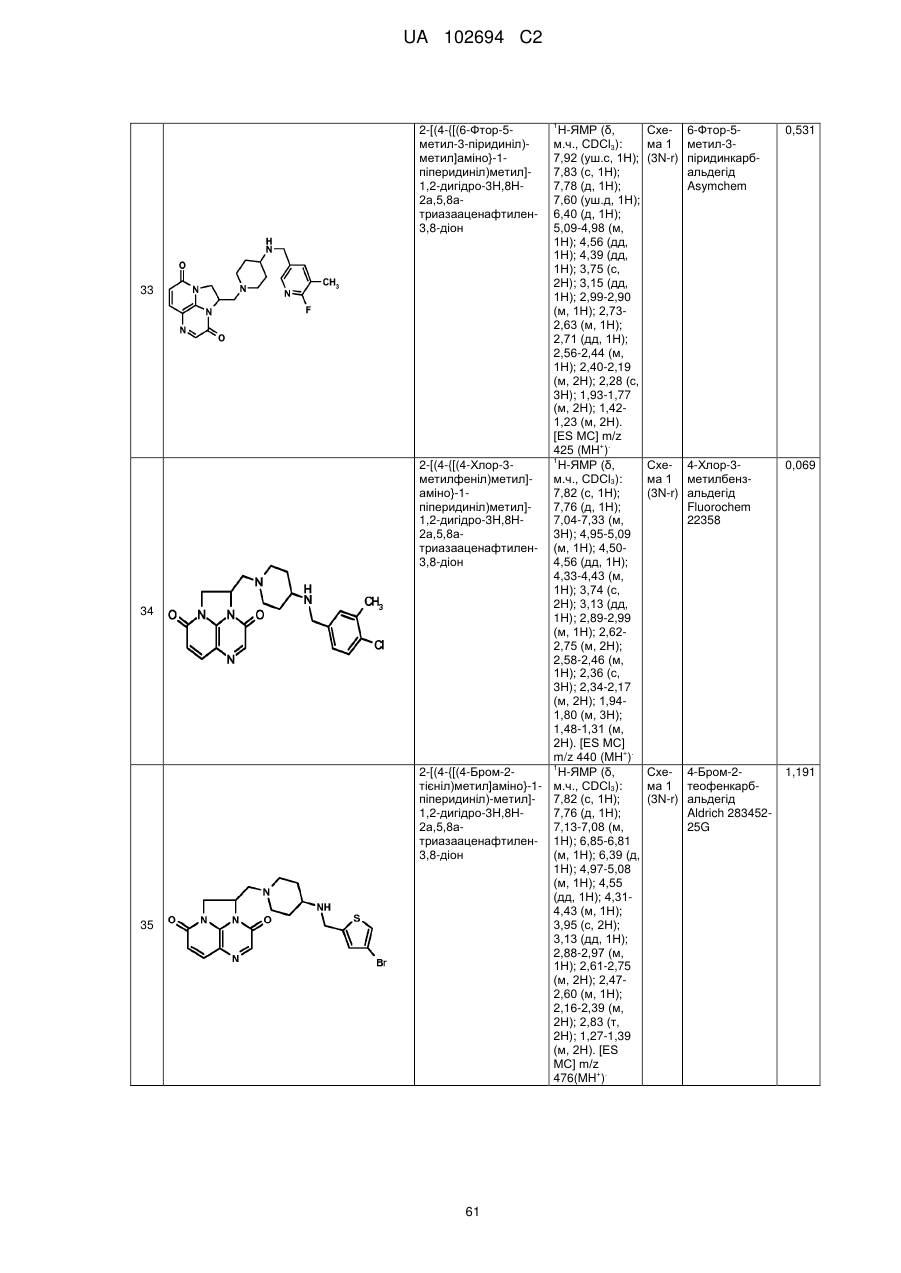
2-[(4-{[(6-фтор-5-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-[(4-{[(4-хлор-3-метилфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-[(4-{[(4-бром-2-тієніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
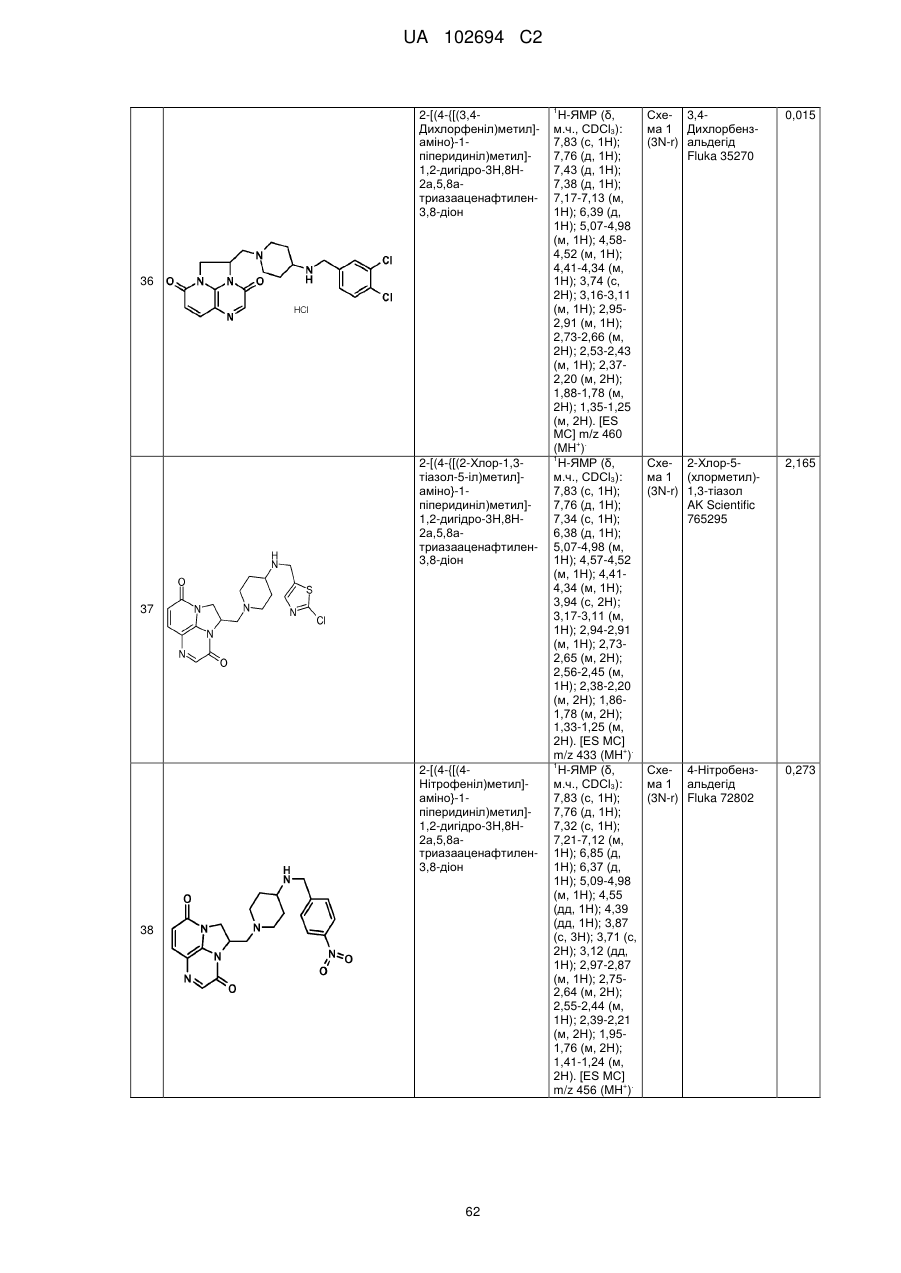
2-[(4-{[(3,4-дихлорфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-[(4-{[(2-хлор-1,3-триазол-5-іл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-[(4-{[(4-нітрофеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-{[4-({[3-хлор-4-(метилокси)феніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-[(4-{[(5-бром-2-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-[(4-{[(5-бром-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-[(4-{[(5-хлор-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-[(4-{[(3-фтор-4-метилфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-[(4-{[(3,4-дифторфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
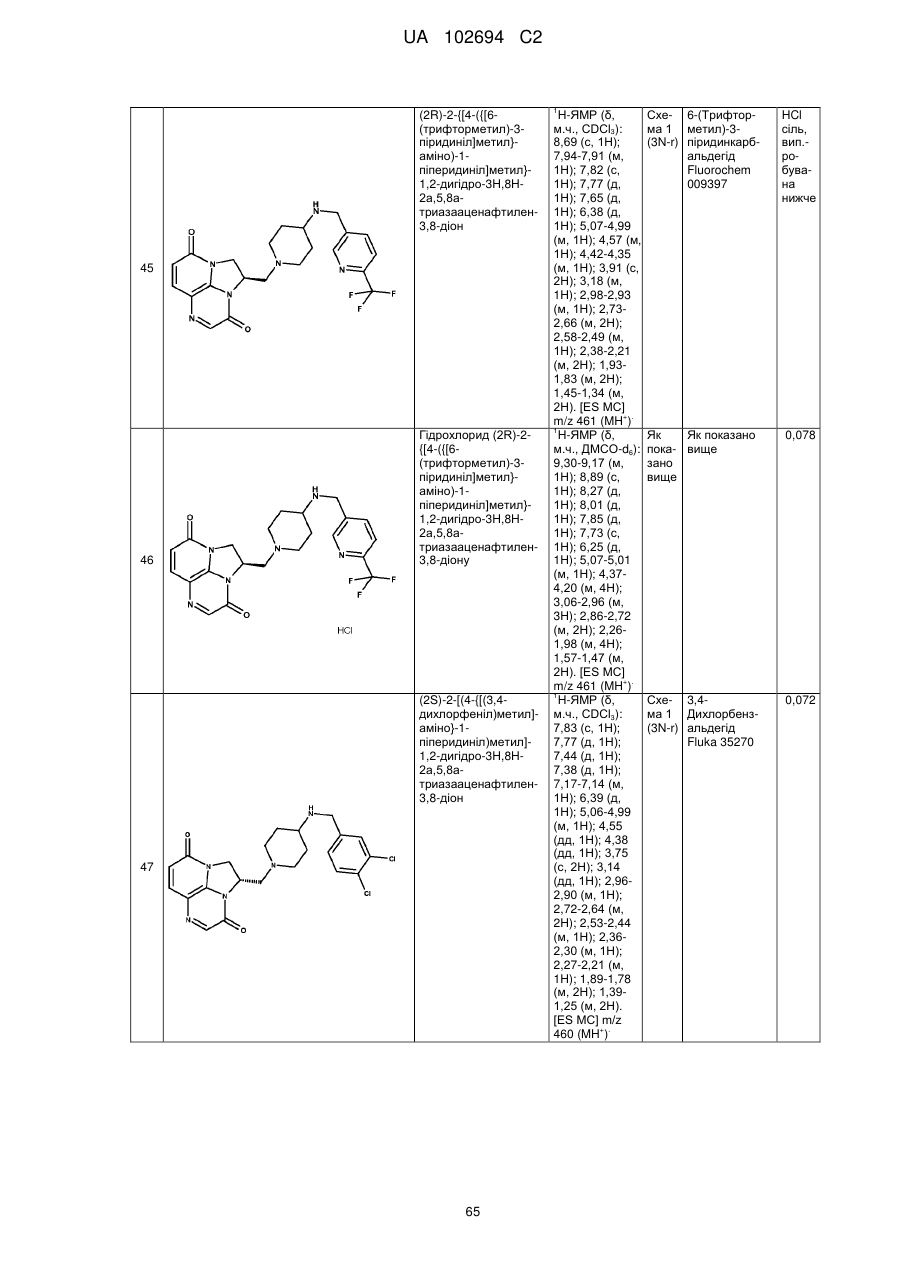
(2R)-2-{[4-({[6-(трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
гідрохлориду (2R)-2-{[4-({[6-(трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
(2S)-2-[(4-{[(3,4-дихлорфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
(2S)-2-{[4-({[6-(трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
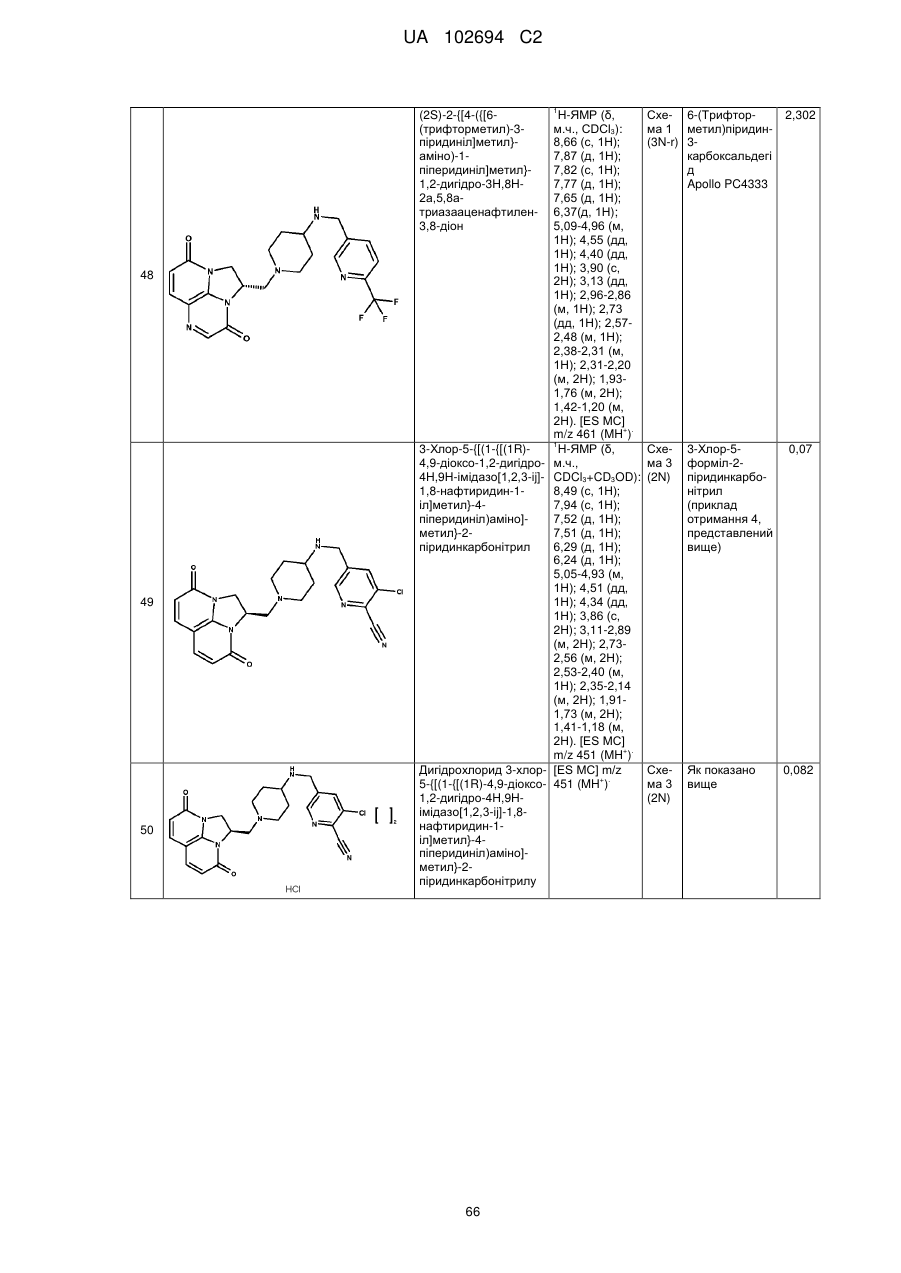
3-хлор-5-{[(1-{[(1R)-4,9-діоксо-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-1-іл]метил}-4-піперидиніл)аміно]метил}-2-піридинкарбонітрилу;
дигідрохлориду 3-хлор-5-{[(1-{[(1R)-4,9-діоксо-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-1-іл]метил}-4-піперидиніл)аміно]метил}-2-піридинкарбонітрилу;
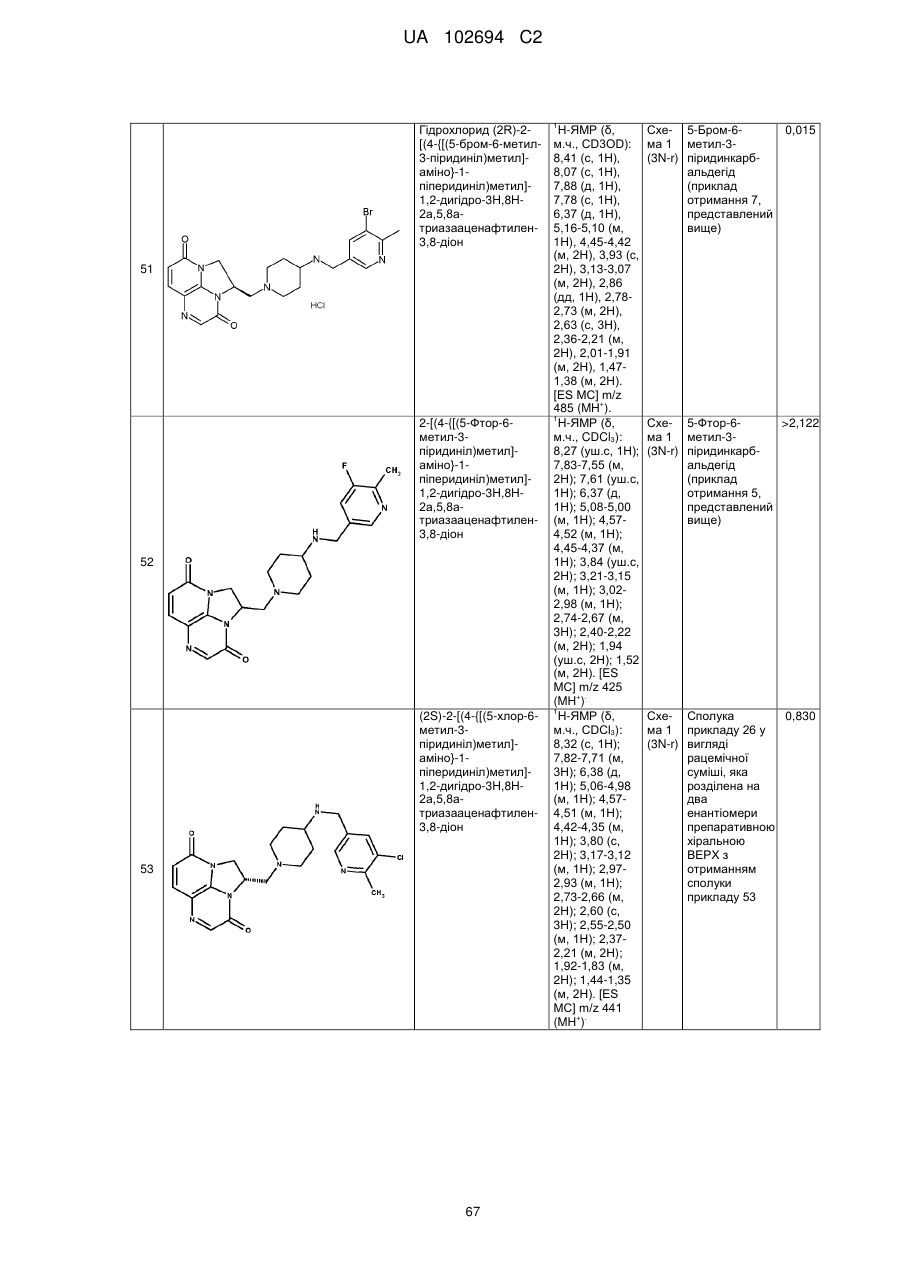
(2R)-2-[(4-{[(5-бром-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
2-[(4-{[(5-фтор-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
(2S)-2-[(4-{[(5-хлор-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
(1R)-1-[(4-{[(6-етил-5-фтор-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону;
гідрохлориду (1R)-1-[(4-{[(5-бром-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
(1R)-1-{[4-({[5-хлор-6-(гідроксиметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону;
2-{[4-({[4-метил-3-(метилокси)феніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
гідрохлориду (1R)-1-{[4-({[6-(трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону;
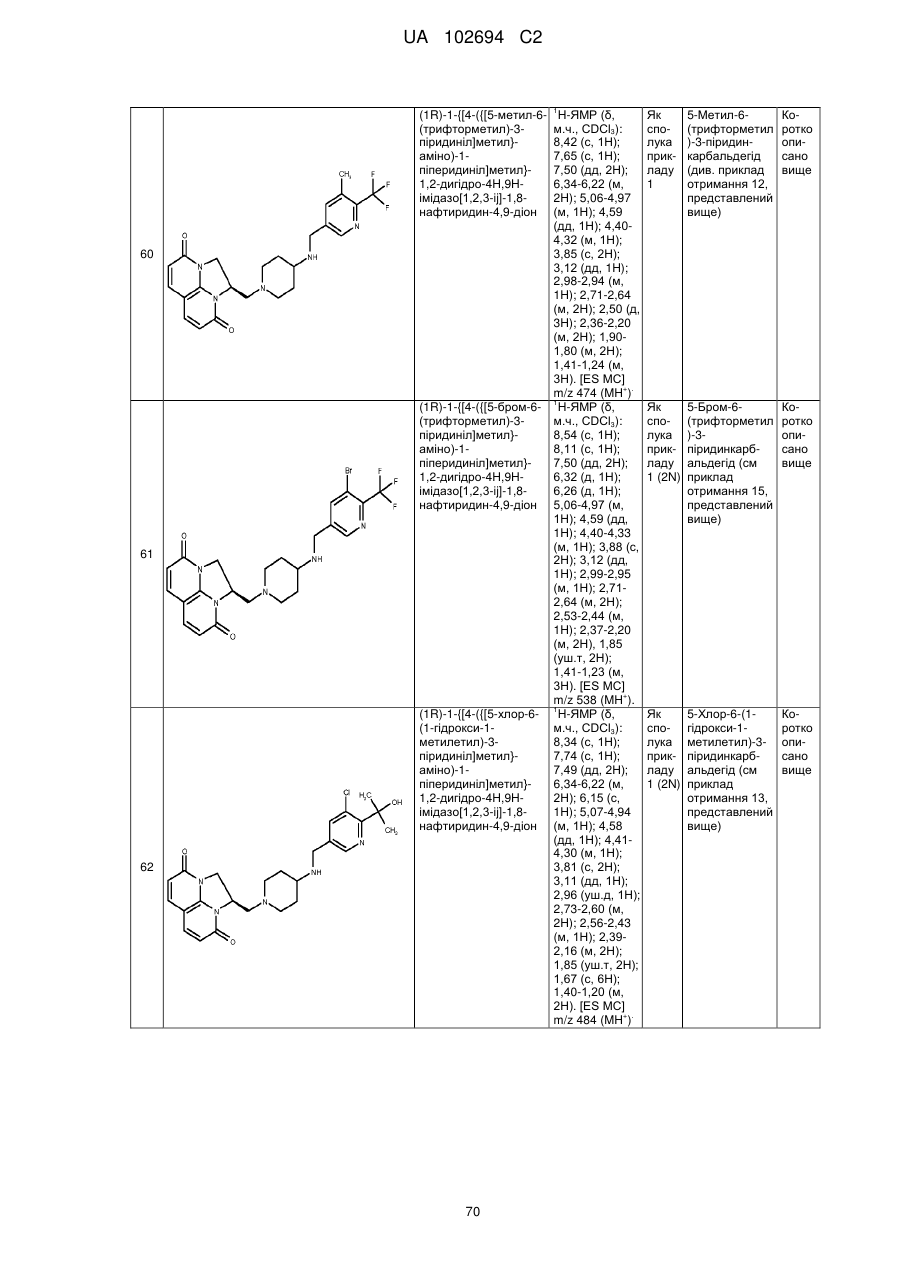
(1R)-1-{[4-({[5-метил-6-(трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону;
(1R)-1-{[4-({[5-бром-6-(трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону;
(1R)-1-{[4-({[5-хлор-6-(1-гідрокси-1-метилетил)-3-піридиніл]метил}-аміно)-1-піперидиніл]метил}-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону;
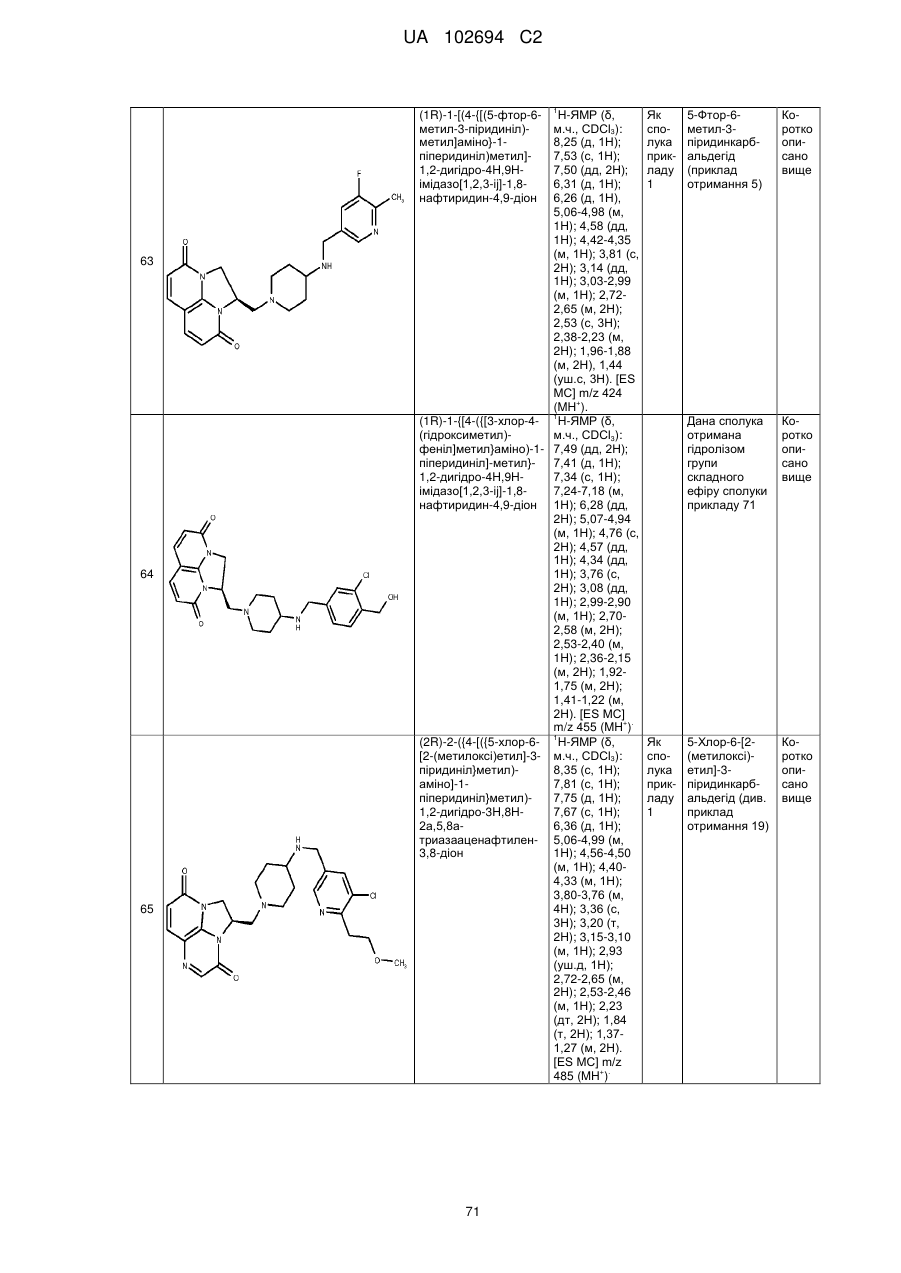
(1R)-1-[(4-{[(5-фтор-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону;
(1R)-1-{[4-({[3-хлор-4-(гідроксиметил)феніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону;
дигідрохлориду 3-xлop-5-{[(1-{[(2R)-3,8-дioкco-1,2-дигiдpo-3H,8H-2a,5,8a-триазааценафтилен-2-іл]метил}-4-піперидиніл)аміно]метил}-2-піридинкарбонітрилу;
(2R)-2-[(4-{[(5,6-диxлop-3-пipидинiл)мeтил]aмiнo}-1-пiпepидинiл)мeтил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
(2R)-2-{[4-({[5-xлop-6-(гiдpoкcимeтил)-3-пipидинiл]мeтил}aмiнo)-l-піперидиніл]метил}-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону;
(2-хлор-4-{[(1-{[(1R)-4,9-діоксо-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-1-іл]метил}-4-піперидиніл)аміно]метил}феніл)метилацетату;
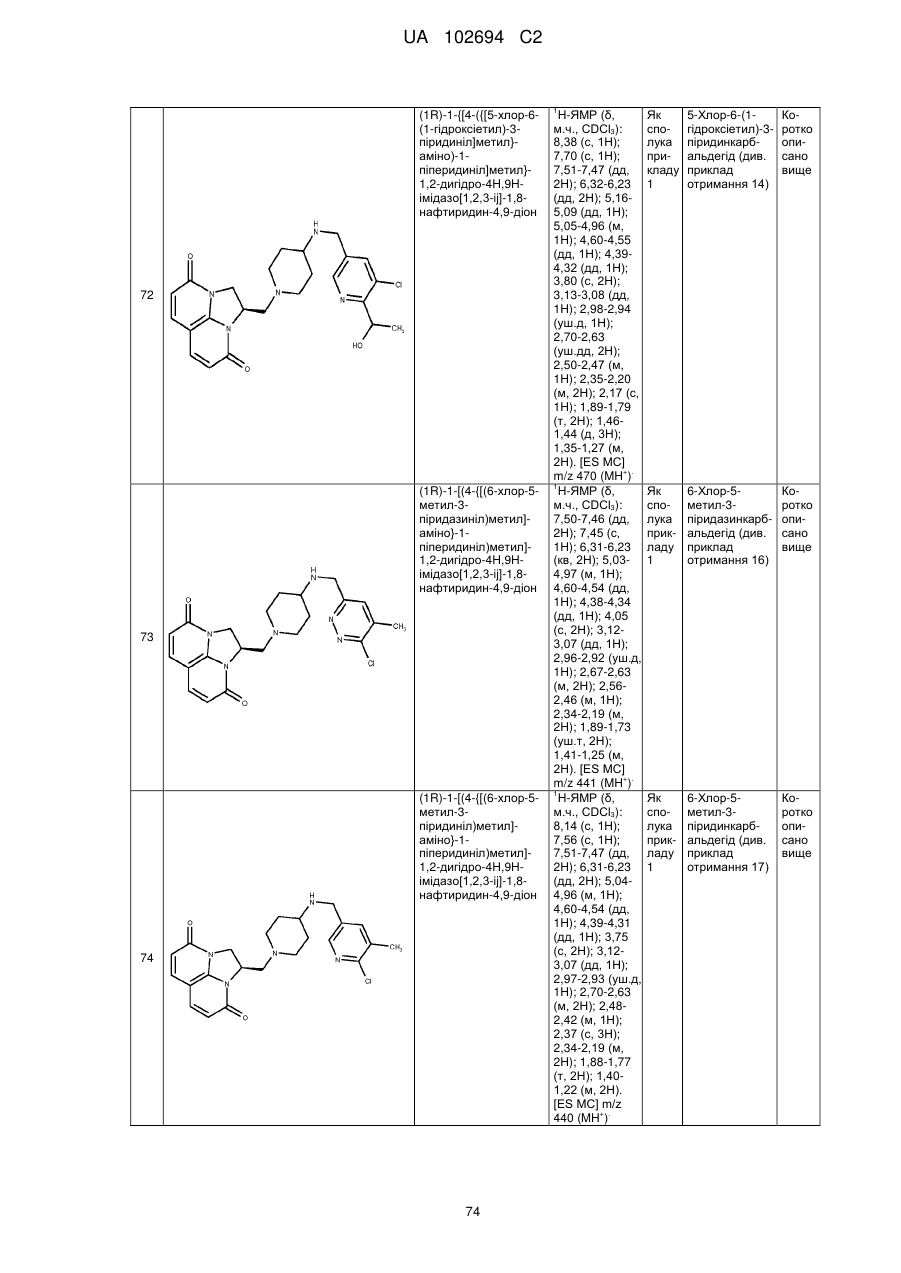
(1R)-1-{[4-({[5-хлор-6-(1-гідроксіетил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону;
(1R)-1-[(4-{[(6-хлор-5-метил-3-піридазиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону;
(1R)-1-[(4-{[(6-хлор-5-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону і
гідрохлориду (2R)-2-{[4-({[5-метил-6-(трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діону.
13. Сполука за п. 12, яка являє собою (1R)-1-[(4-{[(5-хлор-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діон.
14. Сполука за п. 12, яка являє собою (2R)-2-[(4-{[(5-хлор-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3Н,8Н-2а,5,8а-триазааценафтилен-3,8-діон.
15. Сполука за п. 12, яка являє собою (1R)-1-{[4-({[6-трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-4Н,9Н-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діон.
16. Фармацевтична композиція, що містить сполуку за п. 1 і один або декілька фармацевтично прийнятних носіїв, наповнювачів або розріджувачів.
17. Спосіб лікування туберкульозу у ссавців, зокрема у людини, за яким ссавцю, що потребує такого лікування, вводять ефективну кількість сполуки за п. 1.
18. Сполука за п. 1 для застосування в терапії.
19. Сполука за п. 1 для застосуванні в лікуванні туберкульозу у ссавців.
20. Застосування сполуки за п. 1 для виробництва лікарського засобу для застосування в лікуванні туберкульозу у ссавців.
21. Фармацевтична композиція, що містить сполуку за п. 1 і один або декілька фармацевтично прийнятних носіїв, наповнювачів або розріджувачів, для застосування в лікуванні туберкульозу у ссавців.
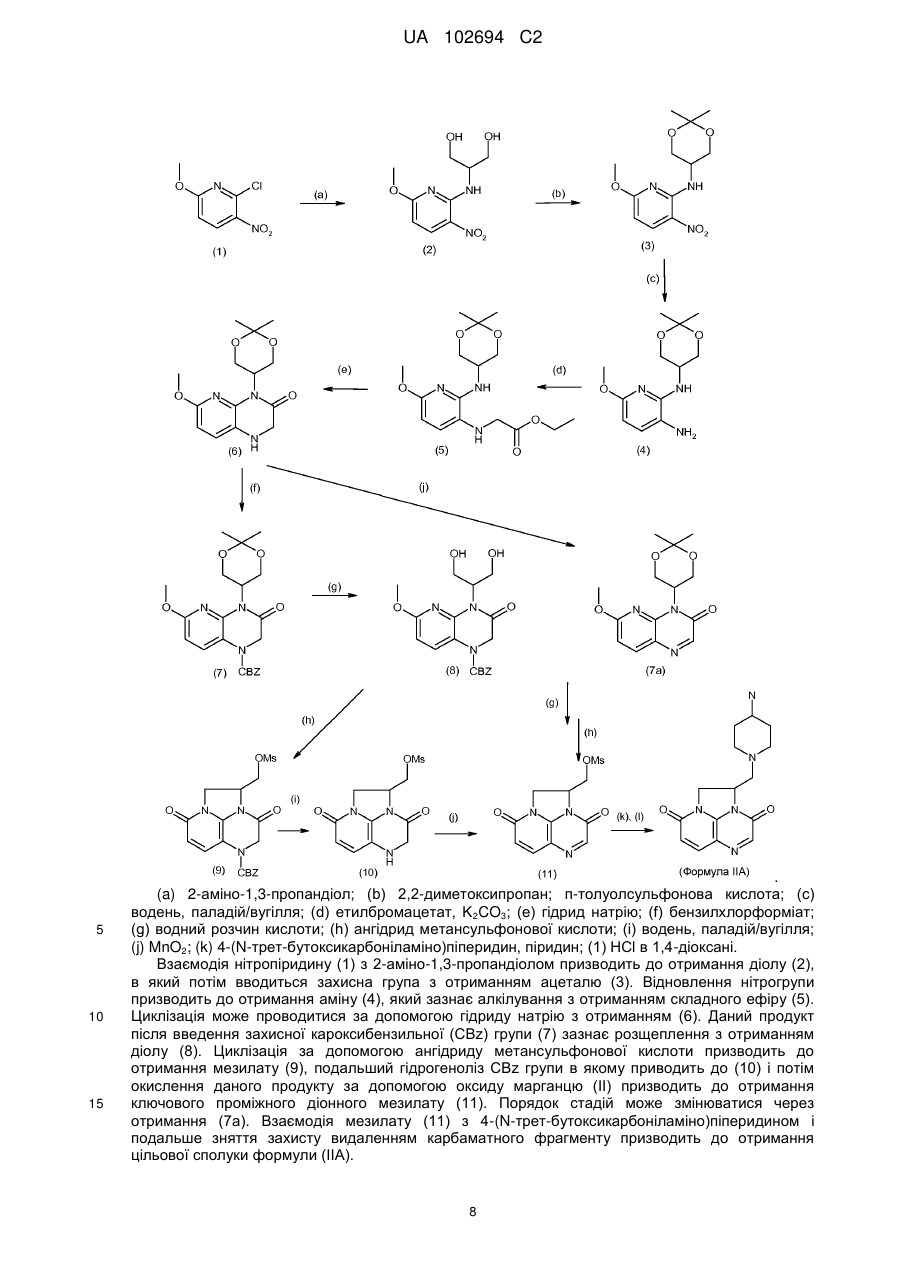
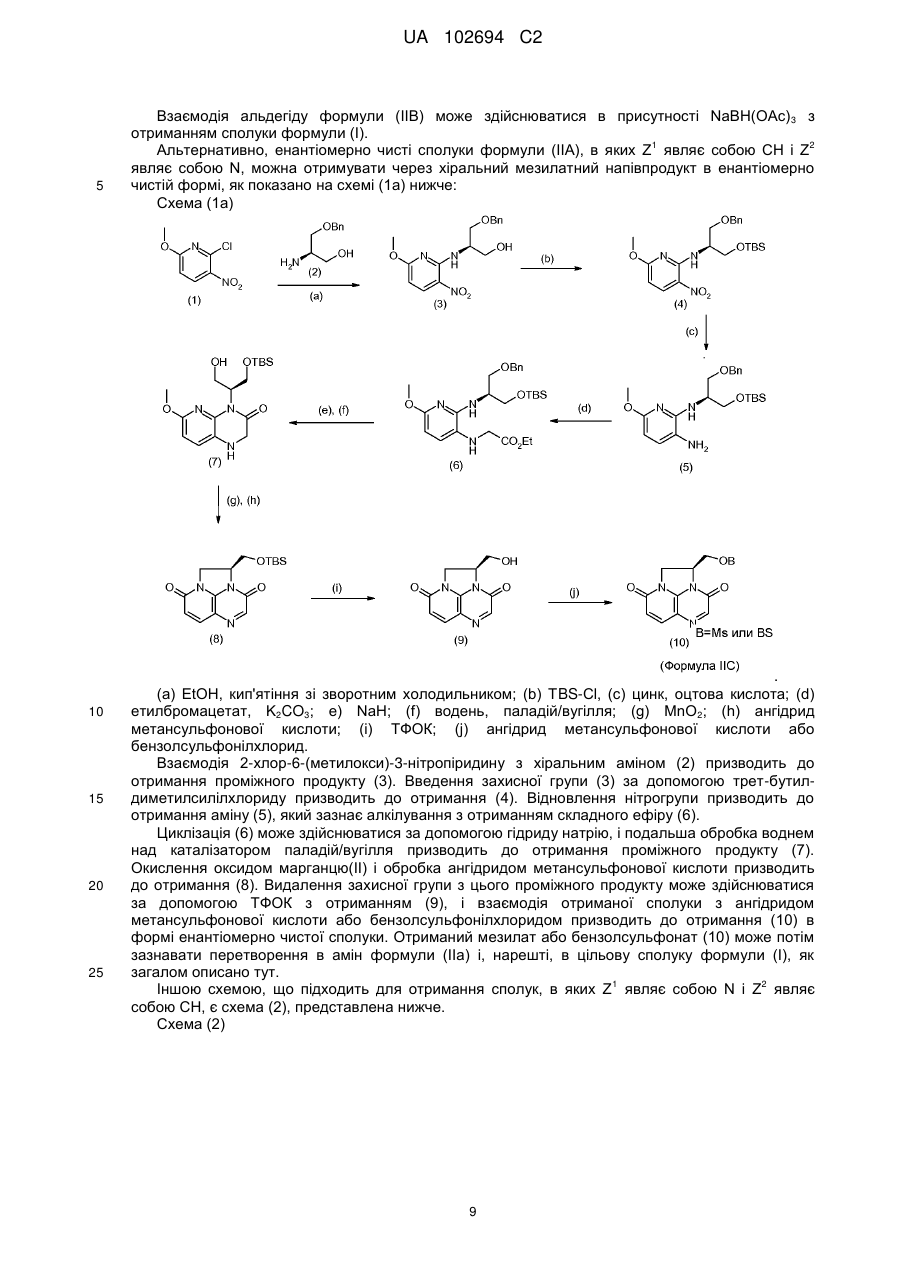
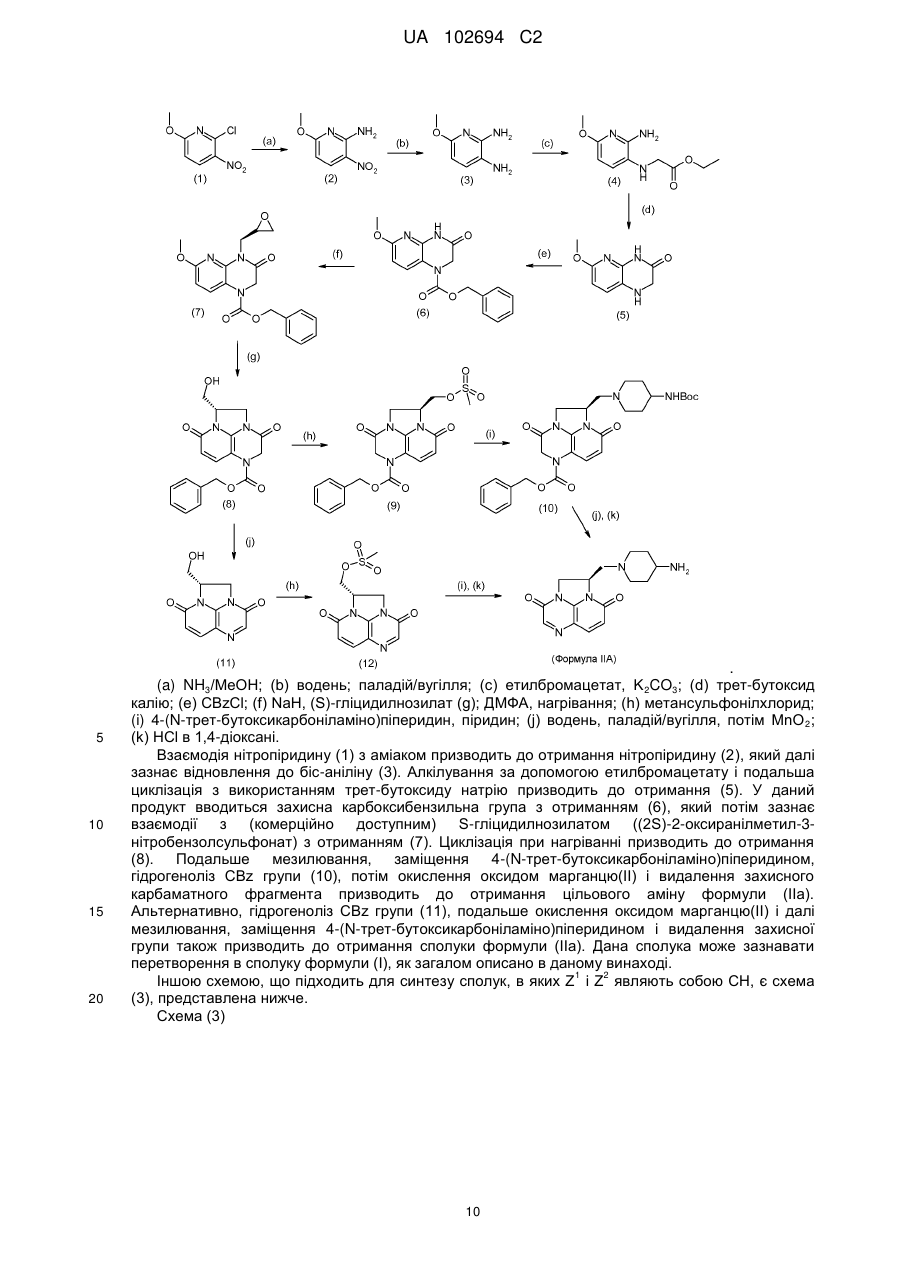
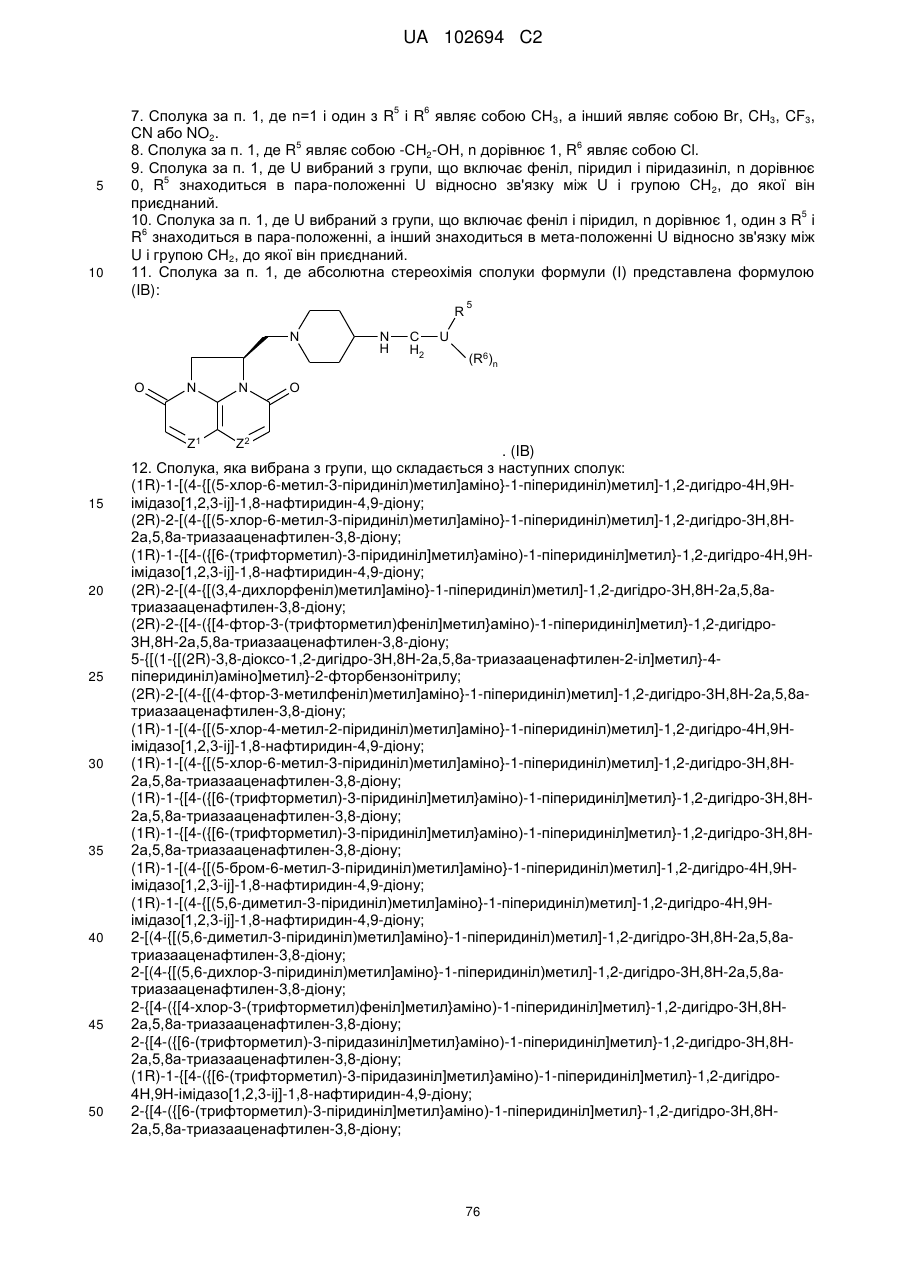
22. Спосіб отримання сполуки за п. 1, за яким проводять взаємодію аміну формули (IIА) і сполуки формули (IIВ):
 ,
,
де Z1, Z2, U, R5, R6 і n набувають значень, визначених для формули (І), і W являє собою альдегідний фрагмент СН=О, причому така взаємодія являє собою реакцію відновного амінування, або W являє собою бромметильний фрагмент СН2Вr.
Текст
Реферат: Винахід стосується сполук формули (І), їх фармацевтично прийнятних солей або N-оксидів (показана відносна стереохімія), фармацевтичних композицій, що включають вказані сполуки, їх застосування в терапії, зокрема, для лікування туберкульозу, а також способів отримання вказаних сполук. UA 102694 C2 (12) UA 102694 C2 R N O N N Z1 Z2 N H C H2 5 U (R6)n O . (I) UA 102694 C2 5 10 15 20 25 30 35 40 45 50 55 Галузь техніки, до якої належить винахід Даний винахід стосується сполук, композицій, що містять вказані сполуки, їх застосування в терапії, включаючи застосування як бактерицидних засобів, наприклад для лікування туберкульозу, і способів отримання таких сполук. Рівень техніки У РСТ патентних публікаціях WO02/08224, WO02/50061, WO02/56882, WO02/96907, WO2003087098, WO2003010138, WO2003064421, WO2003064431, WO2004002992, WO2004002490, WO2004014361, WO2004041210, WO2004096982, WO2002050036, WO2004058144, WO2004087145, WO2006002047, WO2006014580, WO2006010040, WO2006017326, WO2006012396, WO2006017468, WO2006020561, WO2006081179, WO2006081264, WO2006081289, WO2006081178, WO2006081182, WO01/25227, WO02/40474, WO02/07572, WO2004024712, WO2004024713, WO2004035569, WO2004087647, WO2004089947, WO2005016916, WO2005097781, WO2006010831, WO2006021448, WO2006032466, WO2006038172, WO2006046552, WO2006099884, WO2006105289, WO2006081178, WO2006081182, WO2006134378, WO2006137485, WO2007016610, WO2007081597, WO2007071936, WO2007115947, WO2007118130, WO2007122258, WO2007138974, WO2008006648, WO2008003690 і WO2008009700 описуються похідні хіноліну, нафтиридину, морфоліну, циклогексану, піперидину і піперазину, а також трициклічні сполуки з конденсованими циклами, які мають бактерицидну активність. У публікації WO2004104000 описуються трициклічні сполуки з конденсованими циклами, які можуть селективно впливати на канабіноїдні рецептори. Синтетичні лікарські засоби для лікування туберкульозу (ТБ) доступні вже протягом півстоліття, але захворюваність цією хворобою продовжує зростати у всьому світі. У 2004 році виявлено 24500 людей з цим розвиненим активним захворюванням, і близько 5500 людей щодня вмирають від ТБ (World Health Organization, Global Tuberculosis Control: Surveillance, Planning, Financing. WHO Report 2006, Geneva, Switzerland, ISBN 92-4 156314-1). Одночасне інфікування ВІЛ стимулює підвищення захворюваності (Williams, B.G.; Dye, C. Science, 2003, 301, 1535), і причина смерті 31 % пацієнтів зі СНІД на африканському континенті може бути віднесена до ТБ (Corbett, E.L.; Watt, C.J.; Catherine, J.; Walker, N.; Maher D.; Williams, B.G.; Raviglione, M.C; Dye, C. Arch. Intl. Med., 2003, 163, 1009, Septkowitz, А.; Raffalli, J.; Riley, Т.; Kiehn, T.E.; Armstrong, D. Clin. Microbiol. Rev. 1995, 8, 180). З появою полірезистентних штамів Mycobacterium tuberculosis (MDR-TB) масштаб проблеми збільшився. Пройшло вже більше десяти років відтоді, як ВОЗ оголосила ТБ "глобальною загрозою здоров'ю" (World Health Organization, Global Tuberculosis Control: Surveillance, Planning, Financing. WHO Report 2006, Geneva, Switzerland, ISBN 92-4 156314-1). Проблеми протитуберкульозної терапії і попередження захворювання туберкульозом добре відомі. Доступна на сьогоднішній день вакцина BCG була впроваджена в 1921 році і вже не в змозі захищати більшість дорослих людей. В даний час пацієнти, які стають інфікованими активним захворюванням, отримують як комбіноване терапевтичне лікування ізоніазид, рифампін, піразинамід і етамбутол протягом двох місяців, а потім протягом додаткових чотирьох місяців продовжують отримувати ізоніазид і рифампін. Необхідне щоденне введення препаратів, і невисока ефективність препаратів приводить до появи і поширення полірезистентних штамів, лікування яких вимагає підвищення інтенсивності лікування. У нещодавно опублікованому огляді детально обговорюється багато аспектів ТБ, такі як патогенез, епідеміологія, а також лікарські засоби і розроблені вакцини, які використовуються до цього часу (Nature Medicine, Vol. 13(3), pages 263-312). Таким чином, існує гостра потреба в менш тривалих курсах лікування із застосуванням більш активних лікарських засобів, які можна приймати з меншою частотою, тобто існує потреба в лікарських засобах, ефективних у відношенні полірезистентних штамів ТБ (MDR-TB). Отже, існує потреба у відкритті і розробці нових хімічних сполук для лікування ТБ (розроблені останнім часом основні хімічні структури представлені в огляді: Ballell, L.; Field, R.A.; Duncan, K.; Young, R.J. Antimicrob. Agents Chemother. 2005, 49, 2153). Докладний опис винаходу Згідно з одним аспектом, даний винахід надає сполуку формули (I), її фармацевтично прийнятну сіль або N-оксид: 1 UA 102694 C2 5 10 15 20 25 30 35 40 де 1 2 один з Z і Z являє собою СН або N, а інший являє собою CH; U являє собою групу, вибрану з фенілу, піридилу, піридазинілу, піримідинілу, піразинілу, тіазолілу, фуранілу, імідазолілу і тіофенілу; n дорівнює 0 або 1; 5 6 7 7A 7B R і R незалежно вибрані з галогену, CF3, OCF3, C1-3 алкілу, NHR , NR R , C1-3 алкокси, 5 нітро і ціано; або R може являти собою групу -CmH2m-A, де m набуває значення від 1 до 5, фрагмент -CmH2m- може являти собою фрагмент з прямим або розгалуженим ланцюгом і А 7 7 7 7 7 7 7A 7B вибраний з OH, OR , OCOR , OCO2R , OCONR , OPO2R і NH2, де кожний R , R і R незалежно являє собою C1-5 алкіл. В одному варіанті здійснення винаходу сполука формули (I) може являти собою сполуку формули (IA), її фармацевтично прийнятну сіль або N-оксид: де 1 2 один з Z і Z являє собою СН або N, а інший являє собою CH; U являє собою групу, вибрану з фенілу, піридилу, піридазинілу, піримідинілу, піразинілу, тіазолілу, фуранілу, імідазолілу і тіофенілу; 5 6 R і R незалежно вибрані з галогену, CF3, OCF3, C1-3 алкілу, C1-3 алкокси, нітро і ціано, і n дорівнює 0 або 1. Винахід надає також фармацевтичну композицію, що включає сполуку формули (I), її фармацевтично прийнятну сіль або N-оксид, і один або декілька фармацевтично прийнятних носіїв, наповнювачів або розріджувачів. Винахід надає також спосіб лікування туберкульозу у ссавців, зокрема у людини, вказаний спосіб включає введення ссавцеві, що потребує такого лікування, ефективної кількості сполуки формули (I), її фармацевтично прийнятної солі або N-оксиду. Даний винахід надає також спосіб лікування бактерійних інфекцій у ссавців, зокрема у людини, вказаний спосіб включає введення ссавцеві, що потребує такого лікування, ефективної кількості сполуки формули (I), її фармацевтично прийнятної солі або N-оксиду. Винахід надає також сполуку формули (I), її фармацевтично прийнятну сіль або N-оксид для застосування в терапії. Винахід надає також сполуку формули (I), її фармацевтично прийнятну сіль або N-оксид для застосування в лікуванні туберкульозу у ссавців, зокрема у людини. Винахід надає також сполуку формули (I), її фармацевтично прийнятну сіль або N-оксид для застосування в лікуванні бактерійних інфекцій ссавців, зокрема людини. Винахід надає також застосування сполуки формули (I), її фармацевтично прийнятної солі або N-оксиду у виробництві лікарського засобу для застосування в лікуванні туберкульозу у ссавців, зокрема у людини. Винахід надає також застосування сполуки формули (I), її фармацевтично прийнятної солі або N-оксиду у виробництві лікарського засобу для застосування в лікуванні бактерійних інфекцій ссавців, зокрема людини. Винахід надає також фармацевтичну композицію, що включає сполуку формули (I), її фармацевтично прийнятну сіль або N-оксид і один або декілька фармацевтично прийнятних 2 UA 102694 C2 5 10 15 20 25 30 35 40 45 50 носіїв, наповнювачів або розріджувачів, для застосування в лікуванні туберкульозу у ссавців, зокрема у людини. Винахід надає також фармацевтичну композицію, що включає сполуку формули (I), її фармацевтично прийнятну сіль або N-оксид і один або декілька фармацевтично прийнятних носіїв, наповнювачів або розріджувачів, для застосування в лікуванні бактерійних інфекцій ссавців, зокрема людини. В одному варіанті здійснення винаходу U являє собою групу, вибрану з фенілу, піридилу, піридазинілу, піримідинілу, тієнілу, тіазолілу або тіофенілу. В іншому варіанті здійснення винаходу U являє собою групу, вибрану з фенілу, піридилу, піридазинілу, тіазолілу і тіофенілу. 5 У ще одному варіанті здійснення винаходу, коли n=0, R являє собою CF3, OCF3, Cl, Br або NO2. 5 6 У ще одному варіанті здійснення винаходу n=1 і один з R і R являє собою Cl, а інший являє собою Cl, CH3, C2H5, CN, CF3 або OCF3. 5 6 У ще одному варіанті здійснення винаходу n=1 і один з R і R являє собою F, а інший являє собою Cl, CF3, CN, CH3 або C2H5. 5 6 У ще одному варіанті здійснення винаходу n=1 і один з R і R являє собою CH3, а інший являє собою Br, CH3, CF3, CN або NO2. 5 У ще одному варіанті здійснення винаходу n дорівнює 0 і R являє собою CF3. 5 6 У ще одному варіанті здійснення винаходу n дорівнює 1 і R і R являють собою Cl і CH3. 5 6 У ще одному варіанті здійснення винаходу n дорівнює 1 і R і R являють собою CH3 і CF3. 5 6 У ще одному варіанті здійснення винаходу n дорівнює 1 і R і R являють собою Cl і CN. 5 У ще одному варіанті здійснення винаходу m дорівнює 1 і А являє собою OH, так що R 6 являє собою -CH2-OH, n дорівнює 1 і R являє собою Cl. У ще одному варіанті здійснення винаходу, коли U являє собою групу, вибрану з фенілу, 5 піридилу або піридазинілу і n=0, тоді R знаходиться в пара-положенні U відносно зв'язку між U і групою CH2, до якої він приєднаний. У ще одному варіанті здійснення винаходу, коли U являє собою групу, вибрану з фенілу або 5 6 піридилу, і n=1, один з R і R знаходиться в пара-положенні, а інший - в мета-положенні U відносно зв'язку між U і групою CH2, до якої він приєднаний. Один або декілька представлених вище структурних варіантів здійснення винаходу можуть бути представлені в сполуці формули (I). У варіанті здійснення винаходу абсолютна стереохімія сполуки формули (I) або (IA) представлена формулою (IB): . Сполуки формули (I) можуть існувати в формі солей, сольватів або N-оксидів, і формула (I) включає в себе ці форми. Згідно з одним аспектом сполуки, застосовні в даному винаході, включають сполуки, згадані в прикладах, їх фармацевтично прийнятні солі, сольвати або N-оксиди. Відповідно до іншого аспекту сполуки, застосовні в даному винаході, включають наступні сполуки: (1R)-1-[(4-{[(5-хлор-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діон; (2R)-2-[(4-{[(5-хлор-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро3H,8H-2a,5,8а-триазааценафтилен-3,8-діон; (2R)-2-[(4-{[(3,4-дихлорфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8атриазааценафтилен-3,8-діон; (2R)-2-{[4-({[4-фтор-3-(трифторметил)феніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро3H,8H-2a,5,8а-триазааценафтилен-3,8-діон; 5-{[(1-{[(2R)-3,8-діоксо-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-2-іл]метил}-4піперидиніл)аміно]метил}-2-фторбензонітрил; (2R)-2-[(4-{[(4-фтор-3-метилфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H2a,5,8а-триазааценафтилен-3,8-діон; 3 UA 102694 C2 5 10 15 20 25 30 35 40 45 50 55 60 (1R)-1-[(4-{[(5-хлор-4-метил-2-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діон; (1R)-1-[(4-{[(5-хлор-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро3H,8H-2a,5,8а-триазааценафтилен-3,8-діон; (1R)-1-{[4-({[6-(трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діон; (1R)-1-{[4-({[6-(трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро3H,8H-2a,5,8а-триазааценафтилен-3,8-діон; (1R)-1-{[4-({[6-(трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро3H,8H-2a,5,8а-триазааценафтилен-3,8-діон; (1R)-1-[(4-{[(5-бром-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діон; (1R)-1-[(4-{[(5,6-диметил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-4H,9Hімідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діон; 2-[(4-{[(5,6-диметил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H2a,5,8а-триазааценафтилен-3,8-діон; 2-[(4-{[(5,6-дихлор-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8атриазааценафтилен-3,8-діон; 2-{[4-({[4-хлор-3-(трифторметил)феніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-3H,8H2a,5,8а-триазааценафтилен-3,8-діон; 2-{[4-({[6-(трифторметил)-3-піридазиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро3H,8H-2a,5,8а-триазааценафтилен-3,8-діон; (1R)-1-{[4-({[6-(трифторметил)-3-піридазиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діон; 2-{[4-({[6-(трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-3H,8H2a,5,8а-триазааценафтилен-3,8-діон; 2-{[4-({[6-(трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-3H,8H2a,5,8а-триазааценафтилен-3,8-діон; 2-[(4-{[(4-хлорфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8атриазааценафтилен-3,8-діон; 2-[(4-{[(3-хлорфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8атриазааценафтилен-3,8-діон; 2-[(4-{[(4-метил-3-нітрофеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8атриазааценафтилен-3,8-діон; 2-[(4-{[(5-бром-4-метил-2-тієніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H2a,5,8а-триазааценафтилен-3,8-діон; 2-[(4-{[(3,4-диметилфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8атриазааценафтилен-3,8-діон; 2-[(4-{[(5-хлор-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H2a,5,8а-триазааценафтилен-3,8-діон; 2-({4-[({4-[(трифторметил)окси]феніл}метил)аміно]-1-піперидиніл}метил)-1,2-дигідро-3H,8H2a,5,8а-триазааценафтилен-3,8-діон; 2-{[4-({[4-(трифторметил)феніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-3H,8H2a,5,8а-триазааценафтилен-3,8-діон; 2-[(4-{[(4-бромфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8атриазааценафтилен-3,8-діон; 2-[(4-{[(5-хлор-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H2a,5,8а-триазааценафтилен-3,8-діон; (1R)-1-[(4-{[(3,4-дихлорфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-4H,9Hімідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діон; 5-{[(1-{[(1R)-4,9-діоксо-1,2-дигідро-4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин-1-іл]метил}-4піперидиніл)аміно]метил}-3-метил-2-піридинкарбонітрил; 2-[(4-{[(6-фтор-5-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H2a,5,8а-триазааценафтилен-3,8-діон; 2-[(4-{[(4-хлор-3-метилфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8атриазааценафтилен-3,8-діон; 2-[(4-{[(4-бром-2-тієніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8атриазааценафтилен-3,8-діон; 2-[(4-{[(3,4-дихлорфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8атриазааценафтилен-3,8-діон; 4 UA 102694 C2 5 10 15 20 25 30 35 40 45 50 55 60 2-[(4-{[(2-хлор-1,3-тіазол-5-іл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8атриазааценафтилен-3,8-діон; 2-[(4-{[(4-нітрофеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8атриазааценафтилен-3,8-діон; 2-{[4-({[3-хлор-4-(метилокси)феніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-3H,8H2a,5,8а-триазааценафтилен-3,8-діон; 2-[(4-{[(5-бром-2-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8атриазааценафтилен-3,8-діон; 2-[(4-{[(5-бром-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8атриазааценафтилен-3,8-діон; 2-[(4-{[(5-хлор-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8атриазааценафтилен-3,8-діон; 2-[(4-{[(3-фтор-4-метилфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8атриазааценафтилен-3,8-діон; 2-[(4-{[(3,4-дифторфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8атриазааценафтилен-3,8-діон; (2R)-2-{[4-({[6-(трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро3H,8H-2a,5,8а-триазааценафтилен-3,8-діон; гідрохлорид (2R)-2-{[4-({[6-(трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-3,8-діону; (2S)-2-[(4-{[(3,4-дихлорфеніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8атриазааценафтилен-3,8-діон; (2S)-2-{[4-({[6-(трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро3H,8H-2a,5,8а-триазааценафтилен-3,8-діон; 3-хлор-5-{[(1-{[(1R)-4,9-діоксо-1,2-дигідро-4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин-1-іл]метил}4-піперидиніл)аміно]метил}-2-піридинкарбонітрил; дигідрохлорид 3-хлор-5-{[(1-{[(1R)-4,9-діоксо-1,2-дигідро-4H,9H-імідазо[1,2,3-ij]-1,8нафтиридин-1-іл]метил}-4-піперидиніл)аміно]метил}-2-піридинкарбонітрилу; (2R)-2-[(4-{[(5-бром-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро3H,8H-2a,5,8а-триазааценафтилен-3,8-діон; 2-[(4-{[(5-фтор-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H2a,5,8а-триазааценафтилен-3,8-діон; (2S)-2-[(4-{[(5-хлор-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро3H,8H-2a,5,8а-триазааценафтилен-3,8-діон; (1R)-1-[(4-{[(6-етил-5-фтор-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-4H,9Hімідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діон; гідрохлорид (1R)-1-[(4-{[(5-бром-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2дигідро-3H, 8H-2a,5,8а-триазааценафтилен-3,8-діону; (1R)-1-{[4-({[5-хлор-6-(гідроксиметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2дигідро-4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діон; 2-{[4-({[4-метил-3-(метилокси)феніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-3H,8H2a,5,8а-триазааценафтилен-3,8-діон; (1R)-1-[(4-{[(5-хлор-6-етил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-4H,9Hімідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діон; гідрохлорид (1R)-1-{[4-({[6-(трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}1,2-дигідро-4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону; (1R)-1-{[4-({[5-метил-6-(трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2дигідро-4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діон; (1R)-1-{[4-({[5-бром-6-(трифторметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2дигідро-4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діон; (1R)-1-{[4-({[5-хлор-6-(1-гідрокси-1-метилетил)-3-піридиніл]метил}аміно)-1піперидиніл]метил}-1,2-дигідро-4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діон; (1R)-1-[(4-{[(5-фтор-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діон; (1R)-1-{[4-({[3-хлор-4-(гідроксиметил)феніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діон; дигідрохлорид 3-хлор-5-{[(1-{[(2R)-3,8-діоксо-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен2-іл]метил}-4-піперидиніл)аміно]метил}-2-піридинкарбонітрилу; (2R)-2-[(4-{[(5,6-дихлор-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H2a,5,8а-триазааценафтилен-3,8-діон; 5 UA 102694 C2 5 10 15 20 25 30 35 40 45 50 55 60 (2R)-2-{[4-({[5-хлор-6-(гідроксиметил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2дигідро-3H,8H-2a, 5,8а-триазааценафтилен-3,8-діон; (2-хлор-4-{[(1-{[(1R)-4,9-діоксо-1,2-дигідро-4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин-1-іл]метил}4-піперидиніл)аміно]метил}феніл)метилацетат; (1R)-1-{[4-({[5-хлор-6-(1-гідроксіетил)-3-піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2дигідро-4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діон; (1R)-1-[(4-{[(6-хлор-5-метил-3-піридазиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діон; (1R)-1-[(4-{[(6-хлор-5-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діон; і гідрохлорид (2R)-2-{[4-({[5-метил-6-(трифторметил)-3-піридиніл]метил}аміно)-1піперидиніл]метил}-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-3,8-діону. Деякі сполуки формули (I) можуть існувати в формі оптичних ізомерів, наприклад в формі сумішей ізомерів всіх співвідношень, зокрема - рацемічних сумішей. Винахід включає всі такі форми, зокрема чисті ізомерні форми. Наприклад, винахід включає енантіомери. Різні ізомерні форми можуть виділятися або відділятися одна від іншої стандартними методами, або будьякий заданий ізомер може бути отриманий стандартними методами синтезу або методами стереоспецифічного або асиметричного синтезу. Терміни і визначення Термін "С1-3 алкіл", коли використовується в даному описі, стосується алкільної групи з прямим або розгалуженим ланцюгом, що містить від 1 до 3 атомів вуглецю. Приклади С 1-3 алкільних груп включають метил, етил, н-пропіл, ізопропіл. Термін "галоген", коли використовується в даному описі, стосується атома фтору, хлору, брому і йоду. Згідно з одним аспектом, термін "галоген", коли використовується в даному описі, стосується до атома фтору, хлору і брому. Термін "С1-3 алкокси", коли використовується в даному описі, стосується алкоксигрупи з прямим або розгалуженим ланцюгом, що містить від 1 до 3 атомів вуглецю. Приклади С 1-3 алкоксигруп включають метокси, етокси, пропокси і ізопропокси. Термін "сполука згідно з винаходом", коли використовується в даному описі, означає сполуку формули (I), її фармацевтично прийнятну сіль або N-оксид. Термін "сполука згідно з винаходом" означає будь-яку одну із сполук згідно з винаходом, як визначено вище. Крім того, буде зрозуміло, що такі фрази як "сполука формули (I), її фармацевтично прийнятна сіль або N-оксид" або "сполука згідно з винаходом", як це мається на увазі, включають сполуку формули (I), фармацевтично прийнятну сіль або N-оксид сполуки формули (I), або їх будь-яке фармацевтично прийнятне поєднання. Таким чином, як приклад, що використовується в даному описі для ілюстративної мети, але без обмеження, фраза "сполука формули (I), її фармацевтично прийнятна сіль або N-оксид" включає фармацевтично прийнятну сіль сполуки формули (I), яка представлена як сольват, або дана фраза може включати суміш сполуки формули (I) і солі сполуки формули (I). Буде додатково братися до уваги, що всі кристалічні форми, поліморфи і енантіомери сполук згідно з винаходом або їх суміші розглядаються як такі, що належать до галузі даного винаходу. За винятком особливо обумовлених випадків (наприклад, коли показана абсолютна стереохімія), для сполук згідно з винаходом, які містять стереоцентри і, отже, які можуть утворювати енантіомери, сполука містить суміш енантіомерів в співвідношенні 1:1, тобто являє собою рацемічну суміш енантіомерів. Енантіомери можуть розділятися з використанням стандартних способів, таких як хіральна ВЕРХ. Деякі сполуки згідно з даним винаходом можуть зазнавати кристалізації або перекристалізації з розчинників, таких як водні і органічні розчинники. У таких випадках можуть утворюватися сольвати. Даний винахід включає в своєму об'ємі стехіометричні сольвати, включаючи гідрати, а також сполуки, що містять змінні кількості води, які можуть бути отримані, наприклад, ліофілізацією. Оскільки сполуки формули (I) призначені для застосування в фармацевтичних композиціях, буде зрозуміло, що в особливих варіантах здійснення винаходу вони можуть бути отримані по суті в чистій формі, наприклад, з чистотою, щонайменше, 60 %, більш прийнятно з чистотою, щонайменше, 75 %, ще більш прийнятно з чистотою, щонайменше, 85 %, особливо прийнятно з чистотою, щонайменше, 98 % (% з розрахунку на масу відносно загальної маси). Неочищені препарати сполук можуть використовуватися для отримання більш чистих форм, що використовуються в фармацевтичних композиціях; ці менш чисті препарати сполук повинні містити, щонайменше, 1 %, більш прийнятно, щонайменше, 5 %, ще більш прийнятно від 10 до 59 % сполуки формули (I), її фармацевтично прийнятної солі або N-оксиду. 6 UA 102694 C2 5 10 15 20 25 Фармацевтично прийнятні солі сполук формули (I) включають кислотно-адитивні або чвертинні амонієві солі, наприклад, їх солі з мінеральними кислотами, такими як соляна, бромистоводнева, сірчана, азотна або фосфорна кислоти, або з органічними кислотами, такими як оцтова, фумарова, янтарна, малеїнова, лимонна, бензойна, п-толуолсульфонова, метансульфонова, нафталінсульфонова або винна кислоти. Згідно з одним аспектом винаходу, сіль сполуки формули (I) являє собою дигідрохлоридну сіль. Відповідно до іншого аспекту сіль сполуки формули (I) являє собою дигідрохлоридну сіль. Сполуки формули (I) також можуть бути отримані у вигляді N-оксиду. Винахід стосується всіх таких солей і N-оксидів. Отримання сполук У додаткових аспектах винаходу надані способи отримання сполук формули (I) і їх фармацевтично прийнятних солей або N-оксидів. Згідно з одним аспектом, прийнятний спосіб включає взаємодію між амінною сполукою формули (IIA) і сполукою формули (IIB). де 1 2 5 6 Z , Z , U, R і R і n набувають значень, визначених для формули (I), і W являє собою альдегідний фрагмент -CH=О, причому дана реакція являє собою реакцію відновного амінування, яка звичайно проводиться в присутності відновника, такого як боргідрид натрію, або W являє собою бромметильний фрагмент -CH2Br. Такі реакції можуть проводитись в органічному розчиннику, такому як ДХМ/MeOH, при температурі навколишнього середовища. Див., наприклад, Smith, M.B.; March, J.M. Advanced Organic Chemistry, Wiley-Interscience. Сполуки формули (IIA) в формі солі, наприклад в формі гідрохлоридної солі, можуть застосовуватися в даному способі для отримання сполук формули (I) в формі солі. Сполуки формули (IIA) можуть бути отримані відповідно до різних схем отримання. 1 2 Одна така схема, що підходить для отримання сполук, в яких Z являє собою CH і Z являє собою N, представлена нижче як схема (1). Схема (1) 7 UA 102694 C2 5 10 15 . (a) 2-аміно-1,3-пропандіол; (b) 2,2-диметоксипропан; п-толуолсульфонова кислота; (с) водень, паладій/вугілля; (d) етилбромацетат, K2CO3; (е) гідрид натрію; (f) бензилхлорформіат; (g) водний розчин кислоти; (h) ангідрид метансульфонової кислоти; (i) водень, паладій/вугілля; (j) MnO2; (k) 4-(N-трет-бутоксикарбоніламіно)піперидин, піридин; (1) HCl в 1,4-діоксані. Взаємодія нітропіридину (1) з 2-аміно-1,3-пропандіолом призводить до отримання діолу (2), в який потім вводиться захисна група з отриманням ацеталю (3). Відновлення нітрогрупи призводить до отримання аміну (4), який зазнає алкілування з отриманням складного ефіру (5). Циклізація може проводитися за допомогою гідриду натрію з отриманням (6). Даний продукт після введення захисної кароксибензильної (CBz) групи (7) зазнає розщеплення з отриманням діолу (8). Циклізація за допомогою ангідриду метансульфонової кислоти призводить до отримання мезилату (9), подальший гідрогеноліз CBz групи в якому приводить до (10) і потім окислення даного продукту за допомогою оксиду марганцю (II) призводить до отримання ключового проміжного діонного мезилату (11). Порядок стадій може змінюватися через отримання (7а). Взаємодія мезилату (11) з 4-(N-трет-бутоксикарбоніламіно)піперидином і подальше зняття захисту видаленням карбаматного фрагменту призводить до отримання цільової сполуки формули (IIA). 8 UA 102694 C2 5 10 15 20 25 Взаємодія альдегіду формули (IIB) може здійснюватися в присутності NaBH(OAc) 3 з отриманням сполуки формули (I). 1 2 Альтернативно, енантіомерно чисті сполуки формули (IIA), в яких Z являє собою СН і Z являє собою N, можна отримувати через хіральний мезилатний напівпродукт в енантіомерно чистій формі, як показано на схемі (1а) нижче: Схема (1а) . (a) EtOH, кип'ятіння зі зворотним холодильником; (b) TBS-Cl, (с) цинк, оцтова кислота; (d) етилбромацетат, K2CO3; е) NaH; (f) водень, паладій/вугілля; (g) MnO2; (h) ангідрид метансульфонової кислоти; (i) ТФОК; (j) ангідрид метансульфонової кислоти або бензолсульфонілхлорид. Взаємодія 2-хлор-6-(метилокси)-3-нітропіридину з хіральним аміном (2) призводить до отримання проміжного продукту (3). Введення захисної групи (3) за допомогою трет-бутилдиметилсилілхлориду призводить до отримання (4). Відновлення нітрогрупи призводить до отримання аміну (5), який зазнає алкілування з отриманням складного ефіру (6). Циклізація (6) може здійснюватися за допомогою гідриду натрію, і подальша обробка воднем над каталізатором паладій/вугілля призводить до отримання проміжного продукту (7). Окислення оксидом марганцю(II) і обробка ангідридом метансульфонової кислоти призводить до отримання (8). Видалення захисної групи з цього проміжного продукту може здійснюватися за допомогою ТФОК з отриманням (9), і взаємодія отриманої сполуки з ангідридом метансульфонової кислоти або бензолсульфонілхлоридом призводить до отримання (10) в формі енантіомерно чистої сполуки. Отриманий мезилат або бензолсульфонат (10) може потім зазнавати перетворення в амін формули (IIa) і, нарешті, в цільову сполуку формули (I), як загалом описано тут. 1 2 Іншою схемою, що підходить для отримання сполук, в яких Z являє собою N і Z являє собою СН, є схема (2), представлена нижче. Схема (2) 9 UA 102694 C2 5 10 15 20 . (a) NH3/MeOH; (b) водень; паладій/вугілля; (с) етилбромацетат, K 2CO3; (d) трет-бутоксид калію; (е) CBzCl; (f) NaH, (S)-гліцидилнозилат (g); ДМФА, нагрівання; (h) метансульфонілхлорид; (i) 4-(N-трет-бутоксикарбоніламіно)піперидин, піридин; (j) водень, паладій/вугілля, потім MnO 2; (k) HCl в 1,4-діоксані. Взаємодія нітропіридину (1) з аміаком призводить до отримання нітропіридину (2), який далі зазнає відновлення до біс-аніліну (3). Алкілування за допомогою етилбромацетату і подальша циклізація з використанням трет-бутоксиду натрію призводить до отримання (5). У даний продукт вводиться захисна карбоксибензильна група з отриманням (6), який потім зазнає взаємодії з (комерційно доступним) S-гліцидилнозилатом ((2S)-2-оксиранілметил-3нітробензолсульфонат) з отриманням (7). Циклізація при нагріванні призводить до отримання (8). Подальше мезилювання, заміщення 4-(N-трет-бутоксикарбоніламіно)піперидином, гідрогеноліз CBz групи (10), потім окислення оксидом марганцю(II) і видалення захисного карбаматного фрагмента призводить до отримання цільового аміну формули (IIa). Альтернативно, гідрогеноліз CBz групи (11), подальше окислення оксидом марганцю(II) і далі мезилювання, заміщення 4-(N-трет-бутоксикарбоніламіно)піперидином і видалення захисної групи також призводить до отримання сполуки формули (IIa). Дана сполука може зазнавати перетворення в сполуку формули (I), як загалом описано в даному винаході. 1 2 Іншою схемою, що підходить для синтезу сполук, в яких Z і Z являють собою СН, є схема (3), представлена нижче. Схема (3) 10 UA 102694 C2 5 10 15 20 . На стадії (a) триметилацетамід може зазнавати взаємодії з 2-хлор-6-(метилокси)піридином. На стадії (b) продукт стадії (a) може зазнавати обробки н-бутиллітієм і 1,2-диброметаном. Продукт даної стадії (b) може оброблятися на стадії (с) н-бутилакрилатом. Гідрування в присутності паладію-на-вугіллі на стадії (d) може призводити до отримання гідрованого продукту. Продукт стадії (d) може зазнавати циклізації на стадії (е) з отриманням 3,4-дигідро1,8-нафтиридин-2(1H)-ону обробкою соляною кислотою. На стадії (f) оксиран може бути отриманий взаємодією з гідридом натрію і потім з (2S)-2-оксиранілметил-3нітробензолсульфонатом. Циклізацію з отриманням імідазонафтиридину можна здійснювати за допомогою нагрівання оксирану або за допомогою мікрохвильового опромінення. Стадія (h), внаслідок якої відбувається приєднання 4-(N-трет-бутоксикарбоніламіно)піперидинового фрагмента, може проводитися за допомогою утворення метансульфонату і потім взаємодією з відповідним аміном. Ароматизація циклу на стадії (i) може проводитися обробкою DDQ з подальшим нагріванням. Після цього захисна група амінної групи може віддалятися з використанням кислотного гідролізу на стадії (j) з отриманням аміну (IIA), який може потім зазнавати взаємодії із сполукою формули IIB, наприклад, з альдегідом, з утворенням сполуки формули (I). В іншому аспекті прийнятний спосіб отримання сполук формули (I) включає взаємодію між сполукою формули (IIC) і сполукою формули (IID): , 1 2 5 6 де Z , Z , U, R і R і n набувають значень, визначених для формули (I), і В являє собою бензолсульфонільний фрагмент. Сполуки формули (IID) можуть бути отримані, наприклад, із сполук формули (IIB), як описано вище, взаємодією із сполукою формули (IIE): 11 UA 102694 C2 5 10 15 20 25 30 35 40 45 50 з подальшим видаленням захисної ВОС-групи амінного фрагмента. Прикладом такої схеми синтезу через сполуки формули (IIC) і (IID) є схема 4, представлена нижче, де сполука формули (IIC) може бути отримана, як показано на схемі (1а). Схема (4) Сольові форми сполук формули (I) і (IA), наприклад гідрохлориди, можуть бути отримані обробкою відповідних вільних основ кислотою, такою як соляна кислота, або при отриманні сполук в присутності такої кислоти. 5 Велика кількість реагентів формули (IIB), що містять необхідну групу R і необов'язкову групу 6 R , є відомими в даній галузі сполуками (див., наприклад, комерційні джерела, вказані в таблиці 1) або можуть бути отримані аналогічно відомим сполукам (див., наприклад, WO02/08224, WO02/50061, WO02/56882, WO02/96907, WO2003087098, WO2003010138, WO2003064421, WO2003064431, WO2004002992, WO2004002490, WO2004014361, WO2004041210, WO2004096982, WO2002050036, WO2004058144, WO2004087145, WO06002047, WO06014580, WO06010040, WO06017326, WO06012396, WO06137485, WO06017468, WO06020561 і EP0559285). Використання вказаних схем, альтернативних реагентів для отримання альтернативних 2 5 6 замісників, таких як R , R , R і т. д. буде зрозуміле фахівцеві в даній галузі техніки. Додаткові подробиці отримання сполук формули (I) представлені в наведених далі прикладах. Препарати і способи введення Бактерицидні і/або протитуберкульозні сполуки згідно з даним винаходом можуть бути введені в препарати для введення для застосування в охороні здоров'я або ветеринарії будьяким зручним способом, аналогічним для інших бактерицидних або протитуберкульозних сполук. Фармацевтичні композиції згідно з винаходом включають фармацевтичні композиції в формі, адаптованій для перорального, місцевого або парентерального застосування і можуть застосовуватися для лікування бактерійних інфекцій або інфекцій Mycobacterium tuberculosis у ссавців, включаючи людей. Сполуки можуть бути введені в препарат для введення будь-яким способом, що підходить для протибактеріального і/або протитуберкульозного терапевтичного лікування. Композиції можуть бути в формі таблеток, капсул, порошків, гранул, пастилок, кремів або рідких препаратів, таких як стерильні розчини або суспензії для перорального або парентерального введення. Препарати для місцевого введення згідно з даним винаходом можуть бути представлені, наприклад, у вигляді мазей, кремів або лосьйонів, очних мазей або очних або вушних крапель, імпрегнованих перев'язочних матеріалів і аерозолів, і можуть містити прийнятні стандартні добавки, такі як консерванти, розчинники для сприяння проникненню лікарських засобів, і пом'якшувачі в мазях і кремах. Препарати також можуть містити сумісні стандартні носії, такі як основи для кремів і мазей і етанол або олеїновий спирт для лосьйонів. Такі носії можуть бути присутніми в препараті в кількості, що складає від приблизно 1 % до приблизно 98 % препарату. Частіше вони будуть становити приблизно 80 % препарату. Препарати для перорального введення можуть являти собою, наприклад, таблетки або капсули лікарської форми стандартної дози і можуть містити традиційні наповнювачі, такі як зв'язувальні агенти, наприклад, сироп, гуміарабік, желатин, сорбіт, трагакант або полівінілпіролідон; заповнювачі, наприклад, лактозу, цукор, кукурудзяний крохмаль, фосфат кальцію, сорбіт або гліцин; мастильні речовини для виробництва таблеток, наприклад стеарат магнію, тальк, поліетиленгліколь або діоксид кремнію; дезінтегруючі агенти, наприклад кукурудзяний крохмаль; або прийнятні змочувальні агенти, такі як натрійлаурилсульфат. 12 UA 102694 C2 5 10 15 20 25 30 35 40 45 50 55 60 Таблетки можуть бути покриті оболонкою відповідно до методів, добре відомих в традиційній фармацевтичній практиці. Препарати для перорального введення також можуть бути представлені в рідкій формі, наприклад, в формі водних або масляних суспензій, розчинів, емульсій, сиропів або еліксирів, або можуть бути представлені в формі сухого продукту для змішування з водою або іншим прийнятним розріджувачем перед застосуванням. Такі рідкі препарати можуть містити стандартні добавки, такі як суспендуючі агенти, наприклад, сорбіт, метилцелюлозу, сироп глюкози, желатин, гідроксіетилцелюлозу, карбоксиметилцелюлозу, гель стеарату алюмінію або здатні зазнавати гідрування харчові жири; емульгатори, наприклад, лецитин, сорбітанмоноолеат або гуміарабік; неводні розріджувачі (які можуть включати харчові масла), маслянистий складний ефір, такий як гліцерин, пропіленгліколь, або етиловий спирт; консерванти, наприклад, метил- або пропіл-п-гідроксибензоат або сорбінову кислоту, і, якщо треба, традиційні добавки, що поліпшують смак, або барвники. Супозиторії будуть містити традиційні основи для супозиторіїв, наприклад, масло какао або інший гліцерид. Лікарські форми стандартної дози для парентерального введення отримують з використанням сполуки і стерильного розріджувача, причому переважним розріджувачем є вода. Сполука, в залежності від розріджувача і концентрації, що використовується, може суспендуватися або розчинятися в розріджувачі. При приготуванні розчинів сполука може розчинятися у воді для ін'єкції і стерилізуватися фільтруванням перед заповненням отриманим розчином відповідного пухирця або ампули і герметизацією. Переважно, в розріджувачі можуть розчинятися такі добавки, як місцеві анестетики, консерванти і буферні агенти. Для підвищення стабільності композиція може зазнавати заморожування після її внесення в пухирець і видалення води у вакуумі. Сухий ліофілізований порошок після цього герметично закривається в пухирці і одночасно може постачатися пухирець води для ін'єкції для відновлення рідини перед застосуванням. Суспензії для парентерального введення отримують по суті таким же чином, але з тією відмінністю, що сполука не розчиняється, а суспендується в розріджувачі, і стерилізація може проводитися не під час фільтрації. Сполука може стерилізуватися за допомогою витримування в етиленоксиді перед суспендуванням в стерильному розріджувачі. Переважно, для сприяння однорідному розподілу сполуки в препараті в композицію включається поверхнево-активна речовина або змочувальний агент. В залежності від способу введення композиції можуть містити 0,1 % по масі, переважно від 10 до 60 % по масі сполуки згідно з винаходом. Коли композиція включає лікарські форми стандартних доз, кожна стандартна доза буде переважно містити від 25 до 1000 мг активного інгредієнта. Дозування при застосуванні для лікування дорослих людей буде переважно знаходитися в інтервалі від 100 до 3000 мг на день, наприклад, 1500 мг на день, в залежності від способу і частоти введення. Відповідне дозування складає від 5 до 30 мг/кг на добу. Сполука формули (I), її фармацевтично прийнятна сіль або N-оксид може бути єдиним терапевтичним засобом в композиціях згідно з винаходом, або вона може бути присутньою в препараті в поєднанні з одним або декількома додатковими терапевтичними засобами. Таким чином, винахід надає в додатковому аспекті комбінацію, що включає сполуку формули (I), її фармацевтично прийнятну сіль або N-оксид разом з одним або декількома додатковими терапевтичними засобами. Додатковий терапевтичний засіб, згаданий вище, являє собою, наприклад, лікарський засіб, застосовний для лікування туберкульозу у ссавця. Приклади таких терапевтичних засобів включають ізоніазид, етамбутол, рифампін, піразинамід, стрептоміцин, капреоміцин, ципрофлоксацин і клофазимін. Коли сполука формули (I), її фармацевтично прийнятна сіль або N-оксид застосовується в комбінації з одним або декількома додатковими терапевтичними засобами, доза сполуки або лікарського засобу може відрізнятися від тієї дози, яка застосовується при введенні однієї сполуки або лікарського засобу. Відповідні дози будуть легко підбиратися фахівцем даної галузі техніки. Потрібно представляти, що кількість сполуки згідно з винаходом і одного або декількох додаткових терапевтичних засобів, необхідних для застосування в лікуванні, буде змінюватися в залежності від природи стану, що підлягає лікуванню, і віку і стану пацієнта і буде, в кінцевому результаті, визначатися лікуючим лікарем або ветеринаром. Комбінації можуть бути зручно представлені для застосування в формі фармацевтичного препарату. У додатковому аспекті даного винаходу надана фармацевтична комбінація, що включає сполуку формули (I), її фармацевтично прийнятну сіль або N-оксид разом з одним або декількома додатковими терапевтичними засобами і один або декілька фармацевтично 13 UA 102694 C2 5 10 15 20 25 прийнятних носіїв, наповнювачів або розріджувачів. Окремі компоненти таких комбінацій можуть вводитися послідовно або одночасно в роздільних або об'єднаних фармацевтичних препаратах за допомогою традиційного способу введення. Коли введення є послідовним, сполука згідно з даним винаходом або один або декілька додаткових терапевтичних засобів може вводитися першим. Коли введення є одночасним, комбінація може вводитися або в одній фармацевтичній композиції, або в різних фармацевтичних композиціях. Потрібно представляти, що при введенні в одному препараті сполука і інші лікарські засоби повинні бути стабільними і сумісними з кожним іншим і іншими компонентами препарату. При введенні в роздільних препаратах сполука згідно з винаходом і інші лікарські засоби можуть бути надані в будь-якому зручному препараті, традиційно такому, які відомі для таких сполук в даній галузі техніки. Сполука формули (I) може являти собою єдиний терапевтичний засіб в композиціях згідно з винаходом або представляти одну сполуку з комбінації з одним іншими або декількома бактерицидними і/або протитуберкульозними сполуками. Якщо інший бактерицидний засіб являє собою -лактам, тоді може також застосовуватися інгібітор -лактамази. Сполуки формули (I) також можуть застосовуватися в лікуванні бактерійних інфекцій, що викликаються широким спектром організмів, включаючи грамнегативні і грампозитивні організми. Деякі сполуки формули (I) можуть бути активними у відношенні більш ніж одного організму. Це може визначатися способами, описаними в даному винаході. Всі публікації, включаючи, але без обмеження, патенти і заявки на патенти, згадані в даному описі, введені в опис у вигляді посилання, як якби кожна окрема публікація була конкретно і окремо вказана для введення у вигляді посилання у всій її повноті. Наведені далі приклади ілюструють отримання деяких сполук формули (I) і активність деяких сполук формули (I) відносно різних бактерійних організмів і організмів, які відомі як такі, що викликають туберкульоз. Приклади і експериментальна частина Абревіатури, що використовуються: AcOH Ac2O Bn ВОС ВОС ангідрид CH3СN CBz Celite® CF3TMS DME ДХМ DDQ DIBAL-H ДМФА ДМСО-d6 ДМСО ES МС EtOAc EtOH Et3N год. Оцтова кислота Оцтовий ангідрид Бензил N-трет-бутоксикарбоніл Ди-трет-бутилдикарбонат Ацетонітрил Карбобензил Допоміжна фільтруюча добавка, що складається з діатомового діоксиду кремнію (торгова марка Manville Corp., Denver, Colorado) (Трифторметил)триметилсилан Диметоксіетан Дихлорметан 2,3-Дихлор-5,6-диціано-1,4-бензохінон (реагент атомаризації) Гідрид діізобутилалюмінію Диметилформамід Дейтерований диметилсульфоксид Диметилсульфоксид Електророзпилювальна масспектрометрія Етилацетат Етанол Триетиламін години 14 UA 102694 C2 Високоефективна рідинна хроматографія Рідинна хроматографічна масРХМС спектроскопія MeOH Метанол Макропористий MPтриетиламонійметилполістиролкарбокарбонат нат (Argonaut Technologies) MsМетансульфоніл (мезил) NaBH(OAc)3 Триацетоксиборгідрид натрію NMP N-метилпіролідон (розчинник) Спектроскопія ядерно-магнітного ЯМР резонансу АсО Ацетокси Pd/С Каталізатор - паладій-на-вугіллі Pd2(dba)3 Трис-(дибензиліденацетон)дипаладій rt Кімнатна температура Являє собою іонообмінну колонку, що SCX містить міцну катіонообмінну смолу Cartridge (бензолсульфонова кислота), доступна від Varian, USA TBS-Cl Трет-бутилдиметилсилілхлорид ТВМЕ Простий метил-трет-бутиловий ефір ТФОК Трифтороцтова кислота ТГФ Тетрагідрофуран УФ Ультрафіолетове випромінювання ВЕРХ 5 10 15 20 25 Записують спектри протонного ядерного магнітного резонансу і хімічні зсуви в нижню область фіксують в частинах на мільйон (δ) відносно тетраметилсилану (ТМС), який використовується як внутрішній стандарт. Абревіатури, що використовуються для даних ЯМР, мають наступні значення: с = синглет, д = дуплет, т = триплет, кв. = квартет, м = мультиплет, дд = дуплет дуплетів, дт = дуплет триплетів, арр = уявний, уш. = уширений. Мас-спектри отримують з використанням методів електророзпилювальної (ES) іонізації. Всі температури наводяться в градусах Цельсію. Фахівцеві даної галузі техніки зрозуміло, що посилання на синтез, що проводиться аналогічним чином або відповідно до загального способу, інші способи отримання можуть включати зміну звичайних параметрів, таких як тривалість реакції, температура, умови обробки, незначні зміни в кількостях реагентів і т. д. Реакції, в яких задіяні гідриди металів, включаючи гідрид літію, алюмогідрид літію, гідрид діізобутилалюмінію, гідрид натрію, боргідрид натрію і триацетоксиборгідрид натрію, проводяться в атмосфері аргону. Експериментальні приклади, представлені нижче, отримання сполук, позначених як сполуки прикладів 1, 2, 9, 11, 12, 17, 51, 59, 60, 71 і 75, представлені як типові приклади сполук згідно з даним винаходом і різних схем отримання, описаних в даному винаході. Інші сполуки згідно з даним винаходом, отримані аналогічними способами, представлені в таблиці 1. Приклад сполуки 1: Синтез гідрохлориду (1R)-1-[(4-{[(5-хлор-6-метил-3піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин4,9-діону згідно зі схемою отримання (3) (a) 2,2-Диметил-N-[6-(метилокси)-2-піридиніл]пропанамід Суспензію триметилацетаміду (18,08 г, 178,744 ммоль), Cs 2CO3 (68,823 г, 211,242 ммоль), Pd2(dba)3 (1,488 г, 1,625 ммоль) і Xantphos (4,5-біс-(дифенілфосфіно)-9,9-диметилксантен) 15 UA 102694 C2 5 10 15 20 25 30 35 40 45 50 55 (1,880 г, 3,249 ммоль) в сухому дегазованому 1,4-діоксані (800 мл) в атмосфері аргону обробляють ультразвуком протягом 0,25 год. і потім 2-хлор-6-(метилокси)піридин (19,32 мл, 162,494 ммоль). Після цього суміш кип'ятять зі зворотним холодильником протягом 24 годин. Суміш упарюють, обробляють водою (1 л) і тричі екстрагують ДХМ (1 л, потім 2500 мл). Об'єднані органічні шари сушать (MgSO4), упарюють і хроматографують (елюювання: 50-100 % ДХМ/40-60 петролейний ефір, потім 0-5 % MeOН/ДХМ), отримуючи вказану в заголовку сполуку у вигляді твердої речовини жовтого кольору (25,191 г, 121,111 ммоль, 75 %). Фракції, що містять забруднюючі домішки, знов хроматографують на колонці (елюювання як описано вище), отримуючи додаткову кількість продукту (4,990 г, 23,990 ммоль, 15 %). Загальний вихід 90 %. + [ES МС] m/z 209 (MH , 100 %). (b) N-[3-Бром-6-(метилокси)-2-піридиніл]-2,2-диметилпропанамід Розчин 2,2-диметил-N-[6-(метилокси)-2-піридиніл]пропанаміду (55,011 г, 264,467 ммоль) в ТГФ (450 мл) в тригорлій колбі об'ємом 1 л, забезпеченій зовнішнім термометром, в атмосфері аргону охолоджують до -78С і протягом 15 хвилин обробляють н-бутиллітієм (232 мл, 581,847 ммоль), потім розчину дають можливість нагрітися до 0С і перемішують розчин при 0С протягом 7 годин. Після цього суміш знов охолоджують до -78С, обробляють протягом 10 хвилин 1,2-диброметаном (27,3 мл, 317 ммоль), потім розчину дають можливість нагрітися до кімнатної температури і перемішують при кімнатній температурі протягом 30 хвилин, в процесі чого весь твердий продукт, який утворився, знов розчиняється. На даній стадії відбувається виділення газу, тому до одного з трьох горл колби приєднують барботер. Потім обережно протягом 10 хвилин додають воду (100 мл). Після цього додають додаткову кількість води (500 мл) і суміш екстрагують Et2O (3500 мл). Після цього об'єднані органічні розчинники сушать (MgSO4), фільтрують, випарюють, отримуючи сирий продукт. Отриманий продукт розчиняють в теплому EtOAc (100 мл) і залишають на ніч в холодильнику. Отриманий твердий продукт, який випадає у вигляді кристалів, відфільтровують, промивають охолодженим на крижаній бані Et 2O (20 мл) і сушать у вакуумі, отримуючи продукт у вигляді твердої білої речовини (45,660 г, 159,011 ммоль, 60 %). Фільтрат упарюють і залишок хроматографують (елюювання: 0-25 % EtOAc/40-60 петролейний ефір), отримуючи очищену вихідну речовину (7,264 г, 34,9 ммоль) і продукт у вигляді твердої білої речовини (8,038 г, 27,992 ммоль, 10 %). Продукт перекристалізації і хроматографії ідентифікують за допомогою ЯМР і РХ-МС і об'єднують. + [ES МС] m/z 287/289 (MH , 100 %). (с) Бутил-(2E)-3-[2-[(2,2-диметилпропаноїл)аміно]-6-(метилокси)-3-піридиніл]-2-пропеноат Суміш N-[3-бром-6-(метилокси)-2-піридиніл]-2,2-диметилпропанаміду (78,738 г, 274 ммоль), біс(три-трет-бутилфосфін)паладію(0) (1 г, 1,957 ммоль) і трис(дибензиліденацетон)дипаладію(0) (0,892 г, 0,974 ммоль) в сухому дегазованому 1,4-діоксані (600 мл) обробляють нбутилакрилатом (47,1 мл, 329 ммоль) і дициклогексилметиламіном (64,5 мл, 302 ммоль). Реакційну суміш нагрівають до 80С протягом 4 годин і потім до 120С протягом 3 годин. Потім реакційну суміш упарюють, додають воду (1000 мл) і суміш екстрагують Et 2O (3500 мл). Об'єднані органічні розчинники сушать (MgSO 4), фільтрують, випарюють, отримуючи сирий продукт. Продукт розчиняють в ДХМ (300 мл), хроматографують (елюювання: 10-30 % EtOAc:40-60 петролейний ефір) і потім сушать у вакуумі, отримуючи продукт у вигляді твердої білої речовини (87,412 г, 95 %). + [ES МС] m/z 335 (MH , 100 %). (d) Бутил-3-[2-[(2,2-диметилпропаноїл)аміно]-6-(метилокси)-3-піридиніл]пропаноат Розчин бутил-(2E)-3-[2-[(2,2-диметилпропаноїл)аміно]-6-(метилокси)-3-піридиніл]-2пропеноату (43,706 г, 131 ммоль) в етанолі (450 мл) в атмосфері аргону при кімнатній температурі обробляють паладієм-на-вугіллі (10 % паста) (5,0 г, 47,0 ммоль) і потім перемішують при кімнатній температурі в атмосфері водню з тиском 1 атмосфера (101325 Па) протягом 90 годин. Після цього реакційну суміш фільтрують через тонкий шар кізельгуру, промиваючи продукт додатковою кількістю етанолу (200 мл). Потім розчинник випарюють, отримуючи продукт у вигляді твердої речовини жовтого кольору (43,549 г, 99 %). + [ES МС] m/z 337 (MH , 100 %). (е) 7-(Метилокси)-3,4-дигідро-1,8-нафтиридин-2(1H)-он Суміш бутил-3-[2-[(2,2-диметилпропаноїл)аміно]-6-(метилокси)-3-піридиніл]пропаноату (86,01 г, 256 ммоль) і соляної кислоти (500 мл, 3000 ммоль) (6M, водний розчин) нагрівають до 80С і витримують при даній температурі протягом 6 годин. Реакційний розчин охолоджують, обробляють водою (500 мл), переносять в конічну колбу об'ємом 5 л і обережно нейтралізують твердим K2CO3 (потрібно приблизно 250 г) (спостерігають енергійне піноутворення). Після цього суміш екстрагують 20 % MeOН/ДХМ (3500 мл). Потім об'єднані органічні шари сушать (MgSO 4), 16 UA 102694 C2 5 10 15 20 25 30 35 40 45 50 55 фільтрують, упарюють, отримуючи сирий продукт у вигляді твердої речовини жовтого кольору (35,84 г, 79 %). + [ES МС] m/z 179 (MH , 100 %). (f) 7-(Метилокси)-1-[(2R)-2-оксиранілметил]-3,4-дигідро-1,8-нафтиридин-2(1H)-он Розчин 7-(метилокси)-3,4-дигідро-1,8-нафтиридин-2(1H)-ону (4,974 г, 27,9 ммоль) в ДМФА (100 мл) при 0С в атмосфері аргону обробляють гідридом натрію (60 %, 1,340 г, 33,5 ммоль) і отриману суміш перемішують при 0С протягом 20 хвилин. Реакційну суміш після цього обробляють (2S)-2-оксиранілметил-3-нітробензолсульфонатом (7,60 г, 29,3 ммоль), потім дають можливість суміші повільно нагрітися до кімнатної температури і перемішують суміш при кімнатній температурі протягом 1 години. Додають воду (5 мл). Реакційну суміш упарюють, додають насичений водний розчин NaHCO3 (500 мл) і суміш екстрагують ДХМ (3500 мл). Після цього об'єднані органічні шари сушать (MgSO4), фільтрують, упарюють, отримуючи сирий продукт. + [ES МС] m/z 235 (MH , 100 %). (g) (1S)-1-(Гідроксиметил)-1,2,5,6-тетрагідро-4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діон Розчин 7-(метилокси)-1-[(2R)-2-оксиранілметил]-3,4-дигідро-1,8-нафтиридин-2(1H)-ону (1,167 г, 4,98 ммоль) в ДМФА (20 мл) в атмосфері аргону нагрівають до 120С і витримують при даній температурі протягом 6 годин. Після цього реакційну суміш упарюють і хроматографують (елюювання: 0-20 % MeOН/ДХМ), отримуючи продукт у вигляді твердої речовини оранжевого кольору (339 мг, 31 %). + [ES МС] m/z 221(MH , 100 %). Альтернативно, реакційну суміш можна обробляти СВЧ при 160С протягом 40 хвилин. (h) 1,1-Диметилетил-(1-{(2R)-4,9-діоксо-1,2,8,9-тетрагідро-4H,7H-імідазо[1,2,3-ij]-1,8нафтиридин-2-іл]метил}-4-піперидиніл)карбамат Розчин (1S)-1-(гідроксиметил)-1,2,5,6-тетрагідро-4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9діону (1,909 г, 8,67 ммоль) в ДХМ (100 мл) при 0С в атмосфері аргону обробляють Et3N (1,450 мл, 10,40 ммоль) і потім метансульфонілхлоридом (0,743 мл, 9,54 ммоль), після цього дають можливість суміші нагрітися до кімнатної температури і перемішують при кімнатній температурі протягом 1 години. Реакційну суміш обробляють насиченим водним розчином NaHCO3 (100 мл) і екстрагують ДХМ (2100 мл). Після цього об'єднані органічні шари сушать (MgSO 4), фільтрують, упарюють, отримуючи сирий напівпродукт [(2S)-4,9-діоксо-1,2,8,9-тетрагідро-4H, 7H-імідазо[1,2,3-ij]-1,8-нафтиридин-2-іл]метилметансульфонат. Отриманий проміжний продукт розчиняють в сухому CH3CN (100 мл), обробляють піридином (1,402 мл, 17,34 ммоль) і 1,1диметилетил 4-піперидинілкарбаматом (3,47 г, 17,34 ммоль), нагрівають до 70С і витримують при даній температурі протягом 20 годин. Після цього додають додаткову кількість 1,1диметилетил-4-піперидинілкарбамату (3,47 г, 17,34 ммоль) і піридину (1,402 мл, 17,34 ммоль), суміш нагрівають до температури утворення флегми (нагрівання зупиняють при 95C) і реакційну суміш перемішують при даній температурі протягом додаткових 4 годин. Реакційну суміш упарюють, обробляють насиченим водним розчином NaHCO 3 (200 мл) і отриману суміш екстрагують ДХМ (3200 мл). Після цього об'єднані органічні шари сушать (MgSO 4), фільтрують, упарюють, отримуючи сирий продукт у вигляді твердої речовини коричневого кольору. + [ES МС] m/z 403 (MH , 100 %). (i) 1,1-Диметилетил-(1-{[(1R)-4,9-діоксо-1,2-дигідро-4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин-1іл]метил}-4-піперидиніл)карбамат Розчин 1,1-диметилетил-(1-{[(2R)-4,9-діоксо-1,2,8,9-тетрагідро-4H,7H-імідазо[1,2,3-ij]-1,8нафтиридин-2-іл]метил}-4-піперидиніл)карбамату (5,710 г, 14,19 ммоль) в 1,4-діоксані (50 мл) при кімнатній температурі обробляють DDQ (4,83 г, 21,28 ммоль), потім нагрівають до 120С і витримують при даній температурі протягом 1 години. Після цього реакційну суміш охолоджують до кімнатної температури. Реакційну суміш обробляють насиченим водним розчином K2CO3 (5 %, 1000 мл) і екстрагують ДХМ (3500 мл). Об'єднані органічні шари сушать (MgSО4), фільтрують, упарюють, отримуючи сирий продукт у вигляді твердої речовини коричневого кольору. Реакцію повторюють, використовуючи додаткову порцію карбамату (2,889 г, 7,18 ммоль) в 1,4-діоксані (50 мл) і DDQ (2,444 г, 10,77 ммоль). Після завершення реакції отриману реакційну суміш обробляють як описано вище, і об'єднані залишки хроматографують (елюювання: 0-100 % EtOAc:40-60 петролейний ефір, потім 0-20 % MeOН:EtOAc), отримуючи продукт у вигляді твердої речовини коричневого кольору (1,532 г, 18 %). + [ES МС] m/z 401(MH , 100 %). (j) (1R)-1-[(4-Аміно-1-піперидиніл)метил]-1,2-дигідро-4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин4,9-діон 17 UA 102694 C2 5 10 15 20 25 30 35 40 45 Розчин 1,1-диметилетил-(1-{[(1R)-4,9-діоксо-1,2-дигідро-4H,9H-імідазо[1,2,3-ij]-1,8нафтиридин-1-іл]метил}-4-піперидиніл)карбамату (1,532 г, 3,83 ммоль) в хлороформі (20 мл) в атмосфері аргону при кімнатній температурі обробляють 4M розчином HCl в 1,4-діоксані (10 мл, 40,0 ммоль) і перемішують при кімнатній температурі протягом 0,25 год. Після цього додають MeOH (20 мл) і реакційну суміш перемішують протягом додаткових 0,25 год. Потім реакційну суміш упарюють і розтирають з Et2O (20 мл). Отриману тверду речовину сушать у вакуумі, отримуючи сирий продукт у вигляді твердої речовини коричневого кольору (1,443 г, 101 %). [ES МС] m/z 301(MH+, 100 %). Дигідрохлорид 1-[(4-аміно-1-піперидиніл)метил]-1,2-дигідро-4H,9H-імідазо[1,2,3-ij]-1,8нафтиридин-4,9-діону, отриманий відповідно до даної загальної методики (приклад 5(a)-(j)), аналізують за допомогою хіральної ВЕРХ (Chiralpak AS-H (5 мікрон)) і виявляють єдиний енантіомер, який, приблизно, являє собою R-енантіомер. Сирий дигідрохлорид розчиняють в MeOH і воді (1 мл) і вносять в SCX колонку (20 г) (заздалегідь оброблену МеОН, об'єм якого дорівнює двом об'ємам колонки). Після цього колонку елююють (під дією сили тяжіння), використовуючи (i) MeOH, (ii) 0,5 M розчин аміаку в MeOH. Відповідні фракції об'єднують і упарюють при зниженому тиску, отримуючи 1,0 г (88 %) вказаної в заголовку сполуки у вигляді твердої речовини бежевого кольору. (k) Цільова сполука: Гідрохлорид (1R)-1-[(4-{[(5-хлор-6-метил-3-піридин)метил]аміно}-1піперидиніл)метил]-1,2-дигідро-4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону Розчин (1R)-1-[(4-аміно-1-піперидиніл)метил]-1,2-дигідро-4H, 9H-імідазо[1,2,3-ij]-1,8нафтиридин-4,9-діону (119 мг, 0,396 ммоль) і 5-хлор-6-метил-3-піридинкарбальдегіду (синтез див. в WO2006/137485 Al - приклад 256) (61,6 мг, 0,396 ммоль) в суміші ДХМ (1,5 мл) і MeOH (1,5 мл) перемішують при кімнатній температурі протягом 2 годин. Потім додають NaBH(OAc) 3 (252 мг, 1,189 ммоль) і отриману суміш перемішують при кімнатній температурі. Хід реакції контролюють за допомогою РХМС і, коли спостерігають повну конверсію, реакцію гасять 10 % NaHCO3 і суміш екстрагують ДХМ. Органічний шар сушать (MgSO 4), фільтрують і концентрують. Очищення флеш-хроматографією (Flashmaster II; картридж: силікагель, 5 г; елюювання: суміші ДХМ і MeOH) призводить до отримання 88 мг (0,2 ммоль, 51 %) очікуваного продукту в формі вільної основи. 1 H-ЯМР (δ, м.ч., CDCl3): 8,29 (д, 1H), 7,66 (д, 1H), 7,48 (дд, 2H), 6,27 (дд, 2H), 5,00-4,96 (м, 1H), 4,56 (дд, 1H), 4,37 (дд, 1H), 3,76 (с, 2H), 3,10 (дд, 1H), 2,96-2,91 (м, 1H), 2,67 (дд, 2H), 2,59 (с, 3H), 2,54-2,48 (м, 1H), 2,30-2,17 (м, 2H), 1,90-1,81 (м, 2H), 1,47-1,31 (м, 2H). [ES МС] m/z 440 + (MH ). Отриману вільну основу розчиняють в MeOH (9 мл). До розчину по краплях додають HCl (4M розчин в 1,4-діоксані, 0,050 мл, 0,2 ммоль). Суміш перемішують при кімнатній температурі протягом 20 хвилин і розчинник випарюють, використовуючи МеОН і гексан як допоміжні розчинники для видалення діоксану. Гідрохлорид (1R)-1-[(4-{[(5-хлор-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2дигідро-4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону (92,5 мг, 0,194 ммоль, 49,0 %) отримують у вигляді твердої не зовсім білої речовини. 1 H-ЯМР (δ, м.ч., CDCl3+CD3OD): 8,33 (д, 1Н), 8,05 (д, 1Н), 7,53 (д, 1Н), 7,52 (д, 1Н), 6,28 (д, 1Н), 6,24 (д, 1Н), 5,05-4,93 (м, 1Н), 4,48 (дд, 1Н), 4,35 (дд, 1Н), 3,99 (с, 2Н), 3,07 (дд, 1H), 3,032,78 (м, 2H), 2,77-2,62 (м, 2H), 2,58 (с, 3H), 2,37-2,17 (м, 2H), 2,12-1,97 (м, 2H), 1,70-1,46 (м, 2H). + [ES МС] m/z 440 (MH ). Приклад 1A: Синтез сполуки прикладу 1 - гідрохлориду (1R)-1-[(4-{[(5-хлор-6-метил-3піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-4H, 9H-імідазо[1,2,3-ij]-1,8-нафтиридин4,9-діону через сольову форму сполуки формули (IIA) 18 UA 102694 C2 5 10 15 20 25 30 35 40 45 50 (i) Дигідрохлорид (1R)-1-[(4-аміно-1-піперидиніл)метил]-1,2-дигідро-4H,9H-імідазо[123-ij]-1,8нафтиридин-4,9-діону Розчин 1,1-диметилетил-(1-{[(1R)-4,9-діоксо-1,2-дигідро-4H,9H-імідазо[1,2,3-ij]-1,8нафтиридин-1-іл]метил}-4-піперидиніл)карбамату (см. приклад 1(i) вище) (4,282 г, 10,69 ммоль) в СНCl3 (20 мл) в атмосфері Ar при кімнатній температурі обробляють HCl (4M розчин в 1,4діоксані, 20 мл, 80 ммоль) і отриману суміш перемішують при кімнатній температурі протягом 15 хвилин, після цього додають MeOH (20 мл). Реакційну суміш перемішують протягом 15 хвилин, потім упарюють і залишок розтирають з Et2O (20 мл). Отриману тверду речовину сушать у вакуумі, отримуючи дигідрохлорид {1R)-1-[(4-аміно-1-піперидиніл)метил]-1,2-дигідро-4H,9Hімідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону (4,55 г, 12,21 ммоль, 100 %) у вигляді порошку жовтого + кольору. [ES МС] m/z 301 (MH ). (ii) Цільова сполука: Гідрохлорид (1R)-1-[(4-{[(5-хлор-6-метил-3-піридиніл)метил]аміно}-1піперидиніл)метил]-1,2-дигідро-4H, 9H-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону Розчин дигідрохлориду (1R)-1-[(4-аміно-1-піперидиніл)метил]-1,2-дигідро-4H,9Hімідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону (63,3 мг, 0,170 ммоль) і Et3N (0,022 мл, 0,154 ммоль) в СНCl3 (3 мл) перемішують при кімнатній температурі протягом 15 хвилин, після цього до суміші додають 5-хлор-6-метил-3-піридинкарбальдегід (синтез див. в WO20006/137485 Al, приклад 256) (24 мг, 0,154 ммоль). Отриману реакційну суміш перемішують при кімнатній температурі протягом 1 години, потім додають NaBH(OAc)3 (98 мг, 0,463 ммоль) і отриману суміш перемішують при кімнатній температурі протягом ночі. Хід реакції контролюють за допомогою РХМС, коли спостерігають повну конверсію, реакцію гасять 10 % NaHCO3 і суміш декілька разів екстрагують ДХМ. Органічний шар сушать (MgSO 4), фільтрують і концентрують. Очищення флеш-хроматографією (картридж: силікагель, 5 г; елюювання: суміші ДХМ і MeOH), отримуючи 9 мг (13 %) очікуваного продукту у вигляді вільної основи. Продукт розчиняють в MeOH (2 мл). До отриманого розчину по краплях додають HCl (1M розчин в Et 2O, 0,02 мл, 0,02 ммоль). Суміш перемішують при кімнатній температурі протягом 20 хвилин, розчинник випарюють. Гідрохлорид (1R)-1-[(4-{[(5-хлор-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-4H, 9Hімідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону (92,5 мг, 0,194 ммоль, 49 %) отримують у вигляді порошку жовтого кольору. 1 H-ЯМР (δ, м.ч., CDCl3+CD3OD): 8,33 (д, 1Н), 8,05 (д, 1Н), 7,53 (д, 1Н), 7,52 (д, 1Н), 6,28 (д, 1Н), 6,24 (д, 1Н), 5,05-4,93 (м, 1Н), 4,48 (дд, 1Н), 4,35 (дд, 1Н), 3,99 (с, 2Н), 3,07 (дд, 1H), 3,032,78 (м, 2H), 2,77-2,62 (м, 2H), 2,58 (с, 3H), 2,37-2,17 (м, 2H), 2,12-1,97 (м, 2H), 1,70-1,46 (м, 2H). + [ES МС] m/z 440 (MH ). Сполука прикладу 2: Синтез гідрохлориду (2R)-2-[(4-{[(5-хлор-6-метил-3піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-3,8діону згідно зі схемою отримання (1) (a) 2-{[6-(Метилокси)-3-нітро-2-піридиніл]аміно}-1,3-пропандіол 6-Метокси-2-хлор-3-нітропіридин (36,94 г, 195,9 ммоль) і 2-амінопропан-1,3-діол (35,65 г, 391,3 ммоль) протягом 3 годин перемішують в етанолі (500 мл) при кип'ятінні зі зворотним холодильником в атмосфері аргону. Суміші дають можливість охолонути до кімнатної температури і залишають на ніч. Розчинник частково видаляють при зниженому тиску (до приблизно 150 мл) і отриману завись яскраво-жовтого кольору виливають в крижану воду (1,5 л) при енергійному перемішуванні. Суміш перемішують протягом 1 години, потім фільтрують з підсосом при охолоджуванні. Твердий продукт промивають крижаною водою (200 мл) і сушать на повітрі, отримуючи вказану в заголовку сполуку у вигляді твердої речовини яскраво-жовтого кольору (45,03 г, 94 %). РХМС показує наявність цільового продукту (93 %) з домішкою 7 % вихідної речовини. Продукт використовують на наступній стадії без додаткового очищення. + [ES МС] m/z 244 (MH ). (b) N-(2,2-Диметил-1,3-діоксан-5-іл)-6-(метилокси)-3-нітро-2-піридинамін До 2-{[6-(Метилокси)-3-нітро-2-піридиніл]аміно}-1,3-пропандіолу (53,93 г, 228,7 ммоль) в 2,2диметоксипропані (900 мл) при перемішуванні в атмосфері аргону додають моногідрат птолуолсульфонової кислоти (1,00 г). Суміш перемішують при кімнатній температурі протягом ночі, отримуючи прозорий розчин жовтого кольору. Розчин розбавляють ДХМ (1 л) і отриманий 19 UA 102694 C2 5 10 15 20 25 30 35 40 45 50 55 60 розчин обробляють насиченим водним розчином NaHCO3 (20 мл) і твердим NaHCO3 (20 г) при енергійному перемішуванні (спостерігається піноутворення). Суміш енергійно перемішують протягом 20 хвилин, після чого воду, що залишилася, абсорбують додаванням безводного Na2SO4. Суміш фільтрують з підсосом і тверді продукти промивають ДХМ (500 мл). Об'єднані фільтрат і промивні розчини упарюють при зниженому тиску, отримуючи тверду речовину жовтого кольору, в яку додають петролейний ефір (40-60°), і отриману суміш перемішують протягом вихідних днів. Твердий продукт виділяють фільтрацією з підсосом, промивають петролейним ефіром (40-60°) і сушать на повітрі, отримуючи вказану в заголовку сполуку у вигляді твердої речовини яскраво-жовтого кольору (57,83 г, 92 %). + [ES МС] m/z 284 (MH ). (с) N2-(2,2-Диметил-1,3-діоксан-5-іл)-6-(метилокси)-2,3-піридиндіамін N-(2,2-Диметил-1,3-діоксан-5-іл)-6-(метилокси)-3-нітро-2-піридинамін (35,00 г, 123,6 ммоль) розділяють на 2 аліквоти, кожну з яких переносять в 1,4-діоксан (500 мл) і гідрують над 10 % Pdна-вугіллі (паста, 1:1 мас./мас. з водою, 4,00 г) в атмосфері водню з тиском 1 атмосфера (101325 Па) при кімнатній температурі протягом 18 годин. Суміші фільтрують через целіт (Celite) з підсосом, використовуючи атмосферу аргону і мінімізуючи контакт продукту з повітрям. Тверді продукти промивають 1,4-діоксаном і об'єднані фільтрат і промивні розчини упарюють при зниженому тиску, отримуючи вказану в заголовку сполуку у вигляді масла насиченого пурпурного кольору. Отриманий продукт відразу використовують на наступній стадії. + [ES МС] m/z 254 (MH ). (d) Етил-N-[2-[(2,2-диметил-1,3-діоксан-5-іл)аміно]-6-(метилокси)-3-піридиніл]гліцинат Сирий N2-(2,2-диметил-1,3-діоксан-5-іл)-6-(метилокси)-2,3-піридиндіамін (123,6 ммоль) розчиняють в безводному ДМФА (500 мл) в атмосфері аргону, додають безводний K 2CO3 (37,56 г), потім етилбромацетат (12,31 мл). Суміш перемішують при кімнатній температурі протягом ночі. Розчинник видаляють при зниженому тиску і отриману завись червонувато-коричневого кольору розподіляють між ДХМ (1,2 л) і водою (300 мл). Органічну фазу відділяють і промивають водою (300 мл), сушать над Na2SO4, фільтрують і упарюють при зниженому тиску, отримуючи масло темно-червоного кольору, яке переносять в мінімальну кількість ДХМ і очищають колонковою хроматографією (діоксид кремнію; елюювання: 5 %-60 % EtOAc в петролейному ефірі (40-60°)). Відповідні фракції об'єднують і упарюють при зниженому тиску, отримуючи вказану в заголовку сполуку у вигляді масла темно-оранжевого кольору (35,42 г, 84 %). + [ES МС] m/z 340 (MH ). (е) 4-(2,2-Диметил-1,3-діоксан-5-іл)-6-(метилокси)-1,4-дигідропіридо[2,3-b]піразин-3(2H)-он Етил-N-[2-[(2,2-диметил-1,3-діоксан-5-іл)аміно]-6-(метилокси)-3-піридиніл]гліцинат (35,42 г, 104,4 ммоль) розчиняють в сухому ТГФ (500 мл) і отриманий розчин по краплях протягом 2 годин додають до охолодженої суспензії (0C) гідриду натрію (4,173 г 60 % мас./мас. дисперсія в маслі) в сухому ТГФ (500 мл) в атмосфері аргону. У процесі додавання колір суспензії змінюється від оранжевого до зеленого. Суміш перемішують при 0С протягом додаткових 15 хвилин, потім дають можливість суміші нагрітися до кімнатної температури і перемішують при кімнатній температурі протягом 1 години. Суміш охолоджують до 0С і обережно при енергійному перемішуванні додають насичений розчин NH4Cl (15 мл) (спостерігається піноутворення). Після припинення піноутворення отриманій суміші дають можливість нагрітися до кімнатної температури, суміш перемішують протягом 4 годин, потім розбавляють EtOAc (500 мл) і фільтрують з підсосом. Тверді продукти промивають EtOAc (300 мл) і об'єднані фільтрат і промивні розчини упарюють при зниженому тиску, отримуючи тверду речовину темнокоричневого кольору. Продукт перемішують з петролейним ефіром (40-60°) (500 мл) і EtOAc (20 мл) і фільтрують з підсосом, отримуючи тверду речовину коричневого кольору більш світлого відтінку, продукт промивають петролейним ефіром (40-60°) (100 мл) і сушать на повітрі, отримуючи вказану в заголовку сполуку (25,37 г, 82 %). + [ES МС] m/z 316 (MNa ) (f) 4-(2,2-Диметил-1,3-діоксан-5-іл)-6-(метилокси)піридо[2,3-b]піразин-3(4H)-он 4-(2,2-Диметил-1,3-діоксан-5-іл)-6-(метилокси)-1,4-дигідропіридо[2,3-b]піразин-3(2H)-он (25,37 г) і активований діоксид марганцю (120 г) перемішують в ДХМ (500 мл) при кімнатній температурі протягом 2 годин. Суміш фільтрують з підсосом і тверді продукти промивають ДХМ (2100 мл). Об'єднані фільтрат і промивні розчини упарюють при зниженому тиску, отримуючи піну коричневого кольору; продукт очищають колонковою хроматографією(діоксид кремнію; елюювання: 0 %-100 % EtOAc в петролейному ефірі (40-60°)). Відповідні фракції об'єднують і упарюють при зниженому тиску, отримуючи вказану в заголовку сполуку у вигляді твердої речовини світло-жовтувато-коричневого кольору (17,40 г, 69 %). 20 UA 102694 C2 + 5 10 15 20 25 30 35 40 45 50 55 60 [ES МС] m/z 314 (MNa ). (g) 4-[2-Гідрокси-1-(гідроксиметил)етил]-6-(метилокси)піридо[2,3-b]піразин-3(4H)-он 4-(2,2-Диметил-1,3-діоксан-5-іл)-6-(метилокси)піридо[2,3-b]піразин-3(4H)-он (17,40 г, 59,7 ммоль) розчиняють в ТГФ (220 мл), отримуючи розчин темно-жовтого кольору. Додають 1M водну HCl (200 мл) (в розчині з'являються перехідні блакитний і зелений кольори) і потім розчин, який набув ясно-жовтого забарвлення, перемішують при кімнатній температурі протягом 1 години. Суміш концентрують до приблизно 300 мл на роторному випарнику, використовуючи охолоджувальну водну баню (в осад випадає деяка кількість твердої речовини), потім енергійно перемішують з додаванням невеликими порціями твердого гідрокарбонату натрію (обережно: піноутворення) до досягнення значення рН отриманої суміші приблизно 8. Отриману тверду речовину жовтого кольору збирають фільтрацією з підсосом, промивають водою (220 мл) і сушать на повітрі, отримуючи вказану в заголовку сполуку у вигляді аморфної твердої речовини жовтого кольору (13,805 г, 91 %). + [ES МС] m/z 252 (MH ) (h) (3,8-Діоксо-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-2-іл)метилметансульфонат У круглодонну колбу об'ємом 1 л завантажують 4-[2-гідрокси-1-(гідроксиметил)етил]-6(метилокси)піридо[2,3-b]піразин-3(4H)-он (11,330 г, 45,1 ммоль). Додають безводний хлороформ (280 мл), потім Et3N (31,4 мл, 225 ммоль) і ангідрид метансульфонової кислоти (31,4 г, 180 ммоль), отримуючи розчин темного жовтувато-коричневого кольору. У процесі додавання ангідриду метансульфонової кислоти відбувається екзотермічна реакція, теплоти якої досить для того, щоб спричинити закипання розчинника. Суміш кип'ятять зі зворотним холодильником при енергійному перемішуванні в атмосфері аргону протягом 4,5 годин. Суміші дають можливість охолонути до кімнатної температури, розбавляють ДХМ до приблизно 600 мл і промивають водою (200 мл). Органічну фазу відділяють, водну фазу екстрагують ДХМ (2200 мл). Об'єднані органічні екстракти сушать над безводним Na2SO4, фільтрують і упарюють при зниженому тиску, отримуючи сирий мезилат у вигляді масла темно-коричневого кольору. Продукт залишають на ніч при 40-60° під сумішшю бензину (200 мл) і ДХМ (50 мл). Тверду речовину, що утворюється, виділяють фільтрацією з підсосом, промивають сумішшю гас:ДХМ (4:1, 2?50 мл) і сушать на повітрі, отримуючи вказану в заголовку сполуку у вигляді твердої аморфної речовини коричневого кольору (6,950 г, 52 %). + [ES МС] m/z 298 (MH ). (i) 1,1-Диметилетил-{1-[(3,8-діоксо-1,2-дигідро-3H, 8H-2a, 5,8а-триазааценафтилен-2іл)метил]-4-піперидиніл}карбамат Сирий (3,8-діоксо-1,2-дигідро-3Н, 8Н-2a, 5,8а-триазааценафтилен-2іл)метилметансульфонат (6,950 г, 23,38 ммоль) розчиняють в сухому CH 3CN (200 мл), отриману суміш обробляють піридином (7,55 мл, 94,0 ммоль) і потім 1,1-диметилетил-4піперидинілкарбаматом (10,30 г, 51,4 ммоль). Суміш кип'ятять зі зворотним холодильником при перемішуванні в атмосфері аргону протягом 3 годин, потім при 50С протягом вихідних. Після цього суміш перемішують при 90С протягом 2 годин, потім леткі сполуки видаляють при зниженому тиску і залишок розподіляють між ДХМ (600 мл) і водою (100 мл). Органічну фазу відділяють і водну фазу екстрагують ДХМ (2200 мл). Об'єднані органічні екстракти промивають водою (2100 мл), сушать над безводним Na2SO4, фільтрують і упарюють при зниженому тиску, отримуючи тверду речовину темного жовтувато-коричневого кольору; продукт переносять в мінімальну кількість 5 % розчину MeOH в ДХМ і хроматографують (елюювання: 0-10 % MeOH в ДХМ). Відповідні фракції об'єднують і упарюють при зниженому тиску, отримуючи вказану в заголовку сполуку у вигляді твердої аморфної речовини блідого жовтувато-коричневого кольору (5,444 г, 57 %). + + [ES МС] m/z 424 (MNa ), 402 (MH ). (j) 2-[(4-Аміно-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-3,8-діон (рацемічний і енантіомерний синтез 1 і 2) Спосіб А (рацемічний синтез): 1,1-Диметилетил-{1-[(3,8-діоксо-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-2-іл)метил]4-піперидиніл}карбамат (1,630 г, 4,06 ммоль) суспендують в ДХМ (30 мл) і до отриманої суспензії додають 4M розчин HCl в 1,4-діоксані (15 мл), отримуючи суспензію яскраво-жовтого кольору (спостерігають виділення газу). Суміш яскраво-жовтого кольору витримують при кімнатній температурі протягом 1 години. РХМС показує відсутність вихідної речовини. Розчинники видаляють при зниженому тиску і залишок сушать при зниженому тиску протягом ночі, отримуючи дигідрохлоридну сіль вказаної в заголовку сполуки у вигляді твердої аморфної речовини жовтувато-коричневого кольору (1,760 г (> теоретичного виходу для дигідрохлориду внаслідок присутності розчинника)). 21 UA 102694 C2 5 10 15 20 25 30 35 40 45 50 55 Частину сирого дигідрохлориду (0,513 г) розчиняють в суміші MeOH (4 мл) і води (1 мл) і вносять в SCX колонку (10 г) (заздалегідь оброблену МеОН, взятим в кількості, що рівнює 2 об'ємам колонки). Після цього колонку елююють під дією сили тяжіння, використовуючи (i) MeOH (250 мл), (ii) 0,5 M аміак в MeOH (фракції 350 мл). Відповідні фракції об'єднують, упарюють при зниженому тиску, отримуючи сиру сполуку, вказану в заголовку, у вигляді твердої аморфної речовини жовтувато-коричневого кольору (410 мг), яка містить нерозчинні в MeOH домішки, що не виявляються за допомогою РХМС (можливо, NH 4Cl). Продукт струшують з MeOH (30 мл) і суспензію фільтрують. Твердий продукт промивають MeOH (20 мл), фільтрат і промивні розчини об'єднують і упарюють при зниженому тиску, отримуючи вказану в заголовку сполуку (360 мг, 87 %). + [ES МС] m/z 302 (MH ). Спосіб В 1,1-Диметилетил-{1-[(3,8-діоксо-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-2-іл)метил]4-піперидиніл}карбамат (9,735 г, 24,25 ммоль) суспендують в ДХМ (90 мл) і до отриманої суспензії додають 4M розчин HCl в 1,4-діоксані (45 мл), отримуючи суспензію яскраво-жовтого кольору (спостерігають виділення газу). Суміш яскраво-жовтого кольору перемішують при кімнатній температурі протягом 1 години. Розчинники видаляють при зниженому тиску, отримуючи сирий дигідрохлорид у вигляді твердої аморфної речовини яскраво-жовтого кольору (10,420 г), який містить залишкову кількість розчинника. Рацемічний дигідрохлорид (10,42 г) розділяють на два енантіомери за допомогою препаративної ВЕРХ (колонка Chiralpak AD, 4 дюйми (20 мікрон), рухома фаза 50:50:0,1 СН3CN:MeOН:ізопропіламін). Значення альфа дорівнює 3,1 і основне розділення спостерігають впродовж всіх 3 циклів. Перекриваюча фракція відсутня, і обидва енантіомери (у вигляді вільних основ) виділяють з виходом >99,8 % ee кожний. (2R)-2-[(4-Аміно-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-3,8діон (перший елюйований компонент): (3,30 г, тверда речовина яскраво-бежевого кольору, хіральна ВЕРХ: 100 % ee). + [ES МС] m/z 302 (MH ). Оптичне обертання: альфа D = -120° (С=1,00, MeOH, 21,8С). (2S)-2-[(4-Аміно-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-3,8діон (другий елюйований компонент): (3,30 г, тверда речовина яскраво-бежевого кольору, хіральна ВЕРХ: 99,8 % ee). + [ES МС] m/z 302 (MH ). Оптичне обертання: альфа D =+122° (С=1,00, MeOH, 21,8 °C). (k) Цільова сполука: Гідрохлорид (2R)-2-[(4-{[(5-хлор-6-метил-3-піридиніл)метил]аміно}-1піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-3,8-діону Розчин (2R)-2-[(4-аміно-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен3,8-діону (63,4 мг, 0,210 ммоль) і 5-хлор-6-метил-3-піридинкарбальдегіду (синтез див. в WO2006/137485 Al, приклад 256) (32,7 мг, 0,210 ммоль) в суміші ДХМ (1,5 мл) і MeOH (0,5 мл) перемішують при кімнатній температурі протягом 30 хвилин. Потім до суміші додають NaBH(OAc)3 (312 мг, 1,473 ммоль) і отриману суміш перемішують при кімнатній температурі. Хід реакції контролюють за допомогою РХМС і, коли спостерігають повну конверсію, реакцію гасять 10 % NaHCO3 і екстрагують ДХМ. Органічний шар сушать (MgSO4), фільтрують і концентрують. Очищення флеш-хроматографією (Flashmaster II; картридж: силікагель, 2 г; елюювання: суміші ДХМ і MeOH) призводить до отримання 34,6 мг (0,078 ммоль, 37 %) очікуваного продукту у вигляді вільної основи. Продукт розчиняють в MeOH (6 мл). До розчину по краплях додають HCl (4 M розчин в 1,4-діоксані, 0,019 мл, 0,078 ммоль) і отриману суміш перемішують при кімнатній температурі протягом 35 хвилин. Після цього розчинник випарюють, використовуючи МеОН і діоксан для сприяння видаленню діоксану. Гідрохлорид (2R)-2-[(4-{[(5-хлор-6-метил-3піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H, 8H-2a, 5,8а-триазааценафтилен3,8-діону (60,4 мг, 0,127 ммоль) отримують у вигляді твердої речовини жовтого кольору. 1 H-ЯМР (δ, м.ч., ДМСО-d6): 9,07 (уш.с, 1Н), 8,52 (с, 1Н), 8,10 (с, 1Н), 7,85 (д, 1Н), 7,73 (с, 1Н), 6,25 (д, 1Н), 5,07-4,99 (с, 1Н), 4,36-4,17 (с, 4Н), 3,04-2,96 (м, 3H), 2,86-2,72 (м, 2H), 2,55 (с, 3H), 2,25-1,96 (м, 5H), 1,53-1,46 (м, 2H). + [ES МС] m/z 441 (MH ). Сполука прикладу 2: Синтез гідрохлориду (2R)-2-[(4-{[(5-хлор-6-метил-3піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-3,8діону з використанням схеми отримання (4) 22 UA 102694 C2 5 10 15 20 25 30 35 40 45 50 (a) (2R)-2-{[6-(Метилокси)-3-нітро-2-піридиніл]аміно}-3-[(фенілметил)окси]-1-пропанол До розчину (R)-2-аміно-3-бензилокси-1-пропанолу (698,4 г, 3,931 моль) в EtOH (3,6 л) невеликими порціями протягом 10 хвилин додають Et 3N (1,27 л, 9,11 моль). Потім порціями протягом 10 хвилин додають розчин 2-хлор-6-метокси-3-нітропіридину (672,7 г, 3,567 моль) в EtOH (0,6 л). Суміш нагрівають до 78С і витримують при даній температурі протягом 2 годин. Реакційну суміш охолоджують до кімнатної температури і додають при перемішуванні до суміші лід/Н2O (8,4 л). Суміш екстрагують EtOAc (9 л + 6 л + 3 л). Екстракти промивають насиченим розчином солі (6 л), сушать над MgSO4 (~900 г), фільтрують і упарюють, отримуючи (2R)-2-{[6(метилокси)-3-нітро-2-піридиніл]аміно}-3-[(фенілметил)окси]-1-пропанол (1373,1 г, 115 %) у вигляді масла оранжевого кольору. (b) N-((1S)-2-{[(1,1-Диметилетил)(диметил)силіл]окси}-1-{[(фенілметил)окси]метил}етил)-6(метилокси)-3-нітро-2-піридинамін До розчину (2R)-2-{[6-(метилокси)-3-нітро-2-піридиніл]аміно}-3-[(фенілметил)окси]-1пропанолу (675,8 г) в ДМФА (2,37 л) невеликими порціями додають хлор(1,1диметилетил)диметилсилан (382,0 г). Потім невеликими порціями додають імідазол (331,2 г) і отриману суміш перемішують при кімнатній температурі протягом 1,5 год. Реакційну суміш упарюють і отриману смолу оранжевого кольору розподіляють між EtOAc (3 л) і H 2O (3 л). Шари розділяють і водний шар екстрагують EtOAc (2,5+2 л). Органічні шари об'єднують, сушать над MgSO4 (~500 г), фільтрують і упарюють, отримуючи масло оранжевого кольору. Сирий продукт очищають колонковою хроматографією (діоксид кремнію, 10 кг; елюювання: гептан:EtOAc 9:1), отримуючи N-((1S)-2-{[(1,1-диметилетил)(диметил)силіл]окси}-1{[(фенілметил)окси]метил}етил)-6-(метилокси)-3-нітро-2-піридин (774,7 г, 100 %) у вигляді твердої речовини яскраво-жовтого кольору. (с) N2-((1S)-2-{[(1,1-Диметилетил)(диметил)силіл]окси}-1-{[(фенілметил)окси]метил}етил)-6(метилокси)-2,3-піридиндіамін До розчину N-((1S)-2-{[(1,1-диметилетил)(диметил)силіл]окси}-1{[(фенілметил)окси]метил}етил)-6-(метилокси)-3-нітро-2-піридинаміну (642,6 г, 1,436 моль) в MeOH (12 л) додають суспензію порошкоподібного цинку (938 г, 14,35 моль) в MeOH (4 л). До суміші по краплях протягом ~30 хвилин додають оцтову кислоту (411 мл, 7,18 моль), підтримуючи температуру нижче за 36С. Після завершення додавання отриману суміш перемішують протягом 15 хвилин. Реакційну суміш фільтрують через целіт і осад на фільтрі промивають EtOAc (8 л). Суміш промивають розчином солі (8 л) і шари розділяють. Водну фазу екстрагують EtOAc (8+6 л), потім органічні фази об'єднують, промивають насиченим розчином NaHCO3 (8 л), розчином солі (8 л), сушать над MgSO 4 (1 кг) і фільтрують. Фільтрат випарюють, отримуючи 478 г (80 %) N2-((1S)-2-{[(1,1-диметилетил)(диметил)силіл]окси}-1{[(фенілметил)окси]метил}етил)-6-(метилокси)-2,3-піридиндіамін у вигляді в'язкого масла темночервоного кольору. (d) Етил-N-[2-[((1S-2-{[(1,1-диметилетил)(диметил)силіл]окси}-1{[(фенілметил)окси]метил}етил)аміно]-6-(метилокси)-3-піридиніл]гліцинат 2 До розчину N -((1S)-2-{[(1,1-диметилетил)(диметил)силіл]окси}-1{[(фенілметил)окси]метил}етил)-6-(метилокси)-2,3-піридиндіаміну (673,1 г, 1,612 моль) в ДМФА (10 л) додають K2CO3 (490,1 г, 3,546 моль). До суміші протягом 15 хвилин додають бромацетат етилу (196,6 мл, 1,77 моль) і реакційну суміш перемішують при кімнатній температурі. Через 3 години реакцію гасять H2O (10 л) і суміш екстрагують EtOAc (10 л). Шари розділяють і водний шар екстрагують EtOAc (7 л). Органічні шари об'єднують, промивають H 2O (7 л) і розчином солі (7 л), сушать над MgSO4 (1 кг), фільтрують і упарюють. Отримане темне масло (853 г) очищають колонковою хроматографією (діоксид кремнію, 9 кг; елюювання: гептан і EtOAc), отримуючи етил-N-[2-[((1S)-2-{[(1,1-диметилетил)(диметил)силіл]окси}-1{[(фенілметил)окси]метил}етил)аміно]-6-(метилокси)-3-піридиніл]гліцинат (672,0 г, 83 %) у вигляді темного масла. (е) 4-((1S)-2-([(1,1-Диметилетил)(диметил)силіл]окси]-1-{[(фенілметил)окси]метил}етил)-6(метилокси)-1,4-дигідропіридо[2,3-b]піразин-3(2H)-он 23 UA 102694 C2 5 10 15 20 25 30 35 40 45 50 55 60 До розчину NaH (50,5 г, 57-63 % дисперсія в мінеральному маслі, 1,26 моль) в ТГФ (8,5 л) додають етил-N-[2-[((1S)-2-{[(1,1-диметилетил)(диметил)силіл]окси}-1{[(фенілметил)окси]метил}етил)аміно]-6-(метилокси)-3-піридиніл]гліцинат (577,8 г, 1,147 моль) при -5С. Після завершення додавання отриману суміш нагрівають до кімнатної температури і перемішують протягом 30 хвилин. Реакцію гасять додаванням насиченого водного розчину NH4Cl (610 мл) і отриману суміш перемішують протягом 10 хвилин. До суміші додають Na 2SO4 (1 кг), отриману суміш перемішують протягом 10 хвилин і потім фільтрують через целіт. Осад на фільтрі промивають EtOAc (5 л). Фільтрат випарюють і отримане масло темно-пурпурного кольору очищають колонковою хроматографією (елюювання: суміші гептану і EtOAc), отримуючи 477 г (91 %) 4-((1S)-2-{[(1,1-диметилетил)(диметил)силіл]окси}-1{[(фенілметил)окси]метил}етил)-6-(метилокси)-1,4-дигідропіридо[2,3-b]піразин-3(2H)-он у вигляді в'язкого масла пурпурного кольору. (f) 4-[(1S)-2-{[(1,1-Диметилетил)(диметил)силіл]окси}-1-(гідроксиметил)етил]-6-(метилокси)1,4-дигідропіридо[2,3-b]піразин-3(2H)-он Суміш 4-((1S)-2-{[(1,1-диметилетил)(диметил)силіл]окси}-1-{[(фенілметил)окси]метил}етил)6-(метилокси)-1,4-дигідропіридо[2,3-b]піразин-3(2H)-ону (250,4 г, 0,547 моль), каталізатора Перлмана (25 г) і 10 % Pd/С (25 г, 50 % волог.) в EtOH (5 л) перемішують при 50С в атмосфері H2 з тиском 5 бар (500000 Па) протягом 3,5 годин. Реакційну суміш фільтрують через целіт і фільтрат упарюють, отримуючи 4-[(1S)-2-{[(1,1-диметилетил)(диметил)силіл]окси}-1(гідроксиметил)етил]-6-(метилокси)-1,4-дигідропіридо[2,3-b]піразин-3(2H)-он (191,2 г, 95 %) у вигляді твердої речовини темно-блакитного кольору. (g) 4-[(1S)-2-([(1,1-Диметилетил)(диметил)силіл]окси]-1-(гідроксиметил)етил]-6(метилокси)піридо[2,3-b]піразин-3(4H)-он Розчин 4-[(1S)-2-{[(1,1-диметилетил)(диметил)силіл]окси}-1-(гідроксиметил)етил]-6(метилокси)-1,4-дигідропіридо[2,3-b]піразин-3(2H)-он (494,1 г, 1,34 моль) і MnO2 (584,4 г, 6,72 моль) в ДХМ (18 л) перемішують при кімнатній температурі протягом 1 години. Суміш фільтрують через целіт і фільтрат упарюють, отримуючи тверду речовину пурпурного/білого кольору. Сирий продукт очищають колонковою хроматографією (елюювання: суміші гептану і EtOAc), отримуючи 451,6 г (66 %) 4-[(1S)-2-{[(1,1-диметилетил)(диметил)силіл]окси}-1(гідроксиметил)етил]-6-(метилокси)піридо[2,3-b]піразин-3(4H)-ону. 1 H-ЯМР (δ, м.ч., CDCl3): 8,15 (с, 1Н), 8,03 (д, 1Н), 6,74 (д, 1Н), 6,00 (уш.с, 1Н), 4,30-4,20 (м, 4Н), 4,04-3,96 (м, 1H), 4,01 (с, 3H), 0,66 (с, 9H),-0,046 (с, 3H), -0,166 (с, 3H). + [ES МС] m/z 366 (MH ). (h) (2S)-2-(([(1,1-Диметилетил)(диметил)силіл]окси}метил)-1,2-дигідро-3H,8H-2a,5,8атриазааценафтилен-3,8-діон До розчину 4-[(1S)-2-{[(1,1-диметилетил)(диметил)силіл]окси}-1-(гідроксиметил)етил]-6(метилокси)піридо[2,3-b]піразин-3(4H)-ону (1 г, 2,74 ммоль) в CHCl3 (50 мл) додають Et3N (0,953 мл, 6,84 ммоль) і потім розчин ангідрида метансульфонової кислоти (0,953 г, 5,47 ммоль) в CHCl3 (50 мл). Реакційну суміш кип'ятять зі зворотним холодильником при перемішуванні протягом 5 годин. Сиру реакційну суміш розбавляють водою, промивають розчином NaCl, сушать (MgSO4), фільтрують і концентрують. Очищення флеш-хроматографією (картридж: силікагель, 40 г; елюювання: суміші ДХМ і MeOH), отримуючи (2S)-2-({[(1,1диметилетил)(диметил)силіл]окси}метил)-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-3,8діон (0,806 г, 88 %) у вигляді твердої речовини жовтувато-коричневого кольору. 1 H-ЯМР (δ, м.ч., CDCl3): 7,84 (с, 1H), 7,75 (д, 1H), 6,35 (д, 1H), 5,13-5,07 (м, 1H), 4,53-4,35 (м, + 3H), 3,82 (дд, 1H), 0,66 (с, 9H), 0,00 (с, 3H), -0,13 (с, 3H). [ES МС] m/z 334 (MH ). (i) (2S)-2-(Гідроксиметил)-1,2-дигідро-3H, 8H-2a, 5,8а-триазааценафтилен-3,8-діон Суспензію (2S)-2-({[(1,1-диметилетил)(диметил)силіл]окси}метил)-1,2-дигідро-3H, 8H-2a, 5,8а-триазааценафтилен-3,8-діону (42,6 г, 128 ммоль) і іонообмінної смоли Dowex 50 × 2-200 (50 г, 128 ммоль) в MeOH (1000 мл) перемішують при кімнатній температурі протягом 15 годин. Реакційну суміш фільтрують, отримуючи (2S)-2-(гідроксиметил)-1,2-дигідро-3H, 8H-2a, 5,8атриазааценафтилен-3,8-діон (26,55 г, 121 ммоль, 95 %). + [ES МС] m/z 220 (MH ). (j) [(2S)-3,8-Діоксо-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-2іл]метилбензолсульфонат До суспензії (2S)-2-(гідроксиметил)-1,2-дигідро-3H, 8H-2a, 5,8а-триазааценафтилен-3,8-діону (26,5 г, 121 ммоль) в ДХМ (320 мл) додають бензолсульфонілхлорид (23,38 мл, 181 ммоль) і потім Et3N (39,6 мл, 284 ммоль). Реакційну суміш обережно кип'ятять зі зворотним холодильником при 42С протягом 2 годин. Потім реакційну суміш охолоджують до 5С і до суміші по краплях додають 2-(диметиламіно)етанол (7,30 мл, 72,5 ммоль). Неочищену суміш 24 UA 102694 C2 5 10 15 20 25 30 перемішують при кімнатній температурі протягом 30 хвилин, потім додають TBME (600 мл). Отриманий твердий продукт збирають фільтрацією. Твердий продукт суспендують в 100 мл 1N HCl, промивають водою і TBME і сушать, отримуючи [(2S)-3,8-діоксо-1,2-дигідро-3H,8H-2a,5,8атриазааценафтилен-2-іл]метилбензолсульфонат (37,04 г, 85 %) у вигляді твердої речовини ясно-жовтого кольору. 1 H-ЯМР (δ, м.ч., CDCl3): 7,79-7,69 (м, 5H), 7,57-7,52 (м, 2H), 6,38 (д, 1H), 5,19-5,12 (м, 1H), + 4,92 (дд, 1H), 4,47-4,38 (м, 3H). [ES МС] m/z 360 (MH ). (k) Цільова сполука: Гідрохлорид (2R)-2-[(4-{[(5-хлор-6-метил-3-піридиніл)метил]аміно}-1піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-3,8-діону До суспензії [(2S)-3,8-діоксо-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-2іл]метилбензолсульфонат (14,5 г, 40,3 ммоль) в CH 3CN (100 мл) при 0С додають N-[(5-хлор-6метил-3-піридиніл)метил]-4-піперидинамін (синтез див. в прикладі отримання 11) (11,61 г, 48,4 ммоль) і N,N-діізопропілетиламін (7,03 мл, 40,3 ммоль). Реакційну суміш перемішують при 77С протягом 6 годин. Реакційній суміші дають можливість охолонути до кімнатної температури і суміш охолоджують до 0С на крижаній бані. Тверду речовину, що випала в осад, збирають фільтрацією у вакуумі і промивають CH3CN, отримуючи перший фільтрат. Потім виділену тверду речовину знов промивають H2O і TBME, отримуючи другий фільтрат. Отриманий твердий продукт збирають, отримуючи першу порцію (2R)-2-[(4-{[(5-хлор-6метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8атриазааценафтилен-3,8-діону (3,5 г, 20 %), який являє собою тверду речовину жовтого кольору. Перший фільтрат концентрують у вакуумі і розчиняють в ДХМ. До отриманого розчину додають 2N HCl до досягнення значення рН в інтервалі 1-2 і органічну фазу екстрагують і утилізують. До водної фази додають 10 % розчин NaHCO3 до досягнення pH значення 9, органічну фазу екстрагують ДХМ, промивають розчином NaCl, сушать (MgSO 4), фільтрують і концентрують. Очищення флеш-хроматографією (картридж: силікагель, 50 г; елюювання: суміші ДХМ і MeOH) призводить до отримання другої порції (2R)-2-[(4-{[(5-хлор-6-метил-3піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-3,8діону (2,09 г, 12 %). Другий фільтрат екстрагують ДХМ і ДХМ/MeOH 95/5, сушать (Na 2SO4), фільтрують і концентрують, отримуючи третю порцію (2R)-2-[(4-{[(5-хлор-6-метил-3-піридиніл)метил]аміно}-1піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-3,8-діону в формі вільної основи (7,75 г, 44 %). Загальний вихід 76 %. 1 35 40 45 H-ЯМР (δ, м.ч., CDCl3): 8,30 (с, 1H), 7,82 (с, 1H), 7,76 (д, 1H), 7,64 (с, 1H), 6,38 (д, 1H), 5,064,98 (м, 1H), 4,57-4,52 (м, 1H), 4,41-4,33 (м, 1H), 3,76 (с, 2H), 3,15 (дд, 1H), 2,96-2,92 (м, 1H), 2,732,63 (м, 2H), 2,60 (с, 3H), 2,51-2,45 (м, 1H), 2,36-2,20 (м, 2H), 1,88-1,80 (м, 2H), 1,35-1,31 (м, 2H). + [ES МС] m/z 441 (MH ). До розчину вільної основи (3,5 г, 7,94 ммоль) в ДХМ (80 мл) додають по краплях додають HCl (4M розчин в 1,4-діоксані, 2,0 мл, 8,0 ммоль). Суміш перемішують при кімнатній температурі протягом 1 години, розчинник випарюють у вакуумі і сирий продукт диспергують в суміші гексан/ДХМ. Твердий продукт збирають фільтрацією, отримуючи гідрохлорид (2R)-2-[(4-{[(5хлор-6-метил-3-піридиніл)метил]аміно}-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8атриазааценафтилен-3,8-діону (3,2 г, 84 %) у вигляді твердої речовини жовтого кольору. 1 H-ЯМР (δ, м.ч., ДМСО-d6): 9,07 (уш.с, 1H), 8,52 (с, 1H), 8,10 (с, 1H), 7,85 (д, 1H), 7,73 (с, 1H), 6,25 (д, 1H), 5,07-4,99 (с, 1H), 4,36-4,17 (с, 4H), 3,04-2,96 (м, 3H), 2,86-2,72 (м, 2H), 2,55 (с, 3H), + 2,25-1,96 (м, 5H), 1,53-1,46 (м, 2H). [ES МС] m/z 441 (MH ). Приклад сполуки 9: Синтез гідрохлориду (1R)-1-{[4-({[6-(трифторметил)-3піридиніл]метил}аміно)-1-піперидиніл]метил}-1,2-дигідро-4H,9H-імідазо[1,2,3-ij]-1,8-нафтиридин4,9-діону 25 UA 102694 C2 5 10 15 20 25 30 35 40 Розчин (1R)-1-[(4-аміно-1-піперидиніл)метил]-1,2-дигідро-4H,9H-імідазо[1,2,3-ij]-1,8нафтиридин-4,9-діону (див. вище стадію (j) прикладу сполуки 1; 400 мг, 1,33 ммоль) і 6(трифторметил)-3-піридинкарбальдегіду (233 мг, 1,33 ммоль, від Apollo) в суміші ДХМ (5 мл) і MeOH (5 мл) перемішують при кімнатній температурі протягом 2 годин. Після цього додають NaBH(OAc)3 (1,7 г, 7,99 ммоль) і отриману суміш перемішують при кімнатній температурі. Хід реакції контролюють за допомогою РХМС. Додають додаткову кількість альдегіду (47 мг, 0,27 ммоль) і NaHB(OAc)3 (421 мг, 1,98 ммоль) і, коли спостерігають повну конверсію, реакцію гасять 10 % NaHCO3 і екстрагують ДХМ. Органічний шар сушать (MgSO 4), фільтрують і концентрують. Очищення флеш-хроматографією (картридж: силікагель, 70 г; елюювання: суміші ДХМ і MeOH) призводить до отримання 463 мг (75 %) очікуваного продукту в формі вільної основи. Продукт розчиняють в MeOH (50 мл). До розчину по краплях додають HCl (4M розчин в 1,4-діоксані, 0,25 мл, 1 ммоль). Суміш перемішують при кімнатній температурі протягом 20 хвилин, розчинник випарюють. Отримують гідрохлорид (1R)-1-{[4-({[6-(трифторметил)-3-піридиніл]метил}аміно)-1піперидиніл]метил}-1,2-дигідро-4H, 9H-імідазо[1,2,3-ij]-1,8-нафтиридин-4,9-діону (238 мг, 0,480 ммоль, 36 %) у вигляді твердої речовини бежевого кольору. 1 H-ЯМР (δ, м.ч., d-ДМСО): 10,21 (уш.с, 1Н), 9,01 (с, 1Н), 8,43 (д, 1Н), 8,02 (д, 1Н), 7,79 (дд, 2Н), 6,22 (д, 2H), 5,40 (уш.с, 1H), 4,50-4,36 (м, 4H), 3,80-3,66 (м, 5H), 3,17 (уш.с, 2H), 2,17 (уш.с, + 4H). [ES МС] m/z 460 (MH ). Приклад сполуки 11: Синтез (1R)-1-{[4-({[6-(трифторметил)-3-піридиніл]метил}аміно)-1піперидиніл]метил}-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-3,8-діон згідно зі схемою отримання (2) (a) 6-(Метилокси)-3-нітро-2-піридин Розчин/суспензія 2-хлор-6-(метилокси)-3-нітропіридину (65,7 г, 348 ммоль) в 2M розчині аміаку в MeOH (500 мл, 1000 ммоль) і водному розчині аміаку (500 мл, 348 ммоль) перемішують при 65С протягом 18 годин. Реакційний розчин охолоджують, твердий продукт збирають фільтрацією, промивають водою (2100 мл). Твердий продукт сушать у вакуумній печі при 40С протягом ночі, отримуючи продукт у вигляді твердої речовини яскраво-жовтого кольору (52,14 г, 84 % чистота у відповідності з даними ЯМР, 74 %). + [ES МС] m/z 170 (MH ). (b) 6-(Метилокси)-2,3-піридиндіамін 6-(Метилокси)-3-нітро-2-піридинамін (26 г, 129 ммоль) суспендують в EtOH (500 мл) при кімнатній температурі в атмосфері аргону і потім обробляють паладієм-на-вугіллі (15 г, 14,10 ммоль) (10 % паста). Реакційну суміш перемішують в атмосфері водню з тиском 1 атмосфера (101325 Па) протягом ночі. Реакційну суміш фільтрують через тонкий шар целіту (Celite) і осад на фільтрі промивають EtOH (500 мл). EtOH випарюють, отримуючи продукт у вигляді масла пурпурного кольору (20,68 г, слабо забруднене). + [ES МС] m/z 140 (MH ). (с) Етил-N-[2-аміно-6-(метилокси)-3-піридиніл]гліцинат 6-(Метилокси)-2,3-піридиндіамін (21,7 г, встановлена 87 %чистота, 136 ммоль) розчиняють в CH3CN (500 мл) при кімнатній температурі в атмосфері аргону і потім обробляють K 2CO3 (24,38 г, 176 ммоль) і етилбромацетатом (18,13 мл, 163 ммоль). Реакційну суміш перемішують при кімнатній температурі протягом ночі. Після цього CH3CN видаляють у вакуумі. Реакцію 26 UA 102694 C2 5 10 15 20 25 30 35 40 45 50 55 повторюють, використовуючи додаткову кількість 6-(метилокси)-2,3-піридиндіаміну (20,68 г, чистота 87 %, 129 ммоль) в CH3CN (500 мл), K2CO3 (23,23 г) і етилбромацетату (17,27 г), реакційну суміш знов перемішують при кімнатній температурі протягом ночі і після цього CH 3CN видаляють у вакуумі. Залишки розподіляють між водою (1 л) і EtOAc (1 л) і шари розділяють. Водний шар екстрагують ще раз EtOAc (1 л) і об'єднані органічні екстракти сушать над MgSO 4, фільтрують і упарюють, отримуючи масло пурпурного кольору (64 г). Масло обробляють ДХМ (300 мл) і нерозчинні домішки видаляють фільтрацією. Розчин в ДХМ завантажують в колонку (діоксид кремнію, 800 г; елюювання: 0-2 % MeOH/ДХМ), отримуючи 40,6 г вказаного в заголовку продукту у вигляді твердої речовини коричневого кольору (РХМС і ЯМР підтверджують 75 % вміст вказаної в заголовку сполуки і 15 % циклізованого продукту 6-(метилокси)-1,4дигідропіридо[2,3-b]піразин-3(2H)-ону) і 6,4 г циклізованого продукту 6-(метилокси)-1,4дигідропіридо[2,3-b]]піразин-3(2H)-ону у вигляді твердої речовини пурпурового кольору. + [ES МС] m/z 226 (MH ). (d) 6-(Метилокси)-1,4-дигідропіридо[2,3-b]піразин-3(2H)-он Етил-N-[2-аміно-6-(метилокси)-3-піридиніл]гліцинат (40,6 г, 135 ммоль) розчиняють в ТГФ (1 л) при кімнатній температурі в атмосфері аргону і обробляють трет-бутоксидом калію (15,17 г, 135 ммоль). Суміш перемішують протягом 2 годин при кімнатній температурі, потім додають насичений розчин NH4Cl (500 мл) додають і ТГФ випарюють. До залишку додають воду (500 мл), потім 20 % MeOH/ДХМ (1 л); нерозчинні речовини збирають фільтрацією, промивають Et 2O і сушать у вакуумній печі при 40С протягом ночі, отримуючи цільовий продукт у вигляді твердої речовини жовтого кольору (15,3 г): РХМС і ЯМР підтверджують даний продукт (у відповідності з даними ЯМР, присутні 9 % окисленої сполуки). Дві фази переносять в ділильну лійку і розділяють. Водний шар двічі екстрагують додатковою кількістю 20 % MeOH/ДХМ (2500 мл), об'єднані органічні екстракти сушать над MgSO4, фільтрують і упарюють, отриману тверду речовину коричневого кольору промивають надлишком Et2O, отримуючи додаткову кількість вказаної в заголовку сполуки у вигляді твердої речовини блідо-зеленого кольору (7,7 г): РХМС і ЯМР підтверджують даний продукт (у + відповідності з даними ЯМР, присутні 20 % окисленої речовини). [ES МС] m/z 180 (MH ). Альтернативна методика: Етил-N-[2-аміно-6-(метилокси)-3-піридиніл]гліцинат (16,2 г, 72 ммоль) розчиняють в тетрагідрофурані (500 мл) і охолоджують до 0С (охолоджування на крижаній бані) в атмосфері аргону. Після цього розчин обробляють трет-бутоксидом калію (1M в ТГФ, 80 мл, 80 ммоль). Через 1,5 години реакційну суміш обробляють AcOH (80 ммоль) і упарюють, отримуючи тверду речовину темного забарвлення. Продукт розтирають з водою (200 мл), фільтрують і сушать у вакуумі (~13 г, кількісний вихід), можна використовувати на наступній стадії без додаткового очищення. (е) Фенілметил-6-(метилокси)-3-оксо-3,4-дигідропіридо[2,3-b]піразин-1(2H)карбоксилат До розчину 6-(метилокси)-1,4-дигідропіридо[2,3-b]піразин-3(2H)-ону (6,35 г, 35,4 ммоль) в EtOAc (600 мл)/NaHCO3 (насичений розчин) (200 мл) при енергійному перемішуванні при кімнатній температурі додають бензилхлорформіат (5,31 мл, 37,2 ммоль). Через 45 хвилин реакцію завершують. Шари розділяють і органічний шар сушать над MgSO 4, фільтрують і упарюють, отримуючи вказаний в заголовку продукт у вигляді твердої не зовсім білої речовини (11 г, 99 %). + [ES МС] m/z 314 (MH ). (f) Фенілметил-6-(метилокси)-4-[(2R)-2-оксиранілметил]-3-оксо-3,4-дигідропіридо[2,3b]піразин-1(2H)-карбоксилат Фенілметил-6-(метилоксі)-3-оксо-3,4-дигідропіридо[2,3-b]піразин-1(2H)-карбоксилат (11 г, 35,1 ммоль) розчиняють в ДМФА (300 мл) при кімнатній температурі в атмосфері аргону, отримуючи розчин жовтого кольору. Отриманий розчин охолоджують на крижаній бані і обробляють гідридом натрію (1,685 г, 42,1 ммоль). Розчину дають можливість нагрітися до кімнатної температури. Через 20 хвилин до розчину додають (2S)-2-оксиранілметил-3нітробензолсульфонат (9,56 г, 36,9 ммоль). Через 1 годину всі вихідні речовини повністю витрачаються, тому реакційну суміш обробляють насиченим розчином NaHCO 3 (350 мл) і водний шар екстрагують ДХМ (3400 мл). Об'єднані органічні шари сушать над MgSO 4, фільтрують і упарюють, отримуючи масло світло-коричневого кольору (16,93 г). Продукт використовують на наступній стадії без додаткового очищення. + [ES МС] m/z 370 (MH ). (g) Фенілметил-(1S)-1-(гідроксиметил)-3,8-діоксо-1,2,3,4-тетрагідро-5H,8H-2a,5,8атриазааценафтилен-5-карбоксилат 27 UA 102694 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фенілметил-6-(метилокси)-4-[(2R)-2-оксиранілметил]-3-оксо-3,4-дигідропіридо[2,3-b]піразин1(2H)-карбоксилат (сирий продукт, 15,93 г, приблизно 32,8 ммоль) розчиняють в ДМФА (250 мл) при кімнатній температурі, розчин нагрівають до 130С і витримують при даній температурі протягом 2 ночей і потім при 120С протягом однієї ночі. Реакція завершується, ДМФА випарюють і залишок обробляють сумішшю вода/розчин солі (350/50 мл) і ДХМ (500 мл). Шари розділяють і водний шар екстрагують ще раз ДХМ (500 мл). Об'єднані органічні екстракти сушать над MgSO4, фільтрують і упарюють до масла коричневого кольору, яке сушать у високому вакуумі протягом вихідних. Сирий продукт очищають хроматографією (діоксид кремнію; елюювання з градієнтом: 0-10 % MeOН/ДХМ), отримуючи вказану в заголовку сполуку у вигляді золотистої піни (3,6 г, 30,9 %). + [ES МС] m/z 356 (MH ). (h) (1S)-1-(Гідроксиметил)-1,2-дигідро-3H, 8H-2a, 5,8а-триазааценафтилен-3,8-діон Фенілметил-(1S)-1-(гідроксиметил)-3,8-діоксо-1,2,3,4-тетрагідро-5H, 8H-2a, 5,8атриазааценафтилен-5-карбоксилат (1,6 г, 4,50 ммоль) розчиняють в етанолі (100 мл) при кімнатній температурі і потім обробляють паладієм-на-вугіллі (10 % паста) (1 г, 0,940 ммоль). Суміш перемішують при кімнатній температурі в атмосфері водню з тиском 1 атмосфера (101325 Па) протягом 3 годин. Після цього реакційну суміш фільтрують через тонкий шар целіту і осад на фільтрі промивають додатковою кількістю етанолу. Продукт елююють ДМФА (400 мл) і ДМФА випарюють, отримуючи тверду речовину коричневого кольору (780 мг). Твердий продукт суспендують в 30 % MeOH/ДХМ (150 мл), перемішують з діоксидом марганцю (1,174 г, 13,51 ммоль) при кімнатній температурі протягом 5 годин і потім фільтрують через тонкий шар целіту, який промивають 20 % MeOH/ДХМ (100 мл). Розчинники випарюють, отримуючи вказану в заголовку сполуку у вигляді твердої речовини коричневого кольору (750 мг, 76 %). + [ES МС] m/z 220 (MH ). (i) [(1S)-3,8-Діоксо-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-1-іл]метилметансульфонат (1S)-1-(гідроксиметил)-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-3,8-діон (750 мг, 3,42 ммоль) суспендують в сухому ДХМ (100 мл) при кімнатній температурі в атмосфері аргону і потім обробляють Et3N (0,572 мл, 4,11 ммоль). Після цього суміш охолоджують на бані із сумішшю води з льодом. Після цього додають метансульфонілхлорид (0,293 мл, 3,76 ммоль) і реакційній суміші дають можливість нагрітися до кімнатної температури. Через 50 хвилин вихідна речовина повністю витрачається, отриману суміш промивають насиченим розчином NaHCO3 (100 мл). Водний шар екстрагують сумішшю 20 % MeOH/ДХМ (2100 мл); об'єднані органічні екстракти сушать над MgSO4, фільтрують і упарюють, отримуючи продукт у вигляді піни коричневого кольору (1,05 г, 90 % чистоти у відповідності з РХМС). + [ES МС] m/z 297,9 (MH ). (j) 1,1-Диметилетил-(1-{[(1R)-3,8-діоксо-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-1іл]метил}-4-піперидиніл)карбамат Розчин [(1S)-3,8-діоксо-l, 2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-1іл]метилметансульфонату (1,05 г, 3,53 ммоль) в сухому CH 3CN (50 мл) при кімнатній температурі в атмосфері аргону обробляють піридином (0,343 мл, 4,24 ммоль), потім 1,1диметилетил-4-піперидинілкарбаматом (0,884 г, 4,24 ммоль). Суміш нагрівають до 70С і витримують при даній температурі протягом 1,5 год., потім при 90С протягом 3 годин. РХМС показує наявність ~25 % продукту. Тому додають 0,5 екв. піридину і 0,5 екв. 1,1-диметилетил-4піперидинілкарбамату, реакційну суміш нагрівають до 90С і витримують при даній температурі протягом ночі, потім перемішують при кімнатній температурі протягом 2 днів. Реакцію завершують. Розчинник випарюють і залишок розподіляють між насиченим розчином NaHCO 3 і 20 % MeOH/ДХМ (100 мл/100 мл). Шари розділяють і водний шар знову екстрагують 20 % MeOH/ДХМ (2100 мл). Об'єднані органічні екстракти сушать над MgSO 4, фільтрують і упарюють, отримуючи 1,7 г сирого продукту, які очищають хроматографією (діоксид кремнію; елюювання з градієнтом: 0-5 % MeOH/ДХМ), отримуючи продукт у вигляді твердої речовини жовтого кольору (0,57 г, 40,2 %). + [ES МС] m/z 402 (MH ). (k) (1R)-1-[(4-Аміно-1-піперидиніл)метил]-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен-3,8діон Розчин 1,1-диметилетил-(1-{[(1R)-3,8-діоксо-1,2-дигідро-3H,8H-2a,5,8а-триазааценафтилен1-іл]метил}-4-піперидиніл)карбамату (0,57 г, 1,420 ммоль) в хлороформі (7 мл) при кімнатній температурі обробляють HCl (4M розчин в 1,4-діоксані, 7 мл). Тверда речовина випадає в осад, і отриману суміш перемішують при кімнатній температурі. Через 0,5 години додають деяку кількість MeOH для розчинення більшої частини твердого продукту, потім толуол і всі розчинники видаляють, отримуючи продукт у вигляді твердої речовини жовтого кольору. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюTricyclic nitrogen containing compounds and their use as antibacterials
Автори англійськоюAlemparte-Gallardo, Carlos, Barfoot, Christopher, Barros-Aguirre, David, Cacho-Izquierdo, Monica, Fiandor Roman, Jose, Maria, Hennessy, Alan, Joseph, Pearson, Neil, David, Remuinan-Blanco, Modesto, Jesus
Назва патенту російськоюТрициклические азотсодержащие соединения и их применение как бактерицидных средств
Автори російськоюАлемпарте-Галлардо Карлос, Барфут Кристофер, Баррос-Агирре Давид, Качо-Искердо Моника, Фиандор Роман Хосе Мария, Хеннесси Алан Джозеф, Пирсон Нейл Девид, Ремуинан-Бланко Модесто Хесус
МПК / Мітки
МПК: A61P 31/06, A61K 31/4745, C07D 471/16
Мітки: трициклічні, застосування, азотвмісні, сполуки, засобів, бактерицидних
Код посилання
<a href="https://ua.patents.su/81-102694-triciklichni-azotvmisni-spoluki-i-kh-zastosuvannya-yak-baktericidnikh-zasobiv.html" target="_blank" rel="follow" title="База патентів України">Трициклічні азотвмісні сполуки і їх застосування як бактерицидних засобів</a>
Попередній патент: Похідні фенілімідазолу як інгібітори ферменту pde10a
Наступний патент: Спосіб отримання неорганічних гідравлічних в’яжучих матеріалів
Випадковий патент: Стабілізатор постійної напруги