Трициклічні сполуки та їх застосування як модуляторів глюкокортикоїдного рецептора
Номер патенту: 95332
Опубліковано: 25.07.2011
Автори: Гу Кіао, Рукер Паул Вінсент, Веббер Рональд Кейт, Обуковіц Марк Герард, Чен Генгмяо, Джером Кевін ДеВайн, Ольсон Ліза
Формула / Реферат
1.Сполука формули І:
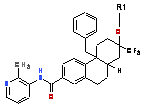 , (І)
, (І)
де R1- -H;
або її сіль.
2. Сполука за п. 1, якою є:
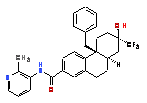
або її сіль.
3. Сполука за п. 1, якою є:
 .
.
4. Гідрохлорид сполуки за п. 1.
5. Композиція, що містить сполуку за п. 1 або її сіль та носій.
6. Спосіб лікування стану або захворювання, за яким здійснюють контактування глюкокортикоїдного рецептора зі сполукою за п. 1 або її сіллю.
7. Спосіб лікування стану, опосередкованого активністю глюкокортикоїдного рецептора у суб'єкта , за яким вводять цьому суб'єкту сполуку формули І:
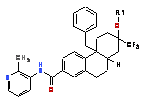 , (І)
, (І)
де R1- -H; або її сіль.
8. Спосіб за п. 7, де станом є стан, пов'язаний із запаленням.
9. Спосіб за п. 7, де станом є астма, дерматит, запальна хвороба кишечнику, хвороба Альцгеймера, глибока психотична депресія, невропатія, відторгнення трансплантата, розсіяний склероз, хронічний увеїт або хронічна обструктивна хвороба легенів.
10. Спосіб за п. 7, де станом є ревматоїдний артрит.
11. Спосіб за п. 7, де станом є дерматит.
12. Спосіб за п. 7, де станом є астма.
13. Спосіб за п. 7, де станом є хвороба Альцгеймера.
14. Спосіб за п. 7, де станом є запальна хвороба кишечнику.
15. Спосіб зменшення побічної дії, асоційованої з модуляцією глюкокортикоїдного рецептора, за яким вводять суб'єкту сполуку за п. 1.
Текст
1.Сполука формули І: 2 3 95332 4 13. Спосіб за п. 7, де станом є хвороба Альцгеймера. 14. Спосіб за п. 7, де станом є запальна хвороба кишечнику. 15. Спосіб зменшення побічної дії, асоційованої з модуляцією глюкокортикоїдного рецептора, за яким вводять суб'єкту сполуку за п. 1. Заявлений винахід стосується сполук, що є модуляторами глюкокортикоїдного рецептору. Заявлений винахід також стосується композицій та способів застосування сполук та композицій Модулятори глюкокортикоїдного рецептору є лігандами глюкокортикоїдного рецептору, що застосовують для лікування різних станів внаслідок їх потужної антизапальної, антипроліферативної та імуномодуляторної активності. J. Міnеr, еt аl., Ехреrt Оріn. Іnvеstіg. Drugs (2005) 14(12):15271545. Приклади модуляторів глюкокортикоїдного рецептору охоплюють дексаметазон, преднізон, преднізолон, RU-486, та описані у WО 2000/66522 та WО 2004/005229. Лікування модуляторами глюкокортикоїдного рецептору є часто асоційованим з побічною дією, як-то втрата кісток та остеопороз. Ототожнення модулятор глюкокортикоїдного рецептору, що є ефективною, потужною та має зменшену побічну дію, є медичною необхідністю. В одному втіленні винахід стосується сполуки формули І: Термін "носій" описує інгредієнт, інший, ніж сполука. Носії можуть бути фармацевтично прийнятним матеріалом або розчинником. Приклади охоплюють рідкі або тверді наповнювачі, розріджувачі, наповнювачі, розчинники або інкапсулювальні матеріали. Вираз "контактування глюкокортикоїдного рецептору" означає іn vіvо, ех vіvо, або іn vіtrо контактування з глюкокортикоїдним рецептором та стосується застосування сполуки або солі заявленого винаходу до особи, що має глюкокортикоїдний рецептор, а також, наприклад, уведення сполуки або солі винаходу у зразок, що містить клітинний, неочищений або очищений препарат, що містить глюкокортикоїдний рецептор. Наприклад, контактування стосується взаємодії між сполукою та рецептором, як-то зв'язування. Вираз "стан, пов'язаний із запаленням" стосується вибраного з групи: артрит, фіброміалгія, анкілозувальний спондиліт, псоріаз, системний червоний вовчак, подагра, недиференційована спондилоартропатія, спондилоартрит з початком в юнацтві, хвороба Крона, виразковий коліт, синдром подразненого кишечнику, запальна хвороба кишечнику та біль, асоційований з вищезгаданими станами. Конкретні приклади артриту охоплюють ревматоїдний артрит, остеоартрит, реактивний артрит, інфекційний артрит, псоріатичний артрит, поліартрит, юнацький артрит, юнацький ревматоїдний артрит, юнацький реактивний артрит, та юнацький псоріатичний артрит. Термін "модуляція" або "модулятори" стосується антагоністу, агоністу, часткових антагоністів та часткових агоністів. Термін "особа" стосується будь-якої тварин, у тому числі ссавців, як-то мишей, щурів, інших гризунів, кролів, собак, котів, свиней, великої рогатої худоби, овець, коней, приматів або людей. Термін "лікування" стосується паліативного, відновлювального та превентивного ("профілактичного") лікування особи. Термін "паліативне лікування" стосується лікування, що полегшує або зменшує вплив або інтенсивність стану у особи без зцілення стану. Термін "превентивне лікування" (та відповідний термін "профілактичне лікування") стосується лікування, що попереджує появу стану у особи. Термін "відновлювальне лікування" ("цілюще") стосується лікування, що припиняє прогресування, зменшує патологічні вияви, або повністю усуває стан у особи. Лікування можна проводити терапевтично ефективною кількістю сполуки, солі або композиції, що викликає біологічну або медичну реакцію тканини, системи або особи, чого прагне дослідник, ветеринар або лікар. В. Сполуки R1 O CF3 (l) CH3 H H N N O 1 де R - -Н або -Р(О)(ОН)2; або її солі. У ще одному втіленні винахід стосується композицій, що містять сполуку формули І та носій. У ще одному втіленні винахід стосується способу контактування глюкокортикоїдного рецептору зі сполукою формули І. Ще одне втілення стосується способів лікування стану у особи, опосередкованого активністю глюкокортикоїдного рецептору застосуванням до особи сполуки формули І. Цей детальний опис втілень призначено тільки для ознайомлення спеціалістів з винаходами, принципами та практичними застосуваннями так, щоб спеціалісти могли адаптувати та застосовувати винаходи в їх численних формах, оскільки вони можуть бути найкраще придатними для потреб конкретного застосування. Ці винаходи, тому, не є обмеженими втіленнями у цьому описі та можуть бути модифікованими. А. Визначення Для наступних визначених термінів застосовувано ці визначення, якщо відмінні визначення не надані у формулі винаходу або будь-де у цьому описі. 5 95332 Заявлений винахід стосується, зокрема, трициклічних сполук формули І. Ці сполуки є корисними як модулятори глюкокортикоїдного рецептору. Заявлений винахід стосується сполуки формули І: R1 O CF3 (І) CH3 H H N N O 1 де R – -Н або -Р(О)(ОН)2; або її солей. Заявлений винахід стосується сполуки формули ІІ: R1 O CF3 (ІІ) CH3 H H N N O 1 де R – -Н або -Р(О)(ОН)2; або її солей. Заявлений винахід стосується сполук форму1 ли І або ІІ де R – -Н, або їх солей. Заявлений винахід стосується сполук форму1 ли І або ІІ де R – -Р(О)(ОН)2, або їх солей. Заявлений винахід стосується (4βS,7R,8αR)4β-бензил-7-гідрокси-N-(2-метилпіридин-3-іл)-7(трифлуорметил)-4β,5,6,7,8,8α,9,10октагідрофенантрен-2-карбоксаміду або його солей; та (2R,4αS,10αR)-4α-бензил-7-((2метилпіридин-3-іл)карбамоїл)-2-(трифлуорметил)1,2,3,4,4α,9,10,10α-октагідрофенантрен-2-іл дигідрогенфосфату або його солей. Солі сполук заявленого винаходу охоплюють їх кислотно-адитивні та основ солі (у тому числі дисолі) -. В одному втіленні заявлений винахід стосується гідрогенхлориду сполуки формули І. У ще одному втіленні заявлений винахід стосується солі кальцію сполуки формули І. У ще одному втіленні заявлений винахід стосується солі натрію сполуки формули І. Придатні кислотно-адитивні солі утворюють з кислот, котрі утворюють нетоксичні солі. Приклади охоплюють ацетат, аспартат, бензоат, безилат, гідрогенкарбонат/карбонат, гідрогенсульфат/сульфат, борат, камзилат, цитрат, едизилат, езилат, форміат, фумарат, глюсептат, глюконат, глюкуронат, гексафлуорфосфат, гібензат, гідрогенхлорид/хлорид, гідрогенбромід/бромід, гідрогенйодид/йодид, ізетіонат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напзилат, 6 нікотинат, нітрат, оротат, оксалат, пальмітат, памоат, фосфат/гідрогенфосфат/дигідрогенфосфат, сахарат, стеарат, сукцинат, тартрат, тозилат та трифлуорацетат. Придатні солі основ утворюють з основами, котрі утворюють нетоксичні солі. Приклади охоплюють солі алюмінію, аргініну, бензатину, кальцію, холіну, діетиламіну, діоламіну, гліцину, лізину, магнію, меглуміну, оламіну, калію, натрію, трометаміну та цинку. Для огляду придатних солей, дивись "Наndbооk оf Рhаrmасеutісаl Sаlts: Рrореrtіеs,Sеlесtіоn, аnd Usе" Stаhl аnd Wеrmuth (Wіlеу-VСН, Wеіnhеіm,Gеrmаnу, 2002). Сіль можна легко отримати змішуванням разом розчинів сполуки заявленого винаходу та потрібної кислоти або основи. Сіль можна осаджувати з розчину та збирати фільтруванням або можна збирати випарюванням розчиннику. Ступінь іонізації солі може варіювати від повністю іонізованого до майже неіонізованого. Сполуки заявленого винаходу можна застосовувати як проліки. Таким чином, деякі похідні, котрі можуть мати невелику фармакологічну активність або не мати її при застосуванні до організму, можуть перетворюватися у сполуки заявленого винаходу, що мають потрібну активність, наприклад, гідролітичним розщепленням. Так похідні визначені як "проліки". Подальшу інформацію стосовно застосування проліків можна знайти у "РrоDrug аs Nоvеl Dеlіvеrу Sуstеms,Vоl.14, АСS Sуmроsіum Sеrіеs (Т Ніguсhі аnd W Stеllа) аnd "Віоrеvеrsіblе Саrrіеrs іn Drug Dеsіgn", Реrgаmоn Рrеss,1987 (еd. Е В Rосhе, Аmеrісаn Рhаrmасеutісаl Аssосіаtіоn). Проліки можна, наприклад, отримувати заміщенням прийнятних функціональних груп у сполуках заявленого винаходу деякими компонентами, відомими спеціалістам як "про-компоненти" як описано, наприклад, у "Dеsіgn оf Рrоdrugs" Н Вundgааrd (Еlsеvіеr,1985). Деякі приклади таких проліків охоплюють ті: (і), де сполука містить спиртову функціональну групу (-ОН), її етер, наприклад, заміщення гідрогену (С1-С6)алканоїлоксиметилом; та (іі), де сполука містить вторинну амінофункціональну групу, її амід, наприклад, заміщення гідрогену (С1-С10)алканоїлом. Зрештою, деякі сполуки заявленого винаходу можуть самі діяти як проліки інших сполук заявленого винаходу. Наприклад, деякі сполуки формули І або ІІ можна розглядати як проліки інших сполук формул І або ІІ. Усі ізомери, як-то стереоізомери, геометричні (цис/транс або Z/Е) ізомери та таутомерні форми сполук або солей є у рамках заявленого винаходу, у тому числі сполуки або солі, що мають більше, ніж один тип ізомерії, та суміші одної або більше з них. Наприклад, нижченаведене зображує сполуку формули І та таутомер. 7 95332 8 R1 R1 O O CF3 CF3 CH3 N H N CH3 H N O (I) Також охопленими є кислотно-адитивні солі або солі основ де протиіон є оптично активним, наприклад, D-лактат або L-лізин, або рацемічні, наприклад, DL-тартрат або DL-аргінін. Ізомери можна розділяти звичайними способами, добре відомими спеціалістам. Заявлений винахід стосується мічених ізотопами сполук винаходу де один або більше атомів є заміщеними атомами, що мають те ж атомне число, але атомну масу або масове число відмінні від атомної маси або масового числа звичайних у природі. Мічені ізотопами сполуки винаходу можна загалом отримати звичайними способами, відомими спеціалістам або способами, аналогічними описаним у нижченаведених прикладах та отриманнях, застосовуючи прийнятні мічені ізотопами реагенти замість немічених реагентів. Для лікування станів, визначених нижче, можна застосовувати сполуки заявленого винаходу. Солі сполук заявленого винаходу можна застосувати також. С. Композиції Сполуки або солі заявленого винаходу можуть бути частиною композиції. Композиції можуть також містити одну або більше сполук або солей заявленого винаходу. Композиція може також мати енантіомерний надлишок одної або більше сполук заявленого винаходу. Інші фармакологічно активні речовини та носії можуть бути у композиції. Одним втіленням є композиція, що містить сполуку формули І або її сіль. Ще одним втіленням є композиція, що містить сполуку формули І або її сіль та носій. Наприклад, носієм може бути наповнювач. Вибір наповнювачу залежить від факторів, як-то конкретний режим застосування, дія наповнювачу на розчинність та стабільність, та природа форми дозування. Композиція може бути твердою, рідкою або обома, та може бути сформованою зі сполукою як композиція одиничної дози, наприклад, таблетки, котра може містити від 0,05 % до 95 % за масою активних сполук. Сполуки або солі заявленого винаходу можна сполучати з придатними полімерами як носіями. D. Способи Заявлений винахід стосується способу контактування глюкокортикоїдного рецептору зі сполукою або сіллю заявленого винаходу. Заявлений винахід також стосується способу лікування стану, опосередкованого активністю глюкокортикоїдного рецептору, у особи, що H N O H полягає у застосуванні до особи сполуки або солі заявленого винаходу. Стан, опосередкований активністю глюкокортикоїдного рецептору стосується нижченаведеного: а) ендокринні розлади, як-то первинна або вторинна адренокортикальна недостатність, уроджена надниркова гіперплазія, негнійний тиреоїдит, та гіперкальцемія, асоційована з раком; b) ревматичні розлади, як-то псоріатичний артрит, ревматоїдний артрит, у тому числі юнацький ревматоїдний артрит, анкілозувальний спондиліт, гострий та підгострий бурсит, гострий неспецифічний теносиновіт, гострий подагричний артрит, пост-травмвтичний остеоартрит, синовіт від остеоартриту та епікондиліт; с) колагенові хвороби, як-то системний червоний вовчак, та гострий ревматичний кардит; d) дерматологічні стани, як-то пемфігус, герпетиформа булезного дерматиту, сувора ексудативна багатоформна еритема (синдром СтевенсаДжонсона), ексфоліативний дерматит, грибовидний мікоз, псоріаз та себорейний дерматит; е) алергічні стани, як-то сезонні або цілорічні алергії, алергічний риніт, бронхіальна астма, контактний дерматит, атопічний дерматит, сироваточна хвороба, реакції гіперчутливості до ліків; f) очні хвороби та стани, як-то алергічні корнеальні граничні виразки, очний герпес, запалення переднього сегменту, дифузний задній увеїт та хоріоїдит, хронічний увеїт, симпатична офтальмія, алергічний кон'юнктивіт, кератит, хоріоїретиніт, зоровий неврит, ірит та іридоцикліт; g) респіраторні хвороби, як-то симптоматичий саркоїдоз, синдром Лефлера, бериліоз, блискучий або розсіяний туберкульоз легень, та аспіраційний пневмоніт; h) гематологічні розлади, як-то геморагічна пурпура, вторинна тромбоцитопенія, набута (автоімунна) гемолітична анемія, еритробластопенія (RВС-анемія), та уроджена (еритроїдна) гіпопластична анемія; і) неопластичні хвороби, як-то лейкемія та лімфома; j) набряклі стани, що викликають діурез чи виділення протеїнурії при нефротичному синдромі, без уремії, ідіопатичного типу, або внаслідок червоного вовчаку; k) шлунково-кишкові хвороби, як-то виразковий коліт, регіонарний ентерит, запальна хвороба кишечнику, хвороба Крона, гастрит, синдром подразненого кишечнику; l) змішані стани, як-то туберкульозний менінгіт та трихінелез; та 9 m) неврологічні стани, як-то хвороба Альцгеймера, хвороба Паркінсона, хвороба Хантингтона, бічний аміотрофічний склероз, поранення спинного хребта, глибока психотична депресія та периферійна невропатія. Стан, опосередкований активністю глюкокортикоїдного рецептору також стосується нижченаведеного: відторгнення трансплантату (наприклад, нирок, печінки, серця, легень, підшлункової залози (наприклад, острівкових клітин), кісткового мозку, рогівки, тонкого кишечнику, алотрансплантатів шкіри, гомотрансплантатів шкіри (як-то у лікуванні опіків), ксенотрансплантатів серцевих клапанів, сироваточна хвороба та хвороба трансплантат проти хазяїна, автоімунні хвороби, як-то ревматоїдний артрит, псоріатичний артрит, розсіяний склероз, діабет типу І та ІІ, юнацький діабет, ожиріння, астма, запальна хвороба кишечнику (як-то хвороба Крона та виразковий коліт), піодерматоз, вовчак (системний червоний вовчак), бульбоспинальний параліч, псоріаз, дерматит, дерматоміозит; екзема, себорея, запалення легень, очний увеїт, гепатит, хвороба Граве, тиреоїдит Хашимото, автоімунний тиреоїдит, синдром Бекхета або Шегрена (сухі очі/рот), згубна або імуногематолітична анемія, атеросклероз, хвороба Адддисона (автоімунна хвороба надниркових залоз), ідіопатична надниркова недостатність, автоімунна полігландулярна хвороба (також, відома як автоімунний полігландулярний синдром), гломерулонефрит, склеродерма, обмежена склеродерма, плоский лишай, вітиліго (депігментація шкіри), гніздова алопеція, автоімунна алопеція, автоімунний гіпопітуїтаризм, синдром Джилліана-Барре та альвеоліт; опосередковані гіперчутливістю Т-клітин хвороби, у тому числі контактна гіперчутливість, гіперчутливість затриманого типу, контактний дерматит (у тому числі внаслідок отруйного плюща), кропивниця, алергії шкіри, респіраторні алергії (сінна лихоманка, алергічний риніт) та глютен-чутлива ентеропатія; запальні хвороби, як-то остеоартрит, гострий панкреатит, хронічний панкреатит, гострий респіраторний дистрес-синдром, синдром Сезарі та хвороби судин, котрі мають запальний та або проліфераторний компонент, як-то рестеноз, стеноз та атеросклероз. Стан, опосередкований активністю глюкокортикоїдного рецептору також стосується нижченаведеного: а) астма будь-якого типу, етіології або патогенезу, зокрема астма, що є членом вибраним з групи: атопічна астма, неатопічна астма, алергічна астма, атопічна бронхіальна опосередкована lgЕ астма, бронхіальна астма, есенціальна астма, істинна астма, спадкова астма, викликана паторфізіологічними порушеннями, набута астма, викликана факторами довкілля, есенціальна астма з невідомої або невідкритої причини, неатопічна астма, астма при бронхіті, емфізематозна астма, викликана вправами астма, викликана алергенами астма, викликана холодним повітрям астма, професійна астма, інфекційна астма, викликана бактеріями, грибками, найпростішими або вірусами, 95332 10 неалергічна астма, початкова астма, синдром хрипкої дитини та бронхіоліт; b) хронічний або гострий бронхостеноз, хронічний бронхіт, закупорка тонких дихальних шляхів та емфізема; с) обструктивні або запальні хвороби дихальних шляхів будь-якого типу, етіології або патогенезу, зокрема, обструктивній або запальній хворобі дихальних шляхів, що є членом вибраним з групи: хронічна еозинофільна пневмонія, хронічна обструктивна хвороба легень (СОРD), СОРD, що супроводжується хронічним бронхітом, емфіземою легень або задишкою, асоційованою або не асоційованою з СОРD, СОРD, що характеризується необоротною, прогресуючою закупоркою дихальних шляхів, респіраторний дистрес-синдром дорослих (АRDS), загострення гіперреактивності дихальних шляхів внаслідок терапії іншими ліками та хвороба дихальних шляхів, що є асоційованою з гіпертензією легень; d) бронхіт будь-якого типу, етіології або патогенезу, зокрема, бронхіт, що є членом вибраним з групи: гострий бронхіт, гострий гортаннотрахеальний бронхіт, арахідний бронхіт, катаральний бронхіт, крупозний бронхіт, сухий бронхіт, інфекційний астматичний бронхіт, продуктивний бронхіт, стрептококовий або стафілококовий бронхіт та пухирчатий бронхіт, гостре поранення легень; та е) бронхоектаз будь-якого типу, етіології або патогенезу, зокрема, бронхоектаз, що є членом вибраним з групи: циліндричний бронхоектаз, осумкований бронхоектаз, веретеноподібний бронхоектаз, капілярний бронхоектаз, кистозний бронхоектаз, сухий бронхоектаз та фолікулярний бронхоектаз. Ще одне втілення стосується застосування сполуки або солі заявленого винаходу для застосування у лікуванні обструктивних або запальних хвороб дихальних шляхів будь-якого типу, етіології або патогенезу, зокрема, обструктивних або запальних хвороб дихальних шляхів, що є вибраними з групи: хронічна еозинофільна пневмонія, хронічна обструктивна хвороба легень (СОРD), СОРD, що супроводжується хронічним бронхітом, емфіземою легень або задишкою, асоційованою або не асоційованою з СОРD, СОРD, що характеризується необоротною, прогресуючою закупоркою дихальних шляхів, респіраторний дистрес-синдром дорослих (АRDS), загострення гіперреактивності дихальних шляхів внаслідок терапії іншими ліками та хвороба дихальних шляхів, що є асоційованою з гіпертензією легень, або астма будь-якого типу, етіології або патогенезу, зокрема астма, що є членом вибраним з групи: атопічна астма, неатопічна астма, алергічна астма, атопічна бронхіальна опосередкована lgЕ астма, бронхіальна астма, есенціальна астма, істинна астма, спадкова астма, викликана паторфізіологічними порушеннями, набута астма, викликана факторами довкілля, есенціальна астма з невідомої або невідкритої причини, неатопічна астма, астма при бронхіті, емфізематозна астма, викликана вправами астма, викликана алергенами астма, викликана холодним повітрям астма, професійна астма, інфекційна 11 астма, викликана бактеріями, грибками, найпростішими або вірусами, неалергічна астма, початкова астма, синдром хрипкої дитини та бронхіоліт. Заявлений винахід стосується способу лікування стану, пов'язаного із запаленням у особи, що полягає у застосуванні до особи сполуки або солі заявленого винаходу. Заявлений винахід стосується способу лікування станів, як-то астма, дерматит, запальна хвороба кишечнику, хвороба Альцгеймера, глибока психотична депресія, невропаті, відторгнення трансплантату, розсіяний склероз, хронічний увеїт, або хронічна обструктивна хвороба легень у особи, що полягає у застосуванні до особи сполуки або солі заявленого винаходу. Заявлений винахід стосується способу лікування ревматоїдного артриту у особи, що полягає у застосуванні до особи сполуки або солі заявленого винаходу. Ревматоїдний артрит вважають хронічною автоімунною та запальною хворобою із запаленням суглобів, котрі з часом набрякають, стають больовими, та починається руйнування хрящів, кісток та зв'язок суглобу. Результатом ревматоїдного артриту є деформування, нестабільність та нерухомість суглобу та рубцювання у суглобі. Суглоби руйнуються з високо змінюваною швидкістю. Багато факторів, у тому числі генетична схильність, можуть впливати на хворобу. Люди з ревматоїдним артритом можуть мати помірний перебіг, випадкові спалахи з довгими періодами ремісії без хвороби, або постійно прогресуючу хворобу, що може бути повільною або швидкою. Ревматоїдний артрит може починатися раптово, з багатьма запаленими суглобами. Більш часто, він починається повільно, поступово вражаючи відмінні суглоби. Звичайно, запалення є симетричним, з суглобами, враженими з обох боків тіла. Звичайно, невеликі суглоби у пальцях, руках, ступнях, зап'ястках та ліктях стають запаленими першими, а потім коліна та стегна. Біль, асоційований із ревматоїдним артритом є звичайно соматичним ноцицептивним болем суглобів. Набряклі зап'ястки можуть стискати нерв та призводити до нерухомості або поколювання внаслідок зап'ясткового тунельного синдрому. Кісти можуть розвиватися ззаду вражених колінок, можуть руйнуватися, викликаючи біль та набрякання у нижчих кінцівках. Заявлений винахід стосується способу лікування дерматиту у особи, що полягає у застосуванні до особи сполуки або солі заявленого винаходу. Заявлений винахід стосується способу лікування хронічної обструктивної хвороби легень у особи, що полягає у застосуванні до особи сполуки або солі заявленого винаходу. Заявлений винахід стосується способу лікування астми у особи, що полягає у застосуванні до особи сполуки або солі заявленого винаходу. Заявлений винахід стосується способу лікування хвороби Альцгеймера у особи, що полягає у застосуванні до особи сполуки або солі заявленого винаходу. 95332 12 Заявлений винахід стосується способу зменшення побічної дії, асоційованої з модуляцією глюкокортикоїдного рецептору, що полягає у застосуванні сполуки формули І до особи. Заявлений винахід стосується способу зменшення побічної дії, асоційованої з лікуванням преднізолоном, що полягає у застосуванні сполуки формули І до особи. Заявлений винахід крім того стосується способів лікування вищезгаданих станів, хвороб та розладів у особи, або особи схильної до такого стану, застосуванням до особи одної або більше сполук або солей заявленого винаходу. В одному втіленні вищезгаданим лікуванням є превентивне лікування. У ще одному втіленні вищезгаданим лікуванням є паліативне лікування. У ще одному втіленні вищезгаданим лікуванням є відновлювальне лікування. Е. Дозування та Застосування Для вибору найбільш прийнятних форм дозування та шляху застосування для лікування запропонованих показань, сполуки або солі винаходу можна оцінювати стосовно їх біофармацевтичних властивостей, як-то розчинність та стабільність розчину (стосовно рН), та проникність. Дози для сполук або солей винаходу є у межах від 0,1 мг до 100 мг для перорального застосування та від 2 мг або менше для застосування інгаляцією. Дозу можна застосовувати одиничною або поділеними дозами та вона може бути поза межами, наданими тут. Дозування базується на середній особі людини, що має масу приблизно 60-70 кг. Дозування та режим дозування залежать від особи та різних станів, що можуть впливати на дозування (вік, стать, маса тіла, тощо). Лікар легко здатний визначити дози для особи, чия маса є поза цими межами, як-то діти та старики. Пероральне Застосування Сполуки винаходу та їх солі можна застосовувати перорально. Пероральне застосування може полягати у ковтанні, так, щоб сполук або сіль потрапила у шлунково-кишковий тракт, та/або букальному, лінгвальному або сублінгвальному застосуванні, котрим сполука або сіль потрапляє у потік крові безпосередньо з рота. Композиції, придатні для перорального застосування охоплюють тверді, напівтверді та рідкі системи, як-то таблетки; м'які або тверді капсули, що містять багато частинок або наночастинок, рідини, або порошки; пастилки (у тому числі заповнені рідиною); жувальні гумки; гелі; швидко дисперговувані форми дозування; плівки; спреї; та букальні/слізові липкі пластири. Крім того, сполук або солі винаходу можна застосовувати як висушені розпиленням дисперсії. Рідкі композиції охоплюють суспензії, розчини, сиропи та еліксири. Так композиції можуть наповнювачам у м'яких або твердих капсулах (наприклад, з желатину або гідроксипропілметилцелюлози) та звичайно містять носій, наприклад, воду, етанол, поліетиленгліколь, пропіленгліколь, метилцелюло 13 зу, або придатну олію, та один або більше емульгаторів та/або суспендувальних агентів. Рідкі композиції можна також отримати відтворенням твердого продукту, наприклад, з пакетику. Сполуки винаходу та їх солі можна застосувати також у швидко розчинюваній, швидко дезінтегровуваній формі дозування, як-то описаній у Ехреrt Оріnіоn іn Тhеrареutіс Раtеnts,11 (6), 981986,Lіаng та Сhеn (2001). Для форми дозування таблеток, залежно від дози, ліки можуть складати від 1 мас. % до 80 мас. % форми дозування, більш звичайно від 5 мас. % до 60 мас. % форми дозування. На додаток до ліків, таблетки загалом містять дезінтегратор. Приклади дезінтеграторів охоплюють натрію крохмаль-гліколят, карбоксиметилцелюлозу натрію, карбоксиметилцелюлозу кальцію, кроскармелозу натрію, кросповідон, полівінілпіролідон, метилцелюлозу, мікрокристалічну целюлозу, заміщену нижчим алкілом гідроксипропілцелюлозу, крохмаль, пептизований крохмаль та натрію альгінат. Загалом, дезінтегратор складатиме від 1 мас. % до 25 мас. %, переважно від 5 мас. % до 20 мас. % форми дозування. Зв'язуючі загалом застосовують для надання властивостей до зчеплення композиції таблеток. Придатні зв'язуючі охоплюють мікрокристалічну целюлозу, желатин, цукор, поліетиленгліколь, природні та синтетичні смоли, полівінілпіролідон, пептизований крохмаль, гідроксипропілцелюлозу та гідроксипропілметилцелюлозу. Таблетки можуть також містити розріджувачі, як-то лактозу (моногідрат, висушений розпиленням моногідрат, безводну тощо), манітол, ксилітол, декстрозу, сахарозу, сорбітол, мікрокристалічну целюлозу, крохмаль та кальцію двоосновний фосфат дигідрат. Таблетки можуть також містити поверхневоактивні агенти, як-то натрію лаурилсульфат та полісорбат 80, та гліданти, як-то силіцій діоксид та тальк. При наявності поверхнево-активні агенти можуть складати від 0,2 мас. % до 5 мас. % таблетки, а гліданти можуть складати від 0,2 мас. % до 1 мас. % таблетки. Таблетки також загалом містять лубриканти, як-то магнію стеарат, кальцію стеарат, цинку стеарат, натрію стеарилфумарат, та суміші магнію стеарату з натрію лаурилсульфатом. Лубриканти загалом містять від 0,25 мас. % до 10 мас. %, переважно від 0,5 мас. % до 3 мас. % таблетки. Інші можливі інгредієнти охоплюють антіокисиданти, барвники, ароматизатори, консерванти та агенти маскування смаку. Таблетки містять до 80 % ліки, приблизно від 10 мас. % до 90 мас. % зв'язуючого, приблизно від 0 мас. % до 85 мас. % розріджувачу, приблизно від 2 мас. % до 10 мас. % дезінтегратор, та приблизно від 0,25 мас. % до 10 мас. % лубриканту. Тверді композиції для перорального застосування можна формувати для негайного та/або модифікованого вивільнення. Композиції для модифікованого вивільнення охоплюють затримане, безперервне, імпульсне, регульоване, цілеспрямоване та програмоване вивільнення. 95332 14 Придатні композиції винаходу для модифікованого вивільнення є описаними у патенті США 6,106,864. Деталі інших придатних способів вивільнення, як-то високо енергетичні дисперсії та осмотичні та покриті частинки можна знайти у Рhаrmасеutісаl Тесhnоlоgу Оn-lіnе, 25(2), 1-14, Vеrmа еt аl (2001). Межі доз для перорального застосування також охоплюють від 0,1 мг до 80 мг, 15 мг – 80 мг, 0,1 мг – 25 мг. Парентеральне застосування Сполуки або солі винаходу можна також застосовувати у потік крові безпосередньо, у м'язи, або у внутрішній орган. Приклад 2 можна застосовувати у потік крові. Придатні засоби для парентерального застосування охоплюють внутрішньовенні, інтрартеріальні, інтраперитонеальні, інтратекальні, інтравентрикулярні, інтрауретральні, інтрастернальні, інтракраніальні, внутрішньом'язові, інтрасиновіальні та підшкірні. Придатні пристрої для парентерального застосування охоплюють голку (у тому числі мікроголку) ін'єктори, безголкові ін'єктори та засоби вливання. Парентеральні композиції є звичайно водними розчинами, котрі можуть містити наповнювачі, якто солі, вуглеводи та буферувальні агенти (переважно для рН від 3 до 9), але, для деяких застосувань, їх можна краще формувати як стерильні неводні розчини або як висушені форми для застосування разом з придатним розчинником, як-то стерильною водою без пірогену. Отримання парентеральних композицій у стерильних умовах, наприклад, ліофілізацією, можна легко досягти, застосовуючи стандартні фармацевтичні способи, добре відомі спеціалістам. Розчинність сполук заявленого винаходу та їх солей, застосованих в отриманні парентеральних розчинів можна підвищити застосуванням прийнятних способів композиції, як-то уведення агентів посилення розчинності. Композиції для парентерального застосування можна формувати для негайного та/або модифікованого вивільнення. Композиції для модифікованого вивільнення охоплюють затримане, безперервне, імпульсне, регульоване, цілеспрямоване та програмоване вивільнення. Таким чином сполуки винаходу можна формувати як суспензію або як твердий, напівтвердий продукт або тиксотропну рідину для застосування як імплантованого депо, що забезпечує модифіковане вивільнення активної сполуки. Приклади таких композицій охоплюють покриті ліками стенти та напівтверді продукти та суспензії, що містить завантажені ліками мікросфери з полі(dlмолочно-когліколевої)кислоти (РGLА). Місцеве застосування Сполуки або солі винаходу можна також застосовувати місцево, (інтра)дермально, або трансдермально до шкіри або слизової. Приклад 1 можна застосовувати до шкіри. Звичайні композиції для цього охоплюють гелі, гідрогелі, лосьйони, розчини, креми, мазі, порошки, пінки, плівки, шкірні пластири, імплантати, волокна, 15 бандажі та мікроемульсії. Ліпосоми можна застосувати також. Звичайні носії охоплюють спирт, воду, мінеральну оливу, рідкий вазелін, білий вазелін, гліцерин, поліетиленгліколь та пропіленгліколь. Посилювачі проникливості можна уводити - дивись, наприклад, J Рhаrm Sсі, 88 (10), 955-958,Fіnnіn та Моrgаn (Осtоbеr1999). Інші засоби місцевого застосування охоплюють електропорацію, іонофорез, фонофорез, сонофорез та мікроголкові або безголкові (наприклад, Роwdеrjесt™, Віоjесt™, тощо) ін'єкції. Композиції для місцевого застосування можна формувати для негайного та/або модифікованого вивільнення. Композиції для модифікованого вивільнення охоплюють затримане, безперервне, імпульсне, регульоване, цілеспрямоване та програмоване вивільнення. Застосування інгаляцією/інтраназальне Сполуки або солі винаходу можна також застосовувати інтраназально або інгаляцією, звичайно у форм сухого порошку (поодинці, як суміш, наприклад, з сухою лактозою, або як частинки змішаних компонентів, наприклад, змішаних з фосфоліпідами, як-то фосфатидилхолін) з інгалятору сухого порошку, як аерозольний спрей з контейнеру під тиском, насосу, розбризкувачу (переважно розбризкувачу, що застосовує електрогідродинаміку для отримання дрібного туману), або розпилювач, із або без застосування придатного пропеленту, як-то 1,1,1,2тетрафлуоретан або 1,1,1,2,3,3,3гептафлуорпропан, або як назальні краплі. Для інтраназального застосування, порошок може містити біоадгезивний агент, наприклад, хітозан або циклодекстрин. Контейнер під тиском, насос, розбризкувач, або розпилювач містить розчин або суспензію сполуки винаходу, що містить, наприклад, етанол, водний етанол, або придатний альтернативний агент для диспергування, розчинення, або вивільнення розширюванням активного засобу, пропелент як розчинник, та необов'язково сурфактант, як-то сорбітан триолеат, олеїнова кислота або олігомолочна кислота. До застосування у композиції сухого порошку або суспензії, ліки мікронізують до розміру, придатного для доставляння інгаляцією (звичайно менше, ніж 5 мікрон). Це можна досягти будь-яким прийнятним способом, як-то струминний млин, для утворення наночастинок, гомогенізацією високого тиску або сушкою розпиленням. Капсули (наприклад, з желатину або гідроксипропілметилцелюлози), блістери та картриджі для застосування в інгаляторі або інсуфляторі можна формувати з вмістом порошкової суміші сполуки винаходу, придатної порошкової основи, як-то лактоза або крохмаль та модифікатору, як-то L-лейцин, манітол, або магнію стеарат. Лактоза може бути безводною або у формі моногідрату. Інші придатні наповнювачі охоплюють дестран, глюкозу, мальтозу, сорбітол, ксилітол, фруктозу, сахарозу та трегалозу. Придатна композиція розчину для застосування у розбризкувачі, застосовуючи електрогідродинаміку, може містити сполуку заяв 95332 16 леного винаходу, пропіленгліколь, стерильну воду, етанол та натрію хлорид. Альтернативні розчинники, котрі можна також застосовувати замість пропіленгліколю, охоплюють гліцерин та поліетиленгліколь. Композиції для застосування інгаляцією/інтраназально можна формувати для негайного та/або модифікованого вивільнення, застосовуючи, наприклад, РGLА. Композиції для модифікованого вивільнення охоплюють затримане, безперервне, імпульсне, регульоване, цілеспрямоване та програмоване вивільнення. У випадку інгаляторів сухого порошку та аерозолів, одиниці дозування визначають за допомогою клапана, котрий видає виміряну кількість. Одиниці згідно з винаходом звичайно підганяють до застосування виміряної дози, котру можна застосовувати як одиничну дозу або, більш звичайно, як поділені дози протягом доби. Межі доз для застосування інгаляцією – від 2 мг і менше або 1 мг і менше. Комбінації Сполуки або солі винаходу можна застосовувати у комбінації з одним або більше іншими терапевтичними агентами, як-то ліки. Сполуку заявленого винаходу або її сіль можна застосовувати одночасно або у відмінні часи як один або більше інших терапевтичних агентів. Наприклад, "у комбінації" стосується: одночасного застосування комбінації сполуки або солі винаходу та терапевтичного агенту до особи, коли такі компоненти формують разом в одиничну форму дозування, котра вивільняє вказані компоненти по суті одночасно до вказаної особи; по суті одночасного застосування комбінації сполуки або солі винаходу та терапевтичного агенту до особи при необхідності лікування, коли такі компоненти формують в окремі форми дозування, котрі приймають по суті одночасно, після чого вказані компоненти вивільняються по суті одночасно до вказаної особи; послідовного застосування комбінації сполуки або солі винаходу та терапевтичного агенту до особи, коли так компоненти формують окремо від кожного іншого в окремі форми дозування, котрі приймають у послідовні часи зі значним інтервалом часу між кожним застосуванням, після чого вказані компоненти вивільняються у по суті відмінні часи до вказаної особи; та послідовного застосування такої комбінації сполуки або солі винаходу та терапевтичного агенту до особи, коли такі компоненти формують разом в одиничну форму дозування, котра вивільняє вказані компоненти регульованим шляхом, після чого їх одночасно, послідовно, та/або перехресно застосовують у той же час та/або відмінні часи, де кожну частину можна застосовувати тим же або відмінним шляхом. Наприклад, сполуки або солі заявленого винаходу можна також у комбінації, частково або повністю, на додаток до інших антизапальних засобів. Придатні антизапальні засоби охоплюють циклоспорин, золедронову кислоту, ефалізумаб, алефацепт, етодолак, лорноксикам, ОМ-89, вальдекоксиб, тоцилізумаб, абатацепт, мелоксикам, 17 етанерцепт, намбуметон, римексолон, 153SmЕDТМР, просорба, імідазол саліцилат, опрелвекін, гіалуронову кислоту, напроксен, піроксикам, діацереїн, люмерикоксиб, такролімус, ацеклофенак, актприт, теноксикам, розиглітазон, дефлазакорт, адалімумаб, лефлуномід, ризедронат натрію, мізопростол та диклофенак, SК-1306Х, інфліксимаб, анакірна, целекоксиб, диклофенак, еторикоксиб та фелбінак, ревмакон, голімумаб, деносумаб, офатумумаб, антитіло 10rТ1, пелубіпрофен, лікофелон, темзиролімус, екулізумаб, ігуратимод, та преднізон. Інші придатні антизапальні засоби охоплюють СР-481715, АВN-912, МLN-3897, НuМах-ІL-15,RА-1, паклітаксел, Оrg-37663, Оrg39141, АЕD-9056, АМG-108, фонтолізумаб, пегсунерцепт, пралнакасан, апіоїмод, GW-274150, АТ-001,681323 (GSК) К-832,R-1503, окрелізумаб, DЕ-096, Срn10, ТНС+СВD (GW Рhаrmа), 856553 (GSК), RеN-1869, імуноглобулін, mm-093, амелубант, SСІО-469, АВТ-874, LеnkоVАХ, LY-2127399, ТRU-015, КС-706, дипіридамол, амоксапінет та дипіридамол, SО-715, РG760564,VХ-702, преднізолон та дипіридамол, РМХ-53, белімумаб, принаберел, СF-101, tgААV-ТNFR:Fс, R-788, преднізолон та SSRІ, дексаметазон, СР-690550 та РМІ-001. Спеціалісту також зрозуміло, що застосовуючи сполуки винаходу або їх солі у лікуванні конкретної хвороби, сполуки винаходу можна комбінувати з різними терапевтичними агентами, застосованими для цієї хвороби. Наприклад, сполуки або солі винаходу можна комбінувати з агентами, що модулюють одну або більше з нижченаведених цілей: Циклооксигеназа 2 (простагландин-ендопероксид-синтаза 2); ТNF-R (рецептор фактору некрозу пухлин типу 1); Циклооксигеназа (Сох 1 та 2; Неспецифічна); Мар-кіназа р38 (Неспецифічна); Рецептор Іl1 (типу І та ІІ, Неспецифічний); Арахідонат 5-ліпоксигеназа; Глюкокортикоїдний рецептор (GR); NF-kВ; Фактор некрозу пухлин (ТNF-альфа); Рецептор хемокіну ССR1; Рецептор лейкотриєну В4 (Неспецифічний); РDЕ4 (Фосфодіестераза 4; Неспецифічна); ІL6 рецептор; Інтегрин (Неспецифічний); АDАМ-17 (фермент перетворення ТNF-альфа); ІСЕ (Каспаза 1/інтерлейкін-1-бета-конвертаза); Ферменти синтезу простагландину (Неспецифічні); Рецептор речовини-Р (SРR/NК-1 рецептор); Рецептор простаноїду (Неспецифічний); білок адгезії клітин судин 1 (VСАМ 1); ММР-13 (колагеназа 3); Рецептор VЕGF (Неспецифічний); Рецептор хемотактичного анафілотоксину С5А (С5АR); інгібіторний фактор міграції макрофагів (МІF); Пурин-нуклеозидфосфорилаза (РNР); Бета 1 інтерферон; ММР-3 (стромелізин 1); Рецептор хемокіну ССR2; ММР-2 (желатиназа А); Рецептор фактору некрозу пухлин 5 (СD40); Рецептор хемокіну ССR5; Простагландин Е-синтаза; Активований проліфератором пероксизом рецептор гамма (РРАR-Гамма); Рецептор хемокіну СХСR4; Катепсин S; Протоонкоген LСК тирозин кіназа; Рецептор хемокіну СХСR3; Рецептор РDGF;FКВР (12FК-506); надродина Іg СТLА-4; Кіназа Білку С (РКС, Неспецифічна); Інтегрин альфа-V/бета-5; Катепсин К; 26S Протеазом; Мінералокортикоїдний рецептор (МR); субодиниця ІkВ кіназа бета (ІКК БЕТА); Рецептор фактору ак 95332 18 тивування тромбоцитів (РАF-R); Фарнезил пірофосфат FРР синтетаза; Рецептор хемокіну СХСR1; рецептор фактору стимулювання колоній макрофагів І (СSF-1R); рецептор 1 ІL18; рецептор Аденозину А3; фактор стимулювання колоній гранулоцитів-макрофагів- (GМСSF); SYК тирозин-кіназа; рецептор СRF (Неспецифічний); Альфа/Бета гетеродимер тубуліну; Тирозин Кіназа (Неспецифічна); Амілоїд бета; фактор стимулювання колоній макрофагів (МСSF); член надродини лігандів фактору некрозу пухлин 11 (активатор рецептору ліганду ядерного фактору каппа b); Фосфоліпаза (Неспецифічна); Рецептор естрогену (альфа/бета; Неспецифічний); ММР-9 (желатиназа В); Нітрогеноксид-синтаза (Неспецифічна); Індукована Нітрогеноксид-Синтаза (Неспецифічна); р53 клітинний антиген пухлин; Інсуліноподібний фактор росту 1 (соматомедин С); комплекс нікотинового асетилхолінового рецептору; опіоїдний рецептор Мu-типу (МОR-1); ІL11; Рецептор Тирозин-Кінази ЕRВВ/ЕGF (Неспецифічний); рецептор Гістаміну Н2; Дипептидил пептидаза ІV (DРР ІV, СD26); Тороізомераза ІІ; Рецептор хемокіну ССR7; Бактеріальна Дигідрофолат Редуктаза (Неспецифічна); Бета-тубулін; ДНК-полімераза (Людини, будь-який склад субодиниці); Рецептор хемокіну ССR4; Рецептор хемокіну ССR3; К+ (калію) Канал (Неспецифічний); Мітоген-активована білкова кіназа 14 (МАРК14 / Р38-альфа); кальцію канали L-типу (Неспецифічні); Рецептор хемокіну ССR6; РDЕ3 ((Фосфодіестераза 3; Неспецифічна); Цистеїнпротеаза (Неспецифічна); Залежний від натрію норадреналін-транспортер (NАТ); кіназа МАР2 (МЕК; Неспецифічна); Кіназа RАF (Неспецифічна); Гіпоксі-індукований рецептор фактору 1 альфа; NМDА; Рецептор естрогену бета (ЕR-бета); ДНК Людини; Рецептор холецистокініну типу В (ССКВ); рецептор брадикініну В1 (ВК1); пуриноцептор 7 Р2Х (Р2 × 7); рецептор аденозину А2А; Канабіноїдний рецептор 2 (СВ2); Сигма-опіоїдний рецептор; Канабіноїдний рецептор 1 (СВ1); Рецептор хемокіну СХСR2; інактиватор комплементного фактору І (С3В/С4В); Білкова кіназа В (RАС-Кіназа) (Неспецифічна); Комплекс Гамма секретази; СRТН2 (GРR44); р53-асоційований ген (МDМ2 убіквітинбілкова лігаза Е3); рецептор VІР (Неспецифічний); рецептор ІL1, тип І; ІL6 (інтерферон, бета 2); ММР (Неспецифічна); Інсулін; ММР-2/3/9; Кальцитонін/кальцитонін-пов'язаний поліпептид, альфа; Ліпоксигеназа (Неспецифічна); фактор росту ендотеліальних судин (VЕGF); Тромбін; Рецептор андрогену; Мар-кіназа (Неспецифічна); Статевий гормон-зв'язувальний глобулін; Хемокін ССL2 (МСР1/МСАF); Фосфоліпаза А2; Еритропоетин (ЕРО); Плазміноген; шлунковий протонний насос (Н+ К+ АТФаза); Каспаза (Неспецифічна); рецептор FGF (Неспецифічний); Активований проліфератором пероксизом рецептор альфа (РРАRальфа); рецептор МІР1а (Неспецифічний); білок зв'язування кальцію S100 (Неспецифічний); рецептор РGЕ (Неспецифічний); пептидил-аргініндеіміназа, тип ІV; комплекс РDGF (а/b); БетаЛактамаза та РВРs (Біосинтез стінок клітин); Опіоїдний рецептор (Неспецифічний); фермент перетворення ангіотензину 1 (АСЕ1); активатор плазмі 19 ногену типу урокінази (UРА); Фосфодіестераза (Неспецифічна РDЕ); Рецептор прогестерону (РR); рецептор 5НТ (серотонін) (Неспецифічний); член надродини факторів некрозу пухлин (лігандів) 5 (ліганд СD40); Тимідилат-синтаза; Інтегрин взаємодії Альфа4 - Паксилін; Інтегрин альфа-4 (VLА-4 / СD49D); ЕRК1; глюкоза-фосфат-ізомераза (фактор автокринної моторики); Рецептор допаміну (Неспецифічний); Хемокін СХСL12 (SDF-1); Білок мікросомального переносу тригліцеридів; Інтегрин альфа-5/бета-1; Перетворювач сигналів та активатор транскрипції 3 (фактор гостро-фазової реакції); інгібітор активатору плазміногену -1 (РАІ-1); Рецептор вітаміну D3 (VDR/1,25-дигідроксивітамін D3 рецептор); Комплекс ароматази (Р450аром та NАDРН-цитохром Р450 редуктаза); Білкова тирозин-фосфатаза (Неспецифічна); 3-гідрокси-3метилглутарил-кофермент А редуктаза (НМGСоА); Інтегрин бета-1 (бета субодиниця рецептор фібронектину); Інтегрин бета-1/альфа-11; Р селектин (GМР140/гранул мембранний білок-140); білок активування п'яти ліпоксигеназ (FLАР); Н+/К+ АТФаза (Неспецифічна); Канал Nа+ (натрію) (Неспецифічний); Тиреоїд-пероксидаза; керований потенціалом канал натрію альфа-1 мозку; Бета-2 адренергічний рецептор; ВСL1 (Циклін D1); Рецептор тиреоїдного гормону (Неспецифічний); рецептор фактору росту ендотеліальних судин 2 (VЕGFR-2/FLК1); Альфа-V/Бета-6 Інтегрин; Інтегрин альфа-V (субодиниця рецептору вітронектину альфа / СD51); SRС-Кіназа; плейотрофін (фактор росту зв'язування гепарину 8, фактор промотування фактору росту нейритів 1); остеопонтин (секретований фосфопротеїн 1); tоll-подібний рецептор 4 (ТLR4); Ванілоїдний рецептор (Неспецифічний); Кіназа Рі3 (Неспецифічна); Полі(АDР-рибоза)полімераза (РАRР); рецептор РРАR (Неспецифічний); Бета адренергічний рецептор (Неспецифічний); член підродини V тимчасових рецепторних потенційних катіонних каналів 1 (ТRРV1); Тороізомераза І; рецептор гістаміну Н1; кініноген; Кіназа ІКК (Неспецифічна); ВІЛ-ТАТ-білок; Тоll-подібний рецептор 2; родина розчинних носів 22 (транспортер органічних катіонів), член 4 (SLС22А4); рецептор RХR (Неспецифічний); Ренін (Ангіотензиногеназа); Рецептор гормону вивільнення гонадотропіну (GNRН-R); Білки зв'язування пеніциліну (Пептидази стінок клітин); Кальмодулін; Мітоген-активована білкова кіназа 1 (МАРК1 / ЕRК2); Кальцію канал (Неспецифічний); Агреканаза (неспецифічна); JNК Кіназа (Неспецифічна); транстиретин (ТТR); рецептор СХ3СR1; Фактор коагуляції ІІІ (тромбопластин, тканинний фактор); залежний від натрію транспортер серотоніну (5НТТ); фактор стимулювання колоній 1 (макрофагів); Тканинна трансглутаміназа (трансглутаміназа 2/ТGМ2); рецептор, специфічний стосовно підвищеного глікозилування кінцевого продукту; Моноамін-оксидаза (А та В; Неспецифічна); Рецептор гістаміну (Неспецифічний); Залежний від натрію транспортер допаміну (DАТ); Тромбопоетин (ліганд фактору росту та фактору розвитку мегакаріоцитів онкогену вірусу мієлопроліферативної лейкемії,); молекула активації передачі сигналів лімфоцитів; Нейтральна ендопептидаза (NЕР / 95332 20 Неприлізин); рецептор ендотеліну-1 (ЕТА); Тирозиназа; Мітоген-активована білкова кіназа 8 (МАРК8/JNК1); ІАР (інгібітор апоптозу) неспецифічний; Фосфоінозитид 3-кіназа; рецептор простагландину F2-альфа (Рецептор простаноїду FР); Гормон росту людини; Рецептор вазопресину (Неспецифічний); рецептор фактору росту мастоцитів/стовбурних клітин (С-КІТ); СDК (Неспецифічний); D4/5НТ1а (рецептор допаміну D4, рецептор серотоніну 1а); рецептор ангіопоетину 1 (ТІЕ-2) (ТЕК); Рецептор естрогену альфа (ЕR-альфа); Епідермальний рецептор фактору росту; Кіназа фокальної адгезії (Неспецифічна); Периферійний бензодіазепіновий рецептор (НРВS); Окситоциназа; Цитозольна фосфоліпаза А2; Ендопептидаза (Неспецифічна); рецептор FGFR1FGF 1; рецептор нейрокінінів NК1/NК2; комплекс проліл-4гідроксилази; Інтегрин альфа-5 (субодиниця рецептору фібронектину альфа / VLА-5 / СD49Е); Мускариновий рецептор ацетилхоліну (Неспецифічний); Тирозин-білкова кіназа JАК3 (JАNUS КІНАЗА 3); оdс1 – орнітин-декарбоксилаза; рецептор 5НТ3; Адреномедулін; гомолог фосфатидилінозитол-3кінази; рецептор еритропоетину; фактор росту сполучної тканини; RАС-альфа серин/треонінкіназа (Білкова кіназа В); Тоll-подібний рецептор 9; Нейрональна нітрогеноксид-синтаза (NОS1); опіоїдний рецептор каппа-типу (КОR-1); серцевий комплекс Nа+ каналу; рецептор білкової тирозинкінази ЕRВВ-2 (рецептор типу поверхні клітин тирозин-кінази НЕR2); Рецептор тромбіну (РАR-1); РDЕ4В (цАМФ-специфічний стосовно фосфодіестерази 4В / НSРDЕ4В); похідний від фактору росту тромбоцитів бета поліпептид; FКВР-рапаміцинасоційований білок (FRАР, mТОR); тромбомодулін; ВІЛ Протеаза (ретропепсин); РDЕ4D (цАМФспецифічний стосовно фосфодіестерази 4D / НSРDЕ4D); Аденозин-кіназа; Гістон-Деацетилаза (Неспецифічна); рецептор простагландину Е2, підтип ЕР4 (Рецептор простаноїду ЕР4); кіназа мітоген-активованої білкової кінази 3 (МАР2К3); ММР-12 (металоеластаза); рецептор ОХ40; Неспецифічна убіквітин-лігаза людини; Рецептор сульфонілсечовини (SUR1 (панкреатичний) та SUR2 (серцевий/гладеньких м'язів)); Фактор коагуляції Х (фактор Стюарта); Мар-кіназою активована білкова кіназа 2 (МАРКАРК-2); постійний регіон важкого ланцюга ІgЕ; рецептори допаміну D2+5НТ2А; рецептор 5-гідрокситриптаміну 4 (5НТ4); рецептор ангіотензину, Тип-1 ІІ (АТ1); Цитохром Р4503А4; циклофілін Т-клітин (циклофілін А); рецептор нейромедину К (рецептор NКR/NК-3); рецептор лейкотриєну В4; тирозин кіназа Брутонса (ВТК); кіназа мітоген-активованої білкової кінази 6 (МАР2К6); ендоглін; М1/D2/5НТ2; залежний від натрію рецептор транспортеру норадреналін + Допамін D4; кіназа мітоген-активованої білкової кінази 4 (МАР2К4); Білок теплового шоку Нsр90 А/В; гістидин-декарбоксилаза; родина розчинних носів 22 (транспортер органічних катіонів), член 5 (SLС22А5); СSК-тирозин-кіназа; пролілендопептидаза; Рецептор цистеїніл-лейкотриєну (СYSLТ1); Ядерний рецептор NURR1 (білок передранньої реакції НЕ); Тоll-подібний рецептор 3; активований протеїназою рецептор 2 (РАR-2); ре 21 цептор простацикліну (рецептор простаноїду ІР); інгібітор серин- (або цистеїн) протеїнази, клад F (альфа-2 антиплазмін, фактор похідного від епітелію пігмент), член 1; рецептор аденілат циклази активування поліпептиду слизової тип 1 (РАСАРR-1); надродина фактору некрозу пухлин (ліганд), член 10; С-МАF (коротка форма); Ацетилхолінестераза (АСНЕ); Альфа1-адренергічний рецептор (Неспецифічний); Рецептор GАВА А Вzзв'язування; рецептор лізосфінголіпіду ЕDG-1; молекула-1 слизового адресину адгезії клітин (МАdСаm); адренергічний рецептор альфа-1L; Рецептор фактору росту гепатоцитів (МЕТ Протоонкоген-тирозин-кіназа); Мускариновий рецептор ацетилхоліну М3; МЕК1; рецептор інсуліну; рецептор GАВА (А + В; Неспецифічний); Фосфатидилінозитол-3-кінази каталітична субодиниця Гамма (РІ3 кіназа Гамма); морфогенний білок кісток 2 (ВМР2); рецептор тирозин-білкової-кінази SКY (ТYRО3) (RSЕ); рецептор родини дискоїдних доменів, член 2 (DDR2); керований калієм канал мозку КV (Неспецифічний); Сфінгозин-кіназа (Неспецифічна); рецептор фактору росту нервів високої афінності (ТRК-А); Карбонові ангідрази (усі); рецептор тромбопоетину; фактор росту ендотеліальних судин С; ангіотензиноген; касета АТФ-зв'язування, підродина В (МDR/ТАР), член 1 (АВСВ1) (Багатолікова резистентність Р-глікопротеїн (МDR1); Мітоген-активована білкова кіназа 7 (МАР2К7); Мускариновий рецептор ацетилхоліну М1; Зворотна транскриптаза ВІЛ; РDЕ5А (сGМР-зв'язування, специфічний стосовно фосфодіестерази сGМР 5А / НSРDЕ5А); Альфа-адренергічний рецептор (Неспецифічний); Ліпопротеїн-асоційований інгібітор коагуляції; Карбоксипептидаза В2 (ТАFІ); Холінестераза (Неспецифічна); рецептор брадикініну В2 (ВК2); Альдоза-редуктаза; Фактор коагуляції ХІ (Предок тромбопластину плазми); білкова Серин/треонін-кіназа Р78; Метіонін-амінопептидаза 2; Розчинна гуанілат-циклаза (Неспецифічна); Рибосомальна білкова кіназа S6; Метаботропний рецептор глутамату 1; Нерецепторна тирозин-білкова кіназа ТYК2; Метаботропний рецептор глутамату (Неспецифічний); рецептор фактору росту ендотеліальних судин 3 (VЕGFR-3/FLТ4); Мітогенактивована білкова кіназа 13 (МАРК13 / Р38 дельта); білок активації фібробластів (сепраза); Рецептор фактору вивільнення кортикотропіну (1 (СRF1); Мітоген-активована білкова кіназа 11 (МАРК11 / Р38 бета); Комплементний компонент 5; рецептор цитокіну FL (FLТ3); рецептор АМРА (рецептори глутамату 1-4); рецептор фактору росту нервів; Ацил-СоА А: холестерин-ацилтрансфераза 1 (АСАТ1); сполучений з G-білком рецептор ВОNZО (SТRL33, СХСR6).; білки ІКСа; рецептор ТGF-бета, тип ІІ (ТGFR-2); білок ВІЛ-vіf; рецептор 5-гідрокситриптаміну 2В (5НТ2В); білок зв'язування жирних кислот (Неспецифічний); Тоll-подібний рецептор 7 (ТLR7); Грелін; рецептор антигену СD36 (колагену тип І, рецептор тромбоспондину); Мітоген-активована білкова кіназа 3 (МАР3К3 / МЕКК3); FМLР-пов'язаний рецептор І (FМLР-RІ); Сфінгозин-кіназа SРНК1; гістидил-тРНК-синтетаза; Мітоген-активована білкова кіназа 9 (МАРК9/JNК2); Р2Х рецептор (Неспецифічний); 95332 22 казеїн-кіназа І (Неспецифічна); Сульфотрансферази (неспецифічні); Ядерний рецептор RОRальфа-1; катехол О-метилтрансфераза (СОМТ); Моноамін-оксидаза А (МАОА); Гамма-глутаміл гідролаза; Білкова кіназа С, альфа тип (РКСальфа); Мітоген-активована білкова кіназа 12 (МАРК12 / ЕRК6 / Р38 Гамма); Канал Кальцію Альфа2Дельта; комплекс тканинний Фактор/Фактор VІІа; фактор інгібітору нейтрофілу анкілостоми; канал калію ІКr; рецептор гістаміну Н4 (JАR3) (РFІ-13); рецептор 5-гідрокситриптаміну 2А (5НТ2А); Рецептор холецистокініну типу А (ССКА); 11-бета гідроксистероїд-дегідрогеназа 1; Гормон вивільнення гормону росту (;білок нікотинового рецептору ацетилхоліну альфа-7; рецептор 5НТ2 (Неспецифічний); ізоформа обміннику Натрію/гідрогену 1 (NНЕ1); рецептор речовини-К (рецептор SКR/NК-2); рецептор 5гідрокситриптаміну 1D (5НТ1D); Рецептори 5НТ1В/1D; сахараза-ізомальтаза; Бета-3 адренергічний рецептор; рецептор пов'язаного з геном кальцитоніну пептиду (GGRР) типу 1; Циклінзалежна кіназа 4 (СDК4); адренергічний рецептор Альфа-1А; рецептор тромбоцитів АDР Р2Y12; Мітоген-активована білкова кіназа 5 (МАР3К5) (МЕКК5); регулятор передачі сигналів Gбілку 2; асоційована з рецептором інтерлейкіну-1 кіназа (ІRАК); Неорганічна пірофосфатаза ();тирозин-кіназа ІТК/ТSК; RАR Гамма; АХL білкова тирозин-кіназа (рецептор UFО, GАS6); подібна рецептору активіну кіназа 1 (АLК-1); пов'язаний з карликовістю фактор транскрипції 2; АМФдеаміназа (Неспецифічна); Рецептор хемокіну ССR8; Рецептор хемокіну ССR11; рецептор ноцицепції; рецептор інсуліноподібного фактору росту І; Рецептор Р2Y (Неспецифічний); Білкова кіназа С типу тета (NРКС-тета); неспецифічна ДНК-метилтрансфераза; Кіназа Фосфорилази (Неспецифічна); Рецептор хемотактичного анафілотоксину С3А (С3АR); сфінгозин-кіназа 2 (SРНК2); неспецифічна казеїн-кіназа ІІ; Фосфогліцерат-кіназа 1; бета 1,4галактозилтрансфераза 2 UDР-Gаl:bеаtGlсNАс (В4GАLТ2); ММР-17 (МТ-ММР 4); казеїн-кіназа ІІ, альфа ланцюгова (СК ІІ); специфічна затримка розвитку 6 (GАS6); Мар-кіназою активована білкова кіназа 3 (МАРКАРК-3); активована мітогеном та стресом білкова кіназа-1 (МSК1); Простагландин D2-синтаза (21kD, мозку); Панкреатичний К+ канал (Неспецифічний); рецептор ТGF-бета типу І (ТGFR-1 / подібна рецептору активіну кіназа 5 / АLК-5); Циклінзалежна кіназа 2 (СDК2); АСАТ (Ферменти АСАТ 1 та 2; Неспецифічні); опіоїдний рецептор дельта-типу (DОR-1); рецептор 5-гідрокситриптаміну 6 (5НТ6); рецептор 5-гідрокситриптаміну 1А (5НТ1А); рецептор 5НТ1 (Неспецифічний); рецептор гормону росту; РDЕ7 (Фосфодіестераза 7; Неспецифічна); рецептор ІgЕ (R1 та R2; Неспецифічний); Циклінзалежна кіназа 1 (СDК1); комплекс фарнезил-білок-трансфераза; рецептор простагландину D2 (рецептор простаноїду DР); Комплементний компонент С1S; Гістон-деацетилаза 5; Р2Х пуриноцептор 4 (Р2 × 4); рецептор подібного лектину окисненого LDL (LОХ-1); епоксид-гідролаза 2 23 (транс-стирен-оксид-гідролаза) (розчинна епоксидгідролаза) (sЕН); дигідродипіколінат-синтаза (dhdрs) (DарА); Комплекс СаМ Кіназа ІІ; LХR альфа/бета (Неспецифічний LХR); друге похідне від активатору мітохондрій каспази; Інтегрин-зв'язана кіназа (ІLК); кіназа фокальної адгезії 2 (FАDК 2); рецептор аденозину А2В; WЕЕ1-подібна білкова кіназа; фіксувальна кіназа (СНК2); Бактеріальний білок SесА; білок нікотинового рецептору ацетилхоліну бета-2; Мітоген-активована білкова кіназа 1 (МАР3К1 / МЕКК1); Білкова кіназа С типу зета (NРКС-zеtа); РDК1 (3-фосфоінозитидзалежна білкова кіназа-1); рецептор 5гідрокситриптаміну 5А (5НТ5А); Стероїдна 5альфа-редуктаза; Мітоген-активована білкова кіназа 8 (МАР3К8 / СОТ); пуриноцептор білкової тирозин-фосфатази 1В; Р2Y 1 (Р2Y1); Альфа-1D адренергічний рецептор; казеїн-кіназа І епсилон (СКІ-ерsіlоn); рецептор 5-гідрокситриптаміну 7 (5НТ7); Фактор коагуляції VІІ (Ерtасоg аlfа); кіназа піруват дегідрогенази (РDНК; Неспецифічна); РDЕ7А (специфічна стосовно цАМФ фосфодіестераза 7А / НSРDЕ7А); рецептор глюкагон-подібного пептиду 1 (GLР-1R); полімеразна субодиниця РНК грипу р3 (рb2 ендонуклеаза); вірусна протеаза (Неспецифічна); Тороізомераза ІV; рецептор паратиреоїдного гормону (рецептор РТН2); Білкова кіназа С бета-І (РКС-бета-1); гідроксилаза допамін бета; асоційована з галактозилтрансферазою білкова кіназа Р58/GТА; Пресинаптичний білок SАР97; інгібітор синовіального апоптозу 1, синовіолін (SYVN1) (НRD1) (НRD-1); Сквален-епоксидаза (ЕRG1); Білкова кіназа С епсилон типу (NРКС-ерsіlоn); Рецептор фактору вивільнення кортикотропіну (2 (СRF2); активований кальцієм канал калію перехідної провідності (ІК1); Нуклеозид-дифосфат-кіназа А (NDКА) (NМ23-Н1); асоційована з рецептором інтерлейкіну-1 кіназа 4 (ІRАК-4); кіназа-3 глікогенсинтази альфа (GSК-3 альфа); родина розчинних носів 22 (транспортер органічних катіонів), член 2 (SLС22А2); кіназа піруват-дегідрогенази 1 (РDК1); РАК-альфа-кіназа (РАК-1); білки 14-3-3 людини; Ізолейцил-тРНК-синтетаза; пренілцистеїнкарбоксилметилтрансфераза (РССМТ); СКLF1; та NААLАDаза ІІ. Сполуки або солі винаходу можна крім того застосовувати у комбінації з одним або більше агентами, як-то SSRІ, інгібітори матриксної металопротеїнази (ММР), інгібітори агреканази, інгібітори індукованого нітрогеноксиду (іNОS), інгібітори експресії або активності інсуліноподібного фактору росту (ІGF), інгібітори експресії або активності фактору росту фібробластів (FGF), інгібітори експресії або активності СD44, інгібітори експресії або активності інтерлейкіну (ІL), інгібітори експресії або активності фактору некрозу пухлин альфа (ТNFальфа), інгібітори експресії або активності індукованого пухлиною білку фактору некрозу 6 (ТSG-6), інгібування експресії або активності бікуніну, інгібітори бета-секретази (ВАСЕ), інгібітори РАСЕ-4, інгібування експресії або активності ядерного рецептору rеv-ЕrbА альфа (NR1D1), інгібування експресії або активності 95332 24 ендотеліальної диференціації сполученого з Gбілком сфінголіпідного рецептору 1 (ЕDG-1), інгібування експресії або активності активованого протеїназою рецептору (РАR), інгібування експресії або активності похідного з хряща чутливого до ретинової кислоти білку (СD-RАР), інгібітори білкової кінази С zеtа (РКСz), інгібування експресії або активності резистину, інгібування дезінтегрину та металопротеїнази 8 (АDАМ8), інгібування експресії або активності субкомпоненту (С1s) комплементного компоненту 1 s, інгібування експресії або активності рецептор-подібного форміл-пептиду 1 (FРRL1). Додаткові приклади агентів, корисних у комбінації зі сполуками або солями винаходу, охоплюють інгібітори ММР -2,-3,-9, або -13; інгібітори агреканази-1 або -2; інгібітори експресії або активності ІGF-1 або -2; інгібітори експресії або активності FGF-2,-18, або -9; та інгібітори експресії або активності ІL-1,-4 або -6. Наступні приклади агентів, корисних у комбінації зі сполуками або солями винаходу, охоплюють антитіла ІGF-1 або -2; антагоністи FGF рецептору -2 або -3, антитіла СD44, антитіла ІL-1,4 або -6, антитіла ТNF-альфа; антитіла ТSG-6; антитіла бікуніну; антагоністи NR1D1; антагоністи ЕDG-1; антагоністи РАR, антитіла СD-RАР, антитіла резистину, антитіла С1s, та антитіла FРRL1. Додаткові приклади сполук, що можна застосовувати зі сполуками або солями заявленого винаходу, охоплюють: селективні інгібітори циклооксигенази-2 (СОХ-2), як-то целекоксиб, рофекоксиб, парекоксиб, вальдекоксиб, деракоксиб, еторикоксиб, та ліміракоксиб; опіоїдні аналгетики, як-то морфін, гідроморфон, оксиморфон, фентаніл, кодеїн, дигідрокодеїн, оксикодон, гідрокодон, бупренорфін, трамадол, та налбуфін; нестероїдні антизапальні ліки (NSАІD), як-то аспірин, диклофенак, дифлунізал, ібупрофен, фенопрофен, напроксен, непафенак, та ацетамінофен; інгібітори фосфодіестерази V (РDЕV), як-то силденафіл; альфа-2-дельта-ліганди, як-то габапентин та прегабалін; та локальні анестетики, як-то бензокаїн, лідокаїн, ропівакаїн, ментол, камфор та метил-саліцилат. Приклади інших типів сполук та класів сполук, що можна також застосовувати у комбінації зі сполуками або солями заявленого винаходу, охоплюють: аналгетики, барбітуратні заспокійливі; бензодіазепіни; антагоністи гістаміну Н1, що мають заспокійливу дію; заспокійливі; релаксанти скелетних м'язів; антагоністи рецептору N-метил-Dаспарагінової кислоти (NМDА); альфа-адренергіки; трициклічні антидепресанти; антиконвульсанти, якто карбамазепін; антагоністи тахікінін (NК), зокрема, антагоністи NК-3, NК-2 або NК-1; мускаринові антагоністи; нейролептики; агоністи або антагоністи ванілоїдного рецептору; бетаадренергіки; кортикостероїди; агоністи або антагоністи рецептору серотоніну (5-НТ), як-то антагоністи рецептору 5-НТ1В/1D,5-НТ2А, та 5-НТ3; холінергічні (нікотинові) аналгетики; канабіноїди; рецептор метаботропного глутамату підтипу 1 (mGluR1) антагоністи; інгібітори перепоглинання 25 серотоніну, як-то сертралін; інгібітори перепоглинання норадреналіну (норепінефрин), як-то ребоксетин, зокрема, (S,S)-ребоксетин; двоїсті інгібітори перепоглинання серотоніну-норадреналіну, як-то дулоксетин; інгібітори індукованої нітроген-оксидсинтази (іNОS), як-то S-[2-[(1іміноетил)аміно]етил]-L-гомоцистеїн, S-[2-[(1іміноетил)-аміно]етил]-4,4-діоксо-L-цистеїн, S-[2[(1-іміноетил)аміно]етил]-2-метил-L-цистеїн, (2S,5Z)-2-аміно-2-метил-7-[(1-іміноетил)аміно]-5гептенова кислота, 2-[[(1R,3S)-3-аміно-4- гідрокси1-(5-тіазоліл)-бутил]тіо]-5-хлор-3піридинкарбонітрил; 2-[[(1R,3S)-3-аміно-4-гідрокси1-(5-тіазоліл)бутил]тіо]-4-хлорбензонітрил, (2S,4R)2-аміно-4-[[2-хлор-5-(трифлуорметил)феніл]тіо]-5тіазолбутанол, 2-[[(1R,3S)-3-аміно-4-гідрокси-1-(5тіазоліл) бутил]тіо]-6-(трифлуорметил)-3 піридинкарбонітрил, 2-[[(1R,3S)-3аміно-4гідрокси-1-(5-тіазоліл)бутил]тіо]-5хлорбензонітрил, N-[4-[2-(3хлорбензиламіно)етил]феніл]тіофен-2карбоксамідин, та гуанідиноетилдисульфід; інгібітори ацетилхолінестерази; антагоністи простагландину Е2 підтип 4 (ЕР4), як-то N-[({2-[4-(2етил-4,6-диметил-1Н-імідазо[4,5-с]піридин-1іл)феніл]етил}аміно)-карбоніл]-4метилбензенсульфонамід або 4-[(1S)-1-({[5-хлор2-(3-флуорфенокси)піридин-3іл]карбоніл}аміно)етил]бензойна кислота; антагоністи лейкотриєну В4, як-то 1-(3-біфеніл-4ілметил-4-гідрокси-хроман-7-іл)циклопентанкарбонова кислота; інгібітори 5ліпоксигенази; та блокатори каналу натрію. Комбінації зі сполуками або солями заявленого винаходу також охоплюють аналгетики, як-то ацетомінофен, напроксен натрію, бупрофен, трамадол, тразодон; циклобензаприн; аспірин, целекоксиб, вальдекоксиб, індометацин та інші NSАІD; антидепресанти, як-то трициклічні антидепресанти та селективні інгібітори перепоглинання серотоніну, наприклад антидепресанти, як-то амітриптилін, іміпрамін, нортриптилін, доксепін, флуоксетин, сертралін, та пароксетин; релаксанти м'язів, як-то циклобензаприн; снодійні, як-то золпідем. Комбінації зі сполуками або солями заявленого винаходу також охоплюють аналгетики, як-то ацетомінофен, напроксен натрію, ібупрофен, трамадол, аспірин, целекоксиб, вальдекоксиб, індометацин, та інші NSАІD; що пом'якшують хворобу, антиревматичн ліки (DМАRD), як-то сульфасалазин або метотрексат; кортикостероїди; та блокатори фактору некрозу пухлин (ТNF), як-то етанерцепт та інфліксимаб. Комбінації зі сполуками або солями заявленого винаходу, охоплюють місцеві кортикостероїди; аналоги вітаміну D, як-то кальципотриєн; антралін; місцеві ретиноїди (тобто, похідні вітаміну А), як-то ацитретин та тазаротен; клобетасол пропіонат; метотрексат; азатіоприн; циклоспорин; гідроксисечовина; та імуномодулювальні ліки, якто алефацепт, ефалізумаб, та етанерцепт. Лікування фототерапією, у тому числі терапією псорален-ультафіолетом А (псорален UVА або РUVА), терапією обмежено-смуговим 95332 26 ультафіолетом В (UVВ), та комбінаційною світлотерапією можна застосувати зі сполуками або солями заявленого винаходу, та вищезгаданими комбінаціями. Комбінації зі сполуками або солями заявленого винаходу охоплюють NSАІD, як-то ацетомінофен, напроксен натрію, ібупрофен, трамадол, аспірин, целекоксиб, вальдекоксиб, та індометацин; та кортикостероїди, як-то преднізон. Комбінації зі сполуками або солями заявленого винаходу, охоплюють аналгетики, як-то ацетомінофен, напроксен натрію, ібупрофен, трамадол, аспірин, целекоксиб, вальдекоксиб, індометацин, та інші NSАІD; антизапальні ліки; сульфасалазин, мезаламін, балкалазид, та олкалазин; кортикостероїди; преднізон; будезонід; імуносупресанти, як-то азатіоприн, меркаптопурин, ТNF-блокатори, як-то інфліксимаб та адалімумаб, метотрексат, та циклоспорин; антибіотики, як-то метронідазол та ципрофлоксацин; анти-діарейні, як-то лоперамід; проносні; антихолінергічні ліки; антидепресанти, як-то трициклічні антидепресанти та селективні інгібітори перепоглинання серотоніну, наприклад антидепресанти, як-то амітриптилін, іміпрамін, нортриптилін, доксепін, флуоксетин, сертралін, та пароксетин; алосетрон; та тегасерод. Сполуки або солі заявленого винаходу можна також застосовувати з довгодіючим бетаагоністом. Придатні приклади інших терапевтичних агентів, котрі можуть також бути у комбінації зі сполуками або солями винаходу охоплюють інгібітори 5ііпоксигенази (5-LО) або антагоністи білку активування 5-ліпоксигенази (FLАР), антагоністи лейкотриєн (LТRАs), у тому числі антагоністи LТВ4,LТС4,LТD4, та LТЕ4, антагоністи рецептору гістаміну, у тому числі антагоністи Н1 та Н3, агоністичні 1- та 2-адреноцепторні судинозвужувальні симпатоміметичні агенти для протизастійного застосування, М3 антагоністи мускаринового рецептору або антихолінергічн агенти, інгібітори РDЕ, наприклад, інгібітори РDЕ3, РDЕ4 та РDЕ5, теофілін, натрію кромоглікат, інгібітори СОХ, неселективні та селективні інгібітори СОХ-1 або СОХ-2 (NSАІDs), пероральні та інгаляційні глюкокортикостероїди, моноклональні антитіла, активні проти ендогенних запальних об'єктів, агоністи 2, у тому числі довгодіючі агоністи 2, інгібітори адгезії молекул, у тому числі антагоністи VLА-4, антагоністи рецептору Кінін-В1 - та В2 -, Імунодепресивні агенти, Інгібітори матриксної металопротеази (ММРs), антагоністи рецепторів тахікініну NК1, NК2 та NК3, інгібітори еластази, агоністи рецептору аденозину А2а, інгібітори урокінази, сполуки, що діють на рецептори допаміну, наприклад, агоністи D2, модулятори провідного шляху NFВ, наприклад, інгібітори ІКК, модулятори провідних шляхів передачі сигналів цитокіну, як-то sуk-кіназа, або інгібітори кінази JАК, агенти, що можуть бути класифікованим як муколітики або засоби проти кашлю, та антибіотики. Згідно з заявленим винаходом сполуки або солі винаходу можна комбінувати з нижченаведеним: 27 95332 антагоністи Н3, антагоністи мускаринового рецептору М3, інгібітори РDЕ4, глюкокортикостероїди, агоністи рецептору аденозину А2а, агоністи 2, модулятори провідних шляхів передачі сигналів, як-то sуk-кіназа, або антагоністи лейкотриєн у(LТRАs), у тому числі антагоністи LТВ4, LТС4, LТD4 та LТЕ4. Згідно з заявленим винаходом, сполуки або солі винаходу можна також комбінувати з нижченаведеним: глюкокортикостероїди, як-то інгаляційні глюкокортикостероїди зі зменшеною системною побічною дією, у тому числі преднізон, преднізолон, флунізолід, триамцинолон ацетонід, беклометазон дипропіонат, будезонід, флутиказон пропіонат, циклезонід, та мометазон фуроат та мометазон фуроат моногідрат; антагоністи мускаринового рецептору М3 або антихолінергічн агенти, у тому числі зокрема, солі іпратропіуму, як-то іпратропіум бромід, солі тіотропіуму, як-то тіотропіум бромід, солі окситропіуму, як-то окситропіум бромід, перензепін, та телензепін, або агоністи 2, як-то довгодіючі агоністи 2, у тому числі салметерол, формотерол, QАВ-149 та СНF-4226. F. Застосування в отриманні композицій або медикаменту В одному втіленні заявлений винахід стосується способів отримання композицій або медикаменту, що містять сполуки або солі заявленого винаходу для застосування у лікуванні стану, опосередкованого активністю глюкокортикоїдного рецептору. У ще одному втіленні винахід стосується застосування одної або більше сполук або солей заявленого винаходу в отриманні композицій або медикаменту для запалення, стану, пов'язаного із запаленням, ревматоїдного артриту, дерматиту, хвороби Альцгеймера. Заявлений винахід також стосується застосування одної або більше сполук або солей заявленого винаходу для отримання композицій або ме 28 дикаменту для лікування одного або більше станів, деталізованих у розділі способи. G. Схеми Сполуки заявленого винаходу можна отримати, застосовуючи способи, ілюстровані у загальних схемах синтезу, деталізованих нижче. Реакції способів синтезу тут проводять у придатних розчинниках, котрі можуть бути легко вибраними спеціалістом, вказані придатні розчинники загалом є будь-яким розчинником, котрий є по суті нереактивним із вихідними матеріалами (реагентами), інтермедіатами, або продуктами при температурах, при, котрий проводять реакції. Реакцію можна проводити в одному розчиннику або суміш більше, ніж одного розчиннику. Залежно від конкретного етапу реакції можуть бути вибраними придатні розчинники для конкретного етапу реакції. Отримання сполук винаходу може містити захист та зняття захисту з різних хімічних груп. Необхідність захисту та зняття захисту, та вибір прийнятних захисних груп може бути легко визначеною спеціалістом. Хімію захисних груп можна знайти, наприклад, у Т.W. Grееnе та Р.G.М. Wuts, Рrоtесtіvе Grоuрs іn Оrgаnіс Sуnthеsіs,3rd. Еd., Wіlеу & Sоns, Іnс., Nеw Yоrk (1999), що уведено тут як посилання. Реакції можна контролювати будь-яким придатним способом, відомим у рівні техніки. Наприклад, утворення продукту можна контролювати спектроскопічними засобами, як-то ядерною магні1 тною резонансною спектроскопією (наприклад, Н 13 або С) інфрачервоною спектроскопією, спектрофотометрією (наприклад, UV-видимою), або масспектрометрією або хроматографією, як-то високого тиску рідинна хроматографія (ВЕРХ) або тонкошарова хроматографія. Застосовані тут вихідні матеріали є комерційно доступними або їх можна отримати будь-якими способами синтезу. Загальні схеми синтезу є для ілюстрації та не є обмежувальними. СХЕМА А OH SO3Na O NaHCO3 H2O, iPrOAc Br iPrOAc Br A-1 N Pyrrolidine Br A-3 A-2 N + Br BnBr iPrOAc Br O H2O, PhCH3 Br A-5 A-4 Ph H2N Ph O N PhCH3 Ph N PhCH3 Br A-6 Br H A-7 OH 29 O 1 M H2SO4 95332 30 вуючи протокол, описаний у схемі А, що є загалом розкритим у WО 00/66522. Рh зображує Феніл. Вn зображує Бензил. Сполуку А-1 можна придбати (наприклад, VОUS та Rіvеrsіdе; САS Не. 4133-35-1). Сполуку А-2 можна отримати як описано у Оrg.Sуn.1971,51,109-112. OH Br A-8 1(R)-Бензил-5-бром-9(S)-гідро-10(R)-гідрокси2,7 10(R)-метил-трицикло[7,3,1,0 ]тридека-2,4,6триєн-13-он формули А-8 отримували, застосоСХЕМА В O OH Br glycol, H+ Toluene/heptane 1. NaOEt, EtOH Br 2. AcCl O Br B-3 B-2 A-8 O O O O O 1. nBuLi/THF 2. CO2/THF 3. CH3I/DMF O O B-4 OH O O H2, Pd/C Toluene/ n-butanol TFA DCM/H2O H3CO H O O CF3TMS TBAF H3CO DCM O H O B-5 B-6 CF3 H B-7 OH CF3 H N NH2 N O N Lithium bistrimethylsilylamide toluene H B-8 (4βS,7R,8αR)-4β-бензил-7-гідрокси-N-(2-метилпіридин-3-іл)-7-(трифлуорметил)-4b,5,6,7,8,8α,9,10октагідрофенантрен-2-карбоксамід отримували, як описано у схемі В. СХЕМА С O OBn P O OBn OH CF3 H O CF3 1) 5-methyltetrazole, DCM 2) H2O2 O O H O B-7 C-1 O OBn P O OBn CF3 5-amino-2,6-dimethyl-1,3-pyrimidine LiHMDS, THF N H NH O H2, Pd/C MeOH N C-2 O OH P O OH CF3 H NH O C-3 (2R,4αS,10αR)-4α-бензил-7-((2-метилпіридин-3-іл)карбамоїл)-2-(трифлуорметил)-1,2,3,4,4α,9,10,10αоктагідрофенантрен-2-іл дигідроген фосфат С-3 отримували, як описано у схемі С. Вn зображує бензил. 31 95332 32 СХЕМА D OH CF3 H N N + H O Ph 1) H N N N N O P OBn CF OBn 3 N P O CH2Cl2 Ph O N H N H O B-8 D-1 O O P OBn CF3 OBn H2 / MeOH / Pd(C) H2O2 H N CH2Cl2 N O O P OH CF OH 3 H N H N O C-2 H O C-3 (2R,4αS,10αR)-4α-бензил-7-((2-метилпіридин-3-іл)карбамоїл)-2-(трифлуорметил)-1,2,3,4,4α,9,10,10αоктагідрофенантрен-2-іл дигідроген фосфат С-3 отримували, як описано у схемі D. Вn зображує бензил. Рh зображує феніл. СХЕМА Е O P OBn CF OBn OH Ph CF3 H N N H + N O NMe 3 N P O N TFA / CH2Cl2 Ph O H N H O O O P OBn 1) H2 / DMAc / Pd(C) CF3 OBn 2) Filtration H2O2 CH2Cl2 H N N H O 3) Silicycle Si-Thiol 4) Filtration 5) H2O/ Filtration O O P OH CF OH 3 N H N H O Chromatography (2R,4αS,10αR)-4α-бензил-7-((2-метилпіридин3-іл)карбамоїл)-2-(трифлуорметил)1,2,3,4,4α,9,10,10α-октагідрофенантрен-2-іл дигідроген фосфат С-3 отримували, як описано у схемі Е. Вn зображує бензил. Рh зображує феніл. Н. ОТРИМАННЯ ТА ПРИКЛАДИ Вихідним матеріалом А-8 є 1(R)-Бензил-5бром-9(S)-гідро-10(R)-гідрокси-10(R)-метил2,7 трицикло[7,3,1,0 ]тридека-2,4,6-триєн-13-он, відображений формулою: A-8 O OH CH3 . Отримання 1: (S)-4α-бензил-7-бром-2-етокси3,4,4α,9-тетрагідрофенантрен Br O Br CH3 B-2 Вихідний матеріал А-8 (450 г; 1,17 моль) розчиняли в етанолі (4,5 л) при температурі довкілля. 21 % натрію етоксид в етанолі (44 мл; 0,12 моль) додавали та суміш гріли при кипінні під зворотним холодильником протягом 3 годин. Як тільки вихідний матеріал А-8 було витрачено, реакційну суміш охолоджували до -25 °C. Ацетилхлорид (250 мл; 3,51 моль) повільно додавали до суміші, підтримуючи температуру біля -25 °C. Після завершення додавання суміш гріли до 0 °C та тримали. доки не було витрачено інтермедіатний енон. Суміш суспендували. 21 % натрію етоксид в етанолі (1,31 л; 3,51 моль) додавали до суміші, підтримуючи температуру між -5 °C та 5 °C. Якщо суміш не була основною, додавали більше натрію етоксиду. Температуру суміші було підвищено до 25 °C та тоді її розріджували водою (5,9 л). Суміш фільтрували та твердий матеріал промивали водою (3 Х). Заголовну сполуку (440 г; 85 %) отриму1 вали як бежевий твердий матеріал. Н ЯМР –1 (ДМСО) δ млн :1,27 (t, 3Н), 1,65 (dt, 1Н), 2,06 (d, 1Н), 2,21 (dd, 1Н), 2,49 (m,1Н), 2,65 (m, 2Н), 2,89 (m, 2Н), 3,85 (q, 2Н), 5,45 (m, 2Н), 6,44 (d, 2Н), 6,98 (t, 2Н), 7,06 (m, 2Н), 7,25 (d, 1Н), 7,33 (dd, 1Н). Отримання 2: (S)-4α-бензил-7-бром-2,2-(1,2етилендіокси)-1,2,3,4,4α,9-гексагідрофенантрен 33 95332 O O B-3 Br (S)-4α-бензил-7-бром-2-етокси-3,4,4α,9тетрагідрофенантрен (1270 г; 3,2 моль; 85 %, котрий можна отримати як описано в отриманні 1) розчиняли у толуєні (6,45 л). Етиленгліколь (898 мл; 16,1 моль) та п-толуєнсульфонову кислоту (6,1 г; 0,03 моль) додавали та реакційну суміш гріли при кипінні під зворотним холодильником. Розчинник (1 л) відганяли з суміші та заміщували свіжим толуєном (1 л). Цю відгонку повторювали двічі більш. Ще додавали п-толуєнсульфонову кислоту (6,1 г), кожного разу додавали свіжий толуєн. Протягом реакції два інтермедіати (визначено за допомогою LС) утворювалися, оскільки субстрат перетворювався у продукт. Кінцем реакції була рівновага між двома інтермедіатами та продуктом. Суміш охолоджували до температури довкілля. Суміш промивали 0,5 М NаОН (2 л). Фази розділяли швидко та обидві були темними з невеликим шаром сміття. Суміш промивали водою (2 л). Фази розділялися дуже повільно. Суміш сушили азеотропною відгонкою. Метанол (4 л) додавали до суміші та розчинник (4 л) відганяли з суміші. Додавання метанолу та відгонку розчиннику повторювали ще двічі. Метанол додавали до суміші та осадження відбувалося через кілька хвилин. Ще додавали до суміші метанол (4 л) та тоді гріли при кипінні під зворотним холодильником. Через 30 хвилин суміш охолоджували до 0 °C. Суміш фільтрували та твердий матеріал промивали охолодженим метанолом (2 × 2 л). Твердий матеріал тушили у вакуумній шафі при 65 °C. Заголовну сполуку (882 г; 98 %) отримували як бежевий 1 –1 твердий матеріал. Н ЯМР (ДМСО) δ млн :1,71 (m, 2Н), 2,06 (m, 2Н), 2,31 (dd, 1Н), 2,39 (m, 1Н), 2,68 (d, 1Н), 2,77 (m, 1Н), 2,86 (dd, 1Н), 3,36 (d, 1Н), 3,86 (m, 4Н), 5,45 (m, 1Н), 6,50 (m, 2Н), 7,00 (m, 4Н), 7,37 (dd, 1Н), 7,44 (d, 1Н). Отримання 3: (S)-метил 4β-бензил-7,7-(1,2етилендіокси)-4β,5,6,7,8,10-гексагідрофенантрен2-карбоксилат O O O H3C O B-4 (S)-4α-бензил-7-бром-2,2-(1,2-етилендіокси)1,2,3,4,4α,9-гексагідрофенантрен (719 г; 1,75 моль, що можна отримати, як описано в отриманні 2) розчиняли у тетрагідрофурані (7,19 л) та охолоджували до -70 °C. 1,6 М н-бутиллітій у гексані (2270 мл; 2,27 моль) додавали при такій швидкості, щоб температура була нижче -60 °C. Суміш тримали ще 15 хвилин після додавання. Карбон діоксид (108 г; 2,45 моль) додавали, підтримуючи температуру нижче -60 °C. Суміш 34 тримали ще 15 хвилин після додавання. Суміш гріли до температури довкілля. Розчинник (7 л) відганяли з суміші при атмосферному тиску. ДМФ (7 л) додавали до суміші. Суміш охолоджували до температури довкілля. Метилйодид (152 мл; 2,45 моль) додавали та суміш тримали до завершення реакції (~1 годину). Суміш гріли до 70 °C та розчинник відганяли, поступово зменшуючи тиск до 70 мм Нg. Після завершення відгонки суміш охолоджували до кімнатної температури. Воду (6,5 л) повільно додавали до суміші для осадження продукту. Суміш фільтрували та твердий матеріал промивали водою (3 Х). Твердий матеріал сушили на фільтрі. Сирий продукт (736 г; 74 %) отримували як бежевий твердий матеріал. Продукт очищали хроматографією. 463 г продукту збирали після хроматографії. Цей матеріал відділяли від нгептану (6130 мл). 394 г заголовної сполуки збирали. Ще 70 г заголовної сполуки збирали з маточни1 –1 ку хроматографією. Н ЯМР (ДМСО) δ млн :1,74 (m, 2Н), 2,10 (m, 2Н), 2,33 (dd, 1Н), 2,45 (m, 1Н), 2,72 (d, 1Н), 2,79 (m, 1Н), 2,94 (dd, 1Н), 3,40 (d, 1Н), 3,87 (m, 7Н), 5,49 (m, 1Н), 6,47 (m, 2Н), 6,93 (m, 2Н), 7,01 (m, 1Н), 7,42 (d, 1Н), 7,64 (d, 1Н), 7,79 (dd, 1Н). Отримання 4: (4βS,8αR)-метил 4β-бензил-7,7(1,2-етилендіокси)-4β,5,6,7,8,8α,9,10октагідрофенантрен-2-карбоксилат O O H O H3C O B-5 (S)-метил 4β-бензил-7,7-(1,2-етилендіокси)4β,5,6,7,8,10-гексагідрофенантрен-2-карбоксилат (201 г; 0,515 моль, що можна отримати, як описано в отриманні 3), та 50 мл етиленгліколю розчиняли у толуєні (2,0 л) в автоклаві. До цього додавали 10 г 5 % Рd/С (сухий каталізатор). Автоклав тоді герметизували та продували азотом (три цикли), а потім воднем (три цикли). Реакція перебігала протягом 18 годин при тиску 80 фунт/кв.дюйм та температурі 50 °C. ВЕРХ-аналіз робили стосовно завершення та селективності (звичайно селективність: 95-5, транс – цис). Суспензію фільтрували через Сеlіtе® для видалення каталізатор та толуєновий розчин концентрували при 50 °C, у вакуумі, до приблизно 200 мл, ще додавали при 50 °C 1 л 1-бутанолу та розчин гріли до 60 °C. Після охолодження утворену тверду заголовну сполуку відділяли вакуумним фільтруванням (196 г; 97 %; транс – цис 95,75 до 1 –1 4,24). Н ЯМР (300 МГц, СDСl3) δ млн :7,79 (bs, 1Н, Аr-Н), 7,47 (d,J= 9 Гц, 1Н, Аr-Н), 7,13-7,05 (сm, 3Н, Аr-Н), 6,56-6,53 (сm, 2Н, Аr-Н), 6,43 (d, J= 9 Гц, 1Н, Аr-Н), 4,04-3,93 (сm, 4Н, 2-СН2), 3,89 (s, 3Н, СН3),3,08-3,03 (сm, 3Н, СН2, СН-Н), 2,63 (d, J= 15 Гц, СН-Н), 2,22-1,72 (сm, 8Н, 4-СН2), 1,57 (сm, 1Н, 13 СН-Н).; С ЯМР (СDСl3, δ): 167,7, 149,2, 137,7, 136,4,131,1,130,5,127,8,127,7,127,4,126,3,125,5,108 ,9,64,6,64,5,52,1,40,5,39,8,38,3,35,8,31,6,30,3,27,9,2 4,6. 35 95332 Отримання 5: (4βS,8αR)-метил 4β-бензил-7оксо-4β,5,6,7,8,8α,9,10-октагідрофенантрен-2карбоксилат O H O H3C B-6 O (4βS,8αR)-метил 4β-бензил-7,7-(1,2етилендіокси)-4β,5,6,7,8,8α,9,10октагідрофенантрен-2-карбоксилат (150 г, 382 ммоль, що можна отримати, як описано в отриманні 4) розчиняли у дихлорметані (630 мл). Воду (270 мл) додавали при перемішуванні, а потім трифлуороцтову кислоту (73 мл. 1150 ммоль) через крапельну лійку протягом 30 хвилин, тримаючи внутрішню температуру нижче 30 °C. Після завершення додавання реакційну суміш гріли при 40 °C протягом 2 годин. Перевірка показала незавершену реакцію з приблизно 9 % вихідного матеріалу. Шари розділяли та додавали свіжу воду (270 мл) та трифлуороцтову кислоту (31 мл). Реакційну суміш гріли при 40 °C протягом 1 годин. Це продовжували, доки не було витрачено вихідний матеріал. Органічну фазу промивали 5 % натрію гідрогенкарбонатом (300 мл), водою (300 мл) та сушили МgSО4 та концентрували до сухого стану, отримуючи126,4 г заголовної сполуки 1 –1 (95 % виходу). Н ЯМР (ДМСО) δ млн : 7,70 (s, 1Н), 7,37 (d,J=8,4 Гц, 1Н), 7,11 (m,3Н), 6,6 (d, J= 5,70 Гц, 2Н), 6,45 (d,J=8,4 Гц, 1Н), 3,80 (s, 3Н), 3,80 (m, 2Н), 3,04-1,48 (m, 11Н). Отримання 6: (4βS,7R,8αR)-метил 4β-бензил7-гідрокси-7-(трифлуорметил)-4β,5,6,7,8,8α,9,10октагідрофенантрен-2-карбоксилат OH CF3 H O H 3C O B-7 (4βS,8αR)-метил 4β-бензил-7-оксо4β,5,6,7,8,8α,9,10-октагідрофенантрен-2карбоксилат (118 г, 0,339 моль, що можна отримати, як описано в отриманні 5) у дихлорметані охолоджували до -50 °C. Розчин мутнів. 1,0 М Тетрабутиламоній флуориду розчин у ТГФ (3,4 мл, 0,003 моль) додавали з несуттєвою зміною температури. Трифлуортриметилсилан (79 мл, 0,51 моль) додавали протягом 20 хвилин зі зміною кольору з ярко-оранжевого до світло-червоного. Реакційну суміш тримали при -50 °C протягом приблизно 2 годин та тоді гріли до 0 °C. Тетрабутиламоній флуорид (340 мл, 0,34 моль) додавали дуже повільно при 0 °C до реакційної суміші протягом 45 хвилин. Спостерігали екзодерм з виділенням газу. Реакційну суміш перемішували 10 хвилин та ВЕРХ-аналіз показав повне десилілування. Воду (1 л) додавали до реакційної суміші при енергійному перемішуванні та гріли до кімнатної температури. Органічний шар промивали водою (1 л). Органічний шар концентрували та 36 хроматографували для отримання 72 г, 51 % заголовної сполуки, з додатковими 32 г забрудне1 –1 ного продукту. Н ЯМР (ДМСО) δ млн : 7,70 (s, 1Н), 7,37 (d, J=8,1 Гц, 1Н), 7,09 (m, 3Н), 6,5 (dd, J=1,2,6,6 Гц, 2Н), 6,38 (d, J=8,4 Гц, 1Н), 3,80 (s, 3Н), 3,80 (m, 2Н), 3,09-1,21 (m, 13Н). Отримання 7: (4βS,7R,8αR)-метил 4β-бензил7-(біс(бензилокси)фосфорилокси)-7(трифлуорметил)-4β,5,6,7,8,8α,9,10октагідрофенантрен-2-карбоксилат O H3C O O O P O O H CF3 C-1 (4βS,7R,8αR)-метил 4β-бензил-7-гідрокси-7(трифлуорметил)-4β,5,6,7,8,8α,9,10октагідрофенантрен-2-карбоксилат (5,0 г; 11,9 ммоль), що можна отримати як в отриманні 6) та 5-метилтетразол (3,6 г; 43,0 ммоль) були змішаними разом у дихлорметані (50 мл) при температурі довкілля. Дибензилфосфорамідит (8,3 мл; 25,1 ммоль) додавали та суміш перемішували до завершення реакції (1 годину). Суміш охолоджували до 0 °C та додавали 30 % гідроген пероксид (10 мл). Реакційну суміш перемішували до завершення окиснення (30 хвилин). Водну фазу відділяли від органічної фази. Органічну фазу промивали 10 % натрію мета-бісульфітом (50 мл). Органічну фазу сушили безводним магнію сульфатом та концентрували. Сирий продукт очищали хроматографією на силікагелі із 15 % етилацетату у гексанах. Очищену заголовну сполуку (8,41 г; 94 % виходу) отримували як безбарвну оливу, що 1 містила 6 % етилацетату за масою. Н ЯМР (ДМСО): δ 1,31 (t, 1Н), 1,63-1,92 (m, 3Н), 2,05-2,35 (m, 3Н), 2,63 (d, 1Н), 2,75-3,16 (m, 4Н), 3,80 (s, 3Н), 5,13 (m, 4Н), 6,43 (d, 1Н), 6,49 (m, 2Н), 7,04-7,17 (m, 3Н), 7,33-7,42 (m, 12Н), 7,71 (d, 1Н). Отримання 8: дибензил (2R,4αS,10αR)-4αбензил-7-((2-метилпіридин-3-іл)карбамоїл)-2(трифлуорметил)-1,2,3,4,4α,9,10,10αоктагідрофенантрен-2-іл фосфат N CH3 O N O O P O O H CF3 C-2 (4βS,7R,8αR)-метил 4β-бензил-7(біс(бензилокси)фосфорилокси)-7(трифлуорметил)-4β,5,6,7,8,8α,9,10октагідрофенантрен-2-карбоксилат (7,9 г; 11,6 ммоль, що можна отримати як в отриманні 7) та 3аміно-2-піколін (1,3 г; 12,2 ммоль) були змішаними разом у тетрагідрофурані (80 мл) та охолодженими до 0 °C. 1 М розчин літій біс(триметилсиліл)аміду у тетрагідрофурані (24 мл; 24,4 ммоль) додавали, тримаючи температуру нижче 10 °C. Суміш перемішували протягом 30 хвилин. Воду (50 мл) додавали до реакційної суміші. Суміш екстрагували етилацетатом. 37 95332 Органічний екстракт промивали водою. Органічну фазу сушили безводним магнію сульфатом та концентрували. Сирий продукт очищали хроматографією на силікагелі із 70 % етилацетату у гексанах. Очищену заголовну сполуку (6,79 г; 68 % виходу) отримували як жовту смолу, що 1 містила 6 % етилацетату за масою. Н ЯМР (ДМСО): δ 1,33 (t, 1Н), 1,66-1,93 (m, 3Н), 2,08-2,34 (m, 3Н), 2,41 (s, 3Н), 2,68 (d, 1Н), 2,76-3,19 (m, 4Н), 5,14 (m, 4Н), 6,47 (d, 1Н), 6,56 (m, 2Н), 7,07-7,19 (m, 3Н), 7,20-7,53 (m, 12Н), 7,71 (d, 1Н), 7,76 (s, 1Н), 8,32 (d, 1Н), 9,93 (s, 1Н). Приклад 1: (4βS,7R,8αR)-4β-бензил-7-гідроксиN-(2-метилпіридин-3-іл)-7-(трифлуорметил)4β,5,6,7,8,8α,9,10-октагідрофенантрен-2карбоксамід OH CF3 CH3 N H H N O B-8 (4βS,7R,8αR)-метил 4β-бензил-7-гідрокси-7(трифлуорметил)-4β,5,6,7,8,8α,9,10октагідрофенантрен-2-карбоксилат (10 г; 23,9 ммоль, що можна отримати, як описано в отриманні 6), та 3-аміно-2-піколін (2,71 г; 25,1 ммоль) розчиняли у толуєні (200 мл). 1М літій біс(триметилсиліл)амід у тетрагідрофурані (74,1 мл; 74,1 ммоль) додавали при такій швидкості, щоб температура була нижче 35 °C. Був помірний екзотерм та твердий матеріал осаджувався при додаванні. Суміш тримали ще 30 хвилин після додавання. Воду (250 мл) додавали до суміші. Був помірний екзотерм та твердий матеріал розчинявся. Етилацетат (50 мл) додавали до суміші, щоб продукт не осаджувався. Перемішування припиняли для відокремлення фаз. Водну фазу видаляли. Органічну фазу промивали водою (250 мл). Розчинник (230 мл) відганяли при атмосферному тиску від органічної фази. Суміш охолоджували до температури довкілля. Суміш фільтрували та твердий матеріал промивали толуєном (2 рази), а потім гептаном (2 рази). Твердий матеріал сушили у вакуумній шафі при 70 °C. Заголовну сполуку прикладу (10 г) отримували як бежевий твердий 1 –1 матеріал. Н ЯМР (ДМСО) δ млн : 1,32 (m, 1Н), 1,82 (m, 4Н), 2,10 (m, 4Н), 2,41 (s, 3Н), 2,68 (d, 1Н), 3,08 (m, 3Н), 6,00 (s, 1Н), 6,43 (d, 1Н), 6,59 (m, 2Н), 7,12 (m, 3Н), 7,25 (dd, 1Н), 7,44 (dd, 1Н), 7,71 (dd, 1Н), 7,75 (d, 1Н), 8,31 (dd, 1Н), 9,91 (s,1Н). Приклад 2: (2R,4αS,10αR)-4α-бензил-7-((2метилпіридин-3-іл)карбамоїл)-2-(трифлуорметил)1,2,3,4,4α,9,10,10α-октагідрофенантрен-2-іл дигідрогенфосфат 38 O OH P O OH CF3 CH3 H H N N C-3 O Дибензил (2R,4αS,10αR)-4α-бензил-7-((2метилпіридин-3-іл)карбамоїл)-2-(трифлуорметил)1,2,3,4,4α,9,10,10α-октагідрофенантрен-2-іл фосфат (6 г; 7,9 ммоль, що можна отримати, як описано в отриманні 8) розчиняли у метанолі (120 мл). 5 % паладію на вугіллі (63 % води) (1,3 г; 0,4 ммоль) додавали до суміші. Суміш обробляли воднем (50 фунт/кв.дюйм) при кімнатній температурі. Реакція зупинялася з 12 % залишком монобензил-інтермедіату. Суміш фільтрували через шар Сеlіtе®. Свіжий каталізатор (1,3 г) додавали до розчину та гідрували. Після завершення реакції суміш фільтрували через шар Сеlіtе®. Розчин концентрували до 60 мл відгонкою без застосування роторного випарника. При відгонці осадився білий твердий матеріал. Суміш охолоджували до температури довкілля. Суміш фільтрували та твердий матеріал промивали метанолом. Твердий матеріал сушили у вакуумній шафі при 70 °C. Сполуку прикладу (3,36 г; 75 % виходу) отримували як білий твердий матеріал, що 1 мав РХ-чистоту 98 %. Н ЯМР (ДМСО): δ 1,33 (t, 1Н), 1,69-1,98 (m, 3Н), 2,07-2,29 (m, 3Н), 2,42 (s, 3Н), 2,61-2,80 (m, 2Н), 2,93-3,19 (m, 3Н), 3,30 (d, 1Н), 6,50 (d, 1Н), 6,64 (m, 2Н), 7,08-7,20 (m, 3Н), 7,29 (dd, 1Н), 7,48 (dd, 1Н), 7,75 (dd, 2Н), 8,33 (dd, 1Н), 9,96 (s, 1Н). І. БІОЛОГІЧНІ ДАНІ Для нижченаведеного опису, порівняльними сполуками є трициклічні сполуки (дивись, наприклад, WО 2000/66522). Сполуки прикладів та порівняльні отримували від Рfіzеr. Преднізолон застосували як клінічно доречну порівняльну сполуку (Р-6004; Sіgmа-Аldrісh, St. Lоuіs). Порівняльною сполукою А є (4βS,7S,8αR)-4βбензил-7-гідрокси-N-((2-метилпіридин-3-іл)метил)7-(3,3,3-трифлуорпропіл)-4β,5,6,7,8,8α,9,10октагідрофенантрен-2-карбоксамід, що має нижченаведену структуру: O N N H OH H CF3 . Порівняльною сполукою В є (4βS,7R,8αR)-4βбензил-N-(3,5-диметилпіразин-2-іл)-7-гідрокси-7(трифлуорметил)-4β,5,6,7,8,8α,9,10октагідрофенантрен-2-карбоксамід, що має нижченаведену структуру: H F 3C HN HO O CH3 N N CH3 . 39 95332 Порівняльною сполукою С є (4βS,7S,8αR)-4βбензил-7-гідрокси-N-(2-метилпіридин-3-іл)-7-(3,3,3трифлуорпропіл)-4β,5,6,7,8,8α,9,10октагідрофенантрен-2-карбоксамід, що має нижченаведену структуру: 40 Порівняльною сполукою І є (4βS,7R,8αS)-4βбензил-7-гідрокси-N-(2-метилпіридин-3-іл)-7(трифлуорметил)-4β,5,6,7,8,8αгексагідрофенантрен-2-карбоксамід, що має нижченаведену структуру: H O N CH3 O . H CF3 N CF3 N H OH NH OH Порівняльною сполукою D є (4βS,7R,8αR)-4βбензил-7-гідрокси-N-(4-метилпіридин-3-іл)-7(трифлуорметил)-4β,5,6,7,8,8α,9,10октагідрофенантрен-2-карбоксамід, що має нижченаведену структуру: CH3 . Порівняльною сполукою J є (4βS,7S,8αR)-4βбензил-N-(2,4-диметилпіримідин-5-іл)-7-гідрокси-7(3,3,3-трифлуорпропіл)-4β,5,6,7,8,8α,9,10октагідрофенантрен-2-карбоксамід, що має нижченаведену структуру: OH OH CF3 CF3 CH3 H N N H N O CH3 . Порівняльною сполукою Е є (4βS,7R,8αS)-4βбензил-7-гідрокси-N-(2-метилпіридин-3-іл)-10-оксо7-(трифлуорметил)-4β,5,6,7,8,8α,9,10октагідрофенантрен-2-карбоксамід, що має нижченаведену структуру: H N H O CH3 N . Порівняльною сполукою К є (2R,4αS,10αR)-4αбензил-7-((2-метилпіридин-3-іл)карбамоїл)-2(трифлуорметил)-1,2,3,4,4α,9,10,10αоктагідрофенантрен-2-іл ізобутил карбонат, що має нижченаведену структуру: O N CH3 O OH O CF3 N H H O . Порівняльною сполукою F є (4βS,7R,8αR,10R)4β-бензил-7,10-дигідрокси-N-(2-метилпіридин-3іл)-7-(трифлуорметил)-4β,5,6,7,8,8α,9,10октагідрофенантрен-2-карбоксамід, що має нижченаведену структуру: N CH3O OH CF3 N H H HO . Порівняльною сполукою G є: OH CH3 O N+ H N H F F F O . Порівняльною сполукою Н є (4βS,7R,8αR)-4βбензил-7-(дифлуорметил)-7-гідрокси-N-(2метилпіридин-3-іл)-4β,5,6,7,8,8α,9,10октагідрофенантрен-2-карбоксамід, що має нижченаведену структуру: OH CH3 N F F H N H O . N H N O F F F H O Перетворення прикладу 2 у приклад 1 Моношар клітин Сасо-2 є іn vіtrо тканинною моделлю культури епітелію кишечнику. Ці клітини походять з ободової кишки людини та стають поляризованими, повністю диференційованими ентероцитами протягом 2-3 тижнів. Як тільки стають диференційованими, ці клітини експресують різні біохімічні процеси, як-то активний витік транспортерів, у тому числі Р-глікопротеїну (Р-gр). З цією моделлю можливе визначення видимої проникності (Рарр) сполуки крізь поляризований моношар клітин Сасо-2. Аналіз А→В проводять з моношарами клітин Сасо-2 для визначення Рарр сполуки з камери А до В. Ця Рарр є репрезентативною стосовно транспорту сполук від просвітного (кишечник) до серозного (кров) крізь епітелій кишечнику, що можна бачити при поглинанні у кишечнику. Приклад 2 незначно перетинає моношар -6 клітин Сасо-2 (А→В, Рарр = 1,15е см/с), тоді як застосування прикладу 2 до апікальної камери призводило до значного підвищення прикладу 1 в апікальній та базолатеральній камерах. Дані показують механізм дефосфорилування прикладу 2 до прикладу 1 зв'язаною з мембраною лужною фосфатазою, розташованою в епітелії кишечнику, а потім поглинання прикладу 1 крізь моношар клітин -6 Сасо-2 (А→В, Рарр = 37,5е см/с). 41 95332 Пероральне дозування прикладу 2 (30 та 200 мг/кг) у ворітну вену щурів призводило до визначення прикладу 1, але не Приклад 2, зразках у плазми з ворітної вени протягом чотирьох годин. Ці результати показали виникнення у кишечнику першого перебігу гідролізу прикладу 2 до прикладу 1 та селективне поглинання кишечником прикладу 1. Приклад 2 демонструє посилену розчинність та притаманне розчинювання, що призводить до 42 посиленого профілю перорального поглинання у щурів внаслідок підвищеного спонукування (1,61 мкг•год./мл [проти 0,46 мкг•год./мл, для прикладу 1]) та Сmах (0,59 мкг/мл [проти 0,13 мкг/мл, для прикладу 1]), а також зменшений час до С mах (0,8 год. [проти 1,5 год., для прикладу 1]) у собак. Біозасвоюваність прикладу 2 була посиленою порівняно з прикладом 1 у щурів (F=59 %, для прикладу 2;F=17 %, для прикладу 1). ІN VІТRО ДАНІ Назва Приклад 1 Гідрохлорид Приклад 1 вільна основа Приклад 2 Порівняльна сполука А Порівняльна сполука В Порівняльна сполука С Порівняльна сполука D Порівняльна сполука Е Порівняльна сполука F Порівняльна сполука G Порівняльна сполука Н Порівняльна сполука І Порівняльна сполука J Порівняльна сполука К Преднізолон а GRFР ІК50 (нМ) 1,31 79,0 (42) 7,10 0,35 1,22 2,06 1,18 1,9 2,13 8,03 9,12 4,58 895 0,526 ІL-6 ІК50 (нМ) а ІL-6 % Інгібування ,400 ,360 а 60 (17) >36,4 4 1,1 1,3 1,1 7 2,1 4,3 2,8 291 76,9 86,1 а 60,2 (80) 59,9 75,8 82,6 79,8 79,7 83,3 80,1 64,9 67,5 55 4,2 (4,6) а 102 (100) а ТNFα ІК50 (нМ) а 92,1 (28,8) >1000 14,9 (15,6) ТNFα % Інгібування 77,1 (62) а 35 а 100 показує додаткові результати, що були знайдені. GRFР: зв'язування глюкокортикоїдного рецептору Аналіз зв'язування ліганду поляризації флуоресценції глюкокортикоїдного рецептору (GRFР) застосовують для оцінки безпосереднього зв'язування тест-сполук з глюкокортикоїдним білком повної довжини (GR). Реагенти для цього аналізу можна придбати від Іnvіtrоgеn у тест-комплекті. Флуоресцентний мічений ліганд GR застосовують як флуоресцентну мітку та тест-сполуки конкурують із флуоресцентною міткою стосовно зв'язування GR. Зміна поляризації у присутності тестсполуки є внаслідок зв'язування тест-сполуки з GR та її застосовують для визначення ІК50 та відносної афінності зв'язування тест-сполуки з GR. ІК50 та % Інгібування ІL-6 Епітеліальні клітини легень людини А549 (Аmеrісаn Туре Сulturе Соllесtіоn,Rосkvіllе, МD) культивували у середовищі Кайна F-12К з пеніциліном-стрептоміцином (10 од/мл) та 10 % інактивованої нагріванням сироватки зародка теляти (усі від Іnvіtrоgеn,Grаnd Іslаnd,NY). А549-клітини поміщали у планшет при густині 30000 клітини/лунку у 96-лунков планшети та інкубували протягом ночі при 37ºС та із 5 % СО2. Клітини позбавляли живлення сироваткою заміщенням середовища росту середовищем Кайна F-12К без сироватки з пеніциліном-стрептоміцином (10 од/мл) та знов інкубували протягом ночі при 37ºС та із 5 % СО2. На третю добу середовище було заміщено свіжим середо вищем без сироватки та клітини інкубували зі сполукою або без неї (розчинник - ДМСО при 0,1 % максимальної концентрації) протягом приблизно 1 години та тоді стимулювали 1 нг/мл рекомбінантного ІL-1β людини (R&D Sуstеms, Міnnеароlіs, МN) протягом 20 годин при 37ºС та із 5 % СО2. Супернатанти клітин збирали для визначення рівнів ІL-6, застосовуючи 96-лункові планшети МSD (Меsо Sсаlе Dіsсоvеrу, Gаіthеrsburg, МD) за інструкціями виробника. Планшети зчитували МSD Sесtоr Іmаgеr6000. Преднізолон (1 мкМ) застосували як максимальний інгібітор та визначали контроль 100 % інгібування. Розчинник застосували для визначення контролю 0 % інгібування. Процент інгібування для кожної концентрації сполуки відносно цих контролів розраховували, застосовуючи Ехсеl (Місrоsоft,Rеdmоnd,WА). Значення ІК50 створювали, застосовуючи програму GrаFіt 5,0 (Еrіthасus Sоftwаrе Ltd., Surrеу, UК). Інгібування ТNFα ІК50 та % Передмоноцитні клітини U937 людини (Аmеrісаn Туре Сulturе Соllесtіоn, Rосkvіllе, МD) культивували у RРМІ 1640 з глутаміном (2 мМ), пеніциліном-стрептоміцином (10 од/мл) та 10 % інактивованої нагріванням сироватки зародка теляти (усі від Іnvіtrоgеn, Grаnd Іslаnd, NY). Клітини були диференційованими до фенотипу моноцит/макрофаг пробол-12-міристат-13-ацетатом (Sіgmа-Аldrісh, St. Lоuіs, МО), 20 нг/мл, протягом ночі. Клітини тоді центрифугували, середовище 43 відсмоктували, клітини ресуспендували у рівному об'ємі свіжого середовища RРМІ 1640 з глутаміном та пеніциліном-стрептоміцином та сироваткою зародка теляти та інкубували протягом 48 годин при 37ºС та 5 % СО2. Після збирання клітини зіскрібали, підраховували, та поміщали у планшет для стимулювання LРS, як описано нижче. Клітини U937 диференціювали та поміщали при густині 200000 клітин/лунку у 96-лункові планшети. Клітини інкубували зі сполукою або без неї (розчинник – ДМСО при 1 % максимальної концентрації) протягом приблизно одної годин та тоді стимулювали 100 нг/мл ліпополісахариду (LРS), Е. соlі серотип 0111:В4 (Sіgmа-Аldrісh, St. Lоuіs, МО) протягом чотирьох годин при 37ºС та із 5 % СО2. Супернатанти клітин збирали для визначення рівнів ТNFα, застосовуючи ЕLІSА. Моноклональне антитіло миші анти-людини ТNFα (клон 28401,111) та біотиніловане кози анти-людини ТNFα (R&D Sуstеms, Міnnеароlіs, МN) застосували як захват та визначення антитіл, відповідно. Стрептавідинпероксидазу хрону (НRР) (R&D Sуstеms, Міnnеароlіs, МN) та К-Блакитний Субстрат/Червоний Стоп (Nеоgеn, Lехіngtоn, КY) застосували як систему визначення. Поглинання вимірювали при 650 нм. Концентрації ТNFα інтерполювали зі стандартної кривої рекомбінантного білку ТNFα людини (R&D Sуstеms, Міnnеароlіs, МN), застосовуючи чотирьох параметричну логістичну модель Маgеllаn (Тесаn,Durhаm,NС). Преднізолон (1 мкМ) застосували як максимальний інгібітор та визначав 100 % контроль інгібування. Розчинник застосували для визначення контролю 0 % інгібування. Процент інгібування для кожної концентрації сполуки, відносно цих контролів, розраховували, застосовуючи Ехсеl (Місrоsоft,Rеdmоnd,WА). ІК50 створювали, застосовуючи програму LаbStаts Fіt Сurvе V4.R7.МО (Рfіzеr Sаndwісh Lаbоrаtоrіеs,UК та Теssеllа Suрроrt Sеrvісеs рlс, Аbіngdоn UК). СУЦІЛЬНА КРОВ ЛЮДИНИ Ех vіvо Це дослідження порівнює інгібування ІL-1β, ІFNγ ІL-6, та продукування ТNFα у ех vіvо LРS стимульованій суцільній крові людини лігандами глюкокортикоїдного рецептору (GR) порівняльною сполукою А, Прикладом 1 та преднізолоном. Венозну кров від людини збирали як аліквоти 10 мл у туби, що містять натрію гепарин (ВD Vасutаіnеr від Весtоn Dісkіnsоn та Соmраnу, Frаnklіn Lаkеs, NY). Кров додавали у стерильні полістиренові круглодонні 96-лункові планшети культур тканин (Соrnіng Соstаr) при 100 мкл/лунку. Середовища (RРМІ Середовище 1640 з Lглутаміном, Іnvіtrоgеn Соrроrаtіоn, Саrlsbаd, СА) додавали до крові у аліквотах 90 мкл до загального об'єму 190 мкл. Поза лунки заповнювали 200 мкл середовища. Кров поміщали у зволожений 37 °C інкубатор із 5 % СО2 тоді як отримували сполуки (приблизно 60 хвилин). Сполуки отримували з 10 мМ запасних розчинів у диметилсульфоксиді (ДМСО, Sіgmа-Аldrісh). Запасну сполуку розріджували серійно 1/3 у ДМСО (тобто 5 мкл сполук + 10 мкл ДМСО), а потім розрідженням кожного серійного розрідження 1/167 у розчинник (2 % ДМСО, 30 % етанолу (ААРЕR 95332 44 Аlсоhоl та Сhеmісаl Соmраnу), та 68 % буферований фосфатом фізіологічний розчин (буферований фосфатом фізіологічний розчин Дульбекко без кальцію хлориду без магнію хлориду, Іnvіtrоgеn Соrроrаtіоn, Саrlsbаd СА). Сполуку або розчинник додавали до крові в аліквотах 10 мкл у потроєнні. Кінцева концентрація преднізолону та Прикладу 1 в аналізі була від 1000 нМ до 0,457 нМ. Концентрації порівняльної сполуки А були від 3000 нМ до 1,4 нМ. Кінцеві концентрації ДМСО та етанолу в аналізі були 0,1 % та 1,5 %. Зразки обережно розтирали у порошок двічі до суміші та поміщали в інкубатор. Запасний LРS (Е. соlі серотип 0111:В4,Sіgmа-Аldrісh), в аліквотах 100 мкг/мл у RРМІ при –20 °C, розріджували 1/50 у RРМІ для створення робочого запасного розчину. Через 60 хвилин інкубації 10 мкл отриманого робочого запасу LРS додавали до крові до кінцевої концентрації 100 нг/мл, нехтуючи лунками для застосування як негативного контролю. Зразки знов обережно розтирали у порошок та планшети інкубували протягом ночі протягом 22 годин. Після інкубації кров центрифугували при 1500 х g протягом 5 хвилин та плазму видаляли для сублімації при –20 °C або аналізу вивільнення цитокіну. Рівні ІL-1β, ІFNγ,ІL-6, та ТNFα вимірювали, застосовуючи комплекти аналізу Меsо Sсаlе (Меsо Sсаlе Dіsсоvеrу, Gаіthеrsburg, МD). Реагенти доводили до кімнатної температури. Планшети Меsо Sсаlе блокували 30 мкл розріджувачем для аналізу плазми/сироватки людини з обережним струшуванням протягом 60 хвилин при кімнатній температурі. Планшети промивали 3х промивним буфером (РВS, Іnvіtrоgеn Соrроrаtіоn, із 0,05 % Тwееn-20, Sіgmа-Аldrісh). Калібратори для стандартних кривих отримували в аналізі розріджувачу плазми/сироватки людини як 1/5 серійні розрідження для досягнення кінцевих концентрацій від 50000 пг/мл до 3,2 пг/мл. Зразки та калібратори додавали при 20 мкл/лунку, тоді інкубували при кімнатній температурі з обережним струшуванням протягом 90 хвилин. Планшети знов промивали 3 рази промивним буфером. Визначення антитіл розріджували у розріджувачі антитіла плазми/сироватки людини до 1 мкг/мл та повільно додавали до планшету при 20 мкл/лунку. Планшети інкубували протягом 60 хвилин та промивали знов. Зчитувальний буфер Т (4х) розріджували 1:1 із водою до 2-кратної концентрації та 150 мкл повільно додавали до кожної лунки. Планшети аналізували на SЕСТОR Іmаgеr6000 (Меsо Sсаlе Dіsсоvеrу) для створення необроблених значень сигналу. Значення зразків ІL-1β, ІFNγ lL-6, та ТNFα контролювали стосовно калібратору стандартних кривих. Індивідуальні значення порівнювали з позитивними та негативними контролями (оброблена розчинником кров з LРS та оброблена розчинником кров без LРS, відповідно) для отримання % інгібування. Потроєні значення усереднювали для кожного донору. Значення для двох донорів усереднювали (тільки один донор застосували для ІL1β) та наносили на графік, застосовуючи 4параметричну підгонку кривих при застосуванні GrаFіt 5,0,11. 45 95332 46 Середні значення інгібування преднізолону ІFNγ (% інгібування) 99,95181 99,7687 94,99872 63,51763 25,733 5,164324 10,85844 4,925277 Концентрація (нМ) 1000 333,3333 111,1111 37,03704 12,34568 4,115226 1,371742 0,457247 ТNFα (% інгібування) 93,85394 88,98186 62,38366 27,66996 12,86882 5,308603 6,613491 0,525846 ІL-1β (% інгібування) 94,92022 92,93646 73,1561 37,74411 33,55115 20,98221 15,1055 9,64873 ІL-6 (% інгібування) 62,08045 40,25956 11,68419 5,032463 -0,41737 -0,23188 -0,94069 2,220454 Середні значення інгібування прикладу 1 ІFNγ (% інгібування) 78,72981 73,47381 60,63503 51,01941 26,70902 -3,18296 19,77643 16,92723 Концентрація (нМ) 1000 333,3333 111,1111 37,03704 12,34568 4,115226 1,371742 0,457247 ТNFα (% інгібування) 38,06288 36,04024 27,35287 18,68644 9,415215 -1,31222 7,869405 8,956175 ІL-1β (% інгібування) 53,51043 57,75726 39,67173 38,24203 21,54167 11,20262 22,38355 23,37486 ІL-6 (% інгібування) 8,053268 2,1505 0,943985 -0,82783 -0,36893 -1,06692 3,32595 -1,36819 ІL-1β (% інгібування) 16,37219 14,96801 12,23526 8,59594 17,27236 22,84851 22,01534 31,97474 ІL-6 (% інгібування) -1,97032 -0,88954 -2,8341 -3,49518 -3,52461 -1,12581 -4,3436 1,459164 Середні значення інгібування порівняльної сполуки А ІFNγ (% інгібування) 28,02163 16,52981 -6,31952 8,737671 -9,80677 0,016012 -1,69672 18,09167 Концентрація (нМ) 3000 1000 333,3333 111,1111 37,03704 12,34568 4,115226 1,371742 ТNFα (% інгібування) -3,03631 -5,43701 -4,61436 -3,82374 -4,19291 0,030908 -0,86051 18,1316 ДАНІ ІN VІVО Назва Приклад 1 вільна основа Порівняльна сполука А Порівняльна сполука В Порівняльна сполука С Порівняльна сполука D Порівняльна сполука Е Порівняльна сполука F Порівняльна сполука G Порівняльна сполука Н Терапевтична Терапевтична Пригнічення Пригнічення Пригнічення Пригнічення mСІА mСІА ТNFα ТNFα остеокальцину остеокальцину (ЕD50 доз) (ЕD80 доз) (ЕD50 доз) (ЕD80 доз) (ЕD50 доз) (ЕD80 доз) 0,4 1,5 0,46 1,82 60 2,91 >10 37 2,9 >10 1,64 2,91 2,39 >10 2,0 >10 0,27 1,33 1,01 2,84 1,47 >20 1,18 3,06 0,5 2,6 0,14 1,18 0,17 1,71 >10 >10 2,11 5,67 1,19 >10 0,6 3,0 2,90 3,33 1,12 7,27 0,23 0,72 0,51 1,46 47 95332 48 ДАНІ ІN VІVО Продовження Назва Порівняльна сполука І Порівняльна сполука J Преднізолон Терапевтична Терапевтична Пригнічення Пригнічення Пригнічення Пригнічення mСІА mСІА ТNFα ТNFα остеокальцину остеокальцину (ЕD50 доз) (ЕD80 доз) (ЕD50 доз) (ЕD80 доз) (ЕD50 доз) (ЕD80 доз) 17,0 >20 0,73 5,45 5,20 >20 3,0 >20 0,09 0,79 0,73 3,58 1,1 5,5 0,90 2,10 1,00 6,80 Приклад 1 є потужною сполукою у моделі хвороби. Індукований колагеном артрит мишей (mСІА) Індукований колагеном артрит мишей є звичайно застосованою хронічною доклінічною моделлю ревматоїдного артриту, у котрій набрякання суглобів та руйнування кісток відбувається після імунізації колагеном типу ІІ. Зменшення випадків хвороби та її суворості раніше показане як прогнозувальне стосовно пом'якшення хвороби та ознак та симптомів зменшення, відповідно, у клініці. У традиційній моделі mСІА, самців DВА/J мишей імунізували 50 мкг колагену курчат типу ІІ (сСІІ) у повному ад'юванті Фрейнда та тоді знов імунізували через 21 добу 50 мкг сСІІ у неповному ад'юванті Фрейнда. Обробку сполуками тоді починали ранком та продовжували протягом 56 діб. Ефективність лікування вимірювали за інцидентністю хвороби (тобто, числом мишей, що показують будь-яку ознаку хвороби) та суворістю хвороби, що вимірювали двічі на тиждень. У терапевтичній моделі mСІА, індукцію випадків хвороби та її суворості синхронізували стимулюванням LРS. Самців мишей DВА/J імунізували 100 мкг бичачого колагену типу ІІ (bСІІ) на добу 0. Усі миші отримували інтраперитонеальну ін'єкцію 20 мкг LРS на добу 28 та хвороба розвивалася через добу 34. На добу 34, усі миші мали хворобу (інцидентність = 100 %) з середнім балом суворості 7. Дозування сполук починали у терапевтичному режимі на добу 34 та продовжували через добу 49. Відмінні обробки порівнювали виміром зменшення інцидентності (тобто, припинення запальних явищ хвороби) та зменшення суворості набрякання лап протягом часу. Визначення балів суворості mСІА (максимальний бал 12/мишу) Бал суворості 1 2 3 Визначення Будь-яке почервоніння або набрякання пальців або лап Перехресне або деформування набрякання лап Анкілоз суглобів Приклад 1 мав бали менше, ніж 2 для mСІА (ЕД80) та менше, ніж 1 для mСІА (ЕД50). ТNFα та усунення остеокальцину (ОС) Сполуки зважували та суспендували у розчиннику 0,5 % метилцелюлоза/0,025 % twееn20 (Sіgmа-Аldrісh, St. Lоuіs, МО). Суспензії сполук гомогенізували, застосовуючи гомогенізатор тканин Роlуtrоn РТ-3100 для створення дуже дрібної суспензії, а тоді обробляли ультразвуком протягом 10 хвилин, застосовуючи водяну баню з обробкою ультразвуком. Аліквоти кожної суспензії робили для добового дозування при 0,2 мл/дозу. Самиць Swіss Wеbstеr мишей, 10-12 тижні віком, 28-29 г, (Тасоnіс, Gеrmаntоwn,NY) застосували згідно з директивами Іnstіtutіоnаl Аnіmаl Саrе аnd Usе Соmmіttее та згідно з директивами NІН стосовно добробуту лабораторних тварин. Мишей акліматизували у сприятливих умовах протягом трьох – семи діб до використання у дослідженні. Преднізолон та сполуки були застосовуваними за допомогою перорального зонда протягом загалом 28 діб. Кожна група лікування містила 5-10 мишей. Для установки режиму дозування для досліджень часу фармакодинаміки експеримент проводили для визначення пригнічення ТNFα після одиничної дози ЕД80. Сполуки, котрі пригнічували ТNFα , дозували раз на добу, тоді як сполуки, котрі не пригнічували ТNFα >50 % до 24 годин дозували два рази на добу. Маси тіла вимірювали на першу та останню добу кожного експерименту. Зразки крові отримували після трьох тижнів дозування для статичного фармакокінетичного (РК) аналізу. Для оцінювання дії сполук на індукований LРS ТNFα, усі миші отримували інтраперитонеальну ін'єкцію LРS (Sаlmоnеllа tурhоsа, L-7895;Sіgmа-Аldrісh,St.Lоuіs,) через 2,5 год. після останньої дози на добу 28. Мишей вбивали через 90 хвилин після застосування LРS. Зразки сироватки визначали на остеокальцин та ТNFα, застосовуючи складні аналізи (Lіnсо Rеsеаrсh, Іnс, St. Сhаrlеs, МО; Lumіnех 100, Аustіn, ТХ). Зразки розріджували 1:20 та аналіз проводили за інструкціями виробника. Остеокальциновий стандарт придбавали окремо (Віоmеdісаl Тесhnоlоgіеs Іnс., Stоughtоn, МА). Мишей не годували протягом 4 годин до збирання сироватки для ТNFα та рівнів остеокальцину. Для кожного експерименту значення, що різко виділяються, були визначеними за допомогою розраховування числа стандартних відхилень від середнього значення групи. Якщо значення було більше, ніж 2,5 стандартних відхилень від середнього значення, його вилучали від решти розрахунків. Процент інгібування тоді розраховували для кожної миші, застосовуючи середні значення для групи розчиннику та контрольної групи 10 мг/кг преднізолону. Значення проценту інгібування індивідуальної миші підганяли до чотирьох 49 95332 параметричної логістичної моделі, застосовуючи середню для кожної групи дозу. Відколи усі чотири параметри були підрахованими та нижче плато не було фіксованим при 0 %. а вище плато не було фіксованим при 100 %, значення ЕД50 та ЕД80 розраховували застосуванням оберненої калібраційної формули для рівня реакції стосовно 50 % або 80 % інгібування або активації. Значеннями ЕД50 та ЕД80 є дози (у мг/кг) потрібні для 50 % або 80 % дії, відповідно. Значенням ЕД50 та ЕД80 отримували для різних кінцевих моментів, застосовуючи чотирьох-параметричну логістичну підгонку. Для сполук, котрі були тестованими багато разів, значення ЕД50 та ЕД80 отримували, застосовуючи чотирьох-параметричні логістичні підгонки комбінованих даних з експериментів. Для сполук, котрі не досягали 80 % дії, значення ЕД80 позначені як >10 мг/кг або >20 мг/кг, залежно від найвищої тестованої дози. Приклад 1 (мг/кг) 0,1 1 10 Загальні клітини (% інгібування) 22 72 83 Еозинофіли (% інгібування) 42 97 99 ІНДЕКС ДИСОЦІАЦІЇ Індекс дисоціації (DІ) було вибрано як вимір для визначення дисоціації сполук відносно преднізолону у термінах біомаркерів антизапальної ефективності та побічної дії. Індекси дисоціації розраховували, застосовуючи клінічно доречні біомаркери, що можна застосовувати у ранній клінічній розробці. Сироваточний остеокальцин та індуковані LРS ТNFα сироватки вважають прогнозувальними стосовно утворення кісток та антизапальної ефективності, відповідно. Індекс дисоціації базувався на нижченаведених принципах: НАЗВА Приклад 1 вільна основа Порівняльна сполука А Порівняльна сполука В Порівняльна сполука С Порівняльна сполука D Порівняльна сполука Е Порівняльна сполука F Порівняльна сполука G Порівняльна сполука Н Порівняльна сполука І Порівняльна сполука J Преднізолон Приклад 1, Порівняльна сполука І, Порівняльна сполука J мала DІ більше, ніж 5 для ОС/ТNFα (ЕД50). Приклад 1 та Порівняльна сполука J мала DІ більше, ніж 4 для ОС/ТNFα (ЕД80). 50 Модель індукованої домашніми кліщами астми Мишей обробляли трьома дозами прикладу 1 (0,1,1 та 10 мг/кг, перорально, двічі на добу) або преднізолону (0,1,1 та 10 мг/кг, перорально, двічі на добу). Окремі групи тварин обробляли відповідними розчинниками, та жодного впливу притоку запальних клітин на індукований домашніми кліщами ВАL приплив запальних клітин не було продемонстровано. Приклад 1 зменшував інфільтрування клітин у рідину ВАL залежно від дози. Оцінювання рідини типів клітин ВАL, застосовуючи цитометрію потоку, показувало значні зменшення еозинофілів, нейтрофілів, лімфоцитів та Т-клітин. У порівнянні, преднізолон давав подібні зменшення інфільтрування клітин у рідині ВАL при подібних дозах (дані не показані). Нейтрофіли (% інгібування) 29 97 100 Лімфоцити (% інгібування) 34 94 97 Т-клітини (% інгібування) 39 88 96 1) потрібний для дисоціації мінімум дози між біомаркерами запалення та побічної дії та було визначено формулою: 2) DІ сполуки можна вважати відносно спостереженого з преднізолоном, клінічною порівняльною сполукою. Скоректований або нормалізований DІ було визначено як DІ сполуки, поділений на DІ преднізолону. Індекс дисоціації (ЕД50 та ЕД80) ОС/ТNFα (ЕД50) 6,33 0,62 1,46 3,74 0,80 1,21 0,56 0,39 2,22 7,12 8,11 1,11 ОС/ТNFα 80) (ЕД >5,49 >3,44 2,14 1,76 2,18 2,03 >3,67 4,53 3,24 Скоректований індекс дисоціації (ЕД50 та ЕД80) на основі преднізолону 51 95332 Назва Приклад 1 вільна основа Порівняльна сполука А Порівняльна сполука В Порівняльна сполука С Порівняльна сполука D Порівняльна сполука Е Порівняльна сполука F Порівняльна сполука G Порівняльна сполука Н Порівняльна сполука І Порівняльна сполука J ОС/ТNFα (ЕД50) 5,70 0,56 1,32 3,37 0,73 1,09 0,50 0,35 2,00 6,41 7,31 Приклад 1, Порівняльна сполука І, Порівняльна сполука J мала скоректований DІ більше, ніж 5 для ОС/ТNFα (ЕД50). Приклад 1 мав скоректований DІ більше, ніж 1,50 для ОС/ТNFα (ЕД80). ЕАUС50 та ЕАUС80 Спонукування ліками, визначене як концентрації ліків у плазмі, інтегровані протягом часу (АUС), застосували для створення Сироваточний ТNFα Остеокальцин сироватки Швидкість утворення кортикальних кісток (ВFR) Інцидентність хвороби (традиційна mСІА) Суворість хвороби (терапевтична mСІА) Індекс дисоціації а ОС/ТNFα а ВFR/ ТNFα b ВFR/інцидентність хвороби b ВFR/суворість хвороби Скоректований Індекс дисоціації а ОС/ТNFα а ВFR/ ТNFα b ВFR/інцидентність хвороби b ВFR/суворість хвороби а 52 ОС/ТNFα 80) (ЕД >1,69 >1,06 0,66 0,54 0,67 0,63 > 1,13 1,40 фармакодинамічних порівнянь між преднізолоном та Прикладом 1. Внаслідок коротких періодів напівперетворення преднізолону та Прикладу 1 у мишах значення АUС(0-4 год.) підраховували для більше, ніж 95 % значень АUС(0-24 год.). Внаслідок об'ємних обмежень відбору зразків крові у мишей, значення АUС(0-4 год.) застосували для створення фармакодинамічних порівнянь. Преднізолон (АUС 0-4 год.) (мкг*год./мл) ЕАUС50 ЕАUС80 0,81 0,95 0,56 1,60 Приклад 1 (АUС 0-4 год.) (мкг*год./мл) ЕАUС50 ЕАUС80 0,22 0,33 1,30 4,20 0,09 0,60 0,27 1,55 0,25 0,60 0,04 0,10 0,38 1,19 0,09 0,19 0,7 0,1 0,4 0,2 1,7 0,6 1,0 0,5 5,9 1,2 6,8 3,0 12,7 4,7 15,5 8,2 8,4 12,0 17,0 15,0 7,5 7,8 15,5 16,4 Дані порівнювали у мишах у тій же моделі. Дані порівнювали у мишах у відмінній моделі, застосовуючи спонукування плазми до нормалізації. ВFR, швидкість утворення кісток. b 53 95332 54 ДАНІ ЕАUС50 ТА ЕАUС80 Параметр 28-добова повторювана модель доз Сироваточний ТNFα Остеокальцин сироватки (ОС) Швидкість утворення кортикальних кісток (ВFR) Інцидентність хвороби (традиційна mСІА) Суворість хвороби (терапевтична mСІА) Інцидентність хвороби (терапевтична mСІА) Скоректовані індекси дисоціації (DІ) ОС / ТNFα ВFR / ТNFα ВFR / інцидентність хвороби ВFR / суворість хвороби Приклад 1 ЕАUС50 ЕАUС80 0,22 0,33 1,31 4,15 0,35 1,76 0,10 0,66 0,09 0,12 ЕАUС50 8,6 16,0 14,5 13,0 0,10 0,19 0,33 ЕАUС80 7,4 7,6 10,6 15,5 0,38 0,68 0,50 1,19 1,38 Приклад 1 є дисоційованою сполукою. Приклад 1 мав DІ та скоректований DІ для ЕАUС50 та ЕАUС80 більше, ніж 7 для ОС/ТNFα, ВFR/ТNFα, ВFR/інцидентності хвороби, та ВFR/суворості хвороби. Гістоморфометрія кортикальних кісток для визначення ВFR Протягом кожного дослідження миші отримували дві інтраперитонеальних (і.р.) ін'єкції (20 мг/кг, 100 мл/мишу) кальцеїну (С-0875; SіgmаАldrісh, St. Lоuіs, МО) на доби 1 та 26 для вимірів гістоморфометрії кісток. Кальцеїн входить у мінерал кісток та дозволяє вимір швидкості утворення кісток. Кальцеїн розчиняли у 2 % натрію гідрогенкарбонаті. Протягом збору тканин ліву велику гомілкову кістку вирізали та очищали для вимірів кортикальної гістоморфометрії. Після видалення шкіри та м'язів велику гомілкову кістку поміщали у 70 % етанолу (4 °C) у темряві протягом мінімум 24 годин. Подрібнені поперечні зрізи застосували для гістоморфометричного аналізу кортикальних кісток. Кістки секціонували, застосовуючи пилку (Іsоmеt, Вuеhlеr, Lаkе Вluff, ІL) з алмазним лезом. Кінець кожної великої гомілкової кістки видаляли Комп’ютерна верстка Л. Купенко Преднізолон ЕАUС50 ЕАUС80 0,82 0,95 0,56 1,64 проксимально до синостозу велика гомілкова кістка-мала гомілкова кістка та робили 75 мм перехресний зріз. Застосовуючи грубий скляний планшет та корок, зрізи подрібнювали до ~25 мм до просвіту та усі мітки були відрізнюваними під флуоресцентним мікроскопом. Зрізи дегідратували, застосовуючи нижченаведені розчини протягом мінімум двох хвилин кожний: 1) 70 % етанолу, 2) 95 % етанолу, 3) 100 % етанолу, 4) 50/50 етанол/ксилен, та 5) ксилен (двічі) (#534056; Sіgmа-Аldrісh, St.Lоuіs, МО). Зрізи монтували, застосовуючи середовище Еukіtt Quісk Моuntіng Меdіum (#03989, Sіgmа-Аldrісh, St. Lоuіs, МО), після котрого застосовували покровне скло. Застосовуючи програму Оstеоmеаsurе Воnе Аnаlуsіs Рrоgrаm (Оstеоmеtrісs, Іnс., Dесаtur Gеоrgіа), швидкість утворення кісток розраховуваої ої ли за відбитками 1 та 3 флуоресцентних міток та внутрішнього та зовнішнього периметру кісток. Швидкість утворення кісток розраховували за нижченаведеним рівнянням: (внутрішня-мічена ширина/мічений інтервал) * (мічений периметр/периметр кістки). Принаймні п'ять зразків вимірювали з кожної групи лікування у кожному дослідженні. Підписне Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюTricyclic compounds and their use as glucocorticoid receptor modulators
Автори англійськоюCheng, Hengmiao, Hu, Xiao, Jerome, Kevin, DeWayne, Obukowicz, Mark, Gerard, Olson, Lisa, Rucker, Paul Vincent, Webber, Ronald, Keith
Назва патенту російськоюТрехциклические соединения и их применение в качестве модуляторов глюкокортикоидного рецептора
Автори російськоюЧен Генгмяо, Гу Киао, Джером Кевин ДеВайн, Обуковиц Марк Герард, Ольсон Лиза, Рукер Паул Винсент, Веббер Рональд Кейт
МПК / Мітки
МПК: A61P 19/02, A61K 31/44, C07D 213/75, A61P 1/00, A61P 11/06, A61P 25/28, A61P 29/00
Мітки: трициклічні, глюкокортикоїдного, модуляторів, сполуки, рецептора, застосування
Код посилання
<a href="https://ua.patents.su/27-95332-triciklichni-spoluki-ta-kh-zastosuvannya-yak-modulyatoriv-glyukokortikodnogo-receptora.html" target="_blank" rel="follow" title="База патентів України">Трициклічні сполуки та їх застосування як модуляторів глюкокортикоїдного рецептора</a>
Попередній патент: Препарат для стимуляції репродуктивної функції кнурів-плідників
Наступний патент: Поліфункціональний засіб для зовнішнього застосування
Випадковий патент: Спосіб і пристрій для вологого нанесення клею на деревні волокна












