Трициклічні сполуки та їх застосування як модуляторів глюкокортикоїдного рецептора
Номер патенту: 94639
Опубліковано: 25.05.2011
Автори: Рукер Паул Вінсент, Деврай Райеш Венкатесваран, Джером Кевін ДеВайн, Гу Кіао, Обуковіц Марк Герард, Веббер Рональд Кейт, де Крескензо Гарі А., Ольсон Ліза
Формула / Реферат
1.Сполука формули І:
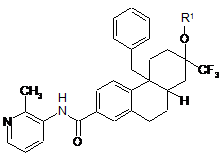 , (I)
, (I)
де R1 є -Р(О)(ОН)2; або її сіль.
2. Сполука за п. 1, якою є сполука:
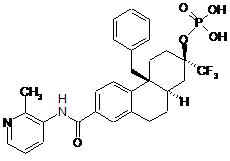
або її сіль.
3. Сполука за п. 1, якою є сполука:
 .
.
4. Сполука за п. 1, якою є кальцієва сіль.
5. Сполука за п. 1, якою є натрієва сіль.
6. Композиція, яка містить сполуку за п. 1 або її сіль і носій.
7. Спосіб лікування стану або захворювання, за яким здійснюють контактування глюкокортикоїдного рецептора зі сполукою за п. 1 або її сіллю.
8. Спосіб лікування стану, опосередкованого активністю глюкокортикоїдного рецептора у суб'єкта, за яким вводять цьому суб'єкту сполуку формули І:
 , (I)
, (I)
де R1 є -Р(О)(ОН)2; або її сіль.
9. Спосіб за п. 8, в якому станом є стан, пов'язаний з запаленням.
10. Спосіб за п. 8, в якому станом є астма, дерматит, запальна кишкова хвороба, хвороба Альцгеймера, психотична глибока депресія, нейропатія, відторгнення трансплантата, множинний склероз, хронічний увеїт або хронічна обструктивна хвороба легенів.
11. Спосіб за п. 8, в якому станом є ревматоїдний артрит.
12. Спосіб за п. 8, в якому станом є дерматит.
13. Спосіб за п. 8, в якому станом є астма.
14. Спосіб за п. 8, в якому станом є хвороба Альцгеймера.
15. Спосіб за п. 8, в якому станом є запальна кишкова хвороба.
16. Спосіб послаблення побічних явищ, пов'язаних з модуляцією глюкокортикоїдного рецептора, за яким вводять суб'єкту сполуку за п. 1.
Текст
1.Сполука формули І: 3 94639 R1 O CF3 CH3 H N N H O , (I) 1 де R є -Р(О)(ОН)2; або її сіль. 9. Спосіб за п. 8, в якому станом є стан, пов'язаний з запаленням. 10. Спосіб за п. 8, в якому станом є астма, дерматит, запальна кишкова хвороба, хвороба Альцгей Винахід включає сполуки, що є модуляторами рецептора глюкокортикоїду. Винахід також включає композиції і способи використання таких сполук і композицій. Модулятори рецептора глюкокортикоїду є лігандами рецептора глюкокортикоїду, які використовують у лікуванні ряду станів завдяки їх потужній антизапальній, антипро-ліферативній і імуномодуляторній активності (J. Miner, et al., Expert Opin. Investig. Drugs (2005) 14(12): 1527-1545). Приклади модуляторів рецептора глюкокортикоїду включають дексаметазон, преднізон, преднізолон, RU-486 і препарати, описані у WO 2000/66522 і WO 2004/005229. Лікування модулятором рецептора глюкокортикоїду часто викликає побічні явища, наприклад, втрату кістки і остеопороз. Існує медична потреба у модуляторі рецептора глюкокортикоїду, який є ефективним, потужним і з послабленою побічною дією. В одному з втілень винахід стосується сполуки формули І: 1 де R є -Н або -Р(О)(OН)2 або їх сіллю. В іншому втіленні винахід стосується композицій, що містять сполуку формули І і носія. В іншому втіленні винахід стосується способу введення рецептора глюкокортикоїду у контакт з сполукою формули І. Додаткове втілення включає способи лікування стану, опосередкованого активністю рецептора глюкокортикоїду, введенням суб'єкту сполуки формули І. 4 мера, психотична глибока депресія, нейропатія, відторгнення трансплантата, множинний склероз, хронічний увеїт або хронічна обструктивна хвороба легенів. 11. Спосіб за п. 8, в якому станом є ревматоїдний артрит. 12. Спосіб за п. 8, в якому станом є дерматит. 13. Спосіб за п. 8, в якому станом є астма. 14. Спосіб за п. 8, в якому станом є хвороба Альцгеймера. 15. Спосіб за п. 8, в якому станом є запальна кишкова хвороба. 16. Спосіб послаблення побічних явищ, пов'язаних з модуляцією глюкокортикоїдного рецептора, за яким вводять суб'єкту сполуку за п. 1. Цей детальний опис втілень призначено лише для ознайомлення фахівців з винаходом, його принципами і практичним застосуванням, щоб фахівець міг адаптувати і застосувати винахід у його різних формах згідно з його уявленнями про найкращий варіант застосування. Винахід не обмежується описаними втіленнями і може бути модифікований. А. Визначення Наведені нижче визначення термінів використовуються у подальшому, якщо у Формулі винаходу або в іншому місці не наведено іншого визначення. Термін "носій" стосується інгредієнту, відмінного від сполуки. Носії можуть бути фармацевтично прийнятним матеріалом або середовище. Приклади включають рідкий або твердий заповнювач, розріджувач, ексципієнт, розчинник або інкапсулятор. "Введення у контакт рецептора глюкокортикоїду" означає in vivo, ex vivo, або in vitro контакт рецептор глюкокортикоїду і включає введення сполуки або її солі згідно з винаходом суб'єкту, що має рецептор глюкокортикоїду, а також, наприклад, введення сполуки або її солі згідно з винаходом у зразок, що містить клітинний, неочищений або очищений препарат, що містить рецептор глюкокортикоїду. Наприклад, контактування включає взаємодії між сполукою і рецептором, наприклад, зв'язування. "Стан, пов'язаний з запаленням" включає артрит, фіброміалгію, анкілозний спондиліт, псоріаз, системну червону вовчанку, подагру, недиференційовану спондилоарт-ропію, юнацький спондилоартрит, хворобу Крона, виразковий коліт, синдром подразнення кишечнику, запальну кишкову хворобу і біль, пов'язаний з зазначеними станами. Приклади артриту включають ревматоїдний артрит, остеоартрит, реактивний артрит, інфекційний артрит, псоріазний артрит, поліартрит, юнацький артрит, юнацький ревматоїдний артрит, юнацький реактивний артрит і юнацький псоріазний артрит. Термін "модуляція" або "модулятори" включає антагоністи, агоністи, часткові антагоністи і часткові агоністи. 5 Термін "суб'єкт" стосується будь-якої тварини, включаючи ссавців, наприклад, мишей, щурів, інших гризунів, кролів, собак, котів, свиней, худобу, овець, коней, приматів або людей. Термін "лікування" (і, відповідно, "лікувати") включає паліативне, відновлювальне і превентивне ("профілактичне") лікування суб'єкту. Термін "паліативне лікування" означає лікування, яке полегшує або зменшує дію або інтенсивність стану суб'єкта без лікування стану. Термін "превентивне лікування" (і, відповідно, "профілактичне лікування") означає лікування, яке відвертає появу даного стану у суб'єкта. Термін "відновлювальне лікування " ("лікувальне") означає лікування, яке зупиняє або зменшує патологічні прояви або повністю усуває даний стан у суб'єкта. Лікування може бути проведено терапевтично ефективною кількістю сполуки, її солі або композиції, які викликають біологічну або медичну реакцію тканини, системи або суб'єкту, з якими працюють, наприклад, дослідник, лікар, ветеринар або клініцист. В. Сполуки Винахід включає, зокрема, трициклічні сполуки формули І. Ці сполуки можуть бути використані як модулятори рецептора глюкокортикоїду. Винахід включає сполуку формули І: 1 де R є -Н або -Р(О)(ОН)2 або їх сіллю. Винахід включає сполуку формули II: 1 де R є -Н або -Р(О)(ОН)2 або їх сіллю. Винахід включає сполуки формули І або II, де 1 R є -Н або її сіль. Винахід включає сполуки формули І або II, де 1 R є -Р(О)(ОН)2 або її сіль. Винахід включає (4S,7R,8R)-4-бензил-7гідрокси-N-(2-метилпіридин-3-іл)-7(трифлуорметил)-4,5,6,7,8,8,9,10октагідрофенантрен-2-карбоксамід або його сіль і (2R,4S,10R)-4-бензил-7-((2-метилпіридин-3іл)карбамоїл)-2-(трифлуорметил) 94639 6 1,2,3,4,4,9,10,10-октагідрофенантрен-2-ілдигідрофосфат або його сіль. Солі сполуки винаходу включають її кислотоадитивні і основні солі (включаючи дисолі). В одному з втілень винах включає гідрохлоридну сіль сполуки формули І. В іншому втіленні винахід включає кальцієву сіль сполуки формули І. В іншому втіленні винахід включає натрієву сіль сполуки формули І. Придатними кислотоадитивними солями є утворені з кислотою, яка утворює нетоксичні солі. Приклади таких солей включають ацетат, аспартат, бензоат, бесилат, бікарбонат/карбонат, бісульфат/сульфат, борат, камсилат, цитрат, едисилат, есилат формат, фумарат, глюцептат, глюконат, глюкоронат, гексафлуорфосфат, гібензат, гідрохлорид/хлорид, гідробромід/бромід, гідройодид/йодид, ізетіонат, лактат, малат, малеат, малонат, месилат, метилсульфат, нафтилат, 2напсилат, нікотинат, нітрат, оротат, оксалат, пальмятат, памоат, фосфат/гідрофосфат/дигідрофосфат, сахарат, стеарат, сукцинат, тартрат, тосилат і трифлуорацетат. Основні солі утворюються з основ, які утворюють нетоксичні солі. Приклади таких солей включають солі алюмінію, аргінін, бензатин, солі кальцію, холін, діетиламін, діоламін, гліцин, лізин, солі магнію, калію, натрію, цинку, меглумін, оламін і трометамін. Див "Handbook of Pharmaceutical Salts Properties, Selection and Use" by Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002). Сіль можна приготувати, змішуючи разом розчини сполуки винаходу і бажану кислоту або основу. Сіль може випасти з розчину і бути зібрана фільтрацією або може бути ізольована випарюванням розчинників. Рівень іонізації у солі може змінюватись від повної до майже відсутньої. Сполуки винаходу можна вводити як проліки. Деякі похідні які самі мають дуже низьку або зовсім не мають фармакологічної активності при введенні, можуть бути перетворені у сполуки винаходу з бажаною активністю, наприклад, гідролітичним розщепленням. Такі похідні називають проліками (див 'Рrо-лікs as Novel Dепечіну Systems, Vol. 14, ACS Symposium Series (T Higuchi і W Stella) і 'Bioreversible Carriers in Drug Design', Pergamon Press, 1987 (ed. Ε Β Roche, American Pharmaceutical Association). Проліки можуть, наприклад, бути приготовлені заміщенням відповідних функціональностей у сполуках винаходу певними компонентами, відомими як "про-компоненти", описані, наприклад, у "Design of Progrugs" by H Bundgaard (Elsevier, 1985). Деякі приклади таких проліків включають: (і) якщо сполука містить спиртову функціональність (-ОН), її етер наприклад, заміщення гідрогену (С1-С6)алканоїлоксиметилом; і (ii) якщо сполука містить вторинну амінову функціональність, її амід, наприклад, заміщення гідрогену (С1-С10)алканоїлом. Деякі сполуки винаходу можуть самі діяти як проліки інших сполук винаходу. Наприклад, деякі сполуки формул І або II можна розглядати як проліки інших сполук формул І або II. 7 Всі ізомери, наприклад, стереоізомери, геометричні (цис/транс або Z/E) ізомери і таутомерні форми сполук або солей входять в об'єм винаходу, включаючи сполуки або солі, що мають декілька типів ізомерії, і їх суміші. Наприклад, сполука формули І і тау-томер ілюструються формулами: Винахід також включає кислотоадитивні або основні солі, в яких контріон є оптично активним, наприклад, D-лактат або L-лізин, або рацемічні, наприклад, DL-тартрат або DL-аргінін. Ізомери можуть бути розділені звичайними способами, добре відомими фахівцям. Винахід включає мічені ізотопами сполуки винаходу, в яких один або більше атомів заміщено атомами з тим же атомним номером, але з атомною масою або масовим номером, відмінними від тих, що зустрічаються у природі. Мічені ізотопами сполуки винаходу приготовляють звичайними способами, відомими фахівцям, або способами, подібними описаним у Прикладах і Препаратах, з використанням належних мічених ізотопами реагентів замість немічених. Для лікування описаних нижче станів пацієнту можуть бути введені сполуки винаходу або їх солі. С. Композиції Сполуки або солі винаходу можуть бути частиною композиції. Композиції можуть також включати одну або більше сполук або солей винаходу. Композиції можуть також включати енантіомерні надлишки одної або більше сполук винаходу. Інші фармакологічно активні речовини і носії також можуть бути включені у композицію. Одним з втілень є композиція, що містить сполуку формули І або її сіль. Іншим втіленням є композиція, що містить сполуку формули І або її сіль і носія. Наприклад, носієм може бути ексципієнт. Вибір ексципієнт у значній мірі залежить від таких факторів, як, наприклад, спосіб введення, вплив ексципієнта на розчинність і стабільність і типу дозованої форми. Композиції можуть бути твердими, рідкими або і тими і іншими, і можуть бути утворені з сполукою як одиночно-дозовані композиції, наприклад, таблетки, які можуть містити від 0,05% до 95% (за масою) активних сполук. Сполуки або солі згідно з винаходом можуть бути об'єднані з придатними полімерами як носіями ліків. D. Способи Винахід включає спосіб введення рецептора глюкокортикоїду у контакт з сполукою або сіллю винаходу. Винахід також включає спосіб лікування стану, опосередкованого активністю рецептора глюкокортикоїду у суб'єкта, який включає введення цьому суб'єкту сполуки або солі винаходу. 94639 8 Стани, опосередковані активністю рецептора глюкокортикоїду, включає: a) ендокринні розлади, наприклад, первинну або вторинну адренокортикальну недостатність, природжену адренальну гіперплазію, негнійний тироїдит і гіперкальцемію, пов'язану з раком; b) ревматичні розлади, наприклад, псоріазний артрит, ревматоїдний артрит, включаючи юнацький ревматоїдний артрит, анкілозний спондиліт, гострий і субгострий бурсит, гострий неспецифічний теносиновіт, гострий подагричний артрит, посттравматичний остеоартрит, синовіт остеоартриту і епікондиліт; c) колагенні хвороби, наприклад, системна червона вовчанка і гострий ревматичний кардит; d) дерматологічні стани, наприклад, пемфігус, бульйозний дерматит, гостра бага-тоформна еритема (синдром Стівенса-Джонсона), ексфоліативний дерматит, грибковий мікоз, псоріаз і себорейний дерматит; e) алергічні стани, наприклад, сезонні або весняні алергії, алергічний риніт, бронхіальнa астмa, контактий дерматит, атопічний дерматит, сироваткова хвороба і реакції надчутливості до ліків; f) офтальмічні хвороби і стани, наприклад, алергічні корнеальні маргінальні виразки, оперізувальний офтальмологічний лишай, запалення переднього сегмента, дифузний задній увеїт і хороїдит, хронічний увеїт, симпатерична офтальмія, алергічний кон'юнктивіт, кератит, хоріоретиніт, оптичний неврит, ірит і іридоцикліт; g) респіраторні хвороби, наприклад, симптоматичний саркоїдоз, синдром Лефлера, бериліоз, швидкоплинний або дисемінований пульмонарний туберкульоз і аспіраційний пневмоніт; h) гематологічні розлади, наприклад, ідіопатична тромботична пурпура, вторинна тромбоцитопенія, набута (аутоімунна) гемолітична анемія, еритробластопенія (анемія RBC) і природжена (еритроїдна) гіпопластична анемія; і) неопластичні хвороби, наприклад, лейкемія і лімфома; j) едематозні стани, наприклад, індукований діурез або протеїнурія у нефротичному синдромі без уремії ідіопатичного типу або вона ж як наслідок еритематозу; k) шлунково-кишкові хвороби, наприклад, виразковий коліт, регіональний ентерит, запальна кишкова хвороба, хвороба Крона, гастрит, синдром подразнення кишечнику; І) інші стани, наприклад, туберкульозний менінгіт і трихоноз; і m) неврологічні стани, наприклад, хвороба Альцгеймера, хвороба Паркінсона, хорея Хантингтона, аміотрофічний латеральний склероз, травма спинного мозку, психотична глибока депресія і периферійна нейропатія. Стани, опосередковані активністю рецептора глюкокортикоїду, також включають відторгнення трансплантату (наприклад, нирки, печінки, серця, легені, підшлункової залози (наприклад, інсулярних клітин), кісткового мозку, роговиці, тонких кишок, шкірного аутотрансплантату, шкірного алотрансплантату (наприклад, при опіках), ксенотрансплантату серцевого клапану, сироват 9 кову хворобу і гомологічну хворобу, аутоімунні хвороби, наприклад, ревматоїдний артрит, псоріазний артрит, множинний склероз, діабет типів І і II, юнацький діабет, ожиріння, астму, запальну кишкову хворобу (наприклад, хворобу Крона і виразковий коліт), гангренозну піодерму, вовчанку (системну червону вовчанку), міастенію, псоріаз, дерматит, дерматоміозит; екзему, себорею, пульмонарне запалення, увеїт очей, гепатит, хворобу Грейвса, тироїдит Хашимото, аутоімунний тироїдит, синдром Бехчета або Шегрена (сухість очей/рота), злоякісну або імуногемолітичну анемію, атеросклероз, хворобу Адисона (аутоімунна хвороба надниркової залози), ідіопатичну недостатність надниркової залози, аутоімунну полігландулярну хворобу (аутоімунний полігландулярний синдром), гломерулонефрит, склеродермію, кільцеву склеродермію, лишай Вільсона, депігментацію шкіри), кругову алопецію, аутоімунну алопецію, аутоімунну гипопитуитаризм, синдром ПйєнаБарре і альвеоліт; опосередковані Т-клітинами хвороби гіперчутливість, включаючи контактну гіперчутливість, затриману гіперчутливість, контактний дерматит (включаючи викликаний отруйною рослиною), утикарію, шкірні алергії, респіраторні алергії (сінна лихоманка, алергічний риніт) і целіакію; запальні хвороби, наприклад, остеоартрит, гострий панкреатит, хронічний панкреатитит, гострий респіраторний дистресний синдром, синдром Сезарі і судинні хвороби з запальним і або проліферативним компонентом, наприклад, рестеноз, стеноз і артеросклероз. Стани, опосередковані активністю рецептора глюкокортикоїду, також включають: а) астму будь-якого типу, етіології або патогенезу, зокрема, астму, що належить до групи, яку складають атопічна астма, неатопічна астма, алергічна астма, атопічна бронхіальна опосередкована ІgЕ астма, бронхіальна астма, первинна астма, істинна астма, внутрішня астма, викликана патофізіологічними порушеннями, зовнішня астма, викликана довкільними факторами, первинна астма невідомого походження, неатопічна астма, бронхітична астма, емфізематозна астма, астма, викликана фізичними вправами, астма, викликана холодним повітрям, інфекційна астма, викликана бактеріальною, грибковою, протозоальною або вірусною інфекцією, неалергічна астма, початкова астма, синдром хрипоти немовлят і бронхіоліт; b) хронічну або гостру бронхоконстрикцію, хронічний бронхіт, обструкцію малих дихальних шляхів і емфізему; c) обструктивну або запальну хворобу дихальних шляхів будь-якого типу, етіології або патогенезу, зокрема, обструктивну або запальну хворобу дихальних шляхів, яка належить до групи, яку складають хронічна еозинофільна пневмонія, хронічна обструктивна пульмонарна хвороба (COPD), COPD, що включає хронічний бронхіт, пульмонарну емфізему або диспное, пов'язану або не пов'язану з COPD, COPD, що відрізняється необоротною прогресуючою обструкцією дихальних шляхів, респіраторний дистресний синдром дорослих (ARDS), загострення гіперреактивності дихальних шляхів внаслідок препаративного лікування і хво 94639 10 роба дихальних шляхів, пов'язана з пульмонарною гіпертонією; d) бронхіт будь-яких типу, етіології або патогенезу, зокрема, бронхіт, що належить до групи, яку складають гострий бронхіт, гострий ларинготрахейний бронхіт, арахідичний бронхіт, катаральний бронхіт, крупозний бронхіт, сухий бронхіт, інфекційний астматичний бронхіт, продуктивний бронхіт, стафілококовий або стрептококовий бронхіт і везикулярний бронхіт, гостра легенева травма; і e) бронхоектазія будь-яких типу, етіології або патогенезу, зокрема, така, що належить до групи, яку складають циліндрична бронхоектазія, мішкоподібна бронхоектазія, веретеноподібна бронхоектазія, капілярна бронхоектазія, цистозна бронхоектазія, суха бронхоектазія і фолікулярна бронхоектазія. Інше втілення включає використання сполуки або її солі згідно з винаходом у лікуванні обструктивних або запальних хвороб дихальних шляхів будь-яких типу, етіології або патогенезу, зокрема, таких, що належать до групи, яку складають хронічна еозинофільна пневмонія, хронічна обструктивна пульмонарна хвороба (COPD), COPD, що включає хронічний бронхіт, пульмонарну емфізему або диспное, пов'язану або не пов'язану з COPD, COPD, що відрізняється необоротною прогресуючою обструкцією дихальних шляхів, респіраторний дистресний синдром дорослих (ARDS), загострення гіперреактивності дихальних шляхів внаслідок препаративного лікування і хвороба дихальних шляхів, пов'язана з пульмонарною гіпертонією; або астми астму будь-яких типу, етіології або патогенезу, зокрема, астми, що належить до групи, яку складають атопічна астма, неатопічна астма, алергічна астма, атопічна бронхіальна опосередкована ІgЕ астма, бронхіальна астма, первинна астма, істинна астма, внутрішня астма, викликана патофізіологічними порушеннями, зовнішня астма, викликана довкільними факторами, первинна астма невідомого походження, неатопічна астма, бронхітична астма, емфізематозна астма, астма викликана фізичними вправами, астма викликана холодним повітрям, інфекційна астма, викликана бактеріальною, грибковою, протозоальною або вірусною інфекцією, неалергічна астма, початкова астма, синдром хрипоти немовлят і бронхioліт, Винахід включає спосіб лікування пов'язаних з запаленням станів у суб'єкта, який включає введення цьому суб'єкту сполуки або її солі згідно з винаходом. Винахід включає спосіб лікування таких станів, як, наприклад, астма, дерматит, запальна кишкова хвороба, хвороба Альцгеймера, психотична глибока депресія, нейро-патія, відторгнення трансплантату, множинний склероз, хронічний увеїт або хронічна обструктивна пульмонарна хвороба, який включає введення суб'єкту сполуки або її солі згідно з винаходом. Винахід включає спосіб лікування ревматоїдного артриту, який включає введення суб'єкту сполуки або й солі згідно з винаходом. Ревматоїдний артрит вважають хронічною аутоімунною і запальною хворобою, яка викликає запалення суглобів, які набрякають, стають боліс 11 ними і зазнають деградації хряща, кістки і зв'язок суглоба. Наслідками ревматоїдного артриту є деформація нестабільність і закостенілість суглоба і рубці у суглобі. Суглоби руйнуються з дуже змінною швидкістю. Різні фактори, включаючи природжену схильність, можуть впливати на розвиток хвороби. Люди з ревматоїдним артритом можуть мати м'яке протікання хвороби з рідкими загостреннями і тривалими ремісіями або мати прогресуючу хворобу, повільну або швидку. Ревматоїдний артрит може починатись несподівана, з одночасним запаленням багатьох суглобів. Частіше він починається м'яко, поступово вражаючи різні суглоби. Звичайно запалення є симетричним, з ураженням суглобів по обидва боки тіла. Звичайно першими вражаються малі суглоби на пальцях рук і ніг, руках, ногах зап'ястках, ліктях і щиколотках, і потім коліна і стегна. Біль, пов'язаний з ревматоїдним артритом звичайно є соматичним ноцицептичним суглобним болем. Розпухлі зап'ястки можуть защіпляти нерви і викликати оніміння або поколювання внаслідок зап'ясткового тунельного синдрому. За враженими колінами може розвиватись кіста, яка внаслідок розривання спричиняє біль і опухання нижньої частини ніг. Винахід включає спосіб лікування дерматиту, який включає введення суб'єкту сполуки або її солі згідно з винаходом. Винах включає спосіб лікування хронічної обструктивної пульмонарної хвороби, який включає введення суб'єкту сполуки або її солі згідно з винаходом. Винахід включає спосіб лікування астми, який включає введення суб'єкту сполуки або й солі згідно з винаходом. Винахід включає спосіб лікування хвороби Альцгеймера, який включає введення суб'єкту сполуки або її солі згідно з винаходом. Винахід включає спосіб послаблення побічних явищ, пов'язаних з модуляцією рецептора глюкокортикоїду, який включає введення суб'єкту сполуки формули І суб'єкту. Винахід включає спосіб послаблення побічних явищ, пов'язаних з преднізолоновим лікуванням, який включає введення суб'єкту сполуки формули І суб'єкту. Винахід також включає способи лікування зазначених вище станів, хвороб і розладів у суб'єкта або суб'єкта, схильного мати такий стан, введенням цьому суб'єкту одної або більше сполук або їх солей згідно з винаходом. В одному з втілень зазначене лікування є превентивним. В іншому втіленні зазначене лікування є паліативним. В іншому втіленні зазначене лікування є відновлювальним. Е. Дозування і введення Для обрання найкращих дозованих форм і способу введення згідно з призначеннями сполуки або їх солі згідно з винаходом можуть бути оцінені за їх біофармацевтичними властивостями, наприклад, розчинністю і стабільністю розчину (при різних рН) і проникністю. 94639 12 Дози для сполук або солей згідно з винаходом становлять від 0,1 мг до 100 мг для перорального введення і 2 мг або менше для інгаляції. Дози можна вводити як одиночну або розділену дозу і вони можуть бути поза визначеними вище межами. Дозування базується на середній масі людинисуб'єкта 60-70 кг. Дозування і режими введення залежать від суб'єкта і типу стану, які можуть вплинути на дозу (вік, стать, маса тіла тощо). Лікар визначає дозу для суб'єкта, маса якого виходить за зазначені вище межі, наприклад, для дітей і осіб похилого віку. Пероральне введення Сполуки винаходу і її солі можна бути вводити перорально. Пероральне введення може включати ковтання в результаті чого сполук або сіль потрапляє у шлунково-кишковий тракт, і/або букальне, язичне або під'язичне введення, коли сполука або сіль потрапляє у кровообіг безпосередньо з рота. Рецептури, придатні для перорального введення, включають тверді, напівтверді і рідкі системи, наприклад, таблетки, м'які або тверді капсули, що містять мульти- або наночастки, рідини або порошки; коржики (включаючи заповнені рідиною); жуйки; желе; легкодисперсні дозовані форми; плівки; овули; спреї і букальні/слизоадгезивні накладки. Сполуки або солі згідно з винаходом можна вводити розпилюванням сухої дисперсії. Рідкі рецептури включають суспензії, розчини, сиропи і еліксири. Такі рецептури можуть бути використані як заповнювачі у м'яких або твердих капсулах (виготовлених, наприклад, з желатину або гідроксипропілметилцелюлози) і звичайно включають носія, наприклад, воду, етанол, поліетиленгліколь, пропіленглікол, метилцелюлозу або масло і один або більше емульгаторів і/або суспендуючих агентів. Рідкі рецептури можуть також бути приготовлені відновленням твердої речовини, наприклад, з саше. Сполуки винаходу і їх солі можуть також бути використані у швидкорозчинних, швидкодезінтегрових дозованих формах, наприклад, описаних у Expert Opinion (Therapeutic Patents, 11 (6), 981-986, by Liang and Chen (2001). У таблетках, залежно від дози, ліки можуть становити від 1% до 80% (за масою) цієї дозованої форми, звичайно від 5% до 60% (за масою). Крім ліків таблетки звичайно містять дезінтегратор. Приклади дезінтеграторів включають натрійгліколатний крохмаль, натрій-карбоксиметилцелюлозу, кальцій-карбоксиметилцелюлозу, кроскармелозний натрій, кросповідон, полівінілпіролідон, метилцелюлозу, мікрокристалічну целюлозу, нижчу заміщену алкілом гідроксипропілцелюлозу, крохмаль, желатинізований крохмаль і альгінат натрію. Взагалі дезінтергатор становить від 1% до 25% (за масою), бажано, від 5% до 20% (за масою) дозованої форми. Зв'язуючі агенти взагалі використовують для надання когезивності таблетковим рецептурам. Придатні зв'язуючі агенти включають мікрокристалічну целюлозу, желатин, цукри, поліетиленгліколь, природні і синтетичні гуми, полівінілпіролідон, желатинізований крохмаль, гідроксипропілцелюлозу і гідроксипропілметилце 13 люлозу. Таблетки можуть також містити розріджувачі, наприклад, лактозу (моногідрат, висушений розпилюванням моногідрат, безводний тощо), манітол, ксилітол, декстрозу, сахарозу, сорбітол, мікрокристалічну целюлозу, крохмаль і діосновний фосфодигідрат кальцію. Таблетки можуть також, як варіант, включати ПАР, наприклад, лаурилсульфат натрію і полісорбат 80, і гліданти, наприклад, діоксид кремнію і тальк. ПАР може становити від 0,2% до 5% (за масою) таблетки, а глідант - від 0,2% до 1% (за масою) таблетки. Таблетки також взагалі містять змащувачі, наприклад, стеарат магнію, стеарат кальцію, стеарат цинку, стеарил-фумaрат натрію і суміші стеарату магнію з лаурилсульфатом натрію. Змащувачі взагалі становлять від 0,25% до 1 % (за масою), бажано, від 0,5% до 3% таблетки. Іншими інгредієнтами можуть бути антиоксиданти, забарвлювачі, смакові добавки, консерванти і агенти маскування смаку. Типові таблетки містять до приблизно 80% ліків, від приблизно 10% до приблизно 90% (за масою) зв'язуючого агента, від приблизно 0% до приблизно 85% (за масою) розріджувача, від приблизно 2% до приблизно 10% (за масою) дезінтегратора і від приблизно 0,25% приблизно 10% (за масою) змащувача. Тверді рецептури для перорального введення можуть бути призначені для негайного і/або модифікованого вивільнення. Рецептури з модифікованим вивільненням включають варіанти з уповільненим, затриманим, імпульсним, контрольованим, націленим і програмованим вивільненням. Рецептури з модифікованим вивільненням, придатні для використання у винаході, описано у патенті США 6106864. Інші технології, наприклад, високоенергетична дисперсія і осмотичні і покриті частки описано у Pharmaceutical Technology Online, 25(2), 1-14, by Verma et al. (2001). Межі дозування для перорального введення становлять від 0,1 мг до 80 мг, від 15 мг до 80 мг, від 0,1 мг до 25 мг. Парентеральне введення Сполуки або їх солі згідно з винаходом можна також вводити безпосередньо у кровообіг, у м'язи або у внутрішні органи. Сполуку Прикладу 2 можна вводити у кровопотік. Парентеральне введення включає внутрішньовенне, інтраартеріальне, інтраперитонеальне, інтратекальне, інтравентрикулярне, інтрауретральне, інтрастернальне, інтракраніальне, внутрішньом'язове, інтрасиновіальне і пiдшкірне. Пристрою для парентерального введення включають голку (включаючи мікроголку), ін'єктори, безголкові ін'єктори і інфузійні пристрої. Парентеральні рецептури звичайно є водними розчинами, які можуть містити ексципієнти, наприклад, солі, карбогідрати і буфери (бажано, рН=39), але у деяких випадках вони можуть бути виготовлені як стерильний неводний розчин або як суха форма для використання разом з придатним носієм, наприклад, стерильною апірогенною водою. 94639 14 Приготування парентеральних рецептур у стерильних умовах, наприклад, ліофілізацією, може бути здійснене з використанням стандартних фармацевтичних процедур. Розчинність сполук винаходу і їх солей, що використовуються у приготуванні парентеральних розчинів, може бути підвищена використанням відповідних способів, наприклад, доданням підвищуючих розчинність агентів. Рецептури для парентерального введення можуть бути приготовлені для негайного і/або модифікованого вивільнення. Рецептури для модифікованого вивільнення включають варіанти з уповільненим, затриманим, імпульсним, контрольованим, націленим і програмованим вивільненням. Сполуки винаходу можуть бути приготовлені як суспензії або як тверді або напівтверді речовини або як тиксотропні рідини для введення як імплантовані джерела, що забезпечують модифіковане вивільнення активної сполуки. Приклади таких рецептур включають стенти з лікувальним покриттям і напівтверді речовини і суспензії, що містять наповнені ліками мікросфери з полі(димолочної-співгліколевої)кислоти (PGLA). Топічне введення Сполуки або їх солі згідно з винаходом можна вводити топічно, (інтра)дермально або трансдермально через шкіру або слизову. Сполуку Прикладу 1 можна вводити у шкіру. Типовими рецептурами є желе, гідрожеле, лосьйони, розчини, креми, мазі, порошки, пов'язки, піни, плівки, нашкірні накладки, вафлі, імпланти, губки, волокна, бандажі і мікроемульсії. Ліполсоми також знаходять застосування. Типовими носіями є спирт, вода, мінеральне масло, рідкий петролатум, Білий петролатум, гліцерин, поліетиленгліколь і пропіленгліколь. Можуть бути додані прискорювачі проникнення (див., наприклад, J Pharm Sci, 88 (10), 955-958, Finnin and Mjrgan (October 1999)). Інші засоби топічного введення включають введення електрофорезом, іонофорезом, фонофорезом, сонофорезом і ін'єкції мікроголкою або безголковим пристроєм (наприклад Powderject, Bioject тощо). Рецептури для топічного введення можуть бути приготовлені у варіантах з уповільненим, затриманим, імпульсним, контрольованим, націленим і програмованим вивільненням. Інгаляційне/інтраназальне введення Сполуки або їх солі згідно з винаходом можна також вводити інтраназально або інгаляцією, звичайно у формі сухого порошку (індивідуально або як суміш, наприклад, у сухій суміші з лактозою, або як суміші часток, наприклад, змішаних з фосфоліпідами, наприклад, фосфатидилхоліном) через інгалятор сухого порошку, як аерозоль з інгалятора під тиском, насосом, розпилювачем, атомізатором (бажано, електрогідродинамічним, для отримання тонкого туману), або пульверизатором з використанням (або без) належного пропелента, наприклад, 1,1,1,2-тетрафлуопентану або 1,1,1,2,3,3,3-гептафлуорпропану, або як носові краплі. Для інтраназального використання порошки можуть включати біоадгезивні агенти, наприклад, хітозан або циклодекстрин. 15 Працюючі під тиском контейнери, насоси, розпилювачі, атомізатори або пульверизатори містять розчин або суспензію сполуки винаходу, у, наприклад, етанолі, водному етанолі або іншому придатному для диспергування агенті, солюбілізатори або продовжувачі вивільнення активного агента, пропелент як розчинник і, як варіант, ПАР, наприклад, сорбітантріолеат, олеїнову кислоту або олігомолочну кислоту. Перед використанням сухих порошкових або суспензійних рецептур лікувальний продукт мікронізують до розмірів, придатних для введення інгаляцією (звичайно менше 5 мкм). Цього можна досягти будь-яким способом подрібнення, наприклад, спіральним меленням у потоці, струйним меленням у рідинному шарі, суперкритичною обробкою рідини для отримання наночасток, гомогенізацією під високим тиском або сушінням розпилюванням. Капсули (виготовлені, наприклад, з желатину або гідроксипропілметилцелюлози), блістери і картриджи для використання в інгаляторі або інсуфляторі, можуть бути призначені містити порошкову суміш сполуки винаходу, придатної порошкової основи, наприклад, лактози або крохмалю, і модифікатора ефективності, наприклад, L-лейцину, манітолу або стеарату магнію. Лактоза може бути безводною або у формі моногідрату (останнє є бажаним). Інші придатні ексципієнти включають декстран, глюкозу, мальтозу, сорбітол, ксилітол, фруктозу, сахарозу і трегазол. Розчинна рецептура для використання в електрогідродинамічному атомізаторі може включати сполуку винаходу, пропіленгліколь, стерильну воду, етанол і хлорид натрію. Інші розчинники, які можуть бути використані замість пропіленгліколю, включають гліцерол і поліетиленгліколь. Рецептури для інгаляційного/інтраназального введення можуть бути приготовлені для негайного і/або модифікованого вивільнення, наприклад, за допомогою PGLA. Рецептури для топічного введення можуть бути приготовлені у варіантах з уповільненим, затриманим, імпульсним, контрольованим, націленим і програмованим вивільненням. У випадку сухих порошкових інгаляторів і аерозолів, дозування здійснюється клапаном, який подає відмірену кількість. Одиниці згідно з винаходом звичайно вводять відміреною дозою або "вдиханням", яке може бути одиничною дозою або, частіше, як розділена денна доза. Дози для інгаляції лежать у межах 2 мг або менше, або 1 мг або менше. Комбінування Сполуки або їх солі згідно з винаходом можна вводити у комбінації з одним або більше іншими терапевтичними агентами, наприклад, ліками. Сполуку винаходу або її сіль можна вводити одночасно або у різні часи разом з одним або більше іншими терапевтичними агентами. Наприклад, "у комбінації" включає: одночасне введення комбінації сполуки або солі винаходу і терапевтичного агента суб'єкту, коли такі компонент приготовлено разом в одній дозованій формі, яка вивільняє зазначені компоненти суттєво одно 94639 16 часно у цьому суб'єкті; суттєво одночасне введення комбінації сполуки або солі винаходу і терапевтичного агента суб'єкту, що потребує лікування, коли ці компоненти приготовлені окремо один від одного в окремих дозованих формах, які приймаються суттєво одночасно даним суб'єктом, після чого зазначені компоненти вивільняються суттєво одночасно для зазначеного суб'єкта; послідовне введення комбінації сполуки або солі винаходу і терапевтичного агента суб'єкту, коли ці компонент приготовлено окремо один від одного в окремих дозованих формах, які зазначений суб'єкт приймає послідовно у різні часи з значним інтервалом, після чого зазначені компоненти вивільняються у суттєво різні часи у зазначеному суб'єкті; і послідовне введення такої комбінації сполуки або солі винаходу і терапевтичного агента суб'єкту, коли ці компоненти приготовлено разом в одній дозованій формі, яка вивільняє зазначені компоненти контрольовано, внаслідок чого вони отримуються одночасно, послідовно і/або з перекриттям одночасно і/або у різні часи зазначеним суб'єктом, причому кожну частину можна вводити одним або різними шляхами. Наприклад, сполуку або сіль згідно з винаходом може бути використана у комбінації частково або повністю на додаток до інших антизапальних агентів. Придатні антизапальні агенти включають циклоспорин, соледронову кислоту, ефалізумаб, алефацепт, етодолак, лорноксикам, ОМ-89, вальдекоксиб, тоцилізумаб, абатацепт, мелоксикам, етанерцепт, намбуметон, римексолон, 153SmEДTMP, просорба, імідазол саліцилат, опрелвекін, гілауронову кислоту, напроксен, піроксикам, діацереїн, лумерикоксиб, такролімус, ацеклофенак, актарит, теноксикам, розиглітазон, дефлазокорт, адалімумаб, лефлуномід, ризедронат натрію, мізопростол і диклофенак, SK-1306X, інфліксимаб, анакінра, целекоксиб, диклофенак, еторикоксиб і фельбінак, ревмакон, голімумаб, денозумаб, офатумумаб, 10rТ1 антитіло, пелубіпрофен, лікофелон, темсіролімус, екулізумаб, ігуратимод і преднізон. Інші придатні антизапальні агенти включають СР-481715, ABN-912, MLN-3897, HuMax-IL-15, RA1, паситаксель, Org-37663, Org 39141, АЕД-9056, AMG-108, фонтолізумаб, пегзунерцепт, пральнакасан, апілімод, GW-274150, АТ-001, 681323 (GSK) K-832, R-1503, окрелізумаб, DE-096, Срn10, THC+CBD (GW Pharma), 856553 (GSK), ReN-1869, імуноглобулін, mm-093, амелубант, SCIO-469, ABT-874, LenkoVAX, LY-2127399, TRU-015, KC706, дипіридамол, амоксапінет і дипіридамол, ТАK-715, PG 760564, VX-702, преднізолон і дипіридамол, РМХ-53, белімумаб, принаберель, CF101, tgAAV-TNFR:Fc, R-788, преднізолон і SSRI, дексаметазон, СР-690550 і РМІ-001. Зрозуміло, що при використанні сполук винаходу або їх солей у лікуванні певної хвороби ці сполуки винаходу можна комбінувати з різними існуючими терапевтичними агентами, що використовуються при цій хворобі. Наприклад, сполуки або солі згідно з винаходом можуть бути комбіновані з агентами, що модулюють один або більше таких об'єктів: циклооксигеназа 2 (синтаза 2 простагландинового 17 ендоперексиду 2); TNF-R (рецептор фактора некрозу пухлини типу 1); циклооксигеназа (Сох 1 і 2; неспецифічнa); Кіназf Мар р38 (неспецифічна); рецептор II1 (тип І і II, неспецифічний); 5ліпоксигеназа арахідонату; рецептор глюкокортикоїду (GR); NF-kB, фактор некрозу пухлини (TNFальфа); рецептор хемокіну CCR1; рецептор лейкотрієну В4 (неспецифічний); PDE4 (Фосфодіестераза 4, неспецифічна); рецептор IL6; Інтегрин (неспецифічний); ADAM-17 (ензим перетворення TNF-альфа); ICE (бета-конвертаза каспази 1/інтерлейкіну-1); ензим синтезу простагландину (неспецифічний); рецептор речовини-Р (SPR/рецептор NK-1); Простаноїдний рецептор (неспецифічний); Протеїн 1 адгезії васкулярних клітин (VCAM 1); ММР-13 (колагеназа 3); Рецептор VEGF (неспецифічний); хематотоксичний рецептор анафілатоксину С5А (C5AR); Фактор пригнічення міграції макрофагів (MIF); Пуриннуклеозидна фосфорилаза (PNP); Бета 1 інтерферон; ММР-3 (стромелізин 1); рецептор хемокіну CCR2; ММР-2 (желатиназа А); Рецептор 5 фактора некрозу пухлини (CD40); антиген CD44 (функція наведення і система індійської групи крові); рецептор хемокіну CCR5; Синтаза простагландину Е; Гамма-рецептоp, активований проліфератором пероксисоми (PPAR-гамма); рецептор хемокіну CXCR4; Катепсин S; Тирозинова кіназа протоонкогену LCK; рецептор хемокіну CXCR3; Рецептор PDGF; FKBP (12 FK-506); суперродина Ig CTLA-4; Протеїнова кіназа С (РKС, неспецифічна); Інтегрин альфа-V/бета-5; Катепсин K; Протеасома 26S; Мінералокортикоїдний рецептор (MR); Бетасубодиниця кінази IkB (IKK БЕТА); Рецептор фактора активації тромбоцитів (PAF-R); Синтетаза фарнезил-пірофосфату FPP; рецептор хемокіну CXCR1; Рецептор фактора стимуляції колонії макрофагів (CSF-1R); рецептор 1 IL18; Рецептор аденозину A3; Фактора стимуляції колонії гранулоцитів-макрофагів (GMCSF); кіназа тирозину SYK; рецептор CRF (неспецифічний); Альфа/Бета гетеродимер тубуліну; Кіназа тирозину (неспецифічна); Амілоїд бета; Фактора стимуляції колонії макрофагів (MCSF); Член 11 надродини ліганду фактора некрозу пухлини (ліганд активатора рецептор нуклеарного фактора каппа b); Фосфоліпаза (неспецифічна); Рецептор естрогену (альфа/бета, неспецифічний); ММР-9 (желатиназа В); Нітрооксидна синтаза (неспецифічна); Індукована Нітрооксидна синтаза (неспецифічна); р53 клітинний антиген пухлини; інсуліноподібний фактор росту 1 (соматомедин С); Нікотиновий комплекс рецептора ацетилхоліну; oпiоїдний рецептор Мютипу (MOR-1); IL11; ERBB/EGF Рецептор Кінази тирозину (неспецифічний); рецептор гістаміну Н2; Дипептидил пептидаза IV (DPP IV, CD26); Топоізомераза II; рецептор хемокіну CCR7; Бактеріальна Дигідрофолатна редуктаза (неспецифічна); Бета-тубулін; Полімераза ДНК (людська, будь-якої композиції субодиниць); рецептор хемокіну CCR4; рецептор хемокіну CCR3; Канал K+ (калію) (неспецифічний); Мітогенно активована кіназа протеїну 14 (MARK14/Р38-альфа); канали кальцію L-типу (неспецифічні); рецептор хемокіну CCR6; PDE3 ((Фосфодіестераза 3; неспецифічна); Цистеїнова 94639 18 протеаза (неспецифічна); Залежний від натрію транспортер норадреналіну (NAT); МАР2-Кіназа (МЕK, неспецифічна); Кіназа RAF (неспецифічна); Гіпоксійний фактор 1 альфа; рецептор NMDA; Рецептор бета естрогену (ER-бета); Людська ДНК; Рецептор холецистокініну типу В (ССКВ); рецептор брадикініну В1 (ВК1); пуриноцептор 7 Р2Х (Р2Х7); Рецептор аденозину А2А; Канабіноїдний рецептор 2 (СВ2); Сигма-опiоїдний рецептор; Канабіноідний рецептор 1 (СВ1); рецептор хемокіну CXCR2; Комплементний фактор І (інактиватор С3В/С4В); Кіназа Протеїну В (RAC-Кіназа) (неспецифічна); Гамма-секретазний комплекс; CRTH2 (GPR44); р53асоційований uty (MDM2 убікітин-протеїнова лідаза Е3); рецептор VIP (неспецифічний); рецептор IL1, тип І; IL6 (інтерферон; бета 2); ММР (неспецифічна); інсулін; ММР-2/3/9; Кальцитонін/кальцитонінний поліпептид; альфа; Ліпоксигеназа (неспецифічна); Васкулірний ендотеліальний фактор росту (VEGF); Тромбін; Рецептор андрогену; Map-Кіназа (неспецифічна); Статевий гормонозв'язувальний глобулін; Хемокін CCL2 (MCP1/MCAF); Фосфоліпаза А2; Еритропоєтин (ЕРО); Плазміноген; Гастричний протонний насос (Н+ K+ ATPase); Каспаза (неспецифічна); рецептор FGF (неспецифічний); Активований рецептор альфа проліфератора нероксимази (PPARальфа); рецептор МІР1а (неспецифічний); S100 протеїн зв'язування кальцію (неспецифічний); рецептор PGE (неспецифічний); Деіміназа пептидиларгініну, тип IV; комплекс PDGF (а/b); Беталактамаза і PBPs (біосинтез клітинної стінки); Опiоїдний рецептор (неспецифічний); Ензим 1 перетворення ангіотензину (АСЕ1); Урокіназний активатор плазміногену (UPA) Фосфодіестераза (неспецифічна PDE); Рецептор прогестерону (PR); рецептор 5НТ (серотоніну) (неспецифічний); фактор некрозу пухлини (ліганд); член 5 надродини (ліганд CD40); Синтаза тимідилату; Інтегрин Альфа4 - раксилінова взаємодія; Інтегрин альфа-4 (VLA-4/CD49D); ERK1; ізомераза фосфату глюкози (фактор аутокринної рухомості); Рецептор допаміну (неспецифічний); Хемокін CXCL12 (SDF-1); Протеїн переносу мікросомного тригліцериду; Інтегрин альфа-5/бета-1; Перетворювач сигналу і активатор транскрипції 3 (Фактор гострої фази реакції); Інпбітор-1 активатора плазміногену (РАІ-1); рецептор вітаміну D3 (VDR/рецептор 1,25дигідроксивітаміну D3); Ароматазний комплекс (P450arom і редуктаза NADPH-цитохрому Р450); Протеїн-тирозинова фосфатаза (неспецифічна); Редуктаза 3-гідрокси-3-метилглютарилового співензиму A (HMG-CoA); Інтегрин бета-1 (рецептор фібронектину; бета-субодиниця); Інтегрин бета1/альфа-11; Протеїн-140 Ρ селектину (СМР140/грануломембрани); Протеїн активації 5ліпоксигенази (FLAP); H+/K+ ATPase (неспецифічна); Канал Na+ (натрію) (неспецифічний); Тироїдна пероксидаза; Мозковий керований напругою натрієвий канал альфа-1; Бета-2 адренкергічний рецептор; BCL1 (Cyclin D1); рецептор тироїдного гормону (неспецифічний); Рецептор 2 васкулярного ендотеліального фактора росту (VEGFR-2/FLK1); Альфа-V/Бета-6 Інтегрин; Інтегрин альфа-V (альфа-субодиниця вітронектинового рецепто 19 ра/СD51); Кіназа SRC; Плейотропін (гепариновий зв'язувальний фактор росту 8, фактор 1 сприяння росту невритів); остеопонтин (секреційний фосфопротеїн 1); рецептор 4 (TLR4); Ванілоїдний рецептор (неспецифічний); Рі3-Кіназа (неспецифічна); Полі(АОР-рибоза)-полімераза (PARP); рецептор PPAR (неспецифічний); Бета-адренергічний рецептор (неспецифічний); перехідний канал катіонного потенціалу рецептора; субродина V; член 1 (TRPV1); Топоізомераза І; Рецептор гістаміну Н1; кініноген; ІKK-Кіназа (неспецифічна); протеїн ТАТ ВІЛ; рецептор 2; носій розчину, родина 22 (органічний транспортер катіону), член 4 (SLC22A4); рецептор RXR (неспецифічний); Renin (ангіотензиногеназа); рецептор гормону вивільнення гонадотропіну (GNRH-R); Протеїни зв'язування пеніциліну (пептидази клітинної стінки); Кальмодулін; Активована мітогеном протеїнова кіназа 1 (MAPK1/ERK2); Канал кальцію (неспецифічний); агреканаза (неспецифічна); Кіназа JNK (неспецифічна); транстиретин (TTR); рецептор CX3CR1; Коагуляційний фактор lll тром-бопластин, тканинний фактор); Натрій-залежний транспортер серотоніну (5НТТ); Фактор 1 стимуляції колонії (макрофагів); Тканинна трансглютаміназа (Трансглютаміназа 2/TGM2); Специфічний до кінцевого продукту глюкосилаційний рецептор; Оксидаза моноаміну (Α і В; неспецифічна); рецептор гістаміну (неспецифічний); Натрій-залежний транспортер допаміну (DAT); Вірусний онкогенний ліганд мієлопроліферативної лейкемії; фактор розвитку і росту мегакаріоцитів; Сигнальна молекула активації лімфоцитів; Нейтральна ендопептидаза (NEP/неприлізин); Рецептор ендотеліну (ЕТА); Тирозиназа; активована мітогеном кіназа протеїну 8 (MAPK8/JNK1); ІАР (інгібітор апоптозу) неспецифічний; Фосфоінозитидна 3-кіназа; рецептор простагландину Р2-альфа (рецептор простаноіду FP); Гормон росту людини; Рецептор вазорепресину (неспецифічний); Рецептор фактора росту (С-KІТ); CDK (неспецифічна); D4/5HT1a (рецептор допаміну D4, рецептор серотоніну 1а); Рецептор ангіопойетину (ТІЕ-2) (ТЕK); Рецептор-альфа естрогену (ER-альфа); Рецептор епідермального фактора росту; Фокальна адгезійна кіназа (неспецифічна); Рецептор периферійного бензодіазепіну (HPBS); Окситоциназа; Цитосолічна фосфоліпаза А2; Ендопептидаза (неспецифічна); рецептор 1 FGFR1 FGF; рецептор нейрокініну NK1/рецептор NK2; Проліл-4-гідроксилазний комплекс; Рецептор інтегрину альфа-5 (Рецептор фібронектину; альфа субодиниця/VLА-5/СО49Е); рецептор мускаринового ацетилхоліну (неспецифічний); Тирозинпротеїнова кіназа JAK3 (JANUS КІНАЗА 3); рецептор odC1 - орнітинова декарбоксилаза; рецептор 5НТ3; Адреномедулін; Гомолог фосфатидилінозитол-3-кінази (Мутований ген атаксіїтелеанпектазн/АТМ); рецептор еритропойєтину; Фактор росту з'єднувальної тканини; RAC-альфа кіназа серин/треоніну (Протеїнова кіназа В); Рецептор 9; Синтаза нейронного нітрооксиду (NOS1); рецептор Каппа-типу oпiоїду (KOR-1); Серцевий комплекс каналу Na+; рецептор ERBB-2 протеїнової кінази тирозину (Рецептор кінази клітинного тирозину HER2); рецептор тромбіну (PAR-1); 94639 20 PDE4B (сАМР-специфічна фосфодіестеразі 4B/HSPDE4B); Фактор росту тромбоцитного бетаполіпептиду; Асоційований з FKBP-рапаміцином протеїн (FRAP, mTOR); тромбомодулін; Протеаза ВІЛ (ретропепсин); PDE4D (сАМР-специфічна фосфодіестераза 4D/HSPDE4D); Аденозинна кіназа; Гістон-деацетилаза (неспецифічна); рецептор субтипу ЕР4 простагландину Е2 (Простаноїдний рецептор ЕР4); Активована мітогеном протеїнова кіназа 3 (МАР2K3); ММР-12 (металоеластаза); рецептор ОХ40; Неспецифічна людська лігаза убікітину; рецептор сульфонілмочевини (SUR1 панкреатична) і SUR2 (серцевий/гладкий м'яз)); Коагуляційний фактор X (фактор Стюарта); Активована МАР-кіназою протеїнова кіназа 2 (МАРKАРK-2); Постійний регіон важкого ланцюга ІgЕ; рецептор допаміну D2+5НТ2А; Рецептор 5гідрокситриптаміну 4 (5НТ4); Рецептор (АТ1) ангіотензину II типу 1; Цитохром Р450 3А4; Циклофілін Т-клітини (циклофілін А); Рецептор нейромедину K (NKR/рецептор NK-3); рецептор лейкотрієну В4; Кіназа тирозину (ВТК); Активована мітогеном протеїнова кіназа кінази 6 (МАР2K6); ендоглін; M1/D2/5HT2; Натрій-залежний норадреналіновий транспортер + рецептор допаміну D4; Активована мітогеном протеїнова кіназа кінази 4 (МАР2K4); Протеїн теплового шоку Hsp90 А/В; Гістидиндекарбоксилаза; носій розчинника, родина 22 (органічний транспортер катіону), член 5 (SLC22A5); CSK кіназа тирозину; Проліл-ендопептидаза; рецептор цистенеїл-лейкотрієну (CYSLT1); Нуклеарний рецептор NURR1 (Протеїн негайної-ранньої реакції NOT); Рецептор 3; Активований протеїназою рецептор 2 (PAR-2); рецептор простацикліну (рецептор простагланоїду IP); Інгібітор протеїнази мерину (або цистеїну), клейд F (альфа-2 антиплазмін, фактор пігменту епітелію), член 1; Пітуїтарний аденілатний циклазний активуючий поліпептидний рецептор типу І (PACAP-R-1); Фактор некрозу пухлини (ліганд), надродина, член 10; C-MAF (коротка форма); Ацитолхолінестераза (ACHE); Адренергічний рецептор Альфа1 (неспецифічний); Рецептор Bz зв'язування GABA А; рецептор EDG-1 лізосфінголіпіду; Слизова адресинова молекула-1 адгезії клітин (MAdCam); Адренергічний рецептор альфа-IL; рецептор фактора росту гепатоцитів (MET Прото-онкогенна кіназа тирозину); рецептор Μ ускаринового ацетилхоліну М3; МЕK1; рецептор інсуліну; рецептор GABA (А+В; неспецифічний); Каталітична субодиниця гамма 3-кінази фосфитидилінозитолу (РІ3 кіназа гамма); Кістковий морфогенетичний протеїн 2 (ВМР2); рецептор SKY протеїнової кінази тирозину (TYRO3) (RSE); Родина рецептора дискоїдинового домену, член 2 (DDR2); KV керований напругою калієвий канал (неспецифічний); Сфінгозинна кіназа (неспецифічна); рецептор високої спорідненості фактора росту нерва (TRK-A); Карбонові ангідрази (усі); рецептор тромбопойєтину; Васкулярний ендотеліальний фактор росту С; ангіотензиноген; Касета зв'язування АТФ, субродина В (MDR/TAP), член 1 (АВСВ1) (Рглікопротеїн мультирезистентності до ліків (MDR1); Активована мітогеном протеїнова кіназа кінази 7 (МАР2К7); рецептор мускаринового ацетилхоліну М1; Зворотна транскриптаза ВІЛ; PDE5A 21 (cGMP-зв'язування, cGMP-специфічна фосфодіестераза 5A/HSPDE5A); Альфа адренергічний рецептор (неспецифічний); Інгібітор ліпопротеїнової коагуляції; Карбоксипептидаза В2 (TAFI); Холінестераза (неспецифічна); рецептор В2 брадикініну (ВK2); Редуктаза альдози; Коагуляційний фактор XI (Тромбопластиновий антецедент плазми); Протеїнова кіназа серину/треоніну Р78; Метіонінова амінопептидаза 2; Розчинна гупнілатна циклаза (неспецифічна); Рибосомна протеїнова S6 кіназа; Метаботропічний рецептор 1 глютамату; Нерецепторна тирозин-протеїнова кіназа TYK2; Метаботропічний рецептор глютамату (неспецифічний); рецептор васкулярного ендотеліального фактора росту 3 (VEGFR-3/FLT4); Активована мітогеном протеїнова кіназа 13 (MARK13/Р38 дельта); Протеїн активації фібробласту (сепраза); рецептор 1 фактора вивільнення кортикотропіну (CRF1); Активована мітогеном протеїнова кіназа 11 (MARK11/Р38 бета); Комплементний компонент 5; FL рецептор цитокіну (FLT3); рецептор АМРА (рецептори 1-4 глютамату); Рецептор фактора росту нерва; АсуІ-СоА А: холестерольна ацилтрансфераза 1 (АСАТ1); Зглажений гомолог завитого рецептора (SMO); Сполучений G-протеїном рецептор BONZO (STRL33, CXCR6); ІKСа протеїни; TGF-бета рецептор, тип II (TGFR-2); ВІЛ-vif протеїн; Рецептор 5-гідрокситриптаміну 2В (5НТ2В); Протеїн зв'язування жирної кислоти (неспецифічний); Рецептор 7 (TLR7); Грелін; рецептор антигену CD36 (колагену типу І), рецептор тромбоспондіну); Активована мітогеном протеїнова кіназа кінази 3 (МАР3K3/МЕKK3); FMLP рецептор І (FMLP-RI); Сфінгозинова кіназа SPHK1; Гістидил-tPHK синтетаза; Активована мітогеном протеїнова кіназа 9 (MAPK9/JNK2); рецептор Р2Х (неспецифічний); Казеїнова кіназа І (неспецифічна); Сульфотрансферази (неспецифічні); Нуклеарний рецептор ROR-альфа-1; Катехол-О-метилтрансфераза (СОМТ); Моноамінова оксидаза А (МАОА); Гаммаглютамілова гідролаза; Протеїнова кіназа С альфа-типу (РKС-альфа); Активована мітогеном протеїнова кіназа 12 (MAPK12/ERK6/P38 гамма); Альфа2 Дельта-канал кальцію; Комплекс тканиний фактор/фактор VIla; Нейтрофільний фактор пригнічення анкілостоми; калієвий канал ІKr; Рецептор гістаміну Н4 (JAR3) (PFI-13); Рецептор 5гідрокситриптаміну 2А (5НТ2А); рецептор холецистокініну типу А (ССKА); 11-бета гідроксистероїдна дегідрогеназа 1; Гормон вивільнення гормону росту; Нікотиновий рецептор ацетилхолінового протеїну альфа-7; Рецептор 5НТ2 (неспецифічний); Ізоформа обміну натрій/гідроген 1 (NHE1); рецептор Substance-K (SKR/рецептор NK-2); рецептор 5гідрокситриптаміну 1D (5HT1D); Рецептори 5HT1B/1D; Сахароза-ізомальтаза; Бета-3 адрогенний рецептор; Пов'язаний з геном пептидний рецептор кальцитоніну (GGRP), тип 1; Циклінозалежна кіназа 4 (CDK4); Адреногенний рецептор Альфа-1А; рецептор P2Y12 тромбоциту ADP; Активована мітогеном протеїнова кіназа кінази 5 (МАР3K5) (MEKK5); Регулятор сигналів G-протеїну 2; Рецептор інтерлейкіну-1, пов'язаний з кіназою (IRAK); Неорганічна пірофосфатаза (пфаза); ITK/TSK кіназа тирозину; RAR гамма; AXL тирозин 94639 22 протеїнова кіназа (UFO; рецептор GAS6); Активінова рецепторна кіназа 1 (ALK-1); Транскрипційний фактор 2, пов'язаний з мініатюрністю; AMP деаміназа (неспецифічна); Рецептор CCR8 хемокіну; Рецептор CCR11 хемокіну; рецептор ноцицептину; рецептор інсуліноподібного фактора росту І; рецептор P2Y (неспецифічний); Протеїнова кіназа С типу тета (NPKC-тета); DNA-метилтрансфераза; неспецифічна; Фосфорилазна кіназа (неспецифічна); Хемотактичний рецептор С3А анафілатоксину (C3AR); Сфінгозинова кіназа 2 (SPHK2); Казеїнова кіназа II; неспецифічна; Фосфогліцератна кіназа 1; UDP-Gal:beatGlcNAc бета 1,4галактосилтрансфераза 2 (B4GALT2); Носій розчину родини sapiens 7 (катіонний амінокислотний транспортер; у+ система), член 5 (SLC7A5); ММР17 (МТ-ММР 4); Альфа ланцюг казеїнової кінази II (СK II); Специфічний затримувач росту 6 (GAS6); Активована МАР кіназою протеїнова кіназа 3 (MARKАРК-3); Активована мітогеном і стресом протеїнова кіназа-1 (MSK1); Синтаза простагландину D2 (21 kD; мозок); Панкреатичний K+ канал (неспецифічний); TGF-бета рецептор типу І (TGFR-1/активінова рецепторна кіназа 5/ALK-5); Циклінозалежна кіназа 2 (CDK2); АСАТ (АСАТ Ензими 1 і 2; неспецифічні); Oпiоїдний рецептор дельта-типу (DOR-1); Рецептор 5-гідрокситриптамін 6 (5НТ6); рецептор 5-гідрокситриптамін 1А (5НТ1А); рецептор 5НТ1 (неспецифічний); рецептор гормону росту; PDE7 (фосфодіестераза 7; неспецифічна); Рецептор IgE (R1 і R2; неспецифічний); Циклінозалежна кіназа 1 (CDK1) Фарнезилпротеїновий трансферазний комплекс; Рецептор простагландину D2 (простаноїдний DP рецептор); Комплементний C1S компонент; Гістондеацетилаза 5; dickkopf попередник гомолога 1; Р2Х пуриноцептор 4 (Р2Х4); Лектиноподібний оксидований рецептор LDL (LOX-1); Епоксидна гідролаза 2 (транс-стиреноксидна гідролаза) (розчинна епоксидна гідролаза) (sEH); синтаза дигідродипіколінату (dhdps) (DapA); CaM комплекс Кінази І; LXR альфа/бета (неспецифічна LXR); Друга мітохондрієвий активатор каспази; Кіназа з інтегриновим зв'язком (ILK); Фокальна адгезійна кіназа 2 (FADK 2); Рецептор аденозину А2В; WEE1-подібна протеїнова кіназа; Реперна кіназа (СНK2); Бактеріальний SecA протеїн; Нікотиновий рецептор ацетилхолінового протеїну бета-2; Активована мітогеном протеїнова кіназа кінази 1 (МАР3K1/MEKK1); Протеїнова кіназа С дзета-типу (NPKC-дзета); PDK1 (3-фосфоіноситидно-залежна протеїнова кіназа-1); Рецептор 5-гідрокситриптаміну 5А (5НТ5А); Стероїдна 5-альфа-редуктаза; Активована мітогеном протеїнова кіназа кінази 8 (МАР3K8/СОТ); Протеїнова тирозин-фосфатаза 1В; P2Y пуриноцептор 1 (P2Y1); Альфа-1D адренергічний рецептор; Казеїнова кіназа І-епсілон (СKІ-епсілон); Рецептор 5гідрокситриптаміну 7 (5НТ7); Коагуляційний фактор VII (Eptacog alfa); Піруватна кіназа дегідрогенази (PDHK; неспецифічна); PDE7A (сАМРспецифічна фосфодіестераза 7A/HSPDE7A); Глюкагоноподібний пептидний 1 рецептор (GLP-1R); Субодиниця р3 полімерази інфлюенци р3 (рb2 ендонуклеаза); Вірусна протеаза (неспецифічна); Топоізомераза IV; Рецептор паратироїдного гор 23 мону (рецептор РТН2); Протеїнова кіназа С типу бета-1 (РKС-бета-1); Допамінова бета гідроксилаза; Пов'язана з галактосилтрансферазою протеїнова кіназа P58/GTA; Пресинаптичний протеїн SAP97; Інгібітор 1 синовіального апоптозу 1; синовioлін (SYVN1) (HRD1) (HRD-1); Скваленова епоксидаза (ERG1); Протеїнова кіназа С епсилонтипу (NPKC-епсилон); Рецептор фактора вивільнення кортикотропіну 2 (CRF2); Проміжний провідний активований кальцієм калієвий канал (ІK1); Нуклеозидна дифосфатна кіназа A (NDKA) (NM23H1); Пов'язана з рецептором інтер-лейкіну-1 кіназа 4 (IRAK-4); Кіназа-3 альфа синтази глікогену (GSK3 альфа); Носій розчину, родина 22 (органічний транспортер катіону); член 2 (SLC22A2); Піруватна кіназа 1 дегідрогенази (PDK1); РАK-альфа кіназа (РАK-1); Людські протеїни 14-3-3; Ізолейцил-tPHKсинтетаза; Пренілцистеїнова карбоксилметилтрансфераза (РССМТ); CKLF1; і NAALADaзa II. Сполуки або солі згідно з винаходом можна вводити у комбінації з одним або більше агентами, наприклад, SSRI, інгібіторами матричної металопротеїнази (ММР), інгібіторами агреканази, інгібіторами індукованого нітрооксиду (iNOS), інгібіторами експреси або активності інсуліноподібного фактора росту (IGF), інгібіторами експресії або активності фібробрастного фактора росту (FGF), інгібіторами експресії або активності CD 44, інгібіторами експресії або активності інтерлейкіну (IL), інгібіторами експресії або активності фактора некрозу пухлини альфа (TNF-альфа), інгібіторами експресії або активності індукованого фактором некрозу пухлини протеїну 6 (TSG-6), інгібітором експресії або активності бікуніну, інгібіторами бетасекретази (ВАСЕ), інгібіторами РАСЕ-4, інгібіторами експресії або активності нуклеарного рецептора rev-ErbA альфа (NR1D1), інгібіторами експресії або активності сполученого G-протеїном рецептора ендотеліального діференціюючого сфінголіпіду 1 (EDG-1) інгібіторами експресії або активності активованого протеїназою рецептора (PAR), інгібіторами експресії або активності хрящового чутливого до ретинової кислоти протеїну (CD-RAP), інгібіторами протеїнової кінази С дзета (PKCz), інгібіторами експресії або активності резистину, інгібіторами експресії або активності дезінтегрину і металопротеїнази 8 (ADAM8), інгібіторами експресії або активності комплементного субкомпонент 1 компоненту (C1s), інгібіторами експресії або активності формілпептидного рецепторного 1 (FPRL1). Додатковими прикладами агентів, корисних у комбінації з сполуками або солями згідно з винаходом, є інгібітори ММР -2, -3, -9, або -13; інгібітори експресії або активності агреканази -1 або -2; інгібітори експресії або активності IGF -1 або -2 і експресії або активності FGF -2, -18, або -9; і інгібітори експресії або активності IL -1, -4 або -6. Приклади агентів, корисних у комбінації з сполуками або солями згідно з винаходом, включають антитіла IGF -1 або -2; антагоністи рецептора FGF -2 або -3, антитіла CD 44, антитіла IL -1, -4 або -6, антитіла TNF-альфа; антитіла TSG-6л; антитіла бікуніну; антагоністи NR1D1; антагоністи EDG-1; 94639 24 антагоністи PAR; антитіла CD-RAP, антитіла резистину, антитіла C1s і антитіла FPRL1. Приклади сполук, які можна вводити з сполуками або солями згідно з винаходом включають селективні інгібітори циклооксигенази-2 (СОХ-2), наприклад, целекоксиб, рофекоксиб, парекоксиб, вальдекоксиб, деракоксиб, еторикоксиб і люміракоксиб; опіoїдні анальгетики наприклад, морфін, гідроморфон, оксиморфон, фентаніл, кодеїн, дигідрокодеїн, оксикодон, гідрокодон, бупренорфін, трамадол і нальбуфін; нестероїдні антизапальні ліки (NSAID) наприклад, аспірин, диклофенак, дифлунізал, ібупрофен, фенопрофен, напроксен, непафенак і ацетомінофен; інгібітори фосфодіестерази V (PDEV) наприклад, сільденафіл альфа-2дельта ліганди, наприклад, габапентин і прегабалін і локальні анестетики, наприклад, бензокаїн, лідокаїн, ропівакаїн, ментолі, камфора і метилсаліцилат. Приклади інших типів сполук і класів сполук, що можуть бути використані у комбінації з сполуками або солями згідно з винаходом, включають анальгетики, барбітурати, бензодіазепіни, антагоністи гістаміну H1 седативної дії; седативи; рeлаксанти скелетних м'язів; антагоністи рецептора N-метил-D-аспартової кислоти (NMDA); альфаадренергетики; трициклічні антидепресанти; антиконвульсанти, наприклад, карбамазанін; антагоністи тахикініну (ΝΚ), зокрема, антагоністи ΝΚ-3, ΝΚ2 або ΝΚ-1; антагоністи мускарину; нейролептики; антагоністи або агоністи ванілоїдного рецептора; бета-адренергетики; кортикостероїди; антагоністи або агоністи рецептора серотоніну (5-НТ), наприклад, 5-HT1B/1D, 5-НТ2А і антагоністи рецептора 5-НТ3; холінергічні (нікотинові) анальгетики; канабіноіди; антагоністи рецептор метаботропічного глютамату субтипу 1 (mGluR1); інгібітори повторного поглинання серотоніну, наприклад, сентралін; інгібітори повторного поглинання норадреналіну (норепінефрину), наприклад, ребоксетин, зокрема, (S,S)-ребоксетин, інгібітори дуального повторного поглинання серотоніну-норадреналіну, наприклад, дулоксетин; інгібітори нітрооксидної синтази (iNOS), наприклад, S-[2-[(1-іміноетил)аміно]етил]L-гомоцистеїн, S-[2-[(1-іміноетил)-аміно]етил]-4,4діоксо-L-цистеїн, S-[2-[(1-іміноетил)-аміно]етил]-2метил-L-цистеїн, (2S,5Z)-2-аміно-2-метил-7-[(1іміноетил)аміно]-5-гептенову кислоту, 2-[[(1R,3S)3-аміно-4-гідрокси-1-(5-тіазоліл)-бутил]тіо]-5-хлор3-піридинкарбонітрил; 2-[[(1R,3S)-3-аміно-4гідрокси-1-(5-тіазоліл)бутил]тіо]-4-хлорбензонітрил, (S,4R)-2-амiно-4-[[2-хлор-5(трифлуорметил)-феніл]тіо]-5-тіазол-бутанол, 2[[(1R,3S)-3-аміно-4-гідрокси-1-(5тіазоліл)бутил]тіо]-6-(трифлуорметил)-3-піридинкарбонітрил, 2-[[(1R,3S)-3-аміно-4-гідрокси-1-(5тіазоліл)-бутил]тіо]-5-хлорбензонітрил, N-[4-[2-(3хлорбензиламіно)-етил]-феніл]тіофен-2карбоксамідин і інгібітори гуанідинетилдисульфіду; інгібітори ацетилхолін естерази; антагоністи простагландину Е2 субтипу 4 (ЕР4), наприклад, N-[({2-[4-(2-етил-4,6-диметил-1Н-імідазо[4,5с]піридин-1-іл)феніл]етил}аміно)-карбоніл]-4метилбензолсульфонамід або 4-[(1S)-1-({[5-хлор2-(3-флуорфенокси)піридин-3 25 іл]карбоніл}аміно)етил]бензойну кислоту; антагоністи лейкотрієну В4, наприклад, 1-(3-біфеніл-4ілметил-4-гідрокси-хроман-7-іл)-циклопентанкарбонову кислоту; інгібітори 5-ліпоксигенази і блокери натрієвого каналу. У комбінації з сполуками або солями згідно з винаходом також входять анальгетики, наприклад, ацетомінофен, напроксен натрій, ібупрофен, трамадол, тразодон; циклобензаприн; аспірин, целекоксиб, вальдекоксиб, індометацин і інші NSAID; антидепресанти, наприклад, трициклічні антидепресанти і селективні інгібітори повторного поглинання серотоніну, наприклад, такі антидепресанти, як наприклад, амітриптилін, іміпрамін, нортриптилін, доксепін, флуоксетин, сертралін і пароксетин; релаксанти м'язів, наприклад, циклобензаприн; снодійні, наприклад, зольпідем. Комбінації з сполуками або солями згідно з винаходом також включають такі анальгетики, як, наприклад, ацетомінофен, напроксен натрій, ібупрофен, трамадол, тразодон; циклобензаприн; аспірин, целекоксиб, вальдекоксиб, індометацин і інші NSAID; антиревматичні ліки (DMARD), наприклад, сульфазалазин або метотрексат; кортикостероїди; і блокери фактора некрозу пухлини (TNF), наприклад, етанерцепт і інфліксимаб. Комбінації з сполуками або солями згідно з винаходом включають топічні кортикостероїди; аналоги вітаміну D, наприклад, кальуипортрієн; антралін; топічні ретиноїди (похідні вітаміну А), наприклад, фцитретин і тазаротен; клобетазол пропіонат; метотрексат; азатіоприн; циклоспорин; гідроксимочевина; і імуномодулятори, наприклад, алефацепт, ефалізумаб і етанерцепт. Лікування фототерапією включає псораленову УФ А (псораленову УФА або ПУФА) терапію вузькосмугову УФ В (УФВ) терапію і комбінацію світлотерапії з сполуками або солями винаходу і зазначеними вище комбінаціями. Комбінації з сполуками або солями винаходу включають NSAID, наприклад, ацетомінофен, напроксен натрій, ібупрофен, трамадол, аспірин, целекоксиб, вальдекоксиб і індометацин; і кортикостероїди, наприклад, преднізолон. Комбінації з сполуками або солями згідно з винаходом включають анальгетики, наприклад, ацетомінофен, напроксен натрій, ібупрофен, трамадол, аспірин, целекоксиб, вальдекоксиб, індометацин і інші NSAID; антизапальні ліки; сульфазалазин, мезаламін, бальсалазид і ольсалазин; кортикостероїд; преднізон; будесонід; імуносупресанти, наприклад, азатіоприн, меркаптопурин, блокери TNF, наприклад, інфліксимаб і адалімумаб, иетотрексат і циклоспорин; антибіотики, наприклад, метронідазол і ципрофлоксацин; антидіарейні ліки, наприклад, лоперамід; послабллюючі ліки; антихолінергічні ліки; антидепресанти, наприклад, трициклічні антидепресанти і селективні інгібітори повторного поглинання серотоніну, наприклад, такі антидепресанти, як амітриптилін, іміпрамін, нортриптилін, доксепін, флуоксетин, сертралін і пароксетин, алозетрон і тегасерод. Сполуки або солі згідно з винаходом можна також вводити з бета агоністами тривалої дії. 94639 26 Приклади інших терапевтичних агентів, які можуть бути використані у комбінації з сполуками або солями згідно з винаходом, включають інгібітори 5-ліпооксигенази (5-LO) і або антагоністи протеїну, що активує 5-ліпоксигеназу (FLAP), антагоністи лейкотрієну (LTRAs), включаючи антагоністи LTB4, LTC4, LTD4 i LTE4, антагоністи рецептора гістаміну, включаючи антагоністи Н1 і H3, 1- i 2адреноцепторного агоніста вазокрнстрикторних симпатоміметичних агентів протизастійної дії, антагоністи рецептора мускаринової M3 або антихолінергічні агенти, інгібітори PDE, наприклад, інгібітори PDE3, PDE4 і PDE5, теофілін, натрій кромоглікат, інгібітори СОХ, неселективні і селективні інгібітори СОХ-1 або СОХ-2 (NSAID), пероральні і інгаляційні глюкокортикостероїди, моноклональні антитіла, активні проти ендогенних запальних збудників, агоністи 2, включаючи агоністи 2 тривалої дії, інгібітори адгезійної молекули, включаючи антагоністи VLA-4, антагоністи рецептора Κinin-Β1- i Β2-, імуносупресанти, інгібітори матричної металопротеази (ММР), антагоністи рецептора тахикініну ΝΚ1, ΝΚ2 i ΝΚ3, інгібітори еластази, агоністи рецептора аденозину А2а, інгібітори урокінази, сполуки, що діють на рецептори допаміну наприклад, агоністи D2, модулятори шляхів NFB, наприклад, інгібітори ІKK, модулятори сигнальних шляхів цитокіну, наприклад, кіназу syk або інгібітори кінази JAK, агенти, що можуть бути класифіковані як муколітики або протикашлеві ліки, і антибіотики. Згідно з винаходом, сполуки або їх солі можуть бути комбіновані з антагоністами H3, антагоністами рецептора мускаринової M3, інгібіторами PDE4, глюкокортикостероі-дами, агоністами рецептора аденозину А2а, агоністами 2, модуляторами шляхів NFB, наприклад, кіназою syk, або антагоністами лейкотрієну (LTRA), включаючи антагоністи LTB4, LTC4, LTD4 і LТЕ4. Сполуки або солі згідно з винаходом можуть також бути комбіновані з глюкокортикостероїдами, наприклад, інгаляційними глюкокортикостероїдами з зниженими системними побічними явищами, включаючи преднізон, преднізолон, флунісрлід, тріамцинолон ацетонід, беклометазон дипропіонат, будесонід, флютиказон пропіонат, циклесонід, мометазон фурорат і мометазон фуроат моногідрат, антагоністами рецептора мускаринової M3 або антихолінергічними агентами, включаючи, зокрема, солі іпратропію, наприклад, бромід іпратропію, солі тіотропію, наприклад, бромід тіотропію, солі окситропію, наприклад, бромід окситропію, перензепін і телензепін або агоністи 2, наприклад, агоністи 2 тривалої дії, включаючи сальметерол, формотерол, QAB-149 і CHF-4226. F. Використання у приготуваннях композицій або медикаментів В одному з втілень винахід включає способи приготування композицій або медикаментів, що містять сполуки або солі згідно з винаходом, призначених для лікування стану, опосередкованого активністю рецептора глюкокортикоїду. В іншому втіленні винах включає використання одної або більше сполук або солей згідно з винаходом у приготуванні композицій або медикамен 27 94639 28 тів проти запалення, пов'язаних з запаленням станів, ревматоїдного артриту, дерматиту, хвороби Альцгеймера. Винахід також включає використання одної або більше сполук або солей згідно з винаходом для приготування композицій або медикаментів для лікування одного або більше станів, описаних у розділі Способи. G. Схеми Сполуки винаходу можуть бути приготовлені з використанням способів, ілюстрованих загальними схемами синтезу і експериментальними процедурами, описаними нижче. Реакції синтезу проводять у відповідних розчинниках, які можуть бути вибрані фахівцем і можуть бути взагалі будьякими розчинниками, які не реагують з вихідними матеріалами (реагентами), інтермедіатами або продуктами при температурах реакції. Реакцію можна проводити в одному розчиннику або суміші декількох розчинників. Залежно від конкретної стадії реакції вибирають належний розчинник. Приготування сполуки винаходу може включати захист і позбавлення захисту різних хімічних груп. Необхідність захисту і позбавлення захисту і вибір належних захисних груп може визначити фахівець (див., наприклад, Τ.W. Greene, P.G.M. Wuts, Protective Groups in Organic Synthesis, 3rd. Ed., Wiley & Sons, Inc., New York (1999)). Реакцію можна контролювати за будь-якою відомою процедурою. Наприклад, за утворенням продукту можна стежити засобами спектроскопи, 1 13 наприклад, ЯМР ( Н або С), ІЧ спектроскопи, спектрофотометрії (наприклад, УФ - відиме світло) або мас-спектрометрією, або хроматографією, наприклад, рідинною хроматографією високої ефективності (РХВЕ) або ТШ (тонкошаровою) хроматографією. Вихідні матеріали, що використовуються тут, є комерційно доступними або можуть бути приготовлені стандартними способами синтезу. Наведені нижче загальні схеми синтезу є ілюстративними і не обмежують винаходу. (4,7R,8R)-4-бензил-7-гідрокси-N-(2метилпіридин-3-іл)-7-(трифлуорметил) 4b,5,6,7,8,8,9,10-октагідрофенантрен-2карбоксамід приготовляють за Схемою В. 1(R)-бензил-5-бром-9(S)-гідро-10(R)-гідрокси2,7 10(R)-метил-трицикло[7,3,1,0 ]-тридека-2,4,6трієн-13-он формули А-8 приготовляють за протоколом Схеми А, описаним взагалі у WO 00/66522. Ph означає феніл. Вn - бензил. Сполук А-1 може бути придбана (наприклад, VOUS and Riverside; CAS No. 4133-35-1). Сполука А-2 може бути приготовлена згідно з Org. Syn. 1971, 51, 109-112. 29 94639 30 (2R,4S10R)-4-бензил-7-((2-метилпіридин3-iл)карбамоїл)-2-(трифлуорметил)1,2,3,4,4,9,10,10-октагідрофенантрен-2-іл дигід роген фосфат з С-3 приготовляють за Схемою С. Bn - бензил. (2R,4S,10R)-4-бензил-7-((2-метилпіридин3-іл)карбамоїл)-2-(трифлуорметил)1,2,3,4,4,9,10,10-октагідрофенантрен-2-іл дигід роген фосфат з С-3 приготовляють за Схемою D. Bn - бензил, Ph - феніл. 31 (2R,4S,10R)-4-бензил-7-((2-метилпіридин3-іл)карбамоїл)-2-(трифлуорметил)1,2,3,4,4,9,10,10-октагідрофенантрен-2-іл дигідроген фосфат з С-3 приготовляють за Схемою Е. Bn - бензил, Ph - феніл. Η. Приготування і приклади Вихідним матеріалом А-8 є 1(R)-бензил-5бром-9(S)-гідро-10(R)-гідрокси-10(R)-метил2,7 трицикло[7,3,1,0 ]тридека-2,4,6-трієн-13-он формули 94639 32 мом. Додають 21%-й етоксид натрію в етанолі (1,31 л; 3,51 моль) при температурі -5°С - 5°С. Якщо суміш не є основною, додають ще етоксиду натрію. Температуру суміші підвищують до 25°С і потім розріджують водою (5,9 л). Суміш фільтрують і тверду речовину промивають водою (3 X). Названу сполуку (440 г; 85% ) отримують як беже1 ву тверду речовину. Н ЯМР (ДМСО) 1/млн: 1,27 (t, 3H), 1,65 (dt, 1Н), 2,06 (d, 1Н), 2,21 (dd, 1Н), 2,49 (m, 1Н), 2,65 (m, 2Н), 2,89 (m, 2Н), 3,85 (q, 2Н), 5,45 (m, 2Н), 6,44 (d, 2Н), 6,98 (t, 2Н), 7,06 (m, 2Н), 7,25 (d, 1H), 7,33 (dd, 1H). Приготування 2: (S)-4-бензил-7-бром-2,2-(1,2етилендіокси)-1,2,3,4,4,9-гексагідрофенантрен Приготування 1: (S)-4-бензил-7-бром-2етокси-3,4,4,9-тетрагідро-фенантрен Вихідний матеріал А-8 (450 г; 1,17 моль) розчиняють в етанолі (4,5 л) при зовнішній температурі. Додають 21%-й етоксид натрію в етанолі (44 мл; 0,12 моль) і суміш нагрівають до флегми 3 год. Після поглинання вихідного матеріалу А-8 реакційну суміш охолоджують до -25°С. Повільно додають ацетилхлорид (250 мл; 3,51 моль) при температурі приблизно -25°С. Після завершення додання суміш доводять до 0°С і витримують до поглинання інтермедіату енону. Суміш стає шла (S)-4-бензил-7-бром-2-етокси-3,4,4,9тетрагідрофенантрен (1270 г, 3,2 моль, 85% (об’ємн.)), Приготовлений, як у Приготуванні 1), розчиняють у толуолі (6,45 л). Додають етиленгліколь (898 мл, 16,1 моль) і р-толуолсульфонову кислоту (6,1 г, 0,03 моль) і реакцію нагрівають до флегми. Розчинник (1 л) дистилюють з суміші і заміщують свіжим толуолом (1 л). Цей процес повторюють двічі. Додають ще р-толуолсульфонової кислоти (6,1 г) кожного разу, коли додають свіжий толуол. Під час реакції утворюють два інтермедіати (виявлені РХ), які як субстрати перетворюються у продукт. Кінцевою стадією реакцією є стадія рівноваги між двома інтермедіатами і продуктом. Після досягнення цієї стадії суміш охолоджують до зовнішньої температури, потім промивають 0,5М NaOH (2 л). Фази швидко розділяють (обидві є темними з невеликим червоним шаром. Суміш промивають водою (2 л), фази дуже повільно розділяють. Суміш сушать азеотропічною дистиляці 33 єю. Додають метанол (4 л) і розчинник (4 л) дистилюють з суміші. Додання метанолу і дистиляцію розчинника повторюють ще двічі. Додають метанол і після утворення осаду додають ще метанолу (4 л) і потiм додводять до флегми. Через 30 хвил. Суміш охолоджують до 0°С, фільтрують і тверду речовину промивають холодним метанолом (2X2 л), потім сушать у вакуумній печі при 65°С. Названу сполуку (882 г, 98% (об’ємн.)) отримують як 1 бежеву тверду речовину. Н ЯМР (ДМСО) 1/млн: 1,71 (m, 2Н), 2,06 (m, 2Н), 2,31 (dd, 1Н), 2 39 (m, 1Н), 2,68 (d, 1H), 2,77 (m, 1Н) 2,86 (dd, 1Н), 3,36 (d, 1Н), 3,86 (m, 4Н), 5,45 (m, 1Н), 6,50 (m, 2Н), 7,00 (m, 4Н), 7,37 (dd, 1H), 7,44 (d, 1H). Приготування 3: (S)-метил 4-бензил-7,7-(1,2етилендіокси)-4,5,6,7,8,10-гексагідрофенантрен2-карбоксилат (S)-4-бензил-7-бром-2,2-(1,2-етилендіокси)1,2,3,4,4,9-гексагідрофенантрен (719 г; 1,75 моль, приготовлений, як у Приготуванні 2), розчиняють у ТГФ (7,19 л) і охолоджують до -70°С. Додають 1,6М n-бутиллітій у гексані (2270 мл; 2,27 моль), підтримуючи температуру нижче -60°С. Суміш витримують 15 хвил. після додання. Додають діоксид карбону (108 г; 2,45 моль) при температурі нижче 60°С. Суміш витримують ще 15 хвил., потім нагрівають до зовнішньої температури. Розчинник (7 л) дистилюють з суміші при атмосферному тиску. Додають ДМФ (7 л), суміш охолоджують до зовнішньої температури, додають метилйодид (152 мл; 2,45 моль) і суміш витримують до завершення реакції (прибл. 1 год.). Суміш нагрівають до 70°С і розчинник дистилюють, поступово знижуючи тиск до 70 мм Hg. Після цього суміш охолоджують до кімнатної температури. Повільно додають воду (6,5 л) до осадження продукту. Суміш фільтрують і тверду речовину промивають водою (3 X), потім сушать на фільтрі. Сирий продукт (736 г; 74% (об’ємн.)) отримують бежеву тверду речовину, яку потім очищають хроматографією, отримуючи 463 г продукту. Цей матеріал ізолюють з n-гептану (6130 мл), і отримують 394 г названої сполуки. Інші 70 г названої сполуки отримують з материнського роз1 чину хроматографією. Н ЯМР (ДМСО) 1/млн: 1,74 (m, 2Н), 2,10 (m, 2Н), 2,33 (dd, 1H), 2,45 (m, 1Н), 2,72 (d, 1Н), 2,79 (m, 1Н), 2,94 (dd, 1Н), 3,40 (d, 1Н), 3,87 (m, 7Н), 5,49 (m, 1Н), 6,47 (m, 2Н), 6,93 (m, 2Н), 7,01 (m, 1Н), 7,42 (d, 1H), 7,64 (d, 1H), 7,79 (dd, 1H). Приготування 4: (4s,8r)-метил 4-бензил7,7-(1,2-етилендіокси)-4,5,6,7,8,8,9,10октагідрофенантрен-2-карбоксилат 94639 34 (S)-метил 4-бензил-7,7-(1,2-етилендіокси)4,5,6,7,8,10-гексагідрофенантрен-2-карбоксилат (201 г; 0,515 моль, який може бути приготовлений, як у Приготуванні 3) і 50 мл етиленгліколю розчиняють у толуолі (2,0 л) в автоклаві і додають 10 г 5% Pd/C (сухий каталізатор). Автоклав герметизують і очищають нітрогеном (три цикли) і потім гідрогеном (три цикли). Реакцію проводіть протягом 18 год. при тиску 80 фунт/кв. дюйм (5,6 ат) і температурі 50°С. Проводять аналіз РХВЕ на завершення і селективність (типова селективність - 95:5, Транс:Цис). Суспензію фільтрують через Celite для видалення каталізатор і толуольний розчин концентрують при 50°С у вакуумі до приблизно 200 мл. При 50°С, додають 1 л 1-бутанолу і розчин нагрівають до 60°С до прозорості. Після охолодження отриману тверду названу сполуку ізолюють вакуумною фільтрацією (196 г; 97%; 1 Транс:Цис=95,75:4,24). Н ЯМР (300 МГц, CDCI3) 1/млн: 7,79 (bs, 1Н, Ar-Н), 7,47 (d, J=9 Гц, 1Н, Ar-Н), 7,13-7,05 (cm, 3H, Ar-H), 6,56-6,53 (cm, 2H, Ar-H), 6,43 (d, J=9 Гц, 1H, Ar-H), 4,04-3,93 (cm, 4H, 2-CH2), 3,89 (s, 3H, CH3),3,08-3,03 (cm, 3H, CH2, CH-H), 2,63 (d, J=15 Гц, CH-H), 2,22-1,72 (cm, 8H, 4-CH2), 13 1,57 (cm, 1H, CH-H).; СЯМР (CDCI3, ): 167,7, 149,2, 137,7, 136,4, 131,1, 130,5, 127,8, 127,7, 127,4, 126,3, 125,5, 108,9, 64,6, 64,5, 52,1, 40,5, 39,8, 38,3, 35,8, 31,6, 30,3, 27,9, 24,6. Приготування 5: (4S,8R)-метил 4-бензил-7оксо-4,5,6,7,8,8,9,10-октагідрофенантрен-2карбоксилат (4S,8R)-метил 4-бензил-7,7-(1,2етилендіокси)-4,5,6,7,8,8,9,10-октагідрофенантрен-2-карбоксилат (150 г, 382 ммоль), який може бути приготовлений, як у Приготуванні 4, розчиняють у ДХМ (630 мл). Додають воду (270 мл) з перемішуванням, потім трифлуороцтову кислоту (73 мл. 1150 ммоль) крапельною воронкою протягом 30 хвил., при внутрішній температурі 35 нижче 30°С. Після цього реакцію нагрівають при 40°С 2 год. Шари розділяють і додають свіжу воду (270 мл) і трифлуороцтову кислоту (31 мл). Реакційну суміш нагрівають при 40°С 1 год. Процес продовжують до повного поглинання вихідного матеріалу. Органічну фазу промивають 5%-м водним бікарбонатом натрію (300 мл), водою (300 мл) і сушать над MgSO4 і концентрують до сухості, отримуючи 126,4 г названої сполуки (95%-й вихід). 1 Н ЯМР (ДМСО) 1/млн: 7,70 (s, 1H), 7,37 (d, J=8,4 Гц, 1Н), 7,11 (m, 3H), 6,6 (d, J=5,70 Гц, 2Н), 6,45 (d, J=8,4 Гц, 1Н), 3,80 (s, 3H), 3,80 (m, 2H), 3,04-1,48 (m, 11H). Приготування 6: (4S,7R,8R)-метил 4бензил-7-гідрокси-7-(трифлуор-метил)4,5,6,7,8,8,9,10-октагідрофенантрен-2карбоксилат (4S,8R)-метил 4-бензил-7-оксо4,5,6,7,8,8,9,10-октагідрофенантрен-2карбоксилат (118 г, 0,339 моль), який може бути приготовлений, як у Приготуванні 5, розчиняють у ДХМ і охолоджують до -50°С. Розчин стає мутним. Додають 1,0М розчин флуориду тетрабутиламонію у ТГФ (3,4 мл, 0,003 моль) без зміни температури. Додають трифлуортриметилсилан (79 мл, 0,51 моль) протягом 20 хвил. Колір змінюєтья з яскраво оранжевого на світлочервоний. Реакційну суміш витримують при -50°С приблизно 2 год. і залишають нагрітись до 0°С. Повільно додають флуорид тетрабутиламонію (340 мл, 0,34 моль) при 0°С протягом 45 хвил. Спостерігається екзотермія з відділенням газу. Реакційну суміш перемішують 10 хвил. і ΡΧΒΕ показує повну десилікацію. Додають воду (1 л) з енергійним перемішуванням і залишають нагрітись до кімнатної температури. Органічний шар промивають водою (1 л), потім концентрують і хроматографують, отримуючи 72 г, 51% названої сполуки, з додатковими 32 г нечистого 1 продукту. Н ЯМР (ДМСО) 1/млн 7,70 (s, 1Н), 7,37 (d, J=8,1 Гц, 1Н), 7,09 (m, 3H), 6,5 (dd, J=1,2, 6,6 Гц, 2H), 6,38 (d, J=8,4 Гц, 1H), 3,80 (s, 3H), 3,80 (m, 2H), 3,09-1,21 (m, 13H). Приготування 7: (4S,7R,8R)-метил 4бензил-7-(біс(бензилокси)-фосфорилокси)-7(трифлуорметил)-4,5,6,7,8,8,9,10октагідрофенантрен-2-карбоксилат 94639 36 (4S,7R,8R)-метил 4-бензил-7-гідрокси-7(трифлуорметил)-4,5,6,7,8,8,9,10октагідрофенантрен-2-карбоксилат (5,0 г, 11,9 ммоль), який може бути приготовлений, як у Приготуванні 6, і 5-метилтетразол (3,6 г, 43,0 ммоль) перемішують у ДХМ (50 мл) при зовнішній температурі. Додають дибензилфосфорамідит (8,3 мл, 25,1 ммоль) і суміш перемішують до завершення реакції (1 год). Суміш охолоджують до 0°С і додають 30%-й гідрогенпероксид (10 мл). Реакцію перемішують до завершення окислення (30 хвил.). Водну фазу відділяють від органічної фази. Органічну фазу промивають 10%-м метабісульфітом натрію (50 мл), потім сушать безводним сульфатом магнію і концентрують. Сирий продукт очищають силікагелевою хроматографією 15% етилацетату у гексанах. Очищену названу сполуку (8,41 г, 94%-й вихід) отримують як безбарвне масло з 6% 1 етилацетату (за масою). Н ЯМР (ДМСО): 1,31 (t, 1Н), 1,63-1,92 (m, 3H), 2,05-2,35 (m, 3H), 2,63 (d, 1H), 2,75-3,16 (m, 4H), 3,80 (s, 3H), 5,13 (m, 4H), 6,43 (d, 1H), 6,49 (m, 2H), 7,04-7,17 (m, 3H), 7,337,42 (m, 12Н), 7,71 (d, 1H). Приготування 8: дибензил (2R,4S,10R)-4бензил-7-((2-метилпіридин-3-іл)карбамоїл)-2(трифлуорметил)-1,2,3,4,4,9,10,10октагідрофенантрен-2-ілфосфат (4S,7R,8R)-метил 4-бензил-7(біс(бензилокси)фосфорилокси)-7-(трифлуорметил)-4,5,6,7,8,8,9,10-октагідрофенантрен-2карбоксилат (7,9 г; 11,6 ммоль, який може бути приготовлений, як у Приготуванні 7), і 3-аміно-2піколін (1,3 г; 12,2 ммоль) змішують у ТГФ (80 мл) і охолоджують до 0°С. Додають 1М розчин літійбіс(триметилсиліл)амід у ТГФ (24 мл; 24,4 ммоль) при температурі нижче 10°С. Суміш перемішують 30 хвил., потім додають воду (50 мл). Суміш екстагують етилацетатом, органічний екстракт промивають водою, органічну фазу сушать з безводним сульфатом магнію і концентрують. Сирий продукт очищають силікагелевою хроматографією з 70% 37 94639 38 етилацетату у гексанах. Очищену названу сполуку (6,79 г; 68%-ний вихід) отримують як жовту гуму з 1 6% етилацетату (за масою). Н ЯМР (ДМСО): 1,33 (t, 1H), 1,66-1,93 (m, 3H), 2,08-2,34 (m, 3H), 2,41 (s, 3H), 2,68 (d, 1H), 2,76-3,19 (m, 4H), 5,14 (m, 4H), 6,47 (d, 1Н), 6,56 (m, 2Н), 7,07-7,19 (m, 3H), 7,20-7,53 (m, 12Н), 7,71 (d, 1H), 7,76 (s, 1H), 8,32 (d, 1Н), 9,93 (s, 1H). Приклад 1: (4S,7R,8R)-4-бензил-7-гідроксиN-(2-метилпіридин-3-іл)-7-(трифлуорметил)4,5,6,7,8,8,9,10-октагідрофенантрен-2карбоксамід (4S,7R,8R)-метил 4-бензил-7-гідрокси-7(трифлуорметил)-4,5,6,7,8,8,9,10октагідрофенантрен-2-карбоксилат (10 г; 23,9 ммоль, який може бути приготовлений, як у Приготуванні 6), і 3-аміно-2-піколін (2,71 г; 25,1 ммоль) розчиняють у толуолі (200 мл). Додають 1М літій біс(триметилсиліл)амід у ТГФ (74 1 мл, 74,1 ммоль), підтримуючи температуру нижче 35°С. Спостерігається невелика екзотермія, і тверда речовин осаджується під час додання. Суміш витримують 30 хвил. після додання. Додають воду (250 мл). Є невелика екзотермія, і тверда речовина розчиняється. Додають етилацетат (50 мл) для відвернення осадження продукту. Перемішування припиняють, щоб дозволити фазам розділитись. Водну фазу видаляють. Органічну фазу промивають водою (250 мл). Розчинник (230 мл) дистилюють при атмосферному тиску з органічної фази. Суміш охолоджують до зовнішньої температури, потім фільтрують і тверду речовину промивають толуолом (двічі), потім гептаном (двічі). Тверду речовину сушать у вакуумній печі при 70°С. Названу сполуку (10 г) отримують як бежеву тверду 1 речовину. Н ЯМР (ДМСО) 1/млн 1,32 (m, 1Н), 1,82 (m, 4Н), 2,10 (m, 4Н), 2,41 (s, 3H), 2,68 (d, 1H), 3,08 (m, 3H), 6,00 (s, 1Н), 6,43 (d, 1Н), 6,59 (m, 2Н), 7,12 (m, 3H), 7,25 (dd, 1H), 7,44 (dd, 1H), 7,71 (dd, 1H), 7,75 (d, 1H), 8,31 (dd, 1H), 9,91 (s, 1H). Приклад 2: (2R,4S,10R)-4-бензил-7-((2метилпіридин-3-іл)карбамоїл)-2-(трифлуорметил)1,2,3,4,4,9,10,10-октагідрофенантрен-2-іл дигідрогенфосфат Дибензил (2R,4S,10R)-4-бензил-7-((2метилпіридин-3-іл)карбамоіл)-2-(трифлуорметил)1,2,3,4,4,9,10,10-октагідрофенантрен-2ілфосфат (6 г, 7,9 ммоль, може бути приготовлений, як у Приготуванні 8), розчиняють у метанолі (120 мл) Додають 5% паладій на карбоні (63% у воді) (1,3 г, 0,4 ммоль). Суміш обробляють гідрогеном (50 фунт/кв. дюйм (3,5 ат)) при кімнатній температурі. Реакція припиняється з залишком 12% монобензильного інтермедіату. Суміш фільтрують через подушку Celite. Додають свіжий каталізатор (1,3 г) і знову гідрогенують. Після завершення реакції суміш фільтрують через подушку Celite. Розчин концентрують до приблизно 60 мл дистиляцією без використання роторного випарника. Під час дистиляції осаджується біла тверда речовина. Суміш охолоджують до зовнішньої температури, потім фільтрують і тверду речовину промивають метанолом, після чого сушать у вакуумній печі при 70°С. Бажану сполуку (3,36 г, 75%-ний вихід) отримують як білу тверду речовину чистотою (РХ) 1 98% (об’ємн.). Н ЯМР (ДМСО) 1,33 (t, 1Н), 1,691,98 (m, 3H), 2,07-2,29 (m, 3H), 2 42 (s, 3H), 2,612,80 (m, 2Н), 2,93-3,19 (m, 3H), 3,30 (d, 1H), 6,50 (d, 1H), 6,64 (m, 2H), 7,08-7,20 (m, 3H), 7,29 (dd, 1H), 7,48 (dd, 1H), 7,75 (dd, 2H), 8,33 (dd, 1H), 9,96 (s, 1H). І. Біологічні дані У подальшому описі компараторами є трициклічні сполуки (див. WO 2000/66522). Сполуки прикладу і компараторів приготовлено у Pfizer. Преднізолон використовується як клінічний компаратор (Р-6004; Sigma-Aldrich, St. Louis). Компаратором А є (4S,7S,8R)-4-бензил-7гідрокси-N-((2-метилпіридин-3-іл)метил)-7-(3,3,3трифлуорпропіл)-4,5,6,7,8,8,9,10октагідрофенантрен-2-карбоксамід формули Компаратором В є (4S,7R,8R)-4-бензил-N(3,5-диметилріразин-2-іл)-7-гідрокси-7(трифлуорметил)-4,5,6,7,8,8,9,10октагідрофенантрен-2-карбоксамід формули 39 94639 40 Компаратором G є Компаратором С є (4S,7R,8R)-4-бензил-7гідрокси-N-(2-метилпіридин-3-іл)-7-(3,3,3трифлуорпропіл)-4,5,6,7,8,8,9,10октагідрофенантрен-2-карбоксамід формули Компаратором Η є (4S,7R,8R)-4-бензил-7(дифлуорметил)-7-гідрокси-N-(2-метилпіридин-3іл)-4,5,6,7,8,8,9,10-октагідрофенантрен-2карбоксамід формули Компаратором D є (4S,7R,8R)-4-бензил-7гідрокси-N-(4-метилпіридин-3-іл)-7(трифлуорметил)-4,5,6,7,8,8,9,10октагідрофенантрен-2-карбоксамід формули Компаратором І є (4S,7R,8R)-4-бензил-7гідрокси-N-(2-метилпіридин-3-іл)-7(трифлуорметил)-4,5,6,7,8,8гексагідрофенантрен-2-карбоксамід формули Компаратором Ε є (4S,7R,8R)-4-бензил-7гідрокси-N-(2-метилпіридин-3-іл)-10-оксо-7(трифлуорметил)-4,5,6,7,8,8,9,10октагідрофенантрен-2-карбоксамід формули Компаратором F є (4S,7R,8R,10R)-4бензил-7,10-дигідрокси-N-(2-метилпіридин-3-іл)-7(трифлуорметил)-4,5,6,7,8,8,9,10октагідрофенантрен-2-карбоксамід формули Компаратором J є (4S,7R,8R)-4-бензил-N(2,4-диметилпіримідин-5-іл)-7-гідрокси-7-(3,3,3трифлуорпропіл)-4,5,6,7,8,8,9,10октагідрофенантрен-2-карбоксамід формули Компаратором K є (2R,4S,10R)-4-бензил-7((2-метилпіридин-3-іл)карбамоіл)-2(трифлуорметил)-1,2,3,4,4,9,10,10 октагідрофенантрен-2-іл ізобутил карбонат формули 41 94639 42 Приклад 2 не перетинає суттєво клітинний мо-6 ношар Сасо-2 (АВ, Рарр=1,15е см/с), але застосування Прикладу 2 до апікальної частини призводить до значного збільшення Прикладу 1 як у апікальній, так і базолатеральній частинах. Дані вказують механізм, що включає дефосфорилізацію Прикладу 2у Приклад 1 через пов'язані з мембраною лужні фосфатази, локалізовані у кишковому епітелії, з подальшою абсорбцією Прикладу 1 через клітинний моношар Сасо-2 (АВ, -6 Рарр=37,5е см/с). Пероральна доза Прикладу 2 (30 і 200 мг/кг) через канюлю у портальній вені щурів дозволяє виявити Приклад 1, але не Приклад 2 у зразку плазми з портальної вени протягом 4 год. Ці результати вказують на наявність кишкового раннього гідролізу. Прикладу 2 з утворенням Прикладу 1 і селективну кишкову абсорбцію Прикладу 1. Приклад 2 демонструє підвищену розчинність і внутрішнє розкладання що поліпшує профіль пероральної абсорбції у щурів через підвищену експрозицію (1,61 мкг·год/мл [порівняно з 0,46 мкг·год/мл для Прикладу 1]) і Cmax (0,59 мкг/мл [порівняно з 0,13 мкг/мл для Прикладу 1]), а також зменшення часу до Cmax (0,8 год. [порівняно з 1,5 год. для Прикладу 1]) у собак. Біозасвоюванють Прикладу 2 поліпшується порівняно з Прикладом 1 у щурів (F=59% для Прикладу 2, F=17% для Прикладу 1). Перетворення Прикладу 2 у Приклад 1 Клітинний моношар Сасо-2 є in vitro тканинною моделлю культури кишкового епітелію. Ці клітини походять з товстої кишки людини і стають поляризованими, повністю диференційованими через 2-3 тижні. Після диференціації ці клітини мають тісні зв'язки і експресують різні біохімічні процеси, наприклад, активний витік транспортерів, включаючи Р-глікопротеїн (Рарр). У цій моделі можна визначити істинну проникність (Рарр) сполуки через поляризований клітинний моношар Сасо-2. Аналіз АВ проводять з клітиними моношарами Сасо-2 для визачення Рарр сполуки з камер А у камеру В. Ця Рарр репрезентує транспортування сполуки з порожнини (кишечник) у сироватку (крові) через кишковий епітелій, яке має місце при кишковій абсорбції. Дані in vitro Назва Приклад 1 (сіль HCL) Приклад 1 (вільна основа) Приклад 2 Компаратор А Компаратор В Компаратор С Компаратор D Компаратор Ε Компаратор F Компаратор G Компаратор Η Компаратор І Компаратор J Компаратор K Преднізолон а GRFP ІК50 (нМ) 1,31 79,0 (42) 7,10 0,35 1,22 2,06 1,18 1,9 2,13 8,03 9,12 4,58 895 0,526 а IL-6: ІК50 (нМ) ,400 ,360 а 60 (17) >36,4 4 1,1 1,3 1,1 7 2,1 4,3 2,8 291 4,2 (4,6) а IL-6: пригнічення (%) 76,9 86,1 а 60,2 (80) 59,9 75,8 82,6 79,8 79,7 83,3 80,1 64,9 67,5 55 102 (100) а TNF: ІК50 (нМ) а 92,1 (28,8) TNF: пригнічення (%) а 77,1 (62) >1000 35 14,9 (15,6) а 100 додаткові результати GRFP: Зв'язування рецептора глюкокортикоїду Аналіз на зв'язування ліганда флюоресцентної поляризації рецептора глюкокортикоїду використовували для оцінювання прямого зв'язування випробуваних сполук з пов-нодовжинним глюкокортикоїдним (GR) протеїном. Реагенти для цього аналізу були придбані від Invitrogen як тестувальний комплект. Флюоресуентний мчений ліганд GR використовували як флюоресцентний індикатор і випробувані сполуки конкурували з цим індикато ром у зв'язуванні GR. Зміна значення поляризації у присутності випробуваної сполуки зумовлюється зв'язуванням цих сполук з GR і використовується для визначення ІКС50 і відносної спорідненості випробуваних сполук до GR. ІК50 і пригнічення (%) IL-6 Легеневі епітеліальні клітини А549 (American Type Культур Collection, Rockville, MD) були культуровані у середовищі Kaighn's F-12K з пеніцилінострептоміцином (10 од/мл) і 10% деактивованої 43 теплом сироваткою бичачого зародка (від Invitrogen, Grand Island, NY). Клітини А549 були внесені у 96-комірковий планшет з щільністю 30000 клітин/комірка і були інкубовані протягом ночі при 37°С з 5% СО2. Клітини були майже позбавлені сироватки заміщенням середовища росту середовищем без сироватки (Kaighn's F-12K) з пеніциліном-стрептоміцином (10 од/мл) і їх знову інкубували протягом ночі при 37°С з 5% СО2. На третій день середовищу було заміщене свіжим середовищем без сироватки і клітини були інкубовані з сполукою або без (носій - ДМСО з максимальною концентрацією 0,1%) протягом приблизно 1 год. і потім були стиульовані 1 нг/мл рекомбінантною людською IL-1 (R&D Systems, Minneapolis, MN) протягом 20 год. при 37°С з 5% СО2. Клітинні надосадові рідини збирали для визначення рівнів IL-6 з використанням MSD (Meso Scale Discovery, Gaithersburg, MD) і 96-коміркових планшетів Single Spot згідно з інструкціями виробника. Зчитування з планшетів проводили, використовуючи MSD Sector Imager 6000 Преднізолон (1 мкМ) використовували як максимальний інгібітор і для визначення 100%го контрольного пригнічення. Носій використовували як 0%-й контроль. Пригнічення (у %) для кожної концентрації сполуки відносно контролю обчислювали, використовуючи Excel (MiKposoft, Redmond, WA). Значення ІК50 отримували, використовуючи програму обробки даних GraFit 5,0 (Enthacus Software Ltd., Surrey, UK). ΙΚ50 і пригнічення (%) TNF Людські премоноцитні клітини U937 (American Type Культур Collection, Rockville, MD) були культуровані у RPMI 1640 з глютаміном (2 мМ), пеніцилін-стрептоміцином (10 од/мл) і 10% деактивованої теплом сироваткою бичачого зародка (від Invitrogen, Grand Island, NY). Клітини були диференційовані до моноцитно/макрофагового фенотипу форбол-12-міристан-13-ацетатом (SigmaAldnch, St Louis, МО), 20 нг/мл протягом ночі. Клітини потім центрифугували, середовище аспірували, клітини суспендували у такому ж об'ємі свіжого середовища RPMI 1640 з глютаміном і пеніцилін-стрептоміцином сироваткою бичачого зародка і інкубували 48 год. при 37°С з 5% СО2. Після цього клітини відбирали, рахували і вносили у планшет згідно з експериментальною процедурою і потім стимулювали LPS, як описано нижче. Клітини U937 диференціювали і вносили у 96комірковий планшет з щільністю 200000 клітин/комірка і інкубували з сполукою або без (носій - ДМСО з максимальною концентрацією 0,1%) протягом приблизно 1 год. і потім стисмулювали 100 нг/мл ліпополісахариду (LPS), Ε. coli серотип 0111:В4 (Sigma-Aldnch, St. Louis, МО) протягом 4 год. при 37°С з 5% СО2. Клітинні надосадові рідини збирали для визначення рівнів TNF, використвуючи ELISA. Мишачеантилюдське моноклональне антитіло TNF (клон 28401.111) і біотиніловане козяче антилюдське TNF (R&D Systems, Minneapolis, MN) використовували для захоплення і виявлення антитіл, відповідно. Стрептавідинову пероксидазу редьки (HRP) (R&D Systems, Minneapolis, MN) і K-Blue Substrate/Red Stop (Neogen, Lexington, KY) використовували як сис 94639 44 тему виявлення. Абсорбцію виміряли на 650 нм. Концентрації TNF інтерполювали від людського рекомбінантного протеїну TNF (R&D Systems, Minneapolis, MN) і отримували стандартну 4параметричну криву логістичної моделі за допомогою програми аналізу даних Magellan 4.11 (Tecan, Durham, NC). Преднізолон (1 мкМ) використовували як максимальний інгібітор і для визначення 100%-го контрольного пригнічення. Носій використовували як 0%-й контроль. Пригнічення (у %) для кожної концентрації сполуки відносно контролю обчислювали, використовуючи Excel (Microsoft, Redmond, WA). Значення ІК50 отримували, використовуючи програму обробки даних LabStats Fit Крив V4.R7.MO (Pfizer Sandwich Laboratories, UK and Tessella Support Services pic, Abingdon UK). Ex vivo цільна кров людини Цим аналізом порівнюється пригнічення продукування IL-1, IFNIL-6 і TNF у ех vivo стимульованої LPS цільної крові людини лігандами рецептора глюкокортикоїду (GR) (Компаратор А, Приклад 1, преднізолон). Венозну людську кров від донорів збирали як 10 мл аліквоти у пробірки з гепарином натрію (BD Vacutainer від Becton Dickinson and Company, Franklin Lakes, NY). Кров вносили у стерильні полістирольні круглодонні 96-коміркові планшети для тканинних культур (Corning Costar) по 100 мкл /комірка, виключаючи зовнішні комірки. Середовище (RPMI Medium1640 з L-глютаміном, Invitrogen Corporation, Carlsbad, CA) додавади до крові аліквотами 90 мкл до повного об'єму 190 мкл. Зовнішні комірки заповнювали середовищем (200 мкл). Кров вносили у зволожений при 37°С інкубатор з 5% СО2 поки приготовляли сполуки. Сполуки приготовляли з 10 мМ маточних розчинів у (ДМСО (Sigma-Aldnch). Сполуки розріджувли послідовно на 1/3 у ДМСО (тобто 5 мкд сполук + 10 мкл ДМСО), після чого розріджували кожне послідовне на 1/167 носійним розчином (2% ДМСО, 30% етанолу (AAPER Alcohol and Chemical Company) і 68% буферованого фосфатом розсолу (Dulbecco's Phosphate Бyфeped Saline без хлориду кальцію, без хлориду магнію, Invitrogen Corporation, Carlsbad CA). Сполуку або носій додавали до крові аліквотами 10 мкл у трьох екземплярах. Кінцева концентрація кожного преднізолону і Прикладу 1 в анадізі становила від 1000 нМ до 0,457 нМ. Концентрація компаратора А становила від 3000 нМ до 1,4 нМ. Кінцеві концентрації ДМСО і етанолу становили 0,1% і 1,5%. Зразки обережно розтирали двічі для змішування і заміщення в інкубаторі. Розчин LPS (Е соlі серотип 0111:В4, Sigma-Aldnch) аліквотами 100 мкг/мл у RPMI при 20°С розріджували на 1/50 у RPMI для отримання робочого маточного розчину. Після 60-хвилинноі інкубації 10 мкл приготовленого маточного розчину LPS додавали до крові до кінцевої концентрації 100 нг/мл, виключаючи комірки, призначені для негативного контролю. Зразки знову перетирали і планшети інкубували протягом 22 год. Після інкубації кров центрифугували при 1500g протягом 5 хвил. і плазму відбирали для заморожування при 20°С або аналізу на вивільнення цитокіну. 45 94639 Рівні протеїнів ΙL-1, IFN,IL-6 і TNF виміряли аналітичним комплектом Meso Scale (Meso Scale Discovery, Gaithersburg, MD). Реагенти доводили до кімнатної температури. Планшети Meso Scale блокували, розріджуючи 30 мкл людської плазми/сироватки розріджувач з обережним струшуванням протягом 60 хвил. при кімнатній температурі. Планшети промивали тричі промивним буфером (PBS, Invitrogen Corporation, з 0,05% Tween-20, Sigma-Aldrich). Калібратори для стандартних кривих приготовляли у людському аналітичному розліджувачі плазма/сироватка з послідовним розрідженням на 1/5 для отримання кінцевої концентрації від 50000 пкг/мл до 3,2 пкг/мл. Зразки і калібратори додавали по 20 мкл/комірка, потім інкубували при кімнатній температурі з обережним струшуванням 90 хвил. Планшети промивали тричі промивним буфером. Антитіла для виявлення розріджували людською плазмою/сироваткою як ан 46 титільним розріджувачем до 1 мкг/мл і додавали у планшет по 20 мкл/комірк. Планшети інкубували 60 хвил. і промивали. Read Buffer Τ (4x) розріджували (1:1) mqH2O до подвійної концентрації і додавали 150 мкл у кожну комірку. Планшет аналізували на SECTOR Imager 6000 (Meso Scale Discovery) і отримували сирі значення сигналів. Зразки IL-1, IFN,IL-6 і TNF перевіряли на відповідність калібраторам стандартних кривих. Індивідуальні значення порівнювали з позитивним і негативним контролями (оброблена носієм кров з LPS і без LPS, відповідно) для отримати % пригнічення. По три значення усереднювали для кожного донора. Значення для двох донорів усереднювали (лише один донор був використаний для IL1) і побудували графіки, як 4-параметричні криві, використовуючи GraFit 5.0.11. Середні значення пригнічення преднізолону Концентрація (нМ) 1000 333,3333 111,1111 37,03704 12,34568 4,115226 1,371742 0,457247 Пригнічення IFN (%) 99,95181 99,7687 94,99872 63,51763 25,733 5,164324 10,85844 4,925277 Пригнічення TNF (%) 93,85394 88,98186 62,38366 27,66996 12,86882 5,308603 6,613491 0,525846 Пригнічення IL-1 (%) 94,92022 92,93646 73,1561 37,74411 33,55115 20,98221 15,1055 9,64873 Пригнічення IL-6 (%) 62,08045 40,25956 11,68419 5,032463 -0,41737 -0,23188 -0,94069 2,220454 Середні значення пригнічення Прикладу 1 Концентрація (нМ) 1000 333,3333 111,1111 37,03704 12 34568 4,115226 1,371742 0,457247 Пригнічення ІFN (%) 78,72981 73,47381 60,63503 51,01941 26,70902 -3,18296 19,77643 16,92723 Пригнічення TNF (%) 38,06288 36,04024 27,35287 18,68644 9,415215 -1,31222 7,869405 8,956175 Пригнічення IL-1 (%) 53,51043 57,75726 39,67173 38,24203 21,54167 11,20262 22,38355 23,37486 Пригнічення IL-6 (%) 8,053268 2,1505 0,943985 -0,82783 -0,36893 -1,06692 3,32595 -1,36819 Середні значення пригнічення Компаратора A Концентрація (нМ) 3000 1000 333,3333 111,1111 37,03704 12,34568 4,115226 1,371742 Пригнічення IFN (%) 28,02163 16,52981 -6,31952 8,737671 -9,80677 0,016012 -1,69672 18,09167 Пригнічення TNF (%) -3,03631 -5,43701 -4,61436 -3,82374 -4,19291 0,030908 -0,86051 18,1316 Пригнічення IL-1 (%) 16,37219 14,96801 12,23526 8,59594 17,27236 22,84851 22,01534 31,97474 Пригнічення IL-6 (%) -1,97032 -0,88954 -2,8341 -3,49518 -3,52461 -1,12581 -4,3436 1,459164 47 94639 48 Дані in vivo Назва Приклад 1 вільна осн. Компаратор А Компаратор В Компаратор С Компаратор D Компаратор Ε Компаратор F Компаратор G Компаратор Η Компаратор І Компаратор J Преднізолон mСІА (доза ЕД50) 0,4 mСІА (доза ЕД80) 1,5 2,9 2,0 >10 >10 0,5 >10 0,6 26 >10 30 17,0 3,0 1,1 >20 >20 5,5 Пригнічення TNF (доза ЕД50) 0,46 60 1,64 0,27 1,47 0,14 2,11 2,90 0,23 0,73 0,09 0,90 Приклад 1 є потужною сполукою у моделях хвороб. Індукований колагеном артрит у мишей (mСІА) Індукований колагеном артрит у мишей використовують як хронічну, доклінічну модель ревматоїдного артриту, при якому відбувається розпухання суглобу і руйнування кістки після імунізації колагеном типу II. Було показано, що зниження частоти захворювання і її важкості є результатом модифікації хвороби 11 послаблення ознак і симптомів у клінічних умовах. У традиційній моделі mCIA, самці DBA/J миші були імунізовані 50 мкг колагену типу II (сСІІ) у повному ад'юванті Фройнда і потім через 21 день ще 50 мкг сСІІ у неповному ад'юванті Фронда. Лікування сполукою почали у день додання вранці і продовжували 56 днів. Ефективність лікування виміряли частотою виникнення хвороби (тобто кількістю мишей з будь-якими ознаками хвороби) і важкістю хвороби. Виміряння проводили двічі на тиждень. У терапевтичній моделі mCIA індукування частоти виникнення хвороби і її важкості синхронізували з стимуляцією LPS. Самці DBA/J миші були імунізовані 100 мкг бичачого колагену типу II (bСІІ) у день 0. Всі миші отримали інтраперитонеальну ін'єкцію 20 мкг LPS у день 28 і хворобу залишили розвиватись до дня 34. У день 34 всі миші мали хворобу (частота=100%) з середнім показником важкості 7. Дозування сполуки у терапевтичному режимі почали у день 34 продовжували до дня 49. Різні лікування порівнювали, виміряючи зниження частоти захворювання (тобто послаблення хвороби) і зниження розпухання лап з часом. Визначення показника важкості mCIA (mах 2/миша) Показник важкості 1 2 3 Визначення Будь-яке почервоніння або розпухання пальців або лап Значне розпухання або деформація усієї лапи Анкілоз суглобів Пригнічення TNF (доза ЕД80) 1,82 2,91 1,33 >20 1,18 5,67 3,33 0,72 5,45 0,79 2,10 Пригнічення Пригнічення остеокальцину остеокальцину (доза ЕД50) (доза ЕД80) 2,91 >10 37 2,39 >10 1,01 2,84 1,18 3,06 0,17 1,71 1,19 >10 1,12 7,27 0,51 1,46 5,20 >20 0,73 3,58 1,00 6,80 Приклад 1 дав показник важкості менше 2 для mCIA (ЕД80) і менше 1 для mCIA (ЕД50). Пригнічення TNF і остеокальцину (ОС) Сполуки зважували і суспендували у носи 0,5% метилцелюлози/0,025% tween 20 (SigmaAldnch, St Louis, MO). Суспензії гомогенізували, використовуючи тканиний гомогенізатор РТ-3100 для створення дуже тонкої суспензі і потім обробляли ультазвуком 10 хвил. у водяній ванні. Були приготовлені аліквоти кожної суспензі для денного дозування 0,2 мл/доза. Самиці миші Swiss Webster, віком 10-12 тижнів, 28-29 г, (Тасопю, Germantown, NY) були використані згідно з вимогами. Організації з захисту тварин і Комітету з використання, а також з вимогами ΝΙΗ стосовно поводження з лабораторними тваринами. Мишей акліматизували у тераріумі Pfizer протягом 3-7 днів перед використанням у дослідах. Преднізолон і сполуки вводили перорально через зонд протягом 28 днів. Кожна група містила 5-10 мишей. Для визначення режиму дозування був проведений пілотний експеримент для кількісного визначення фармакодинаміки при пригніченні TNF одиночною дозою ЕД80. Сполуки, що пригнічують TNF, були дозовані учетверо більшою кількістю, а сполуки, що не пригнічують TNF протягом >50% 24 год. дозували двічі на день. Вагу тіла виміряли у перший і останній день кожного експерименту. Зразки крові отримували після 3 тижнів дозування для аналізу сталої фармакокінетики (РK). Для оцінювання дії сполуки на індукований LPS TNF всі миші отримували інтраперитонеальну ін'єкцію LPS (Salmonella typhosa, L7895; Sigma-Aldrich, St. Louis,) через 2,5 год. після останньої дози у день 28. Мишей умертвляли через 90 хвил. післі введення LPS Зразки сироватки квантували на остеокальцин і TNF, використвуючи множинні аналізи (Linco Research, Inc, St. Charles, MO; Luminex 100, Austin, TX). Зразки розріджували (1:20) і аналіз проводили згідно з інструкціями виробника. Остеокальцинний стандарт отримували окремо (Biomedical Technologies Inc., Stoughton, MA). Мишей не годували 4 год. перед відбиранням сироватки для визначення рівнів TNF і остеокальцину. Для кожного експерименту 49 94639 викиди виявляли обчисленням стандартних відхилень середнього у групі. Якщо це значення перевищувало більше 2,5 стандартних відхилень, його видаляли з решти обчислень. Пригнічення (у %) обчислювали для кожної миші, використовуючи середні значення носія і преднізолонову контрольну групу (). Значення пригнічення (%) для кожної миші репрезентували 4параметричною логістичною моделлю, використовуючи середню дозу для кожної групи. Оскільки всі 4 параметри були оцінені і нижче плато не було зафіксоване при 0%, а верхнє не було зафіксоване при 100%, значення ЕД50 і ЕД80 були обчислені за формулою оберненої калібрації для значень 50%го або 80%-го пригнічення або активації. Значення ЕД50 і ЕД80 (мг/кг) відповідають 50%му або 80%-му результату, на певній кінцевій стадії. ЕД50 і ЕД80 отримували для різних кінцевих стадій, використовуючи 4-параметричну логістичну підгонку. Для сполук, що були тестовані багаторазово, ЕД50 і ЕД80 отримували 4-параметричною Приклад 1 (мг/кг) 39 88 96 Повне пригнічення клітин (%) 0,1 1 10 50 логістичною підгонкою комбінованих даних множинних експериментів. Для сполук, які не показали 80%-ї дії, ЕД80 визначали як >10 мг/кг або >20 мг/кг, залежно від того, яка доза була випробувана. Модель астми, викликаної домашніми пиловими кліщами Мишам вводили три дози Прикладу 1 (0,1, 1 і 10 мг/кг, перорально, букально і під'язично) або преднізолону (0,1, 1 і 10 мг/кг, перорально, букально і під'язично). Окремі групи тварин отримали відповідні носії і ніякого впливу проникнення запальних клітин, індукованого запальними клітинами BAL від кліщів, не спостерігалось. Приклад 1 послабив інфільтрацію клітин у рідину BAL залежно від дози. Оцінювання типів клітин у рідині BAL з використанням цитометрії у потоці показало значне зниження еозинофілів, нейтрофілів, лімфоцитів і Т-клітин. Преднізолон показав таке ж зниження інфільтрації клітин у рідину BAL при таких же дозах (дані не наведено). Пригнічення ео- Пригнічення ней- Пригнічення лімзинофілів (%) трофілів (%) фоцитів (%) 22 42 29 72 97 97 83 99 100 Дисоціативний індекс Дисоціативний індекс (DI) був обраний для кількісного оцінювання дисоціації сполук порівняно з преднізолоном через біомаркери антизапальної ефективності і побічних ефектів. Дисоціативні індекси обчислювали, використовуючи клінічні біомаркери, які можуть бути використані у ранньому клінічному розвитку. Остеокальцин сироватки і ідукований LPS TNF сироватки розглядались для клінічного прогнозування кісткоутворення і антизапальної ефективності, відповідно. Дисоціативний індекс базується на таких принципах: Пригнічення Тклітин (%) 34 94 97 1) Межі доз, потрібних для дисоціації між біомаркерами запалення і побічними ефектами визначаються формулою: DI=кінцева стадія побічного ефекту/антизапальна кінцева стадія. Наприклад: DI=ЕД50 пригнічення остеокальцину (ОС) (або EAUC50)/EД50 пригнічення TNF (або EAUC50). 2) DI сполуки можна оцінювати відносно спостереженої дії преднізолону, його клінічного компаратора. Коригований або нормалізований DI визначають як DI сполуки, поділений на DI преднізолону. Дисоціативний індекс (ЕД50 і ЕД80) Назва Приклад 1 (вільна основа) Компаратор А Компаратор В Компаратор С Компаратор D Компаратор Ε Компаратор F Компаратор G Компаратор Η Компаратор І Компаратор J Преднізолон OC/TNF (ЕД50) 6,33 0,62 1,46 3,74 0,80 1,21 0,56 0,39 2,22 7,12 8,11 1,11 OC/TNF (ЕД80) >5,49 >3,44 2,14 1,76 2,18 2,03 >3,67 4,53 3,24 Приклад 1, Компаратор І, Компаратор J мають DI>5 для OC/TNF (ЕД50). Приклад 1 і Компаратор J мають DI>4 для OC/TNF (ЕД80). 51 94639 52 Коригований дисоціативний індекс (ЕД50 І ЕД80), базований на преднізолоні Назва Приклад 1 (вільна основа) Компаратор А Компаратор В Компаратор С Компаратор D Компаратор Ε Компаратор F Компаратор G Компаратор Η Компаратор І Компаратор J OC/TNF (ЕД50) 5,70 0,56 1,32 3,37 0,73 1,09 0,50 0,35 2,00 6,41 7,31 Приклад 1, Компаратор І і Компаратор J коригували DI до >5 для OC/TNF (ЕД50). Приклад 1 коригував DI до >1,50 для OC/TNF (ЕД80). EAUC50 i EAUC80 Експозиція ліків, визначена як інтеграл концентрацій плазми у часі (AUC), була використана для фармакодинамічних порівнянь між преднізолоном і OC/TNF (ЕД80) >1,69 >1,06 0,66 0,54 0,67 0,63 >1,13 1,40 Прикладом 1. Внаслідок невеликого півжиття преднізолону і Прикладу 1 у миші, значення AUC(0-4 год.) становили більше 95% значень AUC(0-24 год.). Внаслідок обмеженого об'єму зразків крові мишей для фармакодинамічних порівнянь був використаний AUC(0-4 год.). Преднізолон (AUC 0-4 год.) (мкг*год/мл) EAUC50 EAUC80 0,81 0,95 TNF сироватки Остеокальцин сироватки 0,56 1,60 Швидкість утворення кортикальної кістки (BFR) 0,09 0,60 Частота хвороби (звичайна mCIA) 0,25 0,60 Важкість хвороби (терапевтична mCIA) 0,38 1,19 Дисоціативний індекс a 0,7 1,7 OC/TNF a 0,1 0,6 BFR/TNF b BFR/частота хвороби 0,4 1,0 b BFR/важкість хвороби 0,2 0,5 Коригований дисоціативний індекс a OC/TNF a BFR/TNFa b BFR/ частота хвороби b BFR/важкість хвороби Приклад 1 (AUC 0-4 год.) (мкг*год./мл) EAUC50 EAUC80 0,22 0,33 1,30 4,20 0,27 1,55 0,04 0,10 0,09 0,19 5,9 1,2 6,8 3,0 12,7 4,7 15,5 8,2 8,4 12,0 17,0 15,0 7,5 7,8 15,5 16,4 a Порівняння даних у мишах у тій же моделі. Порівняння даних для всіх мишей у різних моделях з використанням експозиції плазми для нормалізації. BFR - швидкість утворення кістки. b EAUC50 i EAUC80 (набір даних 2) Параметр Модель 28-денного повторення дози TNF сироватки Остеокальцин сироватки (ОС) Швидкість утворення кортикальної кістки (BFR) Частота хвороби (звичайна mCIA) Важкість хвороби (терапевтична mCIA) Частота хвороби (терапевтична mCIA) Кориговані дисоціативні індекси (DI) ОС/TNF BFR/TNF BFR/частота хвороби BFR/важкість хвороби Приклад 1 EAUC50 EAUC80 0,22 0,33 1,31 4,15 0,35 1,76 0,10 0,09 0,19 0,12 0,33 EAUC50 EAUC80 8,6 7,4 16,0 7,6 14,5 10,6 13,0 15,5 Преднізолон EAUC50 EAUC80 0,82 0,95 0,56 1,64 0,10 0,66 0,50 0,38 1,19 0,68 1,38 53 94639 Приклад 1 є дисоційованою сполукою. Приклад 1 має DI і коригований DI для EAUC50 і EAUC80 вище 7 для OC/TNF, BFR/TNF, BFR/частота хвороби і BFR/важкість хвороби. Гістоморфометрія кортикальної кістки для визначення BFR Під час прижиттєвої частини кожного дослідження миші отримували дві інтраперитонеальні ін'єкції (20 мг/кг, 100 мл/миша) кальцеїну (С-0875; Sigma-Aldrich, St. Louis, МО) у дні 1 і 26 для гістоморфометричних вимірювань кістки. Кальцеїн проникає у мінерали кістки і дозволяє вимірювати швидкість утворення кістки. Кальцеїн розчиняють у 2%-му бікарбонаті натрію. При відбирання тканини залишок великої берцевої кістки зрізали і очищали для кортикальної гістоморфометрії. Після видалення усієї шкіри і м'язів велику берцеву кістку вносили у 70%-й етанол (4°С) у темряві на мінімум 24 год. Поперечні секції основи використовували для гістоморфометричного аналізу кортикальної кістки. Кістки секціонували низькошвидкісною пилою (l3omet, Buehler, Lake Bluff, IL), обладнаною діамантовим тонким лезом. Кінець кожної великої берцевої кістки видаляли поблизу синостозу великої Комп’ютерна верстка О.Гапоненко 54 берцевої кістки і малої берцевої кістки і вирізали 75-міліметрову поперечну секцію. Використовуючи загрублену скляну пластину і пробку, секції шліфували до ~25 мм доки транспарентні і всі інші мітки ставали видимими під флюоресцентним мікроскопом. Секції зневоднювали, використовуючи такі розчини протягом не менше 2 хвил. кожний: 1) 70%-й етанол, 2) 95%-й етанол, 3) 100%-й етанол, 4) 50/50 етанол/ксилол і 5) ксилол (двічі) (#534056; Sigma-Aldrich, St. Louis, МО). Секції встановлювали, використовуючи Eukitt Quick Mounting Media (#03989, Sigma-Aldrich, St. Louis, MO), після чого накладали покривне скло. Використовуючи Osteomeasure Bone Analysis Program (OcTeometrics, Inc., Decatur, Georgia), швидкість утворення кістки обчислювали, стежачи за 1-ю і 3ю флюоресцентними мітками і внутрішнім і зовнішнім периметрами кістки. Швидкість утворення кістки обчислювали за формулою: (ширина між мітками/інтервал міток)x(мічений периметр/периметр кістки). У кожному експерименті використано щонайменше 5 зразків для вимірювання у кожній групі. Підписне Тираж 24 прим. Міністерство освіти і науки України Державний департамент інтелектуальноївласності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюTricyclic compounds and their use as glucocorticoid receptor modulators
Автори англійськоюDevraj, Rajesh, Venkateswaran, de Crescenzo, Gary, A., Hu, Xiao, Jerome, Kevin, DeWayne, Obukowicz, Mark, Gerard, Olson, Lisa, Rucker, Paul Vincent, Webber, Ronald, Keith
Назва патенту російськоюТрициклические соединения и их применение как модуляторов глюкокортикоидного рецептора
Автори російськоюДеврай Райеш Венкатесваран, де Крескензо Гари А., Гу Киао, Джером Кевин ДеВайн, Обуковиц Марк Герард, Ольсон Лиза, Рукер Паул Винсент, Веббер Рональд Кейт
МПК / Мітки
МПК: A61P 19/02, A61K 31/44, A61P 11/06, C07F 9/58, A61P 25/28, A61P 1/00, A61P 29/00
Мітки: сполуки, глюкокортикоїдного, модуляторів, трициклічні, застосування, рецептора
Код посилання
<a href="https://ua.patents.su/27-94639-triciklichni-spoluki-ta-kh-zastosuvannya-yak-modulyatoriv-glyukokortikodnogo-receptora.html" target="_blank" rel="follow" title="База патентів України">Трициклічні сполуки та їх застосування як модуляторів глюкокортикоїдного рецептора</a>
Попередній патент: Формування діаграми спрямованості з просторово-часовим кодуванням і рознесенням передачі
Наступний патент: Герметичне нарізне з’єднання нафтопромислових труб
Випадковий патент: Пристрій для чищення взуття












