Мікробіологічна інженерія для одержання хімічних та фармацевтичних продуктів ізопреноїдним шляхом
Номер патенту: 112054
Опубліковано: 25.07.2016
Автори: Аджікумар Парайіл К., Фон Ту Хенг, Стефанопулос Грегорі
Формула / Реферат
1. Спосіб підвищення продукування терпеноїду в клітині, що продукує один або більше терпеноїдів, який включає забезпечення Escherichia соlі (Е. соlі), яка продукує ізопентил пірофосфат (ІРР) та диметилаліл пірофосфат (DMAPP), через шлях проти ходу транскрипції метилеритритолу форсфату (МЕР) та конвертує ІРР та DMAPP в терпеноїд через рекомбінантно експресований шлях по ходу транскрипції синтезу терпеноїду; та культивування Е. соlі для продукування терпеноїду, при цьому акумулювання індолу в культурі регулюють до рівня нижче 100 мг/л.
2. Спосіб за п. 1, у якому клітина надекспресує один або більше компонентів немевалонатного (МЕР) шляху.
3. Спосіб за п. 2, у якому клітина рекомбінантно експресує фермент геранілгераніл дифосфат синтазу (GGPS).
4. Спосіб за будь-яким з пп. 2-3, у якому один або більше компонентів немевалонатного (МЕР) шляху є вибраними з групи, що включає dxs, ispC, ispD, ispE, ispG, ispH, idi, ispA та ispB.
5. Спосіб за п. 4, у якому клітина включає гетерологічний оперон dxs-idi-ispDF.
6. Спосіб за будь-яким з пп. 1-5, у якому стадія контролю акумулювання індолу в клітині або культурі клітин включає врівноваження немевалонатного ізопреноїдного шляху проти ходу транскрипції з шляхом синтезу продукту за ходом транскрипції.
7. Спосіб за п. 6, у якому немевалонатний ізопреноїдний шлях проти ходу транскрипції врівноважують відносно до шляхів синтезу продукту за ходом транскрипції, шляхом одного або кількох із:
збільшення числа копій гену для одного або кількох ферментних шляхів проти ходу або за ходом транскрипції,
збільшення або зменшення рівня експресії генів шляхів проти ходу та/або за ходом транскрипції, як окремих генів або як оперонів, використовуючи промотори різної сили,
збільшення або зменшення рівня експресії генів шляхів за ходом та/або проти ходу транскрипції, як окремих генів або як оперонів, застосовуючи модифікації до сайтів зв'язування рибосом,
заміни рідних генів у шляхах проти ходу та/або за ходом транскрипції на гетерологічні гени, що кодують гомологічні ферменти,
оптимізації кодонів з одного або більше гетерологічних ферментів у шляхах проти ходу та/або за ходом транскрипції,
амінокислотної мутації в одному або кількох генах шляхів проти ходу та/або за ходом транскрипції, або
модифікації порядку шляху проти ходу та/або за ходом транскрипції генів у гетерологічному опероні.
8. Спосіб за будь-яким з пп. 1-5, у якому стадія контролювання акумулювання індолу в клітині або культурі клітин включає модифікування або регулювання індольного шляху.
9. Спосіб за будь-яким з пп. 1-5, у якому стадія контролювання акумулювання індолу в клітині або культурі клітин включає видалення акумульованого індолу з клітинної культури за допомогою хімічних способів, необов'язково використовуючи абсорбенти або поглиначі.
10. Спосіб за будь-яким з пп. 1-9, у якому один або більше терпеноїдів є монотерпеноїдом, сесквітерпеноїдом, дитерпеноїдом, тритерпеноїдом або тетратерпеноїдом.
11. Спосіб за п. 10, у якому один або більше терпеноїдів є таксадієном або будь-яким попередником таксолу.
12. Спосіб за будь-яким з пп. 1-11, який додатково включає вимірюванія кількості або концентрації індолу в клітині або в культурі клітин.
13. Спосіб за п. 12, де спосіб включає вимірювання кількості або концентрації індолу два або більше разів.
14. Спосіб за п. 12 або п. 13, у якому виміряну кількість або концентрацію індолу використовують для регулювання процесу продукування одного або більше терпеноїдів та/або для регулювання конструкції штаму.
Текст
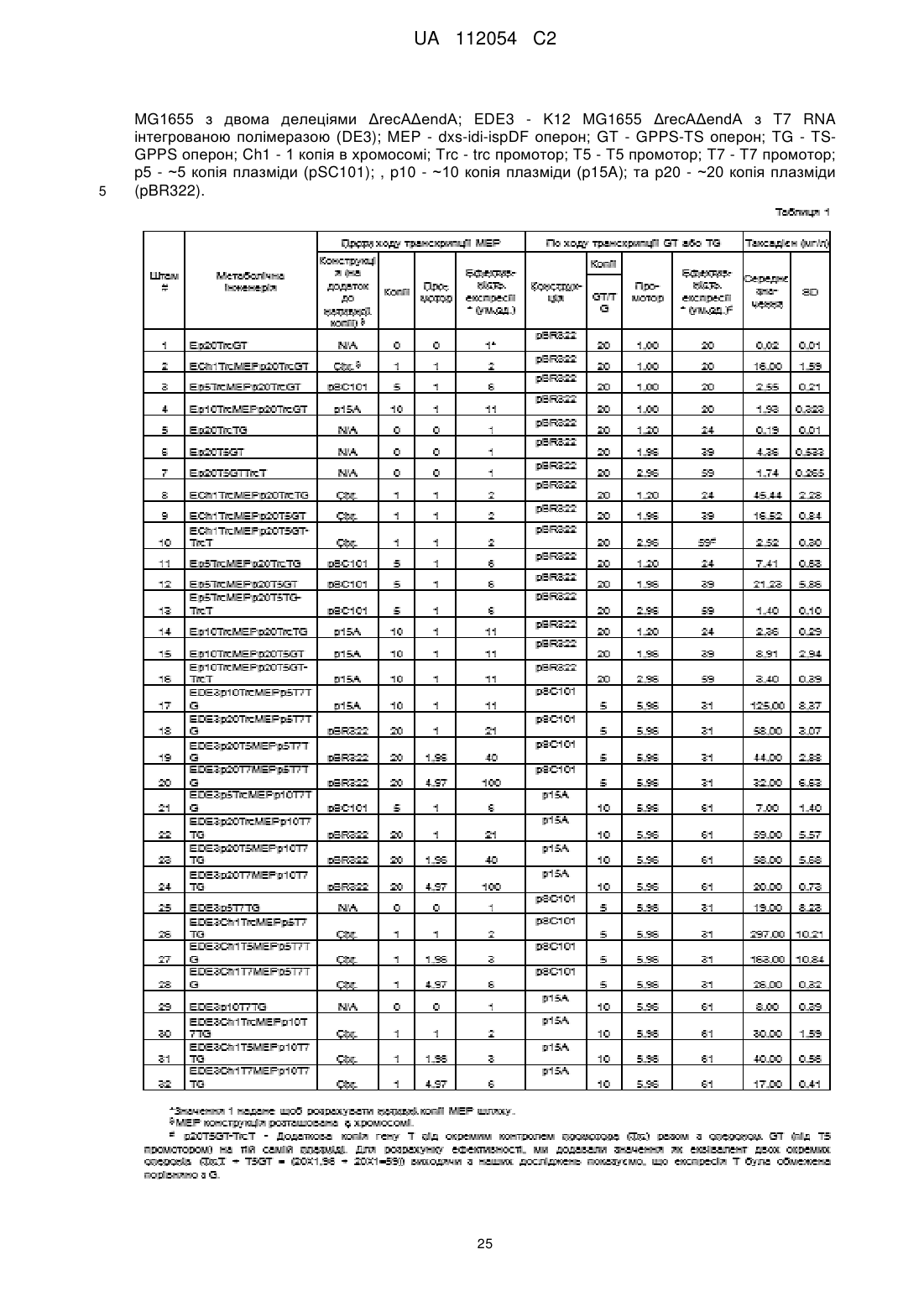
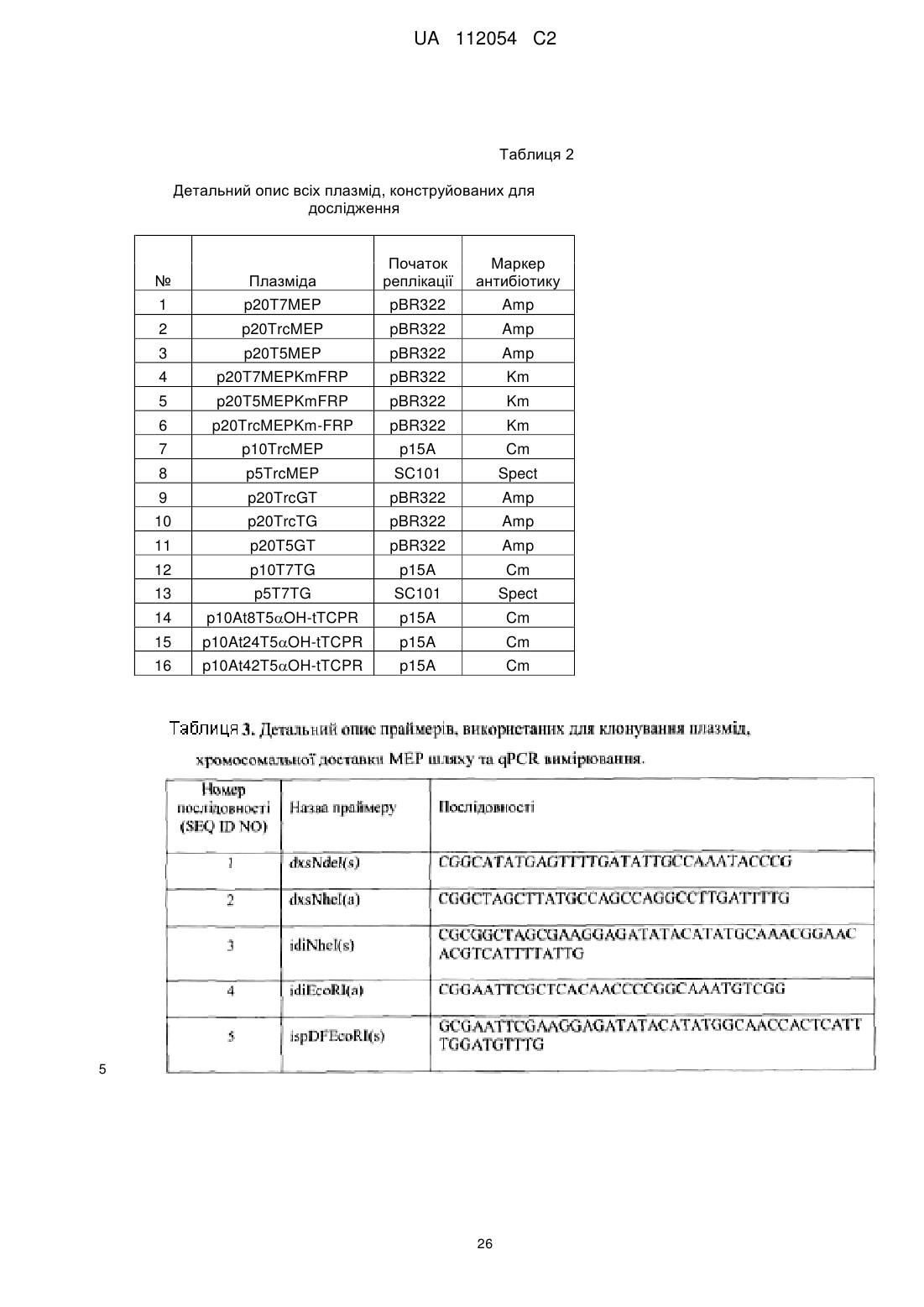
Реферат: Винахід належить до способу підвищення продукування терпеноїду в клітині, який включає забезпечення Escherichia соlі, яка продукує ізопентил пірофосфат (ІРР) та диметилаліл пірофосфат (DMAPP), через шлях проти ходу транскрипції метилеритритолу (МЕР) та конвертує ІРР та DMAPP в терпеноїд через рекомбінантно експресований шлях по ходу UA 112054 C2 (12) UA 112054 C2 транскрипції синтезу терпеноїду; та культивування Е. соlі для продукування терпеноїду, при цьому акумулювання індолу в культурі регулюють до рівня нижче 100 мг/л. UA 112054 C2 5 10 15 20 25 30 35 40 45 50 55 Пов'язані заявки Дана заявка подана згідно прав за 35 U.S.C. § 119(e) по попередній заявці U.S. Provisional Application Serial No. 61/280,877, з назвою "Microbial Engineering for the Production of Chemical and Pharmaceutical Products from Isoprenoid Pathway", поданій 10 листопада 2009 року та по попередній заявці U.S. Provisional Application Serial No. 61/388,543, з назвою "Microbial Engineering for the Production of Chemical and Pharmaceutical Products from Isoprenoid Pathway", поданій 30 вересня 2010 року, повні розкриття яких включені сюди як посилання у їх повному обсязі. Урядовий інтерес Ця робота частково фінансувалася Національним Інститутом Здоров'я по гранту номер 1R01-GM085323-01A1. Уряд має певні права на даний винахід. Галузь винаходу Даний винахід стосується одержання одного або більше терпеноїдів засобами мікробіологічної інженерії. Передумови створення винаходу Таксол та його структурні аналоги були визнані як найбільш сильні та комерційно успішні 1 антиракові ліки, що були введені в останнє десятиріччя. Таксол був першим виділений з кори 2 тису тихого, і начальна стадія способу одержання потребує принесення в жертву від двох до 3 чотирьох повністю вирослих дерева для забезпечення одного пацієнта. Структурна складність таксолу вимагає складного хімічного шляху синтезу, який потребує 35-51 стадій з найвищим 4,5,6 виходом 0,4%. Не дивлячись на це, був розроблений напівсинтетичний шлях, за допомогою якого біосинтетична проміжна сполука баккатин ІІІ була вперше виділена з рослинних джерел та 7 пізніше перетворена в таксол. В той час як цей підхід та наступні спроби одержання, основані на рослинноклітинній культурі, підвищили потребу в лісозаготоці тисових дерев, одержання все 8 ще залежить від процесів на основі рослинної сировини що супроводжується обмеженнями продуктивності та можливості масштабування та обмежує кількість похідних таксолу, які можуть 9, 10 бути синтезовані в процесі пошуку більш ефективних. Суть винаходу Недавні досягнення в метаболічній інженерії та синтетичній біології пропонують нові можливості для перевиробництва складних природних продуктів через більш технічно прийнятні 11, 12 мікробні організми-господарі. Не зважаючи на те, що був досягнутий надихаючий прогрес в 13-16 розумінні біосинтетичного механізму перетворення таксолу в таксус, комерційно важливі продукуючі таксол штами втрачені з попередніх спроб націлених на перенос біосинтетичного 17, 18 механізму цього комплексу до мікробіологічного господаря. Тим не менш, як і з іншими природними продуктами, мікробне виробництво, за рахунок метаболічно інженерних штамів, пропонує прийнятну рентабильність та величезний потенціал для синтезу різних рядів нових 19, 20 сполук з протираковою та іншою фармацевтичною активністю. Метаболічний шлях для таксолу та його аналогів складаються з шляху проти ходу транскрипції ізопреноїдів, що є нативним для E. coli, та гетерологічного шляху по ходу транскрипції терпеноїду (Фіг. 6). Шляхи проти ходу транскрипції мевалонової кислоти (MVA) або метилеритріолу фосфату (MEP) можуть продукувати два загальних складових елемента, ізопентенил пірофосфат (IPP) та диметилаліл пірофосфат (DMAPP), з яких утворюється таксол 12 та інші ізопреноїдні сполуки. Недавні дослідження продемонстрували розробку вищезгаданих шляхів проти ходу транскрипції для підтримки біосинтезу гетерологічних ізопреноїдів, таких як 21-23 лікопін та артемізинова кислота. Шлях по ходу транскрипції таксадієну був відновленим в E. 24 coli, але, до теперішнього часу, титри не перевищують 1,3 мг/л. Вищезгадані раціональні підходи метаболічної інженерії, зосереджені на терпеноїдному шлясі або проти ходу транскрипції (MVA або MEP), або по ходу транскрипції, неявно 25-27 допускають, що модифікації є адитивними, тобто лінійного характеру. Не зважаючи на те, що даний підхід може призвести до помірного зростання в потоці, як правило, ігноруються неспецифічні ефекти, такі як токсичність проміжних метаболітів, клітинні ефекти векторів, що використовують для експресії, та приховані невідомі шляхи, що можуть конкурувати з основним шляхом та відхиляти потік від бажаної мішені. Комбінаторні підходи можуть попереджувати такі проблеми, оскільки вони дають можливість адекватно відібрати параметри простору та виявити 21, 28, 29, 30 дані складні нелінійні взаємодії. Однак, вони вимагають високий пропускний скрінінг, 31 який часто є недоступним для багатьох прийнятних природніх продуктів. Ще інший клас способів оптимізації шляху досліджував комбінаторний простір різних джерел гетерологічних 32 генів, що включають відповідний шлях. Все залежить від високої пропускної здатності аналізу, дані способи, як правило ігнорують необхідність визначення оптимального рівня експресії для 1 UA 112054 C2 5 10 15 20 25 30 35 40 45 50 55 60 індивідуальних генів шляху та, в зв’язку з цим, підтверджують меншу ефективність в структуруванні оптимального шляху. В представленій роботі, як приклад аспектів винаходу, ми зосереджуємося на оптимальному балансуванні між проти ходу транскрипції шляхом IPP-утворення з по ходу транскрипції терпеноїдним шляхом таксадієнового синтезу. Це досягається групуванням дев’яти ферментного шляху в два модулі - модуля чотирьох генів, проти ходу транскрипції, нативного (MEP) шляху та дво-генного, по ходу транскрипції, гетерологічного шляху до таксадієну (Фіг. 1). Використовуючи дану основну конфігурацію, параметри, такі як дія числа плазмідних копій на фізіологію клітини, порядок генів та чисельність промотора в експресійній касеті, та хромосомну інтеграцію оцінюють те, що стосується їх впливу на таксадієнову продуктивність. Даний модульний та багатоаспектний комбінаторний підхід дозволяє нам раціонально випробовувати основні параметри, які впливають на ефективність шляху без необхідності високого пропускного скрінінгу. Багатовимірний пошук по багаточисельним промоторам та числу копій для кожного модуля шляху показує високо нелінійний рельєф ефективності таксадієну з глобальним максимумом, що показує 15 000 нратне зростання продукування таксадієну в порівнянні з контролем, що дає 300 мг/л продуктивності таксадієну в маломасштабних ферментаціях. Крім того, ми розробили P450 на основі хімічного окиснення в біосинтезі таксолу в E. coli, з нашими інженерними штамами, що покращують продукування таксадієн-5-олу в 2400 разів у порівнянні з втсановленими в рівні техніки. Дані вдосконалення розкривають потенціал для широкомасштабного виробництва тисяч різних терпеноїдів за допомогою загальновизнаних мікробних систем. Аспекти винаходу стосуються способів, що включають рекомбінантно експресуючий фермент таксадієн синтазу та фермент геранілгеранілдифосфат синтазу (GGPPS) в клітині, що надекспресує один або більше компонентів з немевалонатного (MEP) шляху. В деяких втіленнях клітина є бактеріальною клітиною, такою як клітина Escherichia coli. В деяких втіленнях бактеріальна клітина є грампозитивною клітиною, такою як Bacillus клітина. В деяких втіленнях клітина є дріжджовою клітиною, такою як Saccharomyces клітина або Yarrowia клітина. В деяких втіленнях, клітина є водоростевою клітиною або рослинною клітиною. В деяких втіленнях, фермент таксадієн синтаза є Taxus ферментом, таким як Taxus brevifolia фермент. В деяких втіленнях, GGPPS фермент є Taxus ферментом, таким як Taxus canadenis фермент. В деяких втіленнях, ген, що кодує фермент таксадієнсинтази, та/або ген, що кодує GGPPS фермент, та/або ген, що кодує один або більше компонентів MEP шляху, експресують з однієї або більше плазмід. В деяких втіленнях, ген, що кодує фермент таксадієнсинтази, та/або ген, що кодує GGPPS фермент, та/або ген, що кодує один або більше компонентів MEP, включають в геном клітини. В деяких втіленнях один або більше компонентів з немевалонатного (MEP) шляху вибирають з групи, що складається з dxs, ispC, ispD, ispE, ispF, ispG, ispH, idi, ispA та ispB. В конкретних втіленнях dxs, idi, ispD та ispF є надекспресованими. Наприклад, dxs, idi, ispD та ispF можуть бути надекспресованими на опероні dxs-idi-idpDF. В деяких втіленнях ген, що кодує фермент таксадієнсинтази, та ген, що кодує GGPPS фермент, експресують разом на опероні. В деяких втіленнях клітина, крім того, експресує таксадієн-5-гідроксилазу (T5OH) або її каталітично активну частину. В конкретних втіленнях фермент T5OH або його каталітично активна частина зливаються в фермент цитохром P450 редуктазу або його каталітично активну частину. Наприклад, фермент T5OH може бути At24T5αOH-tTCPR. Експресія ферменту таксадієнсинтази, GGPPS ферменту та одного або більше компонентів MEP шляху може бути збалансована так, щоб максимізувати продукування таксадієну. Способи відповідно до винаходу, до того ж, можуть охоплювати культивування клітин, що продукують -1 таксадієн або таксадієн-5-ol. В деяких втіленнях продукується, щонайменше, 10 мг л -1 таксадієну. В конкретних втіленнях продукується, щонайменше, 250 мг л таксадієну. В деяких -1 втіленнях продукується, щонайменше, 10 мг л таксадієн-5-олу. В конкретних втіленнях -1 продукується, щонайменше, 50 мг л таксадієн-5-олу. В деяких втіленнях відсоток перетворення таксадієну в таксадієн-5-ол та побічний продукт 5(12)-окса-3(11)-циклотаксан становить, щонайменше, 50%, щонайменше, 75% або, щонайменше, 95%. Способи, відповідно до винаходу, крім того можуть включати, виділення таксадієну або таксадієн-5-олу з культури клітин. В деяких втіленнях, таксадієн або таксадієн-5-ол виділяють з газової фази, тоді як в інших втіленнях органічний шар додають до культури клітин та таксадієн або таксадієн-5-ол виділяють з органічного шару. Аспекти винаходу стосуються клітин, що надекспресують один або більше компонентів немевалонатного (MEP) шляху, та, що рекомбінантно експресують фермент таксадієнсинтазу та фермент геранілгераніл дифосфат синтазу (GGPPS). В деяких втіленнях клітина є 2 UA 112054 C2 5 10 15 20 25 30 35 40 45 50 55 60 бактеріальною клітиною, такою як клітина Escherichia coli. В деяких втіленнях бактеріальна клітина є грампозитивною клітиною, такою як Bacillus клітина. В деяких втіленнях клітина є дріжджовою клітиною, такою як Saccharomyces клітина або Yarrowia клітина. В деяких втіленнях, клітина є водоростевою клітиною або рослинною клітиною. В деяких втіленнях, фермент таксадієнсинтаза є Taxus ферментом, таким як Taxus brevifolia фермент. В деяких втіленнях, GGPPS фермент є Taxus ферментом, таким як Taxus canadenis фермент. В деяких втіленнях, ген, що кодує фермент таксадієнсинтази, та/або ген, що кодує GGPPS фермент, та/або ген, що кодує один або більше компонентів MEP шляху, експресують з однієї або більше плазмід. В деяких втіленнях, ген, що кодує фермент таксадієнсинтази, та/або ген, що кодує GGPPS фермент, та/або ген, що кодує один або більше компонентів MEP, включають в геном клітини. В деяких втіленнях, один або більше компонентів немевалонатного (MEP) шляху вибирають з групи, що складається з dxs, ispC, ispD, ispE, ispF, ispG, ispH, idi, ispA та ispB. В конкретних втіленнях dxs, idi, ispD та ispF є надекспресованими. Наприклад, dxs, idi, ispD та ispF можуть бути надекспресованими на опероні dxs-idi-idpDF. В деяких втіленнях, ген, що кодує фермент таксадієнсинтази, та ген, що кодує GGPPS фермент, експресують разом на опероні. В деяких втіленнях, експресія ферменту таксадієнсинтази, GGPPS ферменту та одного або більше компонентів MEP шляху збалансовують так, щоб максимізувати продукування таксадієну. В деяких втіленнях, клітина, крім того, експресує таксадієн-5-гідроксилазу (T5OH) або її каталітично активну частину. В конкретних втіленнях фермент T5αOH або його каталітично активна частина зливаються в фермент цитохром P450 редуктазу або його каталітично активну частину. Наприклад, фермент T5OH може бути At24T5OH-tTCPR. В деяких втіленнях клітина продукує таксадієн та/або таксадієн-5-ол. Аспекти винаходу стосуються способів відбору клітин, що демонструють підвищене продукування терпеноїдів, включаючи створення або одержання клітини, що надекспресує один або більше компонентів немевалонатного (MEP) шляху, продукування терпеноїду клітиною, порівнюючи кількість терпеноїду, продукованого клітиною до кількості терпеноїду, продукованого в контрольній клітині, та вибираючи першу покращену клітину, що продукує більшу кількість терпеноїду, ніж контрольна клітина, де першою покращеною клітиною, що продукує більшу кількість терпеноїду, ніж контрольна клітина, є клітина, що демонструє підвищене продукування терпеноїду. В деяких втіленнях клітина рекомбінантно експресує фермент терпеноїд синтази та/або фермент геранілгераніл дифосфат синтази (GGPPS). Способи, крім того, можуть включати змінення рівня експресії одного або більше компонентів немевалонатного (MEP) шляху, ферменту терпеноїд синтази та/або ферменту геранілгераніл дифосфат синтази (GGPPS) в першій покращеній клітині, щоб продукувати другу покращену клітину, та порівняння кількості терпеноїду, продукованого другою покращеною клітиною до кількості терпеноїду, продукованого першою покращеною клітиною, де друга покращена клітина, що продукує більшу кількість терпеноїду, ніж перша покращена клітина, є клітиною, що демонструє підвищене продукування терпеноїду. В деяких втіленнях, фермент терпеноїд синтази є ферментом таксадієнсинтази. Крім того, клітина може рекомбінантно експресувати будь-які поліпептиди, пов’язані з даним винаходом. Аспекти винаходу стосуються виділених поліпептидів, що містять фермент таксадієн-5гідроксилази (T5OH) або його каталітично активну частину, злиту з ферментом цитохром P450 редуктази або з його каталітично активною частиною. В деяких втіленнях фермент цитохром P450 редуктази є Taxus цитохром P450 редуктазою (TCPR). В конкретних втіленнях таксадієн5-гідроксилаза та TCPR є з'єднаними лінкером, таким як GSTGS (SEQ ID NO:50). В деяких втіленнях таксадієн-5-гідроксилаза та/або TCPR є усіченим для видалення всієї або частини трансмембранної області. В конкретних втіленнях 8, 24 або 42 N-термінальні амінокислоти таксадієн-5-гідроксилази є усіченими. В конкретних втіленнях 74 амінокислоти TCPR є усіченими. В деяких втіленнях додатковий пептид є злитим з таксадієн-5-гідроксилазою. В конкретних втіленнях додатковий пептид є з бичачої 17-гідроксилази. В конкретних втіленнях пептидом є MALLLAVF (SEQ ID NO:51). В конкретних втіленнях виділеним пептидом є At24T5OH-tTCPR. Крім того, аспекти винаходу охоплюють молекули нуклеїнової кислоти, що кодують будь-які поліпептиди, відповідно до винаходу, та клітини, що рекомбінантно експресують будь-які подіпептиди, відповідно до винаходу. Аспекти винаходу стосуються способів підвищення продукування терпеноїду в клітині, що продукує один або більше терпеноїдів. Способи включають контролювання акумулювання індолу в клітині або культурі клітин, таким чином підвищення продукування терпеноїду в клітині. Будь-яку з клітин, описаних в даному документі, може застосовувати в даних способах, 3 UA 112054 C2 5 10 15 20 25 30 35 40 45 50 55 60 включаючи бактеріальні клітини, такі як клітини Escherichia coli; грампозитивні клітини, такі як Bacillus клітини; дріжджові клітини, такі як Saccharomyces клітини або Yarrowia клітини; водоростеві клітини; рослинні клітини; та будь-які з розроблених клітин, описаних в даному документі. В деяких втіленнях, стадія контролювання акумулювання індолу в клітині або в культурі клітин включає балансування шляху проти ходу транскрипції немевалонатного ізопреноїду з шляхами по ходу транскрипції синтеза продукту та/або модифікацію або регулювання шляху індолу. В інших втіленнях стадія контролювання акумулювання індолу в клітині або в культурі клітин включає або, крім того, включає видалення акумульованого індолу з ферментації за допомогою хімічних способів, таких як застосування абсорбентів або поглиначів. Один або більше терпеноїдів, продукованих клітиною(ами) або культурою можуть бути монотерпеноїдом, секвітерпеноїдом, дитерпеноїдом, тритерпеноїдом або тетратерпеноїдом. В конкретних втіленнях теперноїди є таксадієном або будь-яким попередником таксолу. Аспекти винаходу стосуються способів, що включають вимірювання кількості або концентрації індолу в клітині, що продукує один або більше терпеноїдів, або в культурі клітин, що продукує один або більше терпеноїдів. Способи можуть включати вимірювання кількості або концентрації індолу два або більше разів. В деяких втіленнях виміряну кількість або концентрацію індолу використовують, щоб керувати процесом продукування одного або більше терпеноїдів. В деяких втіленнях виміряну кількість або концентрацію індолу використовують, щоб керувати конструюванням штаму. Ці та інші аспекти винаходу, а також різні його втілення, стануть більш очевидними в застосуванні з кресленнями та детальним описом винаходу. Короткий опис креслень Креслення, що додаються, не призначені бути накресленими для масштабування. В кресленнях кожний ідентичний або близький до ідентичного компонент, що є проілюстрованим в різних фігурах, є представленим однаковими цифрами. З метою ясності, не кожен компонент може бути позначеним на кожному кресленні. На кресленнях: Фігура 1. Багатовимірний-модульний шлях інженерії ізопреноїду показує сильний нелінійний відгук в акумулюванні терпеноїду. Для збільшення ефективності через шлях проти ходу транскрипції MEP, ми ціленаправлено підтверджено гальмували ферментні стадії (dxs, idi, ispD 28 та ispF) для над експресії опероном (dxs-idi-ispDF). Щоб направини переповнений потік від загальних попередників ізопреноїду, IPP та DMAPP, в напрямку до біосинтезу таксолу, конструювали синтетичний оперон генів по ходу транскрипції GGPP синтази (G) та 16 таксадієнсинтази (T) . Шляхи проти ходу транскрипції ізопреноїду та по ходу транскрипції синтетичного таксадієну розташовували під контролем промоторів, що індукуються, щоб контролювати їх відносні генні експресії. (a) Схематичне представлення двох модулів, нативного шляху проти ходу транскрипції MEP ізопреноїду (зліва) та шлях синтетичного таксадієну (справа). В біосинтетичній сітці E. coli, шлях MEP ізопреноїду ініціалізують конденсацією попередників з гліколізу гліцеральдегідів-3 фосфату (G3P) та пірувату (PYR). Розгалуження шляху таксолу починається з універсальних попередників ізопреноїду IPP та DMAPP для утворення першого "лінійного" попередника геранілгераніл дифосфата, та потім "циклічний" таксадієн комітує та переводить проміжні в таксол. Циклічний олефіновий таксадієн проходить декілька циклів стереоспецифічних окиснень, ацилювань, бензоїлувань з впорядкованою структурою бічного ланцюга, щоб, в кінці кіців, утворити таксол. (b) Схематичне представлення інженерного підходу багатовимірного-модульного шляху ізопреноїду для дослідження нелінійного відгуку в акумулюванні терпеноїду з шляху проти ходу транскрипції та по ходу транскрипції розроблених клітин. Експресії шляхів проти ходу транскрипції та по ходу транскрипції модулюють за допомогою зміни сили промотору (Trc, T5 та T7) або підвищенням числа копій, використовуючи різні плазміди. Варіації шляху експресії проти ходу транскрипції та по ходу транскрипції дають різні максимуми в акумулюванні таксадієну. Фігура 2. Оптимізація продукування таксадієну за рахунок регулювання експресії модульних шляхів проти та по ходу транскрипції. (a) Відповідь на акумулювання таксадієну зростанням інтенсивності шляхів проти ходу транскрипції до постійних значень шляху по ходу транскрипції. (b) В залежності від шляху по ходу транскрипції постійно зростає інтенсивність шляху проти ходу транскрипції. Кілька локальних максимумів, що спостерігаються, відгуку таксадієну залежать від зростання єфекивності шляху експресії проти ходу транскрипції або по ходу транскрипції. (c) Відгук таксадієну з інженерних штамів (17-24) з високими надекспресіями шляху проти ходу транскрипції (20-100) з двома різними експресіями по ходу транскрипції (~30 та ~60) для виявлення відгуку таксадієну з балансованими експресіями. Для модулювання даних експресій використовують експресії шляху по ходу транскрипції з низькою копією 4 UA 112054 C2 5 10 15 20 25 30 35 40 45 50 55 плазміди (p5 та p10) під сильним промотором T7TG оперону. Відзначимо, що як проти ходу транскрипції, так і по ходу транскрипції шлях, експресований з різних плазмідів з різними промоторами, може накладати на народжені плазміди метаболічне навантаження. (d) Модулювання шляху проти ходу транскрипції зі зростаючою силою промотора з хромосоми з двома різними експресіями по ходу транскрипції (~30 та ~60) для виявлення відсутнього простору пошуку зі зниженими токсичними діями (штами 25-32). (e) Генетичні деталі штамів, що продукують таксадієн. Число відповідних різних штамів та відповідний їм генотип, E-E. coli K12mG1655 ΔrecAΔendA, EDE3-E. coli K12mG1655 ΔrecAΔendA з T7 RNA полімеразою DE3 створюються в хромосомі, MEP – dxs-idi-ispDF оперон, GT- GPPS-TS оперон, TG- TS-GPPS оперон, Ch1 – 1 копія в хромосомі, Trc – Trc промотор, T5 – T5 промотор, T7 – T7 промотор, p5, p10, p20 - ~5 (SC101), ~10 (p15), та ~20 (pBR322) копія плазміди. Фігура 3. Метаболіт обернено пропорційно корелює з продукуванням таксадієну. (a) Масспектр метаболіту, що одержували, щоб встановити обернене співвідношення з продукуванням таксадієну конструйованим штамом Фіг. 2. Значення характеристичних піків, що спостерігаються, становлять 233, 207, 178, 117, 89 та 62. (b) Співвідношення між побічним продуктом ізопреноїдом Фіг. 3a та таксадієном. Штами 26-29 та 30-32, всі з хромосомально інтегрованою експресією шляху проти ходу транскрипції, вибирали для послідовного порівняння. В штамах 26-29 та 30-32, експресія проти ходу транскрипції зростала за рахунок зміни промоторів з Trc, до T5 та T7, відповідно. Дві серії штамів відрізняються тільки в експресії шляху по ходу транскрипції, друга серія (30-32) має подвійний рівень експресії першої. В першій серії оптимальне балансування досягають штамом 26, який використовує Trc промотор для експресії шляху проти ходу транскрипції та, крім того, показує найнижче акумулювання метаболіту. Зі штамами 30-32, штам 31 показує найнижче акумулювання метаболіту та найвище продукування таксадієну. Дані демонструють обернену кореляцію, що спостерігається, між невідомим метаболітом та продукуванням таксадієну. Фігура 4. Рівні експресії транскрипційного гену шляху проти ходу транскрипції та по ходу транскрипції та зміни в фізіології клітини інженерних штамів. Відносні експресії перших генів в опероні шляху проти ходу транскрипції (DXS) та по ходу транскрипції (TS) кількісно визначають за допомогою qPCR. Подібні профілі експресії спостерігали з генами по ходу транскрипції оперонів. Відповідне число штамів показано на графіку. (a) Відносний рівень транскрипту DXS експресії гену, який кількісно визначають з різних експресій проти ходу транскрипції, модульований, використовуючи промотори та плазміди з двох різних експресій по ходу транскрипції. (b) Відносний рівень транскрипту TS експресії гену, який кількісно визначають з двох різних експресій по ходу транскрипції, модульованих, використовуючи p5T7 та p10T7 плазміди від різних експресій проти ходу транскрипції. Наш аналіз експресії гену напряму підтвердив припущення щодо зі зростанням числа копій плазміди (5, 10 та 20) та сили промотора (Trc, T5 та T7), експресії шляхів проти ходу транскрипції та по ходу транскрипції можуть бути модульованими. (c) Ріст клітини інженерних штамів 25-29. Фенотип росту знаходиться під впливом активації метаболізму ізопреноїду (штам 26), експресії рекомбінантного протеїну (штам 25) та метаболічного навантаження народженої плазміди (контроль vs інженерних штамів) та (d) фенотипи росту штамів 17, 22, 25-32. Лінії чорного кольору є інженерні штами, що продукують таксадієн, та лінії сірого кольору є контрольними штамами без експресії по ходу транскрипції, що несуть пусту плазміду з промотором та декількома сайтами клонування. Ріст корелював з активцією метаболізму терпеноїду, метаболічним навантаженням народженої плазміди, а також з експресією рекомбінантного протеїну. Фігура 5. Інженерія хімічного окиснення таксолу p450 в E. coli. (a) Схематичне представлення перетворення таксадієну до таксадієн-5-олу та до таксолу. (b) Трансмембранна інженерія та створення однокомпонентного химерного протеїну з таксадієн5-ол гідроксилази (T5OH) та Taxus цитохром p450 редуктази (TCPR). 1 та 2 представляє повнодовжинні протеїни T5OH та TCPR, виявлені з 42 та 74 амінокислотними TM областями, відповідно, 3 - химерні ферменти, утворені з трьох різних TM розроблених T5OH компонентів структури, (At8T5OH, At24T5OH та At42T5OH, створених злиттям 8 залишкового синтетичного пептиду (A) з 8, 24 та 42 AA усіченим T5αOH) шляхом трансляційного злиття з 74 AA усіченим TCPR (tTCPR), використовуючи 5 залишок GSTGS пептиду лінкера. (c) Функціональна активність At8T5OH-tTCPR, At24T5OH-tTCPR та At42T5OH-tTCPR конструкцій, трансформованих в штам 18, що продукує таксадієн. (d) Профіль акумулювання таксадієн-5-олу в залежності від часу та профіль росту штаму 18-At24T5aOH-tTCPR, який ферментували в 1 л біореакторі. 5 UA 112054 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фігура 6. Схема біосинтезу продукування таксолу в E. coli. Схематичне представлення двох модулей, нативного шляху проти ходу транскрипції ізопреноїду (зліва) та шлях синтетичного таксолу (справа). В біосинтетичній сітці E. coli дивергенція шляху MEP ізопреноїду ініціалізує з попередників гліцеральдегід-3 фосфат (G3P) та піруват (PYR) з гліколізу (I-V). Розгалуженість шляху таксолу починається з E. coli ізопреноїдного попередника IPP та DMAPP до "лінійного" попередника геранілгераніл дифосфату (VIII), "циклічного" таксадієну (IX), "окисненого" таксадієн-5-олу (X) до кількох циклів стереоспецифічних окиснень, ацилювань, бензоїлувань та епоксидування раннього попередника Baccatin III (XII) та, в кінці кіців, з впорядкованою структурою бічного ланцюга до таксолу (XIII). Мічені гени DXP - 1-деокси-D-ксилулозе-5-фосфат , MEP- 2C-метил-D-еритрітол-4-фосфат, CDP-ME - 4-дифосфоцитидил-2Cметил-D-еритрітол, CDP-MEP - 4-дифосфоцитидил- 2C-метил-D-еритрітол-2-фосфат, ME-cPP - 2C-метил-Dеритрітол-2,4-циклодифосфат, IPP- ізопентеніл дифосфат, DMAPP - диметилаліл дифосфат. Гени, що включають біосинтетичні шляхи з G3P та PYR до таксолу. Синтаза DXS-1-деокси-Dксилулоза-5-фосфату, редуктоізомераза ispC-1-деокси-D-ксилулоза-5-фосфату, синтаза IspD-4дифосфоцитидил-2C-метил-D-еритрітолу, кіназа IspE-4-дифосфоцитидил-2-C-метилDеритрітолу, синтаза IspF-2C-метил-D-еритрітол-2,4-циклодифосфату, синтаза IspG-1-гідрокси-2метил-2-(E)-бутеніл-4дифосфату, редуктаза IspH-4-гідрокси-3-метил-2-(E)-бутеніл-4дифосфату, ізомераза IDI-ізопентеніл-дифосфату, синтаза GGPPS-геранілгеранілдифосфату, синтаза таксадієну, таксоїд-5-гідроксилаза, таксоїд- 5-O-ацетилтрансфераза, таксоїд-13гідроксилаза, таксоїд-10-гідроксилаза, таксоїд-2-гідроксилаза, таксоїд-2-Oбензоїлтрансфераза, таксоїд-7-гідроксилаза, таксоїд-10-O-ацетилтрансфераза, таксоїд-1гідроксилаза*, таксоїд-9-гідроксилаза, таксоїд-9-кето-оксидаза*, таксоїд-C4,C20епоксидаза*, фенілаланін аміномутаза, CoA-лігаза* з бічним ланцюгом, таксоїд-13 O216, 219 фенілпропаноїлтрансфераза, таксоїд-2'-гідроксилаза*, таксоїд-3'-N-бензоїлтрансфераза * є ще й ідентифіковані та охарактеризовані. Фігура 7. Кратність покращень в продукуванні таксадієну з пошуку експресії модулярного шляху. (a) Таксадієновий відгук в кратності покращень зі всіх макимумів, що спостерігаються на Фігурах 2a, b та c, в порівнянні з штамом 1. 2,5 кратність різниць між двома найвищими максимумами (штам 17 та 26) та 23 крана (штам 26 та 10) з найнижчим максимумом демонструє відсутність результатів оптимального відгуку в значно нижчих титрах. Фігура 8. Метаболіт (a) Співвідношення між таксадієном та акумулюванням метаболіту. Акумулювання метаболіту з інженерного штаму непропорційно відноситься до продукування таксадієну за експоненціальною залежністю. Коефіцієнт кореляції для даної залежності становив 0,92 (b) Представлений GC-профіль зі штамів 26-28 демонструє зміну в акумуляції таксадієну та метаболіту. Цифри в хроматограмі 1 та 2 відповідають пікам метаболіту та таксадієну, відповідно. (c) GC-MS профіль метаболіту (1) та таксадієну (2), відповідно. Характеристичними піками метаболіту, що спостерігаються, є 233, 207, 178, 117, 89 та 62. + + + Такса-4(20),11,12-дієновий характеристичний іон m/z 272(P ), 257 (P -CH3), 229 (P -C3H7); 121, 60 122, 123 (C-кільцевий фрагмент кластеру). Пік, мічений зірочкою є внутрішнім стандартом кариофілену. Фігура 9. Профілі ГХ-МС та продукування таксадієну / таксадієн-5-олу з штучного химерного ферменту, створеного штамом 26. (a) GC профіль екстракту гексан:етер (8:2) з трьох компонентів структур (A-At8T5OH-tTCPR, t24T5OH-tTCPR та At42T5OH-tTCPR), перенесених до штаму 26 та ферментованих протягом 5 днів. 1, 2 та 3 позначення піків відповідають таксадієну, таксадієн-5-олу та 5(12)-окса-3(11)-циклотаксану (OCT), відповідно. (b) Продукування такса-4(20),11,12-дієн-5-олу та OCT кількісно визначали з трьох штамів. (c) та (d) GC-MS профіль такса-4(20),11,12-дієн-5-олу та OCT, та піки, що відповідають за 42, 47 фрагментацію, порівнювали з аутентичними стандартами та попередніми повідомленнями. ГХ-МС аналіз підтвердив ідентичність мас-спектру до аутентичного такса-4(20),11,12-дієн-5+ + + олу з характеристичним іоном m/z 288(P ), 273 (P -H2O), 255 (P -H2O-CH3). Фігура 10 представляє схематичне зображення біосинтетичного шляху терпеноїду та природних продуктів одержаних даним шляхом. Фігура 11 представляє схематичне зображення модулювання шляху проти ходу транскрипції для збільшення продукування таксадієну. Фігура 12 представляє схематичне зображення модулювання шляху по ходу транскрипції для збільшення продукування таксадієну. Фігура 13 представляє схематичну вказівку того, що відхилення нововиявленого шляху не є характерним для синтетичного шляху по ходу транскрипції. Фігура 14. Інтенсивність шляху корелює з транскрипційними рівнями експресії гену. (c) відносна експресія idi, ispD та ispF генів зі зростаючою інтенсивністю шляху проти ходу 6 UA 112054 C2 5 10 15 20 25 30 35 40 45 50 55 60 транскрипції та інтенсивністю по ходу транскрипції при 31 довільгих одиницях, та (d) відносна експресія idi, ispD та ispF генів зі зростаючою інтенсивністю шляху проти ходу транскрипції та інтенсивністю по ходу транскрипції при 61 довільгих одиницях. Як і очикувалось, експресія гену зростала оскільки зростала інтенсивність шляху проти ходу транскрипції. Відповідне число штамів показано на гістограмі. Відносну експресію кількісно визначали, використовуючи експресію конститутивного rrsA гену. Данні становлять середнє значення +/- SD з чотирьох повторень. Фігура 15. Вплив акумулювання метаболіту побічного продукту індолу на продукування та ріст таксадієну. (a) Обернена залежність між таксадієном та індолом. Штами з 26 до 28 та з 30 до 32, всі з експресією хромосомально інтегрованого шляху проти ходу транскрипції вибирали для послідовного порівняння. Дві серії штамів відрізняються тільки в експресії шляху по ходу транскрипції від другої скрії (30 до 32), яка має подвійний рівень експресії першої. В штамах з 26 до 28 та з 30 до 32, експресія проти ходу транскрипції зростала зі зміною промоторів з Trc, до T5 та T7, відповідно. В першій серії оптимальне балансування досягають з штамом 26, який застосовує Trc промотор експресії шляху проти ходу транскрипції та, крім того, показує найменше акумулювання індолу. В штамах з 30 до 32, штам 31 показує найменше акумулювання індолу та найвище продукування таксадієну. Кратність покращень є відносною до штаму 25 та 29, відповідно, для двохсерій. (b) Вплив введеного ззовні індолу на продукування таксадієну для високо продукуючого штаму 26. Різні концентрації індолу вводять в культури клітин, що культивують в мінімальному середовищі з 0,5% дріжджового екстракту. Продукування таксадієну значно знижувалось, коли концентрація індолу зростала з 50 мг/л до 100 мг/л (c) Вплив введеного ззовні індолу на ріст клітин інженерних штамів E. coli. Данні становлять середнє значення +/- SD з трьох повторень. Штами вільні від шляху по ходу транскрипції та з різним по єфективності шляхами проти ходу транскрипції (1, 2, 6, 21, 40 та 100) біли вібраними. Штам 26, високо продукуючий таксадієн, демонструє найсильніше інгібування. Фігура 16. Невідомий метаболіт ідентифікований як індол. (A) та (a) газова хроматографа та мас-спектр невідомого метаболіту, екстрагованого з культури клітин, використовуючи гексан. (B) та (b) відповідають газовій хроматографі та мас-спектру чистого індолу, розчиненого в гексані. Крім того, щоб підтвердити хімічну ідентичність, метаболіт екстрагували з ферментаційного середовища, використовуючи для екстракції гексан та очищуючи за допомогою колоночної хроматографії на діоксиді кремнію, використовуючи суміш гексан:етилацетат (8:2) як елюєнт. 1 13 Чистоту сполуку підтверджували ТШС та ГХ-МС. H ЯМР та C ЯМР спектри підтверджували 1 хімічну ідентичність метаболіта як індола. (c) H ЯМР спектр індолу, екстрагованого з культури клітин (CDCl3, 400 МГц) δ: 6,56 (д, 1H, Ar C-H), 7,16 (м, 3H, Ar C-H), 7,38 (д, 1H, Ar C-H), 7,66 (д, 13 1H, Ar C-H), 8,05 (ш, 1H, NH індолу). (d) C ЯМР δ: 135,7, 127,8, 124,2, 122, 120,7, 119,8, 111, 1 102,6. (e) представляє H ЯМР спектр чистого індолу. Фігура 17. Культивування з підпитуванням інженерних штамів в 1 л біореакторі. Залежність від часу акумулювання таксадієну (a), росту клітин (b), акумулювання оцтової кислоти (c) та додавання загального субстрату (гліцерину) (d) для штамів 22, 17 та 26 протягом 5 днів біореакторного культивування з підпитуванням в 1 л ємності біореактору при контрольованому pH та кисневих умовах з мінімальним середовищем та 0,5% дріжджовим екстрактом. Після зменшення гліцерину до ~0,5 до 1 г/л в ферментаторі, 3 г/л гліцерину вводили в біореактор під час ферментації. Данні є середнім значенням з двох повторень біореакторів. Детальний опис винаходу Таксол є потенційним протираковим лікарським засобом, виділений як природній продукт з Taxus brevifolia (тису коротколисного) тихоокеанського тисового дерева. Однак, надійне та економічно-ефективне виробництво таксолу або аналогів таксолу за традиційними способами виробництва з екстрактів рослини є обмеженим. В даному документі ми повідомляємо про багатовимірний-модульний підхід до розробки метаболічного шляху, щоб збільшити в ~15000 разів продукування таксадієну в розроблених Escherichia coli. Таксадієн, перша проміжна сполука комітованого таксолу, є біосинтетичним продуктом немевалонатного шляху в E. Coli, який включає два модулі: нативний шлях проти ходу транскрипції, що утворює ізопентеніл пірофосфат (IPP), та гетерологічний шлях по ходу транскрипції, за яким утворюються терпеноїди. Систематичне багатовимірне дослідження встановлених умов, що оптимально врівноважують два модулі шляхів, щоб мінімізувати акумулювання інгібуючих проміжних сполук та відхилення потоку в напрямок побічних продуктів. Ми, крім того, розробили наступну стадію після таксадієну в біосинтезі таксолу, стадію на основі окиснення P450, що має вихід >98% перетворення субстрату та представляє перший приклад продукування in vivo будь-яких функціоналізованих похідних таксолу в E. coli. Модульний підхід до розробки шляху не тільки підкреслює складність багатостадійного шляху, але й також давав акумулювання високих титрів 7 UA 112054 C2 5 10 15 20 25 30 35 40 45 50 55 60 таксадієну та таксадієн-5α-олу (~300 мг/л та 60 мг/л, відповідно) в маломасштабних ферментаціях, таким чином ілюструючи потенціал мікробіологічного виробництва таксолу та його похідних. Даний винахід не обмежується в своєму застосуванні детальним описом створення та класифікації компонентів, наведеному далі в наступному описі або проілюстрованому в кресленнях. Винахід припускає інші втілення та практичне застосування або виконання різними шляхами. До того ж, фразеологічні вирази та термінологія, використана в даному документі з метою опису, не повинна розглядатися як обмеження. Застосування термінів "включаючи", "містячи", або "маючи", "вміщуючи", "маючи в своєму складі", та їх різновиди в даному документі, є способом охопити пункти перераховані в подальшому та їх еквіваленти, а також додаткові пункти. Мікробне продукування терпеноїдів, таких як таксадієн, продемонстровано в даному документі. Коли експресували на задовільних рівнях, мікробні шляхи різко знизили собівартість виробництва таких сполук. До того ж, вони використовують дешеву, широкодоступну та відновлювальну сировину для виробництва (таку як цукри та інші вуглеводні) та можуть бути джерелом для синтезу чисельних похідних, які можуть демонструвати набагато переважаючі властивості, ніж вихідна сполука. Ключовим елементом в економічно конкурентноспоможньому виробництві сполук ізопреноїдного шляху, включаючи мікробні напрямки є розширення цього шляху з метою дати можливість перевиробництву цих молекул. Описаними в даному документі є способи, що збільшують або розширюють ефективність в напрямку продукування терпеноїдів Escherichia coli (E. coli). Зокрема, способи, що забезпечують збільшення метаболічного потоку в напрямку синтеза ізопентеніл пірофосфату (IPP) (ключової проміжної сполуки для виробництва ізопреноїдних сполук), диметилаліл пірофосфату (DMAPP), гераніл дифосфату (GPP), фарнезил дифосфату (FPP), геранілгераніл дифосфату (GGPP) та фарнезилгераніл дифосфату (FGPP), паклітакселу (таксол), гінколідів, гераніолу, фарнезолу, геранілгераніолу, лінолоолу, ізопрену, монотерпеноїдів, таких як ментол, каротиноїдів, таких як лікопін, поліізопреноїдів, таких як поліізопрен або природний каучук, дитерпеноїдів, таких як елеутеробін, та секвітерпеноїдів, таких як артемізинін. Аспекти винаходу стосуються продукування терпеноїдів. Як використано в даному документі терпеноїд, також стосується ізопреноїду, є органічною хімічною похідною від п'яти-вуглецевої ізопренової одиниці. Декілька не обмежуючих прикладів терпеноїдів, класифікованих, ґрунтуючись на кількості ізопренових одиниць, яку вони містять в своєму складі, включають: напівтерпеноїди (1 ізопренова одиниця), монотерпеноїди (2 ізопренові одиниці), секвітерпеноїди (3 ізопренові одиниці), дитерпеноїди (4 ізопренові одиниці), сестертерпеноїди (5 ізопренових одиниць), тритерпеноїди (6 ізопренових одиниць), тетратерпеноїди (8 ізопренових одиниць) та політерпеноїди з більшим числом ізопренових одиниць. В деяких втіленнях, терпеноїд, що продукується, є таксадієном. В деяких втіленнях, терпеноїд, що продукується, є цитронеллолом, кубеболом, нуткатоном, цинеолом, лімоненом, елеутеробіном, саркодистиїном, псевдоптерозинами, гінклолідами, стевіозидом, ребаудіозидом A, склареолом, лабденедіолом, левопімарадієном, сандракопімарадієном або ізопемарадієном. Описані в даному документі способи та композиції для оптимізації продукування терпеноїдів в клітинах шляхом контрольованої експресії генів або протеїнів, що приймають участь в шляху проти ходу транскрипції та шляху по ходу транскрипції. Шлях проти ходу транскрипції включає продукування ізопентил пірофосфату (IPP) та диметилаліл пірофосфату (DMAPP), яке може бути досягнуте двома різними метаболічними шляхами: шляхом мевалонової кислоти (MVA) та шляхом MEP (2-C-метил-D-еритрітол 4-фосфат), що також називають шляхом MEP/DOXP (2-Cметил-D-еритрітол 4-фосфат/1-деокси-D-ксилулоза 5-фосфат), немевалонатним шляхом або шляхом незалежним від мевалонової кислоти. Шлях по ходу транскрипції є синтетичним шляхом, що призводить до продукування терпеноїдів та включає експресію рекомбінантного гену ферменту терпеноїд-синтази (також згадується як терпенциклаза), та ферменту геранілгераніл дифосфат синтази (GGPPS). В деяких втіленнях, фермент терпеноїд-синтази є ферментом дитерпеноїд-синтази. Декілька нелімітуючих прикладів ферментів дитерпеноїд-синтази включає касбен-синтазу, таксадієнсинтазу, левопімарадієн-синтазу, абієтадієн-синтазу, ізопімарадієн-синтазу, ent-копаліл дифосфат синтазу, syn-стемар-13-єн-синтазу, syn-стемод-13(17)-єн-синтазу, syn-пімара-7,15дієн-синтазу, ent-сандаракопімарадієн-синтазу, ent-касса-12,15-дієн-синтазу, ent-пімара-8(14), 15-дієн синтазу, ent-каур-15-єн-синтазу, ent-каур-16-єн-синтазу, афідиколан-16β-ол-синтазу, філокладан-16α-ол-синтазу, фузікокка-2,10(14)-дієн-синтазу та терпентетрієн-циклазу. Неочіковано, як продемонстровано в розділі Приклади, оптимізація синтезу терпеноїду за допомогою маніпуляцій з шляхами проти ходу транскрипції та по ходу транскрипції, яка описана 8 UA 112054 C2 5 10 15 20 25 30 35 40 45 50 55 60 в данному документі, не була просто лінійним або адитивним процесом. Більш переважно, впродовж комплексного комбінаторного аналізу, оптимізацію досягали за рахунок врівноважування компонентів шляхів проти ходу транскрипції та по ходу транскрипції. Неочиковано, як продемонстровано на Фігурах 1 та 2, на яких показано акумулювання таксадієну в строго нелінійній залежності від відносних інтенсивностей шляхів проти ходу транскрипції MEP та по ходу транскрипції синтетичного таксадієну. Аспекти винаходу стосуються контролю експресії генів та протеїнів в MEP шляху для оптимізованого продукування терпеноїду, такого як таксадієн. Оптимізоване вирбництво терпеноїду стосується продукування більшої кількості терпеноїду, слідуючи проведеню стратегії оптимізації, ніж та, що була б досягнута за відсутності такої стратегії. Слід прийняти до уваги, що способи та композиції, описані в даному документі охоплюютьбудь-який ген та/або протеїн з MEP шляхом. В деяких втіленнях, ген з MEP шляхом є одним з наступних: dxs, ispC, ispD, ispE, ispF, ispG, ispH, idi, ispA або ispB. Експресія одного або більше генів та/або протеїнів з MEP шляхом може бути підвищуючи регульованою та/або знижуючи регульованою. В конкретних втіленнях, підвищена регуляція одного або більше генів та/або протеїнів з MEP шляхом може бути комбінованою з пониженою регуляцією одного або більше генів та/або протеїнів з MEP шляхом. Слід прийняти до уваги, що гени та/або протеїни можуть бути регульованими самостійно або в комбінації. Наприклад, експресія dxs може бути підвищуючи регульованою або знижуючи регульованою самостійно або в комбінації з підвищеною регуляцією або з пониженою регуляцією експресії одного або більше ispC, ispD, ispE, ispF, ispG, ispH, idi, ispA та ispB. Експресія ispC може бути підвищуючи регульованою або знижуючи регульованою самостійно або в комбінації з підвищеною регуляцією або з пониженою регуляцією експресії одного або більше dxs, ispD, ispE, ispF, ispG, ispH, idi, ispA та ispB. Експресія ispD може бути підвищуючи регульованою або знижуючи регульованою самостійно або в комбінації з підвищеною регуляцією або з пониженою регуляцією експресії одного або більше dxs, ispC, ispE, ispF, ispG, ispH, idi, ispA та ispB. Експресія ispE може бути підвищуючи регульованою або знижуючи регульованою самостійно або в комбінації з підвищеною регуляцією або з пониженою регуляцією експресії одного або більше dxs, ispC, ispD, ispF, ispG, ispH, idi, ispA та ispB. Експресія ispF може бути підвищуючи регульованою або знижуючи регульованою самостійно або в комбінації з підвищеною регуляцією або з пониженою регуляцією експресії одного або більше dxs, ispC, ispD, ispE, ispG, ispH, idi, ispA та ispB. Експресія ispG може бути підвищуючи регульованою або знижуючи регульованою самостійно або в комбінації з підвищеною регуляцією або з пониженою регуляцією експресії одного або більше dxs, ispC, ispD, ispE, ispF, ispH, idi, ispA та ispB. Експресія ispH може бути підвищуючи регульованою або знижуючи регульованою самостійно або в комбінації з підвищеною регуляцією або з пониженою регуляцією експресії одного або більше dxs, ispC, ispD, ispE, ispF, ispG, idi, ispA та ispB. Експресія idi може бути підвищуючи регульованою або знижуючи регульованою самостійно або в комбінації з підвищеною регуляцією або з пониженою регуляцією експресії одного або більше dxs, ispC, ispD, ispE, ispF, ispG, ispH, ispA and ispB. Експресія ispA може бути підвищуючи регульованою або знижуючи регульованою самостійно або в комбінації з підвищеною регуляцією або з пониженою регуляцією експресії одного або більше dxs, ispC, ispD, ispE, ispF, ispG, ispH, idi та ispB. Експресія ispB може бути підвищуючи регульованою або знижуючи регульованою самостійно або в комбінації з підвищеною регуляцією або з пониженою регуляцією експресії одного або більше dxs, ispC, ispD, ispE, ispF, ispG, ispH, idi та ispA. В деяких втіленнях, експресія гену та/або протеїну одного або більше з dxs, ispC, ispD, ispE, ispF, ispG, ispH та idi є підвищуючи регульованою в той час, як експресія гену та/або протеїну ispA та/або ispB є знижуючи регульованою. Експресія генів з MEP шляхом може бути регульованою в модульному способі. Як використано в даному документі, регуляція за допомогою модульного способу стосується регуляції кількох генів разом. Наприклад, в деяких втіленнях, кілька генів з MEP шляхом рекомбінантно експресують на суміжних ділянках ДНК, таких як оперон. Слід прийняти до уваги, що клітина, яка експресує такий модуль, може, крім того, експресувати один або більше генів з MEP шляхом або рекомбінантно, або ендогенно. Необмежуючий приклад модулю генів з MEP шляхом є модулем, що включає гени dxs, idi, ispD та ispF, як представлено в розділі Приклади, та посилаються в даному документі як dxs-idiispDF. Слід прийняти до уваги, що модулі генів з MEP шляхом, у відповідності з аспектами винаходу, можуть включати будь-які гени з MEP шляхом, в будь-якому порядку. Експресія генів та протеїнів з синтетичним шляхом по ходу транскрипції синтетичного терпеноїду, крім того, може бути регульованою з метою оптимізації продукування терпеноїду. 9 UA 112054 C2 5 10 15 20 25 30 35 40 45 50 55 60 Синтетичний шлях по ходу транскрипції синтезу терпеноїду включає рекомбінантну експресію ферменту терпеноїдсинтази та GGPPS ферменту. Будь-який фермент терпеноїдсинтази, як обговорювалось вище, може бути експресованим GGPPS в залежності від продукту по ходу транскрипції, що продукується. Наприклад, таксадієн-синтазу використовують для продукування таксадієну. Рекомбінантна експресія ферменту таксадієн-синтази та GGPPS ферменту можуть бути регульованими незалежно один від одного або разом. В деяких втіленнях два ферменти регулюються разом в модульному способі. Наприклад, два ферменти можуть бути експресованими в опероні в обох порядках (GGPPS-TS, також згадується як "GT", або TSGGPPS, також згадується як "TG"). Операції з експресії генів та/або протеїнів, включаючи модулі, такі як dxs-idi-ispDF оперон та TS-GGPPS оперон, можуть бути досягнуті за допомогою способів, відомих будь-якому кваліфікованому фахівцю з рівня техніки. Наприклад, експресія генів або оперонів може бути регульованою шляхом відбору промоторів, таких як індуковані промотори, з різною силою. Декілька необмежуючих прикладів промоторів включають Trc, T5 та T7. До того ж, експресія генів або оперонів може бути регульованою шляхом операції з числа копій гену або оперону в клітині. Наприклад, в конкретних втіленнях, штам, що містить додаткову копію dxs-idi-ispDF оперону на своїй хромосомі при Trc промоторі, контрольовано продукує підвищену кількість таксадієн по відношенню до тільки одного надекспресуючого синтетичного шляху по ходу транскрипції. В деяких втіленнях, експресія генів або оперонів може бути регульованою шляхом маніпулювання порядком генів в модулі. Наприклад, в конкретних втіленнях, зміна порядку генів в синтетичному опероні по ходу транскрипції від GT до TG призводить в результаті до 2-3кратного зростання продукування таксадієну. В деяких втіленнях, експресія генів або оперонів регулюється інтеграцією одного або більше генів або оперонів в хромосому. Наприклад, в конкретних втіленнях, інтеграція dxs-idi-ispDF оперону проти ходу транскрипції в хромосомі клітини призводить в результаті до підвищеного продукування таксадієну. Слід прийняти до уваги, що гени, відповідно до винаходу, можуть бути одержані з різних джерел. В деяких втіленнях, гени з MEP шляхом є бактеріальними генами, такими як гени Escherichia coli. В деяких втіленнях, ген, що кодує GGPPS, є рослинним геном. Наприклад, ген, що кодує GGPPS, може бути з виду Taxus, такого як Taxus canadensis (T. canadensis). В деяких втіленнях, ген, що кодує таксадієн-синтазу, є рослинним геном. Наприклад, ген, що кодує таксадієн-синтазу, може бути з виду Taxus, такого як Taxus brevifolia (T. brevifolia). Номера доступу для типових представників банку генів (GenBank) T. canadensis GGPPS та T. brevifolia таксадієн-синтазу забезпечуються AF081514 та U48796, послідовності яких включені як посилання в даному документі в усій їх повноті. Як будь-який з кваліфікованих фахівців в даній галузі був би поінформованим, що гомологічні гени для застосування в способах, пов’язаних з винаходом, можуть бути одержаними з інших видів та можуть бути ідентифікованими пошуком гомології, наприклад, використовуючи BLAST пошук протеїну, доступний в національному центрі біотехнологічної інформації (the National Center for Biotechnology Information (NCBI)) інтернет сайт (www.ncbi.nlm.nih.gov). Гени та/або оперони, відповідно до винаходу, можуть бути клонованими, наприклад шляхом PCR ампліфікації та/або рестрикції розщеплення, з ДНК з будь-якого джерела ДНК, яка містить наданий ген. В деяких втіленнях, ген та/або оперон, пов’язаний з винаходом, є синтетичним. Будь-який спосіб одержання гену та/або оперону, пов’язаного з винаходом, знаходиться в межах представленого винаходу. В деяких втіленнях, подальша оптимізація продукування терпеноїду досягається модифікуванням гену перед тим як його рекомбінантно експресують в клітині. В деяких втіленнях, GGPPS фермент має одну або більше з наступних мутацій: A162V, G140C, L182M, F218Y, D160G, C184S, K367R, A151T, M185I, D264Y, E368D, C184R, L331I, G262V, R365S, A114D, S239C, G295D, I276V, K343N, P183S, I172T, D267G, I149V, T234I, E153D та T259A. В деяких втіленнях, GGPPS фермент має мутацію в залишку S239 та/або залишку G295. В конкретних втіленнях, GGPPS фермент має мутацію S239C та/або G295D. В деяких втіленнях, модифікування гену, перед тим як його рекомбінантно експресують в клітині, включає оптимізацію кодону для експресії в бактеріальній клітині. Застоссування кодону для різноманітності організмів можуть бути досягнені за допомогою бази даних Codon Usage Database (www.kazusa.or.jp/codon/). Оптимізація кодону, включаючи ідентифікацію оптимальних кодонів для різноманітності організмів, та способи досягнення оптимізації кодону, є відомими для будь-якого кваліфікованого фахівця з рівня техніки, та можуть бути досягнені, застосовуючи стандартні способи. В деяких втіленнях, модифікування гену, перед тим як його рекомбінантно експресують в клітині, включає проведення однієї або більше мутацій в гені, перед тим як його рекомбінантно 10 UA 112054 C2 5 10 15 20 25 30 35 40 45 50 55 60 експресують в клітині. Наприклад, мутація може включати заміну або делецію одиничного нуклеотиду або декількох нуклеотидів. В деяких втіленнях, мутація одного або більше нуклеотидів в гені призведе в результаті до мутації в протеїні, продукованого з гену, такої як заміщення або делеція однієї або більше амінокислот. В деяких втіленнях, може бути прийнятним використання клітини, яку оптимізували для продукування терпеноїду. Наприклад, в деяких втіленнях використовують клітину, що надекспресує один або більше компонентів немевалонатного (MEP) шляху, щонайменше, частково, для ампліфікування ізопентил дифосфату (IPP) та диметилаліл дифосфату (DMAPP), субстратів GGPPS. В деяких втіленнях, надекспресія одного або більше компонентів немевалонатного (MEP) шляху досягається збільшенням числа копій одного або більше компонентів немевалонатного (MEP) шляху. Наприклад, число копій компонентів на стадіях, лімітуючих швидкість, в MEP шлясі, таких як (dxs, ispD, ispF, idi) можуть бути імпліфікованими, таким чином як за допомогою додаткової епісомальної експресії. В деяких втіленнях "раціональна розробка" включають в побудову специфічних мутацій в протеїнах, таких як ферменти. Як використано в даному локументі, "раціональна розробка" стосується поєднання знань про фермент або близьких до ферментів, таких як його тривимірну структуру, його активний(і) сайт(и), його субстрат(и) та/або взаємодію між ферментом та субстратом, в розробці специфічної мутації. Мутації, які основані на підході раціональної розробки, можуть бути створені в ферменті, які потім можуть скринінгувати за підвищеним продукуванням терпеноїду по відношенню до контрольних рівнів. В деяких втіленнях, мутації можуть бути раціонально розробленими, ґрунтуючись на моделюванні гомології. Як використано в даному документі, "моделювання гомології" стосується процесу конструювання моделі з роздільною здатністю до атомів одного протеїну з його амінокислотної послідовності та тривимірної структури близького гомологічного протеїну. В деяких втіленнях, в гені, такому як ген, що кодує фермент, можуть відбуватися випадкові мутації, та дані мутації можуть бути скринінговані за підвищеним продукуванням терпеноїду по відношенню до контрольних рівнів. Наприклад, скринінгування за мутаціями в компонентах MEP шляху, або компонентах інших шляхів, що призводить до підвищенного продукування терпеноїду, може бути проведене за допомогою відбору за випадковим мутагенезом, або за допомогою скринінгу відомих мутацій. В деяких втіленнях, клонування за способом "шотган" геномних фрагментів могло б використовуватися для ідентифікації геномних ділянок, що призводить до зростання продукування терпеноїду, за рахунок скринінгу клітин або організмів, що мають дані фрагменти для підвищенного продукування терпеноїду. В деяких випадках одна або більше мутацій можуть поєднуватися в одній тій самій клітині або організмі. В деяких втіленнях, продукування терпеноїду клітиною може бути підвищене за рахунок проведеня маніпуляцій з ферментами, що діють на той самий шлях, що й ферменти, відповідно до винаходу. Наприклад, в деяких втіленнях може бути прийнятним зростання експресії ферменту або іншого фактору, що діє проти ходу транскрипції ферменту мішені, такого як фермент, відповідно до винаходу. Це могло б досягатися над експресією фактору проти ходу транскрипції, використовуючи будь-який стандартний спосіб. Оптимізація експресії протеїну, крім того, може досягатись за рахунок проведення відбору відповідних промоторів та сайтів, зв’язуючих рибосоми. В деяких втіленнях це може включати відбір великого числа копій плазмід, або низької, або середньої кількості копій плазмід. Стадія термі нації транскрипції, крім того, може бути націлена на регуляцію експресії гену за рахунок введення або видалення структур, таких як стовбурові петлі. Аспекти винаходу стосуються експресії рекомбінантних генів в клітинах. Винахід охоплює будь-який тип клітини, що рекомбінантно експресує гени відповідно до винаходу, включаючи прокаріотні та еукаріотні клітини. В деяких втіленнях клітина є бактеріальною клітиною, такою як Escherichia spp., Streptomyces spp., Zymonas spp., Acetobacter spp., Citrobacter spp., Synechocystis spp., Rhizobium spp., Clostridium spp., Corynebacterium spp., Streptococcus spp., Xanthomonas spp., Lactobacillus spp., Lactococcus spp., Bacillus spp., Alcaligenes spp., Pseudomonas spp., Aeromonas spp., Azotobacter spp., Comamonas spp., Mycobacterium spp., Rhodococcus spp., Gluconobacter spp., Ralstonia spp., Acidithiobacillus spp., Microlunatus spp., Geobacter spp., Geobacillus spp., Arthrobacter spp., Flavobacterium spp., Serratia spp., Saccharopolyspora spp., Thermus spp., Stenotrophomonas spp., Chromobacterium spp., Sinorhizobium spp., Saccharopolyspora spp., Agrobacterium spp. та Pantoea spp. Бактеріальна клітина може бути грам-негативною клітиною, такою як клітина Escherichia coli (E. coli), або грампозитивною клітиною, такою як вид Bacillus. В інших втіленнях клітина є грибковою клітиною, такою як дріжджова клітина, наприклад, Saccharomyces spp., Schizosaccharomyces spp., Pichia spp., Paffia spp., Kluyveromyces spp., Candida spp., Talaromyces spp., Brettanomyces spp., 11 UA 112054 C2 5 10 15 20 25 30 35 40 45 50 55 Pachysolen spp., Debaryomyces spp., Yarrowia spp., та промислово поліплоїдні дріжджові штами. Переважно штам дріжджів є S. cerevisiae штамом або Yarrowia spp. штамом. Інші приклади грибів включають Aspergillus spp., Pennicilium spp., Fusarium spp., Rhizopus spp., Acremonium spp., Neurospora spp., Sordaria spp., Magnaporthe spp., Allomyces spp., Ustilago spp., Botrytis spp. та Trichoderma spp. В інших втіленнях, клітина є водостевою клітиною або рослинною клітиною. Слід прийняти до уваги, що деякі клітини відповідно до винаходу можуть експресу вати ендогенну копію одного або більше генів відповідно до винаходу, а також рекомбінантну копію. В деяких втіленнях, якщо клітина має ендогенну копію одного або більше генів відповідно до винаходу, тоді не буде необхідності способу вимагати додавання рекомбінантної копії гену(ів), які є ендогенно експресованими. В деяких втіленнях клітина може ендогенно експресу вати один або більше ферментів з шляху, що є описаним в даному документі, та може рекомбінантно експресу вати один або більше інших ферментів з шляхів, описаних в даному документі, для ефективного продукування терпеноїдів. Наступні аспекти винаходу стосуються скринінгу бактеріальних клітин або штамів, що демонструють оптимізоване продукування терпеноїду. Як описано вище, способи відповідно до винаходу включають генеруючи клітини, які надекспресують один або більше генів MEP шляху. Продукування терпеноїду культурами таких клітин може бути виміряне та порівняне з контрольною клітиною, в якому клітина, що демонструє більшу кількість продукуваного терпеноїду по відношенню до контрольної клітини, є вибраною як перша покращена клітина. Клітина може бути далі модифікованою за рахунок використання рекомбінантної експресії ферменту терпеноїд-синтази та GGPPS ферменту. Рівень експресії одного або більше компонентів немевалонатного (MEP) шляху, ферменту терпеноїд-синтази та/або GGPPS ферменту в клітині далі може бути регульованим та продукування терпеноїду може бути виміряне знову, що призводить до відбору другої покращеної клітини, яка продукує більшу кількість терпеноїду, ніж перша покращена клітина. В деяких втіленнях, фермент терпеноїдсинтази є ферментом таксадієн-синтази. Наступні аспекти винаходу стосуються ідентифікації та характеристики (за допомогою ГХМС) раніше невідомого метаболіту бактеріальних клітин E. coli (Фігури 3 та 6). Рівень акумулювання заново ідентифікованого метаболіту, індолу, може бути контрольованим генетично обробляючи мікробний шлях надекспресією, знижуючою регуляцією або мутацією генів ізопреноїдного шляху. Метаболіт-індол не знаходиться в співвідношенні як прямий параметр продукування таксадієну в інженерних штамах (Фігури 3, 6 та 15). Подальший контроль акумулювання індолу для корегування ефективності в напрямку біосинтезу терпеноїду в бактеріальних системах (зокрема в клітинах, таких як клітини E. coli) або інших клітинах, може бути досягнутий врівноваженням немевалонатного шляху проти ходу транскрипції ізопреноїду з шляхами по ходу транскрипції синтезу продукту, або модифікаціями або регуляцією індольного шляху. Тим самим, кваліфікований фахівець може знизити або контролювати акумулювання індолу та, таким чином, знизити інгібуючу дію індолу на продукування таксадієну та інших терпеноїдних похідних, з описаних шляхів, таких як: монотерпеноїди, секвітерпеноїди (включаючи аморфадієн), дитерпеноїди (включаючи левопімарадієн), тритерпени та тетратерпени. Інші способи зниження або контролювання акумулювання індолу включають видалення акумульованого індолу з ферментації за допомогою хімічних способів, такиї як застосування абсорбентів, поглиначів, тощо. В інших втіленнях, передбачається, що способи включають вимірювання кількості або концентрації індолу в клітині, що продукує один або більше терпеноїдів або в культурі клітин, що продукують один або більше терпеноїдів. Кількість або концентрацію індолу можуть вимірювати один раз, або двічі, або більше разів, як прийнятно, використовуючи способи, відомі з рівня техніки, та як описано в даному документі. Такі способи можуть застосовувати для керування процесами продукування одного або більше терпеноїдів, наприклад в процесі покращення. Такі способи можуть використовувати для керування процесом конструювання штаму, наприклад, для покращення штаму. Для ідентифікації засобів, щоб досягти дане балансування одержаного 15000-кратного покращення в надпродукуванні терпеноїдів, таких як таксадієн, в порівнянні з немутованим типом бактеріальних клітин, експресованих біосинтетичним шляхом гетерологічного таксадієну. Продукування, до того ж, підвищували за рахунок використання модифікованих способів ферментації, що на виході давало концентрацію близько 2 г/л, яка є в 1500 разів вищою в порівнянні з будь-яким раніше повідомленим продукуванням таксадієну. Як продемонстровано в цьому документі, на даний момент, акумулювання даного метаболіту може бути контрольованим за рахунок генетично розробленого немевалонатного шляху ізопреноїду в E. 12 UA 112054 C2 5 10 15 20 25 30 35 40 45 50 55 coli, який регулює ефективність в напрямку біосинтезу ізопреноїду в бактеріальних клітинах E. coli. Крім того, продемонстрованим в даному документі є подальше каналізування продукування таксадієну в наступному ключовому попереднику до таксолу, таксадієн-5-олу, що досягається за рахунок розробки хімії окиснення для біосинтезу таксолу. Приклад 5 представляє перше вдале поширення синтетичного шляху від таксадієну до таксадієн-5-олу. Подібний до більшості інших терпеноїдів, біосинтез таксолу наслідує уніфікований спосіб "двофазного" біосинтетичного процесу, (i) "циклазна фаза" лінійне сполучення пренільних попередників (IPP та DMAPP) до GGPP з наступною молекулярною циклізацією та перегрупуванням комутованого 57, 58 попередника таксадієну (Фігура 6,VIII-IX). Потім комутований попередник, (ii) "фаза окиснення", циклічний олефіновий фібрилярний центр таксадієну далі функціоналізують сімома цитохром P450 оксигеназами разом з його окисно-відновними партнерами, оформленими з двома ацетатними групами та бензоатною групою ацилом або ароїлом CoA-залежних трансфераз, кетогрупою кетооксидази, та епоксидною групою епоксидази, призводить до пізньої проміжної сполуки баккатину-III, до якого C13 бічним ланцюгом приєднують таксол ((Фігура 6, X15 XIII). Незважаючи на те, що прогнозують приблизний послідовний порядок раньої фази окиснення реакцій, точні розрахунки часу/терміни деяких реакцій гідроксилювань, ацилювань та бензоїлувань є навизначеними. Однак, зрозуміло, що початкове розгалуження починається з цитохром p450 опосередкованого гідроксилювання таксадієнового центру в C5 положенні з наступними по ходу транскрипції гідроксилюваннями, використовуючи гомологічне сімейство цитохром p450 ферментів з високою виведеною подібністю один до одного (>70%), але з 41,59 обмеженою схожістю (70%), але низьку подібність (98% перетворення таксадієну in vivo з акумульованого продукту до ~60 мг/л, 2400 кратне покращення порівняно з попередньою гетерологічною експресією в дріжджах. В наслідок цього дане дослідження вдалося не тільки в синтезуванні значно більших кількостей ключових проміжних сполук таксолу, але й забезпечити основу для синтезу подальших метаболітів в шляху за рахунок подібної P450 хімії. Попередні дослідження взаємовідношення структура-активність для таксолу показали, що зміни, зроблені або за рахунок видалення або приєднання деяких його функціональних груп 1, 48 суттєво не змінювали активність таксолу. Такі дослідження, однак, були обмеженними через обмеження здатності вводити зміни за допомогою хімічного синтезу. Доступність мікробного шляху для синтезу таксолу суттєво розширить простір хімічного модифікування, що може розглядати, таким чином, зростання можливості ідентифікування більш ефективних кандидатів у лікарські засоби. Це викликає пропозиції нових можливостей для розробки лікарських засобів, особливо, якщо врахувати, що такі кандидати в лікарські засоби також будуть пов’язані з ефективними шляхами виробництва. В останні кілька десятиліть, таксол викликав більший інтерес в наукових колах та у широкої 10 громадськості, ніж будь-який інший природній продукт, кандидат в лікарський засіб. Серйозну кризу в забезпеченні передбачали, виходячи з прогнозованого збільшення застосування таксолу або аналогів таксолу для хіміотерапії раку, що вимагає нових шляхів виробництва, 8 таких як інженерінг біосинтетичного механізму таксолу в мікробах. Незважаючи на те, що декілька ендофітних грибів виду Taxus були виділеними та здатні до продукування таксолу в природі, дані мікробні системи ще повинні були продемонструвати придатність для сталого 49 виробництва лікарського засобу. Результати наведені вданому документі, представляють руйнуючу стадію по напрямку до таксолу, мікробного походження, або попередника таксолу, за рахунок усунення вузьких місць в шляху комітованого попередника. Більш того, створення синтетичного шляху відкриває нові можливості до варіювання аналогами таксолу за рахунок використання селективно інженерного шляху, таким чином, змінюючи такса нову структуру. Дані розробки підвищують оптимізм для мікробного шляху для економічно ефективного виробництва таксолу або прийнятних попередників таксолу. Таблиця 1. Розташування експресії шляху проти ходу транскрипції та по ходу транскрипції в умовних одиницях (ум.од.). Рівні експресії MEP шлях та шляху GGPP синтаза/таксадієн-синтаза були встановлені, використовуючи опубліковані значення єфективностей промоторів та числа копій. Ефективності промотора розраховували як trc=1, T5=1,96, T7=4,97, ґрунтуючись на 33, 34 Brosius et. al. and Brunner et. al. Число копії гену визначали за опублікованими числами копій для вихідних реплікацій для різних використаних плазмід, та одну копію використовували для 35-37 інтеграцій. Загальну експресію розраховували як продукт ефективності промотора та числа копії гену. Нативну експресію MEP шляху умовно приймали за значення один, та змінення порядку оперона GGPP синтази та таксадієну приймали за дію експресії таксадієн-синтази за 35 20%. Дані припущення загальної експресії регулювали інженерінгову активність. E - E coli K12 24 UA 112054 C2 5 MG1655 з двома делеціями ΔrecAΔendA; EDE3 - K12 MG1655 ΔrecAΔendA з T7 RNA інтегрованою полімеразою (DE3); MEP - dxs-idi-ispDF оперон; GT - GPPS-TS оперон; TG - TSGPPS оперон; Ch1 - 1 копія в хромосомі; Trc - trc промотор; T5 - T5 промотор; T7 - T7 промотор; p5 - ~5 копія плазміди (pSC101); , p10 - ~10 копія плазміди (p15A); та p20 - ~20 копія плазміди (pBR322). 25 UA 112054 C2 Таблиця 2 Детальний опис всіх плазмід, конструйованих для дослідження Плазміда Початок реплікації Маркер антибіотику 1 p20T7MEP pBR322 Amp 2 p20TrcMEP pBR322 Amp 3 p20T5MEP pBR322 Amp 4 p20T7MEPKmFRP pBR322 Km 5 p20T5MEPKmFRP pBR322 Km 6 p20TrcMEPKm-FRP pBR322 Km 7 p10TrcMEP p15A Cm 8 p5TrcMEP SC101 Spect № 9 p20TrcGT pBR322 Amp 10 p20TrcTG pBR322 Amp 11 p20T5GT pBR322 Amp 12 p10T7TG p15A Cm 13 p5T7TG SC101 Spect 14 p10At8T5OH-tTCPR p15A Cm 15 p10At24T5OH-tTCPR p15A Cm 16 p10At42T5OH-tTCPR p15A Cm 5 26 UA 112054 C2 27 UA 112054 C2 28
ДивитисяДодаткова інформація
Автори англійськоюAjikumar, Parayil, K., Stephanopoulos, Gregory, Phon, Too, Heng
Автори російськоюАджикумар Парайил К., Стефанопулос Грегори, Фон Ту Хенг
МПК / Мітки
МПК: C12P 23/00
Мітки: інженерія, шляхом, фармацевтичних, продуктів, хімічних, мікробіологічна, одержання, ізопреноїдним
Код посилання
<a href="https://ua.patents.su/85-112054-mikrobiologichna-inzheneriya-dlya-oderzhannya-khimichnikh-ta-farmacevtichnikh-produktiv-izoprenodnim-shlyakhom.html" target="_blank" rel="follow" title="База патентів України">Мікробіологічна інженерія для одержання хімічних та фармацевтичних продуктів ізопреноїдним шляхом</a>
Попередній патент: Одержання кормових відходів у виробництві етанолу
Наступний патент: Солі 4-[2-[[5-метил-1-(2-нафталініл)-1н-піразол-3-іл]оксі]етил]морфоліну
Випадковий патент: Спосіб автоматичного керування другим корпусом вакуум-випарної установки для виробництва томат-пасти