Спосіб отримання 2′-дезоксі-5-азацитидину (децитабіну)
Формула / Реферат
1. Спосіб отримання 2'-дезоксі-5-азацитидину (Децитабіну), що включає отримання сполуки формули (І):
 (І)
(І)
де:
R є замісником, що видаляється, відомим per se, переважно (С1-С8)алкілкарбонілом, або таким, що можливо містить замісники фенілкарбоніл, або таким, що можливо містить замісники бензилкарбоніл;
R1 є замісником, що видаляється, переважно галогеном, переважно хлором, бромом, фтором, переважно хлором, або імідатом, переважно трихлорметилімідатом, або тіоалкільним похідним, переважно -S-метилом;
далі, отримання силільованої основи формули (II):
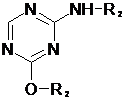 , (II)
, (II)
де R2 є захисною групою, переважно триметилсиліловим (TMS) залишком;
здійснення взаємодії сполуки формули (І) і сполуки формули (II) у прийнятному безводому розчиннику і в присутності прийнятного каталізатора з отриманням сполуки формули (III):
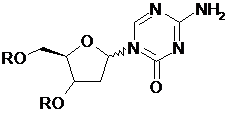 , (III)
, (III)
і видалення замісників R із отриманням вказаної сполуки, що є 2'-дезоксі-5-азацитидином (Децитабіном), при цьому вказаний каталізатор вибирають з групи, що включає сіль аліфатичної сульфокислоти або сіль сильної кислоти.
2. Спосіб отримання сполуки формули (III) за п. 1, що включає отримання сполуки формули
 , (І)
, (І)
у якій
R є замісником, що видаляється, відомим в per se, переважно (С1-С8)алкілкарбонілом, або таким, що можливо містить замісники фенілкарбоніл, або таким, що можливо містить замісники бензилкарбоніл;
R1 є замісником, що видаляється, переважно галогеном, переважно хлором, бромом, фтором, переважно хлором, або імідатом, переважно трихлорметилімідатом, або тіоалкільним похідним, переважно -S-метилом;
далі, отримання силільованої основи формули (II):
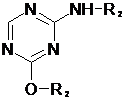 , (II)
, (II)
в якій R2 є захисною групою, переважно триметилсиліловим (TMS) залишком;
здійснення взаємодії сполуки формули (І) і сполуки формули (II) у прийнятному безводому розчиннику і в присутності прийнятного каталізатора з отриманням сполуки формули (III), при цьому вказаний каталізатор вибирають з групи, що включає сіль аліфатичної сульфокислоти або сіль сильної кислоти.
3. Спосіб за пп. 1 або 2, який відрізняється тим, що каталізатор, що використовується у вказаній реакції, є сіллю аліфатичної сульфокислоти, переважно метилсульфокислоти або етилсульфокислоти, або сіллю фторованої аліфатичної сульфокислоти, переважно трифторметансульфокислоти, пентафторетилсульфокислоти або гептафторпропілсульфокислоти.
4. Спосіб за п. 3, який відрізняється тим, що каталізатор є сіллю метилсульфокислоти та/або солі трифторметансульфокислоти.
5. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що каталізатор є сіллю лужного металу або сіллю лужноземельного металу, переважно сіллю літію, натрію, калію або магнію, переважно сіллю літію.
6. Спосіб за будь-яким з пп. 1-5, який відрізняється тим, що каталізатор є метилсульфокислотою літію та/або трифторметансульфонатом літію.
7. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що каталізатор вибирають з солей, що включають солі скандію, переважно Sc(OTf)3, цинку, переважно Zn(OTf)2, або міді, переважно Cu(OTf)2.
8. Спосіб за п. 1 або 2, який відрізняється тим, що каталізатор є сіллю сильної кислоти, що складається з катіона і ненуклеофільного аніона, який не утворює комплексу з вказаним катіоном у розчині, переважно вибраної з групи, що включає: MBPh4, MB(Me)4, MPF6, MBF4, MCIO4, MBrO4, MJO4, M2SO4, MNO3, і М3РО4, переважно MBPh4, MB(Me)4, MPF6, MBF4, MCIO4, MBrO4, MJO4, а каталізатор переважно є сіллю перхлорної кислоти і тетрафторборної кислоти.
9. Спосіб за п. 8, який відрізняється тим, що каталізатор є сіллю лужного металу або сіллю лужноземельного металу, переважно сіллю літію, натрію, калію або магнію, переважно сіллю літію, переважно перхлоратом літію і тетрафторборатом літію.
10. Спосіб за п. 8, який відрізняється тим, що каталізатор є сіллю скандію, цинку або міді.
11. Спосіб за будь-яким з пп. 1-10, який відрізняється тим, що розчинник для проведення реакції вибирають з групи, що включає органічні розчинники, переважно бензол, толуол, ксилол, або хлоровані розчинники, переважно дихлорметан, дихлоретан, хлороформ, хлорбензол або толуол, ксилол, або ацетонітрил, пропіленкарбонат і аналогічні розчинники.
12. Спосіб за п. 11, який відрізняється тим, що розчинник для проведення реакції вибирають з органічних розчинників, переважно толуолу і ксилолу, і хлорованих розчинників, переважно з хлорованих розчинників.
13. Спосіб за будь-яким з пп. 1-10, який відрізняється тим, що каталізатор є трифторметансульфонатом літію і розчинник вибирають з органічних розчинників, переважно толуолу і ксилолу, і хлорованих розчинників, переважно дихлорметану, дихлоретану, хлороформу і хлорбензолу.
14. Спосіб за будь-якиму з пп. 1-13, який відрізняється тим, що замісник R, що видаляється, є (С1-С4)алкілкарбонілом або таким, що можливо містить замісники фенілкарбоніл або бензилкарбоніл, переважно фенілкарбоніл, толілкарбоніл, ксилілкарбоніл; переважно ацетил або пара-хлорфенілкарбоніл.
15. Спосіб за будь-яким з пп. 1-14, який відрізняється тим, що замісник R1, що видаляється, є -О-ацил(С1-С4), -О-алкіл(С1-С4) або хлором, переважно -О-(О)ССН3 або хлором, переважно хлором.
Текст
Реферат: Спосіб отримання 2'-дезоксі-5-азацитидину (Децитабіну) шляхом отримання сполуки формули (І), в якій R є замісником, що видаляється, відомий per se; a R1 є замісником, що видаляється; далі отримання силілованої основи формули (II), в якій R2 є захисною групою, бажано триметилсиліловим (TMS) залишком; здійснення взаємодії сполуки формули (І) і сполуки формули (II) у прийнятному безводому розчиннику і у присутності прийнятного каталізатора; і видалення замісників R з отриманої сполуки, з отриманням вказаної сполуки, що є 2'-дезоксі-5азацитидином (Децитабіном), при цьому вказаний каталізатор вибирають з групи, що включає сіль аліфатичної сульфокислоти або сіль сильної неорганічної кислоти. UA 101482 C2 (12) UA 101482 C2 UA 101482 C2 5 10 15 20 25 30 35 40 45 50 Даний винахід відноситься до способу отримання 2'-дезокси-5-азацитидина (Децитабіна) шляхом приведення у взаємодію глікозильного донора, бажано 1-галоген-похідного, або імідата, бажано трихлорметил-похідного, або тіоалкіл-похідного захищеного моносахариду з вибраною силільованою основою у присутності вибраного каталізатора. Рівень техніки Децитабін є нуклеозидом і є відомою фармацевтично активною сполукою. В US 3,817,980 описаний спосіб синтезу нуклеозидів шляхом силілювання відповідної основи нуклеозида і приведення у взаємодію силільованої основи з глікозильним донором, бажано з 1-галогенпохідним захищеного моносахариду у присутності вибраного каталізатора. Каталізатори, що застосовуються, можуть бути вибрані, наприклад, з SnCI4, ТіСl4, ZnCl2, ВF3-ефірата, АІСІ3 і SbCI5. Основним недоліком є те, що ці каталізатори схильні до гідролізу, в результаті якого утворюються продукти гідролізу, які спричиняють дратівливу дію, такі як НСІ, та/або утворюють нерозчинні оксиди (ТіО2, SnO2), які складно відокремити від продукту реакції. З цими каталізаторами складно працювати, особливо при крупномасштабному виробництві. У US-A-4 082 911 описаний аналогічний процес здійснення взаємодії силільованої основи нуклеозида з захищеним похідним цукру і запропоновано застосування як каталізатора триалкілсилілового ефіру сильної органічної кислоти, такого як триметилсилілтрифторметансульфонат. В US-A-4 209 613 запропонований спосіб, вдосконалений в порівнянні зі способом, описаним в US-A-4 082 911, завдяки проведенню в одну стадію процесу, згідно якому триалкілсиліловий ефір вказаної сильної органічної кислоти, такий як триметилсилілтрифторметансульфонат, утворюється in situ з вільної кислоти шляхом реакції вільної кислоти з силілюючим агентом, наприклад, триалкілхлорсиланом, який присутній у прийнятній молярній кількості. Силілюючі агенти, такі як триалкілхлорсилан, мають високу реакційну здатність і швидко реагують з утворенням триалкілсилілового ефіру вільної кислоти, що присутня в реакційній суміші. Опис винаходу На даний час виявлено, що 1-галоген-похідне для моносахариду можна привести у взаємодію з силільованим або алкілованим 5-азацитозином у присутності солі як каталізатора, при цьому вказаний каталізатор вибирають з групи, що включає сіль аліфатичної сульфокислоти, наприклад трифторметансульфонат, або сіль сильної неорганічної кислоти, наприклад перхлорат. При цьому відсутня необхідність використання сполуки ефіру як каталізатора, внаслідок чого сильно спрощується отримання 2'-дезокси-5-азацитидина (Децитабіна), як описано в даному винаході. Більше того, застосування каталізатора згідно даному винаходу забезпечує досягнення підвищеної вибірковості по відношенню до бетаізомеру (β-ізомеру), наприклад, вибірковості, що складає щонайменше 1:2. Реакцію згідно даному винаходу можна вести таким чином, що приблизно три чверті виходу реакції складатиме бета-ізомер, і, залежно від конкретних умов реакції, відношення альфа-ізомеру до бета-ізомеру складатиме 12:88. Додатково, згідно даному винаходу, можна досягти виходу реакції, вище ніж 95 %, і зазвичай досягається вихід 97-99 %, з розрахунку на сумарну кількість аномерів, присутніх у кінцевій неочищеній реакційній, суміші. Каталізатор, що використовується згідно даному винаходу, характеризується стабільністю у водному середовищі, зручний у використанні, не викликає утворення дратівливих продуктів гідролізу і може бути легко відокремлений від продуктів реакції. Додатково, вибірковість реакції для отримання бажаного аномеру, тобто співвідношення альфа/бета аномерів, і кінцевий вихід значно покращені. Даний винахід визначений у формулі винаходу. Даний винахід відноситься до способу отримання 2'-дезокси-5-азацитидина (Децитабіна), який включає отримання сполуки (захищеного похідного моносахариду) формули (І): у якій R є замісником (захисною групою), що видаляється, відомий per se, бажано (C1-C8) алкілкарбоніл, або фенілкарбоніл, що можливо містить замісники, або бензил карбоніл, що можливо містить замісники; 1 UA 101482 C2 R1 є замісником, що видаляється, бажано галоген, бажано хлор, бром, фтор, бажано хлор, або імідат, бажано трихлорметилімідат, або тіоалкільне похідне, бажано -S-метил; далі, отримання силільованої основи формули (II): 5 у якій R2 є захисною групою, бажано триметилсиліловий (TMS) залишок; здійснення взаємодії сполуки формули (І) і сполуки формули (II) у прийнятному безводому розчиннику у присутності прийнятного каталізатора, з отриманням сполуки формули (III): i 10 15 20 25 30 35 40 45 50 видалення замісника R, з отриманням вказаної сполуки 2'-дезокси-5-азацитидина (Децитабіна), при цьому вказаний каталізатор вибирають з групи, що включає сіль аліфатичної сульфокислоти або сіль сильної неорганічної кислоти. Даний винахід також відноситься до отримання сполуки формули (III) із застосуванням каталізатора згідно даного винаходу, що забезпечує бажану вибірковість, бажано по відношенню до бета-ізомеру (β-ізомеру), бажано при співвідношенні щонайменше 1:2, і так, аби при цьому бажано приблизно три чверті виходу реакції складав бета-ізомер. Бажаним є бетаглікозид формули (III). Якщо каталізатор, що використовується у вказаній реакції, є сіллю аліфатичної сульфокислоти, вказаний каталізатор бажано є сіллю мети л сульфокислоти (мезилата) або етилсульфокислоти, або є сіллю аліфатичної сульфокислоти, що містить фтор, таку як сіль трифторметансульфокислоти, пентафторетилсульфокислоти або гептафторпропілсульфокислоти. Якщо каталізатор, що використовується у вказаній реакції, є сіллю сильної неорганічної кислоти, вказаний каталізатор є сіллю, що складається з катіона, визначеного в даній заявці для солей сильної неорганічної кислоти, і не нуклеофільного аніона. Вказаний не нуклеофільний аніон не утворює комплексу з вказаним катіоном в розчині. Бажано вказану сіль сильної неорганічної кислоти вибирають з групи, що включає: MBPh 4, MB(Me)4, MPF6, MBF4, МСІО4, МВrO4, MJO4, M2SO4, MNO3, і М3РО4. (М = металевий катіон; F = фтор; СІ = хлор; Вr = бром; В = бор; Ph = феніл; Me = метил; Ρ = фосфор; J = йод). Бажаними є MBPh4, MB(Me)4, MPF6, MBF4, MCIO4, MBrO4, MJO4, найбільш бажаними є солі перхлорної кислоти (МСlO4) і тетрафторборної кислоти (MBF4). Найбільш бажаними є солі, в яких Μ = літій. Бажаними з цих солей є солі метилсульфокислоти (мезилата), солі трифторметансульфокислоти і соли перхлорної кислоти. Бажаними, аліфатичними солями сульфокислоти, аліфатичними солями сульфокислоти, що містять фтор, і солями сильної неорганічної кислоти є солі лужних металів і солі лужноземельних металів, бажано солі літію, натрію, калію або магнію. Бажаними є солі літію, бажано метилсульфокислота літію (мезилат літію), трифторметансульфонат літію (LiOTf, трифлат літію), перхлорат літію і тетрафторборат літію. Також можна застосовувати інші солі, наприклад, солі скандію, такі як Sc(OTf)3, цинку, такі як Zn(OTf)2, або міді, такі як Cu(OTf)2. Проте, сіль літію, зокрема LiOTf, є бажаною. Бажаними розчинниками для проведення реакції згідно даного винаходу є органічні розчинники, такі як бензол, толуол, ксилол, або хлоровані розчинники, наприклад, дихлорметан, дихлоретан, хлороформ, хлорбензол або ацетонітрил, і пропіленкарбонат і аналогічні розчинники. Бажаними є толуол і хлоровані розчинники. Бажаним є застосування трифторметансульфоната літію (LiOTf) в хлорованому розчиннику, бажано в дихлорметані, дихлоретані, хлороформі, хлорбензолі та/або в ароматичному розчиннику, такому як толуол або ксилол. Кожен розчинник або суміш розчинників може привести до різної вибірковості по відношенню до бета-ізомеру (β-ізомеру). Для фахівця в даній галузі буде нескладно оптимізувати каталізатор та/або розчинник або суміш розчинників, для отримання бажаної вибірковості по відношенню до бета-ізомеру. 2 UA 101482 C2 5 10 15 20 25 30 35 40 Сполука формули (І) є сполукою глікозильного донора. Отримання сполуки формули (І) відоме per se. Замісник R, що видаляється, бажано є (С1-С4) алкілкарбонілом, або таким, що можливо містить замісники фенілкарбоніл, такий як фенілкарбоніл, толілкарбоніл, ксилілкарбоніл або бензилкарбоніл; бажано ацетил або пара-хлорфенілкарбоніл. Замісник R1, що видаляється, бажано є галогеном, бажано хлором, бромом, фтором, бажано, хлором, або імідатом, бажано трихлорметилімідатом [-NН-(О)С-ССІ3], або тіоалкільним похідним, бажано -S-метилом. Сполука формули (II) і її отримання відомі. Сполуку бажано отримують за допомогою реакції вільної основи з триметилхлорсиланом або з гексаметилдисілазаном. При здійсненні взаємодії сполук формул (І) і (II), температура реакції, як правило, лежить у діапазоні від 0 °C до приблизно 90 °C, бажано приблизно відповідає кімнатній температурі, внаслідок чого компоненти вступають у реакцію в приблизно еквімолярних кількостях або з надлишком сполуки формули (II). Каталізатор бажано використовують у концентрації, рівній приблизно від 10 моль-% до 100 моль-%, розрахованій по відношенню до сумарної молярної присутнрсті двох взаємодіючих компонентів. Для фахівця в даній галузі нескладно оптимізувати молярні співвідношення компонентів. Для видалення замісників R із сполуки формули (III), з метою отримання вказаної сполуки 2'дезокси-5-азацитидина (Децитабіна), що містить вільні гідроксильні групи, використовують відомі способи. Бажаний спосіб видалення замісників R включає, наприклад, обробку спиртовим розчином аміаку або алкоголятами; але можна також застосовувати інші відомі способи. Наступний приклад ілюструє даний винахід. Приклад 1 (A) Суміш 5-азацитозина (20 г, 178,4 ммоль), сульфату амонію (2,4 г, 18,16 ммоль) і гексаметилдисілазана (160 г, 991,3 ммоль) нагрівали до кипіння зі зворотним холодильником до отримання прозорого розчину. Надлишок гексаметилдисілазана видаляли під вакуумом при 60 °C. (B) До залишку, отриманого на етапі (А), додавали 264 г дихлорметану, а потім трифторметансульфонат літію (27,84 г, 178,4 ммоль) і "хлор-цукор" С-137: 1-хлор-3,5-ди-О-пхлорбензоїл-2-дезокси--D-рибофуранозу [76,67 г, 178,4 ммоль, що відповідає сполуці формули (І)]. (C) Отриману суміш перемішували протягом 4 годин при температурі довкілля (20-25 °C). Реакція дозволяла отримати 99,2 % об'єднаних аномерів, вибірковість альфа/бета - 27/73. (D) Потім розчинник видаляли при 40 °C під вакуумом і отриманий залишок розчиняли в 60 г етилацетату. Розчин додавали по краплях до суміші 220 г водного бікарбонату натрію (2,5 % розчин по вазі), 174 г етилацетату, 36 г циклогексану і 70 г ацетонітрилу при 30 °C, і отриману реакційну суміш охолоджували до 0 °C і перемішували протягом 3 годин (ч). Преципітат блокованого (захищеного) амінотриазину фільтрували, промивали водою і, нарешті, сумішшю ацетонітрилу і етилацетату (1:1). Загальний вихід складав 79,2 г (87,8 %) об'єднаних аномерів; співвідношення альфа/бета 31:69. На Схемі 1 показана описана хімічна реакція. Приклад 2: Сполуку, що відповідає формулі (III), отриману в Прикладі 1, додатково обробляли спиртовим розчином аміаку відомим способом, із отриманням 2'-дезокси-5-азацитидина (Децитабіна) практично з кількісним виходом. 3 UA 101482 C2 5 10 15 20 25 30 Приклад 3: Приклад 1 відтворювали з використанням 1,0 еквіваленту мезилата літію замість трифторметансульфоната літію. Вихід реакції після етапу (С): об'єднаних аномерів 95,2 %, вибірковість альфа/бета - 60:40. Сумарний вихід після завершального етапу (D): 85,2 % об'єднаних аномерів; співвідношення альфа/бета - 63:37. Приклад 4: Приклад 1 відтворювали з використанням 1,0 еквіваленту перхлората літію замість трифторметансульфоната літію. Вихід реакції після етапу (С): 99,4 % об'єднаних аномерів, вибірковість альфа/бета - 37:63. Сумарний вихід після завершального етапу (D): 85,2 % об'єднаних аномерів; співвідношення альфа/бета - 36:64. Приклад 5: Приклад 1 відтворювали з використанням 1,0 еквіваленту тетрафторбората літію замість трифторметансульфоната літію. Вихід реакції після етапу (С): 94,5 % об'єднаних аномерів, вибірковість альфа/бета - 59:41. Сумарний вихід після завершального етапу (D): 47,9 % об'єднаних аномерів; співвідношення альфа/бета - 70:30. Приклад 6: Приклад 1 відтворювали з використанням 1,0 еквіваленту трифторметансульфоната натрію замість трифторметансульфоната літію. Вихід реакції після етапу (С): 99,2 % об'єднаних аномерів, вибірковість альфа/бета - 40:60. Сумарний вихід після завершального етапу (D): 80,7 % об'єднаних аномерів; співвідношення альфа/бета - 40:60. Приклад 7: Приклад 1 відтворювали з використанням 1,0 еквіваленту трифторметансульфоната калію замість трифторметансульфоната літію. Вихід реакції після етапу (С): 99,0 % об'єднаних аномерів, вибірковість альфа/бета - 44:56. Сумарний вихід після завершального етапу (D): 79,9 % об'єднаних аномерів; співвідношення альфа/бета - 46:54. Приклад 8: Приклад 1 відтворювали [за винятком етапу (D)] з використанням 1.0 еквіваленту трифторметансульфоната цинку замість трифторметансульфоната літію. Вихід реакції після етапу (С): 96,0 % об'єднаних аномерів, вибірковість альфа/бета - 54:46. Приклад 9: Приклад 1 відтворювали з використанням рівного об'єму толуолу замість дихлорметану як розчинника. Вихід реакції після етапу (С): об'єднаних аномерів 99,4 %, вибірковість альфа/бета - 27:73. Сумарний вихід після завершального етапу (D) 88,7 % об'єднаних аномерів; співвідношення альфа/бета - 31:69. 4 UA 101482 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 10: Приклад 1 відтворювали з використанням рівного об'єму ацетонітрилу замість дихлорметану як розчинника. Вихід реакції після етапу (С): 99,2 % об'єднаних аномерів, вибірковість альфа/бета - 50:50. Сумарний вихід після завершального етапу (D): 82,5 % об'єднаних аномерів; співвідношення альфа/бета - 52:48. Приклад 11 (A) Суміш 5-азацитозина (0.5 г, 4.46 ммоль, 1 екв.), сульфату амонію (40 мг, 0,3 ммоль, 0,07 екв.), і гексаметилдисілазана (4 г, 24,8 ммоль, 5,6 екв.) нагрівали до кипіння зі зворотним холодильником до отримання прозорого розчину. Надлишок гексаметилдисілазана видаляли під вакуумом при 60 °C. (B) Після цього до залишку, отриманого на етапі (А), додавали 10 мл дихлорметану, трифторметансульфоната літію (0,33 г, 2,11 ммоль; 0,47 екв.) і "хлор-цукор" С-137: 1-хлор-3,5ди-О-п-хлорбензоїл-2-дезокси-альфа-D-рибофуранозу [0,73 г, 1,70 ммоль, 0,38 екв.; що відповідає сполуці формули (І)]. Суміш перемішували протягом 4 годин при температурі довкілля (20-25 °C). В результаті реакції отримували 99,1 % об'єднаних аномерів; альфа/бета = 16/84. Приклад 12: Приклад 11 відтворювали з використанням 0,47 еквіваленту трифторметансульфоната міді замість трифторметансульфоната літію. Вихід реакції після етапу (В): 98,0 % об'єднаних аномерів, вибірковість альфа/бета - 42:58. Приклад 13: Приклад 11 відтворювали з використанням 0,47 еквіваленту трифторметансульфоната скандію замість трифторметансульфоната літію. Вихід реакції після етапу (В): 88,0 % об'єднаних аномерів, вибірковість альфа/бета - 43:57. Приклад 14: Приклад 11 відтворювали з використанням 0,47 еквіваленту трифторметансульфоната магнію замість трифторметансульфоната літію. Вихід реакції після етапу (В): 89,0 % об'єднаних аномерів, вибірковість альфа/бета - 58:42. Приклад 15: Приклад 11 відтворювали з використанням рівного об'єму ацетонітрила замість дихлорметану як розчинника. Вихід реакції після етапу (В): 97,6 % об'єднаних аномерів, вибірковість альфа/бета -39:61. Приклад 16: Приклад 11 відтворювали з використанням рівного об'єму хлорбензолу замість дихлорметану як розчинника. Вихід реакції після етапу (В): 96,2 % об'єднаних аномерів, вибірковість альфа/бета - 26:74. Приклад 17: Приклад 11 відтворювали з використанням рівного об'єму пропіленкарбоната замість дихлорметану як розчинника. Вихід реакції після етапу (В): 96,8 % об'єднаних аномерів, вибірковість альфа/бета - 42:58. Приклад 18: Приклад 11 відторювали з використанням суміші 10 мл дихлорметана і 3,5 мл ксилола замість 10 мл чистого дихлорметана як розчинника. Вихід реакції після етапу (В): 93,3 % об'єднаних аномерів, вибірковість альфа/бета - 27:73. Приклад 19 (A) Суміш 5-азацитозина (0,5 г, 4,46 ммоль, 1 екв.), сульфату амонію (40 мг, 0.3, ммоль, 0.07 екв.), і гексаметилдисілазана (4 г, 24,8 ммоль, 5,6 екв.) нагрівали до кипіння зі зворотним холодильником до отримання прозорого розчину. (B) Після цього до залишку, отриманого на етапі (А), додавали 10 мл 1,2-дихлорбензолу, трифторметансульфоната літію (0,33 г, 2,11 ммоль; 0.47 екв.) і "хлор-цукор" С-137: 1-хлор-3,5ди-О-п-хлорбензоїл-2-дезокси-альфа-D-рибофуранозу; [1,15 г, 2,68 ммоль, 0,60 екв.; що відповідає сполуці формули (І)]. Суміш перемішували протягом 4 годин при температурі довкілля (20-25 °C). В результаті реакції отримували 91,2 % об'єднаних аномерів; альфа/бета = 27/73. Приклад 20: Приклад 19 відтворювали з використанням рівного об'єму 1,2-дихлоретану замість 1,2-дихлорбензолу як розчинника. Вихід реакції після етапу (В): 93,4 % об'єднаних аномерів, вибірковість альфа/бета - 27:73. Приклад 21 (A) Суміш 5-азацитозина (0,5 г, 4,46 ммоль, 1 екв.), сульфату амонія (40 мг, 0,3 ммоль, 0,07 екв.), і гексаметилдисілазана (4 г, 24,8 ммоль, 5,6 екв.) нагрівали до кипіння зі зворотним холодильником до отримання прозорого розчину. Надлишок гексаметилдисілазана видаляли під вакуумом при 60 °C. (B) Після цього до залишку, отриманого на етапі (А), додавали 10 мл дихлорметану, трифторметансульфонат літію (0,33 г, 2,11 ммоль; 0,47 екв.) і "хлор-цукор" С-137: 1-хлор-3,5-диО-п-хлорбензоїл-2-дезокси-альфа-D-рибофуранозу; [0,38 г, 0,88 ммоль, 0,20 екв.; що відповідає сполуці формули (І)]). Суміш перемішували протягом 4 годин при температурі довкілля (2025 °C). В результаті реакції отримували 99,3 % об'єднаних аномерів; альфа/бета = 12/88. 5 UA 101482 C2 ФОРМУЛА ВИНАХОДУ 5 10 1. Спосіб отримання 2'-дезоксі-5-азацитидину (Децитабіну), що включає отримання сполуки формули (І): , (І) де: R є замісником, що видаляється, відомим per se, переважно (С1-С8)алкілкарбонілом, або таким, що можливо містить замісники фенілкарбоніл, або таким, що можливо містить замісники бензилкарбоніл; R1 є замісником, що видаляється, переважно галогеном, переважно хлором, бромом, фтором, переважно хлором, або імідатом, переважно трихлорметилімідатом, або тіоалкільним похідним, переважно -S-метилом; далі, отримання силільованої основи формули (II): NH R 2 N N 15 N O R2 , (II) де R2 є захисною групою, переважно триметилсиліловим (TMS) залишком; здійснення взаємодії сполуки формули (І) і сполуки формули (II) у прийнятному безводому розчиннику і в присутності прийнятного каталізатора з отриманням сполуки формули (III): N O RO N NH2 N O RO 20 25 30 , (III) і видалення замісників R із отриманням вказаної сполуки, що є 2'-дезоксі-5-азацитидином (Децитабіном), при цьому вказаний каталізатор вибирають з групи, що включає сіль аліфатичної сульфокислоти або сіль сильної кислоти. 2. Спосіб отримання сполуки формули (III) за п. 1, що включає отримання сполуки формули , (І) у якій R є замісником, що видаляється, відомим в per se, переважно (С1-С8)алкілкарбонілом, або таким, що можливо містить замісники фенілкарбоніл, або таким, що можливо містить замісники бензилкарбоніл; R1 є замісником, що видаляється, переважно галогеном, переважно хлором, бромом, фтором, переважно хлором, або імідатом, переважно трихлорметилімідатом, або тіоалкільним похідним, переважно -S-метилом; далі, отримання силільованої основи формули (II): 6 UA 101482 C2 NH R 2 N N N O R2 5 10 15 20 25 30 35 40 45 , (II) в якій R2 є захисною групою, переважно триметилсиліловим (TMS) залишком; здійснення взаємодії сполуки формули (І) і сполуки формули (II) у прийнятному безводому розчиннику і в присутності прийнятного каталізатора з отриманням сполуки формули (III), при цьому вказаний каталізатор вибирають з групи, що включає сіль аліфатичної сульфокислоти або сіль сильної кислоти. 3. Спосіб за пп. 1 або 2, який відрізняється тим, що каталізатор, що використовується у вказаній реакції, є сіллю аліфатичної сульфокислоти, переважно метилсульфокислоти або етилсульфокислоти, або сіллю фторованої аліфатичної сульфокислоти, переважно трифторметансульфокислоти, пентафторетилсульфокислоти або гептафторпропілсульфокислоти. 4. Спосіб за п. 3, який відрізняється тим, що каталізатор є сіллю метилсульфокислоти та/або солі трифторметансульфокислоти. 5. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що каталізатор є сіллю лужного металу або сіллю лужноземельного металу, переважно сіллю літію, натрію, калію або магнію, переважно сіллю літію. 6. Спосіб за будь-яким з пп. 1-5, який відрізняється тим, що каталізатор є метилсульфокислотою літію та/або трифторметансульфонатом літію. 7. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що каталізатор вибирають з солей, що включають солі скандію, переважно Sc(OTf)3, цинку, переважно Zn(OTf)2, або міді, переважно Cu(OTf)2. 8. Спосіб за п. 1 або 2, який відрізняється тим, що каталізатор є сіллю сильної кислоти, що складається з катіона і ненуклеофільного аніона, який не утворює комплексу з вказаним катіоном у розчині, переважно вибраної з групи, що включає: MBPh4, MB(Me)4, MPF6, MBF4, MCIO4, MBrO4, MJO4, M2SO4, MNO3, і М3РО4, переважно MBPh4, MB(Me)4, MPF6, MBF4, MCIO4, MBrO4, MJO4, а каталізатор переважно є сіллю перхлорної кислоти і тетрафторборної кислоти. 9. Спосіб за п. 8, який відрізняється тим, що каталізатор є сіллю лужного металу або сіллю лужноземельного металу, переважно сіллю літію, натрію, калію або магнію, переважно сіллю літію, переважно перхлоратом літію і тетрафторборатом літію. 10. Спосіб за п. 8, який відрізняється тим, що каталізатор є сіллю скандію, цинку або міді. 11. Спосіб за будь-яким з пп. 1-10, який відрізняється тим, що розчинник для проведення реакції вибирають з групи, що включає органічні розчинники, переважно бензол, толуол, ксилол, або хлоровані розчинники, переважно дихлорметан, дихлоретан, хлороформ, хлорбензол або толуол, ксилол, або ацетонітрил, пропіленкарбонат і аналогічні розчинники. 12. Спосіб за п. 11, який відрізняється тим, що розчинник для проведення реакції вибирають з органічних розчинників, переважно толуолу і ксилолу, і хлорованих розчинників, переважно з хлорованих розчинників. 13. Спосіб за будь-яким з пп. 1-10, який відрізняється тим, що каталізатор є трифторметансульфонатом літію і розчинник вибирають з органічних розчинників, переважно толуолу і ксилолу, і хлорованих розчинників, переважно дихлорметану, дихлоретану, хлороформу і хлорбензолу. 14. Спосіб за будь-якиму з пп. 1-13, який відрізняється тим, що замісник R, що видаляється, є (С1-С4)алкілкарбонілом або таким, що можливо містить замісники фенілкарбоніл або бензилкарбоніл, переважно фенілкарбоніл, толілкарбоніл, ксилілкарбоніл; переважно ацетил або пара-хлорфенілкарбоніл. 15. Спосіб за будь-яким з пп. 1-14, який відрізняється тим, що замісник R1, що видаляється, є О-ацил(С1-С4), -О-алкіл(С1-С4) або хлором, переважно -О-(О)ССН3 або хлором, переважно хлором. Комп’ютерна верстка Л. Купенко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 7
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod of producing 2'-deoxy-5-azacytidine (decitabine)
Автори англійськоюJungmann, Oliver, Kraut, Norbert
Назва патенту російськоюСпособ получения 2'-дезокси-5-азацитидина (децитабина)
Автори російськоюДжунгман Оливер, Краут Норберт
МПК / Мітки
МПК: C07H 19/12
Мітки: децитабіну, спосіб, отримання, 2'-дезоксі-5-азацитидину
Код посилання
<a href="https://ua.patents.su/9-101482-sposib-otrimannya-2-dezoksi-5-azacitidinu-decitabinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання 2′-дезоксі-5-азацитидину (децитабіну)</a>
Попередній патент: Фунгіцидна композиція
Наступний патент: Спосіб ідентифікації продукту
Випадковий патент: Сушарка












