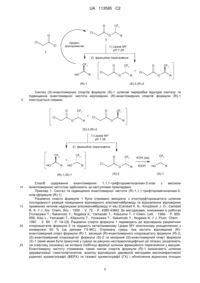
Спосіб одержання енантіомерних 1,1,1-трифторометилалкан-2-олів з високою енантіомерною чистотою
Номер патенту: 113595
Опубліковано: 10.02.2017
Автори: Ващенко Валерій Володимирович, Михайленко Вадим Вікторович, Кривошей Олександр Ігоревич
Формула / Реферат
Спосіб одержання енантіомерних 1,1,1-трифторометилалкан-2-олів з високою енантіомерною чистотою формули:
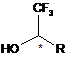 ,
,
де R = н-С4Н9; н-C5H11; н-С6Н13; н-С7Н15,
який включає каталізоване ліпазою кінетичне розщеплення хлороацетатів рацемічних 1,1,1-трифторометилалкан-2-олів і подальше розділення отриманої суміші шляхом фракційного переганяння на фракцію (R)-енантіомерного спирту та фракцію побічного хлороацетату, який відрізняється тим, що отриманий після фракційного переганяння (R)-енантіомерний спирт піддають естерифікації хлороацетилхлоридом з отриманням відповідного хлороацетату, який удруге піддають каталізованому ліпазою кінетичному розщепленню, отриману суміш шляхом фракційного переганяння розділюють на фракцію кінцевого (R)-енантіомерного спирту та другу фракцію побічного хлороацетату, після чого першу та другу побічні хлороацетатні фракції об'єднують і піддають каталізованому ліпазою кінетичному розщепленню, отриману суміш шляхом фракційного переганяння розділюють на фракцію побічного спирту і фракцію (S)-хлороацетату та омилюють отриманий таким чином хлороацетат з одержанням (S)-енантіомерного спирту.
Текст
Реферат: Винахід належить до галузі органічного синтеза, зокрема до способів синтеза енантіомерних хіральних вторинних спиртів. Спосіб синтеза енантіомерних 1,1,1-трифторометилалкан-2-олів формули: CF3 HO * R, де R=н-С4Н9; н-C5H11; н-С6Н13; н-С7Н15, UA 113595 C2 (12) UA 113595 C2 включає каталізоване ліпазою кінетичне розщеплення хлороацетатів рацемічних 1,1,1трифторометилалкан-2-олів і подальше розділення отриманої суміші шляхом фракційного переганяння на фракцію (R)-енантіомерного спирту та фракцію побічного хлороацетату. Отриманий після фракційного переганяння (R)-енантіомерний спирт піддають естерифікації хлороацетилхлоридом з отриманням відповідного хлороацетату, який удруге піддають каталізованому ліпазою кінетичному розщепленню, отриману суміш шляхом фракційного переганяння розділюють на фракцію кінцевого (R)-енантіомерного спирту та другу фракцію побічного хлороацетату. Після цього першу та другу побічні хлороацетатні фракції об'єднують і піддають каталізованому ліпазою кінетичному розщепленню, отриману суміш шляхом фракційного переганяння розділюють на фракцію побічного спирту і фракцію (S)-хлороацетату та омилюють отриманий таким чином хлороацетат з одержанням (S)-енантіомерного спирта. Винахід може бути використаний при отриманні напівпродуктів для тонкого органічного синтеза та біологічно активних речовин, до складу яких входять залишки хіральних 1,1,1трифторометилалкан-2-олів. UA 113595 C2 Винахід належить до галузі органічного синтезу, зокрема до способів синтезу енантіомерних хіральних вторинних спиртів формули 1: CF3 HO * R, 5 10 15 20 25 30 35 40 45 50 55 де R = н-С4Н9 (a); н-C5H11 (б); н-С6Н13 (в); н-С7Н15 (г). Енантіомерні фторовмісні вторинні спирти - корисні хіральні синтони у сучасній медичній хімії та хімії матеріалів [Hiyama T. Organofluorine Compounds: Chemistry and Applications; Yamamoto H., Ed. Springer-Verlag: Berlin, 2000; Pinard E., Alanine A., Alberati D., Bender M., Borroni E., Bourdeaux P., Brom V., Burner S., Fischer H., Hainzl D., Halm R., Hauser N., Jolidon S., Lengyel J., Marty H.-P., Meyer Т., Moreau J.-L., Могу R., Narquizian R., Nettekoven M., Norcross R. D., Puellmann В., Schmid P., Schmitt S., Stalder H., Wermuth R., Wettstein J. G., Zimmerli D. // J. Med. Chem. - 2012. - V. 53. - P. 4603-4614; Hayashi H., Wang A., Kawabata K., Goto H. // Mater. Chem. Phys. - 2013. - V. 137. - P. 816-824]. Наприклад, діестер (R)-1,1,1-трифторометилоктан-2-олу та n-терфенілдикарбонової кислоти був використаний як хіральний компонент рідкокристалічних (РК) сумішей, що мають дуже перспективні властивості для практичних реалізацій рідкокристалічних дисплеїв, які ґрунтуються на ефекті деформованого гелікоїда сегнетоелектрика (DHF) [Pozhidaev E.P., Torgova S.I., Minchenko M.V., Vashchenko V.V., Krivoshey A.I., Strigazzi A. // Моl. Cryst. Liq. Cryst - 2009. - V. 509. - P. 1042-1050; Pozhidaev E.P., Hegde G., Chigrinov V.G., Murauski A.A., Kwok H.S., Vashchenko V.V., Krivoshey A.I. // Моl. Cryst. Liq. Cryst. - 2009. - V. 510. - P. 12-20]. Важливою особливістю застосування діестерів n-терфенілдикарбонової кислоти та спиртів формули 1 у багатокомпонентних РК матеріалах є потреба у обох енантіомерах спиртів формули 1 з високою енантіомерною чистотою задля сполучення властивостей цільових діестерів, які залежать від абсолютної конфігурації спиртів формули 1 (таких, як знаки надмолекулярної спіралі та спонтанної поляризації, що індукують ці діестери), з властивостями інших хіральних компонентів з метою керування властивостями РК матеріалу в цілому. Так, належне сполучення знаків надмолекулярної спіралі та спонтанної поляризації діестеру (S)1,1,1-трифторометилоктан-2-олу та іншого похідного n-терфенілдикарбонової кислоти дозволило отримати рідкокристалічний матеріал з унікальними властивостями [Pozhidaev E.P., Srivastava А.К., Kiselev A.D., Chigrinov V.G., Vashchenko V.V., Krivoshey A.I., Minchenko M.V., Kwok H.S. // Optics Letters. - 2014. - V. 39. - P. 2900-2903], що було б неможливо при наявності лише більш синтетично доступного (R)-енантіомера. 1,1,1-Трифторометилалкан-2-оли формули 1 можна отримати з енантіомерним надлишком біля 90 % за описаним в літературі способом [Ramachandran P.V., Teodorovic A.V., Gong В., Brown H.С. // Tetrahedron: Asymmetry. - 1994. - V. 5. - P. 1075-1086], який полягає у відновленні відповідних кетонів хіральними сполуками бору. Зрозуміло, що абсолютна конфігурація (R- або S-) та синтетична доступність отриманих таким чином спиртів формули 1 буде залежати, відповідно, від абсолютної конфігурації та доступності боровмісних хіральних сполук, які використовують для відновлення. Так чи інакше, окрім не досить високого енантіомерного надлишку, цей спосіб дозволяє отримувати лише один енантіомер з двох можливих. У теперішній час найбільш використаним способом синтезу сполук формули 1 є каталізоване ліпазами кінетичне розщеплення відповідних рацемічних естерів [Yonezawa Т., Sakamoto Y.; Nogawa К., Yamazaki Т., Kitazume T. // Chem. Lett. - 1996. - P. 855-856; Xiao L.; Yamazaki Т., Kitazume Т., Yonezawa Т., Sakamoto Y., Nogawa K. // J. Fluor. Chem. - 1997. - V. 84. P. 19-23]. Це спосіб отримання 1,1,1-трифторометилалкан-2-олів формули 1 лише однієї можливої абсолютної конфігурації, в яких енантіомерний надлишок становить не більше ніж 97-98 %. Загальним недоліком усіх вищеназваних способів синтезу енантіомерних 1,1,1трифторометилалкан-2-олів є доступність лише одного з двох можливих енантіомерів цих хіральних сполук. Таким чином, існує потреба в способі синтезу енантіомерних 1,1,1-трифторометилалкан-2олів, який дозволяв би отримувати обидва енантіомери цих спиртів з якомога більшою енантіомерною чистотою. 1 UA 113595 C2 5 10 15 20 Відомий спосіб синтезу енантіомерних 1,1,1-трифторометилалкан-2-олів формули 1 [Yonezawa Т., Sakamoto Y.; Nogawa К., Yamazaki Т., Kitazume Т. // Chem. Lett. - 1996. - P. 855856; Xiao L., Yamazaki Т., Kitazume Т., Yonezawa Т., Sakamoto Y., Nogawa K. // J. Fluor. Chem. 1997. - V. 84. - P. 19-23], який полягає у каталізованому ліпазами кінетичному розщепленні рацемічних естерів з подальшим розділенням суміші цільового (R)-енантіомерного спирту та побічного естеру, що не вступив до реакції, шляхом фракційного переганяння. Серед іншого, було встановлено, що за умови проведення реакції з конверсією вихідного рацемічного естеру більше 40 % енантіомерний надлишок отриманого таким чином (R)енантіомерного спирту починає знижуватися. Так, енантіомерний надлишок (R)-спирту становить: 98 % - для конверсії рацемічного естеру 40 %, та 91 % - для конверсії 49 %. За відомим способом авторами було проведено синтез (R)-енантіомерного спирту формули (R)-1в. Для цього цей спирт переводили у хлороацетат та піддавали каталізованому Lipase MY кінетичному розщепленню у фосфатному буфері при рН 7,28 та температурі 38 °C з конверсією менше ніж 50 % (за даними ГХ-МС). Розділення суміші продуктів реакції призводить до отримання цільового (R)-енантіомерного спирту формули (R)-1в. Однак, в залежності від партії та терміну зберігання ферментного каталізатора Lipase MY, енантіомерний надлишок (ее) отриманого спирту у різних спробах виявися змінним в досить широких межах - - від ее=88,0 % до ее=98,2 %. Крім того, даний спосіб, вочевидь, не здатний забезпечити отримання (S)енантіомера. В основу винаходу поставлено задачу розробки способу синтезу енантіомерних 1,1,1трифторометилалкан-2-олів, який дозволяє отримувати обидва енантіомери цих спиртів з високою енантіомерною чистотою. Рішення поставленого завдання досягається тим, що в способі одержання енантіомерних 1,1,1-трифторометилалкан-2-олів з високою енантіомерною чистотою формули 1: 25 CF3 HO 30 35 40 45 50 55 * R, де R = н-С4Н9; н-C5H11; н-С6Н13; н-С7Н15, який включає каталізоване ліпазою кінетичне розщеплення хлороацетатів рацемічних 1,1,1трифторометилалкан-2-олів і подальше розділення отриманої суміші шляхом фракційного переганяння на фракцію (R)-енантіомерного спирту та фракцію побічного хлороацетату, згідно з винаходом, отриманий після фракційного переганяння (R)-енантіомерний спирт піддають естерифікації хлороацетилхлоридом з отриманням відповідного хлороацетату, який удруге піддають каталізованому ліпазою кінетичному розщепленню, отриману суміш шляхом фракційного переганяння розділюють на фракцію кінцевого (R)-енантіомерного спирта та другу фракцію побічного хлороацетату, після чого першу та другу побічні хлороацетатні фракції об'єднують і піддають каталізованому ліпазою кінетичному розщепленню, отриману суміш шляхом фракційного переганяння розділюють на фракцію побічного спирту і фракцію (S)хлороацетату та омилюють отриманий таким чином хлороацетат з одержанням (S)енантіомерного спирту. Згідно з експериментальними даними, дія ліпази є, вочевидь, стереоселективною, але не стереоспецифічною (тобто не стовідсотковою), про що свідчить неабсолютна енантіомерна чистота (R)-енантіомерних спиртів, отриманих під дією ліпази (згідно з прототипом). Це дозволяє зробити припущення про те, що, з одного боку, висока стереоселективність дії ліпази підвищує енантіомерну чистоту (R)-енантіомерних спиртів, і, з другого боку, нестереоспецифічність дії ліпази дозволяє розраховувати на те, що після повного витрачання (R)-енантіомерних хлороацетатів у реакційній суміші під час кінетичного розщеплення ліпаза буде продовжувати діяти (хоча і, ймовірно, з меншою швидкістю) вже на (S)-енантіомерні хлороацетати, що має забезпечити їх високу енантіомерну чистоту і, таким чином, високу енантіомерну чистоту відповідних (S)-енантіомерних спиртів, які можна отримати з хлороацетатів шляхом омилення без погіршення енантіомерної чистоти. Отже, як показали наші дослідження, подвійне каталізоване ліпазою кінетичне розщеплення хлороацетатів спиртів формули 1 дозволяє підвищувати енантіомерну чистоту (R)енантіомерних спиртівформули (R)-1 (див. таблицю 1). Крім цього, переробка відходів від отримання (R)-енантіомерних спиртів формули (R)-1 шляхом подальшого каталізованого ліпазою кінетичного розщеплення відповідних побічних хлороацетатів з подальшим омиленням 2 UA 113595 C2 5 дозволяє отримувати (S)-енантіомерні спирти формули (S)-1 з високою енантіомерною чистотою (див. таблицю 2) В таблиці 1 наведено результати первинного синтезу (R)-енантіомерних спиртів формули (R)-1 та підвищення їх енантіомерної чистоти шляхом подвійного кінетичного розщеплення відповідних хлороацетатів. Таблиця 1 № Сполука Фактичні дані Літературні дані б Питоме оптичне Енантіомерна чистота Питоме оптичне а в Вихід , % обертання (ее ) (%) обертання ее, % ВЕРХ ([ ]25 ) , ° d 1 70 95,6 (90,6) 99,9 (99,8) 95,5 (91,0) 99,6 (99,2) 99,1 (98,2) і 100 (100) 98,1 (94,2) 99,8 (99,6) +23,6 (R)-1а ж 2 75 (R)-1б +27,0 68 3 +24,0 ж 4 83 +26,5 5 65 +25,0 (R)-1в 6 ж 60 (R)-1г 8 +25,0 78 7 +25,1 ж 65 д +26,4 ГХ є 95,3 (91,2) 100,0 (100,0) 95,8 (91,6) 99,7 (99,4) 99,0 (98,0) і 100 (100) 98,0 (94,0) 99,8 (99,6) ([ ]25 ) , ° d +29,5 98 +28,0 97 з +24,0 з з 97 +28,6 +23,8 98 а Якщо не вказано інше, вихід обчислено відносно теоретичного виходу спиртів формули (R)1 в реакції каталізованого ліпазою кінетичного розщеплення (50 % від сукупної кількості (R)та (S)-енантіомерних спиртів в рацемічному спирті формули 1). б Енантіомерну чистоту було визначено шляхом дериватизації спиртів формули (R)-1 Iментилфталатом та аналізу відповідних дериватів методами високоефективної рідинної хроматографії (ВЕРХ) і газової хроматографії (ГХ) та обчислення відносних площин піків відповідних диастеромерних дериватів за методикою [Mikhailenko V., Yedamenko D., Vlasenko G., Krivoshey A., Vashchenko V. // Tetrahedron Lett. - 2015. - V. 56. - P. 5956-5959]. в Значення енантіомерного надлишку (ее) обчислені виходячи із експериментально визначених значень енантіомерної чистоти. г Літературні дані наведено у роботах [Yonezawa Т., Sakamoto Y.; Nogawa К.; Yamazaki Т.; Kitazume Т. // Chem. Lett. - 1996. - P. 855-856; Xiao, L.; Yamazaki Т., Kitazume Т., Yonezawa Т., Sakamoto Y., Nogawa K. //J. Fluor. Chem. - 1997. - V. 84. - P. 19-23]. д Колонка Ascentis Si, 25 cм4,6 мм, 5 мкм; елюент: 32 % дихлорометан/циклогексан; аналітична довжина хвилі 245 нм. є Колонка: Agilent HP-5 (5 % фенілметилсилоксан); подільник потоку 20:1; температура інжекції 250 °C; потік 15,0 мл/мин; нагрів: від 40 °C до 300 °C із швидкістю 20 °C/хв., тривалість аналізу: 20 хв. ж Вихід обчислено відносно 100 % конверсії хлороацетатів 1,1,1-трифторометилалкан-2-олів (спиртів формули 1) упродовж процедури підвищення енантіомерної чистоти (див. Приклад 1). з Відповідно до літературних даних, одному й тому ж значенню ее відповідають два суттєво 25 відмінних значення []d . і Відповідний дериват (S)-енантіомера не був виявлений. 10 В таблиці 2 наведено результати синтезу (S-енантіомерних спиртів формули (S)-1 шляхом переробки відходів від синтезу та підвищення енантіомерної чистоти відповідних (R)енантіомерних спиртів формули (R)-1. 3 UA 113595 C2 5 10 15 20 Як видно з таблиці 1 (пп. 1, 3, 5, 7), каталізоване ліпазою кінетичне розщеплення рацемічних хлороацетатів згідно з прототипом призводить до отримання спиртів формули (R)-1 з задовільними виходами, однак енантіомерна чистота отриманих спиртів (R)-1 дещо відрізняється у гірший бік від даних, наведених в літературі. Підвищення енантіомерної чистоти шляхом естерифікації спиртів формули (R)-1 хлороацетилхлоридом та повторного каталізованого ліпазою кінетичного розщеплення оптично активних хлороацетатів під дією Lipase MY з подальшим розділенням спиртової та хлороацетатної фракцій за допомогою фракційного переганяння призводять до отримання спиртів формули (R)-1 із значно підвищеною енантіомерною чистотою (пп. 2, 4, 6, 8). У випадку (R)-1,1,1-трифторометиоктан-2олу ((R)-1в, п. 6) дериват, що відповідає мінорному (S)-енантіомера, взагалі не вдається виявити у будь-якій значущій кількості. Як видно з таблиці 2, кінетичне розщеплення хлороацетатних фракцій, які є відходами синтезу (R)-енантіомерних спиртів (див. таблицю 1), під дією Lipase MY з подальшим омиленням у лужному середовищі відповідних (S)-енантіомерних хлороацетатів призводить до отримання (S)-енантіомерних спиртів (S)-1 у енантіомерно чистому вигляді (деривати, що відповідають відповідним (R)-енантіомерам, виявити не вдається). Спосіб, що заявляється, здійснюють наступним чином. Проводять каталізоване ліпазою кінетичне розщеплення хлороацетатів рацемічних 1,1,1трифторометилалкан-2-олів і подальше розділення отриманої суміші шляхом фракційного переганяння на фракцію (R)-енантіомерного спирту та фракцію побічного хлороацетату. Таблиця 2 Питоме № 1 2 3 4 Сполука (S)-1а (S)-1б (S)-1в (S)-1г а Вихід , % 27 22 49 43 оптичне 25 обертання ([ ]d ) , ° -29,1 -30,3 -28,0 -29,0 б,в Енантіомерна чистота , % ВЕРХ 100 100 100 100 г ГХ д 100 100 100 100 а Обчислено з двох стадій синтезу, починаючи з хлороацетатних фракцій (див. Приклад 2). Енантіомерну чистоту було визначено шляхом дериватизації спиртів формули (S)-1 lментилфталатом та аналізу відповідних дериватів методами високоефективної рідинної хроматографії (ВЕРХ) і газової хроматографії (ГХ) за методикою [Mikhailenko V., Yedamenko D., Vlasenko G., Krivoshey A., Vashchenko V. // Tetrahedron Lett - 2015. - V. 56, - P. 5956-5959]. в Відповідні діастереомерні дерівати не були виявлені. г Колонка Ascentis Si, 25 см4,6 мм, 5 мкм; елюент: 32 % дихлорометан/циклогексан; аналітична довжина хвилі 245 нм. д Колонка: Agilent HP-5 (5 % фенілметилсилоксан); подільник потоку 20:1; температура інжекції 250 °C; потік 15,0 мл/хв.; нагрів: від 40 °C до 300 °C із швидкістю 20 °C/хв., тривалість аналізу: 20 хв. б 25 30 Отриманий після фракційного переганяння (R)-енантіомерний спирт піддають естерифікації хлороацетилхлоридом з отриманням відповідного хлороацетату, який удруге піддають каталізованому ліпазою кінетичному розщепленню, отриману суміш шляхом фракційного переганяння розділюють на фракцію кінцевого (R)-енантіомерного спирту та другу фракцію побічного хлороацетату. Після цього першу та другу побічні хлороацетатні фракції об'єднують і піддають каталізованому ліпазою кінетичному розщепленню, отриману суміш шляхом фракційного переганяння розділюють на фракцію побічного спирту і фракцію (S)-хлороацетату та омилюють отриманий таким чином хлороацетат з одержанням (S)-енантіомерного спирта. Первинний синтез (R)-енантіомерних спиртів формули (R)-1 та підвищення їх енантіомерної чистоти шляхом подвійного кінетичного розщеплення відповідних хлороацетатів формули 2 ілюструється схемою: 4 UA 113595 C2 O Cl O Cl CF3 O пірідин, діхлорометан Cl R 2 1) Lipase MY pH 7,28 3 2) фракційне переганяння н CF3 HO O + Cl R O Cl CF3 O R (R)-1 5 O CF3 R (S)-2,(R)-2 Синтез (S)-енантіомерних спиртів формули (S)-1 шляхом переробки відходів синтезу та підвищення енантіомерної чистоти відповідних (R)-енантіомерних спиртів формули (R)-1 ілюструється схемою: O O CF3 + Cl O Cl CF3 O R R (S)-2,(R)-2 1) Lipase MY pH 7,28 2) фракційне переганяння н CF3 CF3 O + HO R HO R Cl O (S)-2 (R)-1,(S)-1 10 15 20 25 CF3 CF3 KOH (aq) R EtOH HO R (S)-1 Спосіб одержання енантіомерних 1,1,1-трифторометилалкан-2-олів з високою енантіомерною чистотою здійснюють за наступними прикладами. Приклад 1. Синтез та підвищення енантіомерної чистоти (R)-1,1,1-трифторометилалкан-2олів (формули (R)-1) Рацемічні спирти формули 1 було отримано виходячи з етилтрифтороацетата шляхом послідовності реакцій приєднання відповідного алкілмагнійброміду та відновлення відповідних проміжних кетонів надлишком алкілмагнійброміду in situ [Cambell К. N., Knopbloch J. О., Cambell В. К. // J. Am. Chem. Soc - 1950. - V. 72. - P. 4380-4384]. За методиками, описаними в роботах [Yonezawa Т., Sakamoto Y.; Nogawa К., Yamazaki Т., Kitazume Т. // Chem. Lett. - 1996. - P. 855856; Xiao L.; Yamazaki Т., Kitazume Т., Yonezawa Т., Sakamoto Y., Nogawa K. // J. Fluor. Chem. 1997. - V. 84. - P. 19-23]. Рацемічні спирти формули 1 переводять до відповідних рацемічних хлороацетатів формули 2 та піддають каталізованому Lipase MY кінетичному розщепленню з конверсією 50 % (за даними ГХ-МС). Отриману суміш, яка містить відповідний (R)енантіомерний спирт формули (R)-1, залишок (R)-енантіомерного хлороацетату формули (R)-2, (S)-енантіомерний хлороацетат формули (S)-2 та мінорний (S)-енантіомерний спирт формули (S)-1 (який може бути присутній у суміші за рахунок нестереоспецифічної дії ліпази), розділюють на спиртову (основну) на естерну (побічну) фракції шляхом фракційного переганяння у вакуумі. Енантіомерну чистоту отриманих таким чином спиртів формули (R)-1 визначають шляхом дериватизації l-ментилфталатом, аналізу відповідних дериватів методами високоефективної рідинної хроматографії (ВЕРХ) та газової хроматографії (ГХ) і обчислення відносних площин 5 UA 113595 C2 5 10 15 20 25 30 35 40 45 50 55 60 піків відповідних діастеромерних дериватів за методикою [Mikhailenko V., Yedamenko D., Vlasenko G., Krivoshey A., Vashchenko V. // Tetrahedron Lett. - 2015. - V. 56. - P. 5956--5959] (результати див. у таблиці 1, пп. 1, 3, 5, 7). З метою підвищення енантіомерної чистоти спиртів формули (R)-1 з проміжною енантіомерною чистотою розчин спирту формули (R)-1 (0,30 моль) і сухого піридину (51,1 г, 0,45 моль, 1,5 екв.) у сухому діхлорометані (200 мл) без доступу вологи охолоджують до 0 °C при перемішуванні і по краплях додають до нього хлороацетилхлорид (формули 3; 50,8 г, 0,45 моль, 1,5 екв.) протягом 30 хвилин, підтримуючи температуру реакційної суміші не вище 10 °C. Після додавання хлороацетилхлориду реакційну суміш перемішують протягом 2 годин, після чого виливають її на лід та підкислюють розбавленою водною НСl. Органічний шар відділяють, водний - екстрагують дихлорометаном (370 мл). Органічні екстракти об'єднують, промивають 1М НСl (230 мл), потім - водою до нейтральної реакції, після чого висушують над безводним Na2SO4. Осушувач відділяють та упарюють летючі розчинники досуха. Неочищений продукт брунатну рідину - переганяють у вакуумі (20 мм рт. ст.) і, таким чином, отримують відповідний хлороацетат формули 2 у вигляді безбарвної рідини. Для проведення кінетичного розщеплення відповідного хлороацетату формули 2 до 700 мл фосфатного буферного розчину з рН 7,28, термостатованого при 38 °C, додають 25 мг Lipase MY. Отриману суміш витримують при перемішуванні протягом 15 хвилин та додають до неї відповідний хлороацетат формули 2 (0,20 моль). Реакційну суміш перемішують при 38 °C, кожні півгодини відбираючи з неї пробу та аналізуючи її методом ГХ-МС. Після досягнення 85 % конверсії хлороацетату формули 2 (приблизно через 3-4 годин) реакційну суміш охолоджують, додають до неї дихлорометан (100 мл) та підкислюють розбавленою водною НСl. Органічний шар відокремлюють, водний - екстрагують дихлорометаном (325 мл). Об'єднані екстракти промивають водою до нейтральної реакції, висушують над безводним Na 2SO4 та упарюють досуха. Залишок після упарювання летючих розчинників піддають фракційному переганянню у вакуумі (20 мм рт. ст.), відбираючи відповідні спиртову та хлороацетатну фракції. Отриману спиртову фракцію піддають повторній дистиляції у вакуумі (20 мм рт. ст.), отримуючи відповідний (R)-енантіомерний спирт. Енантіомерну чистоту отриманих таким чином спиртів формули (R)-1 визначають таким же чином, як у випадку спиртів формули (R)-1 вище (результати див. у таблиці 1, пп. 2, 4, 6, 8). Вибір під час етапу кінетичного розщеплення хлороацетату формули 2, який переважно складається з (R)-енантіомера, значення конверсії хлороацетату 85 % зроблено з міркувань щодо найменшої енантіомерної чистоти, яку було отримано авторами за способом-прототипом (ее=88 %, що відповідає енантіомерній чистоті (R)-спирту 94 %), з додаванням деякого запасу надійності (за аналогією з прототипом). При цьому слід зазначити, що менше значення конверсії хлороацетатів призводить лише до зменшення виходів цільових (R)-енантіомерних спиртів. І навпаки, проведення цієї реакції з конверсією більше 85 % не дозволяє заздалегідь гарантувати отримання максимально досяжної енантіомерної чистоти отриманих таким чином (R)енантіомерних спиртів. Приклад 2. Синтез (S)-1,1,1-трифторометилалкан-2-олів (формули (S)-1) Для отримання (S)-енантіомерних спиртів формули (S)-1 до 700 мл фосфатного буферного розчину з рН 7,28, термостатованого при 38 °C, додають 100 мг Lipase MY. Отриману суміш витримують при перемішуванні протягом 15 хвилин та додають до неї хлороацетатні фракції після фракційних дистиляцій з Прикладу 1 (які мають містити суміш енантіомерніх хлороацетатів формули 2, збагачену (S)-енантіомерним хлороацетатом формули (S)-2, та залишкові кількості відповідних (R)- та (S)-спиртів формули 1). Реакцію проводять при перемішуванні та температурі 38 °C протягом, приблизно, 4 діб, кожної доби відбираючи з неї проби та аналізуючи їх методом ГХ-МС, до досягнення 30 % конверсії вихідного хлороацетату формули 2 (за даними ГХ-МС). Кожної доби до реакції додають по 100 мг Lipase MY. Після завершення реакції реакційну суміш охолоджують, додають до неї дихлорометан (~100 мл) та підкислюють НСl. Органічний шар відокремлюють, водний - екстрагують дихлорометаном (325 мл). Об'єднані екстракти промивають водою до нейтральної реакції, висушують над безводним Na2SO4 та упарюють досуха. Залишок після упарювання летючих розчинників піддають фракційному переганянню у вакуумі (20 мм рт. ст.), відбираючи відповідні спиртову та хлороацетатну фракції. Отриману хлороацетатну фракцію піддають повторній дистиляції у вакуумі (20 мм рт. ст.), отримуючи хлороацетатну фракцію, яка, за даними ГХ-МС, майже не містить спиртів (та, відповідно, має містити переважно (S)-енатіомерний хлороацетат формули (S)-2). Отриманий таким чином (S)-енантіомерний хлороацетат формули (S)-2 (0,23 моль) додають до розчину КОН (51,1 г, 0,91 моль, 4 екв.) у суміші етанолу (400 мл) та води (160 мл). Реакційну 6 UA 113595 C2 5 10 15 20 суміш нагрівають та кип'ятять при перемішуванні протягом 3 годин, потім охолоджують, додають до неї воду (500 мл) та концентровану водну НСl (100 мл), екстрагують дихлорометаном (350 мл), екстракти об'єднують, висушують над безводним СаСl2 та упарюють летючі розчинники досуха. Залишок після упарювання піддають переганянню у вакуумі (20 мм рт. ст.), отримуючи цільові (S)-енантіомерні спирти формули (S)-1. Енантіомерну чистоту отриманих спиртів формули (S)-1 визначають шляхом дериватизації/-ментилфталатом та аналізу відповідних дериватів методами ВЕРХ та ГХ за методикою [Mikhailenko V., Yedamenko D., Vlasenko G., KrivosheyA., Vashchenko V. // Tetrahedron Lett. - 2015. - V. 56. - P. 5956-5959] (результати див. у таблиці 2). Вибір підчас етапу кінетичного розщеплення побічних хлороацетатних фракцій значення конверсії хлороацетату 30 % зроблено з урахуванням верхньої границі конверсії хлороацетатів під час попереднього етапу підвищення оптичної чистоти (R)-енантіомерних спиртів (85 %), побічні хлороацетатні фракції після якого, головним чином, містять (R)-енантіомери, відповідно, в кількості щонайбільше 15 %, з урахуванням присутності в цих фракціях домішки (1-2 % відповідно до ГХ-МС) спиртів (також, переважно, (R)-енантіомерів) та з додаванням деякого запасу надійності. При цьому слід зазначити, що більші значення конверсії побічних хлороацетатних фракцій призводять лише до зменшення виходів цільових (R)-енантіомерних спиртів. І навпаки, проведення цієї реакції з конверсією менше 30 % не дозволяє заздалегідь гарантувати отримання максимально досяжної енантіомерної чистоти (S)-енантіомерних спиртів. Винахід може бути використаний при отриманні напівпродуктів для тонкого органічного синтезу та біологічно активних речовин, до складу яких входять залишки хіральних 1,1,1трифторометилалкан-2-олів. ФОРМУЛА ВИНАХОДУ 25 Спосіб одержання енантіомерних 1,1,1-трифторометилалкан-2-олів з високою енантіомерною чистотою формули: CF3 30 35 40 HO * R, де R=н-С4Н9; н-C5H11; н-С6Н13; н-С7Н15, який включає каталізоване ліпазою кінетичне розщеплення хлороацетатів рацемічних 1,1,1трифторометилалкан-2-олів і подальше розділення отриманої суміші шляхом фракційного переганяння на фракцію (R)-енантіомерного спирту та фракцію побічного хлороацетату, який відрізняється тим, що отриманий після фракційного переганяння (R)-енантіомерний спирт піддають естерифікації хлороацетилхлоридом з отриманням відповідного хлороацетату, який удруге піддають каталізованому ліпазою кінетичному розщепленню, отриману суміш шляхом фракційного переганяння розділюють на фракцію кінцевого (R)-енантіомерного спирту та другу фракцію побічного хлороацетату, після чого першу та другу побічні хлороацетатні фракції об'єднують і піддають каталізованому ліпазою кінетичному розщепленню, отриману суміш шляхом фракційного переганяння розділюють на фракцію побічного спирту і фракцію (S)хлороацетату та омилюють отриманий таким чином хлороацетат з одержанням (S)енантіомерного спирту. 45 Комп’ютерна верстка М. Мацело Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 7
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C12N 9/00, C07C 31/02, C07C 29/00, C07C 67/14
Мітки: 1,1,1-трифторометилалкан-2-олів, чистотою, енантіомерних, спосіб, енантіомерною, високою, одержання
Код посилання
<a href="https://ua.patents.su/9-113595-sposib-oderzhannya-enantiomernikh-111-triftorometilalkan-2-oliv-z-visokoyu-enantiomernoyu-chistotoyu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання енантіомерних 1,1,1-трифторометилалкан-2-олів з високою енантіомерною чистотою</a>
Попередній патент: Спосіб визначення енантіомерної чистоти хіральних вторинних спиртів
Наступний патент: Спосіб захисту нейтрального провідника від струмів перевантаження та струмів однофазних коротких замикань в електричних мережах з нелінійними видами навантажень
Випадковий патент: Пристрій для контролю технічних параметрів доїльних установок