Спосіб отримання нейральних клітин-попередників
Формула / Реферат
Спосіб отримання нейральних клітин-попередників, який включає дезагрегацію нервової тканини, фільтрацію отриманої суспензії клітин, розведення суспензії середовищем культивування і культивування, який відрізняється тим, що суспензію клітин після фільтрації розводять середовищем DMEM/F12, збагаченим 10 % сироватки крові, до концентрації 1-4×106 клітин/мл, а культивування проводять протягом 3-6 годин до утворення нейральними клітинами-попередниками агрегатів.
Текст
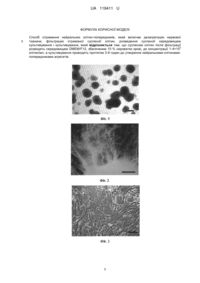
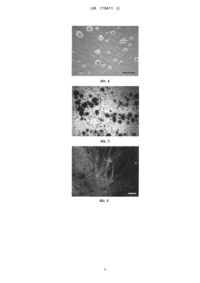
Реферат: Спосіб отримання нейральних клітин-попередників, який включає дезагрегацію нервової тканини, фільтрацію отриманої суспензії клітин, розведення суспензії середовищем культивування і культивування, причому суспензію клітин після фільтрації розводять 6 середовищем DMEM/F12, збагаченим 10 % сироватки крові, до концентрації 1-4×10 клітин/мл, а культивування проводять протягом 3-6 годин до утворення нейральними клітинамипопередниками агрегатів. UA 119411 U (54) СПОСІБ ОТРИМАННЯ НЕЙРАЛЬНИХ КЛІТИН-ПОПЕРЕДНИКІВ UA 119411 U UA 119411 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до галузі біології, а саме біотехнології, і може бути використана в клітинній біології, експериментальній медицині та фармакології. Нейральні клітини-попередники (НКП) широко використовуються для вивчення розвитку нервової системи людини та тварин, моделювання неврологічних захворювань та скринінгу потенціальних фармакологічних препаратів. До теперішнього часу стандартних, загальноприйнятих способів отримання НКП не існує. Тому розробка відтворюваних методів отримання функціонально активних НКП є актуальною проблемою клітинної біології, експериментальної медицини та фармакології. Відомий спосіб отримання НКП, який включає їх сортування за допомогою проточного цитофлуориметра після мічення специфічними флуоресцентними антитілами [1]. Недоліками цього способу є використання дорогого устаткування і дорогих реактивів, низька швидкість процесу отримання, невисокий вихід життєздатних клітин. Найбільш близьким до заявленого є спосіб отримання НКП [2], який включає дезагрегацію нервової тканини шляхом піпетування скляними піпетками зменшуваного діаметру у розчині Хенкса, фільтрацію через клітинний фільтр з діаметром пор 40 мкм, центрифугування суспензії клітин у розчині Хенкса при 240 g протягом 10 хв, подальше центрифугування отриманого осаду клітин в 22 % розчині Перколу при 540 g протягом 10 хв, розведення клітин середовищем 5 Neurobasal до концентрації 1,5 × 10 клітин/мл і культивування в присутності 10 нг/мл фактора росту фібробластів та добавки В27 на протязі 3 діб в чашках Петрі, покритих матригелем. Недоліками цього способу є довготривалість та необхідність використання дорогих матеріалів (перкол, матригель, середовище Neurobasal, фактор росту фібробластів, добавка В27). Задачею корисної моделі є створення такого способу отримання НКП, який би забезпечив можливість прискорити процес їх виділення і не потребував використання дорогих матеріалів. Ця задача вирішується тим, що в способі отримання НКП, який включає дезагрегацію нервової тканини, фільтрацію отриманої суспензії клітин, розведення суспензії середовищем культивування і культивування, згідно з корисною моделлю, суспензію клітин після фільтрації 6 розводять середовищем DMEM/F12, збагаченим 10 % сироватки крові, до концентрації 1-4 × 10 клітин/мл, і культивують до утворення НКП агрегатів. Заявлений спосіб дає можливість скоротити час отримання НКП до 3-6 годин, що в 12-24 рази швидше, ніж у прототипі. При цьому не потрібне використання дорогих матеріалів. Спосіб пояснюється прикладами. Приклад 1 Плід людини 10 тижнів гестації, отриманий в результаті штучного переривання вагітності з письмової згоди поінформованої жінки, поміщали в стерильний контейнер, який містив стерильний розчин Хенкса з антибіотиками (100 од/мл пеніциліну і 100 мкг/мл стрептоміцину) і доставляли в лабораторію на льоду. В умовах стерильного боксу виділяли тканину мозку, відмивали від крові стерильним розчином Хенкса з антибіотиками, подрібнювали, переносили в пробірку та дезагрегували на поодинокі клітини шляхом вібрації з частотою 60 Гц і амплітудою 2 мм протягом 60 сек в 2 мл середовища DMEM/F12, збагаченого 10 % сироватки крові. Отриману суспензію клітин фільтрували через стерильний капроновий фільтр для видалення 6 з'єднувальної тканини, після чого розводили до концентрації 4 × 10 клітин/мл середовищем DMEM/F12, збагаченим 10 % сироватки, і культивували протягом 6 годин до утворення НКП агрегатів (фіг. 1, масштаб: 100 мкм). Життєздатність НКП визначали після утворення ними агрегатів по забарвленню 0,2 % розчином вітального барвника трипанового синього. Підрахунок клітин здійснювали у камері Горяєва. Для цього агрегати дезагрегували на поодинокі клітини шляхом піпетування. Результати наведені в таблиці. Для визначення функціональної активності НКП, агрегати збирали, пересівали та культивували в середовищі DMEM/F12, збагаченому 10 % сироватки. В процесі культивування агрегати прикріплювалися, після чого НКП агрегатів мігрували та диференціювалися в нейрональні β-тубулін-3-позитивні клітини (фіг. 2, фарбування клітин агрегатів флуоресцентними антитілами до маркерних білків нейрональних клітин β-тубулін-3, масштаб: 100 мкм) і гліальні клітини (фіг. 3, масштаб: 50 мкм). Культивування в присутності FGF і EGF НКП, отриманих в результаті дезагрегації агрегатів, супроводжувалося їх проліферацією з наступним утворенням нейросфер (фіг. 4, масштаб: 100 мкм). Приклад 2 Плоди щура 15 тижнів гестації, отримані в стерильних умовах, вміщували в стерильний флакон з розчином Хенкса, який містив 100 од/мл пеніциліну та 100 мкг/мл стрептоміцину. В умовах стерильного боксу ембріони переносили в стерильну чашку Петрі, яка містила 1 UA 119411 U 5 10 15 20 25 30 35 40 45 стерильний розчин Хенкса з антибіотиками. Після цього тканину головного мозку вилучали з голів ембріонів, промивали розчином Хенксу, переносили в пробірку та дезагрегували на поодинокі клітини шляхом вібрації з частотою 60 Гц і амплітудою 2 мм протягом 60 сек в 1 мл середовища DMEM/F12, збагаченого 10 % сироватки крові. Після цього отриману суспензію клітин фільтрували через стерильний капроновий фільтр для видалення з'єднувальної тканини. Далі отримані клітини розводили середовищем DMEM/F12, збагаченим 10 % сироватки крові, до 6 концентрації 1 × 10 клітин/мл і культивували на протязі 3 годин до утворення НКП агрегатів (фіг. 5, масштаб: 100 мкм). Життєздатність НКП визначали після утворення ними агрегатів по забарвленню 0,2 % розчином вітального барвника трипанового синього. Підрахунок клітин здійснювали у камері Горяєва. Для цього агрегати дезагрегували на поодинокі клітини шляхом піпетування. Результати наведені в таблиці. Для визначення функціональної активності НКП агрегати збирали, пересівали і культивували в середовищі DMEM/F12, збагаченому 10 % сироватки. В процесі культивування агрегати прикріплювалися, після чого НКП агрегатів мігрували та диференціювалися в нейрональні β-тубулін-3-позитивні клітини (фіг. 6, фарбування клітин агрегатів флуоресцентними антитілами до маркерних білків нейрональних клітин β-тубулін-3, масштаб: 50 мкм) і гліальні клітини (фіг. 7, масштаб: 50 мкм) та проліферували, утворюючи колонії недиференційованих клітин (фіг. 8, масштаб: 100 мкм). Приклад 3 Новонародженого щура обробляли дезінфикуючим розчином. Тканину мозку видаляли з черепної коробки, промивали стерильним розчином Хенкса з антибіотиками, переносили в пробірку та дезагрегували на поодинокі клітини шляхом вібрації з частотою 90 Гц і амплітудою 2 мм протягом 90 сек в 2 мл середовища DMEM/F12, збагаченого 10 % сироватки крові. Отримані суспензії клітин фільтрували через стерильний капроновий фільтр для видалення з'єднувальної 6 тканини. Далі клітини розводили до концентрації 2 × 10 клітин/мл середовищем DMEM/F12, збагаченим 10 % сироватки крові, і культивували на протязі 6 годин до утворення НКП агрегатів (фіг. 9, масштаб: 100 мкм). Життєздатність НКП визначали по забарвленню 0,2 % розчином вітального барвника трипанового синього. Підрахунок клітин здійснювали у камері Горяєва. Для цього агрегати дезагрегували на поодинокі клітини шляхом піпетування. Результати наведені в таблиці. Для визначення функціональної активності агрегати збирали, пересівали та культивували в середовищі DMEM/F12, збагаченому 10 % сироватки. Культивування агрегатів супроводжувалося їх прикріпленням, після чого НКП агрегатів мігрували та диференціювалися в нейрональні β-тубулін-3-позитивні клітини (фіг. 10, фарбування клітин агрегатів флуоресцентними антитілами до маркерних білків нейрональних клітин β-тубулін-3, масштаб: 100 мкм) і гліальні клітини (фіг. 11, масштаб: 50 мкм) та проліферували, утворюючи колонії недиференційованих клітин, які були нести-позитивними (фіг. 12, фарбування культивованих агрегатів флуоресцентними антитілами до маркерних білків нейральних стовбурових клітин нестину, масштаб: 100 мкм) і віментин-позитивними (фіг. 13, фарбування культивованих агрегатів флуоресцентними антитілами до маркерних білків нейральних прогеніторних клітин віментину, масштаб: 100 мкм). Представлені дані свідчать, що заявлений спосіб, при мінімальних витратах часу і матеріалів, дозволяє отримати функціонально активні НКП з життєздатністю, що перевищує 80 %. Таблиця Життєздатність нейральних клітин-попередників у складі агрегатів Джерело клітин Плоди людини Плоди щурів Новонароджені щури 50 Життєздатність НКП, % 83,3±7,5 85,4±6,5 80,1±5,4 n 24 10 10 Джерела інформації: 1. Uchida N., Buck D. W., He D., et al. Direct isolation of human central nervous system stem cells. // Proc Natl Acad Sci U S A-2000. - Vol. 97, No. 26, P. 14720-14725 2. Цупиков О.М. Метод отримання культури фетальних нейральних прогеніторних клітин з гіпокампа мишей. // Клітинна та органна трансплантологія. - 2014. - Т. 2, № 2. - С. 152-154. 2 UA 119411 U ФОРМУЛА КОРИСНОЇ МОДЕЛІ 5 Спосіб отримання нейральних клітин-попередників, який включає дезагрегацію нервової тканини, фільтрацію отриманої суспензії клітин, розведення суспензії середовищем культивування і культивування, який відрізняється тим, що суспензію клітин після фільтрації 6 розводять середовищем DMEM/F12, збагаченим 10 % сироватки крові, до концентрації 1-4×10 клітин/мл, а культивування проводять протягом 3-6 годин до утворення нейральними клітинамипопередниками агрегатів. 3 UA 119411 U 4 UA 119411 U 5 UA 119411 U 6 UA 119411 U Комп’ютерна верстка О. Рябко Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 7
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61K 35/30
Мітки: нейральних, отримання, спосіб, клітин-попередників
Код посилання
<a href="https://ua.patents.su/9-119411-sposib-otrimannya-nejjralnikh-klitin-poperednikiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання нейральних клітин-попередників</a>
Попередній патент: Спосіб відеоасистованої парієтальної плевректомії з декортикацією легені у хворих на хронічний плеврит запального генезу
Наступний патент: Повітряний регенератор тепла
Випадковий патент: Спосіб селективної флотації частинок вугілля