Спосіб подолання антибіотикорезистентності та/або коліциногенності збудників інфекційних захворювань тварин
Номер патенту: 122748
Опубліковано: 25.01.2018
Автори: Дибкова Світлана Миколаївна, Горбатюк Ольга Іванівна, Андріящук Валентина Олександрівна, Риженко Галина Федорівна, Рєзніченко Людмила Сергіївна, Грузина Тамара Григорівна
Формула / Реферат
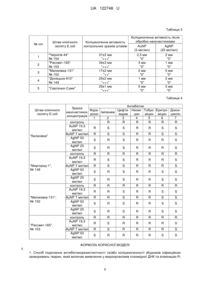
1. Спосіб подолання антибіотикорезистентності та/або коліциногенності збудників інфекційних захворювань тварин, який включає виявлення у мікроорганізмів плазмідної ДНК та елімінацію R-плазмід та/або Col-плазмід, який відрізняється тим, що визначають антибіотикорезистентні та/або коліциногенні штами клінічних ізолятів бактерій Escherichia col і та проводять елімінацію R-плазмід та/або Col-плазмід з відібраних штамів обробкою клітин бактерій в інкубаційному середовищі сферичними наночастинками золота або срібла розміром 30 нм протягом 20-24 годин.
2. Спосіб за п. 1, який відрізняється тим, що використовують наночастинки золота у вигляді колоїдного розчину, одержаного шляхом відновлення аурату калію за методом Девіса.
3. Спосіб за п. 1, який відрізняється тим, що використовують наночастинки срібла у вигляді колоїдного розчину, одержаного конденсаційним методом шляхом відновлення солі срібла.
4. Спосіб за п. 1 або 2, який відрізняється тим, що наночастинки золота вводять до інкубаційного середовища у кількості 5,0-28,0 мкг/мл за металом.
5. Спосіб за п. 1 або 3, який відрізняється тим, що наночастинки срібла вводять до інкубаційного середовища у кількості 20,0-55,0 мкг/мл за металом.
Текст
Реферат: Спосіб подолання антибіотикорезистентності та/або коліциногенності збудників інфекційних захворювань тварин включає виявлення у мікроорганізмів плазмідної ДНК та елімінацію Rплазмід та/або Col-плазмід. Визначають антибіотикорезистентні та/або коліциногенні штами клінічних ізолятів бактерій Escherichia colі та проводять елімінацію R-плазмід та/або Col-плазмід з відібраних штамів обробкою клітин бактерій в інкубаційному середовищі сферичними наночастинками золота або срібла розміром 30 нм протягом 20-24 годин. Використовують наночастинки золота у вигляді колоїдного розчину, одержаного шляхом відновлення аурату калію за методом Девіса. Використовують наночастинки срібла у вигляді колоїдного розчину, одержаного конденсаційним методом шляхом відновлення солі срібла. Наночастинки золота вводять до інкубаційного середовища у кількості 5,0-28,0 мкг/мл за металом. Наночастинки срібла вводять до інкубаційного середовища у кількості 20,0-55,0 мкг/мл за металом. UA 122748 U (12) UA 122748 U UA 122748 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до наномедицини, а конкретно до способів подолання антибіотикорезистентності та коліциногенності збудників інфекційних захворювань тварин. Серед таких захворювань надзвичайно небезпечними є ешерихіози, що викликані патогенними бактеріями Escherichia coli. Ешерихіози характеризуються високою контагіозністю, гострим протіканням у молодняку сільськогосподарських тварин, що проявляється септицемією, токсемією, ентеритом та призводить іноді до летальних наслідків. Для лікування цих захворювань на сьогодні широко застосовують антибіотики. У бактеріальних популяціях розповсюджені екстрахромосомні фактори спадковості плазміди, які несуть гени антибіотикорезистентності (R-плазміди), коліциногенності (Colплазміди), деградації хімічних речовин (D-плазміди), тощо. [Пехов А.П. Основы плазмидологии. - Издательство Российского Университета Дружбы Народов, 1996 г.]. Плазміди антибіотикорезистентності (R-плазміди) несуть гени, що кодують синтез речовин деструкторів антибіотиків, в результаті чого протягом короткого проміжку часу в даній екологічній ніші може сформуватися пул полірезистентних патогенних мікроорганізмів. Широке застосування в медицині та ветеринарії антибіотиків є прямим шляхом виникнення та розповсюдження антибіотикорезистентних бактерій. Резистентність патогенних штамів бактерій є серйозною терапевтичною та епідеміологічною проблемою. В популяції бактерій можуть бути присутніми також плазміди коліциногенності (Соlплазміди). Col-плазміди несуть гени, що кодують синтез білків-бактеріоцинів, які є згубними для близькоспоріднених видів мікроорганізмів. Бактерії Escherichia coli, що мають Col-плазміди, спроможні синтезувати білки коліцини, бактерії Serratia marcescens - білки марцесцини, бактерії Klebsiella pneumoniae - пневмоцини. В природних популяціях кишкової палички близько 20 % штамів мають плазміди коліциногенності. При цьому у популяції, що мають плазміди коліциногенності, коліциногенні бактерії складають звичайно не більше ніж 0,01 % клітин, однак їх число значно зростає в щільних популяціях. Молекули коліцінів адсорбуються на поверхні чутливих бактерій. Іноді достатньо однієї молекули адсорбованого на поверхні клітини коліцину, щоб убити клітину. Механізми загибелі бактерій під дією коліцинів різні. Деякі коліцини порушують функції цитоплазматичної мембрани, інші діють на ДНК або рибосоми. У випадку корисних, наприклад пробіотичних бактерій, коліциногенність є позитивною якістю, оскільки допомагає пробіотикам протистояти патогенній мікрофлорі. Та навпаки, коліциногенність патогенних бактерій підсилює їх позиції в боротьбі з корисною мікрофлорою організму, що спричиняє ослаблення захисних сил організму та значно ускладнює лікування інфекційних захворювань. Тому знаходження шляхів подолання коліциногенності патогенних бактерій, а саме Е.соlі - збудників інфекційних захворювань тварин є дуже актуальним завданням. В той же час на сьогодні засоби та способи подолання коліциногенності патогенних мікроорганізмів не відомі. Для вирішення проблеми подолання антибіотикорезистентності відомий ряд підходів: захист відомих антибіотиків від руйнування ферментами бактерій або видалення їх з бактеріальної клітини за допомогою мембранних насосів; застосування інших антибіотиків обраної групи; застосування комбінації антибіотиків; проведення цільової і вузьконаправленої антибактеріальної терапії; синтез нових сполук, що належать до відомих класів антибіотиків; пошук принципово нових класів антибактеріальних препаратів. Перспективним напрямком подолання стійкості бактерій до антибіотиків є елімінування Rплазмід із бактеріальних клітин за допомогою хімічних речовин. Для R-плазмідовмісних сальмонел, шигел і ешерихій такою ДНК-тропною речовиною є акридиновий жовтогарячий. Однак ця речовина є відомим мутагеном, тому її застосування як лікарського засобу є неможливим. Плазміди антибіотикорезистентності елімінуються з різним рівнем частоти з бактерій Е. соlі під впливом налідиксової кислоти та новобіцину з [Jochen Weisser, Bernd Wiedemann Elimination of plasmids by new 4-quinolones // Antimicrobial agents and chemotherapy. - 1985. - V. 28. - P. 700702]. Показано також, що R-плазміди бактерій Е.соlі та інші елімінуються при дії на клітину деяких гетероциклічних речовин, які здатні зв'язуватися з ДНК [G.Spengler, A.Molnar та інші "Curr Drug Targets", 2006. - 7(7). - P. 823-841]. Елімінація плазмід описаними вище способами досягається за допомогою високотоксичних агентів, або лише для окремих видів бактерій, які є музейними штамами, а не клінічними ізолятами, або спостерігається низька частота елімінації плазмід. Таким чином, сьогодні безпечні, високоефективні та широкоспецифічні елемінуючі R-плазміди хімічні засоби не відомі. В останні роки проведені дослідження з вивчення взаємодії наночастинок золота та срібла з плазмідною ДНК бактерій штаму Е.соlі XL1-Blue та запропоновано використовувати вказані 1 UA 122748 U 5 10 15 20 25 30 35 40 45 50 55 наночастинки для елімінації R-плазмід [заявка № u201613262 від 26.12.2016 на корисну модель "Застосування наночастинок золота або срібла як агентів елімінації плазмід антибіотикорезистентності", автори: Дибкова С.М., Ульберг З.Р. та інші]. Автори показали здатність наночастинок золота та срібла змінювати структуру плазмід шляхом релаксації та викликати високу частоту елімінації рекомбінантних плазмід pUC 19 та pBR322 із бактеріальних клітин штаму Е.соlі XL1-Blue. Плазміди pUC19 мали гени стійкості до антибіотика ампіциліну, а плазміди pBR322 - гени ампіцилінової та тетрациклінової резистентності. Автори відомого рішення на прикладі музейних штамів бактерій Е.соlі XL1-Blue, що містили рекомбінантні R-плазміди, показали можливість видалення їх з клітин за допомогою наночастинок золота або срібла як новий шлях для вирішення задачі подолання антибіотикорезистентності. Оскільки явище стійкості до антибіотиків та явище коліциногенності у патогенних мікроорганізмів, а саме у бактерій Е.соlі - збудників інфекційних захворювань тварин може значно знизити, а іноді й повністю нівелювати ефективність сучасних засобів та способів лікування тварин, проблема подолання антибіотибіотикорезистентності та/або коліциногенності клінічних ізолятів цих бактерій є надзвичайно актуальною. Задачею корисної моделі є розробка ефективного способу подолання антибіотикорезистентності і/або коліциногенності бактерій Е.соlі - збудників інфекційних захворювань тварин. Поставлена задача вирішується новим способом подолання антибіотикорезистентності та/або коліциногенності збудників інфекційних захворювань тварин, що включає виявлення у мікроорганізмів плазмідної ДНК та елімінацію R-плазмід та/або Col-плазмід, в якому згідно з винаходом в клінічних ізолятах бактерій Е.соlі визначають антибіотикорезистентні та/або коліциногенні плазмідовмісні штами та проводять елімінацію R- та/або Col-плазмід з відібраних штамів обробкою клітин бактерій в інкубаційному середовищі наночастинками золота або срібла розміром 30 нм протягом 20-24 годин. Наночастинки застосовують у вигляді колоїдних розчинів. Колоїдний розчин золота з частинками середнього розміру 30 нм може бути одержаний, шляхом відновлення аурату калію за методом Девіса, а колоїдний розчин срібла - конденсаційним методом відновлення солі срібла. Наночастинки золота вводять в інкубаційне середовище у кількості 5,0-28,0 мкг/мл, а срібла - 20,0-55,0 мкг/мл (за металом). Автори вперше вирішили задачу подолання антибіотикорезистентності збудників інфекційних захворювань тварин за допомогою наночастинок золота або срібла, причому ефективність способу показана на клінічних ізолятах патогенних бактерій Е.соlі. Одночасно вперше запропоновано застосування наночастинок золота або срібла для подолання коліциногенності клінічних ізолятів патогенних бактерій Е.соlі шляхом елімінації Col-плазмід. Обробляючи клінічні ізоляти бактерій Е.соlі наночастинками золота або срібла способом, що заявляється, забезпечують видалення плазмідної ДНК з клітин, що містять R-плазміди, з клітин, що містять Col-плазміди та з клітин, що містять обидва види плазмід. Таким шляхом долають антибіотикорезистентність та/або коліциногенність тих штамів, у яких ці явища спричинені наявністю плаз мідної ДНК. Таким чином, спосіб, що заявляється, за допомогою одного засобу дозволяє усунути обидва фактори, які заважають, а іноді перешкоджають ефективному лікуванню інфекційних захворювань тварин, спричинених патогенними штамами Е.соlі. Вельми позитивною якістю запропонованого способу є також малотоксичність наночастинок золота й срібла та низький рівень ефективних концентрацій їх застосування. Нижче наведені приклади здійснення корисної моделі. Приклад 1. Досліджували явище антибіотикорезистентності та коліциногенності у бактерій-збудників інфекційних захворювань тварин. Серед таких бактерій широко відомі патогенні штами бактерій Е. соlі. Визначали наявність плазмідної ДНК (R- та Col-плазмід) в клінічних ізолятах штамів Е.соlі, які виділені з патологічного матеріалу хворих на ешерихіози тварин в лабораторії анаеробних інфекцій Інституту ветеринарної медицини НААН України: Е.соlі штам "Нива", Е.соlі штам "Калинівка", Е.соlі штам "Бердянська", Е.соlі штам "Сергієнко-Суми" та Е.соlі штам "СтароКонстантинівка". Також вивчали збудників ешерихіозів, що були виділені вище вказаною установою з патологічного матеріалу хворих тварин та задепоновані в Депозитарії Державного науково-контрольного інституту біотехнології та штамів мікроорганізмів: Е.соlі штам "Запорізька12" реєстраційний № 150; Е.соlі штам "Чернігів-44" № 154; Е.соlі штам "Рассвет-165" № 153; 2 UA 122748 U 5 10 15 20 25 30 35 40 45 50 55 60 Е.соlі штам "Малинівка-131" № 152; Е.соlі штам "Миргород-1" № 148; Е.соlі штам "Донецька-910" № 149. У бактерій вказаних вище штамів Е.соlі визначали наявність R- та Соl-плазмід. Для скринінгу плазмідної ДНК в бактеріальних клітинах здійснювали процедуру отримання препаратів плазмідної ДНК методом лужного лізису за Бірнбоймом і Долі [Birnboim H.C., Doly J. A rapid alkaline extraction procedure for screening recombinant plasmid DNA // Nucleic Acids Res. 1979. - 7, № 6. - P. 1513-1523]. Осаджували 100 мл нічної культури бактерій, клітини ресуспендували в 6 мл буферу, інкубували 10 хвилин при 0 °C та проводили лужний лізис за вказаною методикою. Отриману плазмідну ДНК візуалізували методом електрофорезу [Маниатис Е., Фрич Э., Сэмбрук Дж. Методы генетической инженерии. Молекулярное клонирование: Перевод с англ. под ред. акад. А.А. Баева и д-ра биол.наук С.К. Скрябина.- М.: Мир, 1984. - 479 с.]. Таким чином виявлено плазмідну ДНК (R- та Col-плазміди) у бактерій наступних клінічних ізолятів Е.соlі: штами "Калинівка", "Миргород-1", "Малинівка-131", "Рассвет-165", "Запорізька12"; "Чернігів-44" "Донецька-910"; "Сергієнко-Суми". Виділені плазміди мали розмір близько 2,7 т.п.н. Штами, які містять R- та/або Col-плазміди відбирали для подальших досліджень їх антибіотикорезистентності та/або коліциногенності. Приклад 2. Визначали наявність коліциногенності патогенних бактерій Е.соlі, що відібрані за прикладом 1. Дослідження проводили за відомою методикою [Клиническая лабораторная аналитика // Под.ред. В.В. Меньшикова. - М.: Агат-Мед, 2003. - Т.IV.]. Штами кишкової палички вирощували 24 години при 37 °C до окремих макроколоній на чашках Петрі з 2 % МПА. Чашки з макроколоніями досліджуваних культур обробляли парами хлороформу протягом 50 хвилин, далі 2,5 години обробляли ультрафіолетом 6-годинні в МПБ культури індикаторного штаму Е.соlі К-12 (безплазмідний штам, дериват Е.соlі XL 1-Blue) об'ємом 0,1 мл змішували з 5 мл розплавленого та охолодженого до 48 °C 0,7 % МПА. Цією сумішшю заливали попередньо оброблені спочатку хлороформом, а потім ультрафіолетом чашки з макроколоніями досліджуваних штамів кишкової палички. Чашки з посівами інкубували 24 години при 37 °C, а далі підсумовували результати. Якщо навколо макроколонії спостерігали зону інгібування індикаторного штаму, досліджуваний штам розглядали як продуцент коліцину. Рівні коліциногенної активності виражали в умовних одиницях - від одного до чотирьох плюсів ("+" - "++++"). За низьку коліцинову активність (один плюс) приймали таку, яка проявлялася в зоні затримки росту індикаторної культури розміром від 7 до 16 мм, середній ("++") та високий ("+++") рівень коліцинову активність із зонами інгібування діаметром 17-26 та 27-36 мм відповідно. Дуже високий рівень ("++++") діаметр зони затримки росту - 37-45 мм. Якщо зона затримки росту була менш ніж 7 мм, активність вважали рівною "0". Наведені у табл. 1 результати досліджень свідчать про наявність коліциногенності у деяких клінічних ізолятів Е.соlі з числа відібраних за прикладом 1. Ці ізоляти містять Col-плазміди і виявляють здебільшого високу коліциногенну активність. Зразки клінічних ізолятів Е.соlі, наведених у табл. 1 (штами "Чернігів-44" № 154, "Рассвет165" № 153, "Малинівка-131" № 152, "Донецька-910" № 149, "Сергієнко-Суми"), які містять Colплазміди направляли на подальшу обробку наночастинками золота або срібла за прикладом 4. Приклад 3. Визначали наявність антибіотикорезистентності патогенних штамів Е.соlі, що відібрані за прикладом 1. Для цього 18-годинні культури, що вирощували на м'ясо-пептонному бульйоні (МПБ) висівали по 0,1 мл на чашки з м'ясо-пептонним агаром (МПА). Одночасно з висівом бактерій на середовище культивування МПА на поверхні середовища розміщували диски з антибіотиками: офлоксацин, ципрофлоксацин, фурадонін, іміпенем, цефтазидим, цефтріаксон, гентаміцин, амікацин, неоміциндоброміцин, еритроміцин, доксициклін. Далі проводили культивування бактерій протягом 24 годин при 37 °C в присутності досліджуваних антибіотиків. Визначення антибіотикорезистентності проводили шляхом візуального спостереження за зонами навколо дисків з антибіотиками. Наявність зони просвітління навколо диска свідчила про чутливість бактеріального штаму до відповідного антибіотика, а відсутність такої зони - про його резистентність. Антибіотикограму досліджуваних плазмідовмісних штамів Е.соlі наведено в таблиці 2, де "R" - відзначено як наявність резистентності, a "S" - відзначено як чутливість до антибіотику. 3 UA 122748 U 5 10 15 20 25 30 35 40 45 50 55 60 Дані таблиці 2 свідчать про те, що усі досліджувані клінічні ізоляти виявилися чутливими до офлоксацину, ципрофлоксацину, цефтріаксону, гентаміцину та амікацину. В той же час усі зразки застосованих в експерименті штамів мають резистентність відносно до решти антибіотиків. Зразки клінічних ізолятів бактерій, у яких була виявлена резистентність відноcно до певних антибіотиків, відбирали та використовували в наступних експериментах з подолання антибіотикорезистентності до цих антибіотиків за прикладом 4. Приклад 4. Для подолання антибіотикорезистентності та коліциногенності проводили обробку зразків патогенних штамів Е.соlі, відібраних за прикладами 2 та 3, наночастинками золота (AuNP) або срібла(АgNР). Для цього застосовували колоїдний розчин золота зі сферичними наночастинками золота середнього розміру 30 нм, одержаний відновленням аурату калію ацетоном або етанолом з використанням як вихідної речовини золотохлористоводневої кислоти (метод Девіса). Для приготування препаратів наносрібла використовували колоїдний розчин срібла зі сферичними наночастинками середнього розміру 30 нм, який одержано конденсаційним методом шляхом відновлення солей срібла. Готували вихідні стерильні водні препарати з вмістом наночастинок золота 38,6 мкг/мл за металом та з вмістом наночастинок срібла 80 мкг/мл за металом. Для елімінації R-плазмід та Соl-плазмід 18-годинні культури зразків бактерій, відібраних за прикладами 2 та 3, розводили МПБ у співвідношенні 1:50 та підрощували на качалці 2 години до 9 4 5 титру клітин 1-2×10 . Далі 1×10 - 1×10 клітин вносили в пробірки з 2 мл МПБ, куди попередньо додавали вихідний препарат наночастинок золота або срібла у кількості, що забезпечувала вміст золота 7 або 19,3 мкг/мл за металом, або срібла у кількості 25 або 50 мкг/мл за металом. Вирощували культури на качалці у темряві при 37 °C. Таку обробку виконували протягом 20-24 годин. Оброблені наночастинками бактеріальні культури висівали по 0,1 мл на чашки з МПА та визначали коліциногенність в зразках, відібраних за прикладом 2, так, як описано у прикладі 2, а в зразках, відібраних за прикладом 3, оцінювали антибіотикорезистентність, так, як описано в прикладі 3. Крім цього оброблені наночастинками металів клітини всіх досліджуваних клінічних ізолятів перевіряли на наявність плазмідної ДНК шляхом виділення плазмід методом Бірнбойма і Долі з послідуючим електрофорезом в агарозному (1 %) гелі та візуалізацією в УФ-світлі як описано в прикладі 1. В результаті такого скринінгу плазмідної ДНК в жодному зі зразків клінічних ізолятів, відібраних за прикладами 2,3 та оброблених наночастинками золота або срібла як описано вище, не було знайдено R-плазмід та Соl-плазмід, що свідчить за повну елімінацію плазмідної ДНК з клітин досліджуваних штамів Е.соlі. В таблиці 3 наведено дані щодо коліциногенності досліджуваних штамів після їх обробки наночастинками у порівнянні з необробленими бактеріями (контрольні зразки). Як видно з табл. 3, всі досліджувані штами, які містять Соl-плазміди, після обробки наночастинками навіть в мінімальних концентраціях втратили свою коліциногенність. Проведені дослідження показали таку ефективність наночастинок як золота, так і срібла у всьому концентраційному діапазоні їх застосування. Порівняння даних щодо резистентності штамів бактерій, оброблених наночастинками, з результатами досліджень резистентності зразків, відібраних за прикладом 3 (контрольних) показало, що вдалося подолати антибіотикорезистентність чотирьох з досліджуваних штамів бактерій відносно до п'яти із семи застосованих антибіотиків, що свідчить про ефективність способу, що заявляється у цих випадках. Негативний результат у випадку решти штамів відносно до усіх антибіотиків, а також у випадку штамів наведених у табл. 4 відносно до цефтазидиму і неоміцину, не зважаючи на досягнуту елімінацію R-плазмід можна пояснити наявністю у бактерій вказаних штамів інших факторів антибіотикорезистентності крім Rплазмідної. В таблиці 4 представлені результати оцінки ефекту подолання антибіотикорезистентності клінічних ізолятів бактерій Е.соlі "Калинівка", "Миргород-1", "Малинівка-131" № 152 та "Рассвет165" № 153. Як свідчать дані табл. 4, особливо ефективними виявилися наночастинки як золота так і срібла відносно до доксицикліну (у всіх чотирьох штамах) та цефтазидиму (у трьох штамах), де досягається подолання антибіотикорезистентності у всьому діапазоні концентрацій металів. В інших випадках наночастинки діють вибірково: ефективне тільки срібло (фурадонін) або тільки золото (іміпенем). Відносно до еритроміцину наночастинки золота і срібла долають резистентність клінічного ізоляту штаму Е.соlі "Малинівка-131" № 152, в той час як клітини 4 UA 122748 U 5 бактерій штаму Е.соlі "Калинівка" стають чутливими до цього антибіотика тільки під дією золота, а бактерії штаму Е.соlі "Миргород-1" № 148 та Е.соlі "Рассвет-165" № 153 - тільки під дією срібла. Таким чином, наведені експериментальні дані переконливо підтверджують можливість подолання антибіотикорезистентності та коліциногенності бактерій Е.соlі - збудників інфекційних хвороб тварин за допомогою наночастинок золота та срібла в умовах пропонованого способу, що можна розглядати як новий ефективний шлях вирішення цих проблем при розробці сучасних ефективних засобів та способів антибіотикотерапії у ветеринарії. Таблиця 1 № п/п 1 2 3 4 5 6 7 8 Штам клінічного ізоляту Е.соlі "Запорізька-12" № 150 "Чернігів-44" № 154 "Рассвет-165" № 153 "Малинівка-131" № 152 "Миргород-1" № 148 "Донецька-910" № 149 "Сергієнко-СУМИ" "Калинівка" Коліциногенна активність 0 31±2 мм - "+++" 34±3 мм - "+++" 17±2 мм - "++" 0 25±2 мм - "+++" 29±1 мм - "+++" 0 10 Таблиця 2 Антибіотик ОфГенЦипроЦеф- ЦефАміШтам клінічного лакФура- Іміпета№ п/п флоксатази- тріаккаізоляту Е.соlі садонін нем міцин дим сон цин цин цин 1 2 3 4 5 6 7 8 "Миргород-1" 1 S S R R R S S S № 148 2 "Калинівка" S S R R R S S S "Малинівка-131" 3 S S R R R S S S № 152 "Рассвет-165" 4 S S R R R S S S № 155 "Запорізька-12" 5 S S R R R S S S № 150 "Чернігів-44" 6 S S R R R S S S №154 "Донецька-910" 7 S S R R R S S S № 149 8 "Сергієнко-Суми" S R R R R S S S 5 То- ЕриНебро- троомімі- міцин цин цин 9 10 11 Доксициклін 12 R R R R R R R R R R R R R R R R R R R R R R R R R R R R R S R S UA 122748 U Таблиця 3 Штам клінічного ізоляту Е.соlі № п/п 1 2 3 4 5 "Чернігів-44" № 154 "Рассвет-165" № 153 "Малинівка-131" № 152 "Донецька-910" № 149 "Сергієнко-Суми" Коліциногенна активність контрольних зразків штамів 31±2 мм "+++" 34±3 мм "+++" 17±2 мм - "++" 25±2 мм "+++" 29±1 мм "+++" Коліциногенна активність після обробки наночастинками AuNP AgNP (5 мкг/мл) (25 мкг/мл) 2,5 мм 2 мм "0" "0" 3 мм 1 мм "0" "0" 2 мм 5 мм "0" "0" 1 мм 2 мм "0" "0" 5 мм 5 мм "0" "0" Таблиця 4 Штам клінічного ізоляту E.coli "Калинівка" "Миргород-1", № 148 "Малинівка-131", № 152 "Рассвет-165", № 153 Антибіотик Зразок ФураЦефта- Неомі- Тобро- Еритро- Доксинаночастинок, Іміпенем донін зидим цин міцин міцин циклін концентрація 1 2 3 4 5 6 7 контроль R R R R R R AuNP 19.3 R S S R R S S мкг/мл AuNP 7 мкг/мл R S S R R S S AgNP 50 S R S R R R S мкг/мл AgNP 25 S R S R R R S мкг/мл контроль R R R R R R R AuNP 19.3 R S S R R R S мкг/мл AuNP 7 мкг/мл R S S R R R S AgNP 50 S R S R R S S мкг/мл AgNP 25 S R S R R S S мкг/мл контроль R R R R R R R AuNP 19.3 R R S R R S S мкг/мл AuNP 7 мкг/мл R R S R R S S AgNP 50 S R S R R S S мкг/мл AgNP 25 S R S R R S S мкг/мл контроль R R R R R R R AuNP 19.3 R S R R R R S мкг/мл AuNP 7 мкг/мл R S R R R R S AgNP 50 S R R R R S S мкг/мл ФОРМУЛА КОРИСНОЇ МОДЕЛІ 5 1. Спосіб подолання антибіотикорезистентності та/або коліциногенності збудників інфекційних захворювань тварин, який включає виявлення у мікроорганізмів плазмідної ДНК та елімінацію R 6 UA 122748 U 5 10 плазмід та/або Col-плазмід, який відрізняється тим, що визначають антибіотикорезистентні та/або коліциногенні штами клінічних ізолятів бактерій Escherichia col і та проводять елімінацію R-плазмід та/або Col-плазмід з відібраних штамів обробкою клітин бактерій в інкубаційному середовищі сферичними наночастинками золота або срібла розміром 30 нм протягом 20-24 годин. 2. Спосіб за п. 1, який відрізняєтьсятим, що використовують наночастинки золота у вигляді колоїдного розчину, одержаного шляхом відновлення аурату калію за методом Девіса. 3. Спосіб за п. 1, який відрізняється тим, що використовують наночастинки срібла у вигляді колоїдного розчину, одержаного конденсаційним методом шляхом відновлення солі срібла. 4. Спосіб за п. 1 або 2, який відрізняється тим, що наночастинки золота вводять до інкубаційного середовища у кількості 5,0-28,0 мкг/мл за металом. 5. Спосіб за п. 1 або 3, який відрізняється тим, що наночастинки срібла вводять до інкубаційного середовища у кількості 20,0-55,0 мкг/мл за металом. Комп’ютерна верстка В. Мацело Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 7
ДивитисяДодаткова інформація
Автори англійськоюDybkova Svitlana Mykolaivna, Rieznichenko Liudmyla Serhiivna, Hruzina Tamara Hryhorivna, Ryzhenko Halyna Fedorivna, Horbatiuk Olha Ivanivna, Andriaschuk Valentyna Oleksandrivna
Автори російськоюДибкова Светлана Николаевна, Резниченко Людмила Сергеевна, Грузина Тамара Григорьевна, Рыженко Галина Федоровна, Горбатюк Ольга Ивановна, Андриящук Валентина Александровна
МПК / Мітки
МПК: G01N 27/447, B01J 23/48, G01N 1/28, B82B 1/00, C12R 1/19, C12N 1/20, G01N 33/483
Мітки: спосіб, коліциногенності, антибіотикорезистентності, збудникiв, подолання, інфекційних, тварин, захворювань
Код посилання
<a href="https://ua.patents.su/9-122748-sposib-podolannya-antibiotikorezistentnosti-ta-abo-kolicinogennosti-zbudnikiv-infekcijjnikh-zakhvoryuvan-tvarin.html" target="_blank" rel="follow" title="База патентів України">Спосіб подолання антибіотикорезистентності та/або коліциногенності збудників інфекційних захворювань тварин</a>
Попередній патент: Спосіб збору, аналізу, зберігання і транспортування молока на мобільному молокоприймальному пункті
Наступний патент: Спосіб збільшення напруги на опорі навантаження при живленні від джерела постійної напруги
Випадковий патент: Десульфураційний агент для сталі та спосіб десульфуризації сталі