Спосіб екстракорпоральної електрохімічної детоксикації крові
Номер патенту: 22372
Опубліковано: 03.03.1998
Автори: Федорук Олександр Леонідович, Громико Андрій Володимирович, Бойко Віктор Олексійович, Столяренко Генадій Степанович
Формула / Реферат
1. Спосіб екстракорпоральної електрохімічної детоксикації крові озоно-кисневою сумішшю в детоксикаційному модулі, який відрізняється тим, що обробку плазми крові проводять в тонкій, стікаючій по поверхні, плівці плазми, яка циркулює по замкнутому контуру.
2 Спосіб за п. 1, який відрізняється тим, що плазму крові перед обробкою розводять 0,9% розчином NaCI у співвідношенні 1:1 та обробляють дозою озону 0,1-0,6 моль/моль.
Текст
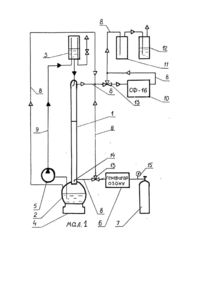
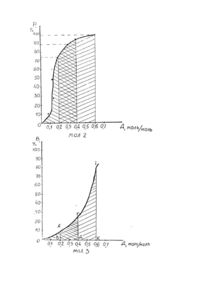
Винахід відноситься до розділу медицини І може бути використаний у Інтенсивній терапії хворих тяжким ендотоксикозом. Методи екстракорпоральної обробки крові сьогодні вважаються необхідним компонентом програми активної детоксикації, які використовуються у лікуванні багатьох гострих 1 хронічних захворювань. Це пов'язано з накопиченням знань про дію екзогенних та ендогенних-токсичних субстанцій на організм та поширення арсеналу методів еферентної терапії. До методів екстракорпоральної детоксикації крові відносяться операції спрямовані на зміну клітинного, білкового, електролітного та газового складу крові. Ефективність цих операцій визначається отупінню виваженості їх головних ефектів: детоксикація, реологічна корекція, Імунокорекція. Детоксикація досягається перш за все екстракорпоральною елімінацією екзогенних та ендогенних токсичних субстанцій. Реокорегуюча дія цих методів пов'язана з впливом практично на всі фактори, які визначають текучі властивості крові: плазменні, клітинні та судинні. Імунокорегуючий ефект екстракорпоральних операцій реалізується декількома механізмами. По-перше при механічному видаленні із кров'яного русла антигенів, у тому числі аутоантигенів, на короткий проміжок часу "розвантажує" специфічні Імунні механізми, що забезпечує зростання надійності функціонування всієї Імунної системи, По-друге Імунокорегуючий ефект забезпечує механічне видалення Із кровотоку факторів гуморального імунітету. Третім механізмом імунокорекції є зміни .функціонування елементів моноцитарно-макрофагальної системи (К.Я.Гуревич, А.Л.Костюченко, 1993). Кров є не тільки головним транспортним середовищем організму, але і в значній мірі основою дoстантної регуляції його різноманітних функцій в інтересах збереження стабільності гомеостазу організма. В залежності від використанної технологічної основи операції хірургії крові діляться на: мембранні (гемодіаліз, гемооксигенація, гемоультрафільтрація); сорбційні (гемосорбція, плазмосорбція, лімфосорбція); центрифужні (плазмоферез, лейкоцитоферез); преципітатні (кріоферез, гепарінова преципітація); електромагнітні (опромінення -ультрафіолетове, лазерне, магнітне, рентгенівське); електрохімічне окислення (гіпохлоріт натрію). Різні технології обробки крові забезпечують ту чи іншу ступінь селективності виведення патологічних чи фізіологічних субстратів, що забезпечує досягнення специфічних ефектів екстракорпоральних операцій. Умовно еферентні операції поділяються на неселективні, напівселективні та селективні. Селективні екстракорпоральні операції (імуносорбція, біоспецифічна сорбція) через складність та невисоку ефективність не знайшли використання в практичній діяльності. Крім того, головні операції еферентної терапії мають мембранну, сорбційну та центрифужну технологічну основу, що не дозволяє моделювати біологічний процес детоксикації. Тому серед специфічних ефектів детоксикація у даних операціях не є ведучою. Ведуче значення в реалізації біологічної трансформації токсичних субстанцій має моноамінооксидантна система печінки, а в основі її фукнціонування знаходяться процеси окислення. Найближчими до біохімічних процесів детоксикації та по селективності дії є методи електрохімічного окислення. Вперше Ідея моделювання детоксикуючої функції печінки за допомогою електрохімічного окислення була висунута у 1975 році S.I.Yao, S.K.Wol.fson, які запропонували видаляти надлишок таких речовин як - сечовина, аміак, кетони, метанол та ін., з крові, або інших біологічних рідин, у вживляемому, або діючому в екстракорпоральному шунті електрохімічному вічку. Майже в той же час у бившому СРСР Ю.М.ЛопухІн, О.І.Арчаков та їх співробітники створили електрохімічну модель цитохрома Р-450, а також детоксикаційну екстракорпоральну систему, яка складалась з реактора окислювача та діалізатора. Перші спроби моделювання детокси-каційної функції печінки зроблені Г.Ф.Жирновим Із співробітниками у 1979 році. Але не дивлячись на велику зацікавленість до методів електрохімічного окислення, вони не знайшли клінічного застосування. Головною причиною невдач була травмуюча дія електроокислення на кров людини. У 1982 році D.PIetcher запропонував метод непрямого електрохімічного окислення крові. У запропонованому методі кров безпосередньо не вступає в контакт з електрохімічною системою. В якості найбільш зручного транспортувальника кисню запропоновано було Ізотонічний розчин натрію хлориду (0,89%), у якому під час електролізу на платинових анодах відбувається накопичення активного хлору у вигляді гіпохлориту натрію. Гіпохлорит натрію являє собою з'єднання з невеликою молекулярною масою і малим структурним розміром і тому може вільно проникати через клітинні мембрани, а значить окислювати токсини які містяться не тільки в крові, але й у тканинах. У бувшому СРСР перші установки по отриманню гіпохлориту натрію створили В.І.Сергієнко, Ю.М.Лопухін, АХМартинов у 1985 році. Втілення у практику цього методу відбулося після серійного випуску апаратів ЕДО-3 та ЕДО-4, починаючи з 1994 року. Але не дивлячись на очевидну принадність даного методу, він також має свої недоліки. По-перше, окислювальна здатність гіпохлориту натрію не дозволяє суттєво впливати на токсичні дози білірубіну, сечовини, креатинину, та Інших компонентів ендотоксикозу. По-друге, під час дії на плазму гіпохлорит натрію розпадається з утворенням іонів CLO- та СІ - (активний хлор) які взаємодіють з органічними субстанціями плазми, утворюючи не властиві для організму хлорорганічні з'єднання. З метою підвищення ефективності та безпечності непрямого електрохімічного окислення запропоновано використання озону. В останній час увагу клініцистів пригортає здатність озону окислювати токсичні сполуки. Перші експериментальні роботи по екстракорпоральній обробці озоном крові були проведені у Горьковському медичному Інституті у 1991 р. Конторщиковою К.Н. Дослідники кров тварин поміщали у скляний оксигенатор та барботували озоно-кисневою сумішшю на протязі 5 хвилин, при швидкості 1 л/хв., з концентрацією озону 0,048 мг/л. Отримані результати свідчать про окислення токсичних з'єднань шляхом дії на пептидні зв'язки в ненасичених жирних кислотах. При цьому не відбувається значної активації перикисного окислення ліпідів. Перший досвід клінічного застосування озонотерапії опубліковано співробітниками Харківського обласного нефро-урологічного центру Ю.І.Козіним, В.І.Савенковим, В.І.Жуковим, В.В.Моновим у 1996 році. Автори використали озонотерапію для 23 хворих сепсисом. При цьому плазму хворого після плазмофорезу та плазмо-заміщення обробляли у барботажній камері до досягнення у ній концентрації озону 1,2±0,2 мг/л. Після цього плазму повертали внутрівенно. Автори відмічають, що така екстракорпоральна операція дозволяє знизити токсичність плазми без підвищення перекисного окислення ліпідів. Незалежно від вищезгаданних авторів, на початковому етапі особистих досліджень ми провели оцінку ефективності барботування плазми крові озоном, яка виявила слідуючі недоліки: утворення великої кількості піни, що ускладнює технологічний процес та приводить до втрати 40-50% плазми 1 використання окислюваючої здатності озону тільки на 50%. В основу винаходу покладено задачу підвищення ефективності детоксикації шляхом хемодеструкції білірубіну та руйнування перекисних з'єднань і вільних радикалів. Задача реалізується хемодеструкцією токсичних речовин плазми озоно-кисневою сумішшю у тонкостікаючій плівці плазми крові, ціркулюючій в екстракорпоральному модулі. Запропонований нами спосіб детоксикації відрізняється від аналога тим, що токсична плазма розводиться 0,9% розчином NaCl співвідношенні 1:1 та обробляється дозою озону від 0,1 до 0,6 моля озону на 1 моль білірубіну. Новим у даному винаході є пропозиція обробляти токсичну плазму з метою руйнування білірубіну в її об'ємі, розведеному 0,9% NaCI у співвідношенні 1:1, озоново-кисневою сумішшю, що дозволяє використовувати окрім окислюючих здатностей озону також його здатність Ініціювати у водних розчинах ланцюгові реакції. Крім того озон у водних розчинах при нормальних умовах розкладається в 5-8 разів швидше ніж у газовій фазі [Розумовський С.Д., Заїков Г.Е, Озон та його реакції з органічними з'єднаннями, 1974]. Першою стадією реакцій є утворення лабільного П-комплексу, який в свою чергу швидко розпадається на два фрагменти: біполярний іон (карбонілоксид) та карбоніл, далі вони реагують між собою, з водою та розчиненим у ній киснем, утворюючи складний комплекс кисневих сполук. Реакцію біполярного Іону з водою вперше відкрив М.В.Поспелов у 1966 році [Поспелов М.В., Міняйло А.Т., Каліко О.Р. Журнал органічної хімії, 1978]. Під час реакцій озону з органічними сполуками утворюються вільні радикали, що пояснює випадки спалахування субстрату. При роботі з водними розчинами органічних сполук спалахів субстрату не спостерігалося [Thorp К., Bibliography of ozone technology. V. 2., 1955]. Вода зв'язує утворені радикали органічного походження згідно запропонованого нами механізму руйнування білірубіну (мал. 4). При розробці механізму руйнування білірубіну ми базувались на роботі доктора хімічних наук Розумовського С.Д. "Озон в процессах восстановления качества води" [Журнал ВХО им. Д.И. Менделєєва № 1 том XXXV, 1990]. Таким чином суттєвою особливістю винаходу є те, що під час детоксикації плазми озоно-кисневою сумішшю ефективно проходить руйнування білірубіну в об'ємі плазми, зв'язування водою утворених вільних радикалів та розклад розчиненого озону з насиченням плазми киснем. У цій роботі використовувались матеріали по екстракорпоральній детоксикації хворих з механічною жовтяницею. Тривала механічна жовтяниця вважається головною передпосилкою розвитку печінкової недостатності після операцій з зовнішнім та внутрішнім дренуванням жовчних шляхів. Консервативні заходи, спрямовані на підтримку обмінних процесів в гепатоцитах (використання есенціалє, рібоксину, сірепару, вливання гепастерилу, використання великих доз глютамінової кислоти, розчинів глюкози з Інсуліном та Ін.) виявляється не рідко недостатнім, щоб запобігти прогресуванню гепатопривного синдрому. В деяких випадках, не дивлячись на зни-ження протокової гіпертензії, рівень білірубінемії у перші дні не змінюється, а навіть зростає, що завжди являється критерієм можливого погіршення функціонального стану печінки. Форсований діурез в таких обставинах не забезпечує необхідного детоксикуючого ефекту. Низька сорбційна здатність вугільних сорбентів по відношенню до білірубіну при високому ступені гіпербілірубінемії не залишає надії на успіх гемосорбції. В даний час методом вибору для екстракорпоральної детоксикації в таких клінічних ситуаціях є обмінний плазмо-форез. Не дивлячись на свою ефективність плазмофорез має суттєвий недолік, пов'язаний з видаленням великої кількості плазми (до 50% об'єму циркулюючої плазми (ОЦП). З ціллю підвищення ефективності детоксикації білірубін в плазмі хворих механічною жовтяницею ми окислювали озоном. Після детоксикації плазма поверталась хворому. Експерименти по екстракорпоральному окисленню білірубіну в плазмі проводилися на модулі зображеному на мал. 1. Модуль складається із слідуючих частин: 1. Окислювальна колонка. 2. Приймальна ємність. 3. Стерильний флакон ємкісною 500 мл. 4. Магнітний змішувач. 5. Роліковий насос. 6. Генератор озону. 7. Кисневий балон. 8. Магістраль озоно-кисневої суміші. 9. Магістраль плазми. 10. Спектрофотометр. 11. Буферна ємність. 12. Ємність з 2% розчином гідроокису натрію. 13. Триходовий кран. 14. Штуцер. 15. Редуктор. Окислювальна колонка (1) та приймальна ємність (2) виготовлені Із товстостінного та термічностійкого скла. Окислювальна колонка являє собою розбірну порожнисту трубку у верхній частині якої є пристрій для забезпечення рівномірного стікання подаваємої плазми по всій поверхні колонки, що дозволяє створити площу контактування 0,9 м2. У нижній частині колонки впаяний штуцер (14) вихідним отвором вниз, що дозволяє турбулізувати потік подаваємої озоно-кисневої суміші. Методика роботи на модулі. Стерелізація колонки (1), приймальної ємкості (2) та триходових кранів (13) проводилось шляхом автоклавування. Магістралі озоно-кисневої суміші (8) та плазми (9) формувалися з одноразових систем для переливання крові. Дезінтоксикаційний модуль збирався в стерильних умовах. Після проведення хворому плазмоферезу на апараті ПФ-05, плазма розводилась 0,9% розчином натрію хлориду у співвідношенні 1:1 та збиралася в стерильні флакони ємкістю 500 мл. Один з флаконів (3) підключався в дезінтоксикаційний модуль. Плазма самопливом поступала у верхню частину окислювальної колонки (1). Подаваємий з балону (7) через редуктор (15) кисень Іонізувався в генераторі озону (6) та отримана озоно-киснева суміш Із швидкістю 80-100 мл/хв поступала у нижній штуцер (14) окислювальної колонки (1). Озоно-киснева суміш в окислювальній колонці йшла протитоком стікаючі по стінках колонки плазми. Після поверхневого контакту з озоном плазма збиралась в приймальну ємність (2) та роликовим насосом (5) подавалась в стерильний флакон (3). Швидкість циркулювання плазми була 100-180 мл/хв. Загальний час обробки плазми складав 4050 хвилин. Після обробки озоном плазма збиралася в стерильний флакон (3) та поверталась хворому. Концентрація озону в озоно-кисневій суміші до її подачі в окислювальну колонку та на виході з неї визначалася за допомогою спектрофотометра СФ-16 [Разумовский С.Д., Заиков Г.Е. Озон и его реакции с органическими соединениями. - М.: Наука, 1974. - 322 с]. Після аналізу озоно-киснева суміш проходила через буферну ємність (11), ємність (12) з розчином 2% гідроокису натрія та спрямовувалася в вентиляцію. Проведені експерименти по екстра-корпоральній детоксикації плазми крові показали можливість застосування селективної дози озону для руйнування білірубіну. Було проведено 126 експерементів при слідуючих умовах: об'єм обробляємої плазми - 500 мл; доза озону - 0,1-0,6 моль/моль; температура обробляємої плазми -10-37°С; час обробки плазми - 30-40 хвилин; швидкість обробки плазми - 100-180 мл/хв; концентрація білірубіну в плазмі 100-600 мкмоль/л. По результатам експериментів були побудовані графіки, зображені на мал. 2 та 3. Графік залежності руйнування загального білірубіну від поглиненої дози озону (мал. 2) побудовано в координатах: D-доза поглиненого озону; Р-руйнування загального білірубіну. Графік ілюструє динаміку руйнування білірубіну в плазмі крові в залежності від кількості .поглиненого плазмою озону (кількість зруйнованого білірубіну дана в % від початкового; кількість поглиненого озону в молях езону/моль білірубіну). Як видно з графіка із збільшенням дози поглиненого озону збільшується кількість зруйнованого білірубіну, досягаючи 98%, при дозі озону 0,6 моль/моль. Але цей хемо-деструкційний процес лімітується зростанням другої небажаної дії озону. Це наглядно Ілюструє графік, зображений на мал. 3. Графік залежності деструкції Імунолобулінів крові (G, М, А) від поглиненої дози озону побудовано в координатах: D - доза поглиненого озону; В - деструкція Імуноглобулінів плазми. Графік ілюструє динаміку руйнування цінних компонентів плазми (таких, як Імуноглобулін різних класів) в залежності від дози поглиненого озону, Кількість зруйнованих Імуноглобулінів дана в % від початкового; доза поглиненого озону в молях озону/моль білірубіну. Застосування доз поглиненого озону більш як 0,4 моль/моль (площа ДПК, мал. 3) призводить до різкого зростання деструкції Імуноглобулінів класів G, М, А, що є дуже небажаним. Для збереження цінних компонентів плазми найбільш сприятливим є застосування доз озону від 0 до 0,2 моль/моль (площа ОАВ). Але застосування таких доз озону мало ефективне з точки зору на його руйнівну здатність по відношенню до' білірубіну та збільшує час обробки плазми в 2-3 рази. Застосування дози озону в межах 0,2-0,4 моль/моль (площа ВАГД, мал. 3) є щадящим по відношенню до імуноглобулінів плазми та ефективно руйнують білірубін в плазмі при оптимальному часі обробки 40 хвилин. Таким чином можна констатувати, що нам вдалося експериментально знайти дозу озону (0,2-0,4 моль/моль), яка володіє селективною дією при очищенні плазми та дозволяє зберегти біологічно цінні компоненти при даних умовах проведення експерименту. Після експериментального відпрацювання технології окислення метод був використаний для лікування хворих механічною жовтяницею. Приклади клінічного застосування. Приклад 1. Хворий Копанов Олександр Абрамович, 1928 року народження, історія хвороби № 8751, поступив у хірургічне відділення Черкаської міської лікарні № 1 20.06.1996 року з діагнозом: механічна жовтяниця, холедохолетіаз. Тривалість механічної жовтяниці 2 місяці. При поступленні стан хворого тяжкий. AT 110/80 мм рт.ст., PS-100 уд/хв, Нв-131 г/л; Ег-4,2 г/л; протромбін - 66%; фібріноген - 1394 мг/л; фібринолітична активність плазми 9%; загальний білок 59 г/л; загальний білірубін - 424,01 мкмоль/л (непрямий - 118,01 мкмоль/л, прямий - 306 мкмоль/л). ALAT - 3,7 мкмоль/л; ASAT 1,8 мкмоль/л; лужна фосфотаза - 392; Тл - 42 %, Вл - 28%, Тх - 28%, Тс - 14%, Та - 22%; ІдА - 2,214 г/л, IgG - 10,8 г/л, ІдМ - 2,1 г/л, ЦІК - 528 ОД, CM - 0,528 ум. од. густини. Після проведеної передопераційної підготовки, 22 липня 1996 року була проведена дренуюча операція з приводу механічної жовтяниці. Операція була виконана за 50 хвилин І пройшла без ускладнень. Для подальшого лікування хворого було переведено у відділення реанімації. Після операції стан хворого стабільний. Хворий у свідомості, АТ-110/70 мм рт.ст., PS-108 ударів за хвилину. Інфузійна терапія в об'ємі 3,5 літра на добу включала - реополіглюкін, гемодез, кристалоїди, плазму. Для попередження печінкової недостатності з другої доби хворому проводили плазмо-ферез на вітчизняному фракціонаторі крові ПФ-05. Об'єм ексфузії плазми складав, за один сеанс, 1,8-2 літра. В подальшому ця плазма піддавалась екстракорпоральній модуляції озоном по ви-щевикладеній технології І після цього поверталась хворому. В процесі операції плазмозаміщення проводилось розчинами декстранів і кристалоїдів, По показанням використовувались препарати кальція, магнію, стероїди, прямі кардіотоніки та антигистамінні засоби. По цій технології хворому було проведено три сеанси детоксикації через день. За весь період лікування використано 480 мл плазми та 800 мл реополіглюкіну. На дев'ятий день стан хворого задовільний. Гемодинаміка стабільна. Загальний білірубін 63 мкмоль/л; лужна фосфотаза 259,3 мкмоль/л; AsAT - 0,8 мкмоль/л; ALAT - 1,2 мкмоль/л; Тл - 38%, Вл - 24%, Тх - 22%, Тс 19%, Та - 20%; ІдА- 2,314 г/л; IgG - 9,81 г/л; ІдМ - 1,5 г/л; CM- 0,324 ум. од. густини. На дванадцятий день післяопераційного періоду у задовільному стані хворий був виписаний з лікарні. Приклад 2. Хворий Заїка Василь Олексійович, 1921 року народження, Історія хвороби № 15882, поступив у хірургічне відділення Черкаської міської лікарні № 1 19.11.1996 року з діагнозом: механічна жовтяниця, Сr підшлункової залози. Тривалість механічної жовтяниці понад 2 місяці. При поступленні стан хворого тяжкий. AT 130/80 мм рт.ст., PS-110 уд/хв, Нв -150 г/л; Er - 5,2 г/л; протромбін - 52%; фібріноген - 1324 мг/л; фібринолітична активність плазми 7%; загальний білок 72 г/л; загальний білірубін - 535,01 мкмоль/л (непрямий - 180,01 мкмоль/л, прямий - 355 мкмоль/л). ALAT - 4,2 мкмоль/л; ASAT - 2,0 мкмколь/л; лужна фосфотаза 402; Тл - 41 %, Вл - 28%, Тх - 30%, Тс - 16%. Та - 24%, ІдА - 2,14 г/л, IgG - 11,7 г/л, ІдМ - 1,9 г/л, ЦІК -410 ОД, CM 0,497 ум. од. густини. Після трьох днів передопераційної підготовки була проведена дренуюча операція холедохоеюноанастомоз. Подальше лікування хворого було проведено у відділенні реанімації. Після операції стан хворого тяжкий. Хворий у свідомості, PS-112, AT - 110/70 мм рт.ст. Інфузійна терапія в об'ємі 4 літра на добу включала реополіглюкін, гемодез, кристалоїди, плазму. У ранньому післяопераційному періоді хворому через день виконали три сеанси плазмоферезу на вітчизняному фракціонаторі крові ПФ-05. Об'єм ексфузії плазми складав, за один сеанс, 1,5-1,8 літра. Отримана плазма піддавалась екстракорпоральному окисленню озоном і поверталась хворому. В процесі маніпуляції плазмозаміщення проводилось розчинами декстранів і кристалоїдів. За весь післяопераційний період лікування використано 360 мл плазми та 800 мл реополіглюкіну, 400 мл гемодезу. На дев'ятий день післяопераційного періоду стан хворого задовільний. Загальний білок - 69,4 г/л; загальний білірубін - 72 мкмоль/л; лужна фосфотаза 284,3 мкмоль/л; AsAT - 1,4 мкмоль/л; ALAT - 0,9 мкмоль/л; Тл-41%,Вл-20%.Тх-20%.Тс-16%.Та-21%. ІдА-2,841 г/л; IgG - 10,7 г/л; ІдМ -1,2 г/л, CM - 0,284 ум.од. густини; ЦІК - 92 ОД. На чотирнадцятий день післяопераційного періоду хворий у задовільному стані був виписаний з лікарні. Приклад 3. Хворий Куценко Анатолій Леонтійович, 1925 року народження, історія хвороби № 9029, поступив у хірургічне відділення Черкаської міської лікарні № 1 26.06.1996 року з діагнозом: механічна жовтяниця, Сr-головки підшлункової залози. Тривалість механічної жовтяниці понад 1,5 місяці. При поступленні стан хворого тяжкий. AT - 110/80 мм рт.ст., PS - 110 уд/хв, Нв -100 г/л; Er - 3,2 г/л; протромбін - 62%; фібріноген - 1224 мг/л; фібринолітична активність плазми 8%; загальний білок - 62 г/л; загальний білірубін - 433,0 мкмоль/л (непрямий - 140,01 мкмоль/л, прямий - 293 мкмоль/л). ALAT - 4,12 мкмоль/л; ASAT -3,74 мкмоль/л; лужна фосфотаза 472; Тл -41%,Вл-22%,Тх-18%,Тс-12%,Та-14%; ІдА - 2,74 г/л,. IgG - 10,8 г/л, ІдМ - 2,4 г/л, ЦІК - 384 ОД, CM - 0,512 ум. од. густини. Після передопераційної підготовки, 28 червня 1996 року хворому була проведена дренуюча операція. Після операції стан хворого залишився тяжким. Хворий у свідомості, AT - 100/60 мм рт.ст., PS - 128 ударів за хвилину. У ранньому післяопераційному періоді хворому проведено три сеанси плазмоферезу на вітчизняному фракціонаторі крові ПФ-05. Об'єм ексфузії плазми за сеанс складав 1,8-2 літра. Плазмозаміщення по ходу операції: кристолоїди - 400 мл; реополіглюкін - 400 мл; плазма- 1,2 л. В цілому в післяопераційний період лікування хворому перелито 3,75 літра плазми. На дев'ятий день післяопераційного періоду стан хворого залишався середньої тяжкості. Загальний білок 59 г/л; загальний білірубін - 260,4 мкмоль/л (прямий - 160,4 мкмоль/л, непрямий - 100 мкмоль/л); лужна фосфотаза - 301,2 мкмоль/л; AsAT -1,9 мкмоль/л; ALAT - 1,91 мкмоль/л; Тл -31%; Вл-20%,Тх-18%,Тс-12%,Та16%: ІдА - 1,224 г/л; IgG - 8,1 г/л; ІдМ - 0,9 г/л; CM - 0,294 ум. од. густини, ЦІК - 124 ОД. Тільки на 16 день післяопераційного періоду хворого з загальним білірубіном 72,4 мкмоль/л було виписано з лікарні. Приклад 4. Хворий Ляпкало Іван Михайлович, 1925 року-народження, Історія хвороби № 9215, поступив у хірургічне відділення Черкаської міської лікарні ISfe 1 1.06.1996 року з діагнозом: механічна жовтяниця, Сгголовки підшлункової залози. Тривалість механічної жовтяниці понад 2,5 місяці. При поступленні стан хворого тяжкий. AT - 120/70 мм рт.ст., PS - 112 уд/хв, Нв -112 г/л; Er - 3,2 г/л; протромбін - 58%; фібріноген - 1326 мг/л; фібринолітична активність плазми 9%; загальний білок - 68 г/л; загальний білірубін - 316,4 мкмоль/л (непрямий - 109,0 мкмоль/л, прямий - 256 мкмоль/л). ALAT - 3,7 мкмоль/л; ASAT - 2,0 мкмоль/л; лужна фосфотаза 472; Тл - 36%, В„ - 18%. Тх - 16%, Тс - 12%. Та - 14%; ІдА- 2,84 г/л, IgG 10,72 г/л, ІдМ - 12 г/л, ЦІК- 293 ОД, CM - 0,474 ум. од. густини. З липня 1996 року хворому була проведена дренуюча операція. Після операції стан хворого залишився тяжким. Хворий у свідомості, AT - 110/60 мм рт.ст., PS - 108 ударів за хвилину. У ранньому післяопераційному періоді хворому проведено три сеанси плазмо-ферезу на вітчизняному фракціонаторі кровi ПФ-05. Об'єм ексфузії плазми за сеанс складав 1,8-2 літра. Плазмозаміщення по ходу операції: кристалоїди - 400 мл; реополіглюкін - 400 мл; плазма - 1,1 літра. В цілому в післяопераційний період лікування хворому перелито 3,64 літра плазми. На дев'ятий день післяопераційного періоду стан хворого залишався середньої тяжкості Загальний білок 56 г/л; загальний білірубін - 127,0 мкмоль/л (прямий -84,0 мкмоль/л; непрямий - 53 мкмоль/л); лужна фосфотаза - 294,1 мкмоль/л; AsAT -0,8 мкмоль/л; ALAT - 1,84 мкмоль/л, Тя -32%,Вл-16%,Тх-14%,Тс-і2%;Та12%; ІдА - 1,97 г/л; IgG - 9,07 г/л; ІдМ - 1,2 г/л; CM -0,312 ум. од. густини, ЦІК- 102 ОД. На 14 день післяопераційного періода хворого було виписано з лікарні (загальний білірубін - 92,4 мкмоль/л). Апробацію запропонованого нами метода виконано у 27 хворих віком 58 ± 7,4 роки з тривалою механічною жовтяницею. У 15 хворих виявили рак головки підшлункової залози, у 8 хворих причиною жовтяниці був холелетiаз. Тривалість гіпербілірубінемії більше 3-х тижнів. Показанням для екстракорпорального окислення білірубіну вважали збереження високого рівня білірубіну на протязі 2-3 днів після виконання дренуючої операції при повному проходженні жовчних шляхів, гіперферментемії по індикаторним ферментам з критичним зниженням відношення AsAT/ALAT і появи тенденції до гіпокоагуляції по факторам протромбінового комплексу, початковим ознакам енцефалопатії. Контрольну групу складали 28 невибраних хворих віком 58 ± 8,4 роки з механічною жовтяницею. Всі вони оперовані у 1996 році з приводу механічної довтяниці як пухлинного (14 осіб) так і непухлинного генезу (12 осіб). У ранньому післяопераційному періоді у хворих даної групи проводили замінний плазмаферез на апараті ПФ-05 по вено- венозному доступу. Плазмозаміщення проводили плазмою, декстранами, кристалоїдами. Отримані в результаті роботи дані представлені в таблицях № 1, 2. 3. У них відображено, що в післяопераційному періоді динаміка зменшення рівня білірубіну в основній групі була більш виражена ніж у контрольній групі. Оскільки хворим основної групи поверталась модульована власна плазма зменшувалась необхідність у донорській плазмі в порівнянні з контрольною групою у 7 разів. При цьому імунний статус лишався на одному рівні в обох групах. Таким чином, екстракорпоральне окислення білірубіну озоном дозволяє більш ефективно боротись з гіпербілірубінемією в післяопераційному періоді при механічній жовтяниці з збереженням для організму цінних компонентів крові.
ДивитисяДодаткова інформація
Автори англійськоюFedoruk Oleksandr Leonidovych, Stoliarenko Genadii Stepanovych, Hromyko Andrii Volodymyrovych, Boiko Viktor Oleksiiovych
Автори російськоюФедорук Александр Леонидович, Столяренко Геннадий Степанович, Громыко Андрей Владимирович, Бойко Виктор Алексеевич
МПК / Мітки
МПК: A61K 33/00, C07C 45/79
Мітки: спосіб, крові, детоксикації, екстракорпоральної, електрохімічної
Код посилання
<a href="https://ua.patents.su/9-22372-sposib-ekstrakorporalno-elektrokhimichno-detoksikaci-krovi.html" target="_blank" rel="follow" title="База патентів України">Спосіб екстракорпоральної електрохімічної детоксикації крові</a>
Попередній патент: Протинакипний склад “антинакипін”
Наступний патент: Пристрій для компостування
Випадковий патент: Швейна машина