Ізольована нуклеїнова кислота, що інгібує експресію протеїну grb2 або grb3-3, вектор, фармацевтична композиція (варіанти)
Формула / Реферат
1.Изолированная нуклеиновая кислота, представленная последовательностью № 1
,
которая способна ингибировать, по крайней мере частично, экспрессию протеина или .
2. Вектор, отличающийся тем, что содержит изолированную нуклеиновую кислоту по пункту 1.
3. Вектор по пункту 2, отличающийся тем, что представляет собой вирусный вектор.
4. Вектор по пункту 3, отличающийся тем, что представляет собой вектор, происходящий из аденовирусов, ретровирусов, , вирусов или вируса осповакцины.
5. Вектор по пунктам 3 или 4, отличающийся тем, что представляет собой вирус дефектный для репликации.
6. Фармацевтическая композиция, отличающаяся тем, что содержит один или несколько векторов по одному из пунктов 2-5.
7. Фармацевтическая композиция по п. 6, отличающаяся тем, что предназначена для лечения рака.
8. Фармацевтическая композиция по п. 6, отличающаяся тем, что предназначена для лечения СПИДа.
9. Фармацевтическая композиция, отличающаяся тем, что содержит одну или несколько изолированных нуклеиновых кислот по пункту 1, в форме комплекса с -декстраном, с ядерными протеинами или с липидами, в сыром виде или еще включенные в липосомы и предназначена для лечения рака.
10. Фармацевтическая композиция по п. 9, отличающаяся тем, что предназначена для лечения рака.
11. Фармацевтическая композиция по п. 9, отличающаяся тем, что предназначена для лечения СПИДа.
Текст
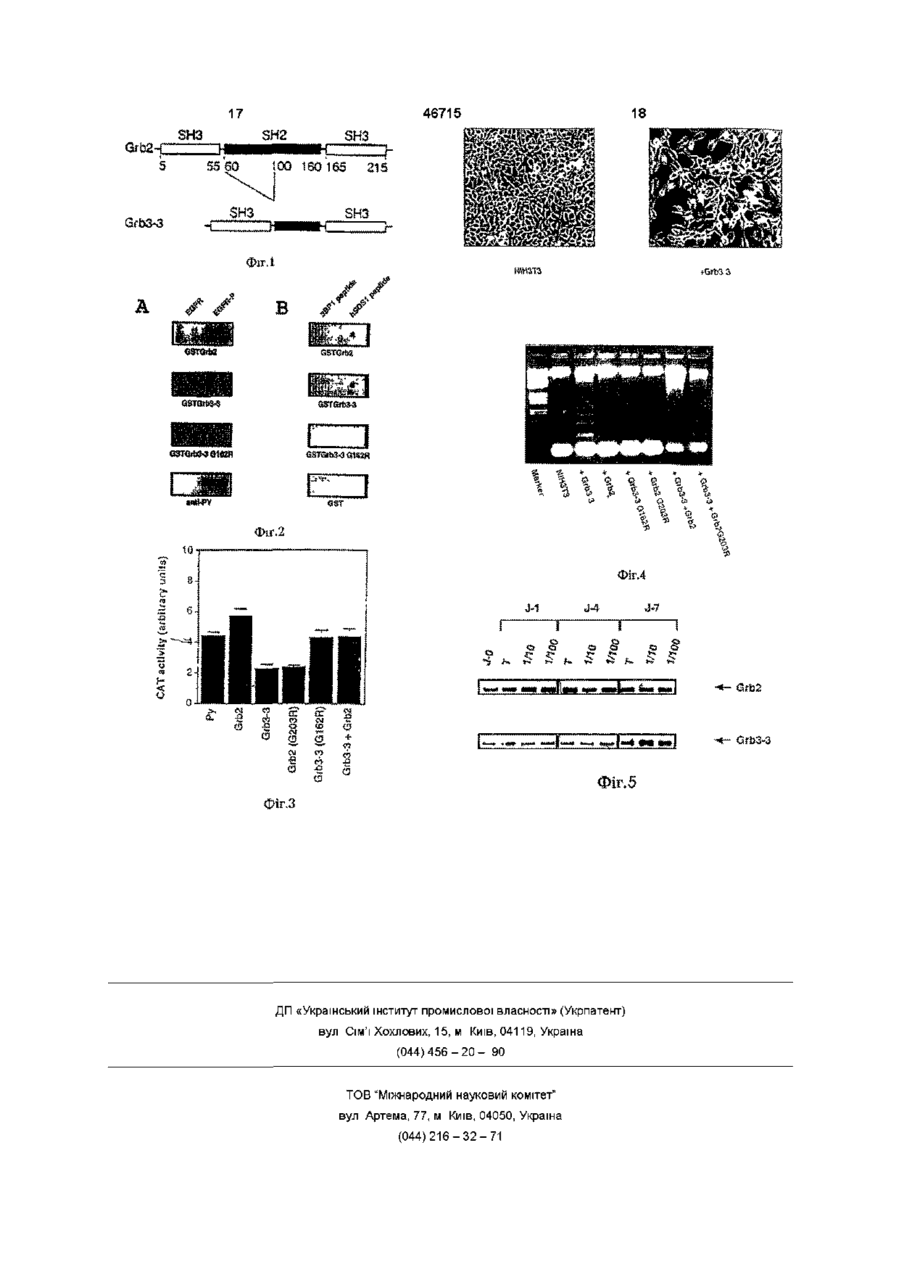
1 Изолированная нуклеиновая кислота, пред аденовирусов, ставленная последовательностью SEQ ID № 1 ' или вируса осповакцины 5 Вектор по пунктам 3 или 4, отличающийся тем, что представляет собой вирус дефектный для репликации 6 Фармацевтическая композиция, отличающаяся тем, что содержит один или несколько векторов по одному из пунктов 2-5 7 Фармацевтическая композиция по п 6, отличающаяся тем, что предназначена для лечения рака 8 Фармацевтическая композиция по п 6, отличающаяся тем, что предназначена для лечения СПИДа GAATTCGGGG CTGCTCAGCA CTGAGCAGGG CTCAGfc ATG GAA GCC АТС GCC AAA Met Glu Ala lie Ala Lys 1 5 TAT GAC TTC ААЙ GCT ACT GCA GAC GAC GAC CTG AGC TTC AAA AGG GGG Tyr Asp Phe Lys Ala The Ala Asp Asp Asp Leu Ser Phe Lys Arg Gly 10 15 20 GAC АТС CTC AAG GTT TTG AAC GAA GAA TGT GAT CAG AAC TGG TAC AAG Asp lie Leu Lys Val Leu Asn Glu Glu Cys Asp Gin Asn Trp Tyr Lys 25 30 35 GCA GAG CTT AAT GGA AAA SAC CGC. TTC ATT CCC AAG AAC TAC ATA GAA fils Glu Leu Asn Gly Lys Asp G I Y Phe lie Pro Lys Asn Туг lie Glu 40 45 50 ATG AAA CCA CAT CCG T M GGA AAC OAT GTG CAG CAC TTC AAG GTG CTC Hat Lys Pro Bis Pro Phe Gly Asn Asp Val Gin His Phe Lys Val Leu 55 60 65 70 ретровирусов, q вирусов Ю (О 46715 10 Фармацевтическая композиция по п чающаяся тем, что предназначена для рака 11 Фармацевтическая композиция по п комплекса с DEAE -декстраном, с ядерными чающаяся тем, что предназначена для протеинами или с липидами, в сыром виде или СПИДа еще включенные в липосомы и предназначена 9 Фармацевтическая композиция, отличающаяся тем, что содержит одну или несколько изолированных нуклеиновых кислот по пункту 1, в форме 9, отлилечения 9, отлилечения для лечения рака Настоящее изобретение относится к новому гену, обозначенному Grb3-3, к его вариантам и к их применениям, например, в генной противораковой терапии Различные гены, называемые онкогенами и супрессорными генами, вовлечены в контроль клеточного деления Среди них ras-гены и их продукты, обычно обозначаемые протеинами р21, играют ключевую роль в пролиферации клеток во всех эукариотных организмах, где они были исследованы Так, было показано, что некоторые специфические модификации этих протеинов лишены своего нормального контроля и становятся онкогенными Так, большое число человеческих опухолей было ассоциировано с наличием модифицированных ras-генов Кроме того, гиперэкспрессия этих протеинов р21 может привести к нарушению пролиферации клеток Следовательно, понимание точной роли этих протеинов р21 в клетках, способа их функционирования и их характеристик является основной целью для понимания и подхода к терапии канцерогенеза Различные факторы, причастные к пути rasзависимой сигнализации, были идентифицированы Среди них фигурирует ген Grb-2, который кодирует протеин 23 - 25кДа, имеющий структуру SH3-SH2-SH3 (Lowenstienetal, Cell 70 (1992) 431, Matuoka et al , PHAS 89 (1992) 9015) Возможно продукт гена Grb-2 взаимодействует с протеинами, фосфорилированными по тирозину в его SH2 области и с фактором обмена GDP класса SOS его SH3 области (Egan et al , Nature 363 (1993) 45) Таким образом он является одним из компонентов трансформирующей активности продукта ras-гена Настоящее изобретение вытекает из обнаружения, клонирования и характеристики изоформы гена Grb-2, обозначенной Grb3-3, имеющей делецию в области SH2 Этот ген определен во взрослых тканях соответствующая мРНК находится под единой полосой 1,5Rb и транслируется в протеин 19кДа Из-за наличия делеции в области SH2 продукт гена Grb3-3 не способен взаимодействовать с фосфорилированными по тирозину протеинами (фосфорилированный EGF рецептор), но он сохраняет способность взаимодействовать с областями, богатыми пролином, протеинов SOS Следовательно, благодаря наличию делеции продукт гена Grb3-3 способен препятствовать клеточным воздействиям продукта гена Grb2 Перенос этого гена in vivo или его вариантов, включая антисмысловые последовательности, позволяет следовательно препятствовать процессам пролиферации, дифференциации и/или смерти клеток Итак, первый объект изобретения относится к нуклеотидной последовательности, включающей весь или часть гена Grb3-3 (последовательность SEQ Ю № 1) Другой объект изобретения относится к нуклеотидной последовательности, происходящей из SEQ ID № 1 и способной ингибировать, по крайней мере частично, экспрессию протеина Grb-2 или Grb3-3 В частности изобретение относится к антисмысловым последовательностям, экспрессия которых в клетке-мишени позволяет контролировать транскрипцию клеточной мРНК Такие последовательности могут быть, например, транскрибированы в клетке-мишени в РНК, комплементарные клеточные мРНК Grb-2 или Grb3-3, и блокировать таким образом их трансляцию в протеин согласно методике, описанной в европейском патенте ЕР 140 308 Такие последовательности могут быть составлены полностью или частично из нуклеотидной последовательности SEQ ID № 1, транскрибированной в обратной ориентации Как указывалось выше, Grb-2 является по крайней мере бифункциональным протеином, имеющим в его области SH2 специфические последовательности, фосфорилированные по тирозину, и в его двух областях SH3 факторы обмена семейства SOS Grb3-3, потерявший свою способность ассоциироваться с протеинами, фосфорилированными по тирозину, может, следовательно, образовать только комплекс с протеинами SOS Следовательно Grb3-3 может препятствовать образованию комплекса Grb-2-SOS на рецепторах аутофосфорилированных факторов роста или на ассоциированных протеинах, также фосфоридированных по тирозину, таких как SHC иди IR SI Grb3-3 способен блокировать это комплексообразование, он способен блокировать митогенные пути и вызвать смерть клетки Заявитель действительно показал, что протеин Grb3-3 проявляет свое действие во время некоторых физиологических процессов, например, при созревании тимуса у крыс Заявитель также показал, что Grb3-3 способен вызвать смерть клеток при апоптозе различных типов клеток Эти очень ценные свойства могут быть доказаны (I) путем инъекции рекомбинантного протеина в фибробласты ЗТЗ и (II) путем переноса последовательности, кодирующей Grb33, в клетки ЗТЗ (пример 4) Следовательно Grb3-3 способен вызывать клеточную смерть живых клеток, таких как иммортализованные (бессмертные), раковые или зародышевые клетки Как показано в примерах, Grb2 способен противодействовать действиям Grb3-3 46715 ческие последовательности нуклеиновых кислот, были описаны в литературе [Akh et al , Nature Genetics 3 (1993) 224, Stratford-Реrrlcandet et al , Human Gene Therapy I (1990) 241, EP 185 573, Levrero et al , Gene 101 (1991) 195, Le Gal la Salle et al , Science 259 (1993) 988, Roemer et Fnedmann, Eur J Biochem 208 (1992) 211, Dobson et al , Neuron 5 (1990) 353, Chiocca et al , New Biol 2 (1990) 739, Miyanohara et al , New Biol 4 (1992) 238, WO 91/18088] Следовательно, настоящее изобретение также относится к любому рекомбинантному вирусу, содержащему вставленную в его геном нуклеотидную последовательность, такую, как описано выше Целесообразно, чтобы рекомбинантный вирус согласно изобретению был дефектным вирусом Термин "дефектный вирус" означает вирус, неспособный реплицироваться в клетке-мишени Обычно, следовательно, геном дефектных вирусов, - генетические антисмысловые последоваиспользуемых в рамках настоящего изобретения, тельности, такие как определено выше, лишен по крайней мере последовательностей, - специфические олигонуклеотиды Grb3-3, монеобходимых для репликаций указанного вируса в дифицированные или нет для лучшей стабильнозараженной клетке Эти области или могут быть сти или биодоступности (фосфоротиоаты, вставки удалены (полностью или частично), или сделаны и т п ) Предпочтительно речь идет об олигонукленефункциональными, или замещены другими поотидах, содержащих локализованную кодирующую следовательностями и, например, нуклеиновой последовательность между N-концевой SH3 облакислотой изобретения Предпочтительно, чтобы стью и остаточной SH2 областью дефектный вирус тем не менее сохранил после- любая последовательность, перенос которой довательности своего генома, которые необходив зараженные клетки вызывает гиперэкспрессию мы для инкапсидации вирусных частиц Grb2 Нуклеотидные последовательности согласно Особенно выгодно использовать нуклеиновые изобретению могут быть использованы как такопоследовательности изобретения в форме вклювые, например, после инъекции человеку или жичения в аденовирус, в AAV или в рекомбинантный вотному, чтобы вызвать защиту или лечить ракодефектный ретровирус вые заболевания В частности, они могут быть Что касается аденовирусов, существуют разинъецированы в форме голой ДНК по методике, личные серотипы, структура и свойства которых описанной в заявке WO 90/11092 Они также могут мало меняются, но которые не являются патогенбыть введены в форме комплексов, например, с ными для человека, а именно не угнетающими ДЕАЕ-декстраном (Pagano et al, J Virol I (1967) иммунную систему Кроме того, эти вирусы не ин891), с ядерными протеинами (Kaheda et al , тегрируются геномом клеток, которые они зараScience 243 (1989) 375), с липидами (Feigner et al , жают, и могут включать значительные фрагменты PNAS 84 (1987) 7413), в форме липосом (Fraley et экзогенной ДНК Среди различных серотипов al , J Biol Chem 255 (1980) 10431) и т д предпочтительно использовать в рамках настоящего изобретения аденовирусы типа 2 или 5 (Ad 2 Предпочтительно нуклеотидные последоваили Ad 5) В случае аденовируса Ad 5 последовательности согласно изобретению являются частью тельности, необходимые для репликации, предвектора Применение такого вектора позволяет в ставляют собой области EIA и EIB Рекомбинантдействительности улучшить введение нуклеиноные дефектные вирусы изобретения могут быть вой кислоты в обрабатываемую клетку, а также получены путем гомологичной рекомбинаций меповысить ее стабильность в указанных клетках, жду дефектным вирусом и плазмидой, несущей что позволяет получить длительный терапевтиченаряду с другими нуклеотидную последовательский эффект Кроме того, можно вводить нескольность, такую, как определено выше (Levrero et al , ко последовательностей нуклеиновой кислоты в Gene 101 (1991) 195, Graham, EMBO J 3/12/ (1984) одном и том же векторе, что также повышает эф2917) Гомологичная рекомбинация происходит фективность лечения после ko-трансфекции указанного вируса и плазИспользуемый вектор может быть различного миды в соответствующую клеточную линию Испроисхождения, лишь бы он был способен транспользуемая клеточная линия предпочтительно формировать клетки животных, предпочтительно должна быть (I) трансформируемой указанными человеческие опухолевые клетки В предпочтиэлементами и (II) содержать последовательности, тельном варианте осуществления изобретения способные дополнять часть генома дефектного используют вирусный вектор, который может быть вируса, предпочтительно в интегрированной форвыбран среди аденовирусов, ретровирусов, адеме, чтобы избежать опасностей рекомбинации В ноассоциированных вирусов (AAV), вируса герпекачестве примера линии, используемой для полуса, цитомегаловируса (CMV), вируса осповакцины чения рекомбинантных дефектных аденовирусов, и т п Векторы, происходящие из аденовирусов, можно провести линию человеческой зародышеретровирусов или AAV, включающие гетерологиКроме того, исследование экспрессии Grb3-3, проведенное во время заражения лимфоцитарных клеток вирусом HIV, позволяло показать, что массированное продуцирование вируса, наблюдаемое через 7 дней после заражения, коррелирует с гиперэкспрессией мРНК Grb3-3 зараженными клетками (пример 5) Этот эксперимент показывает, что удаление или противодействие клеточным эффектам Grb3-3 также может позволить сохранить жизнь зараженным клеткам, а именно зараженным VIH, и также позволить лимфоцитам Т4 продолжать выполнять роль иммунной защиты В этом отношении изобретение также относится к применению соединений, способных устранить или препятствовать по крайней мере частично клеточным аффектам Grb3-3, для приготовления фармацевтической композиции, предназначенной для лечения СПИДа Более конкретно используемыми соединениями могут быть вой почки 293 (Graham et al , J Gen Virol 36 (1977) 59), которая содержит, например, интегрированную в ее геном левую часть генома аденовируса Ad 5 (12%) В качестве примера линии, используемой для получения рекомбинантных дефектных ретровирусов, можно привести линию CRIP (Danos et Mulligan, PNAS 85 (1988) 6460) Затем размножившиеся вирусы собирают и очищают по классическим методикам молекулярной биологии Объектом настоящего изобретения также является фармацевтическая композиция, содержащая по крайней мере один рекомбинантный вирус или одну нуклеотидную последовательность, такие, как определено выше Фармацевтические композиции изобретения могут быть сформулированы с учетом пути введения как для местного введения, оральные, парентеральные, интраназальные, внутривенные, внутримышечные, подкожные, внутриглазные и т п Предпочтительно фармацевтические композиции содержат фармацевтически приемлемые носители для рецептуры для инъекций, необязательно непосредственно в обрабатываемую опухоль В частности, можно привести солевые растворы (мононатрийфосфат, динатрий фосфат, хлорид натрия, калия, кальция или магния, и т п , или смеси этих солей), стерильные, изотонические, или сухие композиции, например, лиофилизированные, которые при добавлении в зависимости от ситуации стерилизованной воды или физиологической сыворотки позволяют получить растворы для инъекций Дозы нуклеиновых кислот (последовательности или векторы), используемые для введения, могут быть адаптированы в зависимости от различных параметров, например, в зависимости от используемого способа введения, конкретной патологии, действующей нуклеиновой кислоты, или еще от длительности желаемого лечения Обычно, что касается рекомбинантных вирусов согласно изобретению, их формулируют и вводят в форме доз, содержащих между 104 и 1014pfu/Mn, предпочтительно 106 - 1010pfu/Mn Термин pfu ("бляшкообразующая единица") соответствует заражающей мощности раствора вируса и определяется путем заражения соответствующей клеточной культуры и измеряется обычно через 48 часов по числу бляшек зараженных клеток Методики определения титра pfu раствора вируса хорошо документированы в литературе Такие фармацевтические композиции могут быть использованы для людей для лечения и/или профилактики рака В частности, продукты изобретения способны модулировать активность rasпротеинов, они позволяют включаться в процессы развития раков, а именно, они могут ингибироватъ активность онкогенов, транспормирующая активность которых проходит через функциональное p21-GAP взаимодействие Действительно, многочисленные ради ассоциируются с наличием онкогенных ras-протеинов Среди раков, наиболее часто содержащих мутированные ras-гены, можно привести, например, аденокарциномы поджелудочной железы, 90% которых имеют мутированный Ki-ras-онкоген в двенадцатом кодоне 8 46715 (Almoghera et coll , Cell 53 (1988) 549), аденокарциномы ободочной кишки и раки щитовидной железы (50%) или карциномы легких и миелоидные лейкемии (30%), (Bos, J L Cancer Res 49 (1989) 4682) Более обычно композиции согласно изобретению могут быть использованы для лечения любого типа патологий, в которых наблюдается аномальная пролиферация клеток, путем индукции апоптоза, а также любых патологий, характеризующихся смертью клеток при апоптозе (СПИД, хорея Хантингтона, Паркинсон), с помощью соединений, блокирующих эффекты Grb3-3 (например, антисмысловые) Настоящее изобретение будет более полно описано с помощью примеров, приведенных ниже, которые должны рассматриваться как иллюстрирующие, но не ограничивающие Подписи к фигурам Фиг 1 Схематическая иллюстрация структурных областей - Grb2 и Grb3-3 Фиг 2 Изучение связи Grb3-3 и рецептором EFG (фиг 2а) и с пептидами, богатыми пролинем (фиг 2в) Фиг 3 Действие Grb3-3 на трансактивацию через ras-RRE-производное гена-усилителя полиома вируса Фиг 4 Выявление смерти клетки, вызванное Grb3-3 на фибробластах ЗТЗ Фиг 5 Выявление экспрессии Grb3-3 в клетках, зараженных вирусом HIV Обычные методики молекулярной биологии Методики, обычно используемые в молекулярной биологии, такие как препаративные экстракции плазмидных ДНК, центрифугирование плазмидной ДНК в градиенте хлорида цезия, электрофорез в агарозном или акридамидном гелях, очистка фрагментов ДНК электроэлюцией, экстракция протеинов фенолом или феноломхлороформом, осаждение ДНК в солевой среде этанолом или изопропанолом, трансформация Esahenchia coh, и т п хорошо известны специалистам в этой области и подробно описаны в литературе (Mamatis T et al , "Molecular Cloning, a Laboratory Manual", Cold Spring Harbor Laboratory Cold Spring Harbor, N,Y, 1982, Ausubel FM et al (eds), "Current Protocols in Molecular Biology", John Wiley and Sons, New York, 1987) Плазмиды типа pBR322, piC и фаги серии М13 имеют коммерческое происхождение (Bethesda Research Laboratories) Для датирования фрагменты ДНК могут быть разделены в соответствии с их размером электрофорезом на агарозном или акриламидном гелях, экстрагированы фенолом или смесью фенол/хлороформ, осаждены этанолом, потом инкубированы в присутствии ДНК лигазы фага Т4 (Biolabs) в соответствии с рекомендациями изготовителя Заполнение выступающих 5'-концов может быть проведено фрагментом ДНК полимеразы I Кленова Е coh (Biolabs) по описанию изготовителя Деструкцию выступающих З'-концов проводят в присутствии ДНК полимеразы фага Т4 (Biolabs), используемой в соответствии с рекомендациями изготовителя Разрушение (деструкцию) выступающих 5'-концов проводят осторожной обработ 46715 10 последовательности изобретения были проявлекои нуклеазои I ны в штамме Е coli TGI в форме протеинов слияНаправленный мутагенез in vitro синтетичения с GST по методике, описанной Smith et скими олигонуклеотидами может быть проведен в Johnson (Genr 67 (1988) 31) Короче, гены Grb2 и соответствии с методикой, разработанной Taylor Grb3-3 сначала были модифицированы введениet al , (Nucleic Acids Res 13 (1985) 8749-8764), исем с обеих сторон стартового и стоп-кодонов сайпользуя набор, выпускаемый Amersham та BamHI Для этого фазы открытого считывания Ферментативная амплификация фрагментов этих генов были амплифицированы PCR с помоДНК по методике, называемой PCR (Полимеразщью следующих олигонуклеотидов ная цепная реакция, Salki Р К et al, Sciens 230 1 Олигонуклеотид I (5 ) (1985) 1350-1354, Mulhs К В et Faloona FA Meth GAATTC G GATCCATG GAAGCATC GCCAAATATG АСТТС Ensym 155 (1987) 335-350), может быть проведе1 Олигонуклеотид II (З ) (SEQ ID № 4) на с использованием "ДНК термального циклера" GAATTC G GATCCTTAGAC GTTCC G GTTCAC G G G G GTGAC (Perkm Elmer Cetus) по описаниям изготовителя Подчеркнутая часть соответствует созданноПроверка нуклеотидных последовательностей му сайту BamHI, следующему за или предшестможет быть проведена по методике, разработанвующему стартовому и стоп-кодонам ной Sanger et al (Proc Natl Acad Sci USA, 74 Амплифицированные таким образом гены за(1977) 5463-5467) с использованием набора, вытем клонируют в форме фрагментов BamHI в векпускаемого Amersham тор pGEX 2T (Pharmacia), лианеризованный тем Примеры же самым ферментом, в 3' и в фазу кДНК, коди1 Выделение гена Grb3-3 рующей GST Полученные таким образом векторы Ген Grb3-3 выделяют скринингом полосы чезатем используют для трансформации штамма ловеческой ДНК с помощью зонда, происходящего Е coli TCI Трансформированные таким образом из последовательности гена Grb2 клетки предварительно культивируют в течение 500 000 рекомбинантных фагов Лямбда gt11, ночи при 37°С, разбавляют 1/10 в среде LB, принесущих фрагменты ДНК, выделенной из банка бавляют IPTG, чтобы вызвать экспрессию (2 часа человеческой плаценты (Clontech) были скрини25°С), потом культивируют 21 час примерно при рованы с помощью зонда, происходящего из по25°С Затем клетки лизируют и полученные слиследовательности гена Grb2 Использованный тые протеины очищают за счет сродства на колонзонд соответствует первым 8 аминокислотам проке Агароза-GSH Для этого бактериальный лизат теина Grb2 и имеет следующую последовательинкубируют в присутствии геля (полученного и ность уравновешенного с буфером лизиса) в течение 15 ATGGAAGCCATCGCCAAATATGAC (SEQ ID п°2) минут при 4°С После 3 промывок Трис-НСІ рН 7,4, Таким образом было идентифицировано 10 протеины элюируют в присутствии буфера Трисположительных клонов Вставка из 10 клонов быНСІ рН 7,7, содержащего избыток GST Супернала изолирована в виде фрагментов EcoRI, клонитант собирают и центрифугируют рована в плазмиде М13 р18 и секвенирована Тот же протокол используют для получения Среди этих 10 клонов 9 имеет вставки, идентичмутанта Grb2, в котором глицин 203 заменен аргиные последовательности Grb2 Один из них имеет нином (Grb2G203R), и мутант] Grb3-3, в котором вставку размером меньше, чем ген Grb2 из-за деглицин 162 заменен аргининов (Grb3-3G162R) леции в области SH2 (фиг1) Анализ остальной Мутант Grb2G203R был описан как не имеющий последовательности показал полную идентичактивности в тесте на реинициацию синтеза ДНК ность с соответствующими областями Grb2, вклю(Lowenstem et al , выше) Мутант Grb3-3G162R чая некодирующие области 5' и 3' Фаза открытого несет ту же мутацию в том же положении и, слесчитывания этого клона кодирует протеин из 177 довательно, тоже должен быть неактивным аминокислот (SEQ ID № 1), содержащий 2 области SH3 по краям незавершенной SH2 области Эти мутанты были получены мутагенезом с (фиг1) Аминокислоты, отсутствующие в области помощью PCR генов Grb2 и Grb3-3, используя в 5' SH2 (остатки 60 - 100 в протеине Grb2), соответолигонуклеотид I, описанный выше, и в 3' олигоствуют остаткам, участвующим в связывании Grb2 нуклеотид III, приведенный ниже, в которое мутис пептидами, содержащими фосфорилированные рованный кодон подчеркнут тирозины Олигонуклеотид III (З1) (SEQ ID № 5) GACGTTCCGGTTCACGGGGGTGACATAATTGGGGGGAAACATGCGGGTC 2 Активность связывания протеина Grb3-3 Амплифицированные таким образом фрагКак указывалось выше, протеин Grb2 является менты затем элюируют, реамплифицируют PCR с медиатором взаимодействия между рецепторами олигонуклеотидами I и II, потом клонируют в векфосфорилированных факторов роста и факторатор pGEX 2T Затем получают мутанты, как описами SOS Этот пример показывает, что протеин но выше Grb3-3 не способен взаимодействовать с фосфоЗатем протеины, слитые с GST (GST-Grb2, рилированным рецептором EGF, но он сохраняет GST-Grb3-3, GST-Grb3-3 G162R и GST), биотинисвою способность взаимодействовать с пептидом, дируют по классическим методикам, известным обогащенным пролинем, происходящим из послеспециалистам (См общие методики молекулярной довательности человеческого фактора SOS I биологии, а также Mayer et al , PNAS 88 (1991) Способность связывания Grb3-3 была изучена 627), и используют в качестве зондов для опредес использованием протеинов слияния в Глутатиления связывания с иммобилизованным фосфоOH-S-Трансферазу (GST), биотинилированных рилированным рецептором EGF (2 1), потом с Этот тип слияния позволяет быстро и эффективно пептидом, происходящим из hSOSI (2 2) очистить рекомбинантные продукты Для этого 2 1 Связывание с фосфорилированным ре 11 46715 12 цепторов EGF Этот пример показывает, что несмотря на его делецию SH2 области протеин Grb3-3 обладает Протокол Используемый EGF рецептор очифункциональным эффектом щают, исходя из клеток А431, путем иммобилизации на WGA-сефарозе по методике, описанной Активность протеина Grb3-3 была исследоваDucheshe et al (Science 259 (1993) 525) Сначала ла путем определения его способности кооперистимулируют 2мкг этого рецептора 1мкМ EGF в роваться с ras для трансактивации промотора, течение 10 минут при 22°С, потом инкубируют с обладающего ответом к ras (RRE), и управляющеили без холодной АТР (ЮмкМ) в присутствии го экспрессией ген а-ре портера 2,5мМ MnCI2 в буфере HNTC (20мМ Hepes, 150мМ Использованный протокол описан, например, NaCI, 0,1% Тритон, 10% глицерина, рН 7,5) при Schweighofferetal Science 256 (1992) 825 Короче, 4°С в течение 2 минут, затем останавливают использованный промотор является синтетичефосфорилирование рецептора добавлением буским промотором, составленным из промотора фера разложения Потом образцы помещают на гена тимидин каназы мыши и 4 элементов PEAI, гель SDS-PAGE 4 - 20%, потом переносят на мемповторяющихся, происходящих из усилителя побраны из поливинилидендифторида (PVDF) Пятлиомы (Wasylyk et al , EMBO J 7 (1988) 2475) на затем инкубируют в присутствии различных промотор Ру-ТК Этот промотор управляет эксслитых биотинилированннх GST (2мкг/мл), потом прессией гена-ре портера, в случае бактериальнопроявляют с помощью стрептавадина, соединенго гена хлорамфеникол ацетил трансферази ного со щелочной фосфатазой (Promega) Рецеп(CAT) вектор Ру-ТК-САТ Векторы экспрессии исторы EGF также подвергают иммуноблоттингу в пытанных генов были сконструировали вставкой присутствии антител анти-фосфотирозинов (антиуказанных генов в форме фрагментов BamHI в РУ) для подтверждения, что рецепторы уже фоссайт Bgll ллазмиды pSV2 Этот сайт позволяет форилированы поместить гены под контроль раннего промотора SV40 Результаты Полученные результаты предКлетки ЕР22 с 40% слияния были заражены ставлены на фиг 2а Они показывают, как и ожи0,5мкг вектора Ру-ТК-САТ, одного (Ру) или в придалось, что протеин Grb2 взаимодействует с ресутствии вектора экспрессии, несущего под концептором EGF только в фосфорилированной тролем раннего промотора SV40 ген Grb2, 2мкг, форме Затем они показывают, что протеин Grb3-3 Grb3-3, 2мкг, Grb2(C203P) 2мкг, Grb3-3(C162P) не связан с рецептором EGF, какой бы ни была 2мкг, или Grb3-3 2мкг + Grb2, 2мкг В каждом слуего степень фосфорилирования чае устанавливают суммарное количество ДНК 2 2 Связывание пептида, производного от 5мкг с вектором экспрессии без вставки Проводят hSOSI заражение в присутствии липоспермина Протокол Синтезируют два пептида, обога(Transfectam, IBF-Sepracor) Клетки выдерживают щенных пролинем 48 часов в культуре в среде ДМЕМ, дополненной Пептид hSOSI GTPEVPVPPPVPPRRRPESA 0,5% фетальной сыворотки теленка Затем опреЭтот пептид соответствует остаткам 1143-1162 деляют активность CAT (трансактивацию РРЕ), протеина hSOSI (Li et al , Nature 363 (1993) ответкак описано Wasylyk et al (PNA 85 (1988) 7952) ственного за взаимодействие между Grb2 и hSOSI (SEQ ID № 6) Подученные результаты представлены на фигЗ Они четко показывают, что экспрессия проПептид 3BPI PPPLPPLV Этот пептид проистеина Grb3-3 препятствует эффектам активации ходит из протеина 3BPI, который известен для рецептора фактора роста Они также показывают, эффективного связывания области SH3 АЫ и Src что избыток Grb2 противодействует влияниям /(Cicchelh et al , Science 257 (1992) 803) (SEQ ID № Grb3-3 на ответ фактора роста 7) 4 Grb3-3 вызывает апоптоз клеток Каждый из этих пептидов (1мкл, 10мг/мл) имЭтот пример показывает прямое участие мобилизуют на мембране из нитроцеллюлозы Grb3-3 в клеточном апоптозе Это свойство делаЗатем мембраны инкубируют в блокирующем бует особенно целесообразными применения для фере (Трис 20мМ рН = 7,6, 150мМ NaCI, 0,1% лечения патологий, вызванных в результате проТвин, 3% сывороточный альбумин) Потом мемлиферации клеток (раки, рестеноз и т п ) браны инкубируют всю ночь при 4°С в присутствии различных слитых биотинилированных GST Возникновение апоптоза клеток с помощью (4мкг/мл), потом проявляют с помощью стрептаGrb3-3 показано (I) путем инъекции рекомбинантвидина, соединенного со щелочной фосфатазой ного протеина в фибробласты ЗТЗ и (II) путем пе(Promeoa) реноса последовательности, кодирующей Grb3-3, в клетки ЗТЗ Результаты Полученные результаты пред(I) Инъекция рекомбинантного протеина ставлены на фиг2в Они показывают, что Grb3-3, как и Grb2, способен связывать пептид hSOSI Рекомбинантный протеин Grb3-3 был получен Они кроме того показывают, что это взаимодейств форме слитого протеина с GST по протоколу, вие является специфическим, потому что не наприведенному в примере 2 Слитый протеин затем блюдается никакого связывания с пептидом 3BPI обрабатывают тромбином (0,25%, Sigma) для отКроме того, результаты также показывают, что деления части GST, потом очищают ионообменмутант Grb3-3G162R не способен связывать пепной хроматографией на колонке моноО Затем тид hSOSI, что подтверждает важность этого осфракции, содержащие рекомбинантный протеин, татка и функциональную роль этого взаимодейстконцентрируют с помощью микроконцентраторов вия Microsep (Filtron) в фосфатном буфере 20мМ (рН 7), содержащем ЮОмМ NaCI Полученный таким 3 Активность протеина Grb3-3 13 46715 образом очищенный протеин инжеісгируют (1 Змг/мл) в культивируемые клетки ЗТЗ с помощью автоматического микроинжектора Эппендорфа Затем клетки инкубируют при 34°С и фотографируют с регулярными интервалами, чтобы проследить морфологические превращения Полученные результаты показывают, что через 5 часов после инъекции Grb3-3 основная часть клеток умирает, тогда как инъекция в тех же условиях Grb2 или мутанта (Grb3-3/C162R) не оказывает никакого влияния на выживаемость клеток (II) Перенос последовательности, кодирующей рекомбинантный протеин Конструируют плазмиду, содержащую последовательность SEQ Ю № 1, кодирующую протеин Grb3-3 под контролем раннего промотора вируса SV40 Фибробласты ЗТЗ с 40% слияния были заражены в присутствии липоспермина (Transfectam, IBF-Sepracor) 0,5 или 2мг этой плазмиды экспрессии Через 48 часов после заражения 50% этих клеток суспендируют в среде, а оставшиеся клетки, прилипшие к стенкам, имеют очень сильные морфологические изменения (фиг 4) Анализ с помощью электрофореза на агарозном геле показал, кроме того, что клетки имеют конструкцию фрагментации олигонуклеосомальной ДНК, характерную для мертвых клеток (фиг 4) Напротив, клетки, зараженные в тех же условиях плазмидой экспрессии Grb2, Grb3-3 (C162R), или Grb2(C203R), сохраняют нормальную морфологию, являются всегда живыми и не имеют никакой фрагментации ДНК Как показано на фиг 4 соэкспрессия Grb2 позволяет препятствовать действиям Grb3-3 Эти результаты четко показывают, следовательно, что Grb3-3 представляет собой генубийцу, способный вызывать апоптоз клеток Как указывалось выше, это свойство делает применения особенно выгодными для лечения паталогий, возникших в результате пролиферации клеток, таких как, например, раки, рестеноз и т п 5 Подтверждение экспрессии Grb3-3 в лимфоцитах, зараженных вирусом HIV Этот пример показывает, что во время цикла заражения лимфоцитов Т вирусом HIV относительное количество мРНК Grb2 и Grb3-3 модифицировано и что информационная РНК Grb3-3 сверх проявляется в момент обильной продукции вируса и смерти клеток Лимфоциты периферической крови заражают вирусом HIV-1 в двух разбавлениях (1/10 и 1/100) в течение 1, 4 или 7 дней Затем анализируют мРНК клеток путем обратной PCR с помощью олигонуклеотидов, специфических к Grb2 и Grb3-3, чтобы определить относительную пропорцию информационных мРНК Grb2 и Grb3-3 Использованные олигонуклеотиды, специфические к Grb33, являются следующими Олигонуклеотид IV (З1) ATCGTTCCAAACGGATGTGGTTT (SEQ 10 п°8) Олигонуклеотид V (51) ATAGAAATGAAACCACATCCGTTT (SEQ 10 f9) Полученные результаты представлены на фиг 5 Они четко показывают, что через 7 дней после заражения вирусом НІ мРНК Grb3-3 сверх проявляется Как показано определением протеи 14 на р24 и обратной транскриптазы вируса, день 7 также соответствует периоду, за который наблюдается обильная продукция вируса Liste de sequences (1) Information generale (1) deposant (a) Nom Rhone-Poulenc Rorer S A (b) Rue 20, avenue Raymond Aron (c) Ville Antony (e) Pays France (f) Code postal 92165 (II) Titre de L' Invention Gene Grb3-3, s e s variants et leurs utilisations (III) Nombre de sequences 9 (IV) Forme hsible par ordinateur (a) Type de support floppy disk (b) Ordinateur IBM PC compatible (c) Systeme D1 Exploitation PC-DOS/MS-DOS (d) Logiciel Patent in release #1 0, version #1 25 (OEB) SEQ ID № 1 (2) Информация для (I) Характеристики последовательностей (a) Длина 933 пар оснований (b) Тип нуклеиновая кислота (c) Тип нитей двунитевая (d) Конфигурация линейная (II) Тип молекулы кДНК (III) Гипотетическая нет (III) Антисмысловая нет (VI) Происхождение (а) Организм Homo Sapiens (IX) Дополнительные характеристики (a) Nom/Cle C D S (b) Emplacement 3 7 - 5 6 7 (d) Autres Renseignements /product = "Grb-3" Описание последовательности (XI) SEQ ID № 1 GAATTCGGGG CTGCXGAGC*, CTGAGCAGGG CTCAGA ATG GAA GCC АТС GCC AAA « e t Glu A l a l i e A l a bye TAT Сад И С A A GCT ACT GCft GAC GAC GAC CTG AGC TEC AM AGG GGG A Tyc Asp Phe Lys Ala T h r Ala h$p Asp Asp Leu S e r S>ha Lys Argr S l y IS 15 20 GAC Лтс CTC AAG GTT TTG AAG GAA GAA TGT GAT CAG AAC TGS TAC &AG ? s p H a Leu Lys Val Leu ASJt 61a Glu Cys Asp S i n S s n TJTB Tvr hvs 2$ 30 35 GCA GAG С П ЛАТ GG1 AAA GAC GGC TTC ATT CCC &AG AAC TAG ATA GAA Ala Glu. Le» ftsn Gljf b y s Asp S l y Pisa l i e S r o Lys Asu 'Syr l i e G l " ATG A A CCA CAT CCG TTT GGAfcACGAT A GTG CAG ChC TTC AAG GTG CTC Het Lys P r o H i s PCD Phe Gly Asn Asp Val Gin H i s Phe Lys v a l Leu S5 60 65 70 CGA GAT GGA GCC GGG A G TAC TTC CTC TGG GTG GTG AAG TTC AAT TCT A Arg Asp Gly Ala Gly Lys Tyr Phe Leu Trp Vsl Val Lys Phe Asn Sex ВО Ё5 TTG AAT. GAG CTG GTG GAT TAT CAC AGA TCT АСА TCT GTC TCC AGA AAC Leu ASii Glu Leu Val Asp Tyr His Arg Set Thi Євг val Ser Arg Asn 100 90 95 CAG CAG ATA TTC СТО CGG GAC ATA GAA CAG GTG CCA CAG CAG CCG АСА Gin Val Pro Gin Gin Pro № r Gin Gin lie Phe LeuftrgAsp lie Glu 105 110 115 TAC GTC CAG GCC CTC TTT GAC TTT GAt CCC CAG GAG GAT GGA GAG CTG Туг Val Gin Ala Leu Phe Asp Kie Asp Pxo Gin Glu Asp Gly Glu Leu 320 125 130 GGC TTC CGC CGG GGft GAT TTT АТС CATGTC ATG GAT AAC TCA GAC CCC Gly Phe Asg &rg Gly Asp Pite H e Яжн Val Met Asp Asn S e r AS£ PEO 135 140 US 150 AAC TGG SGS AAA GGA GCT TGC CAC GGG CAG ACC GGC ATG TTT CCC CGC Лзп їгр тгр Lys Sly Ala Cys His Gly Gin Thr Gly Met Phe Pro Atg 155 160 16S AAT TAT GTC ACC CCC GTG AAC CGG AAC GTC TMGftGTCAA GAAGCAATTA Asn Tyr Val Thr Pro Val Asn Atg Asn v a l 170 175 15 ЇТТААА6ААА вХШАМШ 46715 1 ГАДААСЙСЙТ АСААЙАЙДАЇ ТАААСССйСА «ЙСЙОСйССС TGTSaGGGAd IGCAGMCAC CTGCCGGCTC ACCCTCTGftC ССТСЯСАСТТ TGOTTGGftAC CTEACGGGGT GGGAGGGGGC GTTGSAOTTA ААЛАТСССМ ЙАСТЖАССТА TASAITAAGA ASASTTCTEft ТТАСЛЙДЇСТ TCACTGCTGC T C C f d T T C C ССГССЇЖОТ С Ж Е И Ж И З е И К Х И О Т е т CTCTTCEGTC CATCAGTGCA TGACGCTTAA GGCCACGM 1 АЕКСТЙЯСТ OACGCCftfiSft AAAAACAAGA AACCSAAAAA CCCGAACTC Информация для (2) SEQ Ю № 2 (1) Хараісгеристики последовательностей (a) Длина 24 пар оснований (b) Тип нуклеиновая кислота (c) Тип нитей однониточная (d) Конфигурация линейная (II) Тип молекулы кДНК (VI) Происхождение (а) Организм олигонуклеотид Описание последовательности (XI) SEQ ID № 2 ATGGAAGCCA TCGCCAAATA T G A C Информация для (2) SEQ Ю № 3 (1) Характеристики последовательностей (a) Длина 19 пар оснований (b) Тип нуклеиновая кислота (c) Тип нитей однониточная (d) Конфигурация линейная (II) Тип молекулы кДНК (VI) Происхождение (а) Организм олигонуклеотид I Описание последовательности (XI) SEQ Ю № 3 GAATTCGGAT C C A T G G A G C C A T C G C C A A A TATGACTTC (2) SEQ ID № 4 (1) Характеристики последовательностей (a) Длина 39 пар оснований (b) Тип нуклеиновая кислота (c) Тип нитей однониточная (d) Конфигурация линейная (II) Тип молекулы кДНК (VI) Происхождение (а) Организм олигонуклеотид II Описание последовательности (XI) SEQ ID № 4 GAATTCGGAT C C T T A G A C G T T C C G G T T C A C GGGGGTGAC (2) SEQ ID № 5 (I) Характеристики последовательностей (a) Длина 49 пар оснований (b) Тип нуклеиновая кислота (c) Тип нитей однониточная (d) Конфигурация линейная (II) Тип молекулы кДНК (VI) Происхождение (а) Организм олигонуклеотид III Описание последовательности 16 (XI) SEQ ID № 5 GACGTTCCGG T T C A G G G G G TGACATAATT GCGGGGAAAC ATGCGGGTC (2) SEQ ID № 6 (1) Характеристики последовательностей (a) Длина 20 аминокислот (b) Тип аминокислота (c) Тип нитей однониточная (d) Конфигурация линейная (II) Тип молекулы протеин (VI) Происхождение (а) Организм пептид (остатки 1143-1162) Описание последовательности (XI) SEQ ID № 6 Gly Tnr pro Pro Glu See Glu Val Pro val Pro Fro Pro Val Pro Pro Ala (2) SEQ ID № 7 (1) Характеристики последовательностей (a) Длина 8 аминокислот (b) Тип аминокислота (c) Тип нитей однониточная (d) Конфигурация линейная (II) Тип молекулы протеин (VI) Происхождение (а) Организм пептид 3BPI Описание последовательности (XI) SEQ ID № 7 Pro Pro Pro Leu Pro Pro Leu Val 1 5 (2) SEQ ID № 8 (1) Характеристики последовательностей (a) Длина 24 пары оснований (b) Тип нуклеиновая кислота (c) Тип нитей однониточная (d) Конфигурация линейная (II) Тип молекулы кДНК (VI) Происхождение (а) Организм олигонуклеотид IV Описание последовательности (XI) SEQ ID № 8 ATCGTTTCCA AACGGATGTG GTT (2) SEQ ID № 9 (I) Характеристики последовательностей (a) Длина 24 пары оснований (b) Тип нуклеиновая кислота (c) Тип нитей однониточная (d) Конфигурация линейная (II) Тип молекулы кДНК (VI) Происхождение (а) Организм олигонуклеотид V Описание последовательности (XI) SEQ ID № 9 ATAGAAATGA A A C C A C A T C C GTT Arg Arg 46715 17 Grb2< SH3 SH2 55 60 SH3 tOO 160 165 SH3 Gf-ЬЗ-З 18 215 SH3 ФіГ.1 A В GSTGrlffi GSTGrt)3-8 Q a Q a
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61P 35/00, C07K 14/47, A61P 37/00, C07K 14/475, C12N 15/09, A61K 48/00, C12N 15/12
Мітки: експресію, кислота, вектор, grb3-3, ізольована, інгібує, нуклеїнова, композиція, протеїну, фармацевтична, варіанти
Код посилання
<a href="https://ua.patents.su/9-46715-izolovana-nuklenova-kislota-shho-ingibueh-ekspresiyu-protenu-grb2-abo-grb3-3-vektor-farmacevtichna-kompoziciya-varianti.html" target="_blank" rel="follow" title="База патентів України">Ізольована нуклеїнова кислота, що інгібує експресію протеїну grb2 або grb3-3, вектор, фармацевтична композиція (варіанти)</a>
Попередній патент: Похідні n-(3-бензофураніл)сечовини, суміш їх ізомерів або окремі ізомери і їх солі
Наступний патент: Спосіб одержання покриття на основі
Випадковий патент: Спосіб вібродіагностики технічного стану металообробного верстата