Спосіб боротьби з ендо- та ектопаразитами у ссавців
Номер патенту: 88412
Опубліковано: 11.03.2014
Автори: Іутинська Галина Олександрівна, Акименко Лариса Іванівна, Годовський Олексій Вячеславович, Приходько Юрій Олександрович, Білявська Людмила Олексіївна, Виговська Лілія Миколаївна, Дерябін Олег Миколайович, Ушкалов Валерій Олександрович, Романько Марина Євгеніївна, Головко Анатолій Миколайович, Бабкін Михайло Валерійович
Формула / Реферат
Спосіб боротьби з ендо- таектопаразитами у тварин, який передбачає введення тварині протипаразитарного препарату на основі етанольного екстракту продуцента авермектинів Streptomyces avermitilis, який відрізняється тим, що здійснюють пероральне введення вказаного препарату у формі гелю у дозі 1 мл на 2,5 кг маси тіла тварини, а як продуцент авермектинів використовують штам Streptomyces avermitilis IMB Ас-5015 із вмістом авермектинів 500 мкг/мл.
Текст
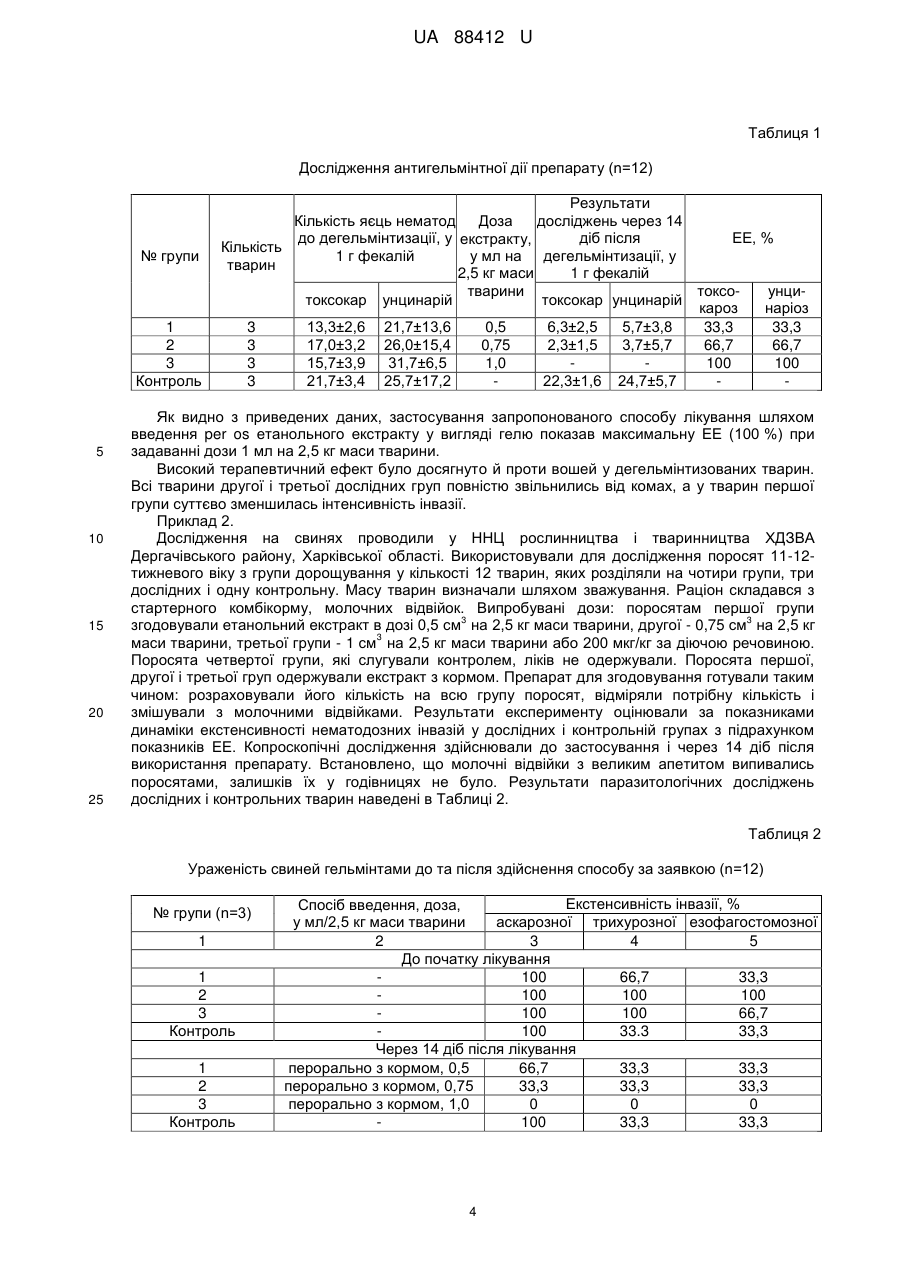
Реферат: Спосіб боротьби з ендо- та ектопаразитами у тварин передбачає введення тварині протипаразитарного препарату на основі етанольного екстракту продуцента авермектинів Streptomyces avermitilis. Здійснюють пероральне введення вказаного препарату у формі гелю у дозі 1 мл на 2,5 кг маси тіла тварини, а як продуцент авермектинів використовують штам Streptomyces avermitilis IMB Ас-5015 із вмістом авермектинів 500 мкг/мл. UA 88412 U (12) UA 88412 U UA 88412 U 5 10 15 20 25 30 35 40 45 50 55 Корисна модель належить до ветеринарної медицини, а саме до способу лікування ендопаразитарних інфекцій у ссавців при використанні авермектинвмісних препаратів, одержаних шляхом мікробіологічного синтезу. Гельмінтози тварин являють собою дуже важливу проблему, яка існує на сьогоднішній день у тваринництві. У шлунково-кишковому тракті тварин може паразитувати велика кількість гельмінтів, які, як правило, належать до різних типів та класів. Серед них найбільш часто зустрічаються альфортіоз, деляфондіоз, стронгільоз, трихонематоз, стронгілоїдоз, аноплоцефалідоз. Зазначені інфекції можуть уражувати до 100 % поголів'я худоби. Гельмінтози викликають у тварин тяжкі ендотоксикози, алергічні реакції, вторинні імунодефіцитні стани. Це призводить до зниження резистентності поголів'я до збудників бактеріальних та вірусних інфекцій, неефективності вакцинацій. Ці фактори несприятливим чином позначаються на кількості та якості продуктів тваринництва: кількості та якості молоко, м'яса, хутра, яке одержують від тварин, а також на потомстві тварин. Протягом тривалого періоду часу у ветеринарній практиці використовували порівняно невеликий арсенал хімічних антипаразитарних препаратів. Проте ефективність таких препаратів звичайно не перевищує 70-80 %, при їх застосуванні у тварин виникають серйозні побічні ефекти, крім того, їх застосування є пов'язаним з негативними екологічними наслідками. За останні 20-30 років завдяки розвитку наукових досліджень у цій галузі та потребі у нових, більш прогресивних засобах для боротьби з паразитами шлунково-кишкового тракту, було запропоновано багато нових препаратів. Особливо ефективними для боротьби з екто- і ендопаразитами тварин та рослин широко застосовуються хімічні сполуки природного походження, одержані з ґрунтового стрептоміцету Streptomyces avermitilis. Серед продуктів життєдіяльності, які продукуються цим мікроорганізмом в процесі ферментації, були одержані сполуки, названі авермектинами. Антибіотик виявляє інсектицидну, нематоцидну та акарицидну властивості, характеризується малими нормами витрат, порівняно швидко розкладається у ґрунті і є перспективним для широкого використання. Препарати на його основі активні по відношенню до екзо- та ендопаразитів тварин (кліщів, нематод, бліх, вошей тощо), а також фітонематод та комах-шкідників рослин (крапчастий і павутинний кліщі, міль попелиця та ін.). Механізм дії авермектинів на цих паразитів полягає у пригніченні синтезу речовин, що виконують роль медіаторів при перенесенні нервового імпульсу у членистоногих та хробаків, внаслідок чого наступає їх параліч та загибель. За хімічною структурою авермектини, які існують у вигляді чотирьох основних форм - А1a, А2a, В1a, В2a - являють собою макроліди з макроциклічного лактону, зв'язаного з дисахаридом диолеандрозою. Лактонна частина утворюється з тих нижчих жирних кислот, які є попередниками у біосинтезі жирних кислот у клітинах актиноміцетів. Відсутність негативного впливу на організми теплокровних тварин, гідробіонтів і бджіл надає авермектину значну перевагу перед хімічними засобами захисту рослин та тварин. Авермектини, одержані шляхом мікробіологічного синтезу, відрізняються як за якісним складом авермектинів, які вони продукують, так за їх кількісним співвідношенням, а також наявністю додаткових сполук, які можуть сприяти виявленню впливу активної сполуки. У відповідності із цим ефективність способів боротьби з паразитарними інфекціями у тварин буде залежати від багатьох факторів, зокрема таких, як мікроорганізм-продуцент авермектину, склад протигельмінтного препарату, тварина, яку піддають лікуванню, спосіб введення препарату та дозування. Зокрема, є відомим протипаразитарний препарат на основі авермектинів для безголкового введення та спосіб, який передбачає застосування вказаного препарату (UA79828, опубл. 25.07.2007). Вказаний спосіб передбачає інтрадермальне введення (за допомогою безголкового пристрою) препарату, що являє собою розчин авермектинів у концентрації 2-35 г/100 мл в органічному розчиннику. Вказаний спосіб вибраний авторами як найближчий аналог заявленої корисної моделі. Описаний спосіб лікування характеризується високою ефективністю, введення безголковим інжектором, не викликає больової і запальної реакції у тварин, препарат не накопичується у тканинах і органах тварин та молоці. Спосіб дозволяє знизити трудомісткість процесу протипаразитарної обробки тварин, зменшити побічні реакції у оброблених тварин та зменшити термін очікування для використання м'ясопродуктів після застосування концентрованих форм. Проте одним з недоліків зазначеного способу є досить висока концентрація авермектинів у препараті, яка може бути причиною захворювань печінки у тварин (печінкова недостатність). В основу корисної моделі поставлена задача розробки способу боротьби з ендо- та ектопаразитами у тварин, який дозволяє суттєво знизити концентрацію авермектинів у 1 UA 88412 U 5 10 15 20 25 30 35 40 45 50 55 60 препараті з метою запобігання побічним ефектам при одночасному збереженні (а в деяких випадках, підвищенні) ефективності щодо впливу на паразитів. Поставлена задача вирішується тим, що у способі боротьби з ендо- та ектопаразитами у тварин, який передбачає пероральне введення протипаразитарного препарату на основі етанольного екстракту біомаси штаму-продуцента авермектинів Streptomyces avermitilis IMB Ас5015 із вмістом авермектинів 500 мкг/мл у формі гелю у дозі 1 мл на 2,5 кг маси тіла тварини. Штам-продуцент Streptomyces avermitilis IMB Ас-5015, який використовується у запропонованому способі, отримано в Інституті мікробіології і вірусології ім. Д.К. Заболотного НАН України шляхом спрямованої селекції із застосуванням N-метил-N-нітро-N-нітрозогуанідіну. Вказаний штам продукує авермектини - речовини антипаразитарної дії (UA69639, опубл. 15.08.2006). Для використання у корисній моделі одержують етанольний екстракт біомаси 7добової культури штаму Streptomyces avermitilis IMB Ас-5015, вирощеного на повноцінному культуральному середовищі. Вміст авермектинів в одержаному етанольному екстракті складає 1400-1800 мкг/мл, при цьому авермектини групи В становлять близько 40 % (Петрук Т.В., Білявська Л.О., Козирицька В.Є., Муквич М.С. Підвищення біосинтетичної активності / Streptomyces avermitilis УКМ Ас-2161 під впливом N-метил- N-нітро-N-нітрозогуанідину // Мікроб, журнал.-2004. - т. 66 - № 6. - С. 24-30). Крім того, культура також синтезує жирні кислоти, амінокислоти, фітогормони, вітаміни групи В. На основі вказаного штаму було створено низку препаратів, які застосовуються як регулятори росту рослин (UA53253, опубл. 27.09.2010, UA92094, опубл. 27.09.2010, UA95557, опубл. 10.08.2011) та як пестициди для контролю фітопаразитів (препарат "Аверком", який використовується для захисту рослин від хвороб та підвищення імунітету). Вказаний штам було люб'язно надано Інститутом мікробіології і вірусології ім. Д.К. Заболотного НАН України у рамках спільного з Державним науковоконтрольним інститутом біотехнології та штамів мікроорганізмів (ДНКІБШМ) проекту. Використовуваний у корисній моделі екстракт готували шляхом екстракції етиловим спиртом міцелію штаму Streptomyces avermitilis IMB № Ас-5015 за відомою методикою (Дриняев В.А., Стерлина Т.С., Берёзкина Н.Е. и др. Авермектины: селекция штамма-продуцента Streptomyces avermitilis BKM Ac 1301. Получение естественного мутанта // Биотехнология.-1994. - № 2. - с. 1618, або патент RU180635, A3g01N21/78. Способ определения авермектинов / Мосин В. А., Дриняев В.А., Мирзаев М.Н., опубл. 30.03.93, бюл. № 12.). Для екстракції використовували біомасу зазначеного штаму, який вирощували на повноцінному соєвому середовищі протягом 7 діб. Авермектин з міцелію виділяли у такий спосіб: 10 мл культуральної рідини центрифугували 20 хв. при 4000 об./хв. До осаду додавали 10 мл охолодженої дистильованої води, ретельно перемішували і центрифугували ще 10 хв. при 4000 об/хв. Відмивання проводили 3-4 рази. Потім до осаду додавали 5 мл етанолу і при постійному перемішуванні проводили екстракцію авермектину при кімнатній температурі протягом 30 хв. Центрифугували 10 хв. при 4000 об./хв. Отримані екстракти зберігали при +4 °C. Концентрацію авермектинів в етанольних екстрактах визначали колориметричним методом, в основі якого лежить кольорова реакція Біаля - процес зміни інтенсивності поглинання світла при 1=630-640 нм продуктом взаємодії авермектинів з орцином [Мосин В.А., 1993]. Вміст авермектинів оцінювали за інтенсивністю поглинання, використовували калібрувальний графік, побудований за різними концентраціями препарату авермектинів фірми "Merck" (США). Здатність до продукування авермектинів оцінювали за кількістю авермектинів (мкг) в 1 мл етанольного екстракту з одиниці біомаси міцелію стрептоміцету. Компонентний склад авермектинового комплексу та співвідношення окремих фракцій у відсотках до загальної їх кількості визначали методом високоефективної рідинної хроматографії (ВЕРХ) у системі етанол - ацетонітрил - вода (55:22,5:22,5) на приладі Beckman System Gold [Викторов А.В., 1999]. Для отримання препарату, який використовували у запропонованому способі, змішували воду дистильовану (приблизно 35-40 мл) з гліцерином (приблизно 5-12 мл) і додавали хлористий калій (приблизно 0,01-0,2 г). Ретельно перемішували. В отриманий розчин при постійному безперервному перемішуванні додавали гелеутворювальний компонент келзан (приблизно 1,0-2,0 г). Утворений густий гель витримували протягом 20 хвилин для остаточного гелеутворення. В отриманий гель додавали спиртовий розчин екстракту біомаси мікроорганізму (0,1 %) у кількості приблизно 40-60 мл і ретельно перемішували до однорідного стану гелю. Запропонований спосіб може використовуватися для лікування й профілактики у тварин (велика рогата худоба, вівці, кози, коні, свині, собаки, коти, кролі, кури, індики, голуби, папуги, перепели, фазани) інвазійних хвороб, спричинених: у великої рогатої худоби: нематодами шлунково-кишкового тракту - Neoascaris vilulorum, Trichuris spp, Nematodirus spp., Ostertagia spp., Bunostomum spp., Haemonchus spp., 2 UA 88412 U 5 10 15 20 25 30 35 40 45 50 55 Trichostrongylus spp., Strongyloides papillosus, ; дорослими легеневими гельмінтами Dictyocaulus viviparus, порожнинними гельмінтами - Setaria labiato-papillosa (у стадії мікросетарій); шкірними гельмінтами - Paraphilaria bovicola; личинками підшкірного ґедзя Hypoderma bovis, H. lineatum; коростяними кліщами - Psoroptes bovis; Sarcoptes bovis, Chorioptes bovis; кліщами - Demodex bovis; волосоїдами - Bovicola bovis; вошама - Haematopinus eurysternus, Linognathus vituli; у овець і кіз: нематодами шлунково-кишкового тракту - Bunostomum spp.; Haemonchus contortus; Ostertagia spp., Cooperia spp., Nematodirus spp., Oesophagostomum venulosum, O. columbianum, Chabertia ovina, Trichostrongylus axei; Trichostrongylus colubriformis, Trichuris ovis; легеневими гельмінтами - Dictyocaulus filar ia, Protostrongylus spp., Mueller ius capillaris; носоглотковим ґедзем - Oestrus ovis; коростяними кліщами - Psoroptes ovis, Sarcoptes ovis, S. caprae, Chorioptes ovis, Ch. caprae; волосоїдами - Bovicola ovis, В. capre; вошами Linognathus ovillus, L. pedalis, L. caprae; у коней: нематодами шлунково-кишкового тракту - родин Ascaridae, Strongylidae, Strongyloididae, Oxyuridae, Trichonematidae (Cyatostomidae), Spiruridae; легеневими нематодами -Dictyocaulus spp.; нематодами - Parafllaria multipapillosa, Onchocerca cervicalis; личинками Gastrophilus spp; у свиней: нематодами шлунково-кишкового тракту - Ascaris suum, Oesophagostomum dentatum; Strongyloides ransomi; Trichuris suis та нематодами із родин Oligacanthorhynchidae та Ollulanidae; легеневими гельмінтами - Metastrongylus spp.; нирковими гельмінтами - Stefanurus dentatus, вошами - Haematopinus suis; кліщами - Sarcoptes suis, S. parvula, Demodex phylloides; у собак і котів: нематодами шлунково-кишкового тракту - Toxocara canis, Toxascaris leonine, Ancylostoma caninum, Uncinaria stenocephala, з родин Capillariidae, Filariidae, Grenosomatidae, Thelaziidae, Trichuridae; кліщами - Sarcoptes canis, Notoedres cati, Otodectes cynotis, Cheyletiella jascuri, Demodex canis; вошами - Linognathus setotus; нашкірними паразитами: Ctenocephalides canis, Trichodectes canis; у кролів: нематодами родин: Oxyuridae, Trichostrongylidae; кліщами видів: Psoroptes cuniculi, Cheyletiella parasitovorax, Listophorus gibbus і блохами Spilopsyllus cuniculi (основний переносник збудників міксоматозу); у птахів (кури, індики, голуби, папуги, перепели, фазани, цесарки, гуси, качки): гельмінтами, спричиненими нематодами родин Acuaridae, Amidostomatidae, Ascaridae, Capillariidae, Dioctophymidae, Heterakidae, Syngamidae, Tetrameridae і ектопаразитози, спричинені кліщами видів Argas persicus, Dermanyssus gallinae, Epidermoptes bilobatus, Knemidocoptes gallinae, K. mutans, K. pilae, Syringophilus bipectinatus; а також різноманітними пухоїдами, пір'яїдами й блохами, з яких найбільш патогенними є види: Menopon gallinae, Menacanthus stramineus, Goniodes hologaster, Lipeurus caponis, Echilnophaga gallinacea, Ceratophyllus gallina; Дана корисна модель може бути проілюстрована приведеними нижче прикладами. Приклад 1. Дослідження ефективності запропонованого способу для лікування собак від паразитарних хвороб проводили на безпритульних тваринах, доставлених до дорадницького центру "Клініка ветеринарної медицини ХДЗВА" Дергачівського району, Харківської області. Для встановлення ураженості собак гельмінтами здійснювали триразові, з інтервалом у сім діб, гельмінтокопроовоскопічні дослідження. Зразки фекалій відбирали індивідуально. Після виявлення яєць гельмінтів встановлювали їх видову належність, розраховували відсоток ураженості тварин - екстенсивність інвазії. Усього в досліді використано 12 собак, спонтанно інвазованих гельмінтами (по три тварини у трьох дослідних групах). Собаки виявились ураженими токсокарами (Т. canis) та унцинаріями (U. stenocephala) поліінвазія. Лікування проводили у відповідності із запропонованим способом, при цьому собакам перорально (з кормом) вводили попередньо одержаний етанольний екстракт Streptomyces avermitilis IMB № Ас-5015 із концентрацією авермектинів 500 мкг/мл у розрахунку у дозах 0,5 мл, 0,75 мл та 1 мл на 2,5 кг маси тварини, одноразово. Облік результатів застосування препаратів здійснювали через 14 діб шляхом гельмінтокопроскопічного і копроовоскопічного дослідження. Про антигельмінтну дію препаратів робили висновок на підставі виявлення або відсутності яєць гельмінтів у матеріалі, що досліджувався. Дози 0,5 мл та 0,75 мл викликали зниження кількості гельмінтів, проте найефективнішою виявилася доза 1 мл екстракту на 2,5 кг ваги тварини. Результати експериментальних досліджень з випробування антигельмінтної дії препаратів на собаках представлені у Таблиці 1. 3 UA 88412 U Таблиця 1 Дослідження антигельмінтної дії препарату (n=12) № групи 1 2 3 Контроль 5 10 15 20 25 Результати Кількість яєць нематод досліджень через 14 Доза до дегельмінтизації, у екстракту, діб після ЕЕ, % Кількість 1 г фекалій у мл на дегельмінтизації, у тварин 1 г фекалій 2,5 кг маси тварини токсоунцитоксокар унцинарій токсокар унцинарій кароз наріоз 3 13,3±2,6 21,7±13,6 0,5 6,3±2,5 5,7±3,8 33,3 33,3 3 17,0±3,2 26,0±15,4 0,75 2,3±1,5 3,7±5,7 66,7 66,7 3 15,7±3,9 31,7±6,5 1,0 100 100 3 21,7±3,4 25,7±17,2 22,3±1,6 24,7±5,7 Як видно з приведених даних, застосування запропонованого способу лікування шляхом введення per os етанольного екстракту у вигляді гелю показав максимальну ЕЕ (100 %) при задаванні дози 1 мл на 2,5 кг маси тварини. Високий терапевтичний ефект було досягнуто й проти вошей у дегельмінтизованих тварин. Всі тварини другої і третьої дослідних груп повністю звільнились від комах, а у тварин першої групи суттєво зменшилась інтенсивність інвазії. Приклад 2. Дослідження на свинях проводили у ННЦ рослинництва і тваринництва ХДЗВА Дергачівського району, Харківської області. Використовували для дослідження поросят 11-12тижневого віку з групи дорощування у кількості 12 тварин, яких розділяли на чотири групи, три дослідних і одну контрольну. Масу тварин визначали шляхом зважування. Раціон складався з стартерного комбікорму, молочних відвійок. Випробувані дози: поросятам першої групи 3 3 згодовували етанольний екстракт в дозі 0,5 см на 2,5 кг маси тварини, другої - 0,75 см на 2,5 кг 3 маси тварини, третьої групи - 1 см на 2,5 кг маси тварини або 200 мкг/кг за діючою речовиною. Поросята четвертої групи, які слугували контролем, ліків не одержували. Поросята першої, другої і третьої груп одержували екстракт з кормом. Препарат для згодовування готували таким чином: розраховували його кількість на всю групу поросят, відміряли потрібну кількість і змішували з молочними відвійками. Результати експерименту оцінювали за показниками динаміки екстенсивності нематодозних інвазій у дослідних і контрольній групах з підрахунком показників ЕЕ. Копроскопічні дослідження здійснювали до застосування і через 14 діб після використання препарату. Встановлено, що молочні відвійки з великим апетитом випивались поросятами, залишків їх у годівницях не було. Результати паразитологічних досліджень дослідних і контрольних тварин наведені в Таблиці 2. Таблиця 2 Ураженість свиней гельмінтами до та після здійснення способу за заявкою (n=12) № групи (n=3) 1 1 2 3 Контроль 1 2 3 Контроль Екстенсивність інвазії, % Спосіб введення, доза, у мл/2,5 кг маси тварини аскарозної трихурозної езофагостомозної 2 3 4 5 До початку лікування 100 66,7 33,3 100 100 100 100 100 66,7 100 33.3 33,3 Через 14 діб після лікування перорально з кормом, 0,5 66,7 33,3 33,3 перорально з кормом, 0,75 33,3 33,3 33,3 перорально з кормом, 1,0 0 0 0 100 33,3 33,3 4 UA 88412 U 5 10 15 20 25 Як видно з приведених даних, застосування запропонованого способу лікування шляхом введення per os етанольного екстракту у вигляді гелю показав максимальну ЕЕ (100 %) при задаванні дози 1 мл на 2,5 кг маси тварини. У 33,3 % свиней до задавання препарату було виявлено кліщів - саркоптесів, а ще у 25,0 % вошей. Всі тварини, які піддавалися лікуванню у дозі 1 мл на 2,5 кг маси тварини, звільнилися від збудників арахноентомозів. Слід зазначити, що даний спосіб задавання препарату може підвищити технологічність його застосування за проведення масових обробок. Очевидно випробувана препаративна форма препарату і спосіб застосування є актуальними для свинарства і потребує якомога швидшого промислового його виготовлення. Приклад 3. Дослідження запропонованого способу на вівцях було проведено у ННЦ рослинництва і тваринництва ХДЗВА Дергачівського району, Харківської області. Дослідні тварини були представлені молодняком овець 2-3-місячного віку, що знаходиться на відгодівлі в кількості 12 голів, яких було поділено на чотири групи: три дослідних і контрольну. Масу тварин визначали шляхом зважування. Раціон складався із якісного сіна, силосу, комбікорму, соковитих кормів, молочних відвійок, мінеральних добавок. 3 Випробувані дози: ягнятам першої групи згодовували етанольний екстракт в дозі 0,5 см на 3 3 2,5 кг маси тварини, другої - 0,75 см на 2,5 кг маси тварини, третьої групи - 1 см на 2,5 кг маси тварини або 200 мкг / кг за діючою речовиною. Ягнята четвертої групи, які слугували контролем, ліків не одержували. Обробку ягнят дослідних груп проводили шляхом введення на корінь язика, за необхідності, щоб тварина не виплюнула препарат, заливали невелику кількість (50100 мл) теплої води. Результати експерименту оцінювали за показниками динаміки екстенсивності виявлених нематодозних інвазій у дослідних групах і порівнювали їх із показниками контрольної групи до лікування, та через 14 діб після нього з обчисленням екстенсефективності (ЕЕ). Копроскопічні дослідження здійснювали до та після лікування. Результати паразитологічних досліджень тварин дослідних і контрольних груп наведені в Таблиці 3. Таблиця 3 Ураженість ягнят гельмінтами до та після здійснення способу за заявкою (n=12) № групи (n=3) 1 1 2 3 Контроль 1 1 2 3 Контроль Екстенсивність інвазії, % Спосіб введення, доза, мл / 2,5 кг маси тварини стронгілятозної нематодірозної трихурозної 2 3 4 5 До лікування 100 66,7 33,3 66,7 100 66,7 100 100 66,7 66,7 33,3 66,7 Після лікування перорально, 0,5 66,7 66,7 33,3 2 3 4 5 всередину, 0,75 33,3 33,3 33,3 всередину, 1,0 0 0 0 100 33,3 33,3 30 35 40 Наведені дані свідчать, що запропонований спосіб лікування за умов полінематодозної інвазії (стронгілятозна, нематодірозна і трихурозна) при застосування per os етанольного екстракту у вигляді гелю показав максимальну ЕЕ (100 %) при задаванні дози 1 мл на 2,5 кг маси тварини. Слід також відмітити, що у 33,3 % овець до лікування було виявлено збудників мелофагозу кровососок. Проте після проведення лікування Аверкомом в дозі 1 мл на 2,5 кг маси тварини вони повністю зникли. Приклад 4. Дослідження запропонованого способу на козах було проведено у ННЦ рослинництва і тваринництва ХДЗВА Дергачівського району, Харківської області. Дослідні тварини: являли собою козенят 2-3-місячного віку, що знаходяться на відгодівлі в кількості 12 голів, яких було поділено на чотири групи: три дослідних і контрольну. Масу тварин визначали шляхом 5 UA 88412 U 5 10 зважування. Раціон складався із якісного сіна, силосу, комбікорму, соковитих кормів, молочних відвійок, мінеральних добавок. 3 Випробувані дози: козенятам першої групи вводили етанольний екстракт в дозі 0,5 см на 3 3 2,5 кг маси тварини, другої - 0,75 см на 2,5 кг маси тварини, третьої групи - 1 см на 2,5 кг маси тварини або 200 мкг/ кг за діючою речовиною. Козенята четвертої групи, які слугували контролем, ліків не одержували. Ягнятам дослідних груп вводили препарат на корінь язика, за необхідності, щоб тварина раптом не виплюнула препарат заливали невелику кількість (50100 мл)теплої води. Антигельмінтну оцінку препарату проводили за результатами динаміки показника екстенсивності виявлених нематодозних інвазій у дослідних групах і порівнювали їх із показниками контрольної до, та через 14 діб після обробки препаратом з обчисленням екстенсефективності (ЕЕ). Результати паразитологічних досліджень козенят дослідних і контрольних груп наведені в Таблиці 4. Таблиця 4 Ураженість кіз гельмінтами до та після здійснення способу за заявкою (n=12) № групи (n=3) 1 1 2 3 Контроль 1 2 3 Контроль Екстенсивність інвазії, % Спосіб введення, доза, мл / 2,5 кг маси тварини стронгілятозної протостронгілідозної 2 3 4 До лікування 100 33,3 66.7 66,7 100 66,7 66,7 66,7 Після лікування перорально, 0,5 66,7 33,3 перорально, 0,75 33,3 33,3 перорально, 1,0 0 0 100 33,3 15 20 25 30 Наведені дані свідчать, що запропонований спосіб лікування є ефективним для стронгілятозів травного тракту та протостронгілідозів дихальних шляхів кіз при застосування гелю етанольного екстракту per os дози 1 мл на 2,5 кг маси тварини при значенні ЕЕ (100 %). Слід зазначити, що у 25,0 % кіз до лікування було також виявлено кровососок. Після застосування запропонованого способу лікування з використанням дози 1 мл на 2,5 кг маси тварини вони зникли. При проведенні токсикологічних властивостей використовуваного у запропонованому способі препарату не реєстрували вірогідних змін активності ферментних систем, а значення показників активності АлАТ, АсАТ, ГГТП і ЛФ наближалися до їх контрольних рівнів. На фоні відсутності активації сечовиноутворення та змін у процесах гліколізу в організмі тварин дослідних груп не реєстрували порушення активності ферментних систем природної детоксикації в їх організмі. Так, у сироватці крові підсвинків дослідної групи фіксували посилення активності амінотрансфераз - АлАТ і АсАТ - у середньому на 51,9 % і 45,5 % (р
ДивитисяДодаткова інформація
Автори англійськоюBabkin Mykhailo Valeriiovych, Ushkalov Valerii Oleksandrovych, Holovko Anatolii Mykolaiovych, Prykhodko Yurii Oleksandrovych, Romanko Maryna Yevheniivna, Vyhovska Liliia Mykolaivna, Akimenko Larysa Ivanivna, Hodovskyi Oleksii Viacheslavovych, Deriabin Oleh Mykolaiovych, Iutynska Halyna Oleksandrivna, Biliavska Liudmyla Oleksiivna
Автори російськоюБабкин Михаил Валерьевич, Ушкалов Валерий Александрович, Головко Анатолий Николаевич, Приходько Юрий Александрович, Романько Марина Евгеньевна, Выговская Лилия Николаевна, Акименко Лариса Ивановна, Годовский Алексей Вячеславович, Дерябин Олег Николаевич, Иутинская Галина Александровна, Белявская Людмила Алексеевна
МПК / Мітки
МПК: A61K 35/66, A61K 38/00
Мітки: боротьби, ендо, спосіб, ектопаразитами, ссавців
Код посилання
<a href="https://ua.patents.su/9-88412-sposib-borotbi-z-endo-ta-ektoparazitami-u-ssavciv.html" target="_blank" rel="follow" title="База патентів України">Спосіб боротьби з ендо- та ектопаразитами у ссавців</a>
Попередній патент: Розпушник з керованим гідроприводом
Наступний патент: Імпульсний безакумуляторний розпушник
Випадковий патент: Склад евтектичних сплавів і покрить на основі заліза