Спосіб одержання азоксистробіну
Номер патенту: 93424
Опубліковано: 10.02.2011
Автори: Уіттон Алан Джон, Беверідж Джилліан, Бойд Еван Кемпбелл, Васс Джек Хью
Формула / Реферат
1. Спосіб одержання сполуки формули (І)
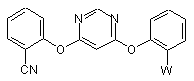 , (I)
, (I)
який включає або
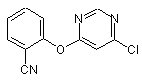
(а) взаємодію сполуки формули (II)
 (II)
(II)
з 2-ціанофенолом або його сіллю в присутності від 0,1 до 40 моль % 1,4-діазабіцикло[2,2,2]октану, або
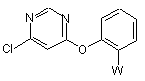
(b) взаємодію сполуки формули (III)
 (IIІ)
(IIІ)
із сполукою формули (IV)
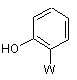 (IV)
(IV)
або її сіллю в присутності від 0,1 до 40 моль % 1,4-діазабіцикло[2,2,2]октану, де W представляє метил(Е)-2-(3-метоксі)акрилатну групу С(СО2СН3)=СНОСН3 або метил-2-(3,3-диметокси)пропаноатну групу С(СО2СН3)СН(ОСН3)2, або суміш двох груп, і де 1,4-діазабіцикло[2,2,2]октан не змішують із сполукою формули (II) або сполукою формули (III), крім: (і) коли присутній 2-ціанофенол або сполука формули (IV); або (іі) коли 1,4-діазабіцикло[2,2,2]октан присутній у вигляді кислої солі, або (ііі) коли умови є такими, що 1,4-діазабіцикло[2,2,2]октан і сполука формули (II) або сполука формули (III) не здатні взаємодіяти одна з одною, при умові, що, коли використовують від 0,1 до 2 моль % 1,4-діазабіцикло[2,2,2]октану, 1,4-діазабіцикло[2,2,2]октан не додають останнім.
2. Спосіб за п. 1, який здійснюють в присутності від 0,5 до 5 моль % 1,4-діазабіцикло[2,2,2]октану.
3. Спосіб за п. 1 або 2, який здійснюють в інертному розчиннику або розріджувачі.
4. Спосіб за п. 3, в якому інертним розчинником або розріджувачем є метилізобутилкетон, циклогексанон, N,N-діізопропілетиламін, толуол, ізопропілацетат або N,N-диметилформамід.
5. Спосіб за п. 4, в якому інертним розчинником або розріджувачем є N,N-диметилформамід.
6. Спосіб за будь-яким з попередніх пунктів, який здійснюють в системі водного органічного розчинника.
7. Спосіб за п. 6, в якому органічним розчинником є циклогексанон, метилізобутилкетон, ізопропілацетат або N,N-диметилформамід.
8. Спосіб за п. 6 або 7, в якому як шар 2-ціанофенолу використовують 2-ціанофеноксид калію.
9. Спосіб за будь-яким з попередніх пунктів, який здійснюють в присутності акцептора кислоти.
10. Спосіб за п. 9, в якому акцептором кислоти є карбонат калію або карбонат натрію.
11. Спосіб за будь-яким з попередніх пунктів, який здійснюють при температурі від 0 до 120 °С.
Текст
1. Спосіб одержання сполуки формули (І) C2 2 (19) 1 3 93424 Даний винахід стосується способу одержання стробілуринового фунгіциду метил-(Е)-2-{2-[6(ціанофенокси)піримідин-4-ілокси]феніл}-3-метоксіакрилату (азоксистробіну). Способи одержання азоксистробіну описані в WO 92/08703. За одним способом азоксистробін одержують взаємодією 2-ціанофенолу з метил-(Е)2-[2-(6-хлорпіримідин-4-ілокси)феніл]-3-метоксіакрилатом. Спосіб одержання похідних асиметричного 4,6-біс(арилокси)піримідину з високим виходом описаний в WO 01/72719, в якому 6-хлор-4арилоксипіримідин взаємодіє з фенолом, необов'язково в присутності розчинника і/або основи, з додаванням від 2 до 40 моль % 1,4діазабіцикло[2,2,2]октану (DABCO). Крім того, авторами даного винаходу раніше було знайдено, що навіть більш низькі концентрації DABCO (наприклад, від 0,1 до 2 моль %) також здатні каталізувати цю реакцію. Даний винахід оснований на відкритті того, що при одержанні азоксистробіну або ацетального попередника азоксистробіну з використанням DABCO як каталізатора порядок додавання реакційних компонентів впливає на вихід і швидкість реакції. Відповідно, даний винахід пропонує спосіб одержання сполуки формули (І): (I) , де W представляє метил-(Е)-2-(3метоксі)акрилатну групу С(СО2СН3)=СНОСН3 або метил-2-(3,3-диметокси)пропаноатну групу С(СО2СН3)СН(ОСН3)2, або суміш двох груп, який включає (а) взаємодію сполуки формули (II): (II) , де W має значення, наведені вище, з 2ціанофенолом або його сіллю в присутності від 0,1 до 40 моль % DABCO, або (b) взаємодію сполуки формули (III): (III) , із сполукою формули (IV): (IV) 4 або її сіллю, де W має значення, наведені вище, в присутності від 0,1 до 40 моль % DABCO, і де DABCO не змішують із сполукою формули (II) або сполукою формули (III), крім: (і) коли присутній 2ціанофенол або сполука формули (IV), або сіль 2ціанофенолу або сполука формули (IV); або (іі) коли DABCO присутній у вигляді кислої солі, або (ііі) коли умови є такими, що DABCO і сполука формули (II) або сполука формули (III) не здатні взаємодіяти одна з одною; при умові, що коли використовують від 0,1 до 2 моль % DABCO, DABCO не додають останнім. Спосіб за даним винаходом легко здійснити змішуванням одного з компонентів реакції, переважно в присутності розчинника або розріджувача, з іншим компонентом, якщо передбачено, в присутності розчинника або розріджувача. У відповідний момент додають акцептор кислоти, як обговорюється нижче, і суміш перемішують, звичайно при підвищеній температурі. Після того, як реакцію вважають завершеною, реакційну суміш обробляють і виділяють продукт, використовуючи традиційні добре відомі кваліфікованим хімікам методи. Згідно з раніше відомими способами каталізатор DABCO може бути доданий в будь-який час до реакційної суміші, включаючи наступне: (і) як перший реагент, (іі) до першого компонента одного, або (ііі) після того, як був доданий другий компонент. Однак тепер було виявлено, що для того, щоб сприяти більш високим виходам продукту і більш швидким швидкостям реакції, не треба давати можливість DABCO взаємодіяти із сполукою формули (II) або сполукою формули (III) за відсутності 2-ціанофенолу або сполуки формули (IV), або солі 2-ціанофенолу або солей сполуки формули (IV). Хоч і без бажання бути пов'язаними теорією, вважається, що за відсутності 2ціанофенолу або сполуки формули (IV), DABCO і сполуки формули (II) або (III) взаємодіють, і потім продукт реакції може додатково конвертуватися, даючи неактивні речовини, таким чином знижуючи вихід і кількість доступного каталізатора. Вважається також, що взаємодія між нейтральною молекулою DABCO і сполуками формули (II) або (III) інгібується в присутності кислих речовин. Тому, якщо кисла сіль DABCO додається в реакційну колбу або утворюється in situ (при додаванні нейтрального DABCO до суміші, що містить кислоту), і при умові, що акцептор кислоти не присутній або недостатньо розчинний в реакційній суміші для того, щоб швидко депротонізувати кислу сіль DABCO, взаємодія між DABCO і сполуками формули (II) або (III) інгібується. Вважається також, що в присутності 2-ціанофенолу або сполуки формули (IV) фенол може діяти як джерело кислоти, або протонуючи сіль DABCO безпосередньо, або після взаємодії між фенолом і сполуками формули (II) або (III) може діяти як основа і бути протонованим молем хлористоводневої кислоти, що утворилася. Нарешті, в присутності солі 2-ціанофенолу або солі сполуки формули (IV) продукт взаємодії DABCO і сполук формули (II) або (III) взаємодіє з 5 сіллю 2-ціанофенолу або сполуки формули (IV), даючи очікуваний продукт формули (І), і одночасно регенерує каталізатор. Таким чином, зокрема, спосіб за даним винаходом може бути здійснений будь-яким одним з наступних способів: і) додавання 2-ціанофенолу або сполуки формули (IV) до сполуки формули (II) або сполуки формули (III) і потім додавання DABCO; іі) додавання 2-ціанофенолу або сполуки формули (IV) до DABCO і потім додавання сполуки формули (II) або сполуки формули (III); ііі) додавання DABCO до 2-ціанофенолу або до сполуки формули (IV) і потім додавання сполуки формули (II) або сполуки формули (III); iv) додавання сполуки формули (II) або сполуки формули (III) до 2-ціанофенолу або сполуки формули (IV) і потім додавання DABCO; v) одержання суміші сполуки формули (II) або сполуки формули (III) з 2-ціанофенолом або сполукою формули (IV) і потім додавання DABCO; vi) одержання суміші DABCO з 2ціанофенолом або сполукою формули (IV) і потім додавання сполуки формули (II) або сполуки формули (III); vii) додавання суміші 2-ціанофенолу або сполуки формули (IV) і сполуки формули (II) або сполуки формули (III) до DABCO; або viii) додавання суміші 2-ціанофенолу або сполуки формули (IV) і DABCO до сполуки формули (II) або сполуки формули (III); іх) додавання DABCO до кислого розчину сполуки формули (II) або сполуки формули (III), в якій наявно досить кислоти для того, щоб перетворити весь DABCO в сіль, і потім додавання 2ціанофенолу або сполуки формули (IV), при умові, що або акцептор кислоти не доданий до 2ціанофенолу, або взаємодія між сіллю DABCO і акцептором кислоти є повільною; або х) змішування кислої солі DABCO, або як твердої речовини, або як солі, заздалегідь утвореної взаємодією кислоти і DABCO, із сполукою формули (II) або сполукою формули (III) і потім додавання 2-ціанофенолу або сполуки формули (IV), при умові, що або основа не додана до 2-ціанофенолу, або взаємодія між сіллю DABCO і акцептором кислоти є повільною. Відповідні кислі солі DABCO включають, але не обмежуються цим, DABCOH+Cl-, DABCOH+(HSO4)-, (DABCOH+)2SO42і DABCOH+(SO3Me)-. Звичайно, якщо DABCO нездатний взаємодіяти із сполукою формули (II) або сполукою формули (III), наприклад, якщо обидва компоненти знаходяться в твердому стані, або один компонент нерозчинний (або, можливо, лише частково розчинний) в розчиннику/розріджувачі, що використовується в реакції, то вони можуть бути змішані із забрудненнями. Однак, в такому випадку, до того як умови будуть зроблені прийнятними для того, щоб відбувалася реакція, повинні бути додані 2ціанофенол або сполука формули (IV), або сіль 2ціанофенолу або сполуки формули (IV). Додаткові варіанти змішування є таким чином дозволеними, якщо компоненти реакції спершу 93424 6 змішані при умовах, в яких вони не здатні взаємодіяти. Наприклад, може бути одержана суміш сполуки формули (II) або сполуки формули (III) з DABCO, і компоненти не будуть взаємодіяти доти, поки не будуть додані 2-ціанофенол або сполука формули (IV). У переважному здійсненні спосіб за винаходом включає взаємодію сполуки формули (II): (II) , в якій W має значення, наведене вище, з 2ціанофенолом або його сіллю (переважно 2ціанофеноксидом калію) в присутності від 0,1 до 40 моль % DABCO. Коли спосіб за винаходом здійснюють, використовуючи сполуку формули (II), в якій W представляє метил-2-(3,3-диметокси)пропаноатну групу, або використовуючи сполуку формули (IV), в якій W представляє метил-2-(3,3-диметокси)пропаноатну групу, продукт, що одержується, може включати частину сполуки формули (І), в якій W представляє метил-(Е)-2-(3-метоксі)акрилатну групу. Це може статися, оскільки можливо, що метанол елімінує з метил-2-(3,3-диметокси)пропаноатної групи в умовах способу. По тій же причині, якщо спосіб за винаходом здійснюють, використовуючи сполуку формули (II) або сполуку формули (IV), в якій W представляє суміш метил-2-(3,3диметокси)пропаноатної групи і метил-(Е)-2-(3метоксі)акрилатної групи (а винахід включає такий спосіб), одержуваний продукт повинен бути сполукою формули (І), в якій W являє собою суміш метил-2-(3,3-диметокси)пропаноатної групи і метил(Е)-2-(3-метоксі)акрилатної групи; однак, продукт може мати більш високу частку сполуки формули (І), в якій W являє собою метил-(Е)-2-(3-метоксі)акрилатну групу, ніж очікувалося з частки сполуки формули (І), в якій W являє собою метил-(Е)-2(3-метоксі)акрилатну групу, в суміші вихідних речовин, внаслідок цього потенційного елімінування метанолу. Це не має реальних наслідків, тому що звичайно потрібно перетворити продукт формули (І), в якій W представляє метил-2-(3,3-диметокси)пропаноатну групу, в сполуку формули (І), в якій W представляє метил-(Е)-2-(3-метоксі)акрилатну групу, шляхом елімінування метанолу. Звичайно спосіб за винаходом здійснюють у відповідному інертному розчиннику або розріджувачі. Вони включають, наприклад, аліфатичні, аліциклічні і ароматичні вуглеводні, такі як петролейний ефір, гексан, гептан, циклогексан, метилциклогексан, бензол, толуол, ксилол і декалін; галогеновані вуглеводні, такі як хлорбензол, дихлорбензол, дихлорметан, хлороформ, чотирихлористий вуглець, дихлоретан і трихлоретан; гетероароматичні розчинники, такі як піридин або заміщений піридин, наприклад, 2,6-диметилпіридин; прості ефіри, такі як діетиловий ефір, діізопропіловий ефір, метил-трет-бутиловий ефір, метил-трет-аміловий ефір, діоксан, тетрагідрофуран, 1,2-диметоксіетан, 1,2-діетоксіетан і анізол; 7 кетони, такі як ацетон, бутанон, метилізобутилкетон і циклогексанон; нітрили, такі як ацетонітрил, пропіонітрил, н- і ізобутиронітрил і бензонітрил; аміди, такі як N,N-диметилформамід, N,Nдиметилацетамід, N-метилформамід, N-метилпіролідон і триамід гексаметилфосфорної кислоти; третинні аміни, особливо аміни формули R1R2R3N, де R1, R2 і R3, кожний незалежно представляє С1-10 (особливо С1-8)-алкіл, С3-6-циклоалкіл, арил (особливо феніл) або арил(С1-4)алкіл (особливо бензил); або два або три з R1, R2 і R3 сполучені разом з атомом азоту, до якого вони приєднані, утворюючи одне, два або три 5-, 6- або 7-членних аліциклічних кільця, необов'язково конденсованих і що необов'язково містять другий атом азоту в кільці, де прикладами відповідних третинних амінів є N,Nдіізопропілетиламін (основа Хюніга), N,N-диметиланілін, триетиламін, трет-бутилдиметиламін, N,Nдіізопропілметиламін, N,N-діізопропілізобутиламін, N,N-діізопропіл-2-етилбутиламін, три-н-бутиламін, N,N-дициклогексилметиламін, N,N-дициклогексилетиламін, N-трет-бутилциклогексиламін, N,Nдиметилциклогексиламін, 1,5-діазабіцикло[4,3,0]нон-5-ен, 1,8-діазабіцикло[5,4,0]ундец-7-ен або 2метиламінопіридин; складні ефіри, такі як метилацетат, етилацетат і ізопропілацетат; сульфоксиди, такі як диметилсульфоксид; сульфони, такі як диметилсульфон або сульфолан; і суміші таких розчинників і розріджувачів і суміші одного або декількох з них з водою. Крім того, якщо вихідні сполуки для реакції або продукт реакції знаходяться у вигляді рідини або повинні бути рідкими при температурі реакції, вони можуть діяти як розріджувач/розчинник для способу за винаходом. У такій ситуації додатковий розріджувач або розчинник може виявитися непотрібним. Особливо прийнятними розріджувачами є кетон (такі як метилізобутилкетон і циклогексанон, складні ефіри (такі як ізопропілацетат), третинні аміни (такі як N,N-діізопропілетиламін (основа Хюніга)), ароматичні вуглеводні (такі як толуол або ксилол (змішані ізомери або індивідуальний ізомер)) і аміди (такі як N,N-диметилформамід). В переважному аспекті даного винаходу як розріджувач використовують метилізобутилкетон. В наступному аспекті даного винаходу як розріджувач використовують циклогексанон. В наступному аспекті даного винаходу як розріджувач використовують ізопропілацетат. В наступному аспекті даного винаходу як розріджувач використовують N,N-диметилформамід. В наступному аспекті даного винаходу як розріджувач використовують толуол. В наступному аспекті даного винаходу як розріджувач використовують N,N-діізопропілетиламін (основа Хюніга). Найбільш переважно розріджувачем, що використовується в даному винаході, є N,N-диметилформамід. У наступному здійсненні даного винаходу спосіб здійснюють в системі водного органічного розчинника. Переважно в цьому здійсненні, коли сполука формули (II) взаємодіє з 2-ціанофенолом, 2ціанофенол присутній у вигляді солі. Ця сіль може бути або додана або генерована in situ з нейтрального фенолу і акцептора кислоти (дивіться нижче). Переважно сіллю є літієва, цезієва, натрієва, 93424 8 калієва, 5-діазабіцикло[4,3,0]нон-5-енова або 1,8діазабіцикло[5,4,0]ундец-7-енова сіль 2-ціанофенолу. Більш переважно сіллю є 1,8-діазабіцикло[5,4,0]ундец-7-енова, натрієва або калієва сіль 2-ціанофенолу. Ще більш переважно сіллю є натрієва або калієва сіль 2-ціанофенолу. Найбільш переважно сіллю є 2-ціанофеноксид калію. Відповідними співрозчинниками для використання в такому водному процесі є розчинники, які щонайменше частково не змішуються з водою, такі як циклогексанон, метилізобутилкетон і ізопропілацетат. Переважно воду видаляють в ході реакції, коли використовують ці розчинники, що частково не змішуються з водою. Крім того, було також знайдено, що в такому водному процесі можуть бути використані також розчинники, що змішуються з водою. Відповідними розчинниками, що змішуються з водою є N,N-диметилформамід, N,Nдиметилацетамід, N-метилпіролідон і диметилсульфоксид. В одному здійсненні воду видаляють в ході реакції, коли використовують розчинники, що змішуються з водою. Найбільш переважно, коли використовуютьтаку водну систему, сіллю 2ціанофенолу є 2-ціанофеноксид калію, а розріджувачем є циклогексанон, метилізобутилкетон, ізопропілацетат або N,N-диметилформамід. Зазначено, що, коли 2-ціанофенол вводять в процес у вигляді водного розчину 2-ціанофеноксиду калію, можна знизити кількість акцептора кислоти, що використовується (дивіться нижче). Крім того, спосіб за винаходом переважно здійснюють в присутності щонайменше 0,8 моль акцептора кислоти на моль 2-ціанофенолу або сполуки формули (IV). Відповідними акцепторами кислоти є всі звичайні неорганічні і органічні основи. Вони включають, наприклад, гідроксиди, ацетати, карбонати, бікарбонати, фосфати, кислі фосфати і гідриди лужноземельних металів і лужних металів (такі як гідроксид натрію, гідроксид калію, ацетат натрію, ацетат калію, карбонат натрію, карбонат калію, бікарбонат натрію, бікарбонат калію, фосфат калію, кислий фосфат калію, фосфат натрію, кислий фосфат натрію, гідрид кальцію, гідрид натрію і гідрид калію), гуанідини, фосфазини (дивіться, наприклад, Liebigs Ann., 1996, 1055-1081), профосфатрани (дивіться, наприклад, JACS, 1990, 9421-9422), діалкіламіни металів (такі як діізопропіламід літію) і третинні аміни (такі як описані вище як можливі розчинники і розріджувачі). Особливо відповідними акцепторами кислот є карбонати лужноземельних металів і лужних металів, особливо карбонат калію і карбонат натрію, і 1,5діазабіцикло[4,3,0]нон-5-ен і 1,8-діазабіцикло[5,4,0] ундец-7-ен. Більш переважно акцептором кислоти є карбонат калію. Найбільш переважно даний винахід здійснюють в присутності метилізобутилкетону, циклогексанону, ізопропілацетату, N,Nдіізопропілетиламіну (основа Хюніга), або N,Nдиметилформаміду з карбонатом калію як акцептором кислоти. Момент, в який додають акцептор кислоти, може бути важливий в деяких здійсненнях винаходу. Якщо акцептор кислоти, що використовується, такий як 1,5-діазабіцикло[4,3,0]нон-5-ен, 1,8-діазабіцикло[5,4,0]ундец-7-ен, фосфат або кислий фо 9 сфат лужного металу, більше ніж моль карбонату лужного металу або лужноземельного металу, не доданий у вигляді водного розчину і не буде генерувати великі (один моль води на моль депротонованого фенолу) кількості води, то акцептор кислоти може бути доданий в будь-який час в ході процесу. Крім того, якщо 2-ціанофенол є першим доданим компонентом реакції, будь-який акцептор кислоти може бути доданий в будь-який час, і можуть бути зроблені висновки, чи треба видаляти всю воду, генеровану взаємодією 2-ціанофенолу з акцептором кислоти. Якщо сполука формули (II) завантажена першим, водні розчини акцептора кислоти не повинні бути додані до того, як в суміш буде доданий 2-ціанофенол. Для сполуки формули (IV), введеної першою, переважно в присутності розріджувача, вигідно додавати сполуку формули (III) до додавання акцептора кислоти. Для сполуки формули (III), введеної першою, переважно в присутності розріджувача, акцептор кислоти може бути доданий в будь-який відповідний час. Хоч і не бажаючи бути пов'язаними теорією, необхідно зазначити, що сильні основи в присутності значних кількостей води можуть гідролізувати сполуку формули (II), приводячи в результаті до утворення побічного продукту і більш низьких виходів - присутність 2-ціанофенолу або обох компонентів реакції буде нейтралізувати сильні основи і дозволить відбуватися бажаній реакції. Очевидно, що при виборі кількості акцептора кислоти, яка повинна бути додана, потрібно розглядати ефект можливого надлишку акцептора кислоти, і звичайно при використанні водних розчинів акцептора кислоти або акцептора кислоти, який генерує моль води на моль фенолу, що депротонується, такого як гідроксиди або кислі карбонати лужного або лужноземельного металу, потрібно використати близькі до стехіометричних кількості основи. Спосіб за винаходом здійснюють в присутності від 0,1 до 40 моль % 1,4-діазабіцикло[2,2,2]октану (DABCO). Переважно його здійснюють в присутності від 0,2 до 40 моль % DABCO. Більш переважно його здійснюють в присутності від 0,5 до 10 моль % DABCO. Найбільш переважно його здійснюють в присутності від 0,5 до 5 моль % DABCO. У конкретному здійсненні винаходу спосіб здійснюють в присутності приблизно 1 моль % DABCO з метилізобутилкетоном, циклогексаноном, ізопропілацетатом, N,N-діізопропілетиламіном (основою Хюніга), толуолом або N,Nдиметилформамідом як розріджувачем. Більш переважно розріджувачем є N,N-диметилформамід або ізопропілацетат. Найбільш переважно розріджувачем є N,N-диметилформамід. Відповідним акцептором кислоти повинен бути карбонат калію. При здійсненні способу за винаходом температура реакції можеваріюватися у відносно широкому інтервалі. Вибрана температура повинна залежати від природи розчинника або розріджувача, наприклад, його температури кипіння і/або його ефективності в прискоренні бажаної реакції, і від швидкості, з якою реакція повинна проводитися. При будь-якому даному розчиннику або розріджувачі реакція буде схильна протікати більш повільно при більш низьких температурах. В принципі 93424 10 реакцію можна провести при температурі від 0 до 120°С, переважно при температурі від 40 до 100°С і звичайно при температурі від 45 до 95°С, наприклад, від 60 до 95°С. Спосіб за винаходом може бути здійснений при будь-якому прийнятному тиску в залежності від розчинника, основи і температури реакції. Для розріджувачів або реагентів, що низько киплять, більш високі температури можуть бути досягнуті при більш високому, ніж атмосферний, тиск, а, якщо бажано, реакція може бути проведена при атмосферному тиску або у вакуумі. Задовільно реакція може бути проведена під тиском від 0,01 до 10 бар, більш переважно від 0,5 до 5 бар і найбільш переважно під тиском від 0,8 до 2 бар, наприклад, під тиском навколишнього середовища. Для здійснення способу за винаходом застосовують переважно від 0,4 до 4 моль, більш переважно від 0,95 до 1,5 моль і найбільш переважно від 1 до 1,2 моль 2-ціанофенолу на моль сполуки формули (II); і застосовують подібні кількості (переважно від 0,4 до 4 моль, більш переважно від 0,95 до 1,5 моль і найбільш переважно від 1 до 1,2 моль) сполуки формули (IV) на моль сполуки формули (III). 2-ціанофенол є сполукою, що є в продажу. Сполука формули (II), в якій W представляє метил-(Е)-2-(3-метоксі)акрилатну групу С(СО2 СН3)=СНОСН3, або сполука формули (II), в якій W представляє метил-2-(3,3-диметокси)пропаноатну групу С(СО2СН3)СН(ОСН3)2, можуть бути одержані, як описано в WO 92/08703, взаємодією 3-(метокси)метиленбензофуран-2(3Н)-ону (одержаного з бензофуран-2(3Н)-ону) з 4,6-дихлорпіримідином. Сполука формули (II), в якій W представляє метил-(Е)-2-(3-метоксі)акрилатну групу, може бути одержана також елімінуванням метанолу (тобто деметанолізом) із сполуки формули (II), в якій W представляє метил-2-(3,3-диметокси)пропаноатну групу, як описано в WO 92/08703 або WO 98/07707. Сполука формули (II), в якій W представляє метил-2-(3,3-диметокси)пропаноатну групу, може бути одержана, як описано в GB-A-2291874, взаємодією сполуки формули (IV), в якій W представляє метил-2-(3,3-диметокси)пропаноатну групу, з 4,6-дихлорпіримідином. Вона може бути очищена перед використанням відомими методами або може бути використана в неочищеному стані від попередньої реакції, наприклад, в формі реакції "в одній посудині". Сполука формули (IV), в якій W представляє метил-2-(3,3-диметокси)пропаноатну групу, може бути одержана, як описано в GB-A-2291874, з 3-(метокси)метиленбензофуран-2(3Н)-ону. Сполука формули (IV), в якій W представляє метил-(Е)-2-(3метоксі)акрилатну групу, може бути одержана по методиці, описаній в ЕР 0242081, або деметанолізом сполуки формули (IV), в якій W представляє метил-2-(3,3-диметокси)пропаноатну групу. У цьому випадку фенольна група повинна бути захищена, наприклад, бензилатуванням перед деметанолізом з подальшим зняттям захисту. Наступні приклади пояснюють винахід. Приклади призначені для необхідного уявлення про проведення випробувань загалом і не призначені 11 для того, щоб яким-небудь чином обмежити винахід. Приклади У цих прикладах: DABCO=діазабіцикло[2,2,2]октан МІВK=метилізобутилкетон ДМФА=N,N-диметилформамід DBU=1,8-діазабіцикло[5,4,0]ундец-7-ен а) Конверсія метил-(Е)-2-{2-[6-хлорпіримідин4-ілокси]феніл}-3-метоксіакрилату в метил-(Е)-2{2-[6-(2-ціанофенокси)піримідин-4-ілокси]феніл}-3метоксіакрилат з DABCO (2,6 моль %), доданим перед 2-ціанофенолом До розчину метил-(Е)-2-{2-[6-хлорпіримідин-4ілокси]феніл}-3-метоксіакрилату в ДМФА (207,3 г при 46,4%, 0,3 моль), що перемішується, при 50°С додавали карбонат калію (53,5 г при 98%, 0,45 моль) і DABCO (0,89 г при 98%, 0,0078 моль, 2,6 моль %). Суміші давали перемішуватися протягом 5 хвилин і потім додавали розчин 2-ціанофенолу в ДМФА (78,5 г при 50%, 0,33 моль). Суміш нагрівали до 65°С і витримували при цій температурі протягом 1 години. ДМФА видаляли вакуумною дистиляцією і потім залишок розчиняли в толуолі (165,8 г), нагрівали до 80°С і промивали водою (318,6 г). Толуольний розчин (301,7 г) містив метил-(Е)-2-{2-[6-(2-ціанофенокси)піримідин-4ілокси]феніл}-3-метоксіакрилат (37,0 мас.%), 92% від теорії. b) Конверсія метил-(Е)-2-(2-[6-хлорпіримідин4-ілокси]феніл}-3-метоксіакрилату в метил-(Е)-2{2-[6-(2-ціанофенокси)піримідин-4-ілокси]феніл|-3метоксіакрилат з DABCO (2,6 моль %), доданим після 2-ціанофенолу До розчину метил-(Е)-2-{2-[6-хлорпіримідин-4ілокси]феніл}-3-метоксіакрилату в ДМФА (207,3 г при 46,4%, 0,3 моль), що перемішується, при 48°С додавали карбонат калію (54,1 г при 98%, 0,38 моль) і розчин 2-ціанофенолу в ДМФА (78,5 г при 50%, 0,33 моль). Додавали DABCO (0,89 г при 98%, 0,0078 моль, 2,6 моль %), суміш нагрівали до 65°С і витримували при цій температурі протягом 1 години. ДМФА видаляли вакуумною дистиляцією і потім залишок розчиняли в толуолі (165,8 г), нагрівали до 80°С і промивали водою (318,6 г). Концентрація метил-(Е)-2-{2-[6-(2-ціанофенокси)піримідин-4-ілокси]феніл}-3-метоксіакрилату в толуольному розчині становила 39,1 мас.% (98,6% від теорії). с) Конверсія метил-(Е)-2-{2-[6-хлорпіримідин-4ілокси]феніл}-3-метоксіакрилату в метил-(Е)-2-{2[6-(2-ціанофенокси)піримідин-4-ілокси]феніл}-3-метоксіакрилат з DABCO (2,6 моль %), доданим після 2-ціанофенолу До розчину метил-(Е)-2-{2-[6-хлорпіримідин-4ілокси]феніл}-3-метоксіакрилату в ДМФА (207,3 г при 46,4%, 0,3 моль), що перемішується, при 48°С додавали карбонат калію (54,1 г при 98%, 0,38 моль) і розчин 2-ціанофенолу в ДМФА (78,5 г при 50%, 0,33 моль). Додавали DABCO (0,89 г при 98 мас.%, 0,0078 моль, 2,6 моль %), суміш нагрівали до 65°С і витримували при цій температурі протягом 1 години. ДМФА видаляли вакуумною дистиляцією до кінцевої температури 100°С, і потім залишок розчиняли ще гарячим в толуолі 93424 12 (165,8 г). Додавали гарячу воду (319 г) і суміш перемішували при 80°С протягом 30 хвилин перед осадженням і відділенням водної фази. Концентрація метил-(Е)-2-{2-[6-(2-ціанофенокси)піримідин4-ілокси]феніл}-3-метоксіакрилату в толуольному розчині (306,7 г) становила 39,3 мас.% (99,7% від теорії). d) Конверсія метил-(Е)-2-{2-Г6-хлорпіримідин4-ілокси]феніл}-3-метоксіакрилату в метил-(Е)-2{2-[6-(2-ціанофенокси)піримідин-4-ілокси]феніл}-3метоксіакрилат з DABCO (2,6 моль %), доданим після 2-ціанофенолу До розчину метил-(Е)-2-{2-[6-хлорпіримідин-4ілокси]феніл}-3-метоксіакрилату в ДМФА (207,3 г при 46,4%, 0,3 моль), що перемішується при 48°С додавали карбонат калію (54,1 г при 98%, 0,38 моль) і розчин 2-ціанофенолу в ДМФА (78,5 г при 50 мас.%, 0,33 моль). Додавали DABCO (0,89 г при 98 мас.%, 0,0078 моль, 2,6 моль %), суміш нагрівали до 65°С і витримували при цій температурі протягом 1 години. ДМФА видаляли вакуумною дистиляцією до кінцевої температури 100°С, і потім залишок розчиняли ще гарячим в толуолі (165,8 г). Додавали гарячу воду (319 г) і суміш перемішували при 80°С протягом 30 хвилин перед осадженням і відділенням водної фази. Концентрація метил-(Е)-2-{2-[6-(2-ціанофенокси)піримідин4-ілокси]феніл}-3-метоксіакрилату в толуольному розчині (303,9 г) становила 39,1 мас.% (98,3% від теорії). e) Реакція поєднання метил-(Е)-2-{2-[6хлорпіримідин-4-ілокси]феніл}-3-метоксіакрилату з 2-ціанофенолом в МІВК з 2 моль % DABCO, доданим після 2-ціанофенолу Суспензію, що містить метил-(Е)-2-{2-[6хлорпіримідин-4-ілокси]феніл}-3-метоксіакрилат (80,9 г при 99%, 0,25 моль), карбонат калію (52,8 г при 98%, 0,375 моль) і 2-ціанофенол (33,6 г при 97,5%, 0,275 моль) в МІВК (160 мл) нагрівали до приблизно 60°С. Додавали розчин DABCO (0,56 г, 0,005 моль) в МІВК (10 мл). Суміш нагрівали до 80°С і витримували при цій температурі протягом 200 хвилин. У реактор завантажували воду (300 мл), підтримуючи температуру в інтервалі 7080°С. Суміш перемішували протягом 40 хвилин, потім відстоювали і нижню водну фазу відділяли. МІВК розчин (238,6 г) містив метил-(Е)-2-{2-[6-(2ціанофенокси)піримідин-4-ілокси]феніл}-3-метоксіакрилат (41,3 мас.%), 97,8% від теорії. f) Реакція поєднання метил-(E)-2-{2-[6хлорпіримідин-4-ілокси]феніл}-3-метоксіакрилату з 2-ціанофенолом в МІВК з 2 моль % DABCO, доданим до 2-ціанофенолу До суспензії, що містить метил-(Е)-2-{2-[6хлорпіримідин-4-ілокси]феніл}-3-метоксіакрилат (80,9 г при 99%, 0,25 моль) і карбонат калію (52,8 г при 98%, 0,375 моль) в МІВК (160 мл), додавали розчин DABCO (0,56 г, 0,005 моль) в МІВК (10 мл). Суміш нагрівали до приблизно 60°С і потім завантажували 2-ціанофенол (33,6 г при 97,5%, 0,275 моль). Суміш нагрівали до 80°С і витримували при цій температурі протягом 280 хвилин. В реактор завантажували воду (300 мл), підтримуючи температуру в інтервалі 70-80°С. Суміш перемішували протягом 40 хвилин, потім відстоювали і нижню 13 водну фазу відділяли. МІВК розчин (237,0 г) містив метил-(Е)-2-{2-[6-(2-ціанофенокси)піримідин-4ілокси]феніл}-3-метоксіакрилат (40,2 мас.%), 94,5% від теорії. g) Реакція поєднання метил-(Е)-2-{2-[6хлорпіримідин-4-ілокси]феніл}-3-метоксіакрилату з 2-ціанофенолом в ДМФА з 5 моль % DABCO, доданим після 2-ціанофенолу Розчин метил-(Е)-2-{2-[6-хлорпіримідин-4-ілокси]феніл}-3-метоксіакрилату (80,0 г при 98,0 мас.%, 0,245 моль) в ДМФА (80 г), що перемішується, нагрівали до 60°С. Додавали карбонат калію (52,4 г при 98 мас.%, 0,37 моль) і розчин 2ціанофенолу (33,3 г при 97,5 мас.%, 0,27 моль) в ДМФА (33,3 г) і DABCO (1,43 г при 97 мас.%, 0,012 моль) з 5-хвилинним інтервалом між кожним додаванням. Суміш нагрівали до 80°С (екзотермічний ефект підіймав температуру до 89°С). Реакція завершувалася повністю за 10 хвилин. ДМФА видаляли з суміші вакуумною дистиляцією до максимальної температури 100°С. Після того, як залишку від дистиляції давали трохи вихолонути, додавали толуол (137 г). Розчин перемішували при 75-80°С протягом 5 хвилин, і потім додавали гарячу воду (263,6 г), підтримуючи температуру суміші вище за 70°С. Двофазну суміш перемішували при 80°С протягом 30 хвилин, потім відстоювали і розділяли. Толуольний розчин (229,7 г) містив метил-(Е)-2-{2-[6-(2-ціанофенокси)піримідин-4ілокси]феніл}-3-метоксіакрилат (42,0 мас.%), 98,0% від теорії. h) Реакція поєднання метил-(Е)-2-{2-[6хлорпіримідин-4-ілокси]феніл|-3-метоксіакрилату з 2-ціанофенолом в ДМФА з 5 моль % DABCO, доданим до 2-ціанофенолу Розчин метил-(Е)-2-{2-[6-хлорпіримідин-4-ілокси]феніл}-3-метоксіакрилату (80,0 г при 98,0 мас.%, 0,245 моль) в ДМФА (80 г), що перемішується, нагрівали до 60°С. Додавали карбонат калію (52,4 г при 98 мас.%, 0,37 моль), DABCO (1,43 г при 97 мас.%, 0,012 моль) і розчин 2ціанофенолу (33,3 г при 97,5 мас.%, 0,27 моль) в ДМФА (33,3 г) з 5-хвилинним інтервалом між кожним додаванням. Суміш нагрівали до 80°С. Реакція завершувалася повністю за 360 хвилин. ДМФА видаляли з суміші вакуумною дистиляцією до максимальної температури 100°С. Після того, як залишку від дистиляції давали трохи вихолонути, додавали толуол (137 г). Розчин перемішували при 75-80°С протягом 5 хвилин, і потім додавали гарячу воду (263,6 г), підтримуючи температуру суміші вище за 70°С. Двофазну суміш перемішували при 80°С протягом 30 хвилин, потім відстоювали і розділяли. Толуольний розчин (228,9 г) містив метил-(Е)-2-{2-[6-(2-ціанофенокси)піримідин-4ілокси]феніл}-3-метоксіакрилат (37 мас.%), 86,1% від теорії. і) Реакція поєднання метил-(Е)-2-{2-[6хлорпіримідин-4-ілокси]-феніл}-3-метоксіакрилату з 2-ціанофенолом в ДМФА з 5,0 моль % DABCO, доданим після 2-ціанофенолу і з карбонатом калію, доданим останнім Розчин метил-(Е)-2-{2-[6-хлорпіримідин-4ілокси]феніл}-3-метоксіакрилату (80,0 г при 98,0 мас.%, 0,245 моль), що перемішується, в 93424 14 ДМФА (80 г) нагрівали до 60°С. Додавали розчин 2-ціанофенолу (33,3 г при 97,5 мас.%, 0,27 моль) в ДМФА (33,3 г), DABCO (1,43 г при 97 мас.%, 0,012 моль) і карбонат калію (52,4 г при 98 мас.%, 0,37 моль), з 5-хвилинним інтервалом між кожним додаванням. Суміш нагрівали до 80°С (екзотермічний ефект підіймав температуру до 89°С). Реакція завершувалася повністю приблизно за 10 хвилин. ДМФА видаляли з суміші вакуумною дистиляцією до максимальної температури 100°С. Після того, як залишку від дистиляції давали трохи вихолонути, додавали толуол (137 г). Розчин перемішували при 75-80°С протягом 5 хвилин, і потім додавали гарячу воду (263,6 г), підтримуючи температуру суміші вище за 70°С. Двофазну суміш перемішували при 80°С протягом 30 хвилин, потім відстоювали і розділяли. Толуольний розчин (229,1 г) містив метил-(Е)-2-{2-[6-(2-ціанофенокси)піримідин-4ілокси]феніл}-3-метоксіакрилат (41,7 мас.%), 97,1% від теорії. j) Реакція поєднання метил-(Е)-2-{2-[6хлорпіримідин-4-ілокси]феніл}-3-метоксіакрилату з 2-ціанофенолом в ДМФА з 5,0 моль % DABCO, доданим до 2-ціанофенолу. Метил-(Е)-2-{2-[6хлорпіримідин-4-ілокси]феніл}-3-метоксіакрилат додавали останнім Суспензію карбонату калію (51,6 г при 98 мас.%, 0,37 моль), що перемішується, в ДМФА (80 г) нагрівали до 60°С. Додавали DABCO (1,41 г при 97 мас.%, 0,012 моль), розчин 2-ціанофенолу (32,8 г при 97,5 мас.%, 0,27 моль) в ДМФА (32,8 г) і метил-(Е)-2-{2-[6-хлорпіримідин-4-ілокси]феніл}-3метоксіакрилат (80,0 г при 98,0 мас.%, 0,244 моль) з 5-хвилинним інтервалом між кожним додаванням. Суміш нагрівали до 80°С (екзотермічний ефект підіймав температуру до 84°С). Реакція завершувалася повністю приблизно за 20 хвилин. ДМФА видаляли з суміші вакуумною дистиляцією до максимальної температури 100°С. Після того, як залишку від дистиляції давали трохи вихолонути, додавали толуол (134,8 г). Розчин перемішували при 75-80°С протягом 5 хвилин, і потім додавали гарячу воду (259,4 г), підтримуючи температуру суміші вище за 70°С. Двофазну суміш перемішували при 80°С протягом 30 хвилин, потім відстоювали і розділяли. Толуольний розчин (225,6 г) містив метил-(Е)-2-{2-[6-(2-ціанофенокси)піримідин-4ілокси]феніл}-3-метоксіакрилат (43,79 мас.%), 100% від теорії. k) Реакція поєднання метил-(Е)-2-{2-[6хлорпіримідин-4-ілокси]феніл}-3-метоксіакрилату з 2-ціанофенолом в ДМФА з 5,0 моль % DABCO, доданим до 2-ціанофенолу. Карбонат калію, доданий останнім Розчин метил-(Е)-2-{2-[6-хлорпіримідин-4ілокси]феніл}-3-метоксіакрилату (80,0 г при 98,0 мас.%, 0,244 моль) в ДМФА (80 г), що перемішується, нагрівали до 60°С. Додавали DABCO (1,41 г при 97 мас.%, 0,012 моль), розчин 2ціанофенолу (32,8 г при 97,5 мас.%, 0,27 моль) в ДМФА (32,8 г) і карбонат калію (51,6 г при 98 мас.%, 0,37 моль) з 5-хвилинним інтервалом між кожним додаванням. Суміш нагрівали до 80°С. Реакція завершувалася повністю за 4 години. ДМФА видаляли з суміші вакуумною дистиляцією 15 до максимальної температури 100°С. Після того, як залишку від дистиляції давали трохи вихолонути, додавали толуол (134,8 г). Розчин перемішували при 75-80°С протягом 5 хвилин, і потім додавали гарячу воду (259,4 г), підтримуючи температуру суміші вище за 70°С. Двофазну суміш перемішували при 80°С протягом 30 хвилин, потім відстоювали і розділяли. Толуольний розчин (226,6 г) містив метил-(Е)-2-{2-[6-(2-ціанофенокси)піримідин-4ілокси]феніл}-3-метоксіакрилат (37,95 мас.%), 87,4% від теорії. l) Реакція поєднання метил-(Е)-2-{2-[6хлорпіримідин-4-ілокси]феніл}-3-метоксіакрилату з 2-ціанофенолом в ізопропілацетаті з 40 моль % DABCO, доданим після 2-ціанофенолу До ізопропілацетату (20,6 г) при 40°С додавали метил-(Е)-2-{2-[6-хлорпіримідин-4-ілокси]феніл}-3-метоксіакрилат (32,8 г при 98 мас.%, 0,1 моль). Після перемішування протягом 10 хвилин додавали карбонат калію (14,1 г при 98 мас.%, 0,1 моль). Додавали додатково ізопропілацетат (0,8 г) (щоб зробити завись пересувною). Після перемішування протягом додаткових 10 хвилин при 40°С, додавали 2-ціанофенол (12,2 г при 97,5 мас.%, 0,1 моль). 10 хвилинами пізніше додавали DABCO (4,61 г при 97 мас.%, 0,04 моль). Суміш перемішували при 40°С (екзотермічний ефект підіймав температуру до 45°С). Реакція завершувалася повністю після 30 хвилин. Реакційну суміш нагрівали до 60°С і розбавляли ізопропілацетатом (13,7 г) і толуолом (24,5 г). Температуру підіймали до 65°С і потім додавали гарячу воду (106,2 г). Двофазну суміш перемішували при 75°С протягом 30 хвилин і потім відстоювали і розділяли. Органічна фаза (107,6 г) містила метил-(Е)-2-{2-[6-(2-ціанофенокси)піримідин-4-ілокси]феніл}-3-метоксіакрилат (36,5 мас.%), 97,5% від теорії. m) Реакція поєднання метил-(Е)-2-{2-[6хлорпіримідин-4-ілокси]феніл}-3-метоксіакрилату з 2-ціанофенолом в ізопропілацетаті з 40 моль % DABCO, доданим до 2-ціанофенолу До ізопропілацетату (20,6 г) при 40°С додавали метил-(Е)-2-{2-[6-хлорпіримідин-4-ілокси]феніл}-3-метоксіакрилат (32,8 г при 98 мас.%, 0,1 моль). Після перемішування протягом 10 хвилин додавали карбонат калію (14,1 г при 98 мас.%, 0,1 моль) разом з додатковим завантаженням ізопропілацетату (0,8 г). Після перемішування протягом додаткових 10 хвилин при 40°С, додавали DABCO (4,61 г при 97 мас.%, 0,04 моль) і потім через 10 хвилин завантажували 2-ціанофенол (12,2 г при 97,5 мас.%, 0,1 моль). Суміш перемішували при 40°С (екзотермічний ефект підіймав температуру до 45°С). Реакція завершувалася повністю після приблизно 20-30 хвилин. Додавали ізопропілацетат (13,7 г) і толуол (24,5 г) і суміш нагрівали до 60-65°С перед тим, як завантажити гарячу воду (106,2 г). Двофазну суміш перемішували при 75°С протягом 30 хвилин і потім відстоювали і розділяли. Органічна фаза (94,7 г) містила метил-(Е)-2-{2[6-(2-ціанофенокси)піримідин-4-ілокси]феніл}-3метоксіакрилат (40,2 мас.%), 94,5% від теорії. n) Реакція поєднання метил-(Е)-2-{2-[6хлорпіримідин-4-ілокси]феніл}-3-метоксіакрилату з 2-ціанофенолом в ізопропілацетаті з 40 моль % 93424 16 DABCO і надлишком розчинника, доданими до 2ціанофенолу До ізопропілацетату (20,6 г) при 40°С додавали метил-(Е)-2-{2-[6-хлорпіримідин-4-ілокси]феніл}-3-метоксіакрилат (32,8 г при 98 мас.%, 0,1 моль). Після перемішування протягом 10 хвилин додавали карбонат калію (14,1 г при 98 мас.%, 0,1 моль) разом з додатковим завантаженням ізопропілацетату (0,8 г). Після перемішування протягом додаткових 10 хвилин при 40°С додавали DABCO (4,61 г при 97 мас.%, 0,04 моль), після чого додавали ізопропілацетат (30,9 г), і потім через 10 хвилин завантажували 2-ціанофенол (12,2 г при 97,5 мас.%, 0,1 моль). Реакційну суміш витримували при 40°С протягом 105 хвилин, до цього часу ГХ аналіз показав, що залишилося 62% площі піка метил-(Е)-2-{2-[6-хлорпіримідин-4-ілокси]феніл}-3метоксіакрилату. Після перемішування при температурі навколишнього середовища протягом 16 годин і потім при 40°С протягом 105 хвилин реакцію зупиняли. Завантажували додатково карбонат калію (7,04 г при 98 мас.%, 0,05 моль) і перемішування продовжували протягом 160 хвилин з протіканням дуже малої додаткової реакції. ГХ аналіз показав, що залишилося 40% площі піка метил(Е)-2-{2-[6-хлорпіримідин-4-ілокси]феніл}-3-метоксіакрилату. о) Реакція поєднання метил-(Е)-2-{2-[6хлорпіримідин-4-ілокси]феніл}-3-метоксіакрилату з 2-ціанофенолом в циклогексаноні з 2,5 моль % DABCO, доданим після 2-ціанофенолу, але до метил-(Е)-2-{2-[6-хлорпіримідин-4-ілокси]феніл}-3метоксіакрилату Циклогексанон (198,2 г) нагрівали до 100°С при перемішуванні і додавали 2-ціанофенол (24,4 г при 97,5 мас.%, 0,2 моль). Через 10 хвилин додавали карбонат калію (70,4 г при 98 мас.%, 0,5 моль). Суміш перемішували протягом 10 хвилин, протягом яких спостерігалося спінювання і газоутворення. Потім з 10-хвилинним інтервалом додавали DABCO (0,289 г при 97 мас.%, 0,0025 моль) і метил-(Е)-2-{2-[6-хлорпіримідин-4-ілокси]феніл}-3метоксіакрилат (32,8 г при 98,0 мас.%, 0,1 моль). Реакційну суміш перемішували при 100°С протягом 80 хвилин. Температуру доводили до 80°С і додавали гарячу воду (106,2 г), підтримуючи температуру вище за 70°С. Суміш перемішували при 75°С протягом 30 хвилин і потім відстоювали і фази розділяли. Циклогексаноновий розчин (255,3 г) містив метил-(Е)-2-{2-[6-(2-ціанофенокси)піримідин-4-ілокси]феніл}-3-метоксіакрилат (15,2 мас.%), 96,3% від теорії. р) Реакція поєднання метил-(Е)-2-{2-[6хлорпіримідин-4-ілокси]феніл}-3-метоксіакрилату з 2-ціанофенолом в циклогексаноні з 2,5 моль % DABCO, доданим до 2-ціанофенолу, але після метил-(Е)-2-(2-[6-хлорпіримідин-4-ілокси]феніл}-3метоксіакрилату Циклогексанон (198,2 г) нагрівали до 100°С при перемішуванні і додавали метил-(Е)-2-{2-[6хлорпіримідин-4-ілокси]феніл}-3-метоксіакрилат (32,8 г при 98 мас.%, 0,1 моль). Після перемішування протягом 10 хвилин вводили DABCO (0,289 г при 97 мас.%, 0,0025 моль), і перемішування продовжували протягом 10 хвилин перед 17 93424 тим, як додати карбонат калію (70,4 г при 98 мас.%, 0,5 моль). Після перемішування протягом додаткових 10 хвилин при 100°С, додавали 2ціанофенол (24,4 г при 97,5 мас.%, 0,2 моль). Реакційну суміш перемішували при 100°С протягом 15 годин. Температуру доводили до 80°С і додавали гарячу воду (106,2 г), підтримуючи температуру вище за 70°С. Суміш перемішували при 75°С протягом 30 хвилин і потім відстоювали і фази розділяли. Циклогексаноновий розчин (256,5 г) містив метил-(Е)-2-{2-[6-(2-ціанофенокси)піримідин-4ілокси]феніл}-3-метоксіакрилат (11,8 мас.%), 75,1% від теорії. q) Реакція поєднання метил-(Е)-2-{2-[6хлорпіримідин-4-ілокси]феніл)-3-метоксіакрилату з 2-ціанофенолом в толуолі з 10 моль % DABCO, доданим після 2-ціанофенолу, і з DBU як основою Толуол (40,8 г) перемішували і нагрівали до 70°С. Додавали з 10-хвилинними інтервалами DABCO (0,85 г при 98 мас.%, 0,007 моль) і 2ціанофенол (9,9 г при 97,5 мас.%, 0,08 моль). Після додаткових 10 хвилин DBU (13,8 г при 98 мас.%, 0,09 моль) додавали за 5 хвилин (екзотермічне розігрівання до 74°С). Після перемішування протягом додаткових 10 хвилин додавали метил-(Е)-2-{2-[6-хлорпіримідин-4-ілокси]феніл}-3метоксіакрилат (24,2 г при 98 мас.%, 0,074 моль), і реакційну суміш перемішували при 70°С протягом 60 хвилин (реакція повністю завершувалася за 30 хвилин). Додавали гарячу (75°С) воду (78,3 г), і суміш перемішували протягом 15 хвилин при 7075°С і потім відстоювали і фази розділяли. Друге водне промивання (78,3 г) проводили таким же чином. Толуольна фаза (73,1 г) містила метил-(Е)2-{2-[6-(2-ціанофенокси)піримідин-4-ілокси]феніл}3-метоксіакрилат (38,6 мас.%), 94,7% від теорії. r) Реакція поєднання метил-(Е)-2-{2-[6хлорпіримідин-4-ілокси]феніл}-3-метоксіакрилату з 2-ціанофенолом в толуолі з 10 моль % DABCO, доданим до 2-ціанофенолу, і з DBU як основою Толуол (40,8 г) перемішували і нагрівали до 70°С. Додавали з 10-хвилинними інтервалами, підтримуючи температуру 70°С, метил-(Е)-2-{2-[6хлорпіримідин-4-ілокси]феніл}-3-метоксіакрилат (24,2 г при 98 мас.%, 0,074 моль), DABCO (0,85 г при 98 мас.%, 0,007 моль) і 2-ціанофенол (9,9 г при 97,5 мас.%, 0,08 моль). Після додаткових 10 хвилин DBU (13,8 г при 98 мас.%, 0,09 моль) додавали за 5,5 хвилини. Під час додавання температура підіймалася до 78°С, і застосовували охолоджування, щоб втримати температуру 70°С. Реакційну суміш перемішували при 70°С протягом 90 хвилин (ще 35,8% площі піка метил-(Е)-2-{2-[6 Комп’ютерна верстка Л. Ціхановська 18 хлорпіримідин-4-ілокси] феніл}-3-метоксіакрилату не провзаємодіяло по ГХ аналізу). Температуру реакції підіймали до 80°С, і перемішування продовжували ще 90 хвилин, до цього часу реакція все ще не була завершена (ще 14,2% площі піка метил-(Е)-2-{2-[6-хлорпіримідин-4-ілокси]феніл}-3метоксіакрилату не провзаємодіяло по ГХ аналізу). Температуру реакції підіймали до 100°С, і перемішування продовжували ще 60 хвилин, щоб повністю завершити реакцію. Реакційну суміш охолоджували до 70°С перед тим, як додати гарячу (75°С) воду (78,3 г). Суміш перемішували протягом 15 хвилин при 70-75°С і потім відстоювали і водну фазу відділяли. Друге водне промивання (78,3 г) проводили таким же чином. Толуольна фаза (66,6 г) містила метил-(Е)-2-{2-[6-(2-ціанофенокси)піримідин-4-ілокси]феніл}-3-метоксіакрилат (32,8 мас.%), 73,3% від теорії. З наведених вище результатів можна бачити, що у всіх випадках, коли DABCO змішують із сполукою формули (II) за відсутності 2-ціанофенолу, вихід продукту знижений і часто збільшений час реакції в порівнянні з реакцією, що проводиться при тих же умовах, але де DABCO не змішують із сполукою формули (II) за відсутності 2ціанофенолу. Порівняємо, наприклад, приклад (а) з прикладами (b), (с) і (d); приклад (f) з (e); приклади (h) і (к) з будь-яким з (g), (і) і (j); приклад (m) з (1); приклад (р) з (о) і приклад (r) з (q). Крім того, можна бачити також переваги в управлінні умовами реакції для того, щоб фізично запобігти взаємодії DABCO і сполукам формули (II). Порівняємо, наприклад, (m), в якому, хоч DABCO доданий до сполуки формули (II) за відсутності 2-ціанофенолу, він здатний лише повільно взаємодіяти із сполукою формули (II) через низьку розчинність системи, з (n), в якому розчинність була підвищена: в останньому значна частина вихідної речовини залишається такою, що не провзаємодіяла після більше 16 годин. Хоч даний винахід був описаний з посиланням на переважні здійснення і їх приклади, об'єм даного винаходу не обмежений тільки цими описаними здійсненнями. Як повинно бути ясно фахівцям, модифікації і адаптація в описаному вище винаході можуть бути зроблені без відхилення від суті і об'єму винаходу, який визначений і обмежений прикладеною формулою винаходу. Всі публікації, цитовані тут, в даний час включені посиланням у всій їх повноті для будь-яких цілей в тій же мірі, в якій кожна окрема публікація була конкретно і індивідуально позначена при введенні посиланням. Підписне Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPreparation of azoxystrobin
Автори англійськоюBeveridge Gillian, Boyd Ewan Campbell, Vass Jack Hugh, Whitton Alan John
Назва патенту російськоюСпособ получения азоксистробина
Автори російськоюБеверидж Джиллиан, Бойд Эван Кемпбелл, Bacc Джек Хью, Уиттон Алан Джон
МПК / Мітки
МПК: C07D 239/34
Мітки: спосіб, азоксистробіну, одержання
Код посилання
<a href="https://ua.patents.su/9-93424-sposib-oderzhannya-azoksistrobinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання азоксистробіну</a>
Попередній патент: Спосіб виробництва каротину кристалічного з водоростей, що вегетують у соляних озерах
Наступний патент: Похідні гідантоїну, що застосовуються як mmp інгібітори
Випадковий патент: Електродетонатор












