Полімерні кон’югати доксорубіцину з рн-регульованим вивільненням лікарського засобу та спосіб їх одержання
Формула / Реферат
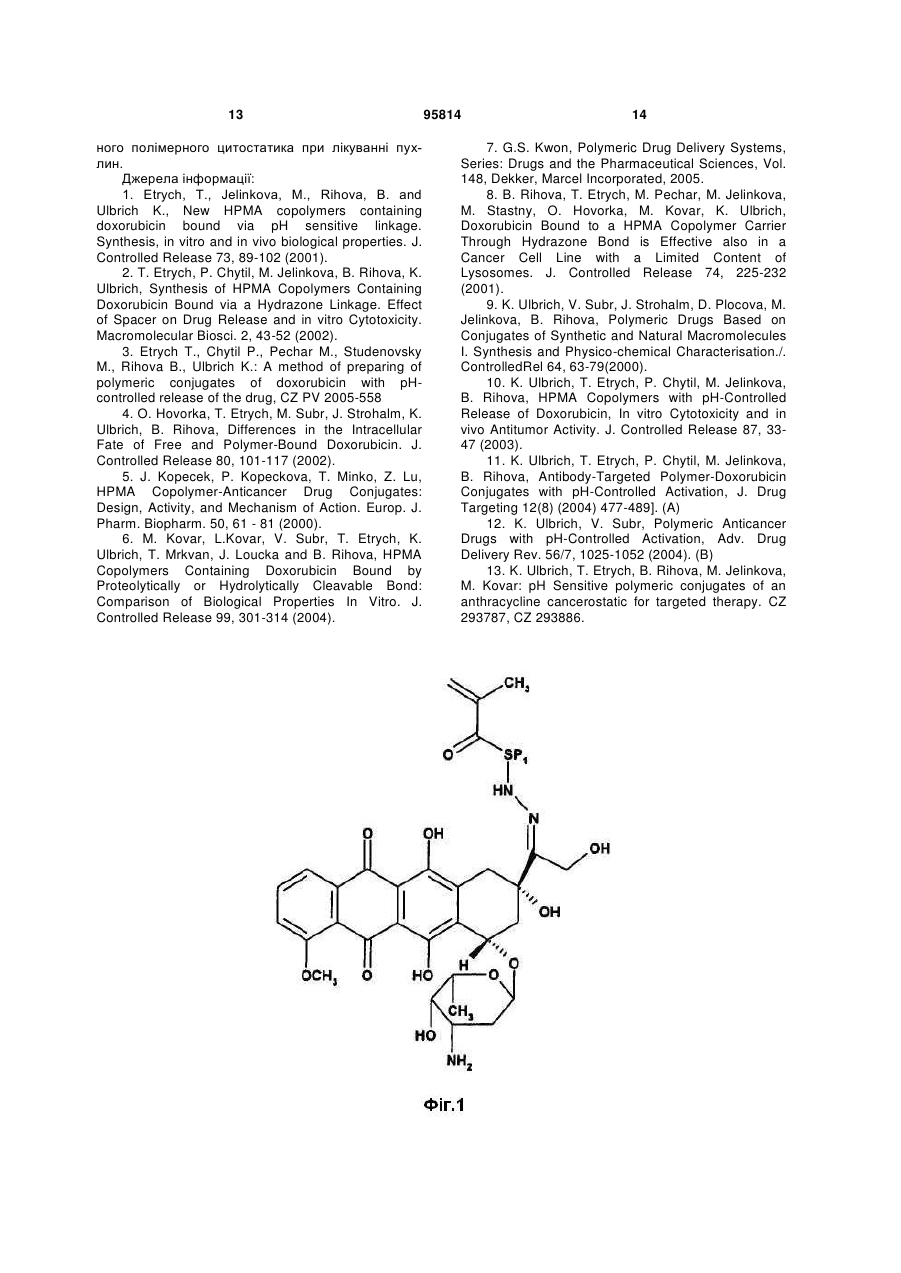
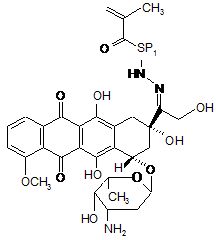
1. Полімерний лікарський засіб у формі кон'югата співполімеру N-(2-гідроксипропіл)метакриламіду ГПМА з доксорубіцином, зв'язаним з полімером за допомогою спейсерів, які містять гідролітично розщеплювані гідразонові зв'язки, формули І
 , I
, I
де SP1 являє собою спейсер аміноацилу, вибраний з гліцильної, гліцилгліцильної, β-аланільної, 6-аміногексаноїльної, 4-амінобензоїльної груп або комплексного ацилу, що походить з олігопептидів GlyPheGly, GlyLeuGly, GlyLeuPheGly або GlyPheLeuGly ,
х = від 40 до 335,
у = від 1 до 25,
що містить від 90 до 99,5 мол. % ланок ГПМА та від 10 до 0,5 мол. % доксорубіциновмісних співмономерних ланок.
2. Спосіб одержання полімерного кон'югата формули І за п. 1, який відрізняється безпосередньою співполімеризацією доксорубіциновмісного мономеру формули II
 , II
, II
де SP1 є таким, як визначено у п. 1,
з ГПМА у молярному співвідношенні від 90 до 99,5 : від 10 до 0,5.
3. Спосіб за п. 2, який відрізняється тим, що полімеризацію здійснюють в середовищі метанолу або етанолу, диметилсульфоксиду або диметилформаміду та ініціюють ініціаторами радикальної полімеризації, які здатні до розкладання під дією тепла.
4. Спосіб за п. 2 або 3, який відрізняється тим, що ініціатори радикальної полімеризації вибрані з групи, яку складають азобіс(ізобутиронітріл) АІБН, азобіс(ізоціановалеріанова кислота) АБІЦ та діізопропілперкарбонат ДІП.
5. Спосіб за п. 4, який відрізняється тим, що ініціатор вибраний з групи АІБН або АБІЦ та реакція відбувається при 50-60 °С протягом 15-24 годин.
6. Спосіб за п. 4, який відрізняється тим, що ДІП вибраний як ініціатор та реакція відбувається при 40-50 °С протягом 15-24 годин.
7. Спосіб за будь-яким з пп. 2-6, який відрізняється тим, що мономерну ланку формули II одержують реакцією гідрохлориду доксорубіцину з метакрилоїл(аміноацил)гідразинами формули MA-SP1NHNH2, де МА є метакрилоїлом та SP1 є таким, як визначено у п. 1, в органічному розчиннику у присутності оцтової кислоти.
8. Спосіб за п. 7, який відрізняється тим, що у вихідній суміші концентрація доксорубіцину вибрана в межах від 10 до 30 мг/мл та концентрація оцтової кислоти вибрана в межах від 35 до 60 мг/мл.
9. Спосіб за п. 8, який відрізняється тим, що у вихідній реакційній суміші концентрація гідрохлориду доксорубіцину становить 19 мг/мл та концентрація оцтової кислоти становить 51 мг/мл.
10. Спосіб за будь-яким з пп. 7-9, який відрізняється тим, що реакцію здійснюють при температурі 20-35 °С протягом 20-28 годин.
11. Спосіб за п. 10, який відрізняється тим, що реакцію здійснюють при 25 °С протягом 24 годин.
12. Спосіб за будь-яким з пп. 7-11, який відрізняється тим, що після завершення реакції співполімер ГПМА з метакрилоїльованим (аміноацил)гідразидом застосовують для видалення надлишкового доксорубіцину.
13. Спосіб за будь-яким з пп. 8-12, який відрізняється тим, що реакційним середовищем є органічний розчинник, вибраний з групи, яку складають метанол, зневоднений етанол, диметилсульфоксид, диметилформамід та диметилацетамід.
15. Спосіб за п. 13, який відрізняється тим, що реакційним середовищем є метанол.
Текст
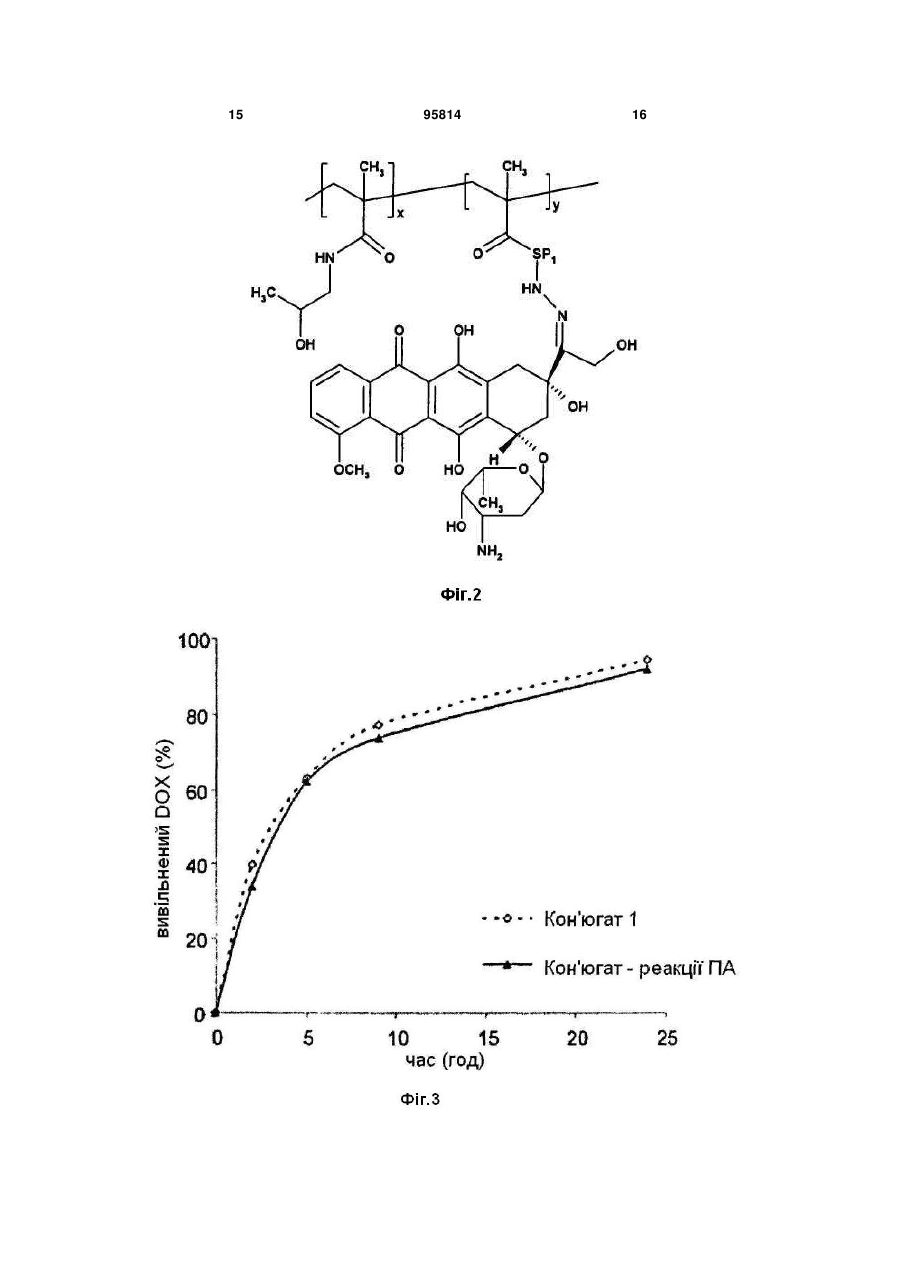
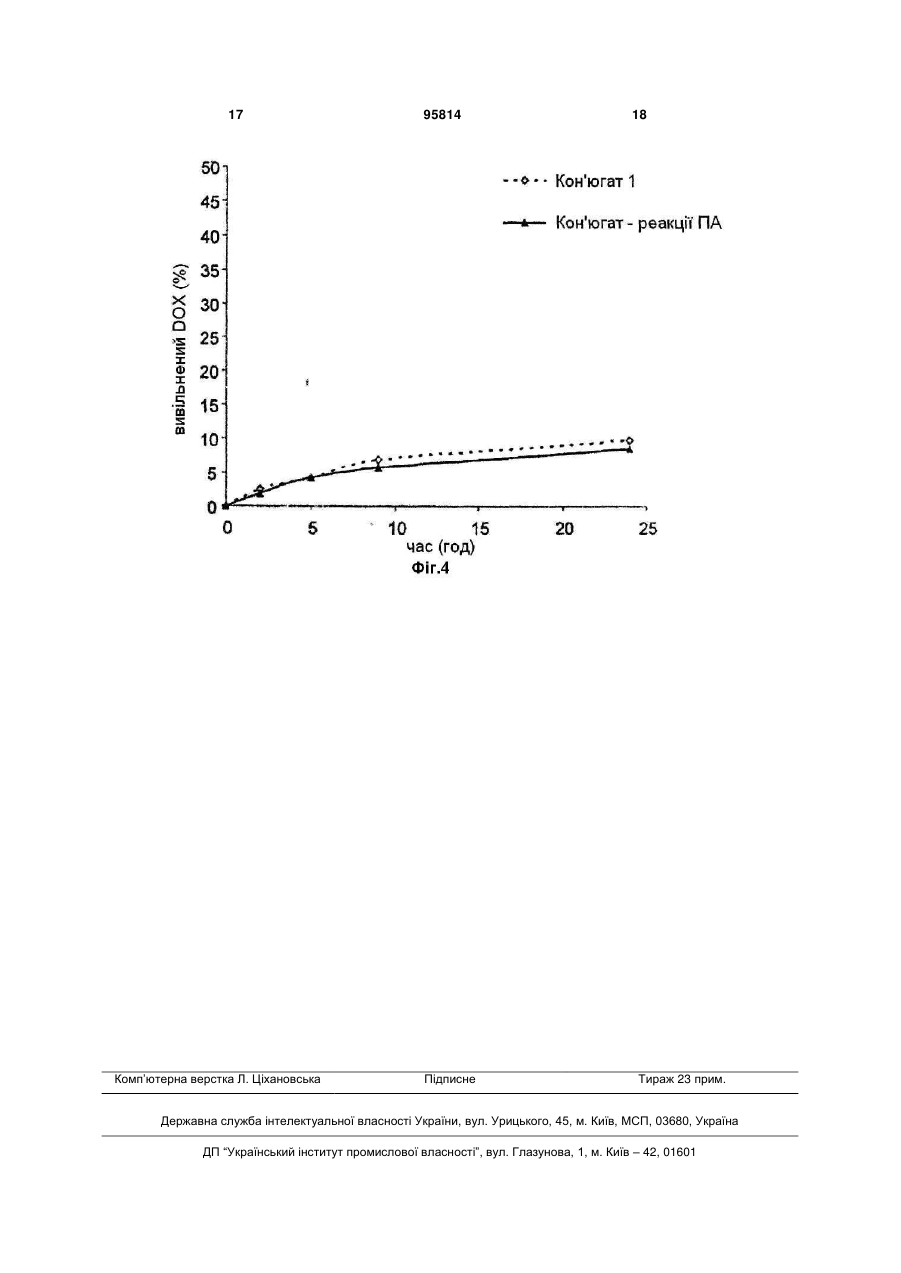
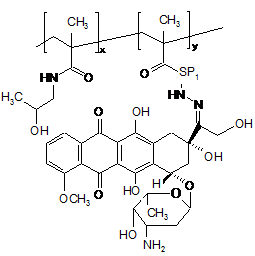
1. Полімерний лікарський засіб у формі кон'югата співполімеру N-(2-гідроксипропіл)метакриламіду ГПМА з доксорубіцином, зв'язаним з полімером за допомогою спейсерів, які містять гідролітично розщеплювані гідразонові зв'язки, формули І CH3 CH3 y x SP1 O HN OH N OH OCH3 O HO H O O C2 OH OH CH3 HO NH2 ,I де SP1 являє собою спейсер аміноацилу, вибраний з гліцильної, гліцилгліцильної, β-аланільної, 6аміногексаноїльної, 4-амінобензоїльної груп або комплексного ацилу, що походить з олігопептидів GlyPheGly, GlyLeuGly, GlyLeuPheGly або GlyPheLeuGly , х = від 40 до 335, у = від 1 до 25, що містить від 90 до 99,5 мол. % ланок ГПМА та від 10 до 0,5 мол. % доксорубіциновмісних співмономерних ланок. 2. Спосіб одержання полімерного кон'югата формули І за п. 1, який відрізняється безпосередньою співполімеризацією доксорубіциновмісного мономеру формули II 95814 O (11) H3C (13) O UA HN (19) (21) a200902032 (22) 08.08.2007 (24) 12.09.2011 (86) PCT/CZ2007/000077, 08.08.2007 (31) PV 2006-505 (32) 09.08.2006 (33) CZ (46) 12.09.2011, Бюл.№ 17, 2011 р. (72) ЕТРІХ ТОМАС, CZ, УЛЬБРІХ КАРЕЛ, CZ (73) ЗЕНТІВА, К.С., CZ (56) WO 03/053473 A, 03.07.2003 WO 2007/028347 A, 15.03.2007 ETRYCH T ET AL: "New HPMA copolymers containing doxorubicin bound via pH-sensitive linkage: synthesis and preliminary in vitro and in vivo biological properties" JOURNAL OF CONTROLLED RELEASE, ELSEVIER, AMSTERDAM, NL, vol. 73, no. 1, 18 May 2001 (2001-05-18), pages 89-102 GAO ET AL: "Colon-specific 9-aminocamptothecinHPMA copolymer conjugates containing a 1,6elimination spacer" JOURNAL OF CONTROLLED RELEASE, ELSEVIER, AMSTERDAM, NL, vol. 110, no. 2, 10 January 2006 (2006-01-10), pages 323-331 DVORAK M ET AL: "High-molecular weight HPMA copolymer-adriamycin conjugates" JOURNAL OF CONTROLLED RELEASE, ELSEVIER, AMSTERDAM, NL, vol. 60, no. 2-3, 5 August 1999 (1999-08-05), pages 321-332 TIJERINA M ET AL: "Correlation of subcellular compartmentalization of HPMA copolymer-Mce6 conjugates with chemotherapeutic activity in human ovarian carcinoma cells" PHARMACEUTICAL RESEARCH, NEW YORK, NY, US, vol. 20, no. 5, May 2003 (2003-05), pages 728-737 KOPECEK J ET AL: "HPMA copolymer-anticancer drug conjugates: design, activity, and mechanism of action" EUROPEAN JOURNAL OF PHARMACEUTICS AND BIOPHARMACEUTICS, ELSEVIER SCIENCE PUBLISHERS B.V., AMSTERDAM, NL, vol. 50, no. 1, 3 July 2000 (200007-03), pages 61-81 2 3 95814 4 , II де SP1 є таким, як визначено у п. 1, з ГПМА у молярному співвідношенні від 90 до 99,5 : від 10 до 0,5. 3. Спосіб за п. 2, який відрізняється тим, що полімеризацію здійснюють в середовищі метанолу або етанолу, диметилсульфоксиду або диметилформаміду та ініціюють ініціаторами радикальної полімеризації, які здатні до розкладання під дією тепла. 4. Спосіб за п. 2 або 3, який відрізняється тим, що ініціатори радикальної полімеризації вибрані з групи, яку складають азобіс(ізобутиронітріл) АІБН, азобіс(ізоціановалеріанова кислота) АБІЦ та діізопропілперкарбонат ДІП. 5. Спосіб за п. 4, який відрізняється тим, що ініціатор вибраний з групи АІБН або АБІЦ та реакція відбувається при 50-60 °С протягом 15-24 годин. 6. Спосіб за п. 4, який відрізняється тим, що ДІП вибраний як ініціатор та реакція відбувається при 40-50 °С протягом 15-24 годин. 7. Спосіб за будь-яким з пп. 2-6, який відрізняється тим, що мономерну ланку формули II одержують реакцією гідрохлориду доксорубіцину з метакрилоїл(аміноацил)гідразинами формули MASP1NHNH2, де МА є метакрилоїлом та SP1 є таким, як визначено у п. 1, в органічному розчиннику у присутності оцтової кислоти. 8. Спосіб за п. 7, який відрізняється тим, що у вихідній суміші концентрація доксорубіцину вибрана в межах від 10 до 30 мг/мл та концентрація оцтової кислоти вибрана в межах від 35 до 60 мг/мл. 9. Спосіб за п. 8, який відрізняється тим, що у вихідній реакційній суміші концентрація гідрохлориду доксорубіцину становить 19 мг/мл та концентрація оцтової кислоти становить 51 мг/мл. 10. Спосіб за будь-яким з пп. 7-9, який відрізняється тим, що реакцію здійснюють при температурі 20-35 °С протягом 20-28 годин. 11. Спосіб за п. 10, який відрізняється тим, що реакцію здійснюють при 25 °С протягом 24 годин. 12. Спосіб за будь-яким з пп. 7-11, який відрізняється тим, що після завершення реакції співполімер ГПМА з метакрилоїльованим (аміноацил)гідразидом застосовують для видалення надлишкового доксорубіцину. 13. Спосіб за будь-яким з пп. 8-12, який відрізняється тим, що реакційним середовищем є органічний розчинник, вибраний з групи, яку складають метанол, зневоднений етанол, диметилсульфоксид, диметилформамід та диметилацетамід. 14. Спосіб за п. 13, який відрізняється тим, що реакційним середовищем є метанол. Технічна галузь Винахід стосується нового способу одержання розчинних у воді полімерних канцеростатиків, що передбачає направлений транспорт та регульоване вивільнення цитостатиків в організмі, переважно у пухлинній тканині та пухлинних клітинах. Полімерні канцеростатики одержують безпосередньо співполімеризацією з мономером, який у своїй структурі містить канцеростатик. Застосування полімерних кон'югатів зосереджується на таргетній терапії пухлинних хвороб у людській медицині. Передумови винаходу Розвиток нових фармакологічно-сильнодіючих речовин, які включають канцеростатики, все більше і більше зосереджується на нових формах, які передбачають специфічну дію активного лікарського засобу лише у конкретній тканині або навіть у конкретному типі клітин. Таргетні лікарські засоби знаходять своє застосування особливо в таких галузях, в яких побічні ефекти активного інгредієнта можуть призвести до пошкодження здорових частин організму. Одержання таргетних лікарських засобів призводить до все більшого застосування макромолекул - полімерів, як натуральних, так і синтетичних. У минулому була одержана та дослі джена значна кількість полімерних кон'югатів канцеростатиків, та було показано, що у багатьох випадках для досягнення фармакологічної ефективності полімерної форми лікарського засобу необхідно забезпечити вивільнення вихідної низькомолекулярної цитотоксичної речовини з її полімерної форми. Звичайно, зв'язок цитостатика з розчинним у воді полімером за допомогою хімічного зв'язку також передбачає радикальне підвищення розчинності нерозчинних або слабо розчинних лікарських засобів та суттєве зменшення їх токсичності. Врешті-решт, але що є не менш важливим, вища молекулярна вага полімерів попереджує швидке вивільнення лікарського засобу з організму за допомогою клубочкової фільтрації та, таким чином, забезпечує тривалий час його циркуляції у крові та утримування в організмі, та, внаслідок цього, забезпечує вищу біологічну доступність лікарського засобу. Сприятливим є забезпечення вивільнення цитостатика з полімерного носія за допомогою здатного до біорозкладання спейсера, який застосований для з'єднання лікарського засобу з полімером, деградація якого в тканині-мішені призводить до направленого та регульованого вивільнення лікарського засобу у CH3 SP1 O HN O N OH OH OH OCH3 O HO H O O CH3 HO NH2 5 тканині. Важливою групою вищеописаних лікарських засобів є полімерні лікарські засоби, одержані на основі співполімерів N-(2гідроксипропіл)метакриламіду (ГПМА). Огляд одержаних до цього часу результатів у цій галузі дуже добре представлений в роботах G.S. Kwon та в роботах J. Коресек та ін. [Kopecek et al. 2000, Kwon 2005]. Нещодавно були опубліковані дослідження по одержанню та використанню полімерних лікарських засобів, в яких канцеростатик доксорубіцин зв'язаний з полімерним носієм на основі співполімерів ГПМА через гідролітично-нестабільний гідразонний зв'язок [Etrych et al. 2001 and 2002, Rihova et al. 2001, Ulbrich et al. 2003, 2004a, 2004b] та речовини були запатентовані [Ulbrich et al.]. Описані лікарські засоби демонстрували суттєве зменшення побічних ефектів на організм, особливо токсичних побічних ефектів, та одночасно значне збільшення протипухлинної ефективності в порівнянні з низькомолекулярними цитостатиками, які широко застосовуються [Rihova et al. 2001, Kovar et al. 2004, Hovorka et al. 2002]. Синтез таких кон'югатів спочатку здійснювали шляхом реакції полімер-аналогічних перетворень полімерних естерів 4-нітрофенілу (ONp) з гідразином з наступною співполімеризацією ГПМА з метакрилоїльованими гідразидами, захищеними N-Boc (тpeт-бутилоксикарбонільною) групою. Пізніше був розроблений новий спосіб одержання полімерних кон'югатів, який включав одержання 6(метакрилоїламіно)гексаноілгідразинового мономеру та його співполімеризацію з ГПМА. Спосіб демонстрував суттєвий прогрес у синтезі та давав можливість точно регулювати молекулярну вагу полімерних прекурсорів та кінцевого продукту [Etrych patent]. У всіх згаданих способах лікарську речовину з'єднували з полімерним прекурсором, який містить групи вільного гідразиду шляхом реакції полімер-аналогічних перетворень. Об'єктом даного винаходу є новий спосіб одержання полімерних цитостатиків на основі співполімерів ГПМА з доксорубіцином, зв'язаним шляхом рН-лабільного гідразонового зв'язку з полімерним носієм. Спосіб, який ми пропонуємо, дозволяє введення лікарської речовини у структуру полімерного кон'югата безпосередньо шляхом співполімеризації ГПМА з мономером, який містить доксорубіцин, з'єднаний зі здатною до полімеризації групою гідразоновим зв'язком за допомогою спейсера, тобто, без необхідності в подальшій реакції зв'язування спейсера лікарської речовини з полімерним прекурсором. Застосування згаданого мономеру у синтезі дозволяє одержати полімерні кон'югати з точно визначеною структурою полімерного ланцюга, який містить лише мономерні ланки ГПМА та мономерні ланки, які містять лікарську речовину зв'язаного гідразону. Розкриття винаходу Винахід переважно включає спосіб одержання полімерного кон'югата співполімера ГПМА з доксорубіцином, зв'язаним з полімером за допомогою різних спейсерів, які містять гідролітичнорозщеплювані гідразонові зв'язки. Спосіб полягає в двоетапному синтезі, який включає синтез мономерів, а саме: ГПМА та метакрилоїльованих 95814 6 похідних амінокислот та олігопептидів, термінованих доксорубіцином, зв'язаним через гідразоновий зв'язок, та безпосередній синтез полімерних кон'югатів співполімеризацією з вказаним мономером, який містить канцеростатик доксорубіцин, зв'язаний ковалентним гідразоновим зв'язком. Полімерний лікарський засіб, одержаний згідно з винаходом, характеризується тим, що його структура складається з гідрофільного розчинного у воді співполімера, який містить ланки ГПМА та ланки метакрилоїльованих похідних амінокислот або олігопептидів, термінованих доксорубіцином, зв'язаним з залишками (спейсерами) амінокислоти або олігопептиду за допомогою рН-чутливого гідролітично-розщеплюваного гідразонового зв'язку. Спейсери можуть складатись з індивідуальних амінокислот, олігопептидів або інших структур, дозволяючи їх термінування гідразидною групою та з'єднання доксорубіцину тим самим гідразоновим зв'язком. Вміст співмономерних (Dox- вмісних) ланок у співполімері може бути від 0,5 до 10 мол.%. Співполімер не містить будь-яких інших недостатньо визначених ланок, наприклад, метакрилоїльованих гідразидів. Полімер з хімічно-зв'язаним цитостатиком є стабільним під час циркуляції у кровотоці, гідразоновий зв'язок між доксорубіцином та полімером є порівняно стабільним при фізіологічних умовах кровотоку (рН 7,4). Після екстравазації та утримування у пухлинах, молекулярно-розчинений кон'югат проникає в окремі клітини пухлини внаслідок піноцитозу, та завдяки зменшенню рН від позаклітинного рН 7,4 до внутрішньоклітинного рН 5 - 6 гідролізу гідразонового зв'язку, відбувається вивільнення цитостатика у клітині-мішені та, таким чином, відбувається активація його цитотоксичного ефекту. Можливість реалізації вищевказаного запропонованого механізму дії полімерного лікарського засобу згідно з винаходом показана шляхом експериментів змодельованого вивільнення доксорубіцину з полімерного носія. Результати вказаних досліджень подані в експериментальній частині заявки. Синтез мономерів починається з синтезу мономеру ГПМА за допомогою способу, описаного раніше [Ulbrich 2000]. Синтез метакрилоїл(аміноацил)гідразидів, які відрізняються за структурою від ацильної складової, є дуже схожим на синтез всіх одержаних мономерів та здійснюється за допомогою методики, описаної раніше [Ulbrich patents, Etrych patent]. Цей синтез починається з метакрилоїлювання метилового естеру гідрохлориду відповідної амінокислоти або олігопептиду з метакрилоїлхлоридом, представленим у дихлорметані у присутності безводного карбонату натрію. Одержаний продукт перетворювали на метакрилоїльований аміноацилгідразин шляхом гідразинолізу відповідного метилового естера з гідразингідратом, який здійснюють у розчині метанолу або 2пропанолу. Аміноацил у метакрилоїл(аміноацил)гідразинах переважно може бути гліцилом, гліцилгліцилом, -аланілом, 6аміногексаноїлом, 4-амінобензоїлом або комплексним ацилом, що походить з олігопептидів GlyPheGly, GlyLeuGly або GlyPheLeuGly. Як прик 7 лад синтезу метакрилоїл(аміноацил)гідразину, у Прикладі 1 показаний синтез 6метакроїл(аміногексаноїл)гідразиду. Одержання (метакрилоїламіно)ацилгідразиддоксорубіцинів починається з реакції зв'язування гідрохлориду доксорубіцину з метакрилоїл(аміноацил)гідразинами з утворенням гідразонового зв'язку. Реакцію переважно здійснюють у метанолі в умовах каталізу з визначеною кількістю оцтової кислоти з додаванням інгібітора. Реакцію також можна здійснювати у диметилсульфоксиді, диметилформаміді, сухому етанолі або диметилацетаміді. Якщо застосовано розчинники інші, ніж метанол, реакція проходить добре, але результати нижчі. Вплив структури спейсера на перебіг реакції зв'язування є мінімальним. Для досягнення оптимального результату зв'язування та мінімального вмісту незв'язаного доксорубіцину, у будь-якому випадку важливим є дотримання концентрацій реагентів та оцтової кислоти у реакційній суміші: концентрація доксорубіцину (DOX) 19 мг/мл, концентрацію оцтової кислоти 51 мг/мл. Оптимальним часом реакції є 24 год при 25 °С. Вищевказані умови є оптимальними і надають максимальний результат. Реакцію також можна провести при дещо змінених реакційних умовах, пристосованих до типу використовуваного розчинника, а також до (метакрилоїламіно)ацилгідразиду. Якщо застосувати нижчу концентрацію DOX (10 мг/мл), реакцію необхідно проводити при вищій температурі (до 35 °С), концентрацію оцтової кислоти можна зменшити до 35 мг/мл, або, як варіант, можна подовжити час реакції (до 28 годин). При вищій концентрації DOX (30 мг/мл), бажано збільшити концентрацію оцтової кислоти до максимальної 60 мг/мл та зменшити час реакції до 20 годин, або, як варіант, зменшити температуру до 20 °С. Для видалення вільної лікарської речовини з продукту переважно можна застосувати додавання невеликої кількості полі(ГПМА-спів-МА-АН-NНNН2) полімеру, гідразинові групи якого будуть зв'язувати доксорубіцин (DOX), який не прореагував. Реакційну суміш далі очищували гель-фільтрацією, переважно на колонці LH-20 у метанолі. Після концентрування фракцію мономерної похідної DOX виділяють шляхом осадження у діетиловому етері. Одержання 6(метакрилоїламіно)гексаноїлгідразиддоксорубіцину та метакроїлгліцилфенілаланіллейцилгліцилгідразиддоксорубіцину представлене у вигляді прикладів синтезу (метакрилоїламіно)ацилгідразиддоксорубіцинів в експериментальній частині. Синтез полімерних кон'югатів доксорубіцину співполімерів ГПМА з метакрилоїльованими похідними амінокислот або олігопептидів, термінованих доксорубіцином, з'єднаним гідразоновим зв'язком, 95814 8 базується на безпосередній радикальній співполімеризації ГПМА з відповідними метакрилоїльованими похідними DOX формули II Полімеризацію здійснюють у розчині, застосовуючи метанол, етанол, диметилсульфоксид або диметилформамід як полімеризаційне середовище. Полімеризацію ініціюють ініціаторами радикальної полімеризації, що розкладаються під дією тепла, на основі азо- або перокси-ініціаторів. Можуть бути переважно застосовані азобіс(ізобутиронітріл) (АІБН), азобіс(ізоціановалеріанова кислота) (АБІЦ) або діізопропілперкарбонат (ДІП). Температура полімеризації залежить від відповідного застосованого ініціатора та розчинника (50 - 60 °С для АІБН, АБІЦ у метанолі, етанолі, ДМФ та ДМСО, 40 50 °С для ДІП). Звичайний час полімеризації складає 15-24 години. Одержання всіх полімерних кон'югатів шляхом радикальної полімеризації є аналогічним; наприклад, співполімеризація ГПМА з метакрилоїльованою похідною DOX показана у Прикладі 3. В порівнянні з застосованою раніше зв'язувальною реакцією полімер-аналогічних перетворень DOX з полімерним прекурсором полі(ГПМА-спів-МА-АН-МНМН2), безпосередня співполімеризація ГПМА з метакрилоїльованою похідною DOX приводить до точно визначених полімерних кон'югатів. Полімерний кон'югат є співполімером ГПМА з метакрилоїльованими похідними амінокислот або олігопептидів, термінованих доксорубіцином, зв'язаним гідразоновим зв'язком, формули І, 9 який характеризується тим, що містить 90 99,5 мол. % ГПМА та 10 - 0,5 мол. % ланок (метакрилоїламіно)ацилгідразид-доксорубіцину. Тут було введено скорочення для спейсерів у бічних ланцюгах кон'югатів та мономерів у структурних схемах: SP1 - це аміноацил у метакрилоїлацилгідразид-доксорубіцинах, наприклад, гліцил, гліцилгліцил, -аланіл, 6-аміногексаноїл (АГ), 4амінобензоїл або комплексний ацил, одержаний з олігопептидів GlyPheGly, GlyLeuGly, GlyLeuPheGly та GlyPheLeuGly. Короткий опис креслень Фігура 1 показує схему структури метакрилоїльованих похідних амінокислот або олігопептидів, термінованих доксорубіцином, зв'язаним гідразоновим зв'язком ((метакрилоїламіно)-ацилгідразиддоксорубіцин)). Фігура 2 показує схему структури кон'югата 1 співполімера ГПМА та метакрилоїльованої похідної амінокислот та олігопептидів, термінованих доксорубіцином, зв'язаним гідразоновим зв'язком (х = від 40 до 335, у = від 1 до 25). Фігура 3 показує графік швидкості вивільнення DOX з полімерного кон'югата 1 та з полімерного кон'югата, одержаного шляхом реакції полімераналогічних перетворень (patent Etrych) у буфері з рН 5 (модель внутрішньоклітинного середовища). Фігура 4 показує графік швидкості вивільнення DOX з полімерного кон'югата 1 та з полімерного кон'югата, одержаного шляхом реакції полімераналогічних перетворень (patent Etrych) у буфері з рН 7,4 (модель кровотоку). Приклади Приклад 1: Синтез мономерів ГПМА одержували згідно з методикою, описаною раніше [Ulbrich et al. 2000]. Елементний аналіз: розраховано 58,8 % С, 9,16 % Н, 9,79 % N; отримано 58,98 % С, 9,18 % Н, 9,82 % N. Продукт був хроматографічно чистим. 1 6-(метакрилоїламіно)гексаноїлгідразид (N -(6гідразино-6-оксогексил)-2 95814 10 метилакриламід) (MA-AH-NHNH2) одержували згідно з методикою, описаною раніше [Ulbrich patents, Etrych patent]. Метакроїлгліцилфенілаланіллейцилгліцилгідразид (MA-Gly-D,L-PheLeuGlyNHNH2) одержували згідно з методикою, описаною раніше [Etrych patent]. 6-(Метакрилоїламіно)гексаноїлгідразиддоксорубіцин (MA-AH-NHN=DOX) 6(Метакрилоїламіно)гексаноїлгідразид (40 мг, 0,188 мкмоль) розчинили у 6 мл метанолу при кімнатній температурі. Розчин вилили у реакційну посудину, в яку помістили доксорубіцин.НСІ (115 мг, 0,198 мкмоль) та суспензію енергійно перемішали. До суспензії додали 310 мкл оцтової кислоти та реакційну суміш перемішували при 25 °С протягом 24 годин. За реакційним процесом слідкували за допомогою ТШХ - на пластинках Silicagel 60 F254 (метанол:хлороформ:оцтова кислота 2:8:1, Rf(DOX) = 0,75, Rf(MA-AH-NHN=DOX)= 0,9). В процесі реакції суспензія була поступово розчинена та розчин був гомогенним через 20 годин протікання реакції. Через 24 години до гомогенної суміші додали 100 мг співполімеру полі(ГПМА-спів-МА-АН-NHNН2) (для зв'язування залишкового вільного DOX) та реакційну суміш перемішували при кімнатній температурі протягом ще 4 годин. Продукт очистили від полімерних та низькомолекулярних домішок за допомогою гельхроматографії на колонці (30 см × 30 см), наповненій Sephadex LH-20 у метанолі. Низькомолекулярну фракцію концентрували до 2 мл та продукт осадили у 30 мл діетилового етеру. Продукт відсмоктали, промили невеликою кількістю діетилового етеру та висушили у вакуумі до досягнення постійної ваги. Вихід становив 110 мг продукту (79 %) з температурою плавлення від 172 до 175 °С. ТШХ (метанол:хлороформ:оцтова кислота 2:8:1): одна пляма з Rf= 0,9. MALDI-TOF МС: 762 (M+Na). Метакроїлгліцилфенілаланіллейцилгліцилгідразид-доксорубіцин (MA-GFLG-NHN=DOX) Одержання MA-GFLG-NHN=DOX здійснювали при таких же умовах, як і у випадку МА-AHNHN=DOX. Метакроїлгліцилфенілаланіллейцилгліцилгідразид (122 мг, 0,258 мкмоль) розчинили у 8,2 мл метанолу при кімнатній температурі. Розчин вилили у реакційну посудину, в яку помістили доксорубіцин. НСІ (157 мг, 0,271 мкмоль) та суспензію енергійно перемішали. До суспензії додали 420 мкл оцтової кислоти та реакційну суміш перемішували при 25 °С протягом 24 годин. За реакційним процесом слідкували за допомогою ТШХ - на пластинках Silicagel 60 F254 (метанол:хлороформ:оцтова кислота 2:8:1, Rf(DOX)= 0,75, Rf(MA-GFLG-NHN=DOX)=0,95). В процесі реакції суспензія була поступово розчинена та розчин був гомогенним після 19 годин протікання реакції. Через 24 години до гомогенної суміші додали 130 мг співполімеру полі(ГПМА-співМА-АН-NHNН2) (для зв'язування залишкового вільного DOX) та реакційну суміш перемішували при кімнатній температурі протягом ще 4 годин. Продукт очистили від полімерних та низькомолекулярних домішок за допомогою гель-хроматографії на колонці (30 см × 30 см) наповненій Sephadex LH 11 20 у метанолі. Низькомолекулярну фракцію концентрували до 2,5 мл та продукт осадили у 40 мл діетилового етеру. Продукт відсмоктали, промили невеликою кількістю діетилового етеру та висушили у вакуумі до досягнення постійної ваги. Вихід становив 210 мг продукту (78 %) з температурою плавлення від 179 до 182 °С. ТШХ (метанол:хлороформ:оцтова кислота 2:8:1): одна пляма з Rf=0,95. MALDI-TOF MC: 1023 (M+Na). Приклад 2: Синтез полімерного кон'югата Кон'югат 1 - співполімер ГПМА з МА-AH-NHN=DOX Полі(ГПMA-спів-MA-AH-NHN=DOX)] співполімер одержували радикальною співполімеризацією в розчині сполук ГПМА та MA-AH-NHN=DOX у метанолі при 60 °С. 840 мг ГПМА та 165 мг MA-AH-NHN=DOX (18 ваг. % мономерів) розчинили у 5,7 мл метанолу та до розчину додали 67 мг АБІН (1,2 ваг. %). Після фільтрації полімеризаційною сумішшю наповнили, в атмосфері аргону, полімеризаційний реактор (об'ємом 20 мл), розташований у термостаті. Над поверхнею протягом декількох додаткових хвилин вводили азот. Температуру полімеризаційної суміші встановили на 60 °С та полімеризація проходила при перемішуванні (50 об/хв) в атмосфері азоту. Полімеризаційну суміш вивантажили з термостату через 22 години, охолодили до кімнатної температури у бані, та полімер виділили шляхом осадження етилацетатом (загально 100 мл). Осаджений полімер виділили шляхом фільтрації через пористий скляний фільтр S4. Осад промили етилацетатом та сушили при кімнатній температурі у вакуумі у мембранному насосі протягом 1 години. Полімерний продукт очистили від низькомолекулярних домішок та незв'язаної лікарської речовини за допомогою гельхроматографії на колонці, наповненій Sephadex LH-20 у метанолі. Полімерну фракцію виділили, концентрували у вакуумному ротаційному випарнику до об'єму 5 мл, та співполімер виділили шляхом осадження з 50 мл етилацетату. Продукт сушили до досягнення постійної ваги. Загальний вміст DOX визначили спектрально. Mw та Mn визначили рідинною хроматографією (LC АКТА) з виявленням на основі дисперсії світла (DAWN DSP Multiangel detector, Wyatt). Характеристика полімерної лікарської речовини: вихід реакції полімеризації: 750 мг (75 %), загальний вміст DOX 10,8 ваг. %, вміст вільного DOX 0,35 % від загального вмісту DOX, молекулярна вага Mw =34000, коефіцієнтполідисперстності Mw / Mn =1,72. Приклад 3: Синтез полімерного кон'югата Кон'югат 2 - співполімер ГПМА з МА-AH-NHN=DOX Полі(ГПMA-спів-MA-AH-NHN=DOX)] співполімер одержували радикальною співполімеризацією в розчині сполук ГПМА та MA-AH-NHN=DOX у метанолі при 60 °С таким же способом, як і у Прикладі 2, з різницею, що композиція полімеризаційної суміші була наступною: 770 мг ГПМА, 235 мг MA-AH-NHN=DOX, 5,7 мл метанолу, 67 мг АБІН (1,2 ваг. %). Виділення та осадження продукту здійснювали таким же способом, як і у Прикладі 2. 95814 12 Характеристика полімерної лікарської речовини: вихід реакції полімеризації: 740 мг (74 %), загальний вміст DOX 16,5 ваг. %, вміст вільного DOX 0,45 % від загального вмісту DOX, молекулярна вага Mw =32800, коефіцієнт полідисперстності Mw / Mn =1,78. Приклад 4: Синтез полімерного кон'югата Кон'югат 3 - співполімер ГПМА з МА-GFLGNHN=DOX Полі(ГПMA-спів-MA-GFLG-NHN=DOX) співполімер одержували радикальною співполімеризацією в розчині сполук ГПМА та MA-GFLG-NHN=DOX у метанолі при 60 °С таким же способом, як і у Прикладі 2, з різницею, що композиція полімеризаційної суміші була наступною: 700 мг ГПМА, 183 мг MA-GFLG-NHN=DOX, 5 мл метанолу, 64 мг АБІН (1,3 ваг. %). Виділення та осадження продукту здійснювали таким же способом, як і у Прикладі 2. Характеристика полімерної лікарської речовини: вихід реакції полімеризації: 670 мг (76 %), загальний вміст DOX 10,5 ваг. %, вміст вільного DOX 0,32% від загального вмісту DOX, молекулярна вага Mw =34800, коефіцієнт полідисперстності Mw / Mn =1,82. Приклад 5: Вивільнення доксорубіцину з прищепних полімерних кон'югатів Виміряли кількість доксорубіцину, вивільненого з полімерних кон'югатів після їх інкубування в фосфатному буфері з рН 5,0 (0,1 М фосфатний буфер містить 0,05 М NaCI), що моделює внутрішньоклітинне середовище, та у фосфатному буфері з рН 7,4, що моделює середовище кровотоку. Кількість вивільненого DOX в інкубаційному розчині визначили за допомогою ВЕРХ (Shimadzu). В попередньо визначених інтервалах відібрали 50 мкл інкубаційного розчину та проаналізували на колонці TSKGel G 3000хІ, ізократичний потік 0,5 мл/хв рухомої фази включав суміш метанол:ацетатний буфер рН 6,5 (80 : 20 об. %). Кількість DOX розрахували з площі піків вільного та зв'язаного DOX (UV-VIS визначення при 488 нм). Після інкубування кон'югатів (концентрації 5 мг/мл) у фізіологічному середовищі при 36 °С (фосфатний буфер, рН 7,4), вивільнилась лише невелика кількість лікарської речовини (до 10%/24год) (Фігура 4); і навпаки, швидкість вивільнення DOX з прищепних полімерних кон'югатів, та, таким чином, швидкість активації цитотоксичної лікарської речовини, є високою у злегка кислому середовищі при рН 5,0 (Фігура 3). Швидкості вивільнення лікарських речовин при рН 7,4 та рН 5 з полімерних кон'югатів, одержаних безпосередньою співполімеризацією із застосуванням 6-(метакрилоїламіно)ацилгідразиддоксорубіцинів, є повністю порівняними з тими, які визначені для гідразонових кон'югатів, одержаних шляхом реакції полімер-аналогічних перетворень (ПА реакція) [Etrych patent]. Результати вимірювань швидкості вивільнення активної лікарської речовини in vitro з полімерного носія в середовищі, яке моделює кров'яне середовище (при переносі лікарської речовини через організм), та у внутрішньоклітинному середовищі клітини-мішені, підтверджують придатність застосування запропонова 13 ного полімерного цитостатика при лікуванні пухлин. Джерела інформації: 1. Etrych, T., Jelinkova, M., Rihova, В. and Ulbrich K., New HPMA copolymers containing doxorubicin bound via pH sensitive linkage. Synthesis, in vitro and in vivo biological properties. J. Controlled Release 73, 89-102 (2001). 2. T. Etrych, P. Chytil, M. Jelinkova, B. Rihova, K. Ulbrich, Synthesis of HPMA Copolymers Containing Doxorubicin Bound via a Hydrazone Linkage. Effect of Spacer on Drug Release and in vitro Cytotoxicity. Macromolecular Biosci. 2, 43-52 (2002). 3. Etrych T., Chytil P., Pechar M., Studenovsky M., Rihova B., Ulbrich K.: A method of preparing of polymeric conjugates of doxorubicin with pHcontrolled release of the drug, CZ PV 2005-558 4. O. Hovorka, T. Etrych, M. Subr, J. Strohalm, K. Ulbrich, B. Rihova, Differences in the Intracellular Fate of Free and Polymer-Bound Doxorubicin. J. Controlled Release 80, 101-117 (2002). 5. J. Kopecek, P. Kopeckova, T. Minko, Z. Lu, HPMA Copolymer-Anticancer Drug Conjugates: Design, Activity, and Mechanism of Action. Europ. J. Pharm. Biopharm. 50, 61 - 81 (2000). 6. M. Kovar, L.Kovar, V. Subr, T. Etrych, K. Ulbrich, T. Mrkvan, J. Loucka and B. Rihova, HPMA Copolymers Containing Doxorubicin Bound by Proteolytically or Hydrolytically Cleavable Bond: Comparison of Biological Properties In Vitro. J. Controlled Release 99, 301-314 (2004). 95814 14 7. G.S. Kwon, Polymeric Drug Delivery Systems, Series: Drugs and the Pharmaceutical Sciences, Vol. 148, Dekker, Marcel Incorporated, 2005. 8. B. Rihova, T. Etrych, M. Pechar, M. Jelinkova, M. Stastny, O. Hovorka, M. Kovar, K. Ulbrich, Doxorubicin Bound to a HPMA Copolymer Carrier Through Hydrazone Bond is Effective also in a Cancer Cell Line with a Limited Content of Lysosomes. J. Controlled Release 74, 225-232 (2001). 9. K. Ulbrich, V. Subr, J. Strohalm, D. Plocova, M. Jelinkova, B. Rihova, Polymeric Drugs Based on Conjugates of Synthetic and Natural Macromolecules I. Synthesis and Physico-chemical Characterisation./. ControlledRel 64, 63-79(2000). 10. K. Ulbrich, T. Etrych, P. Chytil, M. Jelinkova, B. Rihova, HPMA Copolymers with pH-Controlled Release of Doxorubicin, In vitro Cytotoxicity and in vivo Antitumor Activity. J. Controlled Release 87, 3347 (2003). 11. K. Ulbrich, T. Etrych, P. Chytil, M. Jelinkova, B. Rihova, Antibody-Targeted Polymer-Doxorubicin Conjugates with pH-Controlled Activation, J. Drug Targeting 12(8) (2004) 477-489]. (A) 12. K. Ulbrich, V. Subr, Polymeric Anticancer Drugs with pH-Controlled Activation, Adv. Drug Delivery Rev. 56/7, 1025-1052 (2004). (B) 13. K. Ulbrich, T. Etrych, B. Rihova, M. Jelinkova, M. Kovar: pH Sensitive polymeric conjugates of an anthracycline cancerostatic for targeted therapy. CZ 293787, CZ 293886. 15 95814 16 17 Комп’ютерна верстка Л. Ціхановська 95814 Підписне 18 Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPolymeric conjugates of doxorubicin with ph-regulated release of the drug and a method of preparing
Автори англійськоюEtrych Tomas, Ulbrich Karel
Назва патенту російськоюПолимерные коньюгаты доксорубицина с рн-регулированным высвобождением лекарственного средства и способ их получения
Автори російськоюЭтрих Томас, Ульбрих Карел
МПК / Мітки
МПК: A61K 47/48, A61K 31/704, A61P 35/00
Мітки: полімерні, доксорубіцину, вивільненням, спосіб, одержання, рн-регульованим, кон'югати, засобу, лікарського
Код посилання
<a href="https://ua.patents.su/9-95814-polimerni-konyugati-doksorubicinu-z-rn-regulovanim-vivilnennyam-likarskogo-zasobu-ta-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Полімерні кон’югати доксорубіцину з рн-регульованим вивільненням лікарського засобу та спосіб їх одержання</a>
Попередній патент: Система та спосіб виявлення перегріву
Наступний патент: Сполуки бензоїламіногетероциклілу як активатори глюкокінази
Випадковий патент: Насосна установка