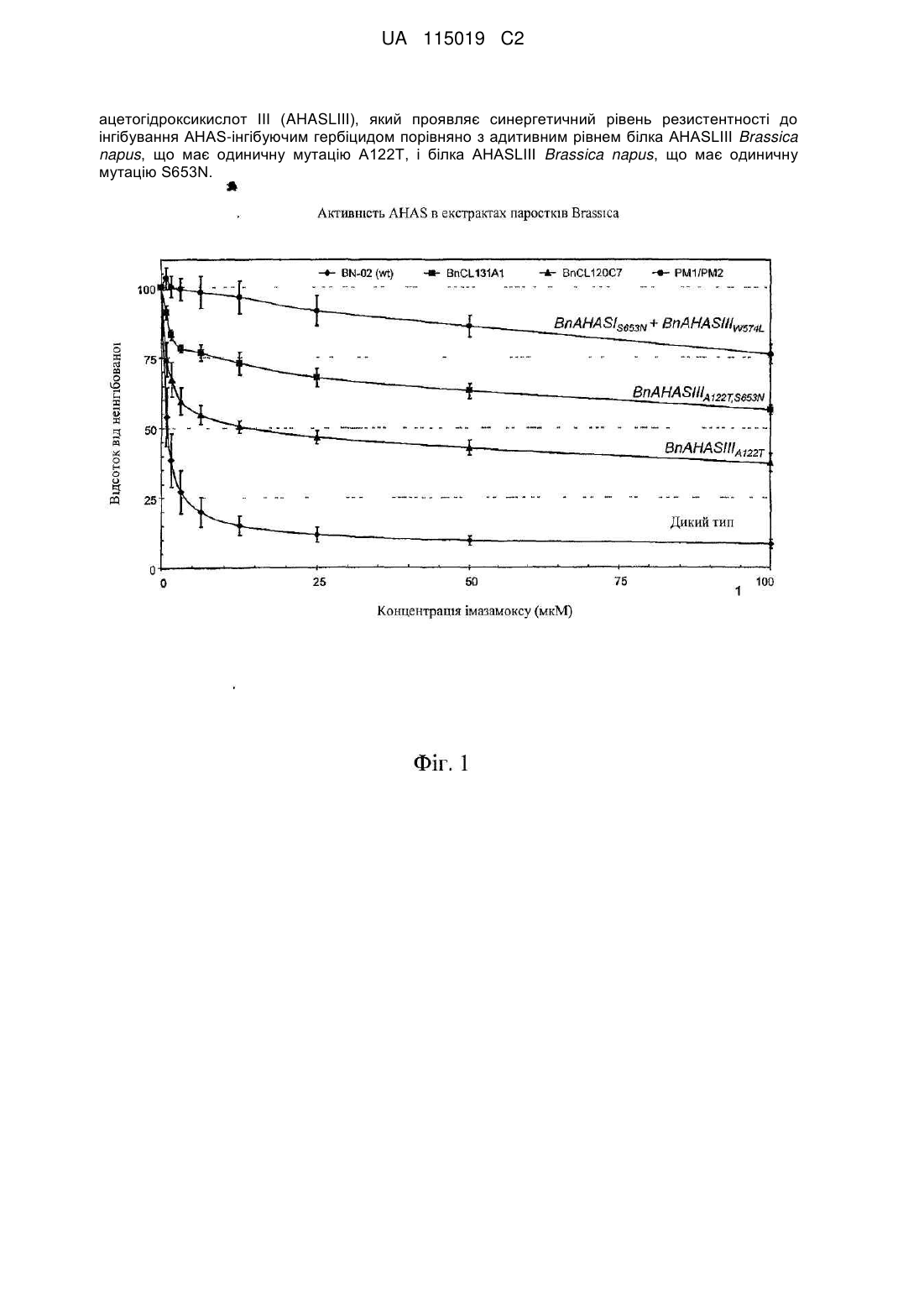
Стійкий до гербіцидів aнas-мутант рослини brassica
Номер патенту: 115019
Опубліковано: 11.09.2017
Автори: Уолкер Кіт, Карлсон Дейл, Гоукал Грег, Шопке Крістіан, Пірс Джеймс, Бітхем Пітер, Мак Елвер Джон, Сінгх Біджай
Формула / Реферат
1. Ізольована, рекомбінантна, піддана мутагенезу або синтетична молекула нуклеїнової кислоти, яка кодує білок великої субодиниці синтази ацетогідроксикислот III (AHASLIII) Brassica napus, що має амінокислотну послідовність SEQ ID NO: 21, де вказаний білок AHASLIII містить заміну аланіну на треонін в положенні, відповідному положенню A122 послідовності SEQ ID NO: 23, і заміну серину на аспарагін в положенні, що відповідає положенню S653 послідовності SEQ ID NO: 23, де вказаний білок AHASLIII є резистентним до інгібування інгібуючим синтазу ацетогідроксикислот (AHAS) гербіцидом, та де кодований білок AHASLIII проявляє синергетичний рівень резистентності до інгібування AHAS-інгібуючим гербіцидом порівняно з адитивним рівнем білка AHASLIII Brassica napus, що має одиничну мутацію А122Т, і білка AHASLIII Brassica napus, що має одиничну мутацію S653N.
2. Ізольована, рекомбінантна, піддана мутагенезу або синтетична молекула нуклеїнової кислоти за п. 1, де молекула нуклеїнової кислоти має послідовність нуклеїнової кислоти SEQ ID NO: 16.
3. Експресучий вектор, який містить ізольовану молекулу нуклеїнової кислоти, що кодує білок AHASLIII Brassica napus, що має амінокислотну послідовність BN02-131 (SEQ ID NO: 21), де вказаний білок AHASLIII містить заміну аланіну на треонін в положенні, що відповідає положенню A122 послідовності SEQ ID NO: 23, і заміну серину на аспарагін в положенні, що відповідає положенню S653 послідовності SEQ ID NO:23, де вказаний білок AHASLIII є резистентним до інгібування AHAS-інгібуючим гербіцидом, та де кодований білок AHASLIII проявляє синергетичний рівень резистентності до інгібування AHAS-інгібуючим гербіцидом порівняно з адитивним рівнем білка AHASLIII Brassica napus, що має одиничну мутацію А122Т, і білка AHASLIII Brassica napus, що має одиничну мутацію S653N.
4. Рослина Brassica, яка містить піддану мутагенезу молекулу нуклеїнової кислоти, що кодує білок AHASLIII Brassica napus, що має амінокислотну послідовність SEQ ID NO: 21, де вказаний білок AHASLIII містить заміну аланіну на треонін в положенні, що відповідає положенню A122 послідовності SEQ ID NO: 23, і заміну серину на аспарагін в положенні, що відповідає положенню S653 послідовності SEQ ID NO: 23, де вказаний білок AHASLIII є резистентним до інгібування AHAS-інгібуючим гербіцидом, та де кодований білок AHASLIII проявляє синергетичний рівень резистентності до інгібування AHAS-інгібуючим гербіцидом порівняно з адитивним рівнем білка AHASLIII Brassica napus, що має одиничну мутацію А122Т, і білка AHASLIII Brassica napus, що має одиничну мутацію S653N, де рослина Brassica є резистентною щонайменше до одного AHAS-інгібуючого гербіциду.
5. Рослина Brassica за п. 4, де рослина Brassica є рослиною виду Brassica, що вибрана з групи, яка складається з B. napus, B. rapa і B. juncea.
6. Рослина Brassica за п. 5, де рослина Brassica є рослиною Brassica napus, і де рослина Brassica є нетрансгенною.
7. Рослина Brassica за п. 4, де рослина Brassica є резистентною до застосування AHAS-інгібуючих гербіцидів, що вибрані з групи, яка складається з імідазолінонових гербіцидів, сульфонілсечовинних гербіцидів, триазолпіримідинових гербіцидів, піримідинілоксибензоатних гербіцидів, сульфоніламінокарбонілтриазолінонових гербіцидів і їх сумішей.
8. Рослина Brassica за п. 4, де рослина додатково містить другу молекулу нуклеїнової кислоти AHASL, яка кодує другий стійкий до гербіцидів білок AHASL, де друга молекула нуклеїнової кислоти AHASL містить РМ2.
9. Насіння рослини Brassica, здатне давати рослину Brassica, яка містить піддану мутагенезу молекулу нуклеїнової кислоти, що кодує білок AHASLIII Brassica napus, що має амінокислотну послідовність SEQ ID NO: 21, де вказаний білок AHASLIII містить заміну аланіну на треонін в положенні, що відповідає положенню A122 послідовності SEQ ID NO: 23, і заміну серину на аспарагін в положенні, що відповідає положенню S653 послідовності SEQ ID NO: 23, де вказаний білок AHASLIII є резистентним до інгібування AHAS-інгібуючим гербіцидом, та де кодований білок AHASLIII проявляє синергетичний рівень резистентності до інгібування AHAS-інгібуючим гербіцидом порівняно з адитивним рівнем білка AHASLIII Brassica napus, що має одиничну мутацію А122Т, і білка AHASLIII Brassica napus, що має одиничну мутацію S653N.
10. Насіння рослини Brassica за п. 9, де рослина Brassica є рослиною виду Brassica, що вибрана з групи, яка складається з B. napus, B. rapa і B. juncea.
11. Насіння рослини Brassica за п. 10, де рослина Brassica є рослиною Brassica napus, і де рослина Brassica є нетрансгенною.
12. Насіння рослини Brassica за п. 9, де насіння оброблено AHAS-інгібуючим гербіцидом.
13. Насіння рослини Brassica за п. 12, де AHAS-інгібуючий гербіцид вибирають з групи, яка складається з амідосульфурону, азимсульфурону, бенсульфурону, хлоримурону, хлорсульфурону, циносульфурону, циклосульфамурону, етаметсульфурону, етоксисульфурону, флазасульфурону, флупірсульфурону, форамсульфурону, галосульфурону, імазосульфурону, йодсульфурону, мезосульфурону, метсульфурону, нікосульфурону, оксасульфурону, примісульфурону, просульфурону, піразосульфурону, римсульфурону, сульфометурону, сульфосульфурону, тифенсульфурону, триасульфурону, трибенурону, трифтоксисульфурону, трифлусульфурону, тритосульфурону, імазаметабензу, імазамоксу, імазапіку, імазапіру, імазахіну, імазетапіру, клорансуламу, диклосуламу, флорасуламу, флуметсуламу, метосуламу, пеноксуламу, біспірибаку, піримінобаку, пропоксикарбазону, флукарбазону, пірибензоксиму, пірифталіду, піритіобаку і їх сумішей.
14. Насіння рослини Brassica за п. 9, де рослина додатково містить другу молекулу нуклеїнової кислоти AHASL, яка кодує другий стійкий до гербіцидів білок AHASL, де друга молекула нуклеїнової кислоти AHASL містить РМ2.
15. Ємність з насінням Brassica, де вказана ємність містить щонайменше 10 % насіння, здатного давати рослини Brassica, що містять мутантну молекулу нуклеїнової кислоти, яка кодує білок ацетогідроксикислот AHASLIII Brassica napus, що має амінокислотну послідовність SEQ ID NO: 21, де вказаний білок AHASLIII містить заміну аланіну на треонін в положенні, що відповідає положенню A122 послідовності SEQ ID NO: 23, і заміну серину на аспарагін в положенні, що відповідає положенню S653 послідовності SEQ ID NO: 23, де вказаний білок AHASLIII є резистентним до інгібування AHAS-інгібуючим гербіцидом, та де кодований білок AHASLIII проявляє синергетичний рівень резистентності до інгібування AHAS-інгібуючим гербіцидом порівняно з адитивним рівнем білка AHASLIII Brassica napus, що має одиничну мутацію А122Т, і білка AHASLIII Brassica napus, що має одиничну мутацію S653N.
16. Ємність з насінням Brassica за п. 15, де рослину Brassica вибрано з групи, яка складається з B. juncea, B. napus, B. rapa, B. carinata, B. oleracea і B. nigra.
17. Ємність з насінням Brassica за п. 15, де AHAS-інгібуючий гербіцид вибраний з групи, що складається з імідазолінонових гербіцидів, сульфонілсечовинних гербіцидів, триазолпіримідинових гербіцидів, піримідинілоксибензоатних гербіцидів і їх сумішей.
18. Ємність з насінням Brassica за п. 15, де рослина Brassica є нетрансгенною.
19. Ємність з насінням Brassica за п. 18, де рослина Brassica є Brassica napus.
20. Ємність з насінням Brassica за п. 15, де гербіцид являє собою імідазоліноновий гербіцид.
21. Ємність з насінням Brassica за п. 20, де гербіцид вибраний з групи, яка складається з імазамоксу, імазапіку, імазапіру, імазетапіру і їх сумішей.
22. Ємність з насінням Brassica за п. 15, де рослина додатково містить другу молекулу нуклеїнової кислоти AHASL, яка кодує другий резистентний до гербіцидів білок AHASL, де друга молекула нуклеїнової кислоти AHASL містить РМ2.
23. Рослинна клітина, що містить піддану мутагенезу молекулу нуклеїнової кислоти, що кодує білок AHASLIII Brassica napus, що має амінокислотну послідовність SEQ ID NO: 21, де вказаний білок AHASLIII містить заміну аланіну на треонін в положенні, що відповідає положенню A122 послідовності SEQ ID NO: 23, і заміну серину на аспарагін в положенні, що відповідає положенню S653 послідовності SEQ ID NO: 23, де вказаний білок AHASLIII є резистентним до інгібування AHAS-інгібуючим гербіцидом, та де кодований білок AHASLIII проявляє синергетичний рівень резистентності до інгібування AHAS-інгібуючим гербіцидом порівняно з адитивним рівнем білка AHASLIII Brassica napus, що має одиничну мутацію А122Т, і білка AHASLIII Brassica napus, що має одиничну мутацію S653N, і де рослинна клітина є стійкою щонайменше до одного AHAS-інгібуючого гербіциду.
24. Рослинна клітина за п. 23, де рослинна клітина являє собою рослинну клітину Brassica.
25. Рослинна клітина за п. 24, де рослинна клітина є рослинною клітиною Brassica napus, і де рослинна клітина є нетрансгенною.
26. Рослинна клітина за п. 23, де рослина додатково містить другу молекулу нуклеїнової кислоти AHASL, яка кодує другий стійкий до гербіцидів білок AHASL, де друга молекула нуклеїнової кислоти AHASL містить РМ2.
27. Спосіб боротьби з бур'янами, який включає надання насіння, здатного давати рослину Brassica, що містить піддану мутагенезу молекулу нуклеїнової кислоти, що кодує білок AHASLIII Brassica napus, що має амінокислотну послідовність SEQ ID NO: 21, де вказаний білок AHASLIII містить заміну аланіну на треонін в положенні, що відповідає положенню A122 послідовності SEQ ID NO: 23, і заміну серину на аспарагін в положенні, що відповідає положенню S653 послідовності SEQ ID NO: 23, де вказаний білок AHASLIII є резистентним до інгібування AHAS-інгібуючим гербіцидом, та де кодований білок AHASLIII проявляє синергетичний рівень резистентності до інгібування AHAS-інгібуючим гербіцидом порівняно з адитивним рівнем білка AHASLIII Brassica napus, що має одиничну мутацію А122Т, і білка AHASLIII Brassica napus, що має одиничну мутацію S653N, і контактування насіння з AHAS-інгібуючим гербіцидом до посіву і/або після попереднього пророщування.
28. Спосіб за п. 27, де рослина додатково містить другу молекулу нуклеїнової кислоти AHASL, яка кодує другий резистентний до гербіцидів білок AHASL, де друга молекула нуклеїнової кислоти AHASL містить РМ2.
29. Спосіб за п. 27, де гербіцид вибраний з групи, яка складається з імазамоксу, імазапіку, імазапіру, імазетапіру і їх сумішей.
30. Спосіб ідентифікації підданої мутагенезу молекули нуклеїнової кислоти AHASL в біологічному зразку, що включає:
формування суміші біологічного зразка і першого і другого праймера нуклеїнової кислоти, здатного ампліфікувати піддану мутагенезу молекулу нуклеїнової кислоти AHASL, де піддана мутагенезу молекула нуклеїнової кислоти AHASL кодує білок AHASLIII Brassica napus, що має амінокислотну послідовність SEQ ID NO: 21, де вказаний білок AHASLIII містить заміну аланіну на треонін в положенні, що відповідає положенню A122 послідовності SEQ ID NO: 23, і заміну серину на аспарагін в положенні, що відповідає положенню S653 послідовності SEQ ID NO: 23, де вказаний білок AHASLIII є резистентним до інгібування AHAS-інгібуючим гербіцидом, та де кодований білок AHASLIII проявляє синергетичний рівень резистентності до інгібування AHAS-інгібуючим гербіцидом у порівнянні з адитивним рівнем білка AHASLIII Brassica napus, що має одиничну мутацію А122Т, і білка AHASLIII Brassica napus, що має одиничну мутацію S653N;
здійснення реакції суміші в умовах, що дозволяють першому і другому праймеру нуклеїнової кислоти ампліфікувати піддану мутагенезу молекулу нуклеїнової кислоти AHASL; і виявлення наявності ампліфікованої підданої мутагенезу послідовності молекули нуклеїнової кислоти AHAS.
31. Спосіб ідентифікації підданої мутагенезу молекули нуклеїнової кислоти AHASL в біологічному зразку, що включає
формування суміші, що містить біологічний зразок, що містить ДНК Brassica, і зонд молекули нуклеїнової кислоти, здатний гібридизуватися з підданою мутагенезу молекулою нуклеїнової кислоти AHASL, де піддана мутагенезу молекула нуклеїнової кислоти AHASL кодує білок AHASLIII Brassica napus, що має амінокислотну послідовність SEQ ID NO: 21, де вказаний білок AHASLIII містить заміну аланіну на треонін в положенні, що відповідає положенню A122 послідовності SEQ ID NO: 23, і заміну серину на аспарагін в положенні, що відповідає положенню S653 послідовності SEQ ID NO: 23, де вказаний білок AHASLIII є резистентним до інгібування AHAS-інгібуючим гербіцидом, та де кодований білок AHASLIII проявляє синергетичний рівень резистентності до інгібування AHAS-інгібуючим гербіцидом порівняно з адитивним рівнем білка AHASLIII Brassica napus, що має одиничну мутацію А122Т, і білка AHASLIII Brassica napus, що має одиничну мутацію S653N;
здійснення реакції суміші в умовах, що дозволяють зонду нуклеїнової кислоти гібридизуватися з підданою мутагенезу молекулою нуклеїнової кислоти AHASL; і
виявлення гібридизації зонда нуклеїнової кислоти з підданою мутагенезу молекулою нуклеїнової кислоти AHASL в зразку, де присутність гібридизації вказує на присутність підданої мутагенезу молекули нуклеїнової кислоти AHASL.
Текст
Реферат: Винахід належить до трансгенної рослини Brassica з підвищеним рівнем стійкості до AHASінгібуючих гербіцидів та до нуклеїнової кислоти, що кодує мутант великої субодиниці синтази UA 115019 C2 (12) UA 115019 C2 ацетогідроксикислот ІІІ (AHASLIII), який проявляє синергетичний рівень резистентності до інгібування AHAS-інгібуючим гербіцидом порівняно з адитивним рівнем білка AHASLIII Brassica napus, що має одиничну мутацію А122Т, і білка AHASLIII Brassica napus, що має одиничну мутацію S653N. 5 10 15 20 25 30 35 40 45 50 55 60 Перехресне посилання на споріднені заявки Дана заявка вимагає пріоритет попередньої заявки на видачу патенту США № 61/100541, поданої 26 вересня 2008 року, повний зміст якої включений в даний опис у вигляді посилання. Галузь техніки, до якої належить винахід Даний винахід стосується резистентних до гербіцидів рослин Brassica і нових полінуклеотидних послідовностей, що кодують резистентні до AHAS-інгібуючих гербіцидів білки великої субодиниці синтази ацетогідроксикислот Brassica, насіння таких рослин і способів застосування таких рослин. Рівень техніки Синтаза ацетогідроксикислот (AHAS; EC 4.1.3.18, також відома як ацетолактатсинтаза або ALS) є першим ферментом, що каталізує біохімічний синтез, амінокислот з розгалуженим ланцюгом, валіну, лейцину і ізолейцину (Singh (1999) "Biosynthesis of valine, leucine and isoleucine", in Plant Amino Acid, Singh, B.K., ed., Marcel Dekker Inc. New York, New York, pp.227247). AHAS є місцем дії п'яти структурно різноманітних сімейств гербіцидів, включаючи сульфонілсечовини (Tan et al. (2005) Pest Manag. Sci. 61:246-57; Mallory-Smith and Retzinger (2003) Weed Technology 17:620-626; `LaRossa and Falco (1984) Trends Biotechnol. 2:158-161), імідазолінони (Shaner et al. (1984) Plant Physiol. 76:545-546), триазолопіримідини (Subramanian and Gerwick (1989) "Inhibition of acetolactate synthase by triazolopyrimidines", in Biocatalysis in Agricultural Biotechnology, Whitaker, J.R. and Sonnet, P.E. eds., ACS Symposium Series, American Chemical Society, Washington, D.C., pp.277-288); Tan et al. (2005) Pest Manag. Sci. 61:246-57; Mallory-Smith and Retzinger (2003) Weed Technology 17:620-626); і сульфоніламінокарбонілтриазолінони (Tan et al. (2005) Pest Manag. Sci. 61:246-57; MallorySmith and Retzinger (2003) Weed Technology 17:620-626); і N-сульфоніламінокарбоніли. Гербіциди на основі імідазолінону і сульфонілсечовини широко застосовують у сучасному сільському господарстві внаслідок їх ефективності при дуже низьких нормах внесення і відносній нетоксичності для тварин. Завдяки інгібуванню AHAS, такі сімейства гербіцидів запобігають подальшому росту і розвитку чутливих рослин, включаючи багато видів бур'янів. Для того, щоб забезпечити фермерам можливість більшої гнучкості в застосуванні різних типів і норм внесення гербіцидів на основі імідазолінону і сульфонілсечовини, часто вимагається велика стійкість до гербіцидів. Також селекціонери рослин, що створюють стійкі до гербіцидів сорти, мають потребу в роботі з мутантами, що забезпечують велику стійкість до гербіцидів, створюючи велику гнучкість у виборі вихідної ідіоплазми, яку вони використовують для створення своїх сортів. Для одержання таких резистентних до AHAS-інгібуючих гербіцидів сортів селекціонери рослин мають потребу в створенні додаткових селекційних ліній, переважно, з підвищеною резистентністю до AHAS-інгібуючих гербіцидів. Таким чином, необхідні додаткові резистентні до AHAS-інгібуючих гербіцидів селекційні лінії і сорти сільськогосподарських культур, а також способи і композиції для одержання і застосування резистентних до AHAS-інгібуючих гербіцидів селекційних ліній і сортів. Суть винаходу Даний винахід стосується ізольованих молекул нуклеїнової кислоти, які кодують білок великої субодиниці (AHASL), що містить мутацію в положенні, яке відповідає положенню A122 послідовності SEQ ID NO:23, і мутацію в положенні, яке відповідає положенню S653 послідовності SEQ ID NO:23. В іншому варіанті, даний винахід стосується експресуючих векторів, що містять ізольовану молекулу нуклеїнової кислоти, яка кодує білок великої субодиниці синтази ацетогідроксикислот (AHASL) Brassica, що містить мутацію в положенні, яке відповідає положенню A122 послідовності SEQ ID NO:23, і мутацію в положенні, яке відповідає положенню S653 послідовності SEQ ID NO:23. У ще одному варіанті даний винахід стосується рослин Brassica, що містять піддану мутагенезу молекулу нуклеїнової кислоти, яка кодує стійкий до гербіцидів білок великої субодиниці синтази ацетогідроксикислот (AHASL) Brassica, що містить мутацію в положенні, яке відповідає положенню A122 послідовності SEQ ID NO:23, і мутацію в положенні, яке відповідає положенню S653 послідовності SEQ ID NO:23. У наступному варіанті даний винахід стосується насіння Brassica, здатного продукувати рослину Brassica, що містить піддану мутагенезу молекулу нуклеїнової кислоти, яка кодує білок великої субодиниці синтази ацетогідроксикислот (AHASL) Brassica, що має мутацію в положенні, яке відповідає положенню A122 послідовності SEQ ID NO:23, і мутацію в положенні, яке відповідає положенню S653 послідовності SEQ ID NO:23. В іншому варіанті даний винахід стосується ємностей з насінням Brassica, при цьому ємність містить щонайменше 10% насіння, здатного продукувати рослини Brassica, що містять 1 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 мутантну молекулу нуклеїнової кислоти, яка кодує білок великої субодиниці синтази ацетогідроксикислот (AHASL) Brassica, що має мутацію в положенні, яке відповідає положенню A122 послідовності SEQ ID NO:23, і мутацію в положенні, яке відповідає положенню S653 послідовності SEQ ID NO:23. У ще одному варіанті даний винахід стосується способів боротьби з бур'янами, що ростуть поруч з рослиною Brassica, при цьому зазначений спосіб включає в себе застосування ефективної кількості AHAS-інгібуючого гербіциду стосовно бур'янів і рослини Brassica, і при цьому рослина Brassica містить у своєму геномі щонайменше одну копію підданої мутагенезу молекули нуклеїнової кислоти, що кодує велику субодиницю синтази ацетогідроксикислот (AHASL), яка кодує резистентний до гербіциду білок AHASL, що має мутацію у положенні, яке відповідає положенню A122 послідовності SEQ ID NO:23, і мутацію в положенні, яке відповідає положенню S653 послідовності SEQ ID NO:23. Даний винахід також стосується способу селекції рослини Brassica, при цьому спосіб включає в себе: схрещування першої лінії Brassica із другою лінією Brassica, де перша лінія Brassica являє собою рослину Brassica, одержану в результаті вирощування з насіння мутантної лінії Brassica; і одержання насіння. Такі мутантні лінії Brassica включають BnCL120C7, зразок зазначеного насіння депонований у ATCC з номером доступу PTA-9278; BnCL131A1, зразок зазначеного насіння депонований у ATCC з номером доступу PTA-9279; BnCL140B3, зразок зазначеного насіння депонований у ATCC з номером доступу PTA-9402; і BnCL140C7, зразок зазначеного насіння депонований у ATCC з номером доступу PTA-9403. Також пропонується насіння мутантних ліній рослин Brassica, названих BnCL120C7, зразок зазначеного насіння депонований у ATCC з номером доступу PTA-9278; BnCL131A1, зразок зазначеного насіння депонований у ATCC з номером доступу PTA-9279; BnCL140B3, зразок зазначеного насіння депонований у ATCC з номером доступу PTA-9402; BnCL140C7, зразок зазначеного насіння депонований у ATCC з номером доступу PTA-9403; PM1PM2/BnCL131Al, зразок зазначеного насіння депонований у ATCC з номером доступу PTA-10321. Даний винахід також стосується ізольованих молекул нуклеїнової кислоти, які кодують білок великої субодиниці синтази ацетогідроксикислот (AHASL) Brassica, що має треонін у положенні, яке відповідає положенню 122 послідовності SEQ ID NO:23. Даний винахід, крім того, стосується рослин Brassica, що містять мутантну молекулу нуклеїнової кислоти, яка кодує білок великої субодиниці синтази ацетогідроксикислот (AHASL) Brassica, що має треонін у положенні, яке відповідає положенню 122 послідовності SEQ ID NO:23. Крім того, даний винахід стосується насіння Brassica, здатного продукувати рослину Brassica, що містить мутантну молекулу нуклеїнової кислоти, яка кодує білок великої субодиниці синтази ацетогідроксикислот (AHASL) Brassica, що має треонін у положенні, яке відповідає положенню 122 послідовності SEQ ID NO:23. Даний винахід, крім того, стосується способів селекції рослини Brassica, при цьому спосіб включає в себе: схрещування першої лінії Brassica із другою лінією Brassica, де перша лінія Brassica являє собою рослину Brassica, одержану в результаті вирощування з насіння мутантної лінії BnCL131A1, зразок зазначеного насіння депонований у ATCC з номером доступу PTA-9279; і одержання насіння. Даний винахід також стосується нетрансгенних рослин Brassica, що містять піддану мутагенезу молекулу нуклеїнової кислоти, яка кодує білок AHAS, що має мутацію в положенні, яке відповідає положенню A122 послідовності SEQ ID NO:23, і мутацію в положенні, яке відповідає положенню S653 послідовності SEQ ID NO:23. Також пропонуються способи одержання нетрансгенної рослини Brassica, яка стійка щонайменше до одного AHAS-інгібуючого гербіциду, які включають у себе: (a) введення в клітини рослини Brassica олігонуклеотидів для репарації генів з цілеспрямованою мутацією в гені AHAS, щоб одержати рослинні клітини з мутантним геном AHAS, що експресує білок AHAS, який є мутантним в одному або більше положеннях амінокислот, при цьому зазначені положення відповідають положенню, вибраному з групи, що складається з положень A122, R199, T203, S653 і G654 послідовності SEQ ID NO:23; (b) ідентифікацію рослинної клітини, що має по суті нормальний ріст у порівнянні з відповідною рослинною клітиною дикого типу в присутності AHAS-інгібуючого гербіциду; і (c) регенерацію нетрансгенної стійкої до гербіцидів рослини Brassica, що має мутантний ген AHAS, із зазначеної рослинної клітини. Крім того, пропонуються способи одержання насіння гібриду F 1 Brassica, які включають у себе схрещування першої рослини Brassica, що має піддану мутагенезу молекулу нуклеїнової кислоти, яка кодує стійкий до гербіцидів білок великої субодиниці синтази ацетогідроксикислот (AHASL) Brassica, що має мутацію в положенні, яке відповідає положенню A122 послідовності 2 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 60 SEQ ID NO:23, і мутацію в положенні, яке відповідає положенню S653 послідовності SEQ ID NO:23, із другою рослиною Brassica; і одержання насіння. Також пропонуються клітини рослин, що містять піддану мутагенезу молекулу нуклеїнової кислоти, яка кодує білок AHAS, що має мутацію в положенні, яке відповідає положенню A122 послідовності SEQ ID NO:23, і мутацію в положенні, яке відповідає положенню S653 послідовності SEQ ID NO:23. Також пропонуються способи підвищення резистентності до гербіцидів рослини, які включають у себе схрещування першої рослини Brassica із другою рослиною Brassica, при цьому перша рослина Brassica містить у своєму геномі щонайменше одну копію підданої мутагенезу молекули нуклеїнової кислоти, що кодує велику субодиницю синтази ацетогідроксикислот (AHASL), яка кодує стійкий до гербіцидів білок AHASL, що має мутацію в положенні, яке відповідає положенню A122 послідовності SEQ ID NO:23, і мутацію в положенні, яке відповідає положенню S653 послідовності SEQ ID NO:23; і одержання насіння у результаті такого схрещування. Крім того, пропонуються рослини Brassica, що містять піддану мутагенезу молекулу нуклеїнової кислоти, яка кодує стійкий до гербіцидів білок AHASL Brassica, що містить мутацію в положенні, яке відповідає положенню A122 послідовності SEQ ID NO:23, і мутацію в положенні, яке відповідає положенню S653 послідовності SEQ ID NO:23, і щонайменше одну додаткову молекулу нуклеїнової кислоти, яка кодує білок, що представляє інтерес. Крім того, пропонуються способи боротьби з бур'янами, що ростуть поблизу рослини Brassica, при цьому спосіб включає в себе застосування ефективної кількості щонайменше одного AHAS-інгібуючого гербіциду стосовно бур'янів і рослини Brassica, де рослина Brassica містить у своєму геномі щонайменше одну копію першої молекули нуклеїнової кислоти AHASL, яка кодує резистентний до гербіцидів білок AHASL, що має мутацію в положенні амінокислоти, яке відповідає положенням A122 і S653 послідовності SEQ ID NO:23, і щонайменше одну другу молекулу нуклеїнової кислоти AHASL, яка кодує другий резистентний до гербіцидів білок AHASL, що має мутацію, вибрану з групи, яка складається з A122T, P197S, A205V, W574L, S653N і їх сполучень. Короткий опис креслень На фіг. 1 представлене схематичне зображення активності AHAS в екстрактах паростків Brassica. На фіг. 2 представлені результати аналізів обприскування гербіцидами рослин Brassica дикого типу і прикладу рослини Brassica, що містить мутантну молекулу нуклеїнової кислоти згідно із даним винаходом. На фіг. 3 показане вирівнювання послідовностей нуклеїнових кислот між молекулами нуклеїнових кислот згідно із даним винаходом (SEQ ID NOS 11-16, відповідно, у зазначеному порядку). На фіг. 4 показане вирівнювання амінокислотних послідовностей між білками AHAS згідно із даним винаходом (SEQ ID NOS 17-21, відповідно, у зазначеному порядку). На фіг. 5 показана послідовність нуклеїнової кислоти й амінокислотна послідовність білка AHASL Arabidopsis thaliana, що має амінокислотну послідовність, зазначену на фіг. 5. Послідовність ДНК зазначена у вигляді SEQ ID NO:22 і амінокислотна послідовність зазначена у вигляді SEQ ID NO:23. Докладний опис винаходу Даний опис стосується ізольованих нуклеотидів, що кодують мутантні білки синтази ацетогідроксикислот (AHAS), з резистентних до AHAS-інгібуючих гербіцидів рослин і способів, що їх стосуються. В одному варіанті ізольовані молекули нуклеїнової кислоти кодують білки AHAS, що мають одну або більше амінокислотних замін у порівнянні з послідовністю AHAS Brassica napus дикого типу (тобто, немутантною). Опис також стосується рекомбінантних векторів, що містять такі молекули нуклеїнової кислоти, а також трансгенних рослин, що містять такі вектори і молекули нуклеїнової кислоти. Даний опис також стосується нетрансгенних рослин, що містять мутантну послідовність, яка кодує AHAS, наприклад, піддану мутагенезу послідовність, що кодує AHAS III, яка має дві або більше амінокислотних замін в порівнянні з послідовністю дикого типу. Мутантна кодуюча AHAS послідовність може мати амінокислотну заміну в положенні, яке відповідає положенню 122, і в положенні, яке відповідає положенню 653 у послідовності білка AHAS Arabidopsis (фіг. 5; SEQ ID NO:23). Також пропонуються способи одержання таких рослин і способи селекції з використанням таких рослин. У деяких варіантах рослини, насіння, способи і композиції згідно із даним винаходом основані на використанні молекул нуклеїнових кислот, які кодують білки AHAS, що мають 3 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 мутації, які приводять до експресії білків AHAS, що мають заміну аланіну на треонін у положенні, яке відповідає положенню 122, і заміну серину на аспарагін у положенні, яке відповідає положенню 653 (які також іноді називаються у даному описі CLB-1). В інших варіантах рослини, насіння, способи і композиції згідно із даним винаходом основані на використанні молекул нуклеїнових кислот, які кодують білки AHAS, що мають мутації, які приводять до експресії білків AHAS, що мають амінокислоту, вибрану з аргініну, глутаміну, фенілаланіну, тирозину, триптофану, лізину, гліцину, гістидину, серину, проліну, глутамінової кислоти, аспарагінової кислоти, цистеїну, метіоніну, лейцину, аспарагіну, ізолейцину і валіну, заміщену в положенні, яке відповідає положенню 122, і амінокислоту, вибрану з аргініну, глутаміну, фенілаланіну, тирозину, триптофану, лізину, гліцину, гістидину, аланіну, проліну, глутамінової кислоти, аспарагінової кислоти, цистеїну, метіоніну, лейцину, треоніну, ізолейцину і валіну, заміщену в положенні, яке відповідає положенню 653. Також пропонуються способи боротьби з бур'янами з використанням трансгенних і нетрансгенних рослин, що містять мутантні послідовності AHAS, які пропонуються в даному винаході. Крім того, винахід стосується резистентних до гербіцидів ліній Brassica, які називаються у даному описі BnCL120C7, BnCL131A1, BnCL140B3, BnCL140C7, а також насіння, потомства і їх похідних, що одержані з використанням способів мутагенезу, які докладно описані нижче. Даний винахід також стосується підвищеної стійкості до гербіцидів і способів одержання підвищеної стійкості до гербіцидів, що досягається у випадку сполучення мутацій AHAS в одній AHAS-кодуючій послідовності. В одному прикладі рослини, що поєднують у собі мутації, які відповідають положенням A122 і S653 послідовності білка AHAS Arabidopsis (фіг. 5; SEQ ID NO:23), виявляють таку підвищену стійкість до гербіцидів. Одержана в результаті стійкість до гербіцидів значимо підвищена, наприклад, має місце синергетичний ефект, у порівнянні з рівнем стійкості, який спостерігається, коли рівні стійкості, одержані у рослин, що містять будьяку одну з мутацій, які відповідають положенням A122 або S653, по окремості, складають разом. Перед більш докладним описом винаходу спочатку будуть визначені наступні терміни. Визначення "Стійка до гербіцидів" або "резистентна до гербіцидів" рослина стосується рослини, яка стійка або резистентна щонайменше до одного AHAS-інгібуючого гербіциду на рівні, що звичайно може убивати або інгібувати ріст нормальної рослини або рослини дикого типу, у якої немає мутантної молекули нуклеїнової кислоти AHAS. Під "резистентною до гербіцидів молекулою нуклеїнової кислоти AHAS" мають на увазі молекулу нуклеїнової кислоти, що містить одну або більше мутацій, які приводять до однієї або більше амінокислотних замін, у порівнянні з немутантним білком AHAS, при цьому результатом мутацій є експресія резистентного до гербіцидів білка AHAS. Під "стійким до гербіцидів білком AHAS" або "резистентним до гербіцидів білком AHAS" мають на увазі, що такий білок AHAS має більш високу активність AHAS у порівнянні з активністю AHAS білка AHAS дикого типу в присутності щонайменше одного гербіциду, який, як відомо, перешкоджає прояву активності AHAS, і при концентрації або рівні гербіциду, який, як відомо, інгібує активність AHAS білка AHASL дикого типу. Крім того, активність AHAS такого стійкого до гербіцидів або резистентного до гербіцидів білка AHASL може бути названа в даному описі "стійкою до гербіцидів" або "резистентною до гербіцидів" активністю AHAS. Для даного винаходу терміни "стійкий до гербіцидів" і "резистентний до гербіцидів" використовують взаємозамінно, і мається на увазі, що терміни мають еквівалентне значення й еквівалентний діапазон використання. Подібним чином, терміни "стійкість до гербіцидів" і "резистентність до гербіцидів" використовують взаємозамінно, і мається на увазі, що терміни мають еквівалентне значення й еквівалентний діапазон. Подібним чином, терміни "резистентний до імідазолінонів" і "резистентність до імідазолінонів" використовують взаємозамінно, і мається на увазі, що терміни мають еквівалентне значення й еквівалентний діапазон як і терміни "стійкий до імідазолінонів" і "стійкість до імідазолінонів", відповідно. "Резистентність до гербіцидів" або "стійкість до гербіцидів" може бути виміряна в результаті порівняння активності AHAS, одержаної в екстрактах клітин з рослин, які містять піддану мутагенезу послідовність AHAS, і з рослин, у яких відсутня піддана мутагенезу послідовність AHAS, у присутності інгібітору AHAS, такого як імазамокс, з використанням способів, описаних у Singh, et al. Anal. Biochem., (1988), 171:173-179. В одному варіанті у випадку резистентних або стійких рослин спостерігають більше ніж 25% відсутність інгібування з застосуванням способів, описаних у публікації Singh зі співавторами (1988), при аналізі з використанням 100 мкм імазамоксу. 4 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 60 "Ізольована" або "очищена" молекула нуклеїнової кислоти або білка або його біологічно активної частини в значній мірі або по суті не містить компонентів, що звичайно супроводжують або взаємодіють з молекулою нуклеїнової кислоти або білком і виявлені в його природному оточенні. Таким чином, ізольована або очищена молекула нуклеїнової кислоти або білка по суті не містить іншої клітинної речовини або культурального середовища при одержанні основаними на рекомбінації способами, або по суті не містить хімічних попередників або інших хімічних речовин при хімічному синтезі. В одному варіанті "ізольована" нуклеїнова кислота по суті не містить послідовностей (переважно, кодуючих білок послідовностей), що у природі фланкують нуклеїнову кислоту (тобто, послідовностей, розташованих на 5'- і 3'-кінцях нуклеїнової кислоти) у геномній ДНК організму, з якого нуклеїнова кислота одержана. Наприклад, у різних варіантах ізольована молекула нуклеїнової кислоти може містити менше ніж приблизно 5 т. п. н., 4 т. п. н., 3 т. п. н., 2 т. п. н., 1 т. п. н., 0,5 т. п. н. або 0,1 т. п. н. нуклеотидних послідовностей, що у природі фланкують молекулу нуклеїнової кислоти в геномній ДНК клітини, з якої нуклеїнова кислота одержана. У деяких варіантах ізольована молекула нуклеїнової кислоти фланкована природними геномними послідовностями, що регулюють її експресію в клітині, наприклад, нативний промотор або нативна 3'-нетрансльована область. Білок, який по суті не містить клітинного матеріалу, включає препарати білка, що містять менше ніж приблизно 30%, 20%, 10%, 5% або 1% (сухої маси) забруднюючого білка. У тому випадку, коли білок відповідно до винаходу або його біологічно активну частину одержують способами на основі рекомбінації, переважно, культуральне середовище складає менше ніж приблизно 30%, 20%, 10%, 5% або 1% (сухої маси) хімічних попередників або хімічних речовин, відмінних від білка, що представляє інтерес. Термін "дикий тип" використовують стосовно молекули нуклеїнової кислоти або білка, що можуть бути знайдені в природі, які відмінні від одержаних людиною штучно або в результаті мутагенезу. В одному варіанті послідовність нуклеїнової кислоти AHAS "дикого типу" стосується послідовності нуклеїнової кислоти BN-02, показаної на фіг. 3. Подібним чином рослина Brassica дикого типу стосується рослини Brassica, що має послідовність нуклеїнової кислоти BN-02, показану на фіг. 3. Термін також використовують стосовно рослин, що містять послідовність нуклеїнової кислоти AHAS BN-02, показану на фіг. 3. Використання терміна "дикий тип" не означає, що при цьому обов'язково мають на увазі, що рослина, рослинна тканина, рослинна клітина або інша клітина-хазяїн не містить рекомбінантної ДНК у своєму геномі і/або не має ознак резистентності до гербіцидів, що відрізняються від ознак резистентності, описаних у даній публікації. "Піддана мутації" молекула або "мутантна молекула", або "піддана мутагенезу" молекула, така як молекула нуклеїнової кислоти або молекула амінокислоти, стосується молекули нуклеїнової кислоти або поліпептиду, що має одну або більше замін, делецій або трансверсій нуклеїнової кислоти або амінокислот у порівнянні з нуклеїновою кислотою або амінокислотою в еквівалентному положенні в немутантній молекулі або молекулі дикого типу. Терміни стосуються молекули нуклеїнової кислоти або молекули поліпептиду, яка модифікована в порівнянні зі своєю нативною формою або формою дикого типу в результаті навмисної обробки людиною і не містить природних послідовностей. У використовуваному в даному описі розумінні терміни "синергія", "синергетичний" і їх похідні, такі як "синергетичний ефект", стосуються таких випадків, у яких біологічна активність сполучення двох або більше мутантних поліпептидів AHAS і/або сполучення мутацій в одній кодуючій послідовності, такій як молекула нуклеїнової кислоти AHAS, яка кодує поліпептид AHAS, що має мутації в положеннях, які відповідають положенням A122 і S653щонайменше на 10% вище, ніж сума біологічних активностей поліпептидів AHAS, що мають окремі мутації. Біологічна активність поліпептидів AHAS може бути виміряна за допомогою порівняння ступеня ушкодження рослин, які містять піддані мутагенезу молекули згідно із даним винаходом, із сумарним ступенем ушкодження рослин, які містять відповідні мутації, через 15 днів після обробки AHAS-інгібуючим гербіцидом, таким як імазамокс. "Еквівалентне положення" або "відповідне положення" стосується положення, яке знаходиться в межах тієї ж самої консервативної області, що і положення еталонної амінокислоти. Наприклад, стосовно послідовності білка AHAS положення амінокислот, зазначені в даному описі, відповідають положенням амінокислот у білку AHASL Arabidopsis thaliana, що має амінокислотну послідовність, зазначену на фіг. 5 (фіг. 5; SEQ ID NO:23). Якщо в описі не зазначене інше, конкретні амінокислотні положення стосуються відповідного положення такої амінокислоти в повнорозмірній амінокислотній послідовності AHASL A. thaliana, зазначеній на фіг. 5 (SEQ ID NO:23). Крім того, фактичні положення амінокислот можуть варіювати залежно від того, додають або видаляють амінокислоти, наприклад, на N-кінці 5 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 60 амінокислотної послідовності, однак еквівалентне положення все ж можна визначити за допомогою вирівнювання з еталонною послідовністю, такою як послідовність на фіг. 5 (SEQ ID NO:23). Таким чином, винахід охоплює амінокислотні заміни в зазначеному положенні або еквівалентному положенні (наприклад, у "положенні 653 або еквівалентному положенні"). "Фрагмент" стосується частини нуклеотидної послідовності, що кодує білок AHASL, або частини амінокислотної послідовності білка AHAS відповідно до винаходу. Фрагмент нуклеотидної послідовності AHASL відповідно до винаходу може кодувати біологічно активну частину білка AHASL або може являти собою фрагмент, який може бути використаний як зонд для гібридизації або праймер ПЛР із використанням описаних нижче способів. Фрагмент поліпептиду AHAS може охоплювати біологічно активний фрагмент білка AHAS. Термін "біологічно активні фрагменти і варіанти" стосується фрагментів і варіантів наведених як приклади молекул нуклеїнової кислоти і поліпептидів, які мають або кодують активність AHAS. Термін "регуляторний елемент" у використовуваному в даному описі розумінні стосується нуклеїнової кислоти, яка здатна регулювати транскрипцію і/або трансляцію оперативно зв'язаної нуклеїнової кислоти. Регуляторними елементами без обмеження є промотори, енхансери, інтрони, 5'-UTR і 3'-UTR. Термін "оперативно зв'язаний" стосується функціонального зв'язку між регуляторним елементом і другою нуклеїновою кислотою, при цьому послідовність регуляторного елемента залучена в регуляцію експресії другої послідовності нуклеїнової кислоти, наприклад, ініціює і/або опосередковує транскрипцію і/або трансляцію послідовності ДНК, що відповідає другій послідовності. Загалом, "оперативно зв'язані" означає, що послідовності нуклеїнових кислот, які зв'язані, є суміжними, і при необхідності зв'язати дві кодуючі білок області є суміжними і знаходяться в одній і тій же рамці зчитування. У використовуваному в даному описі розумінні термін "трансгенний" стосується будь-якої клітини, тканини, рослини, рослинної клітини, калусу, рослинної тканини або частини рослини, що містять усю або частину щонайменше однієї рекомбінантної молекули нуклеїнової кислоти. Молекули нуклеїнових кислот В одному аспекті винахід стосується ізольованих молекул нуклеїнових кислот, споріднених послідовностям великої субодиниці синтази ацетогідроксикислот (AHASL), що містять послідовності нуклеїнової кислоти, які мають мутації в порівнянні з послідовністю нуклеїнової кислоти дикого типу (тобто, природною), з якої вони одержані, а також фрагментів таких послідовностей, що містять такі мутації. Такі ізольовані послідовності нуклеїнових кислот включають послідовності, зазначені на фіг. 3 і 4. В іншому аспекті опис стосується молекул нуклеїнових кислот, що містять нуклеотидні послідовності, які кодують білки AHASL, що мають мутації в порівнянні з білком дикого типу, які здатні забезпечувати стійкість або підвищені рівні резистентності до AHAS-інгібуючих гербіцидів, і таких мутантних білків AHASL. В одному варіанті, кодуюча послідовність AHASL являє собою мутантну кодуючу послідовність AHASL Brassica, наприклад, кодуючу послідовність AHAS III Brassica napus, що містить дві мутації у порівнянні з послідовністю дикого типу. В іншому варіанті винахід стосується виділення і нуклеотидної послідовності молекули нуклеїнової кислоти, що кодує резистентний до гербіцидів білок AHASL III Brassica, з резистентної до гербіцидів рослини Brassica, яка одержана в результаті мутагенезу рослин Brassica дикого типу. Молекули нуклеїнової кислоти можуть бути одержані з будь-якого джерела, такого як рослинні або бактеріальні джерела. В одному варіанті молекули нуклеїнових кислот одержують з рослинного джерела, такого як рослина Brassica. Молекули нуклеїнових кислот, одержані з рослини Brassica, можуть бути одержані з будь-якого виду Brassica, включаючи B. napus, B. rapa або B. juncea. Такі молекули нуклеїнових кислот можуть бути одержані з будь-яких кодучих послідовностей AHAS, таких як AHAS I, AHAS II або AHAS III. В одному варіанті молекули нуклеїнових кислот містять мутації в послідовності нуклеїнової кислоти в положеннях, що відповідають послідовностям кодонів для амінокислот у положеннях 122 (наприклад, GCT → ACT) і/або 653 (наприклад, AGT → AAT) від стартового кодону ATG кодуючої послідовності AHASL. Однак може бути одержана будь-яка мутація в положеннях, які відповідають положенням амінокислот 122 і 653, що входить в обсяг даного винаходу. Крім того, мутації в положеннях 122 і 653 послідовності AHAS можуть приводити до експресії білка AHAS з будь-якою амінокислотою, відмінною від аланіну, у положенні, яке відповідає положенню 122, або будь-якою амінокислотою, відмінною від серину, у положенні, яке відповідає положенню 653. В одному варіанті мутації в положеннях, які відповідають положенням 122 і 653, можуть являти собою консервативні амінокислотні заміни, тоді як в інших варіантах заміни можуть являти собою консервативні заміни треоніну або аспарагіну в положеннях 122 і 653, відповідно. В іншому варіанті мутації в положенні, яке відповідає 6 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 60 положенню 122, приводять до експресії амінокислоти в такому положенні, вибраної з групи, що складається з треоніну і валіну. В іншому варіанті мутації в положенні, яке відповідає положенню 653, приводять до експресії амінокислоти аспарагіну. В одному варіанті білки AHAS, кодовані молекулами нуклеїнових кислот відповідно до винаходу, містять заміну серину на аспарагін у положенні, яке відповідає положенню 653 (наприклад, S653N) гена AHASL (на основі нумерації для Arabidopsis thaliana), і заміну аланіну на треонін у положенні, яке відповідає положенню 122 (наприклад, A122T). Однак може бути одержана будь-яка амінокислотна заміна, включаючи консервативні амінокислотні заміни, у таких положеннях у рамках обсягу даного винаходу. Винахід, крім того, стосується виділення і нуклеотидної послідовності молекули нуклеїнової кислоти, що кодує білок AHASL Brassica дикого типу. У деяких варіантах молекули нуклеїнової кислоти згідно із даним винаходом кодують білки AHAS, що мають мутації, які приводять до експресії білків AHAS, що мають заміну аланіну на треонін у положенні, як відповідає положенню 122, і заміну серину на аспарагін у положенні, яке відповідає положенню 653. В інших варіантах молекули нуклеїнових кислот кодують білки AHAS, що мають мутації, які приводять до експресії білків AHAS, які мають амінокислоту, вибрану з аргініну, глутаміну, фенілаланіну, тирозину, триптофану, лізину, гліцину, гістидину, серину, проліну, глутамінової кислоти, аспарагінової кислоти, цистеїну, метіоніну, лейцину, аспарагіну, ізолейцину і валіну, як замінну амінокислоту в положенні, яке відповідає положенню 122, і амінокислоту, вибрану з аргініну, глутаміну, фенілаланіну, тирозину, триптофану, лізину, гліцину, гістидину, аланіну, проліну, глутамінової кислоти, аспарагінової кислоти, цистеїну, метіоніну, лейцину, треоніну, ізолейцину і валіну, як замінну амінокислоту в положенні, яке відповідає положенню 653. Піддані мутагенезу послідовності поліпептиду AHAS згідно із даним винаходом можуть виявляти резистентність або стійкість до будь-якого AHAS-інгібуючого гербіциду. Такі піддані мутагенезу послідовності поліпептиду AHAS можуть бути резистентними або стійкими щонайменше до одного AHAS-інгібуючого гербіциду. В одному варіанті піддані мутагенезу послідовності поліпептиду AHAS згідно із даним винаходом виявляють резистентність або стійкість до AHAS-інгібуючого гербіциду, вибраного з групи, що складається з імідізолінонових гербіцидів і сульфонілсечовинних гербіцидів. В іншому варіанті піддані мутагенезу послідовності поліпептиду AHAS згідно із даним винаходом виявляють резистентність або стійкість до імідізолінонових гербіцидів. У деяких варіантах піддані мутагенезу послідовності AHAS, що мають мутації в положеннях, які відповідають положенням A122 і S653, забезпечують синергетичні рівні стійкості до гербіцидів. В одному варіанті рівні стійкості до гербіцидів, одержані у рослин, які містять послідовність AHAS з подвійною мутацією згідно із даним винаходом, щонайменше на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% або більше вище, ніж адитивні рівні стійкості, що спостерігаються у рослин, які містять послідовність AHAS, що має відповідну окрему мутацію. Такі синергетичні рівні гербіцидної стійкості також можуть бути одержані у рослин, які мають піддані мутагенезу послідовності AHAS, що містять мутації в положеннях амінокислот, які відповідають положенням A122 і S653, у сполученні з однією або більше додатковими підданими мутагенезу або рекомбінантними послідовностями AHAS, що кодують стійкий до AHAS-інгібіторів білок AHAS. Також описані мутантні молекули нуклеїнових кислот, які кодують білок AHAS III B. Napus, що має заміну аланіну на треонін у положенні, яке відповідає положенню 122 (A122T). В одному варіанті такі молекули нуклеїнових кислот також містять другу мутацію в послідовності нуклеїнової кислоти, наприклад, молекула нуклеїнової кислоти, що кодує заміну серину на аспарагін у положенні, яке відповідає положенню 653 (S653N). В описі також пропонуються ізольовані молекули нуклеїнових кислот, які мають послідовності нуклеїнових кислот BN02-120 або BN02-131, що представлені на фіг. 3 і 4, а також їх фрагменти і варіанти. В описі також пропонуються ізольовані молекули нуклеїнових кислот, які кодують білки AHASL Brassica, що мають одну або більше замін у нуклеїновій кислоті, які приводять до експресії білка AHAS, що має одну або більше амінокислотних замін. Наприклад, винахід стосується ізольованих молекул нуклеїнових кислот, які містять: нуклеотидну послідовність BN02-120 або BN02-131, представлені на фіг. 3 і 4, нуклеотидні послідовності, які кодують білок AHASL, що містить амінокислотну послідовність, яка названа BN02-102 або BN02-131, представлену на фіг. 4, нуклеотидні послідовності, представлені на фіг. 3, нуклеотидні послідовності, які кодують білок AHASL, що містить амінокислотну послідовність, зазначену як BN02-120 або BN02-131 на фіг. 4, і фрагменти і варіанти таких нуклеотидних послідовностей, які кодують функціональні білки AHASL. 7 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 60 Піддані мутагенезу послідовності AHAS згідно із даним винаходом включають в себе послідовності, що мають будь-яку кількість мутацій на доповнення до мутацій, які відповідають положенням 122 і/або 653. Наприклад, піддана мутагенезу послідовність AHAS може містити 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 або більше додаткових мутацій, що можуть або являти собою мовчазні мутації або забезпечувати резистентність або стійкість до того ж самого або до інших класів AHAS-інгібуючих гербіцидів. В іншому варіанті даний винахід стосується ізольованих молекул нуклеїнових кислот, які містять нуклеотидні послідовності, що кодують амінокислотні послідовності, показані на фіг. 3 і 4, а також їх фрагментів і варіантів, які кодують поліпептиди, що мають активність AHAS. Крім того, пропонуються поліпептиди, які мають амінокислотну послідовність, кодовану молекулою нуклеїнової кислоти, описаною в даній публікації, наприклад, нуклеотидними послідовностями, зазначеними на фіг. 3 і 4 (позначеними BN02-120 або BN02-131), і їх фрагментами і варіантами, які кодують поліпептиди, що мають активність AHAS. Даний винахід також стосується білків AHASL з амінокислотними замінами в зазначених положеннях амінокислот у консервативних областях білків AHASL Brassica, що описані у даній публікації. Винахід охоплює композиції ізольованих або в значній мірі очищених нуклеїнових кислот або білків. Даний винахід стосується ізольованих поліпептидів, які включають у себе мутантні білки AHAS. Ізольовані поліпептиди містять амінокислотну послідовність, вибрану з групи, що складається з амінокислотної послідовності BN02-120 або BN02-131, зазначеної на фіг. 4, амінокислотної послідовності, кодованої нуклеотидною послідовністю BN02-120 або BN02-131, зазначеною на фіг. 3, амінокислотної послідовності і функціональних фрагментів і варіантів зазначених амінокислотних послідовностей, які кодують поліпептид AHAS, що має активність AHAS. Описані молекули нуклеїнових кислот можна використовувати в конструкціях нуклеїнових кислот для трансформації рослин, наприклад, культурних рослин, таких як рослини Brassica. В одному варіанті такі конструкції нуклеїнових кислот, що містять молекули нуклеїнових кислот згідно із даним винаходом, можна застосовувати для одержання трансгенних рослин, щоб забезпечити резистентність до гербіцидів, таких як гербіциди, які, як відомо, інгібують активність AHAS, таких як імідазолінонові гербіциди. Конструкції нуклеїнових кислот можна використовувати в касетах експресії, експресуючих векторах, векторах для трансформації, плазмідах і тому подібному. Трансгенні рослини, одержані після трансформації такими конструкціями, виявляють підвищену резистентність до AHAS-інгібуючих гербіцидів, таких як, наприклад, імідазолінонові і сульфонілсечовинні гербіциди. Таким чином, даний винахід охоплює молекули нуклеїнових кислот AHASL і їх фрагменти і варіанти. Молекули нуклеїнових кислот, що являють собою фрагменти таких нуклеотидних послідовностей, також входять в обсяг даного винаходу. В одному варіанті фрагмент містить щонайменше одну мутантну послідовність у порівнянні з відповідною послідовністю з послідовності дикого типу. Біологічно активна частина білка AHAS може бути одержана виділенням частини однієї з нуклеотидних послідовностей AHAS відповідно до винаходу, експресуючої кодовану частину білка AHAS (наприклад, у результаті основаної на рекомбінації експресії in vitro), і оцінкою активності кодованої частини білка AHAS. Молекули нуклеїнової кислоти, що являють собою фрагменти нуклеотидної послідовності AHAS, містять щонайменше приблизно 15, 20, 50, 75, 100, 200, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850 або 900 нуклеотидів або аж до загальної кількості нуклеотидів, присутніх у повнорозмірній нуклеотидній послідовності, описаній в даній публікації, залежно від передбачуваного застосування. Фрагмент нуклеотидної послідовності AHAS, що кодує біологічно активну частину білка AHAS відповідно до винаходу, буде кодувати щонайменше приблизно 15, 25, 30, 50, 75, 100, 125, 150, 175, 200, 225 або 250 амінокислот, що ідуть одна за одною, або аж до загальної кількості амінокислот, присутніх у повнорозмірному білку AHAS відповідно до винаходу. Фрагменти нуклеотидної послідовності AHAS, які застосовні як зонди для гібридизації, для ПЛРпраймерів, звичайно необов'язково кодують біологічно активну частину білка AHAS. В одному варіанті фрагменти послідовності AHAS включають в себе одну або більше мутацій, описаних у даній публікації. Молекули нуклеїнових кислот, які є варіантами нуклеотидних послідовностей, описаних у даній публікації, також входять в обсяг даного винаходу. До "варіантів" нуклеотидних послідовностей AHAS відповідно до винаходу належать послідовності, які кодують білки AHAS, описані в даній публікації, але які мають консервативні відмінності внаслідок виродженості 8 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 60 генетичного коду. Такі алельні варіанти, що зустрічаються в природі, можуть бути ідентифіковані з використанням добре відомих способів молекулярної біології, таких як полімеразна ланцюгова реакція (ПЛР) і способи гібридизації, що описані нижче. Варіанти нуклеотидних послідовностей також включають синтетично одержані нуклеотидні послідовності, які були створені, наприклад, з використанням сайт-специфічного мутагенезу, але які усе ще кодують білок AHAS, розкритий у даному винаході, як обговорюється нижче. Звичайно варіанти нуклеотидних послідовностей відповідно до винаходу будуть щонайменше приблизно на 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% або 99% ідентичні конкретній нуклеотидній послідовності, розкритій в даному описі. Варіант нуклеотидної послідовності AHAS буде, відповідно, кодувати білок AHAS, що має амінокислотну послідовність, яка щонайменше приблизно на 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% або 99% ідентична амінокислотній послідовності білка AHAS, розкритого в даному описі. Крім того, фахівцю в даній галузі буде зрозуміло, що зміни можуть бути введені в результаті мутації в нуклеотидні послідовності відповідно до винаходу, з одержанням таким чином змін в амінокислотній послідовності кодованих білків AHAS без зміни біологічної активності білків AHAS. Таким чином, ізольована молекула нуклеїнової кислоти, яка кодує білок AHAS, що має послідовність, яка відрізняється від послідовності BN02-120 або BN02-131, зазначеної на фіг. 3, може бути створена введенням однієї або більше нуклеотидних замін, додавань або делецій у відповідну нуклеотидну послідовність, описану в даній публікації, так що одна або більше амінокислотних замін, додавань або делецій вводиться в кодований білок. Мутації можуть бути введені стандартними способами, такими як сайт-специфічний мутагенез і ПЛРопосередкований мутагенез, і способами, описаними в даній публікації. Такі варіанти нуклеотидних послідовностей також входять в обсяг даного винаходу. Наприклад, в одному варіанті консервативні амінокислотні заміни можуть бути здійснені в одному або більше обчислених несуттєвих амінокислотних залишках. "Несуттєвим" амінокислотним залишком є залишок, який може бути змінений у порівнянні з послідовністю дикого типу білка AHAS (наприклад, послідовністю, показаною на фіг. 5 (SEQ ID NO:23)) без зміни біологічної активності, тоді як "суттєвий" амінокислотний залишок необхідний для біологічної активності. "Консервативна амінокислотна заміна" являє собою заміну, у випадку якої амінокислотний залишок заміняють амінокислотним залишком, який має подібний бічний ланцюг. Сімейства амінокислотних залишків, які мають подібні бічні ланцюги, визначені в даній галузі. Такі сімейства включають в себе амінокислоти з основними бічними ланцюгами (наприклад, лізин, аргінін, гістидин), кислими бічними ланцюгами (наприклад, аспарагінова кислота, глутамінова кислота), незарядженими полярними бічними ланцюгами (наприклад, гліцин, аспарагін, глутамін, серин, треонін, тирозин, цистеїн), неполярними бічними ланцюгами (наприклад, аланін, валін, лейцин, ізолейцин, пролін, фенілаланін, метіонін, триптофан), бетарозгалуженими бічними ланцюгами (наприклад, треонін, валін, ізолейцин) і ароматичними бічними ланцюгами (наприклад, тирозин, фенілаланін, триптофан, гістидин). Такі заміни не можуть бути здійснені у випадку консервативних амінокислотних залишків або у випадку амінокислотних залишків, що знаходяться в консервативному мотиві. Білки відповідно до винаходу можуть бути змінені різними шляхами, включаючи амінокислотні заміни, делеції і інсерції. Способи таких обробок, загалом, відомі в даній галузі. Наприклад, варіанти амінокислотних послідовностей білків AHAS можуть бути одержані в результаті мутацій у ДНК. Способи мутагенезу і змін нуклеотидних послідовностей добре відомі в даній галузі. Див., наприклад, Kunkel (1985) Proc. Natl. Acad. Sci. USA 82: 488-492; Kunkel et al. (1987) Methods in Enzymol. 154:367-382; патент США № 4873192; Walker and Gaastra, eds. (1983) Techniques in Molecular Biology (MacMillan Publishing Company, New York) і наведені в зазначених публікаціях посилання. Інструкції з приводу відповідних амінокислотних замін, що не впливають на біологічну активність білка, що представляє інтерес, можна знайти в описі моделі Dayhoff et al. (1978) Atlas of Protein Sequence and Structure (Natl. Biomed. Res. Found., Washington, D.C.), включеному в даний опис у вигляді посилання. Переважними можуть бути консервативні заміни, такі як заміна однієї амінокислоти іншою амінокислотою, що має подібні властивості. Альтернативно варіанти нуклеотидних послідовностей AHAS можуть бути одержані в результаті випадкового введення мутацій на протязі усієї або частини кодуючої послідовності AHAS, наприклад, за допомогою насичувального мутагенезу, і одержані мутанти можуть бути піддані скринінгу стосовно активності AHAS, щоб ідентифікувати мутанти, які зберігають активність AHAS, включаючи резистентну до гербіцидів активність AHAS. Після мутагенезу кодований білок може бути експресований рекомбінантно, і активність білка може бути визначена стандартними способами аналізу. 9 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 60 Таким чином, нуклеотидні послідовності відповідно до винаходу включають послідовності, розкриті в даному описі, а також їх фрагменти і варіанти. Нуклеотидні послідовності AHASL відповідно до винаходу і їх фрагменти і варіанти можуть бути використані як зонди і/або праймери. Такі зонди можуть бути використані для виявлення транскриптів або геномних послідовностей, які кодують однакові або ідентичні білки. Таким чином, способи, такі як ПЛР, гібридизація і тому подібні, можуть бути використані для ідентифікації таких послідовностей, які мають значну ідентичність з послідовностями відповідно до винаходу. Див., наприклад, Sambrook et al. (1989) Molecular Cloning: Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Plainview, NY) і Innis, et al. (1990) PCR Protocols: A Guide to Methods and Applications (Academic Press, NY). Нуклеотидні послідовності AHASL, виділені на основі ідентичності їх послідовності з нуклеотидними послідовностями AHAS, зазначеними в даному описі, або їх фрагменти і варіанти входять в обсяг даного винаходу. У способі гібридизації вся або частина відомої нуклеотидної послідовності AHAS може бути використана для скринінгу бібліотек кДНК або геномних бібліотек. Способи конструювання таких бібліотек кДНК і геномних бібліотек, загалом, відомі в даній галузі й описані в Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Plainview, NY). Зонди для гібридизації можуть являти собою фрагменти геномної ДНК, фрагменти кДНК, фрагменти РНК або інші олігонуклеотиди, і їх можна мітити реєстрованою 32 групою, такою як P, або будь-яким іншим реєстрованим маркером, таким як інші радіоізотопи, флуоресціююча сполука, фермент або кофактор ферменту. Зонди для гібридизації можуть бути одержані міченням синтетичних олігонуклеотидів, основаних на відомій нуклеотидній послідовності AHAS, описаній в даній публікації. Крім того, можуть бути використані вироджені праймери, сконструйовані на основі консервативних нуклеотидів або амінокислотних залишків у відомій нуклеотидній послідовності AHAS або кодованій амінокислотній послідовності. Зонд звичайно містить область нуклеотидної послідовності, яка гібридизується в жорстких умовах щонайменше приблизно з 12, переважно, приблизно з 25, більш переважно, приблизно з 50, 75, 100, 125, 150, 175, 200, 250, 300, 350, 400, 500, 600, 700, 800 або 900 нуклеотидів, що ідуть один за одним, нуклеотидної послідовності AHAS відповідно до винаходу або її фрагмента або варіанта. Одержання зондів для гібридизації загалом відоме в даній галузі й описане в публікації Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Plainview, New York), включеній в даний опис у вигляді посилання. Наприклад, повна мутантна послідовність нуклеїнової кислоти AHAS, описана в даній публікації, або одна або більше з її частин можуть бути використані як зонд, здатний специфічно гібридизуватися з відповідними послідовностями AHAS і матричними РНК. Способи гібридизації включають оснований на гібридизації скринінг висіяних на чашках бібліотек ДНК (або бляшок, або колоній; див., наприклад, Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Plainview, New York). Гібридизацію таких послідовностей можна здійснювати у визначених умовах жорсткості. Під "умовами жорсткості" або "умовами жорсткості гібридизації" мають на увазі умови, у яких зонд буде гібридизуватися зі своєю послідовністю-мішенню в реєстрованому більш високому ступені, ніж з іншими послідовностями (наприклад, щонайменше у 2 рази вище фону). Умови жорсткості залежать від послідовності і будуть відрізнятися в різних випадках. Звичайно умови жорсткості можуть являти собою умови, при яких концентрація солі менше, ніж приблизно 1,5М іона Na, звичайно концентрація складає приблизно від 0,01 до 1,0М іонів Na (або інших солей) при pН від 7,0 до 8,3, і температура складає щонайменше приблизно 30C у випадку коротких зондів (наприклад, від 10 до 50 нуклеотидів) і щонайменше приблизно 60C у випадку довгих зондів (наприклад, більше 50 нуклеотидів). Умов жорсткості також можна досягти за допомогою додавання дестабілізуючих засобів, таких як формамід. Приклади умов низької жорсткості включають гібридизацію з використанням буферного розчину, що містить від 30 до 35% формаміду, 1М NaCl, 1% SDS (додецилсульфат натрію), при 37C і промивання в 1X2X SSC (20X SSC=3,0М NaCl/0,3М цитрат тринатрію) при 50-55C. Приклади умов помірної жорсткості включають гібридизацію в 40-45% формаміді, 1,0М NaCl, 1% SDS при 37C і промивання в 0,5X-1X SSC при 55-60С. Приклади умов високої жорсткості включають гібридизацію в 50% формаміді, 1М NaCl, 1% SDS при 37C і промивання в 0,1X SSC при 6065C. Необов'язково буфери для промивання містять приблизно від 0,1% до приблизно 1% SDS. Тривалість гібридизації звичайно складає менше ніж приблизно 24 години, звичайно приблизно від 4 до приблизно 12 годин. Специфічність звичайно залежить від промивань після гібридизації, при цьому вирішальними факторами є іонна сила і температура кінцевого розчину для промивання. У випадку гібридів ДНК-ДНК Tm може бути апроксимована з рівняння, описаного в публікації 10 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 60 Meinkoth and Wahl (1984) Anal. Biochem. 138:267-284: Tm=81,5C + 16,6 (log M) + 0,41 (% GC)0,61 (% form) - 500/L, де M означає молярність одновалентних катіонів, % GC означає процентний вміст гуанозинових і цитозинових нуклеотидів у ДНК, % form означає процентний вміст формаміду в розчині для гібридизації, і L означає довжину гібриду в парах нуклеотидів. T m означає температуру (при визначеній іонній силі і pН), при якій 50% комплементарної послідовності-мішені гібридизується з зондом, що ідеально збігається. T m знижують приблизно на 1C для кожного 1% помилкових спарювань; таким чином, T m, умови гібридизації і/або промивання можна коректувати для послідовностей, що мають необхідну ідентичність. Наприклад, якщо необхідно знайти послідовності з >90% ідентичністю, то T m може бути знижена на 10C. Звичайно умови жорсткості вибирають так, щоб температура була на 5C нижче, ніж температура точки плавлення (T m) для конкретної послідовності і її комплементу при визначеній іонній силі і pН. Однак при дуже жорстких умовах можна використовувати гібридизацію і/або промивання при температурі на 1C, 2C, 3C або 4C нижчій, ніж температура точки плавлення (Tm); у випадку помірно жорстких умов можна використовувати гібридизацію і/або промивання при температурі на 6C, 7C, 8C, 9C або 10C нижче, ніж температура точки плавлення (T m); у випадку умов низької жорсткості можна використовувати гібридизацію і/або промивання при температурі на 11C, 12C, 13C, 14C, 15C або 20C нижчій, ніж температура точки плавлення (Tm). При використанні рівняння, складів для гібридизації, промивання і необхідної T m фахівцям у даній галузі буде зрозуміло, що варіанти жорсткості розчинів для гібридизації і/або промивання, по суті, описані. Якщо необхідний ступінь помилкового спарювання приводить до Tm менше ніж 45C (водний розчин) або 32ºC (розчин формаміду), то переважно збільшити концентрацію SSC так, щоб можна було використовувати більш високу температуру. Усебічне керівництво з гібридизації нуклеїнових кислот наведене в публікації Tijssen (1993) Laboratory Techniques in Biochemistry and Molecular Biology - Hybridization with Nucleic Acid Probes, Part I, Chapter 2 (Elsevier, New York); і Ausubel et al., eds. (1995) Current Protocols in Molecular Biology, Chapter 2 (Greene Publishing and Wiley-Interscience, New York). Див. Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Plainview, New York). Молекули нуклеїнових кислот і білки відповідно до винаходу охоплюють молекули нуклеїнових кислот і білки, які містять нуклеотидну амінокислотну або послідовність, що у значній мірі ідентична нуклеотидній послідовності BN02-120 або BN02-131, зазначеній на фіг. 3 і 4. Термін "у значній мірі ідентичний" використовують у даному описі стосовно першої амінокислотної або нуклеотидної послідовності, що містить достатню або мінімальну кількість ідентичних або еквівалентних (наприклад, з подібним бічним ланцюгом) амінокислотних залишків або нуклеотидів у порівнянні з другою амінокислотною або нуклеотидною послідовністю, так що перша і друга амінокислотні або нуклеотидні послідовності мають загальний структурний домен і/або мають загальну функціональну активність. Наприклад, амінокислотні або нуклеотидні послідовності, що містять загальний структурний домен, які мають щонайменше приблизно 45%, 55% або 65% ідентичність, переважно, 75% ідентичність, більш переважно, 85%, 95% або 98% ідентичність, визначають у даному описі як ідентичні в значній мірі. Щоб визначити ідентичність у відсотках двох амінокислотних послідовностей або двох нуклеїнових кислот, послідовності вирівнюють з метою оптимального порівняння. Ідентичність у відсотках між двома послідовностями є функцією кількості ідентичних положень, наявних в послідовностях (тобто, ідентичність у відсотках = кількість ідентичних положень/загальна кількість положень (наприклад, положень, що перекриваються)×100). В одному варіанті дві послідовності мають однакову довжину. Ідентичність у відсотках між двома послідовностями може бути визначена за допомогою способів, подібних до способів, описаних нижче, з урахуванням або без урахування пробілів. При розрахунку ідентичності у відсотках звичайно підраховують точні збіги. Визначення ідентичності у відсотках між двома послідовностями можна здійснити, використовуючи математичний алгоритм. Переважним необмежувальним прикладом математичного алгоритму, використовуваного для порівняння двох послідовностей, є алгоритм, описаний у публікації Karlin and Altschul (1990) Proc. Natl. Acad. Sci. USA 87:2264, модифікований, як описано в Karlin and Altschul (1993) Proc. Natl. Acad. Sci. USA 90:5873-5877. Такий алгоритм включений у програми NBLAST і XBLAST, Altschul et al. (1990) J. Mol. Biol. 215:403. Пошуки нуклеотидів BLAST можуть бути здійснені з використанням програми NBLAST, рахунок = 100, довжина слова = 12, щоб одержати нуклеотидні послідовності, гомологічні молекулам нуклеїнових кислот відповідно до винаходу. Пошуки білків BLAST можуть бути здійснені з використанням програми XBLAST, рахунок = 50, довжина слова = 3, щоб одержати 11 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 амінокислотні послідовності, гомологічні молекулам білків відповідно до винаходу. Щоб одержати вирівнювання з пробілами з метою порівняння, можна використовувати Gapped BLAST, що описаний у Altschul et al. (1997) Nucleic Acids Res. 25:3389. Альтернативно можна використовувати PSI-Blast, щоб здійснити ітераційний пошук, який дозволяє виявляти віддалені взаємозв'язки між молекулами. Див. Altschul et al. (1997) вище. У випадку застосування програм BLAST, Gapped BLAST і PSI-Blast можна використовувати параметри за замовчуванням відповідних програм (наприклад, XBLAST і NBLAST). Іншим переважним необмежувальним прикладом математичного алгоритму, використовуваного для порівняння послідовностей, є алгоритм, описаний у Myers and Miller (1988) CABIOS 4:11-17. Такий алгоритм включений у програму ALIGN (версія 2.0), яка є частиною пакета комп'ютерних програм для вирівнювання послідовностей GCG. У випадку застосування програми ALIGN для порівняння амінокислотних послідовностей можна використовувати матрицю ваг залишків PAM120, штраф за довжину пробілу 12 і штраф за пробіл 4. Вирівнювання також можна здійснювати вручну за допомогою перегляду. Якщо не зазначене інше, значення ідентичності/подібності послідовностей, наведені в даному описі, стосуються значення, одержаного з використанням повнорозмірних послідовностей відповідно до винаходу і з використанням множинного вирівнювання за допомогою алгоритму Clustal W (Nucleic Acid Research, 22(22):4673-4680, 1994), із застосуванням програми AlignХ, що входить у пакет комп'ютерних програм Vector NTI Advance 10 (Invitrogen, Carlsbad, CA, USA) з параметрами за замовчуванням; або будь-якої еквівалентної програми. Під "еквівалентною програмою" мають на увазі будь-яку програму для порівняння послідовностей, яка у випадку будь-яких двох розглянутих послідовностей здійснює вирівнювання, що дає ідентичні збіги нуклеотидів або амінокислотних залишків і однакову ідентичність послідовностей у відсотках у порівнянні з відповідним вирівнюванням, здійснюваним за допомогою AlignХ, що входить у пакет комп'ютерних програм Vector NTI Advance 10. Мутантні білки AHASL відповідно до винаходу охоплюють описані білки, а також їх варіанти і модифіковані форми. Такі варіанти продовжують мати необхідну мутантну активність AHAS. В одному варіанті такі мутації в молекулі нуклеїнової кислоти, що кодують варіант білка, не повинні виводити послідовність з рамки зчитування і переважно, не будуть створювати комплементарні області, які можуть викликати утворення вторинної структури мрнк. Див. заявку на видачу патенту EP № 75444. В одному варіанті послідовності згідно із даним винаходом кодують білки, що мають активність AHAS. Таку активність можна оцінити в результаті скринінгу активності AHAS, наприклад, як описано в публікації Singh зі співавторами (1988) Anal. Biochem. 171:173-179, включеній в даний опис у вигляді посилання. Варіанти нуклеотидної послідовності і білки також охоплюють послідовності і білки, одержані за допомогою способів мутагенезу і рекомбінації, таких як перетасування ДНК. У випадку такого способу одну або більше різних кодуючих послідовностей AHASL можна піддати обробці, щоб створити новий білок AHASL, який має необхідні властивості. Таким чином створюють бібліотеки рекомбінантних нуклеїнових кислот з популяції споріднених послідовностей нуклеїнових кислот, які містять області послідовності, що мають значиму ідентичність послідовностей і можуть бути піддані гомологічній рекомбінації in vitro або in vivo. Наприклад, з використанням зазначеного способу мотиви послідовності, які кодують домен, що представляє інтерес, можуть бути перетасовані між геном AHASL відповідно до винаходу й іншими відомими генами AHASL, щоб одержати новий ген, що кодує білок з поліпшеною властивістю, що представляє інтерес, такою як підвищений K m у випадку ферменту. Методики такого перетасування ДНК відомі в даній галузі. Див., наприклад, Stemmer (1994) Proc. Natl. Acad. Sci. USA 91:10747-10751; Stemmer (1994) Nature 370:389-391; Crameri et al. (1997) Nature Biotech. 15:436-438; Moore et al. (1997) J. Mol. Biol. 272:336-347; Zhang et al. (1997) Proc. Natl. Acad. Sci. USA 94:4504-4509; Crameri et al. (1998) Nature 391:288-291; і патенти США №№ 5605793 і 5837458. Нуклеотидні послідовності відповідно до винаходу можуть бути використані для виділення відповідних послідовностей з інших організмів, зокрема з інших рослин, більш конкретно інших дводольних рослин. Таким чином, способи, такі як ПЛР, гібридизація і тому подібні, можуть бути використані для ідентифікації таких послідовностей на основі гомології їх послідовностей з послідовностями, зазначеними в даному описі. Послідовності, виділені на основі ідентичності їх послідовностей з повними послідовностями AHASL, зазначеними в даному описі, або з їх фрагментами, входять в обсяг даного винаходу. Таким чином, ізольовані послідовності, які 12 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 60 кодують білок AHASL і які гібридизуються в жорстких умовах з послідовністю, описаною в даній публікації, або з її фрагментами, входять в обсяг даного винаходу. У випадку застосування способу ПЛР можуть бути сконструйовані олігонуклеотидні праймери для використання в реакціях ПЛР, щоб ампліфікувати відповідні послідовності ДНК із кДНК або геномної ДНК, екстрагованої з будь-якої рослини, що представляє інтерес. Способи конструювання праймерів для ПЛР і ПЛР-клонування, загалом, відомі в даній галузі й описані в Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual (2nd ed., Cold Spring Harbor Laboratory Press, Plainview, New York). Див. також Innis et al., eds. (1990) PCR Protocols: A Guide to Methods and Applications (Academic Press, New York); Innis and Gelfand, eds. (1995) PCR Strategies (Academic Press, New York); і Innis and Gelfand, eds. (1999) PCR Methods Manual (Academic Press, New York). Відомі способи ПЛР включають без обмеження способи з використанням спарених праймерів, вкладених праймерів, окремих специфічних праймерів, вироджених праймерів, специфічних для гена праймерів, специфічних для вектора праймерів, частково помилково спарюваних праймерів і тому подібних. Конструкції Молекули нуклеїнових кислот згідно із даним винаходом можна використовувати для одержання конструкцій рекомбінантних нуклеїнових кислот. В одному варіанті молекули нуклеїнових кислот відповідно до винаходу можна використовувати для одержання конструкцій нуклеїнових кислот, наприклад, касет експресії для експресії в рослині, що представляє інтерес. Касета експресії може містити регуляторні послідовності, оперативно зв'язані з послідовністю нуклеїнової кислоти AHASL відповідно до винаходу. Касета додатково може містити щонайменше один додатковий ген, який необхідний для котрансформації організму. Альтернативно додатковий ген (гени) може знаходитися в касетах для множинної експресії. Конструкції нуклеїнових кислот можуть бути забезпечені множиною сайтів рестрикції для інсерції послідовності нуклеїнової кислоти AHASL під транскрипційним контролем регуляторних областей. Конструкції нуклеїнових кислот додатково можуть містити молекули нуклеїнових кислот, які кодують гени селектованих маркерів. В одному варіанті касета експресії містить у 5'-3'-напрямку транскрипції область ініціації транскрипції і трансляції (тобто, промотор), послідовність нуклеїнової кислоти AHASL відповідно до винаходу й область термінації транскрипції і трансляції (тобто, область термінації), які функціонують у рослинах. Для одержання конструкцій нуклеїнових кислот можна використовувати будь-який промотор. Промотор може бути нативним або аналогічним або чужорідним або гетерологічним стосовно рослини-хазяїна і/або послідовності нуклеїнової кислоти AHASL відповідно до винаходу. Крім того, промотор може являти собою природну послідовність або альтернативно синтетичну послідовність. У тому випадку, коли промотор є "чужорідним" або "гетерологічним" стосовно рослини-хазяїна, мається на увазі, що промотор не зустрічається в нативній рослині, у яку вводять промотор. У тому випадку, коли промотор є "чужорідним" або "гетерологічним" стосовно послідовності нуклеїнової кислоти AHASL відповідно до винаходу, мається на увазі, що промотор не є нативним промотором або промотором, що зустрічається в природі, для оперативно зв'язаної послідовності нуклеїнової кислоти AHASL відповідно до винаходу. У використовуваному в даному описі розумінні химерний ген містить кодуючу послідовність, оперативно зв'язану з областю ініціації транскрипції, яка є гетерологічною стосовно кодуючої послідовності. Хоча переважно, можна експресувати молекули нуклеїнових кислот AHASL відповідно до винаходу з використанням гетерологічних промоторів, можна використовувати нативні промоторні послідовності при одержанні конструкцій. Такі конструкції можуть змінювати рівні експресії білка AHASL у рослині або рослинній клітині. Таким чином, змінюється фенотип рослини або рослинної клітини. Можна використовувати будь-який промотор при одержанні конструкцій для регуляції експресії кодуючої послідовності AHAS, такий як промотори, пропоновані для конститутивної, переважної для визначеної тканини, індукованої експресії, або інші промотори для експресії в рослинах. Конститутивні промотори включають, наприклад, коровий промотор Rsyn7 і інші конститутивні промотори, описані в WO 99/43838 і патенті США № 6072050; коровий промотор CaMV 35S (Odell et al. (1985) Nature 313:810-812); промотор актину рису (McElroy et al. (1990) Plant Cell 2:163-171); убіквітину (Christensen et al. (1989) Plant Mol. Biol. 12:619-632 і Christensen et al. (1992) Plant Mol. Biol. 18:675-689); pEMU (Last et al. (1991) Theor. Appl. Genet. 81:581-588); MAS (Velten et al. (1984) EMBO J. 3:2723-2730); промотор ALS (патент США № 5659026) і тому подібні. Інші конститутивні промотори включають, наприклад, промотори, описані в патентах США №№ 5608149, 5608144, 5604121, 5569597, 5466785, 5399680, 5268463, 5608142 і 6177611. 13 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 Переважні для тканини промотори можуть бути використані для забезпечення цілеспрямованої експресії AHASL у конкретній рослинній тканині. Такі переважні для тканини промотори включають без обмеження переважні для листів промотори, переважні для коренів промотори, переважні для насіння промотори і переважні для стебла промотори. Переважні для тканини промотори включають промотори, описані в Yamamoto et al. (1997) Plant J. 12(2):255265; Kawamata et al. (1997) Plant Cell Physiol. 38(7):792-803; Hansen et al. (1997) Mol. Gen Genet. 254(3):337-343; Russell et al. (1997) Transgenic Res. 6(2):157-168; Rinehart et al. (1996) Plant Physiol. 1 12(3):1331-1341; Van Camp et al. (1996) Plant Physiol. 1 12(2):525-535; Canevascini et al. (1996) Plant Physiol. 112(2):513-524; Yamamoto et al. (1994) Plant Cell Physiol. 35(5):773-778; Lam (1994) Results Probl. Cell Differ. 20:181-196; Orozco et al. (1993) Plant Mol Biol. 23(6):1129-1138; Matsuoka et al. (1993) Proc Natl. Acad. Sci. USA 90(20):9586-9590; і Guevara-Garcia et al. (1993) Plant J. 4(3):495-505. Конструкції нуклеїнових кислот також можуть містити області термінації транскрипції. У випадку використання областей термінації транскрипції можна використовувати будь-яку область термінації при одержанні конструкцій нуклеїнових кислот. Наприклад, область термінації може бути нативною стосовно області ініціації транскрипції, може бути нативною стосовно оперативно зв'язаної послідовності AHASL, що представляє інтерес, може бути нативною стосовно хазяїна або може бути одержана з іншого джерела (тобто, бути чужорідною або гетерологічною стосовно промотору, молекули нуклеїнової кислоти AHASL, що представляє інтерес, хазяїна або будь-якого їх сполучення). Приклади областей термінації, що доступні для застосування в конструкціях згідно із даним винаходом, включають області термінації з Tiплазміди A. tumefaciens, такі як області термінації октопінситази і нопалінсинтази. Див. також Guerineau et al. (1991) Mol. Gen. Genet. 262:141-144; Proudfoot (1991) Cell 64:671-674; Sanfacon et al. (1991) Genes Dev. 5:141-149; Mogen et al. (1990) Plant Cell 2:1261-1272; Munroe et al. (1990) Gene 91:151-158; Ballas et al. (1989) Nucleic Acids Res. 17:7891-7903; and Joshi et al. (1987) Nucleic Acid Res. 15:9627-9639. У деяких варіантах нуклеїнові кислоти можуть бути оптимізовані для підвищеної експресії в трансформованій рослині. Тобто, нуклеїнові кислоти, які кодують мутантні білки AHASL, можуть бути синтезовані з використанням переважних для рослини кодонів для підвищеної експресії. Див., наприклад, публікацію Campbell and Gowri (1990) Plant Physiol. 92:1-11, у якій обговорюється переважне для хазяїна використанням кодонів. У даній галузі наявні способи синтезу переважних для рослини генів. Див., наприклад, патенти США №№ 5380831 і 5436391 і публікацію Murray et al. (1989) Nucleic Acids Res. 17:477-498, включені в даний опис у вигляді посилання. Крім того, можуть бути здійснені додаткові модифікації послідовностей нуклеїнових кислот, описаних у даній публікації. Наприклад, відомо, що додаткові модифікації послідовностей підсилюють експресію генів у клітині-хазяїні. Такі модифікації включають виключення послідовностей, що кодують помилкові сигнали поліаденілювання, сигнали сайтів екзонінтронного сплайсингу, подібні транспозонам повтори, і інших добре охарактеризованих послідовностей, що можуть шкодити експресії генів. Вміст G-C у послідовності можна коректувати до середніх рівнів для даної клітини-хазяїна, які розраховують на основі відомих генів, ексрпесованих у клітині-хазяїні. Крім того, послідовність може бути модифікована так, щоб уникнути утворення передбачуваних вторинних структур мрнк у вигляді шпильок. Інші послідовності нуклеїнових кислот також можна використовувати при одержанні конструкцій згідно із даним винаходом, наприклад, для посилення експресії кодуючої послідовності AHAS. До таких послідовностей нуклеїнових кислот належать інтрони гена AdhІ intron1 кукурудзи (Callis et al. Genes and Development 1:1183-1200, 1987) і лідерні послідовності (W-послідовність) з вірусу мозаїки тютюну (TMV), вірусу хлоротичної плямистості кукурудзи і вірусу мозаїки люцерни (Gallie et al. Nucleic Acid Res. 15:8693-8711, 1987 і Skuzeski et al. Plant Mol. Biol. 15:65-79, 1990). Показано, що перший інтрон з локусу shrunkent-1 кукурудзи збільшує експресію генів у химерних генних конструкціях. У патентах США №№ 5424412 і 5593874 розкрите застосування специфічних інтронів у експресуючих генних конструкціях, і в публікації Gallie et al. (Plant Physiol. 106:929-939, 1994) також показано, що інтрони застосовні для регуляції експресії генів на тканиноспецифічній основі. Щоб додатково підсилити або оптимізувати експресію гена великої субодиниці AHAS, експресуючі вектори рослин відповідно до винаходу також можуть містити послідовності ДНК, що містять області прикріплення до матриксу (MAR). Рослинні клітини, трансформовані такими модифікованими системами експресії, потім можуть здійснювати надекспресію або конститутивну експресію нуклеотидної послідовності відповідно до винаходу. 14 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 Конструкції нуклеїнових кислот згідно із даним винаходом додатково можуть містити 5'лідерні послідовності в конструкції касети експресії. Такі лідерні послідовності можуть діяти, підсилюючи трансляцію. Лідери трансляції відомі в даній галузі і включають: лідери пікорнавірусів, наприклад, лідер EMCV (5'-некодуюча область енцефаломіокардиту) (Elroy-Stein et al. (1989) Proc. Natl. Acad. Sci. USA 86:6126-6130); лідери потивірусів, наприклад, лідер TEV (вірусу гравірування тютюну) (Gallie et al. (1995) Gene 165(2):233-238), лідер MDMV (вірусу карликової мозаїки кукурудзи) (Virology 154:9-20), і білок, що зв'язує важкий ланцюг імуноглобуліну людини (BiР) (Macejak et al. (1991) Nature 353:90-94); нетрансльований лідер із мрнк білка оболонки вірусу мозаїки люцерни (AMV RNA 4) (Jobling et al. (1987) Nature 325:622625); лідер вірусу мозаїки тютюну (TMV) (Gallie et al. (1989) у Molecular Biology of RNA, ed. Cech (Liss, New York), pp.237-256); і лідер вірусу хлоротичної плямистості кукурудзи (MCMV) (Lommel et al. (1991) Virology 81:382-385). Також див. Della-Cioppa et al. (1987) Plant Physiol. 84:965-968. Також можна використовувати інші способи, які, як відомо, підсилюють трансляцію, наприклад, з використанням інтронів і тому подібного. При одержанні конструкцій нуклеїнових кислот можна піддавати обробці різні фрагменти ДНК так, щоб одержати послідовності ДНК у правильній орієнтації і, у відповідному випадку, у правильній рамці зчитування. Для цієї мети можна використовувати адаптери і лінкери, щоб зв'язати фрагменти ДНК, або можна використовувати інші маніпуляції, щоб ввести придатні сайти рестрикції, видалити надлишкову ДНК, видалити сайти рестрикції або тому подібне. Для зазначеної мети можна використовувати мутагенез in vitro, репарацію з праймерами, рестрикцію, відпалювання, повторні заміни, наприклад, транзиції і трансверсії. Експресуючі конструкції згідно із даним винаходом також можуть містити послідовності нуклеїнових кислот, здатні направляти експресію послідовності AHAS у мішень - хлоропласт. Такі послідовності нуклеїнових кислот включають в себе направляючі в хлоропласт послідовності, що кодують транзитний пептид хлоропласта, для того, щоб направити продукт гена, що представляє інтерес, у хлоропласти рослинних клітин. Такі транзитні пептиди відомі в даній галузі. Що стосується направляючих у хлоропласт послідовностей, то "оперативно зв'язана" означає, що послідовність нуклеїнової кислоти, яка кодує транзитний пептид (тобто, направляюча в хлоропласт послідовність), зв'язана з молекулою нуклеїнової кислоти AHASL відповідно до винаходу так, що дві послідовності безпосередньо ідуть одна за одною і знаходяться в одній і тій же рамці зчитування. Див., наприклад, Von Heijne et al. (1991) Plant Mol. Biol. Rep. 9: 104-126; Clark et al. (1989) J. Biol. Chem. 264: 17544-17550; Della-Cioppa et al. (1987) Plant Physiol. 84:965-968; Romer et al. (1993) Biochem. Biophys. Res. Commun. 196:1414-1421; і Shah et al. (1986) Science 233:478-481. Хоча білки AHASL відповідно до винаходу включають в себе нативний транзитний пептид хлоропласта, будь-який транзитний пептид хлоропласта, відомий у даній галузі, може бути злитий з амінокислотною послідовністю зрілого білка AHASL відповідно до винаходу за допомогою оперативного зв'язування направляючої в хлоропласт послідовності з 5'-кінцем нуклеотидної послідовності, що кодує зрілий білок AHASL відповідно до винаходу. Направляючі в хлоропласт послідовності відомі в даній галузі і включають малу субодиницю рибулозо-1,5-біфосфаткарбоксилази хлоропласта (Rubisco) (de Castro Silva Filho et al. (1996) Plant Mol. Biol. 30:769-780; Schnell et al. (1991) J. Biol. Chem. 266(5):3335-3342); 5(енолпірувіл)шикімат-3-фосфатсинтазу (EPSPS) (Archer et al. (1990) J. Bioenerg. Biomemb. 22(6):789-810); триптофансинтазу (Zhao et al. (1995) J. Biol. Chem. 270(11): 6081-6087); пластоціанін (Lawrence et al. (1997) J. Biol. Chem. 272(33):20357-20363); хоризматсинтазу (Schmidt et al. (1993) J. Biol Chem. 268(36):27447-27457) і світлозбиральний хлорофіл a/bзв’язувальний білок (LHBP) (Lamppa et al. (1988) J. Biol. Chem. 263:14996-14999). Див. також Von Heijne et al. (1991) Plant Mol. Biol. Rep. 9:104-126; Clark et al. (1989) J. Biol. Chem. 264:1754417550; Della-Cioppa et al. (1987) Plant Physiol. 84:965-968; Romer et al. (1993) Biochem. Biophys. Res. Commun. 196:1414-1421; і Shah et al. (1986) Science 233:478-481. В іншому варіанті конструкції нуклеїнових кислот можуть бути одержані для керування експресією мутантної кодуючої послідовності AHAS із хлоропластів рослинних клітин. Способи трансформації хлоропластів відомі в даній галузі. Див., наприклад, Svab et al. (1990) Proc. Natl. Acad. Sci. USA 87:8526-8530; Svab and Maliga (1993) Proc. Natl. Acad. Sci. USA 90:913-917; Svab and Maliga (1993) EMBOJ. 12:601-606. Спосіб оснований на використанні гармати для частинок для доставки ДНК, яка містить селектований маркер, і цілеспрямованому вбудовуванні ДНК у геном пластид за допомогою гомологічної рекомбінації. Крім того, трансформація пластид може бути здійснена за допомогою трансактивації мовчазного трансгена, який несуть пластиди, у результаті тканиноспецифічної експресії кодованої у ядрі і направленої в пластиди Рнк 15 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 60 полімерази. Така система описана в McBride et al. (1994) Proc. Natl. Acad. Sci. USA 91:73017305. Нуклеїнові кислоти, що представляють інтерес, які необхідно направити в хлоропласт, можуть бути оптимізовані для експресії в хлоропласті з урахуванням відмінностей у використанні кодонів між ядром рослини і даним органоїдом. Таким чином, нуклеїнові кислоти, що представляють інтерес, можуть бути синтезовані з використанням переважних для хлоропластів кодонів. Див., наприклад, патент США № 5380831, включений у даний опис у вигляді посилання. Конструкції нуклеїнових кислот можна застосовувати для трансформації рослинних клітин і регенерації трансгенних рослин, що містять мутантні кодуючі послідовності AHAS. Доступні численні трансформуючі рослини вектори і способи для трансформації рослин. Див., наприклад, патент США № 6753458, An, G. et al. (1986) Plant Physiol., 81:301-305; Fry, J. et al. (1987) Plant Cell Rep. 6:321-325; Block, M. (1988) Theor. Appl Genet.76:767-774; Hinchee et al. (1990) Stadler. Genet. Symp.203212.203-212; Cousins et al. (1991) Aust. J. Plant Physiol. 18:481494; Chee, P. P. and Slightom, J. L. (1992) Gene.118:255-260; Christou et al. (1992) Trends. Biotechnol. 10:239-246; D'Halluin et al. (1992) Bio/Technol. 10:309-314; Dhir et al. (1992) Plant Physiol. 99:81-88; Casas et al. (1993) Proc. Nat. Acad Sci. USA 90:11212-11216; Christou, P. (1993) In Vitro Cell. Dev. Biol.-Plant; 29P:119-124; Davies, et al. (1993) Plant Cell Rep. 12:180-183; Dong, J. A. and Mc Hughen, A. (1993) Plant Sci. 91:139-148; Franklin, C. I. and Trieu, T. N. (1993) Plant. Physiol. 102:167; Golovkin et al. (1993) Plant Sci. 90:41-52; Guo Chin Sci. Bull. 38:2072-2078; Asano, et al. (1994) Plant Cell Rep. 13; Ayeres N. M. and Park, W. D. (1994) Crit. Rev. Plant. Sci. 13:219-239; Barcelo et al. (1994) Plant. J. 5:583-592; Becker, et al. (1994) Plant. J. 5:299-307; Borkowska et al. (1994) Acta. Physiol Plant. 16:225-230; Christou, P. (1994) Agro. Food. Ind. Hi Tech. 5: 17-27; Eapen et al. (1994) Plant Cell Rep. 13:582-586; Hartman et al. (1994) Bio-Technology 12: 919923; Ritala et al. (1994) Plant. Mol. Biol. 24:317-325; і Wan, Y. C. and Lemaux, P. G. (1994) Plant Physiol. 104:3748. Конструкціями також можна трансформувати рослинні клітини, використовуючи гомологічну рекомбінацію. Описані конструкції, що містять послідовності AHASL згідно із даним винаходом, можна застосовувати в різних способах одержання трансгенних клітин-хазяїнів, таких як бактерії, дріжджі, і для трансформації рослинних клітин і в деяких випадках для регенерації трансгенних рослин. Наприклад, способи одержання трансгенної культурної рослини, що містить нуклеїнову кислоту, яка кодує мутантний AHASL, згідно із даним винаходом, коли експресія нуклеїнової кислоти (кислот) у рослині приводить до стійкості до гербіцидів у порівнянні з рослинами дикого типу або з рослинами з AHAS відомого мутантного типу, включають в себе: (a) введення в рослинну клітину експресуючого вектора, що містить нуклеїнову кислоту, яка кодує мутантний AHASL згідно із даним винаходом, і (b) створення з рослинної клітини трансгенної рослини, яка стійка до гербіцидів. Рослинні клітини для застосування в способах згідно із даним винаходом включають без обмеження протопласти, клітини, продукуючі гамети, і клітини, які регенерують у цілу рослину. У багатьох випадках, уся або частина рекомбінантної молекули нуклеїнової кислоти стабільно інтегрується в хромосому або стабільний позахромосомний елемент, так що вона передається наступним поколінням. Даний винахід можна застосовувати для трансформації будь-якого виду рослини, включаючи без обмеження однодольні і дводольні рослини. Приклади видів рослин, що представляють інтерес, включають без обмеження кукурудзу (Zea mays), види Brassica (наприклад, B. napus, B. rapa, B. juncea), зокрема види Brassica, застосовні як джерела олії, одержуваної з насіння, люцерну (Medicago sativa), рис (Oryza sativa), жито (Secale cereale), сорго (Sorghum bicolor, Sorghum vulgare), просо (наприклад, просо африканське (Pennisetum glaucum), просо звичайне (Panicum miliaceum), просо італійське (Setaria italica), елевзине (Eleusine coracana)), соняшник (Helianthus annuus), сафлор (Carthamus tinctorius), пшеницю (Triticum aestivum, T. Turgidum ssp. durum), сою (Glycine max), тютюн (Nicotiana tabacum), картоплю (Solanum tuberosum), арахіс (Arachis hypogaea), бавовник (Gossypium barbadense, Gossypium hirsutum), батат (Ipomoea batatus), маніок (Manihot esculenta), каву (Coffea spp.), кокос (Cocos nucifera), ананас (Ananas comosus), цитрусові дерева (Citrus spp.), какао (Theobroma cacao), чай (Camellia sinensis), банани (Musa spp.), авокадо (Persea americana), фігове дерево (Ficus casica), гуаву (Psidium guajava), манго (Mangifera indica), оливу (Olea europaea), папайю (Carica papaya), кеш’ю (Anacardium occidentale), макадамію (Macadamia integrifolia), мигдаль (Prunus amygdalus), цукровий буряк (Beta vulgaris), цукрова тростина (Saccharum spp.), овес (Avena sativa), ячмінь (Hordeum vulgare), овочі, декоративні рослини і хвойні. Переважно, рослини згідно із даним винаходом являють собою сільськогосподарські 16 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 60 рослини (наприклад, соняшник, види Brassica, бавовник, цукровий буряк, сою, арахіс, люцерну, сафлор, тютюн, кукурудзу, рис, пшеницю, жито, ячмінь, тритикале, сорго, просо і т. д.). Мутантні молекули нуклеїнової кислоти AHASL, що кодують поліпептиди AHASL відповідно до винаходу, також можна використовувати як селектовані маркери, наприклад, щоб ідентифікувати трансгенні клітини, що містять введені молекули нуклеїнових кислот, які кодують мутантні поліпептиди AHASL. В одному варіанті винахід стосується способу ідентифікації або відбору трансформованої рослинної клітини, рослинної тканини, рослини або її частини, який включає в себе: a) одержання трансформованої рослинної клітини, рослинної тканини, рослини або її частини, при цьому трансформована рослинна клітина, рослинна тканина, рослина або її частина містить ізольовану нуклеїнову кислоту, яка кодує мутантний поліпептид AHASL відповідно до винаходу, що описана вище, при цьому поліпептид використовують як селектований маркер, і при цьому трансформована рослинна клітина, рослинна тканина, рослина або її частина можуть необов'язково містити додаткову ізольовану нуклеїнову кислоту, що представляє інтерес; b) здійснення контакту трансформованої рослинної клітини, рослинної тканини, рослини або її частини щонайменше з одним інгібітором AHAS або сполукою, інгібуючою AHAS; c) визначення того, чи піддається рослинна клітина, рослинна тканина, рослина або її частина впливу інгібітору або інгібуючої сполуки; і d) ідентифікацію або відбір трансформованої рослинної клітини, рослинної тканини, рослини або її частини. Винахід також реалізований в очищених білках AHASL, що містять мутації, описані в даній публікації, які застосовні в дослідженнях з молекулярного моделювання з метою додаткового підвищення стійкості до гербіцидів. Способи очищення білка добре відомі і легко можуть бути здійснені з використанням комерційно доступних продуктів або спеціально розроблених способів, які зазначені, наприклад, у Protein Biotechnology, Walsh and Headon (Wiley, 1994). Даний винахід стосується рослин, рослинних тканин, рослинних клітин і клітин-хазяїнів, які резистентні або стійкі щонайменше до одного AHAS-інгібуючого гербіциду, такого як імідазоліноновий або сульфонілсечовинний гербіцид. У деяких варіантах рослини, рослинні тканини, рослинні клітини і клітини-хазяїни виявляють підвищену резистентність або підвищену стійкість щонайменше до одного AHAS-інгібуючого гербіциду. Термін "підвищена" стосується збільшення резистентності або стійкості в більшому ступені, ніж очікується. Переважна кількість або концентрація гербіциду є "ефективною кількістю" або "ефективною концентрацією". "Під ефективною кількістю" і "ефективною концентрацією" мають на увазі кількість і концентрацію, відповідно, які достатні для того, щоб убити або інгібувати ріст подібної рослини дикого типу, рослинної тканини, рослинної клітини, мікроспори або клітини-хазяїна, але така зазначена кількість не убиває або не інгібує так сильно ріст резистентної до гербіцидів рослини, рослинної тканини, рослинних клітин, мікроспор і клітин-хазяїнів згідно із даним винаходом. Звичайно ефективна кількість гербіциду являє собою кількість, яку звичайно використовують у системах виробництва сільськогосподарської продукції, щоб убити бур'яни, що представляють інтерес. Така кількість відома фахівцям у даній галузі або може бути легко визначена способами, відомими в даній галузі. Крім того, зрозуміло, що ефективна кількість гербіциду в системах виробництва сільськогосподарської продукції може в значній мірі відрізнятися від ефективної кількості гербіциду для системи культивування рослин, такої як, наприклад, система культивування мікроспор. Гербіциди згідно із даним винаходом являють собою гербіциди, що перешкоджають прояву активності ферменту AHAS, наприклад, активність AHAS знижується в присутності гербіциду. Такі гербіциди також можуть бути названі в даному описі "AHAS-інгібуючими гербіцидами" або просто "інгібіторами AHAS". У використовуваному в даному описі розумінні "AHAS-інгібуючий гербіцид" або "інгібітор AHAS" не означає обмеження одним гербіцидом, що перешкоджає прояву активності ферменту AHAS. Таким чином, якщо не зазначене або не очевидно з контексту інше, "AHAS-інгібуючий гербіцид" або "інгібітор AHAS" може означати один гербіцид або суміш двох, трьох, чотирьох або більше гербіцидів, кожний з який перешкоджає прояву активності ферменту AHAS. У використовуваному в даному описі розумінні і якщо чітко не зазначене інше термін "рослина" означає рослину на будь-якій стадії розвитку, а також будь-яку частину або частини рослини, що можуть бути не відділені або відділені від цілої інтактної рослини. Такі частини рослини включають без обмеження органи, тканини і клітини рослини, включаючи калуси рослин, скупчення рослинних клітин, протопласти рослин і культури рослинних клітин, з яких рослини можуть бути регенеровані. Приклади конкретних частин рослини включають стебло, лист, корінь, суцвіття, квітку, квітку компактного суцвіття, плід, квітконіжку, плодоніжку, тичинку, пиляк, приймочку, стовпчик, зав'язь, пелюсток, чашолисток, плодолистик, кінчик кореня, кореневий чохлик, кореневий волосок, листовий волосок, волосок насіння, пальцеве зерно, 17 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 60 мікроспору, зародок, насінний зачаток, сім'ядолю, гіпокотиль, епікотиль, ксилему, флоему, паренхіму, ендосперм, клітину-супутницю, замикаючу клітину і будь-які інші відомі органи, тканини і клітини рослини. Крім того, зрозуміло, що насіння стосується поняття "рослина". Рослини згідно із даним винаходом включають як нетрансгенні рослини, так і трансгенні рослини. Мається на увазі, що "нетрансгенна рослина" означає рослину, яка не має рекомбінантної ДНК у своєму геномі, але містить мутантну молекулу нуклеїнової кислоти в геномі рослинної клітини, що стала мутантною в результаті використання способу мутагенезу, такого як хімічний мутагенез, або способів мутагенезу, описаних в даній публікації. Нетрансгенні рослини не охоплюють рослини, які мають мутантні послідовності, що виникли в результаті природних процесів. Мають на увазі, що "трансгенна рослина" означає рослину, яка містить рекомбінантну ДНК у своєму геномі. Така трансгенна рослина може бути одержана введенням рекомбінантної ДНК у геном рослини. У тому випадку, коли таку рекомбінантну ДНК вводять у геном трансгенної рослини, потомство рослини також може містити рекомбінантну ДНК. Рослина-потомок, що містить щонайменше частину рекомбінантної ДНК щонайменше однієї трансгенної рослини-предка, також є трансгенною рослиною. Даний винахід також стосується рослин, резистентних до AHAS-гербіцидів, що містять молекули нуклеїнових кислот, описані в даній публікації. Рослини, резистентні до AHASгербіцидів, можуть бути нетрансгенними або трансгенними стійкими до гербіцидів рослинами, що містять молекулу нуклеїнової кислоти, яка кодує мутантний поліпептид AHASL, що описаний у даній публікації. Рослини, резистентні до AHAS-гербіцидів, можуть бути одержані в результаті перехресного запилення першої рослини з другою рослиною і забезпечення можливості продукування рослиною, що є акцептором пилка (такою рослиною може бути або перша, або друга рослина), насіння в результаті такого перехресного запилення. Насіння й одержані з них рослини-потомки можуть мати мутації, що потрапляють при схрещуванні в геном насіння і/або рослин-потомків. Рослиною-акцептором пилка може бути або перша, або друга рослина. Перша рослина містить першу молекулу нуклеїнової кислоти, яка кодує щонайменше один мутантний поліпептид AHASL, що описаний в даній публікації. Другою рослиною може бути будь-яка сумісна рослина, і така рослина може містити другу молекулу нуклеїнової кислоти, яка кодує такий же або інший мутантний поліпептид AHASL. Перший і другий мутантні поліпептиди AHASL можуть містити ту ж саму або різні амінокислотні заміни в порівнянні з поліпептидом AHASL дикого типу. Може бути відібране насіння або рослини-потомки, одержані в результаті схрещування, які містять одну молекулу нуклеїнової кислоти, яка кодує мутантний поліпептид AHASL, або дві молекули нуклеїнових кислот, які кодують два мутантних поліпептиди AHASL. Коли перша і друга рослини є гомозиготними по першій і другій молекулах нуклеїнової кислоти, відповідно, кожна з одержаних рослин-потомків містить одну копію першої молекули нуклеїнової кислоти й одну копію другої молекули нуклеїнової кислоти, і стадію селекції можна пропустити. Коли щонайменше одна з рослин, перша або друга, є гетерозиготною, у результаті селекції можуть бути відібрані рослини-потомки, що містять обидві молекули нуклеїнової кислоти, наприклад, у результаті аналізу ДНК рослин-потомків, щоб ідентифікувати рослинипотомки, що містять і першу, і другу молекули нуклеїнової кислоти, або в результаті тестування рослин-потомків стосовно підвищеної стійкості до гербіцидів. У деяких варіантах рослини, які містять послідовності нуклеїнових кислот згідно із даним винаходом, можуть бути одержані з використанням нетрансгенних способів, таких як способи сайт-специфічного мутагенезу, включаючи способи, описані, наприклад, у міжнародній заявці PCT/US00/23457 або в патентах США №№ 6271360, 6479292 і 7094606. В одному варіанті такі способи можуть полягати в застосуванні опосередкованої специфічними олігонуклеотидами репарації генів з метою введення точкових мутацій у геном клітини-хазяїна і можуть включати в себе використання однониткових олігонуклеотидів, таких як олігонуклеїнові основи для репарації генів (див. патенти США №№ 6870075 і 5565350). Олігонуклеїнова основа являє собою полімер, що містить нуклеїнові основи, і такий полімер може гібридизуватися завдяки спарюванню основ Уотсона-Кріка з ДНК, що має комплементарну послідовність. Нуклеїнові основи включають в себе основу, яка являє собою пурин, піримідин або їх похідне або аналог. Нуклеїнові основи включають в себе пептидонуклеїнові основи, субодиниці пептидонуклеїнових кислот і морфолінові нуклеїнові основи, а також нуклеозиди і нуклеотиди. Нуклеозиди є нуклеїновими основами, що містять залишок пентозофуранозилу, наприклад, необов'язково заміщений рибозид або 2'-дезоксирибозид. Нуклеозиди можуть бути зв'язані одним з декількох зв’зувальних залишків, які можуть містити або можуть не містити фосфору. Нуклеозиди, що зв'язані незаміщеними фосфодіефірними зв'язками, називають нуклеотидами. Ланцюг олігонуклеїнових основ має окремі 5'- і 3'-кінці, які являють собою кінцеві нуклеїнові основи. Конкретний олігонуклеїновий ланцюг може містити нуклеїнові основи всіх типів. Олігонуклеїнова 18 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 60 сполука являє собою сполуку, що містить один або більше олігонуклеїнових ланцюгів, які є комплементарними і гібридизуються завдяки спарюванню основ Уотсона-Кріка. Нуклеїнові основи є або дезоксириботипу, або риботипу. Нуклеїнові основи риботипу є нуклеїновими основами, що містять пеноктозофуранозил, де 2'-вуглець представлений метиленом, заміщеним гідроксилом, алкоксигрупою або галогеном. Нуклеїнові основи дезоксириботипу являють собою нуклеїнові основи, відмінні від нуклеїнових основ риботипу, і включають усі нуклеїнові основи, що не містять залишку пентозофуранозилу. Однониткові олігонуклеотидні мутагенізуючі вектори (SSMOV) можуть бути одержані для введення мутацій у кодуючу послідовність AHAS. SSMOV можуть бути одержані відповідно до міжнародної заявки на видачу патенту PCT/US00/23457 і патентів США №№ 6271360, 6479292 і 7094606. Послідовність SSOMV може бути основана на таких же принципах, як у випадку мутагенізуючих векторів, описаних у патентах США №№ 5565350, 5731181, 5756325, 5871984, 5760012, 5888983, 5795972, 5780296, 5945339, 6004804 і 6010907 і в міжнародних публікаціях № WO 98/49350, WO 99/07865, WO 99/58723, WO 99/58702 і WO 99/40789. В одному варіанті послідовність SSOMV містить дві області, що гомологічні послідовності-мішені, розділені областю, що містить необхідну генетичну зміну, яка називається мутаторною областю. Мутаторна область може мати послідовність, що має таку ж довжину, як і послідовність, що розділяє гомологічні області в послідовності-мішені, але має іншу послідовність. Така мутаторна область може викликати заміну. Альтернативно, гомологічні області в SSOMV можуть безупинно іти одна за одною, тоді як області в гені-мішені, що мають таку ж послідовність, розділені одним, двома або більшою кількістю нуклеотидів. Такий SSOMV викликає делецію з гена-мішені нуклеотидів, які відсутні в SSOMV. Нарешті, послідовність гена-мішені, що ідентична гомологічним областям, може бути розташована поруч у гені-мішені, але відділена одним, двома або більшою кількістю нуклеотидів у послідовності SSOMV. Такий SSOMV викликає інсерцію в послідовність гена-мішені. У деяких варіантах нуклеотиди SSOMV являють собою дезоксирибонуклеотиди, які зв'язані немодифікованими фосфодіефірними зв'язками, за винятком того, що 5'-кінцевий і/або 3'кінцевий міжнуклеотидний зв'язок або альтернативно два 5'-кінцеві і/або 3'-кінцеві міжнуклеотидні зв'язки можуть бути фосфоротіоатними або фосфоамідатними. У використовуваному в даному описі розумінні міжнуклеотидний зв'язок являє собою зв'язок між нуклеотидами SSOMV і не включає зв'язок між 5'-кінцевим нуклеотидом або 3'-кінцевим нуклеотидом і блокувальним замісником. В одному конкретному варіанті довжина SSOMV складає від 21 до 60 дезоксинуклеотидів, і області гомології, відповідно, мають загальну довжину щонайменше 20 дезоксинуклеотидів, і щонайменше дві області гомології повинні мати довжини щонайменше 8 дезоксинуклеотидів кожна. SSOMV можуть бути сконструйовані так, щоб вони були комплементарними або кодуючій, або некодуючій нитці гена-мішені. Коли необхідна мутація являє собою заміну однієї основи, переважно, щоб мутаторний нуклеотид був піримідиновим. У тих межах, які узгоджуються з досягненням необхідного функціонального результату, переважно, щоб і мутаторний нуклеотид, і нуклеотид, що є мішенню, у комплементарній нитці були піримідиновими. В одному варіанті SSOMV, що кодують мутації трансверсії, тобто, нуклеотид мутатора C або T помилково спарюються, відповідно, з нуклеотидом C або T у комплементарній нитці. Крім олігодезоксинуклеотиду SSOMV може містити 5'-блокувальний замісник, що зв'язаний з 5'-кінцевими атомами вуглецю через лінкер. Хімічна природа лінкера може бути будь-якою, і він має довжину щонайменше 6 атомів, і лінкер переважно, є гнучким. Можна використовувати множину нетоксичних замісників, таких як біотин, холестерин або інші стероїди або неінтеркалюючий катіонний флуоресціюючий барвник. Прикладами реагентів для одержання TM TM SSOMV є реагенти, що продаються як Cy3 і Cy5 , Glen Research, Sterling Va. (на даний час GE Healthcare), які є блокованими фосфороамідитами, що при включенні в олігонуклеотид дають 3,3,3',3'-тетраметил-N,N'-ізопропілзаміщені індомонокарбоціанінові і індодикарбоціанінові барвники, відповідно. В одному варіанті реагентом є Cy3. Коли індокарбоціанін є Nоксіалкілзаміщеним, він може бути просто зв'язаний з 5'-кінцем олігодезоксинуклеотиду фосфодіефірним зв'язком з 5'-кінцевим фосфатом. Хімічна природа лінкера для барвника між барвником і олігодезоксинуклеотидом не є вирішальною, і лінкер вибирають так, щоб він був зручним для синтезу. Коли використовують комерційно доступний фосфорамідит Cy3, як зазначено, одержана в результаті 5'-модифікація складається з блокувального замісника і лінкера, які разом являють собою N-гідроксипропіл-N'-фосфатидилпропіл-3,3,3',3'тетраметиліндомонокарбоціанін. В одному варіанті індокарбоціаніновий барвник є тетразаміщеним у 3- і 3'-положеннях індольних циклів. Без обмеження якою-небудь теорією такі заміщення перешкоджають тому, що 19 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 60 барвник стане інтеркалюючим барвником. Конкретні замісники в таких положеннях не є вирішальними. SSOMV, крім того, може мати 3'-блокувальний замісник. І також хімічна природа 3'-блокувального замісника не є вирішальною. Зміна, що вводиться в ген AHAS, може бути здійснена в будь-якій області послідовності нуклеїнової кислоти, включаючи кодуючі і некодуючі області. В одному варіанті зміна, що вводиться в ген-мішень (AHAS), кодується гетерологічною областю. Зміна, що вводиться в ген, може являти собою зміну в одній або більше основах послідовності гена (тобто, заміну) або додавання, або делецію однієї або більше основ. Даний винахід також стосується резистентної до гербіцидів лінії Brassica, яку у даному описі називають BnCL120C7. Депонування щонайменше 2500 насінин лінії Brassica BnCL120C7 у депозитарії для потреб патентування Американської колекції типів культур (ATCC), Manassas, VA 20110 USA, здійснене 23 червня 2008, і патентованому депозиту наданий номер ATCC PTA9278. Даний винахід також стосується резистентної до гербіцидів лінії Brassica, яку у даному описі називають BnCL131A1. Депонування щонайменше 2500 насінин лінії Brassica BnCL131A1 здійснене 23 червня 2008, і патентованому депозиту наданий номер ATCC PTA-9279. Даний винахід також стосується резистентної до гербіцидів лінії Brassica, яку називають у даному описі BnCL140B3. Депонування щонайменше 2500 насінин лінії Brassica BnCL140B3 у депозитарії для потреб патентування Американської колекції типів культур (ATCC), Manassas, VA 20110 USA, здійснене 27 серпня 2008, і патентованому депозиту наданий номер ATCC PTA-9402. Даний винахід також стосується резистентної до гербіцидів лінії Brassica, яка у даному описі названа BnCL140C7. Депонування щонайменше 2500 насінин лінії Brassica BnCL140C7 у депозитарії для потреб патентування Американської колекції типів культур (ATCC), Manassas, VA 20110 USA, здійснене 27 серпня 2008, і патентованому депозиту наданий номер ATCC PTA-9403. Даний винахід також стосується резистентної до гербіцидів лінії Brassica, яка у даному описі названа PM1PM2/BnCL131A1. Депонування щонайменше 2500 насінин лінії Brassica PM1PM2/BnCL131A1 у депозитарії для потреб патентування Американської колекції типів культур (ATCC), Manassas, VA 20110 USA, здійснене 9 вересня 2009, і патентованому депозиту наданий номер ATCC PTA-10321. Депозит буде зберігатися за умовами Будапештського договору про міжнародне визнання депонування мікроорганізмів для цілей патентної процедури. Депозит ліній Brassica BnCL120C7, BnCL131A1, BnCL140B3, BnCL140C7 і PM1PM2/BnCL131A1 поміщений на термін щонайменше 30 років і буде зберігатися щонайменше 5 років з моменту останнього запиту про видачу зразка депозиту, одержаного ATCC. Крім того, заявники задовольнили усі вимоги статті 37 C.F.R. §§ 1.801-1.809, включаючи надання свідчення про життєздатність зразка. Мутантні резистентні до гербіцидів лінії Brassica BnCL120C7, BnCL131A1, BnCL140B3 і BnCL140C7, наведені як приклад у даному винаході, одержували з використанням методики сайт-специфічного мутагенезу, як описано в прикладах. Однак даний винахід не обмежений резистентними до гербіцидів рослинами Brassica, які одержані такими способами. Будь-який спосіб мутагенезу, відомий у даній галузі, може бути використаний для одержання резистентних до гербіцидів рослин Brassica згідно із даним винаходом. Такі способи мутагенезу можуть включати в себе, наприклад, використання будь-якого одного або більше з наступних мутагенів: випромінювання, такого як рентгенівське випромінювання, гамма-випромінювання (наприклад, кобальт-60 або цезій-137), нейтрони (наприклад, продукт поділу ядра урану-235 в атомному реакторі), бета-випромінювання (наприклад, випромінюване радіоактивними ізотопами, такими як фосфор-32 або вуглець-14) і ультрафіолетове випромінювання (переважно, від 250 до 290 нм), і хімічних мутагенів, таких як етилметансульфонат (EMS), аналоги основ (наприклад, 5бромурацил), споріднені сполуки (наприклад, 8-етоксикофеїн), антибіотики (наприклад, стрептонігрин), алкілувальні агенти (наприклад, сірчистий іприт, азотистий іприт, епоксиди, етиленаміни, сульфати, сульфонати, сульфони, лактони), азид, гідроксиламін, азотиста кислота або акридини. Резистентні до гербіцидів рослини також можуть бути одержані з використанням способів культивування тканин, щоб відібрати рослинні клітини, які містять мутації резистентності до гербіцидів, і потім з них регенерувати резистентні до гербіцидів рослини. Див., наприклад, патенти США №№ 5773702 і 5859348, що включені в даний опис у вигляді посилання в повному обсязі. Додаткові подробиці мутаційної селекції можна знайти в публікації "Principals of Cultivar Development", Fehr, 1993 Macmillan Publishing Company, зміст якої включений в даний опис у вигляді посилання. Крім того, можна використовувати сайтспецифічний мутагенез, щоб одержати мутантні послідовності AHASL у рослинній клітиніхазяїні, які описані в даній публікації. Рослини Brassica відповідно до винаходу додатково включають рослини, які містять, у порівнянні з білком AHASL дикого типу, аспарагін у положенні амінокислоти 653 (номенклатура 20 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 60 для A. thaliana), треонін у положенні амінокислоти 122 (номенклатура для A. thaliana) і одну або більше додаткових амінокислотних замін у білку AHASL у порівнянні з білком AHASL дикого типу, при цьому така рослина Brassica має підвищену резистентність щонайменше до одного гербіциду в порівнянні з рослиною Brassica дикого типу. Рослини і способи селекції Резистентні до AHAS-гербіцидів рослини і потомство таких рослин згідно із даним винаходом, такі як резистентні до AHAS-гербіцидів рослини Brassica, можна застосовувати в способах одержання резистентних рослин, рослин, що мають підвищену стійкість до AHASгербіцидів, і насіння таких рослин. Таким чином, наприклад, рослини Brassica, описані в даній публікації, можуть бути використані в програмах селекції, щоб створити додаткові стійкі до гербіцидів рослини, такі як комерційні сорти B. napus (наприклад, канола). Відповідно до таких способів перша батьківська рослина може бути використана в схрещуваннях із другою батьківською рослиною, при цьому щонайменше одна з зазначених двох батьківських рослин, перша або друга, містить щонайменше одну послідовність нуклеїнової кислоти AHASL згідно із даним винаходом, наприклад, молекулу нуклеїнової кислоти, яка кодує поліпептид AHASL, що має мутацію A122T і мутацію S653N. Одним із застосувань способу є застосування для одержання гібридних рослин F1. Інший важливий аспект такого способу полягає в тому, що спосіб може бути використаний для створення нових батьківських дигаплоїдних або інбредних ліній. Наприклад, лінія рослини, яка описана в даній публікації, може бути схрещена з будь-якою другою рослиною, і одержане гібридне потомство піддане самозапиленню і/або схрещуванню між сибсами протягом приблизно 5-7 поколінь або більшої кількості поколінь, з одержанням таким чином великої кількості окремих батьківських ліній. Потім зазначені батьківські лінії можуть бути схрещені з іншими лініями, і одержане гібридне потомство може бути піддане аналізу стосовно наявності корисних властивостей. Таким чином можуть бути ідентифіковані нові лінії, які надають необхідні властивості. У зазначених способах можна використовувати різні методики селекції, включаючи гаплоїдію, спосіб відбору "педігрі", спосіб відбору однієї насінини в потомстві, модифікований спосіб відбору однієї насінини в потомстві, повторюваний відбір і поворотне схрещування. У деяких варіантах у рослин і їх потомства спостерігають синергетичний ефект, а не адитивний ефект стосовно стійкості до гербіцидів, при цьому рівень стійкості до гербіцидів у рослин і їх потомства, що містять множинні мутації, вище, ніж сумарний рівень стійкості до гербіцидів рослин, що містять білок AHASL з одиничною мутацією. Лінії рослин, що містять молекули нуклеїнових кислот згідно із даним винаходом, можна схрещувати, використовуючи будь-які природні або механічні методики. Механічне запилення може бути здійснене за допомогою контролювання типів пилка, який може бути перенесений на приймочку, або ручним запиленням. Рослини-потомки можна оцінювати стосовно молекул нуклеїнових кислот згідно із даним винаходом будь-яким способом, щоб визначити присутність мутантної нуклеїнової кислоти або поліпептиду AHASL. Такі способи включають фенотипічну оцінку, генотипічну оцінку або їх сполучення. Потомство рослин можна оцінити в наступних поколіннях стосовно резистентності до гербіцидів і інших необхідних властивостей. Резистентність до інгібуючих AHAS гербіцидів можна оцінити, піддаючи рослини впливу одного або більше придатних інгібуючих AHAS гербіцидів і оцінюючи пошкодження гербіцидами. Деякі властивості, такі як стійкість до полягання і висота рослини, можна оцінювати за допомогою візуального огляду рослин, тоді як здатність до раннього дозрівання можна оцінити в результаті візуального огляду насіння у стручках. Інші властивості, такі як процентний вміст олії, процентний вміст білка і загальний вміст глюкозинолатів у насінні, можуть бути оцінені з використанням таких методик, як спектроскопія в ближній інфрачервоній області і/або рідинна хроматографія, і/або газова хроматографія. Рослини згідно із даним винаходом також можуть бути ідентифіковані з використанням будьякого способу генотипічного аналізу. Генотипічна оцінка рослин включає в себе застосування таких методик, як електрофорез ізоферментів, оцінка поліморфізму довжин рестрикційних фрагментів (RFLP), оцінка випадково ампліфікованих поліморфних ДНК (RAPD), випадково праймована полімеразна ланцюгова реакція (AP-PCR), алель-специфічна ПЛР (AS-PCR), фінгерпринтинг ампліфікованої ДНК (DAF), оцінка ампліфікованої області з охарактеризованою послідовністю (SCAR), поліморфізм довжин ампліфікованих фрагментів (AFLP), оцінка повторів простих послідовностей (SSR), які також називають "мікросателітами". Додаткові композиції і способи аналізу генотипу рослин, пропонованих у даному винаході, включають способи, описані в публікації патенту США № 2004/0171027, публікації патенту США № 2005/02080506 і публікації патенту США № 2005/0283858, повний зміст яких включене в даний опис у вигляді посилання. 21 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 60 Оцінка й обробка (за допомогою впливу одного або більше придатних AHAS-інгібуючих гербіцидів) можуть бути здійснені протягом декількох поколінь. Ефективність нових ліній можна оцінити, використовуючи об'єктивні критерії в порівнянні з контрольними сортами. Лінії, що мають необхідні сполучення властивостей, або схрещують з іншою лінією, або піддають самозапиленню, щоб одержати насіння. Самозапилення стосується перенесення пилка з однієї квітки на ту ж саму квітку або іншу квітку на тій же рослині. Рослини, що були піддані самозапиленню і відбору стосовно типу протягом багатьох поколінь, стають гомозиготними майже по всіх генних локусах і дають однорідну популяцію потомства при селекції гомозигот. Будь-який спосіб селекції можна використовувати в способах згідно із даним винаходом. В одному прикладі резистентні до гербіцидів рослини згідно із даним винаходом можна розводити, використовуючи спосіб на основі гаплоїдів. У таких способах батьків, що мають генетичну базу для необхідного комплементування властивостей, схрещують, використовуючи просте або складне схрещування. Схрещування (або перехресне запилення) стосується перенесення пилка з однієї рослини на іншу рослину. Потомство від схрещування вирощують і мікроспори (незрілі пилкові зерна) відділяють і фільтрують, використовуючи методики, відомі фахівцям у даній галузі [(наприклад, Swanson, E. B. et al.,(1987) Plant Cell Reports, 6:94-97, "Efficient isolation of microspores and the production of microspore-derived embryos in Brassica napus"; і Swanson, E. B., (1990) Microspore culture in Brassica, pp.159-169 in Methods in Molecular Biology, vol. 6, Plant Cell and Tissue Culture, Humana Press]. У зазначених мікроспорах спостерігається розщеплення генів. Мікроспори культивують у присутності придатного AHASTM інгібуючого гербіциду, такого як імазетапір (наприклад, PURSUIT ) або імазамокс (наприклад, TM TM TM SOLO , BEYOND і RAPTOR ) або суміш 50/50 імазетапіру і імазамоксу (наприклад, TM ODYSSEY ), який убиває мікроспори, у яких відсутні мутації, відповідальні за резистентність до гербіциду. Мікроспори, що несуть гени, відповідальні за резистентність до гербіциду, виживають і дають зародки, які утворюють гаплоїдні рослини. Потім їх хромосоми подвоюють, одержуючи подвоєні гаплоїди. Інші способи селекції також використовують відповідно до даного винаходу. Наприклад, відбір способом "педігрі" можна використовувати для поліпшення в основному самозапилюваних культур, таких як Brassica і канола. Селекцію "педігрі" починають зі схрещування двох генотипів, кожний з який може мати одну або більше необхідних властивостей, які відсутні в іншому або які доповнюють іншу властивість. Якщо два вихідних батьки не забезпечують усіх необхідних властивостей, то в план схрещувань можна включати додаткових батьків. Таких батьків можна схрещувати у вигляді простого або складного схрещування, щоб одержати прості або складні гібриди F1. Популяцію F2 одержують з F1 у результаті самозапилення однієї або більше рослин F1 або взаємного схрещування двох рослин F1 (тобто, схрещування між сибсами). Відбір найкращих особин можна починати в F 2-поколінні, і, починаючи з F3, відбирають кращі родини, і найкращих представників у найкращих родинах. Повторне тестування родин можна починати в F 4-поколінні, щоб підвищити ефективність селекції стосовно властивостей з низькою успадковуваністю. На пізній стадії інбридингу (тобто, F6 і F7) найкращі лінії або суміші фенотипічно подібних ліній можна тестувати стосовно можливого випуску нових сортів. Однак спосіб селекції педігрі більш трудомісткий, ніж спосіб на основі гаплоїдії, для створення поліпшених рослин, резистентних до AHAS-гербіцидів, оскільки рослини дають розщеплення протягом декількох поколінь, і вихід необхідних властивостей є відносно низьким. Спосіб відбору однієї насінини в потомстві (SSD) також можна використовувати для селекції поліпшених сортів. Спосіб SSD у строгому розумінні стосується саджання сегрегуючої популяції, збирання зразка у вигляді однієї насінини від рослини і використання популяції з одиночних насінин для саджання з метою одержання наступного покоління. Коли популяція буде доведена від F2 до необхідного рівня інбридингу, кожну з рослин, з яких одержані лінії, можна буде простежити до різних особин F2. Кількість рослин у популяції знижується в кожному поколінні внаслідок нездатності деяких насінин прорости або нездатності деяких рослин дати щонайменше одну насінину. У результаті не всі рослини, зразки яких були початково взяті в популяції F2, будуть представлені потомством, коли просування поколінь буде завершене. У випадку способу, основаного на використанні декількох насінин, селекціонери каноли звичайно збирають один або більше стручків з кожної рослини в популяції й обмолочують їх разом, одержуючи загальну масу. Частину загальної маси використовують для саджання наступного покоління, а частину відкладають у запас. Спосіб був названий модифікованим способом відбору однієї насінини в потомстві або способом відбору насіння одного стручка в потомстві. Спосіб відбору декількох насінин використовували для того, щоб зменшити 22 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 60 трудовитрати на збирання. Значно швидше обмолотити стручки машиною, ніж витягати одну насінину з кожного стручка вручну у випадку способу відбору однієї насінини в потомстві. Спосіб відбору декількох насінин також дозволяє висаджувати однакову кількість насіння у популяції кожного покоління при інбридингу. Збирають достатню кількість насіння, щоб компенсувати рослини, що не проростають або не дають насіння. Поворотне схрещування можна використовувати для перенесення гена або генів у випадку легко й у високому ступені наслідуваної ознаки від вихідного сорту або лінії (батька-донора) в інший необхідний культурний сорт або інбредну лінію (рекурентного батька). Після початкового схрещування особини, що мають фенотип батька-донора, відбирають і повторно схрещують (піддають поворотному схрещуванню) з рекурентним батьком. Очікується, що після виконання поворотного схрещування одержана рослина буде мати ознаки рекурентного батька і необхідну властивість, перенесену від батька-донора. У результаті повторюваного відбору також можуть бути створені поліпшені сорти. У даному способі генетично різноманітну популяцію гетерозиготних особин або ідентифікують, або створюють у результаті взаємного схрещування декількох різних батьків. Найкращі рослини відбирають на основі їх індивідуальної переваги, визначного потомства або чудової здатності до схрещування. Відібрані рослини піддають взаємному схрещуванню, одержуючи нову популяцію, у якій продовжують подальші цикли селекції. В іншому аспекті даний винахід стосується способу одержання рослини, яка має резистентність до AHAS-інгібуючих гербіцидів, який включає в себе: (a) схрещування першої лінії рослини з другою лінією рослини, щоб одержати сегрегуючу популяцію, при цьому перша або друга лінія рослини представлена резистентною до AHAS-інгібуючих гербіцидів рослиною, що містить молекулу нуклеїнової кислоти згідно із даним винаходом; (b) скринінг популяції стосовно підвищеної резистентності до AHAS-інгібуючих гербіцидів, стосовно присутності молекули нуклеїнової кислоти згідно даним винаходом або стосовно обох ознак; і (c) відбір одного або більше представників популяції, які мають підвищену резистентність AHAS у порівнянні з рослиною дикого типу або мають молекулу нуклеїнової кислоти згідно із даним винаходом. Перша або друга рослина містить молекулу нуклеїнової кислоти AHASL згідно із даним винаходом. В одному варіанті рослини для застосування в даному способі є рослинами Brassica. В іншому аспекті даний винахід стосується способу інтрогресії ознаки резистентності до AHAS-інгібуючих гербіцидів у рослину, який включає в себе: (a) схрещування щонайменше першої лінії рослин, резистентної до AHAS-інгібуючих гербіцидів, із другою лінією рослин з одержанням сегрегуючої популяції; (b) скринінг популяції стосовно підвищеної резистентності до AHAS-інгібуючих гербіцидів; і (c) відбір щонайменше одного представника популяції, що має підвищену резистентність до AHAS-інгібуючих гербіцидів. В одному варіанті рослини для застосування в даному способі є рослинами Brassica. Альтернативно в іншому аспекті винаходу і перша, і друга батьківські рослини Brassica можуть бути резистентними до AHAS-інгібуючих гербіцидів рослинами Brassica, які описані в даній публікації. Таким чином, будь-яка рослина Brassica, одержана з використанням рослини Brassica, що має підвищену резистентність до AHAS-інгібуючих гербіцидів, яка описана в даній публікації, складає частину винаходу. У використовуваному в даному описі розумінні схрещування може означати самозапилення, схрещування сибсів, поворотне схрещування, схрещування з іншою або тією же самою батьківською лінією, схрещування з популяціями тощо. Даний винахід також стосується способів одержання резистентної до гербіцидів рослини, зокрема резистентної до гербіцидів рослини Brassica, за допомогою звичайної селекції рослин, основаної на статевому розмноженні. Способи включають в себе схрещування першої рослини, що є резистентною до гербіциду, із другою рослиною, що не є резистентною до гербіциду. Перша рослина може бути будь-якою резистентною до гербіцидів рослиною згідно із даним винаходом, включаючи, наприклад, рослини Brassica, що містять щонайменше одну з молекул нуклеїнових кислот згідно із даним винаходом, які кодують резистентну до гербіцидів AHASL, і нетрансгенні рослини Brassica, що мають властивості резистентності до гербіцидів рослини Brassica BnCL120C7, BnCL131A1, BnCL140B3 або BnCL140C7. Друга рослина може бути будьякою рослиною, яка здатна давати життєздатне потомство (тобто, насіння) при схрещуванні з першою рослиною. Звичайно, але необов'язково, перша і друга рослини належать до того ж самого виду. Наприклад, мутантна послідовність AHASL у геномі A рослини B. napus може бути при селекції перенесена в рослини Brassica, які також мають геном A, за допомогою схрещування рослини B. napus, наприклад, з рослиною B. juncea. Способи відповідно до винаходу додатково можуть включати в себе одне або більше поколінь поворотного схрещування рослин-потомків від першого схрещування з рослиною такої ж лінії або генотипу, 23 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 60 як і перша або друга рослина. Альтернативно, потомство від першого схрещування або будьякого подальшого схрещування може бути схрещена з третьою рослиною, яка є рослиною іншої лінії або іншого генотипу, ніж у випадку першої або другої рослини. Способи відповідно до винаходу додатково можуть включати в себе відбір рослин, які мають властивості резистентності до гербіцидів першої рослини. Даний винахід, крім того, стосується способів підвищення резистентності до гербіцидів рослини, зокрема резистентної до гербіцидів рослини Brassica, за допомогою звичайної селекції рослин, основаної на статевому розмноженні. Способи включають в себе схрещування першої рослини, що є резистентною до гербіциду, із другою рослиною, що може бути або не бути резистентною до гербіциду або може бути резистентною до іншого гербіциду або гербіцидів, відмінних від гербіциду, до якого резистентна перша рослина. Перша рослина може являти собою будь-яку резистентну до гербіцидів рослину згідно із даним винаходом, включаючи, наприклад, трансгенні або нетрансгенні рослини, які містять щонайменше одну з молекул нуклеїнових кислот згідно із даним винаходом, які кодують резистентну до гербіциду AHASL, і нетрансгенні рослини Brassica, що мають властивості резистентності до гербіцидів рослини Brassica BnCL120C7, BnCL131A1, BnCL140B3 або BnCL140C7. Другою рослиною може бути будь-яка рослина, що здатна давати життєздатні рослини-потомки (тобто, насіння) при схрещуванні з першою рослиною. Звичайно, але не обов'язково, перша і друга рослини належать до того ж самого виду; а також перша і друга рослини можуть належати до різних видів, але в межах одного роду (приклад: Brassica juncea × Brassica napus, Brassica juncea × Brassica rapa, Brassica juncea × Brassica oleracea, Brassica juncea × Brassica nigra і т. д.), а також перша і друга рослини належать до різних родів (приклад: Brassica × Sinapis). Рослини-потомки, одержані таким способом згідно із даним винаходом, мають підвищену резистентність до гербіциду в порівнянні або з першою, або з другою рослиною, або з обома рослинами. У тому випадку, коли перша і друга рослини резистентні до різних гербіцидів, рослини-потомки будуть мати комбіновані властивості резистентності до гербіцидів першої і другої рослин. Способи відповідно до винаходу додатково можуть включати в себе одне або більше поколінь поворотного схрещування рослин-потомків від першого схрещування з рослиною такої ж лінії або генотипу, як і перша або друга рослина. Альтернативно, потомство від першого схрещування або будь-якого подальшого схрещування може бути схрещене з третьою рослиною, що є рослиною іншої лінії або іншого генотипу, ніж у випадку першої або другої рослини. Способи відповідно до винаходу додатково можуть включати в себе відбір рослин, які мають властивості резистентності до гербіцидів першої рослини, другої рослини або обох рослин. Рослини згідно із даним винаходом можуть бути трансгенними або нетрансгенними. Прикладом нетрансгенної рослини Brassica, що має підвищену резистентність до імідазолінонових і/або сульфонілсечовинних гербіцидів, є рослина Brassica BnCL131A1, BnCL120C7, BnCL140B3, BnCL140C7 або PM1PM2/BnCL131A1; або мутантне, рекомбінантне або генетично сконструйоване похідне рослини BnCL131A1, BnCL120C7, BnCL140B3, BnCL140C7 або PM1PM2/BnCL131A1; або будь-яке потомство рослини BnCL131A1, BnCL120C7, BnCL140B3, BnCL140C7 або PM1PM2/BnCL131A1; або рослина, яка є потомком будь-якої з зазначених рослин; або рослина, яка має властивості резистентності до гербіцидів рослини BnCL131A1, BnCL120C7, BnCL140B3, BnCL140C7 або PM1PM2/BnCL131A1. Даний винахід також стосується рослин, органів рослини, рослинних тканин, рослинних клітин, насіння і клітин-хазяїнів, відмінних від клітин людини, які трансформовані щонайменше однією молекулою нуклеїнової кислоти, касетою експресії або вектором для трансформації відповідно до винаходу. Такі трансформовані рослини, органи рослин, рослинні тканини, рослинні клітини, насіння і клітини-хазяїни, відмінні від клітин людини, мають підвищену стійкість або резистентність щонайменше до одного гербіциду, при використанні рівнів гербіциду, що убивають або інгібують ріст нетрансформованої рослини, рослинної тканини, рослинної клітини або клітини-хазяїна, відмінної від клітини людини, відповідно. В одному варіанті трансформовані рослини, рослинні тканини, рослинні клітини і насіння відповідно до винаходу являють собою рослини Brassica і сільськогосподарські рослини. Даний винахід також стосується насіння рослини, стійкої до AHAS-інгібуючих гербіцидів, здатного давати рослину, яка має резистентність до AHAS-інгібуючого гербіциду, одержаного від рослин, що одержані способами згідно із даним винаходом. В іншому аспекті даний винахід також стосується рослини, вирощеної з насіння рослини, що має резистентність до AHAS-інгібуючого гербіциду, одержаного від рослин, вирощених з насіння, що має властивість резистентності до гербіцидів, а також частин рослин і культур тканин з таких рослин. 24 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 60 Також у даному винаході пропонується ємність з насінням рослини, при цьому насіння здатне давати резистентну до AHAS-інгібуючого гербіциду рослину. Ємність з насінням може містити будь-яку кількість, масу або об’єм насіння. Наприклад, ємність може містити щонайменше або більше ніж приблизно 10, 25, 50, 75, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000 або більше насінин. Альтернативно ємність може містити щонайменше або більше ніж приблизно 1 унцію (28,3 г), 5 унцій (141,5 г), 10 унцій (283 г), 1 фунт (0,453 кг), 2 фунти (0,906 кг), 3 фунти (1,359 кг), 4 фунти (1,812 кг), 5 фунтів (22665 кг) або велику масу насіння. Ємності з насінням Brassica можуть являти собою будь-яку ємність, наявну в даній галузі. Як необмежувальний приклад, ємність може являти собою коробку, мішок, пакет, сумку, стрічковий рулон, відро, фольгу або пробірку. В іншому аспекті насіння, що знаходяться в ємностях з насінням, може являти собою оброблене або необроблене насіння. В одному аспекті насіння може бути оброблене для поліпшення проростання, наприклад, за допомогою пророщення насіння або за допомогою дезінфекції, щоб захистити від наявних у насінні патогенів. В іншому аспекті насіння може бути покрите будь-яким доступним покриттям, щоб поліпшити, наприклад, посів, проростання насіння і захист від патогенів, наявних на насінні. Покриття насіння може являти собою будь-яку форму покриття для насіння, включаючи без обмеження дражирування, плівкове покриття й інкрустацію. Крім того, рослини Brassica можна застосовувати в способах селекції для одержання рослин, які мають додаткові властивості, що представляють інтерес, у сполученні зі стійкістю до AHAS-інгібітору (також називаними "підсумованими властивостями" або "підсумовуванням властивостей"), такими як сполучення резистентності до додаткових гербіцидів, таких як гліфосат, глюфосинат і/або дикамба. Крім того, рослини Brassica можна застосовувати в способах селекції, щоб одержати рослини Brassica, які мають декілька послідовностей, що кодують резистентність до AHAS-інгібуючих гербіцидів. Також, описані рослини можна застосовувати в способах селекції для одержання рослин, які мають властивість стійкості до AHAS-інгібуючого гербіциду в сполученні з іншими агрономічно важливими властивостями, такими як резистентність до захворювань і патогенів, такими як властивість, що надається геном Bt, резистентність до "чорної ніжки". Описані способи селекції включають способи селекції резистентних до AHAS-інгібуючих гербіцидів рослин Brassica, при цьому спосіб включає в себе стадії (a) схрещування рослини Brassica, що містить піддану мутагенезу молекулу нуклеїнової кислоти, яка кодує стійкий до гербіцидів білок AHAS, що має мутацію в положенні, яке відповідає положенню A122 послідовності SEQ ID NO:23, і мутацію в положенні, яке відповідає положенню S653 послідовності SEQ ID NO:23, із другою рослиною Brassica; і (b) одержання насіння в результаті такого схрещування. Одержане насіння може бути піддане скринінгу, щоб ідентифікувати насіння, яке містить піддану мутагенезу молекулу нуклеїнової кислоти. Такі способи можуть додатково включати в себе одержання зразка ДНК із насіння від схрещування й аналіз зразка стосовно наявності або відсутності підданої мутагенезу молекули нуклеїнової кислоти. Альтернативно насіння може бути піддане скринінгу стосовно стійкості до AHAS-інгібуючого гербіциду, щоб ідентифікувати насіння або потомство, яке експресує нуклеїнову кислоту стійкою до гербіцидів AHAS. В іншому аспекті даний винахід стосується способу одержання рослини Brassica, що має резистентність до AHAS-інгібуючих гербіцидів, який включає в себе: (a) схрещування першої лінії Brassica із другою лінією Brassica з утворенням сегрегуючої популяції, при цьому перша лінія Brassica представлена резистентною до AHAS-інгібуючих гербіцидів рослиною, яка містить піддану мутагенезу молекулу нуклеїнової кислоти AHAS згідно із даним винаходом; (b) скринінг популяції стосовно підвищеної резистентності до AHAS-інгібуючих гербіцидів; і (c) відбір одного або більше представників популяції, що мають підвищену резистентність AHAS у порівнянні з рослиною Brassica дикого типу. В іншому аспекті даний винахід стосується способу інтрогресії ознаки резистентності до AHAS-інгібуючих гербіцидів у рослину Brassica, який включає в себе: (a) схрещування щонайменше першої лінії Brassica, резистентної до AHAS-інгібуючих гербіцидів, із другою лінією Brassica з одержанням сегрегуючої популяції; (b) скринінг популяції стосовно підвищеної резистентності до AHAS-інгібуючих гербіцидів; і (c) відбір щонайменше одного представника популяції, що має підвищену резистентність до AHAS-інгібуючих гербіцидів. Альтернативно в іншому аспекті винаходу і перша, і друга батьківські рослини Brassica можуть бути резистентними до AHAS-інгібуючих гербіцидів рослинами Brassica, які описані в даній публікації. Таким чином, будь-яка рослина Brassica, одержана з використанням рослини 25 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 Brassica, що має піддану мутагенезу молекулу нуклеїнової кислоти AHAS, яка описана в даній публікації, складає частину винаходу. У використовуваному в даному описі розумінні схрещування може означати самозапилення, схрещування сибсів, поворотне схрещування, схрещування з іншою або тією ж самою батьківською лінією, схрещування з популяціями тощо. У деяких варіантах піддана мутагенезу молекула нуклеїнової кислоти AHAS відповідно до винаходу може бути сконструйована у вигляді молекулярного блока з молекулою нуклеїнової кислоти, яка надає резистентність до другого гербіциду, такого як гліфосат або глюфосинат. В інших варіантах молекулярний блок додатково містить щонайменше одну додаткову молекулу нуклеїнової кислоти, яка надає стійкість до третього гербіциду. В одному варіанті послідовність надає стійкість до глюфосинату й у конкретному варіанті послідовність складає частину винаходу. В інших варіантах рослина Brassica відповідно до винаходу має одну або більше ознак, що представляють інтерес, і в деяких варіантах піддану мутагенезу молекулу нуклеїнової кислоти AHAS компонують з будь-яким сполученням послідовностей молекул нуклеїнових кислот, щоб створити рослини з необхідним сполученням ознак. Ознака у використовуваному в даному описі розумінні стосується фенотипу, одержаного завдяки конкретній послідовності або групі послідовностей. Наприклад, молекули нуклеїнових кислот, які визначають стійкість до гербіцидів, можуть бути скомпоновані з будь-якими іншими молекулами нуклеїнових кислот, які кодують поліпептиди, що мають пестицидну і/або інсектицидну активність, такі як токсичні білки Bacillus thuringiensis (описані в патентах США №№ 5366892; 5747450; 5737514; 5723756; 5593881; Geiser et al. (1986) Gene 48:109-118; Lee et al. (2003) Appl. Environ. Microbiol. 69:46484657 (Vip3A); Galitzky et al. (2001) Acta Crystallogr. D. Biol. Crystallogr. 57:1101-1109 (Cry3Bb1); and Herman et al. (2004) J. Agric. Food Chem. 52:2726-2734 (Cry1F)), lectins (Van Damme et al. (1994) Plant Mol. Biol. 24:825-830, пентин (описаний у патенті США № 5981722) і тому подібні. Створювані сполучення також можуть включати в себе множинні копії будь-якої однієї з молекул нуклеїнової кислоти, що представляють інтерес. У деяких варіантах, піддану мутагенезу молекулу нуклеїнової кислоти AHAS можна компонувати з іншими ознаками стійкості до гербіцидів, щоб створити рослину Brassica відповідно до винаходу з додатковими поліпшеними властивостями. Інші молекули нуклеїнової кислоти, що визначають стійкість до гербіцидів, які можна використовувати в таких варіантах, включають молекули, що надають стійкість до гліфосату або до інгібіторів AHAS з іншим механізмом дії, такі як, наприклад, ген, що кодує фермент гліфосатоксидоредуктазу, який більш повно описаний у патентах США №№ 5776760 і 5463175. Інші ознаки, які можна сполучати з підданою мутагенезу молекулою нуклеїнової кислоти AHAS, включають ознаки, що обумовлені молекулами нуклеїнових кислот, які надають рослині здатність продукувати високий рівень 5енолпірувілшикімат-3-фосфатсинтази (EPSPS), що більш повно описані, наприклад, у патентах США №№ 6248876B1, 5627061, 5804425, 5633435, 5145783, 4971908, 5312910, 5188642, 4940835, 5866775, 6225114B1, 6130366, 5310667, 4535060, 4769061, 5633448, 5510471, Re. 36449, RE 37287 E і 5491288 і міжнародних публікаціях WO 97/04103, WO 00/66746, WO 01/66704 і WO 00/66747. Інші ознаки, які можна сполучати з підданими мутагенезу молекулами нуклеїнових кислот AHAS, включають молекули, які надають ознаки стійкості до сульфонілсечовини і/або імідазолінону, що більш повно описані, наприклад, у патентах США №№ 5605011, 5013659, 5141870, 5767361, 5731180, 5304732, 4761373, 5331107, 5928937 і 5378824 і міжнародній публікації WO 96/33270. Таким чином, пропонуються рослини Brassica, які містять піддані мутагенезу молекули нуклеїнової кислоти AHAS згідно із даним винаходом в сполученні (тобто, "скомпоновані") з іншими мутантними або рекомбінантними нуклеїновими кислотами, які кодують гени, що представляють інтерес, такими як молекули нуклеїнових кислот, які визначають стійкість до AHAS-інгібіторів. В одному прикладі додаткові молекули нуклеїнових кислот, що визначають стійкість до AHAS-інгібіторів, які можна використовувати в таких сполученнях, можуть містити будь-яку мутацію в порівнянні з послідовністю AHAS дикого типу, наприклад, білки AHAS, що мають мутації P197S, A205V, S653N, W574L і/або A122T і їх сполучення (наприклад, послідовність AHAS з подвійною або потрійною мутацією). В одному прикладі пропонуються рослини Brassica, які поєднують у собі стійкий до гербіцидів білок AHASL, що містить амінокислотні мутації в положеннях A122 і S653, з іншим стійким до гербіцидів білком AHASL, що містить амінокислотну мутацію в положенні W574, і стійким до гербіцидів білком AHASL, що містить амінокислотну мутацію в положенні S653. Також пропонується насіння таких мутантних ліній рослин Brassica, наприклад, лінії, яка називається PM1PM2/BnCL131A1; зразок зазначеного насіння депонований у ATCC з номером доступу PTA-10321. 26 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 60 Крім того, мутантні або рекомбінантні нуклеїнові кислоти, комбіновані з нуклеїновими кислотами стійкості до AHAS-інгібіторів, можуть бути локалізовані в будь-якому з геномів Brassica і давати гетерозиготні або гомозиготні сполучення. Таким чином, нуклеїнові кислоти, що представляють інтерес, для застосування в сполученнях, можуть бути в одному і тому ж або в різних геномах у вигляді нуклеїнової кислоти з подвійною мутацією стійкості до AHASінгібіторів згідно із даним винаходом. Наприклад, пропонуються рослини Brassica napus (що містять геном AACC), які містять піддану мутагенезу AHAS згідно із даним винаходом в сполученні з молекулами нуклеїнових кислот, які визначають стійкість до імідазолінону, локалізованими, наприклад, у геномі "A", з одержанням гетерозиготного сполучення, або в геномі "C", з одержанням гомозиготного сполучення. В іншому прикладі пропонуються рослини Brassica juncea (що містять геном AABB), які містять піддану мутагенезу AHAS згідно із даним винаходом в сполученні з молекулами нуклеїнових кислот, які визначають стійкість до імідазолінону, локалізованими, наприклад, у геномі "A", з одержанням гетерозиготного сполучення, або в геномі "B", з одержанням гомозиготного сполучення. У ще одному прикладі пропонуються рослини Brassica rapa (що містять геном AA), які містять піддану мутагенезу AHAS згідно із даним винаходом в сполученнях з молекулами нуклеїнових кислот, які визначають стійкість до імідазолінону, локалізованими, наприклад, у геномі "A", з одержанням гетерозиготного сполучення. Прикладами таких рослин Brassica є рослини Brassica napus, які містять піддану мутагенезу молекулу нуклеїнової кислоти AHAS згідно із даним винаходом в сполученні з PM2, яка являє собою молекулу нуклеїнової кислоти AHASL з геному A, що містить одну мутацію W574L (див., наприклад, WO 2004/040011), і в деяких варіантах у додатковому сполученні з PM1, що являє собою молекулу нуклеїнової кислоти AHASL з послідовності геному C, що містить одну мутацію S653N (див., наприклад, WO 2004/040011). Іншим прикладом є рослини Brassica juncea, які містять піддану мутагенезу молекулу нуклеїнової кислоти AHAS згідно із даним винаходом в сполученні з bR, яка являє собою молекулу нуклеїнової кислоти AHASL з геному B, що містить одну мутацію S653N (наприклад, публікації патентів США № 2005/0283858 і 2009/0013424). Іншими прикладами є рослини Brassica, які містять піддані мутагенезу молекули нуклеїнової кислоти AHAS згідно із даним винаходом в сполученні з PM1. У деяких варіантах сполучення стійких до AHAS-інгібіторів нуклеїнових кислот можуть забезпечувати будь-який рівень стійкості до AHAS-інгібітору, наприклад, адитивні ефекти або синергетичні ефекти. У деяких варіантах піддані мутагенезу молекули нуклеїнової кислоти AHAS можна компонувати, наприклад, з гідроксифенілпіруватдіоксигеназами, які являють собою ферменти, що каталізують реакцію, у якій парагідроксифенілпіруват (HPP) перетворюється в гомогентизат. Молекули, які інгібують такий фермент і які зв'язуються з ферментом, щоб інгібувати перетворення HPP у гомогентизат, застосовні як гербіциди. Ознаки, що надають стійкість до таких гербіцидів, у рослин описані в патентах США №№ 6245968 B1, 6268549 і 6069115, і в міжнародній публікації WO 99/23886. Інші приклади придатних ознак стійкості до гербіцидів, які можна сполучати з підданими мутагенезу послідовностями AHAS, включають молекули нуклеїнової кислоти діоксигенази арилоксіалканоату (які, як повідомляють, надають стійкість до 2,4-D і інших феноксіауксинових гербіцидів, а також до арилоксифеноксипропіонатних гербіцидів, що описані, наприклад, у WO 2005/107437) і молекули нуклеїнової кислоти, що надають стійкість до дикамби, які описані, наприклад, у Herman et al. (2005) J. Biol. Chem. 280:24759-24767. Інші приклади ознак стійкості до гербіцидів, які можна сполучати з підданими мутагенезу молекулами нуклеїнової кислоти AHAS згідно із даним винаходом, включають ознаки, що надаються молекулами нуклеїнових кислот, які кодують екзогенну ацетилтрансферазу фосфінотрицину, що описані в патентах США №№ 5969213, 5489520, 5550318, 5874265, 5919675, 5561236, 5648477, 5646024, 6177616 і 5879903. Рослини, які містять екзогенну ацетилтрансферазу фосфінотрицину, можуть виявляти підвищену стійкість до глюфосинатних гербіцидів, які інгібують фермент глутамінсинтазу. Інші приклади ознак стійкості до гербіцидів, які можна сполучати з підданими мутагенезу послідовностями AHAS, включають ознаки, що надаються молекулами нуклеїнових кислот, які забезпечують змінену активність протопорфініногеноксидази (протоксу), що описані в патентах США №№ 6288306 B1, 6282837 B1 і 5767373, і в міжнародній публікації WO 01/12825. Рослини, які містять такі молекули нуклеїнових кислот, можуть виявляти підвищену стійкість до будь-якого з множини гербіцидів, мішенню яких є фермент протокс (що також називаються "інгібіторами протоксу"). Інші приклади генів стійкості до гербіцидів, які можна сполучати з підданими мутагенезу молекулами нуклеїнових кислот AHAS, включають гени, що надають стійкість до гербіциду 27 UA 115019 C2 5 10 15 20 25 30 35 40 45 50 55 60 дикамба. Такі гени відомі в даній галузі й описані, наприклад, у патенті США № 7022896 і публікації патенту США № 2008/0015110. Іншими прикладами ознак стійкості до гербіцидів, які можна сполучати з підданими мутагенезу молекулами нуклеїнових кислот AHAS згідно із даним винаходом, є ознаки, які надають стійкість щонайменше до одного гербіциду в такій рослини, наприклад, як рослина Brassica. Стійкі до гербіцидів рослини Brassica відомі в даній галузі, як, наприклад, рослини, що мають варійовану стійкість до конкретних гербіцидів. Див., наприклад, патент США № 5627061. Ознаку (ознаки), відповідальну за таку стійкість, можна сполучати, використовуючи селекцію або інші способи, такі як трансгенні способи, з підданими мутагенезу молекулами нуклеїнової кислоти AHAS, щоб одержати рослину відповідно до винаходу, а також здійснити способи її застосування. Піддані мутагенезу молекули нуклеїнових кислот AHAS також можна сполучати щонайменше з однією іншою ознакою, щоб одержати рослини згідно із даним винаходом, які додатково мають сполучення декількох необхідних ознак, включаючи без обмеження ознаки, необхідні при одержанні кормів для тварин, такі як високий вміст олії (наприклад, патенти США №№ 7238856, 7268276), амінокислотний склад, вміст білка, поліпшене засвоєння або змінені склади жирних кислот. Піддані мутагенезу молекули нуклеїнових кислот AHAS також можна сполучати з іншими необхідними ознаками, такими як, наприклад, гени авірулентності і резистентності до захворювань (Jones et al. (1994) Science 266:789-793; Martin et al. (1993) Science 262:1432-1436; Mindrinos et al. (1994) Cell 78:1089-1099), і ознаками, необхідними для обробки й одержання таких продуктів, як модифіковані олії (наприклад, гени десатурази жирних кислот (патент США № 5952544, WO 94/11516)), і полімери або біопластики (наприклад, патент США № 5602321, бета-кетотіолаза, полігідроксибутиратсинтаза й ацетоацетил-соа-редуктаза (Schubert et al. (1988) J. Bacteriol. 170:5837-5847) сприяють експресії полігідроксіалканоатів (PHA)). Також можна сполучати стійкі до гербіцидів молекули нуклеїнових кислот з молекулами нуклеїнових кислоти, які забезпечують будь-які агрономічні ознаки. Блоки сполучень можуть бути створені будь-яким способом, включаючи без обмеження селекцію рослин будь-яким відомим способом або генетичну трансформацію, або сполучення способів. Якщо послідовності компонують за допомогою генетичної трансформації рослин, то послідовності молекул нуклеїнових кислот, що представляють інтерес, можна сполучати в будьякий момент часу й у будь-якому порядку. Ознаки можуть бути введені одночасно при використанні протоколу котрансформації з молекулами нуклеїнових кислот, що представляють інтерес, які представлені у будь-якому сполученні в касетах для трансформації. Наприклад, якщо будуть введені дві послідовності, то дві послідовності можуть знаходитися в окремих касетах для трансформації (транс) або знаходитися в одній і тій же касеті для трансформації (цис). Експресією послідовностей може керувати один і той же промотор або різні промотори. У деяких випадках може бути бажаним введення касети для трансформації, яка буде супресувати експресію молекули нуклеїнової кислоти, що представляє інтерес. Касету можна сполучати з будь-яким сполученням інших супресуючих касет або надекспресуючими касетами, щоб створити необхідне сполучення ознак рослини. Крім того, зрозуміло, що молекули нуклеїнової кислоти можуть бути скомпоновані в необхідній геномній локалізації з використанням сайтспецифічної системи рекомбінації. Див., наприклад, публікації WO 99/25821, WO 99/25854, WO 99/25840, WO 99/25855 і WO 99/25853, які всі включені в даний опис у вигляді посилання. Способи реєстрації Також пропонуються способи і композиції для ідентифікації рослини, яка містить піддані мутагенезу молекули нуклеїнових кислот і поліпептиди AHAS, включаючи потомство і похідні. Такі способи застосовні для ідентифікації і/або виявлення рослин, які містять такі піддані мутагенезу послідовності в будь-якому біологічному матеріалі. Такі способи включають, наприклад, способи підтвердження чистоти насіння і способи скринінгу насіння у партії насіння стосовно підданих мутагенезу послідовностей згідно із даним винаходом. В одному варіанті пропонується спосіб ідентифікації підданих мутагенезу послідовностей AHAS у біологічному зразку, який включає в себе утворення суміші біологічного зразка і праймерів першої і другої нуклеїнових кислот, здатних ампліфікувати піддану мутагенезу молекулу нуклеїнової кислоти AHAS; взаємодію в суміші в умовах, які дозволяють праймерам першої і другої нуклеїнових кислот ампліфікувати піддану мутагенезу молекулу нуклеїнової кислоти AHAS; і виявлення наявності або відсутності ампліфікованої підданої мутагенезу послідовності молекули нуклеїнової кислоти AHAS. Ампліфікована молекула нуклеїнової кислоти (амплікон) може бути будь-якої довжини, яка дозволяє виявляти піддану мутагенезу послідовність AHAS. Наприклад, амплікон може мати 28
ДивитисяДодаткова інформація
Назва патенту англійськоюHerbicide-resistant ahas-mutants and methods of use
Автори англійськоюBeethan, Peter, Carlson, Dale, Gocal, Greg, Mc Elver, John, Pearce, James, Schopke, Christian, Singh, Bijay, Walker, Keith
Автори російськоюСингх Биджай
МПК / Мітки
МПК: C12N 15/82, C12N 9/88, C12N 15/60, A01H 5/00
Мітки: aнas-мутант, стійкий, гербіцидів, brassica, рослини
Код посилання
<a href="https://ua.patents.su/92-115019-stijjkijj-do-gerbicidiv-anas-mutant-roslini-brassica.html" target="_blank" rel="follow" title="База патентів України">Стійкий до гербіцидів aнas-мутант рослини brassica</a>
Попередній патент: Спосіб вимірювання відстані до об’єкта (варіанти) та автомобільний пасивний оптичний пристрій для його реалізації
Наступний патент: Однокорпусна багатоступенева вакуумна випарна установка
Випадковий патент: Спосіб отримання гірудину із медичних пиявок