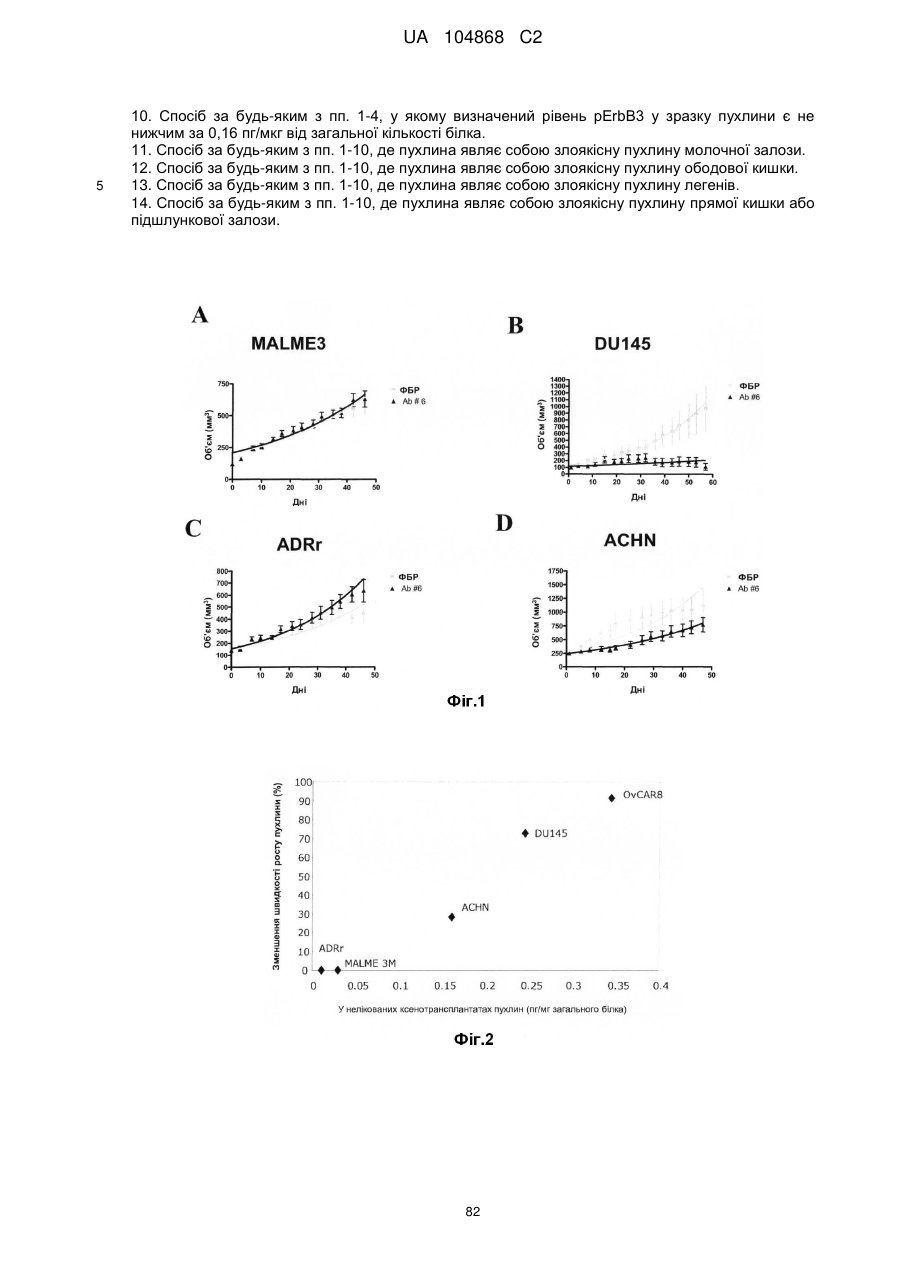
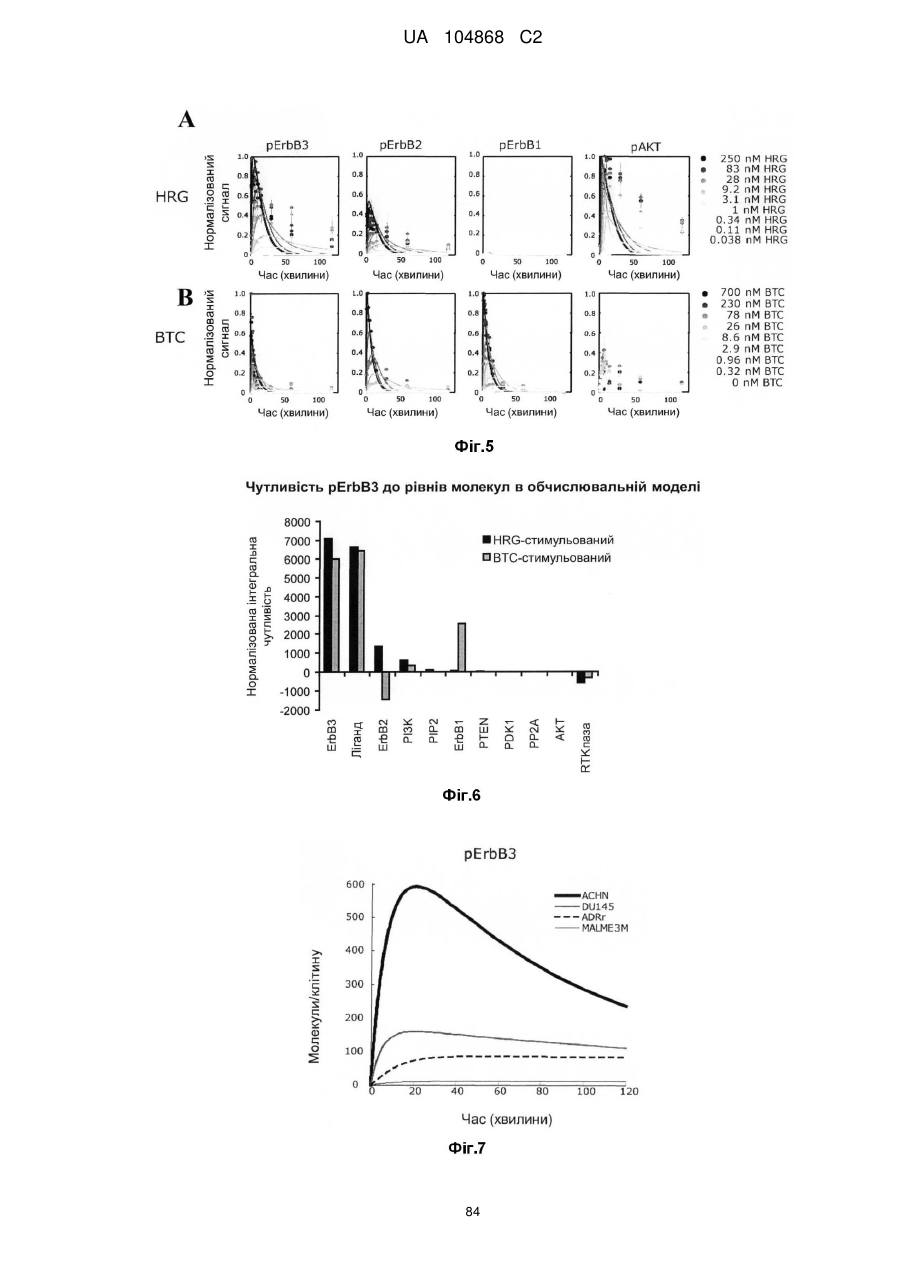
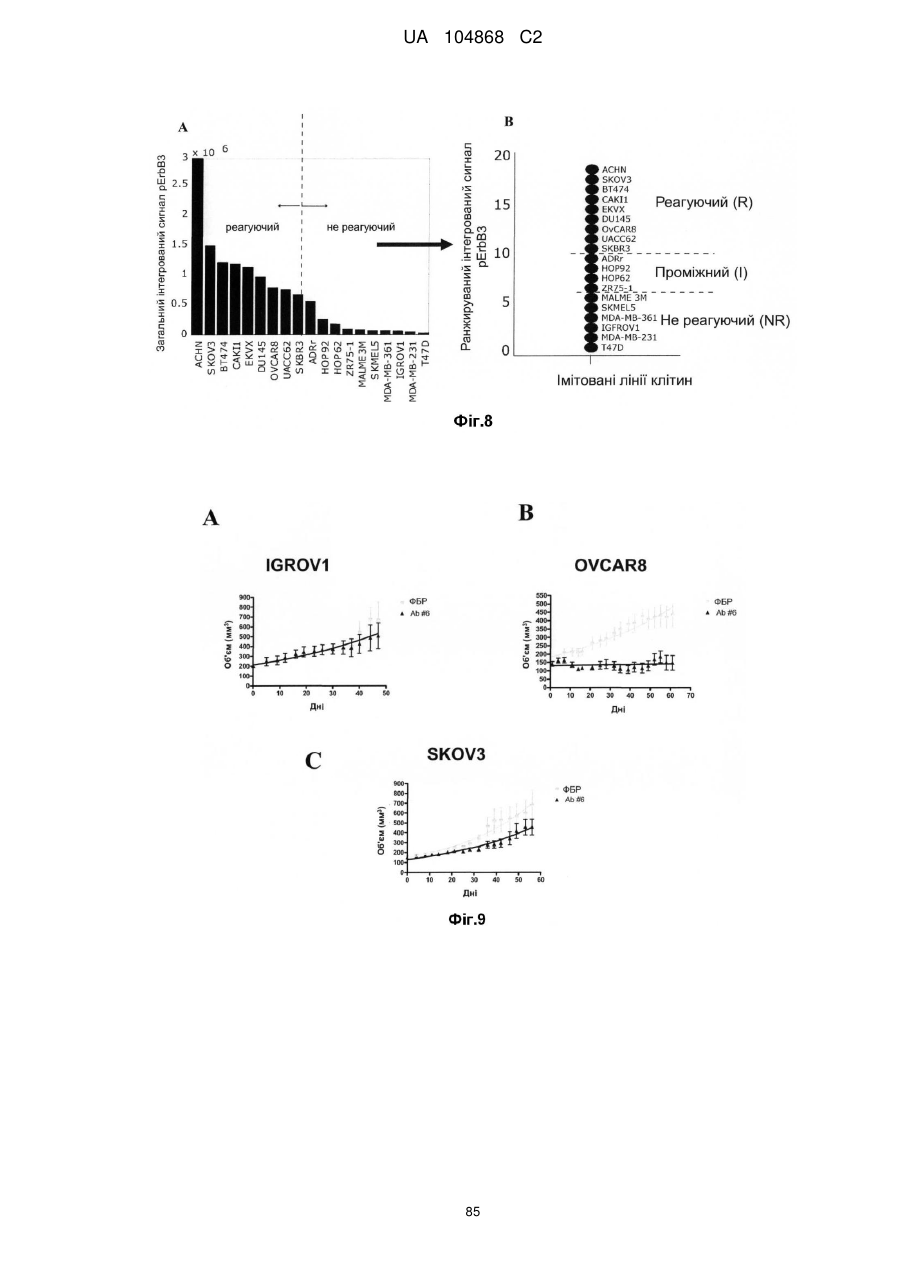
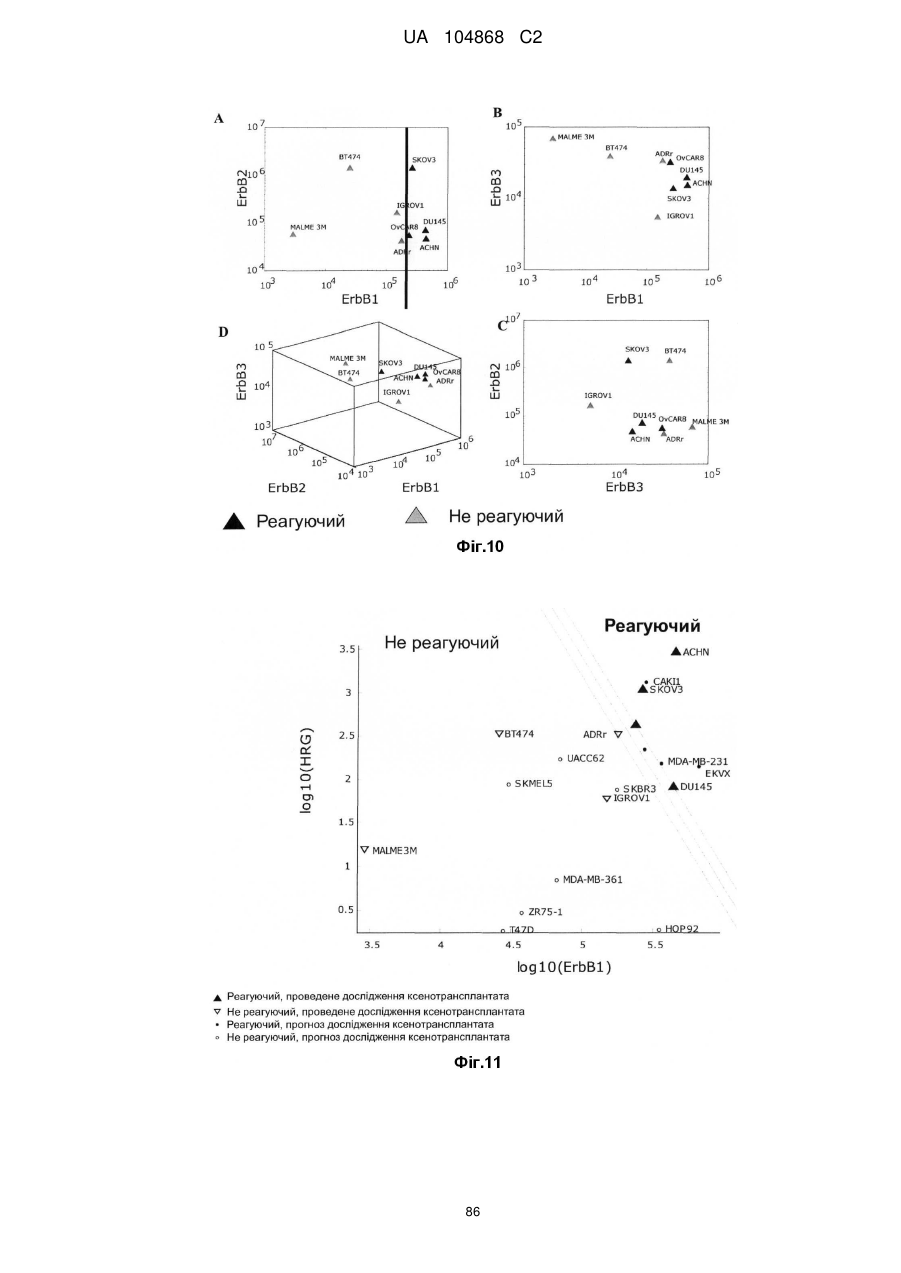
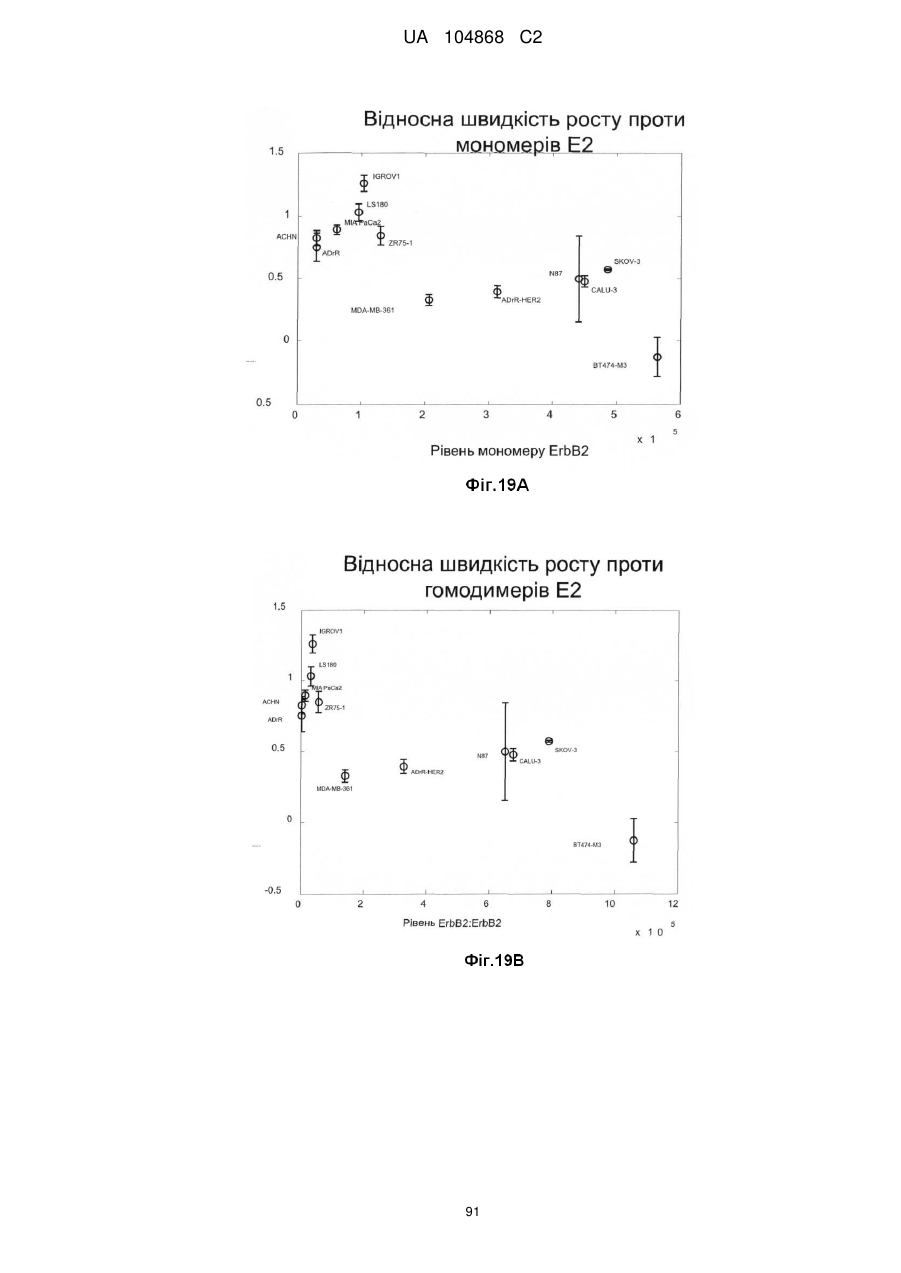
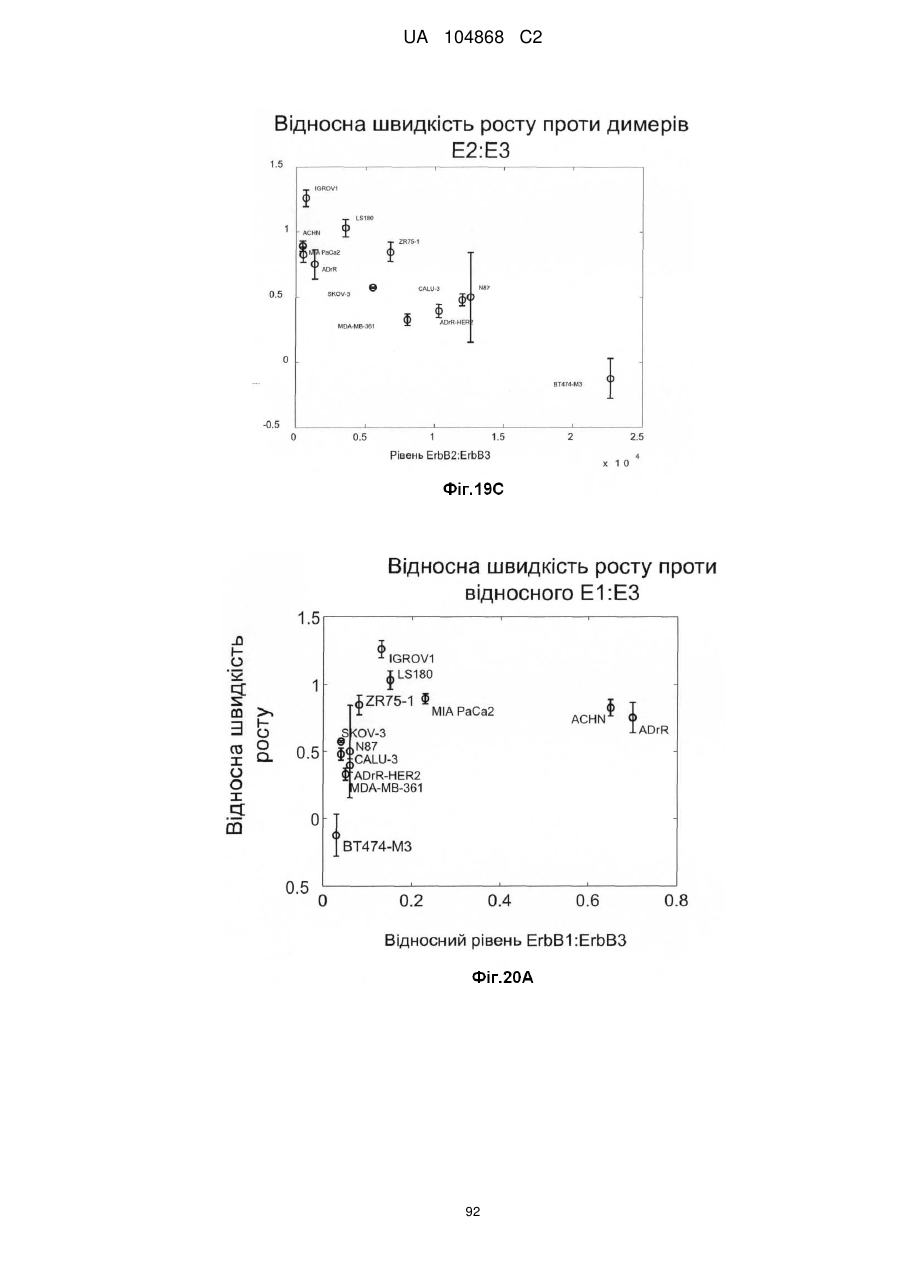
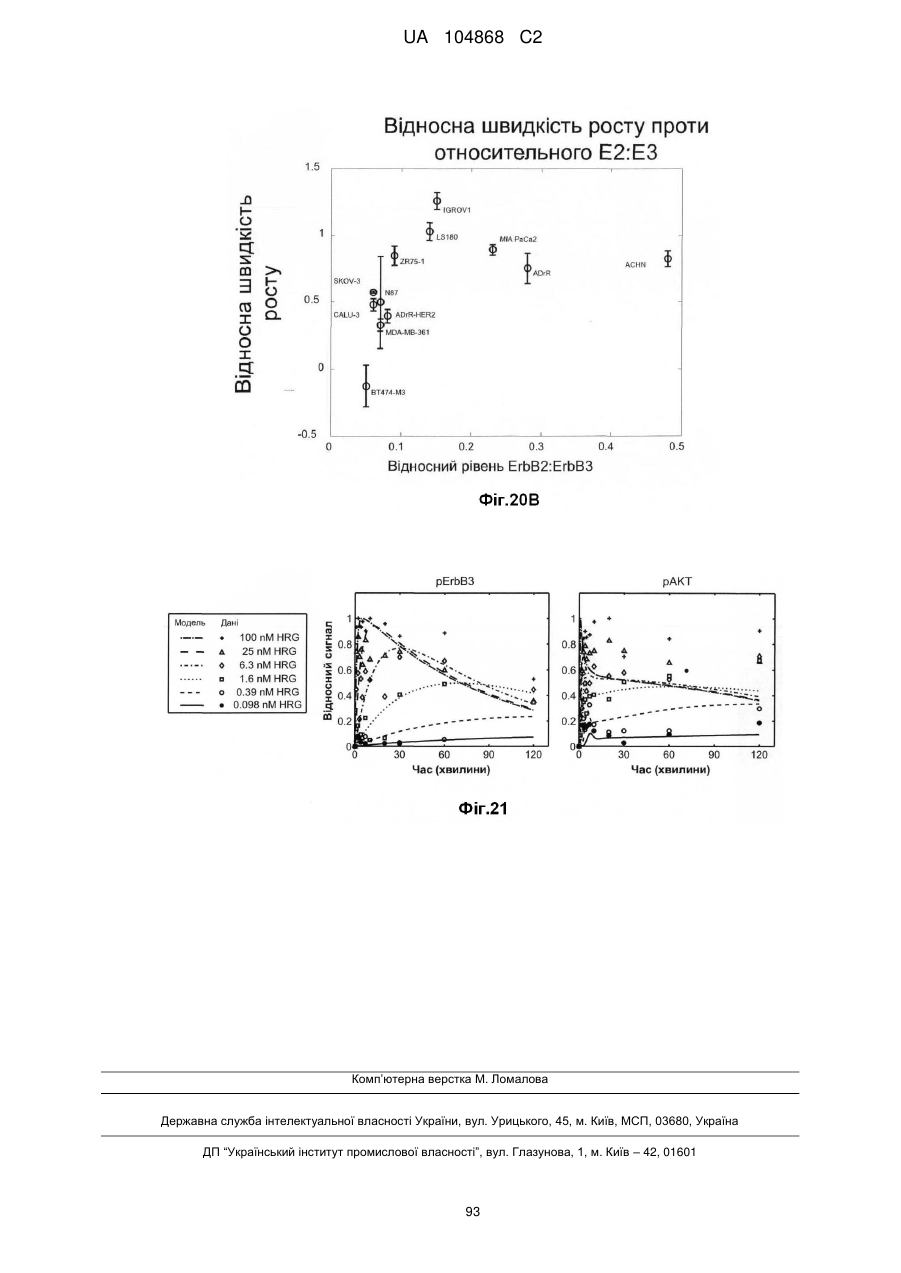
Спосіб лікування пацієнта, що має неопластичну пухлину, відповідно до спрогнозованої реакції
Номер патенту: 104868
Опубліковано: 25.03.2014
Автори: Кубасек Уільям, Онсам Метью Дейвід, Шоеберл Біргіт, Нільсен Ульрік, Фіцджеральд Джонатан Безіл, Хармс Брайєн, Гібонс Френсіс Девід
Формула / Реферат
1. Спосіб лікування пацієнта, що має неопластичну пухлину, який включає:
- визначення рівня фосфорильованого ЕrbB3 (рЕrbB3) у зразку пухлини, отриманої від пацієнта, та
- введення анти-ЕrbB3 антитіла пацієнту, за умови, що визначений рівень фосфорильованого ЕrbB3 (рЕrbB3) в пухлині пацієнта є не нижчим за 0,064 пг/мкг від загальної кількості білка.
2. Спосіб за п. 1, у якому пухлина являє собою злоякісну пухлину органа, вибраного з групи, що включає: ободову кишку, легені, пряму кишку, жовчний міхур, мозок, спинний мозок, молочну залозу, нирку, підшлункову залозу, шлунок, печінку, кістку, шкіру, селезінку, яєчник, яєчко, передміхурову залозу і м'язи.
3. Спосіб за п. 1 або п. 2, у якому анти-ЕrbB3 антитіло включає принаймні одне з:
(і) антитіло, що містить послідовності варіабельної ділянки важкого ланцюга (VH) і варіабельної ділянки легкого ланцюга (VL), показані в SEQ ID NO: 1 і 2, відповідно, або антитіло, що містить послідовності CDR VH і VL, показані в SEQ ID NO: 7-9 і 10-12, відповідно;
(іі) антитіло, що містить послідовності VH і VL, показані в SEQ ID NO: 3 і 4, відповідно, або антитіло, що містить послідовності CDR VH і VL, показані в SEQ ІD NО: 13-15 і 16-18, відповідно;
(ііі) антитіло, що містить послідовності VH і VL, показані в SЕQ ID NO: 5 і 6, відповідно, або антитіло, що містить послідовності CDR VH і VL, показані в SЕQ ID NO: 19-21 і 22-24, відповідно;
(iv) антитіло, що містить послідовності VH і VL, показані в SEQ ID NO: 25 і 26, відповідно, або антитіло, що містить послідовності CDR VH і VL, показані в SЕQ ID NО: 27-29 і 30-32, відповідно; і
(v) антитіло, що містить послідовності VH і VL, показані в SEQ ID NО: 33 і 34, відповідно, або антитіло, що містить послідовності CDR VH і VL, показані в SEQ ID NО: 35-37 і 38-40, відповідно.
4. Спосіб за будь-яким з пп. 1-3, у якому анти-ЕrbB3 антитіло включає антитіло, що містить послідовності варіабельної ділянки важкого ланцюга (VH) і варіабельної ділянки легкого ланцюга (VL), показані в SEQ ID NО: 1 і 2, відповідно, або aнтитіло, що містить послідовності CDR VH і VL, показані в SEQ ID NО: 7-9 і 10-12, відповідно.
5. Спосіб за будь-яким з пп. 1-4, у якому визначений рівень рЕrbB3 у зразку пухлини є не нижчим за 0,08 пг/мкг від загальної кількості білка.
6. Спосіб за будь-яким з пп. 1-4, у якому визначений рівень рЕrbB3 у зразку пухлини є не нижчим за 0,096 пг/мкг від загальної кількості білка.
7. Спосіб за будь-яким з пп. 1-4, у якому визначений рівень рЕrbB3 у зразку пухлини є не нижчим за 0,122 пг/мкг від загальної кількості білка.
8. Спосіб за будь-яким з пп. 1-4, у якому визначений рівень рЕrbB3 у зразку пухлини є не нижчим за 0,128 пг/мкг від загальної кількості білка.
9. Спосіб за будь-яким з пп. 1-4, у якому визначений рівень рЕrbB3 у зразку пухлини є не нижчим за 0,144 пг/мкг від загальної кількості білка.
10. Спосіб за будь-яким з пп. 1-4, у якому визначений рівень рЕrbB3 у зразку пухлини є не нижчим за 0,16 пг/мкг від загальної кількості білка.
11. Спосіб за будь-яким з пп. 1-10, де пухлина являє собою злоякісну пухлину молочної залози.
12. Спосіб за будь-яким з пп. 1-10, де пухлина являє собою злоякісну пухлину ободової кишки.
13. Спосіб за будь-яким з пп. 1-10, де пухлина являє собою злоякісну пухлину легенів.
14. Спосіб за будь-яким з пп. 1-10, де пухлина являє собою злоякісну пухлину прямої кишки або підшлункової залози.
Текст
Реферат: Винахід належить до cпособу лікування пацієнта, що має неопластичну пухлину, який включає визначення рівня фосфорильованого ЕrbB3 (рЕrbB3) у зразку пухлини, отриманої від пацієнта, UA 104868 C2 (12) UA 104868 C2 та введення анти-ЕrbB3 антитіла пацієнту, за умови, що визначений рівень фосфорильованого ЕrbB3 (рЕrbB3) в пухлині пацієнта є не нижчим за 0,064 пг/мкг від загальної кількості білка. UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 Рівень техніки Досягнуті значні успіхи в розробці таргетної терапії для лікування раку та інших захворювань. Таргетна терапія включає моноклональні антитіла, які зв'язуються з антигенами, специфічно або переважно експресованими на пухлинних клітинах, і низькомолекулярні речовини, які специфічно перешкоджають дискретним компонентам сигнальних шляхів, активним в пухлинних клітинах. Наприклад, цетуксимаб (Ербітукс®) є моноклональним антитілом, яке націлене на рецептор епідермального фактора росту (EGFR, також відомий як ErbB1 або HER1), що показане, принаймні, при раку товстої кишки і раку голови та шиї. Крім того, наприклад, іматиніб (Глівек®) є низькомолекулярною сполукою, націленою на тирозинкіназу BCR-Abl, яка експресується і виступає онкогенним фактором, при деяких видах хронічного мієлоїдного лейкозу та є аномальним варіантом доброякісного клітинного білка. Хоча було показано, що така таргетна терапія ефективна у деяких пацієнтів, її ефективність ніколи не досягає 100 %. Наприклад, середній показник ефективності для монотерапії цетуксимабом становить всього близько 15–20 % пацієнтів, навіть за наявності пухлини з відомою експресією ErbB1 (EGFR). Таким чином, явна експресія ErbB1 (антиген-мішень антитіла цетуксимаб) в пухлині не гарантує сприйнятливості до цетуксимабу. Таким чином, хоча таргетна терапія є досить перспективною, варіююча ефективність такої терапії у пацієнтів в поєднанні з побічними ефектами, пов'язаними з такою терапією і, як правило, високою вартістю такого лікування, показує, що способи лікування пацієнтів, які включають прогнозування можливої реакції пацієнтів на терапевтичне лікування і лікування тільки пацієнтів із спрогнозованою реакцією, є високою мірою бажаними. Один з підходів був розроблений для того, щоб спробувати виявити генетичні маркери (наприклад, мутації або алелі), які корелюють із сприйнятливістю до терапії. При такому способі, здійснювали генотипування вибірки пацієнтів до початку лікування, щоб визначити, чи є пацієнт носієм генетичного маркера(ів), що свідчить про сприйнятливість до терапії. Інший підхід був розроблений, щоб спробувати ідентифікувати білкові біомаркери, які корелюють із сприйнятливістю до терапії. При такому підході, експресія білка визначається в одержаних від пацієнтів зразках до початку лікування, щоб визначити, чи експресуються в організмі пацієнта один або декілька білкових біомаркерів, які вказують на чутливість до терапії. Обидва вищезазначені способи можуть вважатися підходами "прямих" маркерів, в яких наявність (або відсутність, або рівень експресії) маркера(ів) (наприклад, BCR-Abl або ErbB1) вимірюється безпосередньо, і продемонстрована кореляція чутливості або нечутливості до терапії. Крім того, обидва ці способи базуються на використанні маркерів, які є достатньо стабільними в клітинах, і можуть бути достовірно визначені кількісно в зразку, виділеному з організму пацієнта. Враховуючи, що може пройти значний період часу між моментом, коли зразок виділений з організму пацієнта і, коли вміст маркера(ів) вимірюється в зразках, такі підходи "прямих" маркерів, описані вище, як правило, вимагають використання генетичних або білкових маркерів, які не схильні до розкладу або змін з часом, коли зразки піддаються стандартній обробці і переробці. Хоча такі стабільні, "прямі" маркери, які є індикаторами реакції на певні терапевтичні засоби, були ідентифіковані, незрозуміло, чи можуть бути ідентифіковані такі маркери для всіх терапевтичних засобів. Вважається, що ріст пухлини регулюється набором сигнальних шляхів, що активуються лігандами, які звичайно активуються звя'зуванням ліганду з його спорідненими рецепторами, спричиняючи фосфорилування самого рецептора, а також подальше фосфорилування кіназ, що веде до фосфорилування наступних компонентів шляху. Такі кінази запускають механізми виживання і проліферації клітин. Таким чином, активація сигнального шляху приводить до зміни внутрішньоклітинних компонентів, зокрема, до фосфорилування білка. Ознака фосфорилування деяких рецепторів, що експресуються на пухлинній тканині, може допомогти ідентифікувати основні шляхи, які ведуть до прогресування певної пухлини. Однак, фосфопротеїни можуть бути дуже нестабільними, і фосфорилування може швидко згасати після хірургічного втручання, якщо зразок тканини не був негайно і швидко заморожений (або, в деяких випадках, зафіксований у формаліні). Більш того, навіть якщо можливо надійно виміряти рівень одного або декількох фосфопротеїнів в зразку певної пухлини, прогностичне значення наявності або відсутності того або іншого фосфопротеїну відносно ефективності лікування таких пухлин будьяким терапевтичним засобом, як правило, невідоме. Таким чином, хоча фосфопротеїнові профілі містять важливу інформацію про шляхи стимуляції прогресування пухлини, такі фосфопротеїнові профілі на даний час не поширені широко як біомаркери для прогнозування реакції на терапевтичне лікування. Відповідно, нові способи визначення рівня різноманітних фосфопротеїнів і використання таких рівнів та інших характеристик пухлинних клітин для прогнозування реакції окремих пухлин 1 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 на певні терапевтичні засоби необхідні для покращення терапевтичної і економічної ефективності лікування раку. Сутність винаходу У даному розділі представлені способи прогнозування реакції клітин, зокрема, клітин новоутворень, таких як пухлинні клітини (наприклад, клітини доброякісних пухлин або клітини злоякісних пухлин) і злоякісні клітини, які не є клітинами пухлини, на терапевтичні засоби і способи лікування пацієнтів з такими пухлинами терапевтичними засобами. З одного боку, це способи лікування хворих від злоякісних новоутворень протипухлинним терапевтичним засобом шляхом одержання зразка злоякісних клітин від пацієнта, визначення відомих біохімічних характеристик клітин в зразку, а потім введення, принаймні, одного протипухлинного терапевтичного засобу пацієнту. У деяких варіантах, біохімічні характеристики - це рівень, принаймні, одного біомаркера; у інших варіантах, рівень(ні) біомаркера(ів) визначаються шляхом вимірювання рівня інших, стабільніших, біохімічних сполук, і потім за допомогою парадигми комп'ютерного моделювання визначається рівень цільового біомаркера(ів). Терапевтичний засіб вибирають на підставі рівня(ів) біомаркера(ів); деякі препарати вводять тільки коли рівень(ні) певного(их) біомаркера(ів) перевищений. У деяких варіантах запропоновані способи лікування хворого з пухлинним новоутворенням протипухлинними терапевтичними засобами, які включають: одержання зразка пухлини (наприклад, біоптат або одержаний в результаті резекції зразок), що містить клітини пухлини, визначення рівня фосфорильованих ErbB3 (фосфо-ErbB3, pErbB3) в зразку, а потім введення, принаймні, одного антинеопластичного терапевтичного засобу хворому. Анти-ErbB3 терапевтичний засіб вводять, якщо в клітинах зразка виявлений, принаймні, мінімальний рівень pErbB3; анти-ErbB3 терапевтичний засіб не застосовується у хворих, якщо виявлено, що клітини зразка не містять, принаймні, мінімального рівня pErbB3, і тоді вводять антинеопластичний терапевтичний засіб, який не є анти-ErbB3 терапевтичним засобом. Звичайно надають перевагу анти-ErbB3 фармацевтичним засобам, що містять антитіла проти ErbB3. У деяких варіантах цього способу, рівень ErbB3 в клітинах зразка визначається логічно, шляхом вимірювання рівнів інших, стабільніших, біомаркерів, і використовується для компю'теризованого методу із застосуванням обчислювальної системи і створення комп'ютерної моделі для розрахунку (на підставі фактичних емпірично виміряних рівнів інших біомаркерів в клітинах зразка) Стану активації сигнальної мережі (Network Activation State), що дозволяє визначити за допомогою моделювання рівень pErbB3 в клітинах зразка. В рамках одного з таких варіантів запропоновані способи лікування хворих із злоякісними пухлинами, які включають: одержання зразка пухлини, визначення рівня pErbB3 в зразку, а потім введення, принаймні, одного протипухлинного терапевтичного засобу хворому; при цьому, якщо визначений рівень pErbB3 в зразку не нижчий за 50 % виміряного рівня pErbB3 в культурі клітин раку нирки ACHN (номер доступу ATCC CRL-1611), культивованих протягом 20– 24 годин в середовищі без сироватки (наприклад, RPMI), то, принаймні, один протипухлинний терапевтичний засіб, що містить анти-ErbB3 антитіла, далі вводять хворому, і, якщо певний рівень pErbB3 в зразку нижчий за 50 % виміряного рівня pErbB3 в культурі клітин раку нирок ACHN, то, принаймні, один протипухлинний терапевтичний засіб, що не містить анти-ErbB3 антитіла, далі вводять пацієнту. У деяких аспектах даного винаходу пропонуються компю'теризовані способи із застосуванням обчислювальної системи, яка включає, щонайменше, один ввідний пристрій, обладнаний для введення даних, і, принаймні, один вивідний пристрій, налаштований на одержання результату, причому вказані способи служать для прогнозування реакції клітин (наприклад, пухлинних клітин) у складі клітинної сигнальної мережі (наприклад, сигнального шляху ErbB) на лікування терапевтичними засобами, які націлені на компоненти клітинної сигнальної мережі, де вказані способи включають: (а) одержання через вказаний ввідний пристрій обчислювальної системи вхідних даних, які визначають рівні одного або декількох компонентів клітинної мережі, виміряних в зразку клітин; (б) обчислення на базі вхідних даних обчислювальної системи Стану активації мережі (САМ, NAS) або Стану інгібування мережі (СІМ, NIS) для клітин із застосуванням обчислювальної моделі клітинної сигнальної мережі; і (в), генерацію в обчислювальній системі, а потім передачу на вказаний вивідний пристрій спрогнозованої реакції клітини на лікування терапевтичними засобами на базі, принаймні, частково, обчислень САМ або СІМ в (б). З іншого боку, способи прогнозування реакції клітин на лікування терапевтичними засобами, націленими на компоненти внутрішньоклітинної сигнальної мережі (наприклад, сигнальний шлях ErbB) включають: (а) вимірювання в зразку клітин рівня одного або декількох компонентів клітинної мережі; і (б) застосування комп'ютерної реалізації способу, яка включає: (i) 2 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 обчислення Стану активації мережі (САМ) або Стану інгібування мережі (СІМ) для клітин із застосуванням обчислювальної моделі клітинної сигнальної мережі з одним або більш виміряними рівнями; і (ii) обчислення і виведення спрогнозованої реакції клітин на лікування терапевтичними засобами на базі, принаймні, частково, обчислень САМ або СІМ в (i). У деяких варіантах, такий спосіб може додатково включати лікування клітин або пацієнта, від якого клітини одержані, терапевтичними засобами на базі спрогнозованої реакції клітин на терапевтичний засіб. Крім того, наведені в даному описі способи прогнозування реакції клітин на лікування терапевтичними засобами, націленими на компоненти внутрішньоклітинної сигнальної мережі (наприклад, сигнальний шлях ErbB), - це способи, що включають: (а) вимірювання в клітинах зразка рівнів одного або декількох компонентів клітинної мережі; і (б) застосування комп'ютерної реалізації способу, яка включає: (I) обчислення обчислювальної моделі клітинної мережі із застосуванням алгоритму статистичної класифікації для введення виміряних рівнів і обчислених САМ або СІМ для клітин; і (II) прогнозування реакції клітини на лікування терапевтичним засобом, засноване, принаймні, частково на обчисленнях САМ або СІМ. Деякі варіанти таких способів можуть додатково включати лікування клітин, або пацієнта, від якого одержані клітини, терапевтичним засобом, на базі спрогнозованої реакції клітин на терапевтичний засіб. В даному винаходу також запропоновані компю'теризовані способи із застосуванням обчислювальної системи, яка містить, щонайменше, однин ввідний пристрій, обладнаний для введення даних і, принаймні, один вивідний пристрій, налаштований на одержання результату, причому вказані способи служать для прогнозування реакції клітин на лікування терапевтичним засобом, який націлений на компоненти клітинної мережі, де такі способи включають: (а) одержання через вказаний ввідний пристрій обчислювальної системи вхідних даних, які визначають рівні одного або декількох компонентів клітинної мережі, виміряні в зразку клітин; (б) обчислення на базі вхідних даних обчислювальної системи Стану активації мережі (САМ) або стану інгібування мережі (СІМ) для клітин із застосуванням обчислювальної моделі клітинної сигнальної мережі; (в) застосування алгоритму статистичної класифікації обчислювальної системи; і (г), генерація в обчислювальній системі, а потім передача на вказаний вивідний пристрій спрогнозованої реакції клітини на лікування терапевтичним засобом на базі, принаймні частково, результату алгоритму статистичної класифікації. Також в даному винаході пропонуються способи прогнозування реакції клітин на лікування терапевтичними засобами, націленими на компоненти сигнального шляху ErbB. Деякі такі способи включають: (а) вимірювання в клітинах зразка рівнів (I) херегуліну (HRG) і (II), принаймні, одного з вибраних рецепторів ErbB1, ErbB2 і ErbB3; і (б) прогнозування із застосуванням обчислень реакції клітин на лікування терапевтичними засобами в залежності від рівня, виміряного в (а), де підвищений рівень HRG і, принаймні, одного рецептора, в порівнянні з контролем, прогнозує реакцію на лікування терапевтичним засобом. Інші такі способи включають: (а) вимірювання в клітинах зразка рівнів одного або декількох гетеродимерів ErbB1/ErbB3, мономерів ErbB2, гомодимерів ErbB2/ErbB2, фосфорильованих гомодимерів ErbB2/ErbB2, гетеродимерів ErbB2/ErbB3, фосфорильованих гетеродимерів ErbB1/ErbB3 і фосфорильованих гетеродимерів ErbB2/ErbB3, гетеродимерів ErbB2/ErbB4, фосфорильованих гетеродимерів ErbB2/ErbB4, гетеродимерів ErbB3/ErbB4, фосфорильованих гетеродимерів ErbB3/ErbB4; і (б) прогнозування із застосуванням обчислення реакції клітин на лікування терапевтичним засобом в залежності від рівня, виміряного в (а), при цьому різниця в рівні гетеродимерів ErbB1/ErbB3, мономерів ErbB2, гомодимерів ErbB2/ErbB2, гетеродимерів ErbB2/ErbB3, фосфорильованих гетеродимерів ErbB1/ErbB3 або фосфорильованих гетеродимерів ErbB2/ErbB3 в порівнянні з контролем, прогнозує реакцію на лікування терапевтичним засобом. У деяких варіантах такий спосіб може додатково включати лікування клітин, або пацієнта, від якого одержані клітини, терапевтичним засобом, на підставі спрогнозованої реакції клітин на терапевтичний засіб. У даному винаході також пропонуються компю'теризовані способи із застосуванням обчислювальної системи, яка включає, щонайменше, один ввідний пристрій, обладнаний для введення даних і, принаймні, один вивідний пристрій для виведення результату, причому вказані способи служать для прогнозування реакції клітин на лікування терапевтичним засобом, який націлений на компоненти сигнального шляху ErbB. Деякі з таких способів включають: (а) одержання через вказаний ввідний пристрій обчислювальної системи вхідних даних, які визначають виміряні рівні (I) HRG і (II), принаймні, одного з вибраних рецепторів ErbB1, ErbB2 і ErbB3, виміряні в клітинах зразка; і (б), генерацію в обчислювальній системі, а потім передачу на вказаний вивідний пристрій, спрогнозованої реакції клітин на лікування терапевтичним засобом на базі виміряних рівнів, де підвищені рівні HRG і, принаймні, одного рецептора, в 3 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 порівнянні з контролем, прогнозують реакцію на лікування терапевтичним засобом. Інші такі способи включають: (а) одержання, через вказаний ввідний пристрій обчислювальної системи вхідних даних, які визначають виміряні рівні одного або декількох гетеродимерів ErbB1/ErbB3, мономерів ErbB2, гомодимерів ErbB2/ErbB2, гетеродимерів ErbB2/ErbB3, фосфорильованих гетеродимерів ErbB1/ErbB3 і фосфорильованих гетеродимерів ErbB2/ErbB3, виміряних в клітинах зразка; і (б) генерацію в обчислювальній системі, а потім передачу на вказаний вивідний пристрій спрогнозованої реакції клітин на лікування терапевтичним засобом на базі виміряних рівнів, в яких різниця в рівнях гетеродимерів ErbB1/ErbB3, мономерів ErbB2, гомодимерів ErbB2/ErbB2, гетеродимерів ErbB2/ErbB3, фосфорильованих гетеродимерів ErbB1/ErbB3 або фосфорильованих гетеродимерів ErbB2/ErbB3 в порівнянні з контролем прогнозує реакцію на лікування терапевтичним засобом. В інших аспектах даного винаходу пропонуються набори для прогнозування реакції клітин на лікування терапевтичними засобами, націленими на компоненти клітинної сигнальної мережі, які включають: (а) тести для визначення рівня одного або декількох компонентів клітинної мережі; і (б) інструкції з розрахунку Стану активації мережі (САМ) або Стану інгібування мережі (СІМ, СІМ) для клітин із застосуванням обчислювальної моделі клітинної мережі. У деяких аспектах, такі набори додатково містять: (в) інструкції з використання набору для прогнозування реакції клітини на лікування терапевтичним засобом. У даному винаході також пропонуються способи визначення біомаркерів для прогнозування реакції клітин на лікування терапевтичними засобами, націленими на компоненти клітинної мережі, в тому числі: (а) вимірювання в зразку клітин рівня одного або декількох компонентів клітинної мережі; і (б) застосування комп'ютерної реалізації методу, яка включає: (I) обчислення рівнів одного або декількох додаткових компонентів клітинної мережі за допомогою обчислювальної моделі клітинної мережі; і (II) визначення компонентів клітинної мережі, обчислений рівень яких прогнозує реакцію клітин на лікування терапевтичним засобом, щоб таким чином виявити компоненти, які служать біомаркерами для прогнозування реакції клітин на лікування терапевтичними засобами. Також в даному винаході пропонуються компю'теризовані способи із застосуванням обчислювальної системи, яка містить, щонайменше, один ввідний пристрій, обладнаний для введення даних і, принаймні, один вивідний пристрій, налаштований на виведення результату, причому вказані способи служать для визначення біомаркерів для прогнозування реакції клітин на лікування терапевтичними засобами, які націлені на компоненти клітинної мережі, причому такі способи включають: (а) одержання через вказаний ввідний пристрій обчислювальної системи вхідних даних, які визначають рівні одного або декількох компонентів клітинної мережі, виміряні в зразку клітин (б) обчислення на базі вхідних даних обчислювальної системи рівнів одного або декількох додаткових компонентів клітинної мережі із застосуванням обчислювальної моделі клітинної сигнальної мережі; і (в) визначення за допомогою обчислювальної системи компонентів клітинної мережі, обчислений рівень яких прогнозує реакцію клітин на лікування терапевтичним засобом, і тим самим ідентифікація біомаркерів як компоненту для прогнозування реакції клітин на лікування терапевтичними засобами. Додатково, в даному винаході пропонується обчислювальна програма, що включає один або декілька комп'ютерних накопичувачів, забезпечених модулем виконання інструкцій, які виконуються при здійсненні будь-якого з вищенаведених способів. Короткий опис фігур Фігури 1А–1D є графіками, що показують інгібування росту ксенотрансплантата пухлини, обробленого антитілом Ab #6. Фігура 1А показує результати для моделі ксенотрансплантата пухлини MALME3M. Фігура 1B показує результати для моделі ксенотрансплантата пухлини DU145. Фігура 1С показує результати для моделі ксенотрансплантата пухлини ADRr. Фігура 1D показує результати для моделі ксенотрансплантата пухлини ACHN. Фігура 2 являє собою графік концентрації фосфорильованих ErbB3 (pErbB3) в ксенотрансплантаті пухлини (у пг/мкг загального білка) проти уповільнення темпів росту (%), спостережуваного при лікуванні ксенотрансплантата Ab #6. Фігури 3A-3E - це гістограми, що показують рівень pErbB3 (фіг. 3А) і фосфорильованих протеїнкіназ (рAKT) (фіг. 3В) в зразках ксенотрансплантата пухлини ACHN, заморожених через 0, 10, 30 або 60 хвилин після препарування ксенотрансплантата, і рівні ErbB1 (фіг. 3C), ErbB2 (фіг. 3D) і ErbB3 (фіг. 3E) в зразках ксенотрансплантата EKVX пухлини, заморожених через 0, 10, 30 або 60 хвилин після препарування ксенотрансплантата. На фігурах 4А–4D показана схематична діаграма перетворення динамічного зображення сигнального шляху на обчислювальну модель. Фігура 4А показує динамічне зображення сигнального шляху ErbB, що містить різні ліганди і рецептори ErbB. Фігура 4В показує множину 4 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 біохімічних реакцій, що описують білкові взаємодії у вигляді динамічного зображення. Фігура 4C показує множину змін, одержаних з множини біохімічних реакцій. Фігура 4D показує множину нелінійних звичайних диференціальних рівнянь (ЗДУ) з урахуванням кінетики, що характеризує мережі трансдукції сигналу. Фігури 5А-5В - це графіки, що показують рівні фосфо-ErbB3, фосфо-ErbB2, фосфо-ErbB1 і фосфо-AKT в часі у клітинах, стимульованих дев'ятьма різними концентраціями херегуліну (HRG) (фіг. 5А) або бета-целюліну (фіг. 5В) в клітинах раку яєчників ADRr. Параметри обчислювальної моделі були відкалібровані для результатів моделювання (суцільні лінії) з метою опису експериментальних даних (точки). Фігура 6 - це гістограма, що показує результати аналізу локальної чутливості для визначення ключових маркерів активації ErbB3. Фігура 7 являє собою графік обчислення рівнів pErbB3 в лініях клітин MALME3M, DU145, ADRr і ACHN. Фігури 8А-8B - це графіки, що показують застосування значення Стану активації мережі (САМ) для прогнозування реакції 15 клітинних ліній на лікування Ab #6, на базі порогу значень САМ, встановлене на 4 досліджених клітинних лініях (MALME3M, DU145, ADRr і ACHN). На фігурі 8А представлена гістограма, що моделює рівні pErbB3 для 19 клітинних ліній, від найвищого до найнижчого рівня pErbB3. Фігура 8B - це лінійний графік значень 19 клітинних ліній від найвищого до найнижчого значення САМ, де клітинні лінії із значенням САМ нижче за значення MALME3M позначені як резистентні (NR), а клітинні лінії із значенням САМ вище за значення ADRr позначені як реагуючі на лікування, і клітинні лінії із значенням САМ між значеннями MALME3M і ADRr позначені як невизначені. Фігури 9А-9C - це графіки, що показують інгібування росту ксенотрансплантата пухлини, обробленого антитілом Ab #6. Фігура 9А показує результати для моделі ксенотрансплантата пухлини IGROV1. Фігура 9B показує результати для моделі ксенотрансплантата пухлини OVCAR8. Фігура 9C показує результати для моделі ксенотрансплантата пухлини SKOV3. Фігури 10А-10D - це графіки, на яких логарифм концентрації одного рецептора ErbB нанесений проти логарифма концентрації одного або декількох інших рецепторів ErbB. Значення рецепторів для наведених клітинних ліній класифікуються як реагуючі або не реагуючі на Ab #6. Фігура 10А - це графік порівняння ErbB2 і ErbB1. Фігура 10В - це графік порівняння ErbB3 і ErbB1. Фігура 10C - це графік порівняння ErbB2 і ErbB3. Фігура 10D - це графік порівняння ErbB1 з ErbB2 і ErbB3. На фігурі 11 показаний графік, на якому логарифм концентрації HRG нанесений проти логарифма концентрації ErbB1. На графіку виділені реагуючі в порівнянні з не реагуючими клітинними лініями в дослідженнях ксенотрансплантата. Фігури 12A-12C - це графіки, на яких нанесений логарифм впорядкованого рівня експресії (у пг/мкг, визначений за методом ELISA) різних компонентів ErbB сигнального шляху ксенотрансплантата клітинних ліній і зразків пухлини людини. Фігура 12А - це графік ErbB2 в порівнянні з ErbB1. Фігура 12B - це графік ERBB4 в порівнянні з ErbB3. Фігура 12С - це графік HRG- β1 в порівнянні з BTC. Фігури 13А-13D - це графіки, що показують кількісні імуногістохімічні (qIHC) результати для ксенотрансплантатів клітинних ліній і зразків пухлини людини. На фігурі 13А показана стандартна крива клітинної лінії для ErbB1. Фігури 13B, 13C і 13D - це гістограми оцінки qIHC для ErbB1, ErbB2 і ErbB3, відповідно, в ксенотрансплантатах клітинних ліній (червоні стовпчики) і зразках пухлини людини (сині лінії). Фігури 14 являє собою гістограму, що показує сумарний вміст фосфорильованого ErbB1: 3 рівні гетеродимеру (кількість інтегрованого в часі гетеродимеру на клітину), обчислені для 8 клітинних ліній, які розділені на не реагуючі (MALME3M, BT474, IGROV1 і ADRr) і реагуючі (OVCAR8, SKOV3, DU145 і ACHN) на Ab # 6. Фігури 15А і 15В показує блок-схеми, що включають різні функціональні кроки і дії, які можуть бути виконані в ході реалізації деяких варіантів винаходу. Фігура 16 є одним з варіантів обчислювальної схеми, яка може бути використана для реалізації деяких аспектів винаходу. Фігури 17A-D - це графіки кривих інгібування для клітин, оброблених біспецифічними антитілами H3xB1D2. Фігури 17А і 17В показують криві інгібування для рівнів pErbB3 і рівнів рakt, відповідно, в клітинах OVCAR8. Фігури 17C і 17D показують криві інгібування для рівнів pErbB3 і рівнів рakt, відповідно, в клітинах OVCAR8 трансфікованих HER2/ErbB2 (клітини OVCAR8-HER2). Суцільна лінія модельних даних одержана з обчислювальної моделі, в той час, як круги представляють дані, одержані експериментальним шляхом. Змодельовані значення IC50 (DR50sim) і експериментальні значення IC50 (DR50data) також показані. 5 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фігури 18A-D - це графіки кривих інгібування для клітин, оброблених біспецифічними антитілами H3хB1D2. Фігури 18А і 18Б показують криві інгібування для рівнів pErbB3 і рівнів рAKT, відповідно, в клітинах ADrR. Суцільна лінія модельних даних одержана з обчислювальної моделі, в той час, як круги представляють дані, одержані експериментальним шляхом. Змодельовані значення IC50 (DR50sim) і експериментальні значення IC50 (DR50data) також показані. Фігури 18C і 18D показують змодельовані криві інгібування для рівнів pErbB3 і рівнів рakt, відповідно, в клітинах ADrR з імітацією лікування іРНК ErbB1. Фігури 19А-С - це графіки визначеної in vivo відносної швидкості росту (RGR) для групи пухлинних клітин моделі ксенотрансплантата, обробленого H3хB1D2, в залежності від обчислювальних рівнів мономерів ErbB2 (фіг. 19А), гомодимерів ErbB2:ErbB2 (фіг. 19В) і гетеродимерів ErbB2:ErbB3 (фіг. 19C) в групі пухлинних клітин без H3 х B1D2. Фігури 20A-B - це графіки визначеної in vivo відносної швидкості росту (RGR), для групи пухлинних клітин моделі ксенотрансплантата, обробленого H3 х B1D2, в залежності від обчислених відносних рівнів гетеродимерів ErbB2:ErbB3 (фіг. 20А) і гетеродимерів ErbB1:ErbB3 (фіг. 20В) в групі пухлинних клітин в моделі за відсутності і в присутності H3хВ1D2. Фігура 21 являє собою графічне зображення прогнозованих (лінія, побудована по точках) і фактичних (точки) даних індукованого HRG проведення сигналу pErbB3 і рakt в надмірно експресуючій ErbB2 клітинній лінії BT474-M3 при дозах HRG, як вказано і як описано в Прикладі 11. Докладний опис винаходу Даний винахід в цілому пропонує способи, системи і продукти комп'ютерної програми, в яких стан активації одного або декількох елементів (наприклад, ErbB3) одного або декількох клітинних сигнальних шляхів визначається шляхом використання непрямих маркерів, а не шляхом прямого вимірювання рівня одного або декількох елементів. Такі непрямі вимірювання можуть бути використані для визначення стану активації елементів сигнального шляху шляхом комп'ютерного моделювання, за допомогою моделі сигнального шляху. Застосовуючи способи, запропоновані в даному винаході, одержану інформацію можна використовувати для прогнозування реакції клітин на терапевтичні засоби, і, таким чином, вибирати схему лікування для пацієнтів із захворюваннями або розладами (такими як рак). Завдяки застосуванню винаходу, можна визначити типові властивості фосфорилування пухлинних клітин в зразку. Це дозволяє використовувати фосфорильовані клітинні білки як біомаркери для визначення реакції на терапевтичні засоби, без необхідності безпосереднього вимірювання рівня таких фосфопротеїнів в клінічних зразках, що дозволяє уникнути потенційних проблем, пов'язаних з вимірюванням фосфопротеїнів (наприклад, нестабільності, ненадійності). Таке моделювання типових властивостей фосфорилування може бути використане для точного прогнозування реакції клітин на протипухлинні терапевтичні засоби, і, отже, може бути використане, щоб уникнути введення пацієнтам тих протиракових препаратів, які будуть неефективними для лікування раку у даного пацієнта. Крім того, розкриті способи дозволяють моделювати рівні інших лабільних компонентів внутрішньоклітинної мережі, таких як гомота/або гетеродимери рецепторів або фосфорильовані гомо- та/або гетеродимери; у клітинних системах такі компоненти також можуть бути використані для прогнозування реакції клітин на терапевтичні засоби. Більше того, розкриті способи дозволяють моделювати вплив лікарських засобів на компоненти внутрішньоклітинної мережі, що також може бути використане для прогнозування реакції клітин на терапевтичні засоби. У деяких способах рівень одного або декількох стабільних клітинних компонентів (таких як рецептори клітинної поверхні, ліганди і т. п.) внутрішньоклітинної мережі вимірюється в клітинах зразка (наприклад, біоптаті або одержаному в результаті резекції зразку). На основі результатів вимірювання, Стан активації мережі (або САМ) або Стан інгібування мережі (СІМ) в клітинах обчислюється із застосуванням обчислювальної моделі (наприклад, теоретична обчислювальна модель) одного або декількох сигнальних шляхів. Наприклад, САМ може бути числовим значенням, що представляє обчислений рівень фосфорильованих білків (який не був безпосередньо виміряний) в клітинній системі. І навпаки, СІМ може бути числовим значенням, що представляє обчислений рівень компоненту внутрішньоклітинної мережі в моделі за наявності терапевтичного засобу (в порівнянні з рівнем компоненту в моделі за відсутності терапевтичного засобу). Порівнюючи обчислені значення САМ або СІМ з контрольним значенням, що являє собою порогове значення чутливості або нечутливості, можна передбачити, чи реагуватимуть клітини на терапевтичний засіб. Таким чином, показане використання "непрямих" маркерів чутливості клітин до лікування, при якому рівень "непрямих" маркерів (наприклад, фосфорильованих білків або димерів активованих сигнальних шляхів) не вимірюється безпосередньо, а обчислюється або 6 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 моделюється на базі рівнів інших клітинних компонентів, які вимірюються безпосередньо. Способи також можуть включати застосування класифікації статистичної алгоритмів, наприклад, поєднання обчислень САМ або СІМ. У контексті даного винаходу, і, як описано далі в розділі Приклади, теоретична обчислювальна модель ErbB сигнального шляху успішно застосовується для обчислення рівнів фосфорильованих ErbB3 (pErbB3), як індикаторів активації клітинної мережі ErbB (або САМ), і змодельовані рівні pErbB3 точно передбачають реакцію пухлинних клітинних ліній на лікування анти-ErbB3 антитілами Ab #6 в системі ксенотрансплантата in vivo. Крім того, як описано далі в розділі Приклади, теоретична обчислювальна модель ErbB сигнального шляху була успішно застосована для обчислення відносних рівнів гетеродимерів ErbB2/ErbB3 і гетеродимерів ErbB1/ErbB3 при моделюванні за відсутності і в присутності терапевтичних засобів, як індикатор інгібування ErbB клітинної мережі (або СІМ), і при моделюванні відносних рівнів гетеродимерів ErbB2/ErbB3 і ErbB1/ErbB3 була точно передбачена реакція ліній пухлинних клітин на лікування анти-ErbB3 х анти-ErbB2 біспецифічними антитілами H3 х B1D2 в системі ксенотрансплантата in vivo. Для спрощення розуміння винаходу нижче визначені деякі терміни. У даному описі термін "терапевтичний засіб" включає всі без винятку сполуки, які здатні знижувати або зменшувати тяжкість симптомів захворювань або порушень, або збільшувати частоту та/або тривалість періодів ремісії в ході захворювання або розладу, або гальмувати або запобігати погіршенню або втраті працездатності, у зв'язку із захворюванням або розладом, або перешкоджати або гальмувати прогресування захворювання або розладу, або перешкоджати або затримувати початок розвитку захворювання або розладу, або пригнічувати або запобігати інфекціям або інфекційне захворювання або розлад. Необмежуючими прикладами терапевтичних засобів є низькомолекулярні органічні сполуки, моноклональні антитіла, біспецифічні антитіла, рекомбінантні біопрепарати, іРНК сполуки і т. п. У даному описі поняття терапевтичного засобу, "націленого на компонент внутрішньоклітинної мережі", відноситься до засобів, терапевтична активність яких, принаймні частково, є результатом наявності агента, що здійснює специфічний прямий або непрямий вплив на активність компоненту в межах клітинної мережі. Необмежуючими прикладами терапевтичних засобів, націлених на компоненти клітинної мережі, є моноклональне антитіло цетуксимаб, яке специфічно зв'язується з ErbB1, і, таким чином, специфічно націлене на ErbB1 в клітинній системі ErbB, і гефітиніб, синтетичний препарат, який специфічно інгібує тирозинкіназний (ТК) домен ErbB1, і, таким чином, специфічно націлений на ErbB1-ТЗ в межах клітинної мережі ErbB. У даному описі термін "Стан активації мережі" або "САМ" відноситься до показників; як правило, це числове значення, яке відображає або відповідає рівню активності клітинної мережі. САМ звичайно обчислюється із застосуванням обчислювальної моделі клітинної мережі. САМ може бути, наприклад, змодельованим рівнем одного або декількох фосфорильованих білків в клітинній системі. Хоча один або декілька рівнів фосфопротеїнів є переважним варіантом для САМ (наприклад, рівень PErbB3, як описано далі в Прикладі 7, або рівень фосфорильованого гомодимеру або гетеродимерів ErbB, такого як гетеродимер pErbB1/ErbB3, як описано далі в Прикладі 10, або рівні нижчележачих кіназ, таких як PI3K), інші клітинні компоненти в межах активованого сигнального шляху можуть служити індикатором(ами) активації мережі і, таким чином, можуть бути використані як САМ, зокрема, не обмежуючись ними, димеризація рецепторів (гомодимери і гетеродимери, наприклад, рівні гомодимерів ErbB1/ErbB1 або ErbB2/ErbB2 або рівні гетеродимерів ErbB1/ErbB2, ErbB1/ErbB3, ErbB1/ErbB4, ErbB2/ErbB3 або ErbB2/ErbB4), розщеплювання білка, активацію факторів транскрипції та активацію експресії генів. Стан активації клітинної мережі, наприклад, пухлинних клітин, є показником залежності клітин від цього сигнального шляху, який може бути інгібований терапевтичним засобом, націленим саме на цей сигнальний шлях. У даному описі термін "Стан інгібування мережі" або "СІМ" відноситься до показників; як правило, це числове значення, яке відображає або відповідає, рівню інгібування клітинної мережі. СІМ звичайно обчислюється із застосуванням обчислювальної моделі клітинної мережі. СІМ може представляти, наприклад, змодельований рівень одного або декількох компонентів внутрішньоклітинної мережі в моделі за наявності терапевтичного засобу, в порівнянні з (або відносно) змодельованим рівнем(ями) в моделі за відсутності терапевтичного засобу. Наприклад, СІМ може бути представлене як співвідношення рівня одного або декількох компонентів в моделі за наявності терапевтичного засобу і рівня одного або декількох компонентів в моделі за відсутності терапевтичного засобу. Необмежуючими прикладами СІМ є обчислені відносні рівні одного або декількох гомо- або гетеродимерів (наприклад, відносно 7 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 рівнів гетеродимерів ErbB2/3 і ErbB1/3), обчислених в моделі за відсутності і в присутності терапевтичного засобу (тобто, рівень в моделі за наявності терапевтичного засобу в порівнянні з рівнем в моделі за відсутності терапевтичного засобу). Однак, слід враховувати, що інші клітинні компоненти в сигнальних шляхах, рівні яких модулюються терапевтичним засобом, також можуть служити індикатором(ами) інгібування мережі і, отже, їх рівні можуть бути використані як показники СІМ. СІМ клітин і САМ клітин, наприклад пухлинних клітин, є показниками впливу терапевтичного засобу на компоненти сигнальних шляхів клітин, і дозволяють прогнозувати реакцію клітин на терапевтичні засоби. Термін "обчислювальна модель клітинної мережі" відноситься до моделі, обчисленої комп'ютерною програмою, яка переводить схему або динамічне зображення біологічних шляхів (наприклад, множину білкових взаємодій, що мають відношення до раку) в набір математичних рівнянь, придатних для подальшого моделювання і аналізу. Деяка інформація (наприклад, концентрації ліганду та/або рецепторного білка, константи швидкості) може бути введена в модель, здатну імітувати додаткову інформацію, яка не може бути явно виміряна (наприклад, рівні фосфопротеїнів). Стан активації мережі (або САМ) або Стан інгібування мережі (або СІМ) для внутрішньоклітинної мережі можна обчислити за допомогою обчислювальної моделі клітинної мережі, як описано в даному описі. У даному описі термін "алгоритм" в цілому відноситься до набору інструкцій, процедур або формул, для застосування методу або рішення проблеми. Термін "алгоритм статистичної класифікації" відноситься до алгоритму, який визначається статистичним зв'язком між одним або декількома виміряними параметрами, або вхідними даними (наприклад, рівнями білка, виміряними в зразку тканини) і конкретними результатами або вихідними даними (наприклад, реакцією на терапевтичний засіб), які класифікуються і дають прогноз (наприклад, чутливість проти нечутливості до терапевтичного засобу). Використаний в даному описі термін "біомаркер" відноситься до речовин (наприклад, білків, мРНК, алелів), що знаходяться або експресуються в клітинах, в яких біомаркери корелюють із сприйнятливістю захворювання до призначеного лікування. В даному описі термін "прямі біомаркери" відноситься до речовин (наприклад, білків, мРНК, алелів) що знаходяться або експресуються в клітинах, в яких прямі біомаркери корелюють із сприйнятливістю захворювання до призначеного лікування, і де наявність або рівень цієї речовини вимірюється безпосередньо в клітинах, щоб таким чином спрогнозувати реакцію захворювання на призначене лікування. У даному описі термін "непрямі біомаркери" відноситься до речовин (наприклад, білків, мРНК, алелів), що знаходяться або експресуються в клітинах, в яких прямі біомаркери корелюють із сприйнятливістю захворювання до призначеного лікування, і де наявність або рівень цієї речовини не вимірюється безпосередньо в клітинах, але визначається непрямим шляхом, наприклад, шляхом моделювання із застосуванням обчислювальної моделі, тим самим прогнозуючи реакцію захворювання на призначене лікування. "Антитіла" в даному описі являють собою білки, що складаються з одного або декількох поліпептидів, що містять домени звя'зування, кодовані генами імуноглобулінів або фрагментами генів імуноглобулінів, за допомогою яких імуноспецифічний білок зв'язується з антигеном. Розпізнавані гени імуноглобулінів включають гени константної ділянки капа, лямбда, альфа, гама, дельта, іпсилон і мю, а також численні гени варіабельної ділянки імуноглобулінів. Легкі ланцюги класифікуються як капа або лямбда. Важкі ланцюги класифікуються як гама, мю, альфа, дельта або іпсилон, що, у свою чергу, визначає імуноглобуліни класів IgG, IgM, IgA, IgD і IgE, відповідно. Типова структурна одиниця імуноглобуліну являє собою тетрамер, що складається з двох ідентичних пар поліпептидних ланцюгів, одна пара "легких" ланцюгів (близько 25 кДа) і одна "важких" ланцюгів (близько 50–70 кДа). "VL" і "VH" - це легкі і важкі ланцюги, відповідно. Антитіла включають інтактні імуноглобуліни, а також антиген-звя'зуючі їх фрагменти, які можуть бути одержані при обробці різноманітними пептидазами, або синтезовані хімічно de novo, із застосуванням методу рекомбінантної ДНК. До таких фрагментів відносяться, наприклад, F(ab)2 димер і Fab мономер. Представлені антитіла являють собою одноланцюгові антитіла (антитіла, які існують у вигляді одного поліпептидного ланцюга), як правило, одноланцюгові антитіла Fv (scFv), в яких ланцюги VH і VL зє'днані (безпосередньо або через пептидний лінкер) у формі стабільного поліпептиду. 5132405, і 4956778). "Імуноспесифічні" або "імуноспецифічно" відноситься до антитіл, які зв'язуються за допомогою доменів, в основному кодованих генами імуноглобулінів або фрагментами генів імуноглобулінів, з одним або декількома епітопами цільового білка, але які в незначній мірі розпізнають і зв'язуються з іншими молекулами в зразку, що містить змішану популяцію 8 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 антигенних молекул. Як правило, антитіла зв'язуються з розпізнаним антигеном з константою дисоціації Kd не менше 50 нМ, що вимірюється за методом резонансу поверхневого плазмону або методом звя'зування з клітинами. Застосування таких методів добре відоме в цій галузі, і підтверджене в Прикладі 13 даного опису. "Анти-ErbB3 антитіло" - це виділене антитіло, яке зв'язується імуноспецифічно з ектодоменом ErbB3. Таке звя'зування з ErbB3 дає Kd не менше 50 нМ, при вимірюванні методом резонансу поверхневого плазмону або методом звя'зування з клітинами. Звичайно розглядаються анти-ErbB3 антитіла, які інгібують опосередковане EGF-подібним лігандом фосфорилування ErbB3. EGF-подібні ліганди включають EGF, TGFα, бета-целюлін, що епідермальний фактор росту, зв'язується з гепарином, бірегулін, епіген, епірегулін і амфірегулін, які звичайно зв'язуються з ErbB1 та індукують гетеродимеризацію ErbB1 з ErbB3. Термін "біспецифічні" в даному описі відноситься до білків, що включають два антигензвя'зуючі сайти, де перший сайт звя'зування володіє спорідненістю до першого антигену або епітопу і другий сайт звя'зування володіє спорідненістю до другого антигену або епітопу, відмінному від першого. У даному описі термін "суб'єкт" або "пацієнт (хворий)" позначає будь-яку людину або тварину, що не відноситься до Homo sapiens, із захворюваннями або розладами, при яких реакція на лікування терапевтичним засобом може бути спрогнозована вказаними способами за винаходом, наприклад, суб'єкт або пацієнт з пухлиною. Термін "тварина, що не відноситься до Homo sapiens" включає всіх хребетних, наприклад, ссавців і не ссавців, таких як примати, вівці, собаки, кішки, коні, корови, кури і т.п. Багато із способів здійснення даного винаходу включають одну або декілька обчислювальних систем, наприклад, обчислювальна машина спеціального призначення і загального призначення, включаючи різноманітне комп'ютерне апаратне забезпечення, таке як ввідний пристрій даних, вивідний пристрій даних, процесор(и), накопичувач інформації та інші відповідні вузли обчислювальної машини. Багато із способів за винаходом також включають зчитуваний пристрій обчислювальної мережі, що запам'ятовує, включаючи виконуваний модуль машинних команд або структур даних, що зберігаються там (зокрема, інструкції і дані структури, визначені в даному описі, такі як теоретична обчислювальна модель, виміряні рівні білка і біомаркерів, класифікація алгоритмів, статус мутації, і т. д.), і які спеціально побудовані для реалізації описаних способів, заявлених в даному винаході. Такими зчитуваними пристроями обчислювальної мережі, що запам'ятовують, можуть бути будь-які наявні засоби, для яких може бути доступна обчислювальна машина спеціального або загального призначення. Як приклад, не обмежуючись ними, такі зчитувані пристрої обчислювальної системи, що запам'ятовують, можуть містити RAM, ROM, EEPROM, CD-ROM або інші оптичні диски, магнітні диски або інші магнітні пристрої для зберігання даних, або будь-який інший носій, який може бути використаний для зберігання необхідної програми управління, що передбачає модулі і програмне забезпечення у вигляді виконуваних комп'ютером інструкцій або структур даних, і, яка може бути доступна для загальних цілей або спеціальних комп'ютерних цілей. В деяких випадках передача інформації може також використовуватися для перенесення інструкцій виконуваного модуля обчислювальної мережі, таким чином, що даний винахід розповсюджується на додатки, мережі та інші варіанти конструкції, включаючи засіб передачі даних, для перенесення інструкцій виконуваного модуля обчислювальної машини, які виконуються для здійснення одного або декількох процесів, описаних в даному описі. Коли інформація передається або надається через систему або інше комунікативне з'єднання (будьяка апаратна, бездротова мережа або комбінація апаратної і бездротової мережі) комп'ютера, комп'ютер правильно оцінює з'єднання, як зчитуваний обчислювальною системою засіб передачі. Терміни "виконуваний модуль інструкцій обчислювальної системи", "виконувані інструкції", "модулі" та "обчислювальні модулі" іноді використовуються в даному описі рівнозначним чином і позначають код обчислювальної системи, структуру даних і програмне забезпечення, включаючи доступ і виконання одного або декількох обчислювальних процесорів і технологічних компонентів однієї або декількох обчислювальних систем для реалізації деяких способів за винаходом, як це вказано в даному описі і як викладено у формулі винаходу. Додаткові аспекти, що стосуються вищевикладеного, і різноманітні додаткові аспекти даного винаходу описані детальніше в наступних підрозділах, які не вважаються вичерпними. I. Теоретичні обчислювальні моделі Теоретичні обчислювальні моделі можна розглядати як передбачуваний математичний опис молекулярної взаємодії в білковій системі. Принаймні, деякі варіанти способів, наведених в 9 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 даному описі для прогнозування реакції на терапевтичні засоби, включають використання теоретичної обчислювальної моделі. Теоретичні обчислювальні моделі перетворюють схеми або динамічні зображення біологічних шляхів (наприклад, множину білкових взаємодій, що відбуваються паралельно із шляхом сигнальної трансдукції, наприклад, шлях, пов'язаний з раком) в набір математичних рівнянь, придатних для подальшого моделювання і аналізу. Таким чином, першим кроком в побудові моделі є генерація докладної схеми або динамічного зображення представленої біологічної реакції, яка включає відповідні білки і молекули, що беруть участь в шляху. Критичні рішення повинні бути ухвалені відносно того, які білки і молекули повинні бути включені, а також біологічних реакції, що їх пов'язують. Інформація, що міститься в науковій літературі, про білок і молекули, що беруть участь в шляху, та про біологічні реакції, які їх сполучають, зібрана і використана для ряду динамічних зображень представлених біологічних реакцій. Як тільки динамічне зображення, що представляє біологічний шлях, згенероване, ця інформація переводиться в систему рівнянь, які представляють білок-білкові взаємодії шляху, також відомі як клітинна мережа. Розрахункові моделі є біохімічними реакціями мереж на базі сигнальної трансдукції в мережах, наприклад, нелінійні звичайні диференціальні рівняння (ЗДУ), стохастичні моделі, логічні або розмиті логічні моделі або мережі Петрі. Вони складаються з диференціальних рівнянь, що вимагають двох типів параметрів, які повинні бути виміряні експериментально або обчислені: початкова кількість молекул (c 0,i для i-го виду) і константа швидкості (kj для j-ої швидкості). Схема процесу створення обчислювальної моделі показана на фіг. 4A-D, які демонструють схему динамічного зображення сигнального шляху ErbB (фіг. 4А), переведення цього шляху в серію біохімічних реакцій і потоків (фіг. 4B і 4C) і представлення білок-білкових взаємодій серією диференціальних рівнянь (фіг. 4D). Обчислювальна модель звичайно будується як набір виконуваних інструкцій, внесених в комп'ютер, на мові опису сценаріїв, наприклад, за допомогою програмного забезпечення MATLAB SimBiology (The MathWorks, Natick, MA), можливо в поєднанні з Systems Biology Toolbox 2 для MATLAB (SBtoolbox2.оrg), або програмним забезпеченням для моделювання JACOBIAN (Numerica Technology, Cambridge, MA). Однак, слід враховувати, що межі винаходу розповсюджуються також на розробку і використання обчислювальних моделей, побудованих за допомогою програмного забезпечення і інтерфейсів, окрім тих, що побудовані за допомогою програмного забезпечення і інтерфейсів MATLAB або JACOBIAN. Винахід також розповсюджується на варіанти, в яких застосовуються обчислювальні моделі, підготовлені незалежно від джерела і завантажені в обчислювальні мережі, що є іншими аспектами винаходу. Для калібрування моделі встановлені і введені в обчислювальні системи значення всіх можливих параметрів, засновані на інформації з наукової літератури, наприклад, рівні білка, здатність до звя'зування, константи швидкості звя'зування лігандів з їх спорідненими рецепторами. Значення параметрів, які недоступні з наукової літератури, можуть бути одержані експериментально. Модель "навчають" шляхом оптимізації результатів з урахуванням експериментально одержаних даних, які вводяться в обчислювальну систему для навчання. Шляхом апроксимації моделі до експериментальних даних вибирають оптимальний набір параметрів моделі. Процес калібрування моделі включає модифікацію припущень і оцінки параметрів. Для калібрування моделі, необхідно спочатку визначити субпопуляцію білків і параметрів, які є особливо важливими з біологічної точки зору для трансляції стимулу у вигляді ліганду в нижчележачу подію проведення сигналу. Цей процес називається аналізом чутливості, що, точніше, є математичним засобом для вимірювання змін реакцій, наприклад, фосфорилування субстрату у відповідь на зміну концентрації білка і кінетичних параметрів шляху. Абсолютна нормалізована чутливість (( sij t )i, спостережувана c i ( t ) відносно змін j константи швидкості (kj), визначається за наступною формулою: lnc i t sij t ln k j Калібрування моделі виконується обчислювальною системою за допомогою локальних і глобальних методів оптимізації (наприклад, не обмежуючись ними, генетичний алгоритм, математичний анілінг, оптимізація Льовенберга-Марквардта, тощо), які мінімізують відстань між експериментальними даними і результатами моделювання шляхом зміни параметрів і початкових концентрацій білка, визначених в аналізі чутливості. Обчислювальна система може бути налаштована на автоматичні зміни параметрів під час калібрування або зміни параметрів тільки у відповідь на поступове додавання вхідних даних користувачем. 55 10 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 Численні обчислювальні моделі для різноманітних сигнальних шляхів були описані в науковій літературі (див., наприклад, Kholodenko, B.N. et al. (1999) J. Biol. Chem. 274:3016930181; Schoeberl, B. et al. (2002) Nat. Biotech. 20: 370-375; Hayakeyama, M. et al. (2003) Biochem. J. 373:451-463; Nielsen, U.B. and Schoeberl, B. (2005) IDrugs 8:822-826; Schoeberl, B. et al. (2006) Conf. Proc. IEEE Eng. Med. Biol. Soc. 1:53-54; Schoeberl, B. et al. (2006) IBM J. Res. Dev. 50:645; Fitzgerald, J.B. et al. (2006) Nat. Chem. Biol. 2:458-466; Kholodenko, B.N. (2007) Nat. Cell. Biol. 9:324-330; Birtwistle, M.R. et al. (2007) Molecular Systems Biology 3:144; Hinow, P. et al. (2007) Theoretical Biology and Medical Modelling 4:14). Крім того, побудова і використання обчислювальних моделей розглядається в Kholodenko, R.N. (2006) Nature Reviews: Mol Cell. Biol. 7:165-176 and Kumar, N. et al. (2006) Drug Discovery Today 11:806-811. Однією з обчислювальних моделей, використаних в деяких способах, запропонованих в даному описі, є модель сигнального шляху ErbB. Побудова зразка обчислювальної моделі сигнального шляху ErbB детально описана в Прикладі 4. У даному описі термін "сигнальний шлях ErbB" включає сигнальні шляхи, які запускаються взаємодією лігандів з рецептором родини ErbB. Компоненти сигнальних шляхів ErbB можуть включати: (I) один або декілька лігандів, прикладами яких є HRG, бета-целюлін (BТC), епідермальний фактор росту (EGF), епідермальний фактор росту, що зв'язується з гепарином (HB-EGF), трансформуючий фактор росту альфа (TGFα), амфірегулін (AR), епіген (EPG) і епірегулін (EPR); (II) один або декілька рецепторів, прикладами яких є ErbB1, ErbB2, ErbB3 і ERBB4; і (III) внутрішньоклітинні кінази, фосфатази і субстрати, прикладами яких є фосфатидилінозітол-3-кінази (PI3K), фосфатидилінозітол бісфосфат (PIP2), фосфатидилінозітол трисфосфат (PIP3), фосфатази і гомолог тензину (PTEN), кіназний ізофермент 1 піруватдегидрогеназа (PDK1), AKT, RAS, RAF, MEK, позаклітинні сигнально регульовані кінази (ERK), протеїнфосфатази 2A (PP2A) і SRC протеїнтирозинкінази. Іншою обчислювальною моделлю, використаною в деяких способах, запропонованих в даному описі, є модель "сигнального шляху IGF1R". У даному описі термін "сигнальний шлях IGF1R" включає сигнальні шляхи, які запускаються взаємодією лігандів з рецептором сімейства інсулінового фактора росту 1. Компоненти сигнального шляху IGF1R можуть включати: (I) один або декілька лігандів, прикладами яких є інсуліновий фактора росту 1 (IGF1); (II) один або декілька рецепторів, прикладами яких є IGF1R і рецептор інсуліну; (III) один або декілька білків, що зв'язуються з IGF і (IV) внутрішньоклітинні кінази і субстрати, прикладами яких є субстрат 2 інсулінового рецептору (IRS2), PI3K, AKT, споріднений з Bcl-2 білок BAD, RAS, RAF, MEK і активовані мітогеном протеїнкінази (МАРК). Ще однією обчислювальною моделлю, використаною в деяких способах, запропонованих в даному описі, є модель "сигнального шляху с-Met". У даному описі термін "сигнальний шлях сMet" включає сигнальні шляхи, які запускаються взаємодією лігандів з рецепторною протеїнтирозинкіназою с-Met. Компоненти сигнального шляху с-Met можуть включати: (I) один або декілька лігандів, прикладами яких є фактор росту гепатоцитів (HGF), (II) один або декілька рецепторів, прикладами яких є рецепторна протеїнтирозинкіназа с-Met; і (III) внутрішньоклітинні кінази і субстрати, прикладами яких є PI3K, фактор росту рецептор-звя'заних білків 2 (Grb2), гомологи Src і білки колагену (SHC), протеїнтирозинкіназа SRC і білок платформи GAB1, а також RAS, RAF, MEK і що активується мітогеном протеїнкінази (МАРК). Ще однією обчислювальною моделлю, використовуваною в деяких способах, запропонованих в даному описі, є модель, що включає будь-яку комбінацію двох або більш сигнальних шляхів факторів росту, таких як IGR1R, і проведення сигналу рецептором ErbB, проведення сигналу ErbB і проведення сигналу с-Met або IGF1-R, проведення сигналу ErbB і сMet в сполученні. Незважаючи на специфічність наведених прикладів, слід розуміти, що інші обчислювальні моделі (наприклад, для сигнальних шляхів, таких як TNF, IL-2, PDGF, FGF, TRAIL, інтегринів, цитокінів і практично будь-яких інших шляхів) також можуть бути включені і використані у варіантах даного винаходу. У деяких варіантах, наявність одного або декількох терапевтичних засобів може бути змодельована в обчислювальній моделі. Розрахункове представлення терапевтичних засобів може бути побудоване за допомогою рівняння реакції дії мас, яка описує звя'зування засобів, націлених на клітини, або інакшим чином описує вплив засобів на змодельований клітинний шлях. Параметри для подій звя'зування або інших біологічних ефектів, можуть бути одержані прямими експериментальними вимірюваннями, а також сформовані за допомогою моделі, щоб відповідати даним впливу терапевтичного засобу на клітину. Наприклад, для агентів у формі антитіл швидкість утворення і швидкість дисоціації звя'зування антитіл з антигенними мішенями може бути експериментально визначена за допомогою стандартних методів (наприклад, 11 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 технології BIACore або KinExA), і такі параметри можуть бути включені до обчислювальної моделі. Крім того, наприклад, для біспецифічних засобів, параметр перехресного зшивання, як міра кількості біспецифічних молекул, зв'язаних з кожною окремою біспецифічною мішенню або обидвома біспецифічними мішенями, може бути використаний як учбовий параметр для обчислювальної моделі. Параметр перехресного зшивання може бути одержаний шляхом прийняття загальної експериментальної спорідненості звя'зування (визначається стандартним аналізом FACS) і апроксимації до стандартного логічного рівняння звя'зування. На додаток до вищевикладеного, додаткові параметри, які можуть з фармацевтичної точки зору мати відношення до конкретного терапевтичного засобу, і, відповідно, бути представлені в обчислювальній моделі, відомі середньому фахівцю в даній галузі. Якщо ефект терапевтичного засобу повинен бути представлений в обчислювальній моделі, один засіб може бути змодельований або декілька засобів можуть бути змодельовані в комбінації, і тим самим імітувати вплив комбінованої терапії на реакцію клітини. Наприклад, в одному з варіантів два антитіла, які зв'язуються з різними антигенними мішенями, можуть бути представлені в обчислювальній моделі. В іншому варіанті, антитіла, націлені на той або інший сигнальний шлях (наприклад, шлях ErbB), і низькомолекулярні інгібітори того ж сигнального шляху (наприклад, шляху ErbB) можуть бути одночасно представлені в обчислювальній моделі для оцінки впливу такої комбінованої терапії сигнального шляху в клітині. II. Статистичні алгоритми класифікації Принаймні в деяких варіантах, способи, запропоновані в даному описі для прогнозування реакції на терапевтичні засоби (наприклад, генерація очікуваної реакції на терапевтичний засіб за допомогою комп'ютера) і способи лікування хворих із злоякісними пухлинами пов'язані із застосуванням одного або декількох алгоритмів статистичної класифікації. Однією з цілей статистичної моделі є різниця співвідношення між, наприклад, рівнем білка, виміряним в тканинах зразка, а також рівнем активації (наприклад, Стан активації мережі "САМ") або рівнем інгібування (наприклад, Стан інгібування мережі або "СІМ"), обчисленим на базі біохімічній моделі, з одного боку, і реакцією пацієнта на терапевтичний засіб, з іншого. Таким чином, алгоритм статистичної класифікації визначає статистичний зв'язок між одним або декількома вимірюваними параметрами або вхідними даними (наприклад, рівень білка визначається в тканині зразка за допомогою обчислень значення САМ або СІМ), і конкретним результатом, або вихідними даними (наприклад, реакція на терапевтичний засіб), при цьому можна здійснити класифікацію або прогнозування (наприклад, чутливість проти нечутливості до терапевтичного засобу). Таким чином, статистична модель допомагає визначити поріг, що розділяє чутливість і нечутливість, а також допомагає встановити приблизну похибку визначеного порогу. Різноманітні типи систем статистичної класифікації були описані в даній галузі і можуть бути придатними для використання в способах за винаходом; такі необмежуючі приклади включають аналіз головного компоненту (АГК, PCA), регресивний аналіз результату ділення найменших квадратів (РАДНК, PLSR), трилінійний аналіз РАДНК, аналіз нечіткої логіки і Байєсовського висновку, алгоритм випадкового лісу (ВЛ, RF), аналіз класифікації і регресії дерева (К&РД, C&RT), аналіз форсованих дерев, аналіз нейронних мереж (НМ, NN), метод опорного вектора (МОВ, SVM), загальну хі-квадрат автоматичну модель детектора взаємодії, аналіз інтерактивного дерева, аналіз мультиадаптивного сплайна регресії, аналіз класифікатора машинного навчання і їх комбінації. Див., наприклад, Публікацію PCT WO 2007/109571. Для виведення алгоритму статистичної класифікації, переважно використовують терміни галузі: "машина" або "обчислювальна система" (наприклад, комп'ютер) "взнає" зв'язок між рівнем експресії білка і Станом активації мережі (САМ) з вказівкою фактичної реакції пацієнта (наприклад, чутливість, нечутливість), досліджуючи кількість "навчених" прикладів, які були введені в комп'ютер, за допомогою "Класифікатора" (статистичного алгоритму). Цей процес відомий як "навчання під наглядом", оскільки збір зразків, для яких обидва параметри введених даних (рівні білка, виміряні і обчислені) і вихідних даних (наприклад, реакція на терапевтичний засіб) відомі апріорі. Невід'ємною частиною застосування алгоритмів статистичної класифікації є вибір інформативних ознак (особливість будь-якого виміряного або обчисленого рівня білка або рівня активації білка), а також визначення оптимального порогу оцінки здійснюється за алгоритмом. Це бажано застосовувати для перевірки алгоритмів статистичної класифікації на окремих "тестових наборах" зразків, для яких вихідні дані відомі, але не розкриті в класифікаторі. Шляхом порівняння прогнозування з відомими результатами може бути виміряна ефективність. Якщо кількості зразків недостатньо, це не може бути здійснено, і існують встановлені методи, щоб обійти цю вимогу. Основним з них є перехресна перевірка, обговорювана нижче. Вихідна 12 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 оцінка класифікатора, за бажанням, може бути переведена в клас прогнозування. Як правило, процес навчання класифікатора також включає способи визначення оптимальних порогів. Для того, щоб перевірити здатність до прогнозування, в загальному порядку перехресної перевірки відкладають частину даних (частину зразків) як "підготовку даних" або "учбовий набір (даних)", а решта даних називається "тестовим набором (даних)". Як правило, ця процедура повторюється багато разів, і кожного разу використовують різні частини даних для навчання і тестування. Очевидна корисність повчальних вибірок більшого розміру (чим більше прикладів, тим краще класифікатор), за винятком такого ж великого тестового набору (чим більше прогнозів можна перевірити, тим вище ваша упевненість в майбутньому прогнозуванні). Якщо розмір вибірки невеликий, ця процедура може бути змінена таким чином, що один зразок відкладається убік, як тестові дані, і класифікатор навчання використовує всю решту зразків. Прогнозування виконується на одному відкладеному зразку. Це називається "спосіб виключення поодинці" (LOOCV), і добре зарекомендував себе в даній галузі. У свою чергу, ця процедура повторюється для кожного відкладеного зразка. Після того, як всі прогнози здійснені, оцінюється ефективність. У статистичних алгоритмах класифікації, використаних в способах за винаходом, різноманітні параметри, або інформативні ознаки, або частини інформації можуть бути використані як вхідні дані. Необмежуючі приклади таких вхідних даних включають рівні білка для одного або декількох компонентів клітинної мережі, одержаних з клітин зразка, Стан активації мережі (САМ) або Стан інгібування мережі (СІМ), обчислені за допомогою обчислювальної моделі, статус мутації одного або декількох білків в клітинах зразка, вік суб'єкта, для якого досліджується сприйнятливість до лікування, і стать суб'єкта, для якого досліджується сприйнятливість до лікування. III. Вимірювання рівня клітинних компонентів в клітинах зразка У способах, запропонованих в даному описі, для формування прогнозу реакції на лікування терапевтичним засобом і для лікування пацієнтів із злоякісними пухлинам, одна з процедур звичайно включає вимірювання в клітинах зразка рівнів одного або декількох компонентів клітинної мережі або, крім того, введення виміряних рівнів одного або декількох компонентів клітинної мережі, які були одержані в результаті вимірювань, здійснених в клітинах зразка, в обчислювальну систему. Наприклад, зразок пухлини може бути одержаний стандартними способами від пацієнта з пухлиною, і рівні одного або декількох компонентів клітинної мережі можна виміряти в зразку пухлини. Введення даних може бути здійснено вручну в обчислювальну систему. Вхідні даних можуть бути також автоматично внесені або завантажені в обчислювальну систему, в деяких випадках, наприклад, якщо компю'теризовані вимірювальні прилади підключені до обчислювальної системи, і спосіб введення відноситься до ознак винаходу. У зв'язку з цим також слід розуміти, що будь-яка інформація про вимірювання і будь-яка інформація про стан (наприклад, інформація про статус мутацій), а також будь-які інші дані про тканину/пацієнта, описані в даному описі, можуть бути одержані за допомогою компю'теризованих пристроїв, які автоматично одержують і завантажують параметри та інформацію про стан однієї або декількох інших обчислювальних систем, які використовують дані для виконання описаних способів за винаходом. У даному описі термін "рівень" компоненту відноситься до кількості або концентрації компоненту, присутнього в зразку. Рівень компоненту може бути виміряний за допомогою будьякого з численних відомих способів. Рівень звичайно визначається шляхом вимірювання рівня білка, і альтернативно, в деяких випадках, рівень може бути визначений шляхом вимірювання рівнів мРНК, які можуть бути використані шляхом перетворення даних щодо мРНК, щоб передбачити рівні білка. Рівні білків (наприклад, мономерів, гомодимерів, або гетеродимерів) можуть бути виміряні за допомогою одного або декількох способів, добре відомих в даній галузі, з необмежуючими прикладами, які включають кількісне флуоресцентне сортування клітин (qFACS), твердофазний імуноферментний аналіз (ELISA, Luminex), імуногістохімію (IHC), кількісну імуногістохімію (qIHC), способи, засновані на зближенні (наприклад, метод Форстера, заснований на резонансному перенесенні енергії, флуоресценція біомолекулярної комплементації (BiFC), методи VeraTag™ або ДНК-запрограмованая хімія™ (DPC™)), масспектрометрію, Вестерн-аналіз (імуноблотинг) і коімунопреципітацію. Рівень білка може бути представлений як пг деякого білка на мкг загального білка. Білки або мРНК можуть бути визначені в клітинному лізаті. Клітинний лізат може бути одержаний, наприклад, як детально описано в Прикладі 2. Крім того, представлені приклади використання методів ELISA для визначення рівнів білка детально описані в Прикладах 2 і 4, типовий приклад використання qFACS для визначення рівня білка детально описаний в 13 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 Прикладі 4, і типовий приклад вимірювання вмісту мРНК і перетворення його на рівень білка детально описаний в Прикладі 4 (для HRG-b1). Зразком пухлини може бути, наприклад, свіжий зразок клітин, свіжозаморожений зразок або зафіксований зразок тканини. Для пацієнтів зразки тканин, архівні блоки тканини можуть бути більш доступними, ніж свіжозаморожені зразки. Таким чином, переважним є варіант, коли використовується зафіксований у формаліні і залитий парафіном (FFPE) зразок тканини, і рівень компонентів (наприклад, лігандів, рецепторів) може бути визначений за методом напівкількісної імуногістохімії (ІГС, IHC) (описаний в Прикладі 9 нижче). Щоб перетворити інформацію, одержану методом напівкількісної ІГС, на концентрацію, придатну для введення в обчислювальну модель, контрольний слайд, що містить клітинні пробки або ксенотрансплантати з відомими рівнями експресії рецепторів та/або лігандів, порівнюють із зразком пацієнта. Крім того, можуть бути визначені коефіцієнти переведення для перетворення рівня експресії, одержаного в безрозмірних одиницях (наприклад, кількість білка або РНК), в рівень концентрації, який може бути введений в обчислювальну модель, що описано детальніше в Прикладі 4 для рівня експресії BTC і HRG. Рівні мРНК ліганду і білка ліганду в цілому достатньо добре корелюють. Тому може бути використана QRT-ПЛР для визначення рівня експресії мРНК в клітинних лізатах з ліній пухлинних клітин і ксенотрансплантата, а також фіксованого у формаліні та залитого парафіном зразка. IV. Способи прогнозування реакції на терапевтичні засоби У деяких аспектах даного винаходу пропонуються способи прогнозування реакції клітин на лікування терапевтичними засобами, націленими на компоненти клітинної мережі. Такі методи звичайно включають елементи, вказані нижче в способах прогнозування 1–5. Спосіб прогнозування 1 (а) одержання результатів вимірювання рівня одного або декількох компонентів клітинної мережі, шляхом вимірювання рівня(ів) одного або декількох компонентів клітинної мережі, присутніх в клітинах зразка, а також (б) застосування комп'ютерної реалізації способу, що включає: (I) обчислення Стану активації мережі (САМ) або Стану інгібування мережі (СІМ) для клітин із застосуванням введених вимірювань обчислювальної моделі клітинної мережі, і (II) обчислення і виведення спрогнозованої реакції клітин на лікування терапевтичним засобом, на заснованої, принаймні частково, на обчисленнях САМ або СІМ в (I). Спосіб прогнозування 2 (а) Вимірювання в клітинах зразка рівнів одного або декількох компонентів клітинної мережі, а також (б) застосування комп'ютерної реалізації способу, що включає: (I) обчислення Стану активації мережі (САМ) або Стану інгібування мережі (СІМ) для клітин із застосуванням обчислювальної моделі клітинної мережі; (II) застосування алгоритму статистичної класифікації; і (III) прогнозування реакції клітин на лікування терапевтичним засобом, засноване, принаймні частково, на результатах алгоритму статистичної класифікації. Спосіб прогнозування 3 а) введення в обчислювальну систему через ввідний пристрій вхідних даних, які ідентифікують рівні одного або декількох компонентів клітинної мережі, виміряні в клітинах зразка; б) обчислення за допомогою обчислювальної системи Стану активації мережі (САМ) або Стану інгібування мережі (СІМ) для клітин із застосуванням обчислювальної моделі клітинної мережі, а також c) генерація в обчислювальній системі, а потім виведення через вивідний пристрій спрогнозованої реакції клітин на лікування терапевтичними засобами, заснованої, принаймні частково, на обчисленнях САМ або СІМ в б). Спосіб прогнозування 4 а) вимірювання в клітинах зразка рівнів одного або декількох компонентів клітинної мережі; б) обчислення Стану активації мережі (САМ) або Стану інгібування мережі (СІМ) для клітин із застосуванням обчислювальної моделі клітинної мережі; в) застосування алгоритму статистичної класифікації; і г) прогнозування реакції клітин на лікування терапевтичним засобом, засноване, принаймні частково, на результатах алгоритму статистичної класифікації. Спосіб прогнозування 5 а) введення в обчислювальну мережу через ввідний пристрій вхідних даних, які 14 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 ідентифікують рівні одного або декількох компонентів клітинної мережі, виміряні в клітинах зразка; б) обчислення за допомогою обчислювальної системи Стану активації мережі (САМ) або Стану інгібування мережі (СІМ) для клітин із застосуванням обчислювальної моделі клітинної мережі; с) застосування в обчислювальній системі алгоритму статистичної класифікації, а також д) генерація в обчислювальній системі, а потім виведення на вивідний пристрій спрогнозованої реакції клітин на лікування терапевтичним засобом, заснованої на результатах алгоритмів статистичної класифікації. Способи, описані вище, необов'язково можуть додатково включати лікування клітини або пацієнта, від якого клітини одержані, терапевтичним засобом, засноване на спрогнозованій реакції клітин на терапевтичний засіб. У різних аспектах, виявлені рівні компоненту(ів) служать ознакою ефективності прогнозування для одного або декількох конкретних терапевтичних засобів. Нерідко це означає, що, якщо виміряні рівні компоненту(ів) (або певний коефіцієнт концентрації в порівнянні з іншими вказаними компонентами) відповідно до вищенаведеного критерію (або, в деяких випадках, нижче) попередньо визначеного порогу відсікання або коефіцієнта, то даний терапевтичний засіб за прогнозами буде ефективним і вводиться пацієнту, а якщо виміряні рівні компоненту(ів) або коефіцієнт концентрації не відповідають критерію визначеного порогу відсікання або коефіцієнту, то терапевтичний засіб не вводять пацієнту. Відповідні порогові рівні можуть бути встановлені за допомогою звичайних способів, описаних в даному описі. Щоб спрогнозувати реакцію клітин, як правило, значення САМ або СІМ обчислюють для множини відомих чутливих і нечутливих до терапевтичного засобу клітин, і такі відомі значення для чутливих і нечутливих клітин використовуються для встановлення порогу значень САМ або СІМ, вказуючого на чутливість або нечутливість до терапевтичного засобу (далі описано в Прикладах 7 і 10). Таким чином, згенеровану та/або спрогнозовану реакцію клітин на лікування можна одержати у в) шляхом порівняння значень САМ або СІМ, обчислених в б), з порогом значень САМ або СІМ, що показує чутливість або нечутливість до терапевтичного засобу. Щоб застосувати алгоритм статистичної класифікації, одну або декілька частин інформації вводять в алгоритм або обчислювальну систему, що включає одну або декілька частин інформації про алгоритм. Наприклад, ця процедура може включати введення в алгоритм однієї або декількох частин інформації, вибраної з (I) рівня одного або декількох компонентів клітинної мережі; (II) обчислень САМ або СІМ; (III) мутаційного статусу одного або декількох генів в клітинах зразка; (IV) віку суб'єкта, який одержуватиме лікування терапевтичним засобом; (V) статі суб'єкта, яка одержуватиме лікування терапевтичним засобом; (VI) наявності або відсутності рецепторів естрогену (ЕР, ER) в клітинах; (VII) наявності або відсутності рецепторів прогестерону в клітинах; і (VIII) наявності або відсутності андрогенних рецепторів в клітинах. Додатково або альтернативно, застосований алгоритм статистичної класифікації може бути включений в обчислювальні алгоритми обчислювальної системи після введення одного або декількох фрагментів інформації, викладених в пп. (I)–(VIII) вище. Оскільки алгоритм статистичної класифікації визначає статистичний зв'язок між введеною інформацією і реакцією клітин (наприклад, пухлинних клітин) на лікування, прогнозування реакції клітин на лікування може бути засноване на результатах алгоритмів статистичної класифікації. Для способів прогнозування та інших способів, запропонованих в даному описі, переважно включати клітинну мережу сигнального шляху ErbB. В одному з варіантів, один або декілька компонентів були виміряні і введені в обчислювальну систему в способі, що включає один або декілька лігандів, які беруть участь в сигнальному шляху ErbB. Необмежуючі приклади таких лігандів включають HRG (зокрема, HRG-β1, HRG-β2, HRG-α, HRG-3 і HRG-4), EGF, HB-EGF, TGFα, AR, EPG і EPR. Додатково або альтернативно, один або декілька компонентів, рівні яких вимірюють в способі, можуть включати один або декілька рецепторів, що беруть участь в сигнальному шляху ErbB. Необмежуючі приклади таких рецепторів включають ErbB1, ErbB2, ErbB3 і ERbB4 (також відомі в даній галузі як HER1, HER2, HER3 і HER4, відповідно). Такі рецептори можуть бути проаналізовані як окремий об'єкт (будь-який з мономерів, що зустрічаються, гомодимерів або гетеродимерів), а в деяких варіантах кожен гомодимер і гетеродимер також може бути виміряний як окремий компонент і введений в обчислювальну систему. Наприклад, компоненти вимірювання можуть включати 1, 2, 3, 4, 5 або 6 або більше рецепторів, лігандів, або обох, вибраних з ErbB1, ErbB2, ErbB3, ERbB4, HRG, і ВТС (наприклад, ErbB1 і HRG, або ErbB1, ErbB2 і ErbB3). Наприклад, в деяких способах обчислене САМ імітує рівень гомодимеру ErbB2/ErbB2 або гетеродимеру ErbB2/ErbB3 за відсутності терапевтичного засобу. У інших подібних способах обчислене СІМ імітує рівень гетеродимеру ErbB2/ErbB3 або 15 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 гетеродимеру ErbB1/ErbB3 в присутності терапевтичного засобу в порівнянні з рівнем гетеродимеру ErbB2/ErbB3 або гетеродимеру ErbB1/ErbB3 за відсутності терапевтичного засобу. У деяких з вищенаведених способів, обчислене САМ імітує рівень одного або декількох фосфорильованих білків в сигнальному шляху ErbB3. Наприклад, обчислене САМ може імітувати рівень pErbB3 в клітинах зразка. У альтернативних варіантах, обчислене САМ може імітувати рівень фосфорильованих гетеродимерів ErbB1/ErbB3 або фосфорильованих гетеродимерів ErbB2/ErbB3 в клітинах зразка. В одному з варіантів терапевтичні засоби включають анти-EGFR (анти-ErbB1) антитіла, типовим прикладом яких є анти-ErbB1 антитіло цетуксимаб (Ербітукс®, ImClone Systems). Інші приклади анти-ErbB1 антитіл включають матузумаб, панітумумаб; німотузумаб і mAb 806 (Mishima, К. et al. (2001) Cancer Res. 61:5349-5354). У інших варіантах терапевтичні засоби включають анти-ErbB2 антитіла, типовим прикладом яких є трастузумаб (Герцептин®, Genentech). В іншому варіанті терапевтичні засоби включають анти-ErbB3 антитіла. Переважно, антиErbB3 антитіла включають ММ-121, які на даний час проходять етап клінічних випробувань. Переважно, анти-ErbB3 антитіла включають Аb #6, описані детальніше в WO 2008/100624 та послідовності VH і VL, показані в SEQ ID NO: 1 і 2, відповідно. В іншому варіанті анти-ErbB3 антитіла є антитілами, що включають Ab #6 послідовності CDR V H і VL, показані в SEQ ID NO: 79 (VH CDR1, 2, 3) і 10-12 (VL CDR1, 2, 3), відповідно. Інші приклади анти-ErbB3 антитіл включають Ab #3, Ab #14, Ab #17 і Ab #19, також описані додатково в WO 2008/100624, і послідовності VH і VL, показані в SEQ ID NO: 3 і 4, 5 і 6, 25 і 26, і 33 і 34, відповідно. В іншому варіанті анти-ErbB3 антитіла - це антитіла, що включають послідовності CDR VH і VL Ab #3 (SEQ ID NO: 13-15 і 16-18, відповідно), або антитіла, що включають послідовності CDR VH і VL Ab#14 (SEQ ID NO: 19-21 і 22-24, відповідно), або антитіла, що включають послідовності CDR VH і VL Ab#17 (SEQ ID NO: 27-29 і 30-32, відповідно), або антитіла, що включають послідовності CDR V H і VL Ab#19 (SEQ ID NO: 35-37 і 38-40, відповідно). Інші приклади анти-ErbB3 антитіл включають антитіла 1B4C3 і 2D1D12 (U3 Pharma AG), описані в Публікації США № 2004/0197332, і моноклональні антитіла (зокрема, гуманізовану версію), такі як 8B8, описані в патенті США 5968511. В іншому варіанті анти-ErbB3 антитіла - це біспецифічні антитіла (наприклад, рекомбінантний білок), які включають анти-ErbB3 антитіла, зв'язані з іншими антитілами (наприклад, анти-ErbB2 антитілами). Переважним прикладом такого біспецифічного антитіла є H3хB1D2, амінокислотна послідовність якого показана в SEQ ID NO: 41. У даному біспецифічному антитілі одноланцюгове антитіло, яке зв'язується з ErbB3, названим H3 (з послідовностями CDR VH і VL, показаними в SEQ ID NO: 42-44 і 45-47, відповідно), з'єднане з одноланцюговим антитілом, яке зв'язується з ErbB2, названим B1D2 (з послідовностями CDR VH і VL, показаними в SEQ ID NO: 48-50 і 51-53, відповідно). Антитіла-компоненти біспецифічних антитіл H3хB1D2 описані докладніше в патентах США №№ 7332585 і 7332580, а також в заявці PCT/US2006/023479 (опублікована як WO 2007/084181) і заявці PCT/US2007/024287 (опублікована як WO 2008/140493). Ще в одному варіанті терапевтичний засіб складається з двох або більше анти-ErbB3 антитіл, кожне з яких зв'язується з різними епітопами на ErbB3. Переважно, терапевтичний засіб складається з трьох анти-ErbB3 антитіл, кожне з яких зв'язується з різними епітопами на ErbB3. В іншому варіанті терапевтичний засіб містить анти-ERBB4 антитіла. Ще в одному варіанті терапевтичний засіб містить інгібітори pan-ErbB або інгібітори димеризації HER. Прикладом інгібітору димеризації є антитіло пертузумаб (також відоме як антитіло 2C4), яке описане докладніше в Agus, D.B. et al. (2005) J. Clin. Oncol. 23:2534-2543. Ще в одному варіанті терапевтичний засіб складається з одного або декількох низькомолекулярних інгібіторів сигнального шляху ErbB, типові приклади яких включають гефітиніб (Іресса®), присутній на ринку від AstraZeneca і Teva, і лапатиніб (Тукерб®), присутній на ринку від GlaxoSmithKline. Інші приклади низькомолекулярних інгібіторів ErbB сигнального шляху включають CI-1033 (PD 183805, Pfizer), ерлотиніб HCL (OSI-774; Тарцева®; OSI Pharma); PKI-166 (Novartis), PD-158780; ЕКВ-569; і тирфостин AG 1478 (4-(3-хлоранілін)-6,7диметоксихіназолін). В іншому варіанті клітинна система включає сигнальний шлях с-Met (мезенхімальноепітеліальний фактор переходу). В одному з варіантів один або декілька компонентів, виміряних та/або введених в а), можуть складатися з одного або декількох лігандів, які беруть участь в сигнальному шляху с-Met. Необмежуючим прикладом такого ліганду є фактор росту гепатоцитів (HGF). Додатково або альтернативно, один або декілька компонентів, виміряних в б), можуть 16 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 складатися з одного або декількох рецепторів, що беруть участь в сигнальному шляху с-Met. Необмежуючим прикладом такого рецептора є рецепторна протеїнтирозинкіназа с-Met. У зв'язку з вищевикладеним, способи прогнозування, запропоновані в даному описі, дозволяють прогнозувати реакції клітин, наприклад, комп'ютерне прогнозування реакції пухлини на терапевтичний засіб, націлений на компоненти сигнального шляху с-Met. Терапевтичний засіб може включати, наприклад, антитіла (наприклад, моноклональні антитіла), які зв'язуються з с-Met. Приклади таких антитіл проти с-Met включають AV299 (AVEO); AMG102 (Amgen) і 5D5 (OA-5D5; Genentech). Переважно, терапевтичні засоби, націлені на сигнальний шлях с-Met, включають біспецифічні моноклональні антитіла, що складаються з анти-ErbB1 антитіл, з'єднаних з анти-сMet антитілами. Приклади таких біспецифічних антитіл описані докладніше в публікаціях PCT WO 2005/117973 і WO 2006/091209. В іншому варіанті терапевтичні засоби являють собою низькомолекулярні інгібітори сигнального шляху с-Met, прикладами яких є ARQ 197 (ArQule) і PHA665752 (Christensen, J.G. et al. (2003) Cancer Res. 63:7345-7355). В іншому варіанті клітинна система включає сигнальний шлях рецептора інсулінового фактора росту 1 (IGF1R). У одному з варіантів один або декілька компонентів, виміряних в а), можуть складатися з одного або декількох лігандів, що беруть участь в сигнальному шляху IGF1R. Необмежуючим прикладом такого ліганду є інсуліновий фактор росту 1 (IGF1). Додатково або альтернативно, один або декілька компонентів, виміряних в б), можуть складатися з одного або декількох рецепторів, що беруть участь в сигнальному шляху IGF1R. Необмежуючим прикладом такого рецептора є рецептори IGF1R. У зв'язку з вищевикладеним, способи прогнозування за винаходом дозволяють прогнозувати реакцію клітин, наприклад, комп'ютерне прогнозування реакції пухлини на терапевтичний засіб, націлений на компоненти сигнального шляху IGF1R. У переважному варіанті терапевтичний засіб являє собою антитіла, які зв'язуються з IGF1R, приклади яких включають mAb391 (Hailey, J. et al. (2002) Mol. Cancer. Ther. 1:1349-1353); IMC-A12 (Imclone Systems, Inc.), 19D12 (Schering Plough), H7C10 (Goetsch, L. et al. (2005) Int. J. Cancer 113:316-328), CP751,871 (Pfizer), SCV/FC (ImmunoGen, Inc.) і EM/164 (ImmunoGen, Inc.). У переважному варіанті терапевтичні засоби, що включають біспецифічні антитіла, включають анти-IGF1R антитіла, з'єднані з анти-ErbB3 антитілами. Такі біспецифічні антитіла описані докладніше в публікаціях PCT WO 2005/117973 і WO 2006/091209. В іншому варіанті терапевтичний засіб являє собою низькомолекулярний інгібітор IGF1R (наприклад, інгібітор тирозинкінази), прикладами яких є NVP-AEW541 (Novartis); NVP-ADW742 (Novartis); NVP-TAE226 (Novartis); BMS-536, 924 (Bristol-Myers Squibb); BMS-554, 417 (Bristol-Myers Squibb); циклолігнани, такі як пікроподофілін (РРР) (Menu, E. et al. (2006) Blood 107:655-660); і PQ401 (Gable, K.L. et al. (2006) Mol. Cancer Ther. 5:1079-1086). У ще одному варіанті терапевтичні засоби включають комбінацію терапевтичних засобів, де така комбінація включає, принаймні, один засіб, націлений на компоненти сигнального шляху ErbB, наприклад, комбінація засобів, яка включає, принаймні, один із засобів, націлених на шлях ErbB, описаних вище. Наприклад, комбінація засобів може складатися з двох або декількох засобів, які націлені на компоненти сигнального шляху ErbB. Крім того, комбінація засобів може включати, щонайменше, один засіб, націлений на компоненти сигнального шляху ErbB, і, щонайменше, один засіб, націлений на компоненти іншого сигнального шляху, такого як сигнальні шляхи с-Met або IGF1R. У різноманітних інших варіантах клітинна мережа складається з комбінації двох або декількох сигнальних шляхів, таких як сигнальний шлях ErbB в поєднанні із сигнальним шляхом с-Met, або сигнальний шлях ErbB в поєднанні із сигнальним шляхом IGF1R. В іншому варіанті способів прогнозування, запропонованих в даному описі, такі способи можуть додатково включати порядок визначення в клітинах зразка статусу мутації одного або декількох генів в клітинах. Переважно визначають статус мутації, принаймні, одного гена, вибраного з KRAS (гомолог вірусного онкогена саркоми щурів Кирстен), PI3K і PTEN. Додатково або альтернативно, спосіб може включати обчислювальну систему, в яку вводять через ввідний пристрій дані, що ідентифікують статус мутації одного або декількох генів в клітинах, такий як статус мутації, принаймні, одного гена, вибраного з KRAS, PI3K і PTEN. В іншому варіанті способи прогнозування клітинної мережі включають сигнальний шлях ErbB і а) включають вимірювання та/або введення виміряних рівнів BTC і AR, і додатково спосіб включає визначення статусу мутації, або введення статусу мутації гена KRAS. В іншому варіанті клітинна мережа включає сигнальний шлях ErbB і а) включає вимірювання та/або введення виміряних рівнів ErbB1, ErbB2, ErbB3, HRG, BTC, AR, HB-EGF, EGF, TGFα, EPG і EPR, і додатково спосіб включає визначення статусу мутації або введення статусу мутації гена KRAS. Переважно в цьому варіанті САМ, обчислене в б), імітує рівень одного або декількох фосфорильованих білків в сигнальному шляху ErbB. В іншому переважному варіанті САМ, 17 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 обчислене в б), імітує рівень фосфорильованих гетеродимерів ErbB1/ErbB3 в зразку пухлини пацієнта. У ще одному переважному варіанті САМ, обчислене в б), імітує рівень фосфорильованих гетеродимерів ErbB2/ErbB3 в зразку пухлини пацієнта. У деяких способах, описаних вище, значення САМ або СІМ, обчислені для кожної з множини клітин з відомою чутливістю і нечутливістю до терапевтичного засобу, використовуються для визначення порогу значень САМ або СІМ, вказуючого на чутливість або нечутливість до терапевтичного засобу. У інших способах реакція клітини на лікування прогнозується шляхом порівняння обчислень САМ або СІМ в (б) з порогом значень САМ або СІМ, вказуючим на чутливість або нечутливість до терапевтичного засобу. V. Біомаркери і способи прогнозування реакції на інгібування шляху ErbB В іншому аспекті винаходу пропонуються прямі біомаркери, які передбачають реакцію клітин (наприклад, пухлинних клітин) на лікування терапевтичними засобами, націленими на компоненти внутрішньоклітинної мережі (наприклад, сигнального шляху ErbB). Такі біомаркери можуть бути визначені із застосуванням передбачених обчислювальних моделей. Способи ідентифікації таких біомаркерів, як правило, включають: (а) вимірювання в клітинах зразка рівнів одного або декількох компонентів клітинної мережі; і (б) застосування комп'ютерної реалізації способу, яка включає: (I) обчислення рівня одного або декількох додаткових компонентів клітинної мережі за допомогою обчислювальної моделі внутрішньоклітинної мережі; і (II) визначення компонентів клітинної мережі, обчислений рівень яких прогнозує реакцію клітин на лікування терапевтичним засобом, щоб, таким чином, ідентифікувати такі компоненти, як біомаркери для прогнозування реакції клітин на лікування терапевтичним засобом. Деякі методи визначення біомаркерів для прогнозування реакції клітин на лікування терапевтичним засобом, націленим на компоненти клітинної мережі, включають: а) введення в обчислювальну систему через ввідний пристрій вхідних даних, які ідентифікують виміряні рівні одного або декількох компонентів клітинної мережі в клітинах зразка; б) обчислення за допомогою обчислювальної системи рівнів одного або декількох додаткових компонентів клітинної мережі за допомогою обчислювальної моделі клітинної мережі, а також с) ідентифікацію за допомогою обчислювальної системи компоненту клітинної мережі, обчислений рівень якого прогнозує реакцію клітин на лікування терапевтичним засобом, і тим самим ідентифікують компонент, як біомаркер для прогнозування реакції клітин на лікування терапевтичним засобом. Наприклад, як показано в Прикладі 10, обчислювальна модель може бути застосована для обчислення рівнів одного або декількох компонентів внутрішньоклітинної мережі (наприклад, сигнального шляху ErbB), щоб одержати одне або декілька значень САМ (як міру активації клітинної мережі) і визначити кореляцію САМ з реакцією клітин на лікування терапевтичним засобом. Такі компоненти клітинної мережі, для яких обчислені рівні окремо чутливих і нечутливих зразків, можуть також бути використані як прямі біомаркери для прогнозування реакції на лікування, особливо, коли рівні цих компонентів легко вимірюються прямим шляхом. Тобто, підхід обчислювальної моделі/САМ, описаний в даному описі, може бути застосований для ідентифікації (комп'ютерної) компонентів(у), які прогнозують реакцію клітин на лікування терапевтичними засобами, і, крім того, можуть бути безпосередньо виміряні рівні ідентифікованих компонентів, як прямих біомаркерів для прогнозування реакції. Наприклад, обчислювальна модель, описана в даному документі, була застосована для обчислення рівнів гомо- і гетеродимерів сигнального шляху ErbB, а потім рівні димерів, розділених на чутливі і нечутливі зразки, можуть бути безпосередньо виміряні як прямі біомаркери для прогнозування реакції на лікування пухлин. Далі, як описано в Прикладі 8, на даний час показано, що комбіноване вимірювання рівнів (I) HRG і (II) принаймні, одного рецептора родини ErbB (наприклад, ErbB1, ErbB2 і ErbB3) в зразку пухлини, дозволяють ефективно розподілити пухлини на чутливі і нечутливі з точки зору реакції на лікування терапевтичними засобами, націленими на компоненти сигнального шляху ErbB, такими як анти-ErbB3 антитіла (наприклад, Ab #6). Крім того, як описано далі в Прикладі 10, рівні гетеродимерів ErbB1/ErbB3 або рівні фосфорильованих гетеродимерів ErbB1/ErB3 можуть служити прямими маркерами для реакції на лікування терапевтичними засобами, націленими на компоненти ErbB сигнального шляху, такими як анти-ErbB3 антитіла (наприклад, Ab #6). Крім того, як описано далі в Прикладі 12, рівні мономерів ErbB2, гомодимерів ErbB2/ErbB2 і гетеродимерів ErbB2/ErbB3 дозволяють ефективно розподілити пухлини на чутливі і нечутливі з точки зору реакції на лікування терапевтичними засобами, націленими на компоненти сигнального шляху ErbB, такими як анти-ErbB3 х анти-ErbB2 біспецифічні антитіла (наприклад, 18 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 H3хB1D2). Як наголошувалося вище, в даному винаході пропонуються способи прогнозування реакції клітин на лікування терапевтичними засобами, націленими на компоненти сигнального шляху ErbB. Деякі з таких способів включають: (а) вимірювання в клітинах зразка рівнів (I) HRG і (II) принаймні, одного рецептора, вибраного з ErbB1, ErbB2 і ErbB3; і (б) прогнозування за допомогою обчислювальної системи реакції клітин на лікування терапевтичним засобом в залежності від рівнів, виміряних в (а), де підвищені рівні HRG і, принаймні, одного рецептора в порівнянні з контролем прогнозують реакцію на лікування терапевтичним засобом. В деяких ситуаціях вимірюються рівні HRG і ErbB1. У інших випадках вимірюються рівні HRG і ErbB2, або вимірюються рівні HRG і ErbB3. У інших ситуаціях вимірюються рівні HRG і не менше двох рецепторів, вибраних з ErbB1, ErbB2 і ErbB3, або вимірюються рівні HRG, ErbB1, ErbB2 і ErbB3. У деяких ситуаціях прогнозування може бути здійснене шляхом обчислення із застосуванням способів, які включають: (I) введення в обчислювальну систему через ввідний пристрій вхідних даних, які ідентифікують виміряні рівні (I) HRG і (II), принаймні, одного рецептора, вибраного з ErbB1, ErbB2 і ErbB3, де рівні виміряні в зразку клітин; і (II) генерацію в обчислювальній системі, а потім виведення на вивідний пристрій спрогнозованої реакції клітин на лікування терапевтичним засобом на базі виміряних рівнів, де підвищені рівні HRG і, принаймні, одного рецептора в порівнянні з контролем передбачають реакцію на лікування терапевтичним засобом. Популярні терапевтичні засоби, для яких прогнозується чутливість, включають анти-ErbB3 антитіла, більш переважно, Аb #6 (послідовності VH і VL показані в SEQ ID NO: 1 і 2, відповідно) або анти-ErbB3 антитіла, що містять послідовності CDR VH і VL Аb #6, показані в SEQ ID NO: 7-9 (CDR1 VH, 2, 3) і 10-12 (CDR1 VL, 2, 3), відповідно. Інші способи прогнозування реакції клітин на лікування терапевтичним засобом, націленим на компоненти сигнального шляху ErbB, включають: (а) вимірювання в клітинах зразка рівнів одного або декількох гетеродимерів ErbB1/ErbB3, мономерів ErbB2, гомодимерів ErbB2, гетеродимерів ErbB2/ErbB3, фосфорильованих гетеродимерів ErbB1/ErbB3 і фосфорильованих гетеродимерів ErbB2/ErbB3; і (б) прогнозування за допомогою обчислювальної системи реакції клітин на лікування терапевтичним засобом в залежності від виміряного рівня в (а), при цьому різниця в рівні гетеродимерів ErbB1/ErbB3, мономерів ErbB2, гомодимерів ErbB2/ErbB2, гетеродимерів ErbB2/ErbB3, фосфорильованих гетеродимерів ErbB1/ErbB3 або фосфорильованих гетеродимерів ErbB2/ErbB3, в порівнянні з контролем прогнозує реакцію на лікування терапевтичним засобом. Прогнозування може бути виконане шляхом обчислення, із застосуванням способів, які включають: (I) введення в обчислювальну систему через ввідний пристрій вхідних даних, які ідентифікують виміряні рівні одного або декількох гетеродимерів ErbB1/ErbB3, мономерів ErbB2, гомодимерів ErbB2/ErbB2, гетеродимерів ErbB2/ErbB3, фосфорильованих гетеродимерів ErbB1/ErbB3 і фосфорильованих гетеродимерів ErbB2/ErbB3, де рівні виміряні в клітинах зразка; і (II) генерація в обчислювальній системі, а потім виведення на вивідний пристрій спрогнозованої реакції клітин на лікування терапевтичним засобом на базі виміряних рівнів, в яких різниця в рівні гетеродимерів ErbB1/ErbB3, мономерів ErbB2, гомодимерів ErbB2/ErbB2, гетеродимерів ErbB2/ErbB3, фосфорильованих гетеродимерів ErbB1/ErbB3 або фосфорильованих гетеродимерів ErbB2/ErbB3, в порівнянні з контролем, прогнозує реакцію на лікування терапевтичним засобом. У деяких варіантах способів, описаних вище, виміряні рівні вводяться в статистичний алгоритм класифікації, і реакція клітин на лікування прогнозується на базі вихідних даних алгоритму. Додатково в таких способах Стан активації мережі (САМ) або Стан інгібування мережі (СІМ) обчислюється на базі виміряних рівнів із застосуванням обчислювальної моделі клітинної мережі ErbB; переважно, реакція клітин на лікування терапевтичним засобом прогнозується на базі обчислень значень САМ або СІМ. У деяких варіантах виміряні рівні - це рівні мономерів ErbB2, гомодимерів ErbB2:ErbB2 та/або гетеродимерів ErbB2:ErbB3, і терапевтичний засіб являє собою біспецифічне антитіло, яке включає анти-ErbB3 антитіло, пов'язане з анти-ErbB2 антитілом, як описано вище. 60 19 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 Переважно, клітини для використання в способах, описаних вище, - це пухлинні клітини, в тому числі наведені вище. Зразки включають пухлинну тканину, тонкоголковий пунктат, сосковий пунктат, суцільну кров, сироватку, плазму, лімфу, слину і сечу або "злущені" або циркулюючі пухлинні клітини. Як наголошувалося вище, очевидно, що виміряні рівні є рівнями білків (наприклад, мономерів, гомодимерів або гетеродимерів) або мРНК, і в цілому можуть бути визначені, як описано вище. Будь-який з даних способів необов'язково може додатково включати вибір схеми лікування (наприклад, для терапевтичного засобу) на базі спрогнозованої реакції клітин на лікування та/або може додатково включати приготування терапевтичного засобу для застосування на базі спрогнозованої реакції. У переважному варіанті різницею рівня в порівнянні з контролем є підвищений рівень. Вищезгадані способи необов'язково можуть додатково включати лікування клітин або суб'єкта (пацієнта), від якого клітини одержані, терапевтичним засобом, на базі спрогнозованої реакції клітин на терапевтичний засіб. Для варіантів, в яких вимірюються рівні гетеродимерів ErbB1/ErbB3 та/або фосфорильованих гетеродимерів ErbB1/ErbB3, переважно, терапевтичний засіб, для якого прогнозується чутливість, являє собою анти-ErbB3 антитіло, більш переважно, Аb #6 (послідовності VH і VL показані в SEQ ID NO: 1 і 2, відповідно) або анти-ErbB3 антитіло, що містить послідовності CDR VH і VL Аb #6, показані в SEQ ID NO: 7-9 (CDR1 VH, 2, 3) і 10-12 (CDR1 VL, 2, 3), відповідно. Для варіантів, в яких вимірюються рівні мономерів ErbB2, гомодимерів ErbB2/ErbB2 та/або гетеродимерів ErbB2/ErbB3, переважним терапевтичним засобом, для якого прогнозується чутливість, є анти-ErbB3 х анти-ErbB2 біспецифічне антитіло, більш переважно, біспецифічне антитіло H3хB1D2 (послідовність амінокислот показана в SEQ ID NO: 41), або біспецифічне антитіло, яке включає анти-ErbB3 антитіло, що містить CDR Н3 (SEQ ID NO: 42-44 і 45-47), з'єднане з анти-ErbB2 антитілами, що містять CDR B1D2 (SEQ ID NO: 48-50 і 1-53). Рівні гомо- або гетеродимерів рецепторів або гомо- або гетеродимерів фосфорильованих рецепторів можуть бути виміряні в клітинах зразка із застосуванням способів, відомих в даній галузі. Наприклад, рівні таких гомо- або гетеродимерів можуть бути виміряні за допомогою способу виявлення димеризації, як описано в патенті США № 7105308, патенті США № 7255999, Публікації США № 20040229380 і Публікації США № 20080187948. У таких способах використовують пару зондів (наприклад, антитіл), один мічений зонд і один розщеплений зонд, при цьому кожен зонд специфічно зв'язується з одним із компонентів димеру. Звя'зування двох зондів з димером веде до розщеплювання і виходу молекулярної мітки з димерного комплексу, що забезпечує вимірювання структури димерного комплексу. Такі методи також згадуються в даному описі як способи, засновані на зближенні, прикладами яких, присутніми на ринку, є система VeraTag™ (Monogram Biosciences). Крім того, інші способи, відомі в даній галузі для кількісного визначення рівня димерів, можуть застосовуватися, зокрема, не обмежуючись ними, коімунопреципітація компонентів димеру і застосування інших способів, заснованих на зближенні, таких як заснований на резонансному перенесенні енергії метод Форстера і біомолекулярна флуоресцентна комплементація (BiFC) (докладніше описано, наприклад, в Tao, R.H. and Maruyama, I.N. (2008) J. Cell Sci. 121:3207-3217). В одному з варіантів вищезгаданих способів рівні прямих біомаркерів, виміряні в а), вводяться в статистичний алгоритм класифікації, збережений в обчислювальній системі, і реакція клітин на лікування прогнозується на базі результатів алгоритму, на базі розрахунків і перетворень даних в обчислювальній системі із застосуванням алгоритму і виміряних рівнів. В іншому варіанті Стан активації мережі (САМ) або Стан інгібування мережі (СІМ) обчислюється в залежності від рівня, виміряного в б), із застосуванням обчислювальної моделі клітинної мережі ErbB. Можна спрогнозувати реакцію клітин на лікування терапевтичним засобом, на базі, принаймні частково, на обчисленнях значень САМ або СІМ. У різноманітних варіантах терапевтичний засіб включає будь-яке поєднання одного або декількох анти-ErbB3 антитіл, анти-ErbB1 антитіл, анти-ErbB2 антитіл, анти-ERBB4 антитіл, інгібітору pan-ErbB, інгібітору димеризації HER і низькомолекулярного інгібітору із сигнального шляху ErbB, кожний з яких описаний і наведений вище. VI. Застосування способів в лікуванні Способи за винаходом можуть бути застосовані для прогнозування ефективності лікування широкого спектру захворювань, для яких існують терапевтичні засоби, націлені на один або декілька компонентів клітинної мережі, що беруть участь в захворюванні. Більш того, способи за винаходом можуть бути застосовані для вибору схеми лікування суб'єкта, який страждає на 20 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 захворювання, при якому способи можуть додатково включати лікування суб'єкта відповідно до вибраної схеми лікування, яка може включати введення одного або декількох терапевтичних засобів суб'єкту. Необмежуючі приклади порушень включають рак, аутоімунні захворювання і запальні захворювання. Способи за винаходом є особливе придатними для прогнозування, наприклад, обчислювального прогнозування, реакції пухлини на лікування терапевтичним засобом, тобто прогнозування реакції пацієнта з пухлиною на лікування терапевтичним засобом. Способи прогнозування можна застосовувати для будь-якої пухлини, залежної від сигнального шляху, який моделюється в способі. Наприклад, в одному з варіантів способу пухлини залежать від сигнального шляху ErbB (наприклад, сигнальний шлях ErbB3). У інших варіантах способи можуть застосовуватися для пухлин, які залежать від сигнальних шляхів с-Met або IGF1R. У переважному варіанті пухлина - це пухлина товстої кишки. В іншому переважному варіанті пухлини - це немілкоклітинний рак легені (NSCLC). В іншому варіанті пухлина є солідною пухлиною. В іншому варіанті пухлина - це несолідна пухлина, така як світлоклітинна саркома. У різноманітних інших варіантах пухлина може бути, наприклад, пухлиною органу, вибраного з легені, товстої кишки, прямої кишки, жовчного міхура, головного мозку, спинного мозку, молочної залози, нирок, підшлункової залози, шлунку, печінки, кісток, шкіри, селезінки, яєчника, яєчка, передміхурової залози, голови і шиї, щитоподібної залози і м'язів. У інших варіантах пухлина це пухлина шлунку або пухлина рота/глотки. Для здійснення способу прогнозування клітини зразка, наприклад, клітини пухлини, одержують від пацієнта. Наприклад, зразок пухлини - це переважно зразок пухлинної тканини. Зразок тканини пухлини може бути одержаний за допомогою стандартних способів, таких як біопсія пухлини або хірургічна резекція пухлини. Свіжозаморожені зразки пухлинної тканини можуть бути використані або, навпаки, зафіксовані у формаліні, залитий парафіном (FFPE) зразок тканини також придатний для використання. Інші типи зразків пухлини також можуть бути доступні для використання в способах, в яких зразок містить клітини пухлини та/або клітинні компоненти, виділених з пухлини. Необмежуючі приклади інших типів зразків пухлини включають тонкоголкову аспірацію, соскову аспірацію, суцільну кров, сироватку, плазму, лімфу, слину і сечу, або "злущені" або циркулюючі пухлинні клітини. У переважному варіанті винахід передбачає спосіб прогнозування реакції хворого на рак на лікування терапевтичним засобом, де спосіб може бути легко і швидко здійснений діагностичною лабораторією, щоб надати оперативну інформацію про те, з якою вірогідністю пацієнт з пухлиною буде реагувати на конкретне терапевтичне лікування. У такому способі прогнозування зразки пухлини, такі, як свіжозаморожені зразки або фіксовані у формаліні, залиті парафіном зразки тканини, одержують від пацієнта, і рівні рецепторів пухлини вимірюють за допомогою напівкількісної імуногістохімії (IHC). Вибір рецептора(ів) і ліганду(ів) для вимірювань заснований на тому, на яку клітинну мережу терапевтичний засіб націлений (наприклад, для шляху ErbB рівні наступних лігандів/рецепторів можуть бути виміряні: HRG, BTC, ErbB1, ErbB2 і ErbB3). Далі результати вимірювань методом напівкількісної IHC перетворюють на концентрацію за допомогою контролю, який містить клітинні пробки або ксенотрансплантати з відомими рівнями експресії рецепторів і лігандів в порівнянні із зразком пацієнта. У деяких ситуаціях, статус мутації одного або декількох цільових генів (наприклад, PI3K, PTEN) може бути визначений в зразку із застосуванням стандартних способів генотипування. Далі набір даних (концентрації ліганду і рецептора, статус генної мутації, якщо він встановлений) вводиться в обчислювальну модель цільової клітинної мережі і обчислюється Стан активації мережі (САМ). Прогнозування реакції на терапевтичний засіб може бути здійснене на базі порівняння обчисленого значення САМ із пороговим значенням САМ для чутливості і нечутливості. Використання веб-засобів для введення концентрації білка і даних щодо мутації в обчислювальну модель з подальшим обчисленням САМ і прогнозуванням реакції, дозволяє діагностичній лабораторії одержати майже миттєво відомості щодо вірогідності сприйнятливості до лікування пухлини терапевтичним засобом. Для будь-якого способу прогнозування за винаходом, описаного в даному описі, окрім реакції клітин (наприклад, пухлинних клітин) на лікування терапевтичним засобом, яка може бути спрогнозована із застосуванням способу, спосіб може додатково включати вибір схеми лікування для суб'єкта на базі спрогнозованої реакції клітин (наприклад, пухлинних клітин) на лікування. Наприклад, способи можуть додатково включати обчислювальну систему для візуалізації і уручну або автоматично рекомендувати та/або вибирати схему лікування для суб'єкта на базі обчислень спрогнозованої реакції клітин на лікування. Більш того, якщо курс лікування рекомендований або вибраний на базі спрогнозованої реакції клітин, способи за винаходом можуть додатково включати лікування суб'єкта відповідно до рекомендованої або 21 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 вибраної схеми лікування, яка може включати введення суб'єкту одного або декількох терапевтичних засобів. Крім того в даному описі запропоновані набори для прогнозування реакції клітин (наприклад, пухлинних клітин) на лікування терапевтичним засобом, націленим на компоненти клітинної мережі. Один з таких наборів включає: а) спосіб або способи визначення рівня одного або декількох компонентів клітинної мережі; б) інструкції з обчислення Стану активації мережі (САМ) або Стану інгібування мережі (СІМ) для клітин із застосуванням обчислювальної моделі клітинної мережі, і в) інструкції із застосування набору для прогнозування реакції клітин на лікування терапевтичним засобом. У додаткових варіанті набір може додатково містити інструкції із застосування алгоритму статистичної класифікації для обчислення САМ або СІМ. Клітинна мережа може бути, наприклад, сигнальним шляхом ErbB, сигнальним шляхом сMet або сигнальним шляхом IGF1R. Терапевтичний засіб може бути, наприклад, будь-яким з терапевтичних засобів, описаних вище, націленим на компоненти будь-якого з цих шляхів. В одному з варіантів для визначення рівнів одного або декількох компонентів клітинної мережі вводили один або декількох реагентів, що дозволяють визначати рівні білкових компонентів, таких як один або декілька реагентів у формі антитіл. В іншому варіанті вводили для визначення рівнів одного або декількох компонентів клітинної мережі один або декілька реагентів, що дозволяють визначати рівні мРНК компонентів, наприклад, один або декілька реагентів у формі нуклеїнових кислот (наприклад, зонди нуклеїнових кислот, праймери для ПЛР і т. п.). Такі реагенти для виявлення білкових або мРНК клітинних компонентів звичайно добре відомі фахівцям. Такі засоби для визначення рівнів можуть також включати обчислювальний пристрій, налаштований на вимірювання рівня білка. До способів, придатних для визначення рівня білка в клітинних компонентах, відносяться описані в даному описі такі способи, як кількісне флуоресцентне сортування клітин (qFACS), твердофазний імуноферментний аналіз (ІФА, Люмінекс), імуногістохімія (ІГХ, IHC), кількісна імуногістохімія (кІГХ, qIHC), мас-спектрометрія і Вестерн-аналіз (імуноблотинг). До способів, придатних для виявлення рівнів мРНК в клітинних компонентах відносяться, наприклад, кількісна полімеразна ланцюгова реакція (кПЛР, qPCR) і Нозерн-блотинг. Засоби для виявлення рівня одного або декількох компонентів клітинної мережі можуть також включати, наприклад, буфери або інші реагенти для використання в способах оцінки рівня компоненту(ів). Набір може включати інструкції (наприклад, друковані інструкції, такі як етикетки або листки-вкладиші) для проведення експерименту(ів) з визначення рівня одного або декількох компонентів клітинної мережі. Переважно, клітинна мережа - це сигнальний шлях ErbB, і в комплект входить засіб для визначення рівня одного або декількох компонентів (наприклад, одного або декілька рецепторів, гомодимерів рецепторів, гетеродимерів рецепторів і лігандів рецепторів) сигнального шляху ErbB, вибраних з ErbB1, ErbB2, ErbB3, ERbB4, HRG (зокрема HRG-b1), BTC, EGF, HB-EGF, TGFα, AR, EPG і EPR. Переважно, в набір входить засіб для визначення рівня, принаймні, одного рецептора сигнального шляху ErbB (наприклад, ErbB1, ErbB2, ErbB3, ERbB4) і, принаймні, одного ліганду сигнального шляху ErbB (наприклад, HRG, BTC, EGF, HB-EGF, TGFα, AR, EPG і EPR). Наприклад, в одному з варіантів в набір входить засіб для визначення рівня ErbB1, ErbB2, ErbB3, HRG і BTC. В іншому варіанті в набір входить засіб для визначення рівня ErbB1 і HRG. У ще одному варіанті в набір входить засіб для виявлення ErbB1, ErbB2 і ErbB3. У інших варіантах в набір входить засіб для виявлення мономерів ErbB2, гомодимерів ErbB2, гетеродимерів ErbB2/ErbB3 або гетеродимерів ErbB1/ErbB3. Засобами обчислень Стану активації мережі (САМ) або Стану інгібування мережі (СІМ) для клітин із застосуванням обчислювальної моделі клітинної мережі можуть бути, наприклад, комп'ютерний програмний продукт, що містить виконувані інструкції, які активують процесор для виконання операцій з обчислення САМ або СІМ клітин. Альтернативно, засобом обчислень САМ або СІМ може бути, наприклад, компонент, який дозволяє користувачу набору здійснити зв'язок на базі Інтернет-сервісу, на якій працює комп'ютерна програма, здатна обчислити САМ або СІМ для клітин після надходження користувачу інформації про рівень одного або декількох компонентів клітинної мережі. Такий компонент може включати, наприклад, інтерфейс, вебсторінки та/або пароль для доступу до Інтернет-бази, а також інструкції, наприклад, друковані інструкції з використання сервісу. Обчислювальна система і програмне забезпечення, встановлене для даної галузі і описане далі в даному описі, можуть бути адаптовані для використання в наборі за винаходом. Обчислювальні пристрої і обчислювальні компоненти, розглянуті на фіг. 16, можуть також включати засоби обчислення САМ або СІМ, такі як обчислювальні процесори, ввідний пристрій виміряних даних, виведення даних і т. д. Інструкції з використання набору для прогнозування реакції клітин на лікування 22 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 терапевтичним засобом можуть включати комп'ютерні інструкції і комп'ютерні інтерфейси, а також друковані видання і навчальні посібники. В деяких випадках набір упакований в єдину упаковку. В інших варіантах різні компоненти набору знаходяться в різних місцях. Наприклад, деякі з компонентів можуть забезпечуватися, зберігатися або розміщуватися на одній або декількох віддалених обчислювальних системах і стають доступними тільки через мережове підключення. Переважно, набори за винаходом призначені для застосування у суб'єкта-людини, наприклад, пацієнта-людини з пухлиною. У таких випадках клітини, як правило, - це клітини, одержані від пацієнтів шляхом біопсії або резекції пухлини. VII. Терапевтичні способи і набори Пропонуються способи лікування пацієнтів із злоякісними пухлинами. Загалом, такі способи включають: одержання зразка (наприклад, зразок біопсії або резекції) пухлини від пацієнта, визначення рівня одного або декількох біомаркерів в зразку; і введення терапевтичного засобу пацієнту, якщо рівні біомаркера(ів) в зразку відповідають заданому профілю, наприклад, рівень біомаркерів більше за мінімальний рівень. Такі способи застосовуються до будь-якої солідної пухлини. Придатні зразки пухлини загалом описані вище. У деяких варіантах біомаркери є рецепторними білками ErbB. Деякі варіанти таких способів включають: одержання зразків пухлини, оцінку рівня pErbB3 в зразку, а потім введення, принаймні, одного протипухлинного терапевтичного засобу пацієнту; при цьому, якщо рівень pErbB3, визначений в зразку, не нижчий за мінімальний рівень, що становить 25 %, 50 %, 60 %, 70 %, 80 %, 90 % або 100 % (бажано 50 %) від рівня pErbB3, виміряного в культурі клітин ACHN (клітини раку нирок, номер доступу ATCC CRL-1611), культивованої близько 20-24 годин в середовищі без сироватки, то пацієнту далі вводять, принаймні, один протипухлинний терапевтичний засіб, що містить анти-ErbB3 антитіла, і якщо рівень pErbB3, виміряний в зразку, нижчий за мінімальний рівень, то пацієнту далі вводять, принаймні, один протипухлинний терапевтичний засіб, що не містить анти-ErbB3 антитіла. Переважними культурами клітин ACHN є клітини, які перевивали не більше 9 разів, наприклад, перевиті 8 разів клітини ACHN. У подальших аспектах таких варіантів біомаркер являє собою pErbB3, терапевтичний засіб - це анти-ErbB3 антитіло, і мінімальний рівень становить 40 %, 50 %, 60 %, 70 %, 80 %, 90 % або 100 % від рівня, спостережуваного в пухлинних клітинах моделі ксенотрансплантата пухлини ACHN. У додаткових аспектах мінімальний рівень дорівнює 0,064 пг/мкг загального білка, 0,08 пг/мкг загального білка, 0,096 пг/мкг загального білка, 0,122 пг/мкг загального білка, 0,128 пг/мкг загального білка, 0,144 пг/мкг загального білка або 0,16 пг/мкг загального білка. У попередніх варіантах рівень pErbB3 в зразку може, в певних випадках, бути визначений: а) вимірюванням рівня, принаймні, двох компонентів сигнального шляху ErbB3 в зразку; б) обчисленням Стану активації мережі (САМ), яке імітує рівень pErbB3 в зразку за допомогою рівня(їв), виміряного в (а), введеного в обчислювальну модель сигнального шляху ErbB3, і (в) визначенням на їх основі рівня pErbB3 в зразку. У деяких варіантах рівні, принаймні, трьох, чотирьох, п'яти або шести компонентів сигнального шляху ErbB3 визначають в (а). Відповідні компоненти сигнального шляху ErbB3 включають, наприклад, ErbB1, ErbB2, ErbB3, ERBB4 (і гомо- та гетеродимери білків ErbB), HRG (наприклад, HRG-β1), BTC, EGF, HB-EGF, TGFα, AR, EPG і EPR. Ці компоненти можуть бути проаналізовані як білки (наприклад, мономери, гомодимери або гетеродимери) або, якщо це можливо (наприклад, якщо загальний рівень білка вимірюється незалежно від статусу фосфорилування, а не там, де вимірюється рівень фосфопротеїну, наприклад, для мономерів, гомодимерів або гетеродимерів), як рівень мРНК, яка кодує білок. Відповідні способи добре відомі в цій області, і включають описані в даному описі. У додаткових аспектах способи визначення рівня pErbB3 додатково включають застосування статистичного алгоритму класифікації для створення обчислювальної моделі сигнального шляху ErbB3, що використовується при розрахунку САМ. У інших варіантах обчислене САМ імітує рівні фосфорильованих гетеродимерів ErbB1/ErbB3 та/або фосфорильованих гетеродимерів ErbB2/ErbB3 в зразку. Aнти-ErbB3 антитіла для застосування в межах даного винаходу включають, не обмежуючись ними, анти-ErbB3 антитіла, розкриті в Міжнародній патентній заявці № PCT/US2008/002119, опублікованої як Міжнародна заявка № WO 2008/100624, яка включена до даного опису шляхом посилання. Особливо переважними для даного винаходу є антитіла, розкриті в даному описі, відомі як ММ-121, які на даний час проходять етап клінічних випробувань. Представлені анти-ErbB3 антитіла також включають анти-ErbB3 антитіла, описані вище. Іншими анти-ErbB3 антитілами, які можуть бути використані в способах, описаних в 23 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 даному описі, є U3-1287 (AMG888) (U3Pharma AG і Amgen), які на даний час проходять етап клінічних випробувань. Пухлини, що піддаються лікуванню, як вказано в даному описі, в цілому описані вище. Зразки пухлин органів вибрані з пухлин товстої кишки, легені, прямої кишки, жовчного міхура, головного мозку, спинного мозку, молочної залози, нирок, підшлункової залози, шлунку, печінки, кістки, шкіри, селезінки, яєчників, яєчок, передміхурової залози і м'язів. У деяких аспектах ErbB3-позитивні пухлини або ErbB2- і ErbB3-позитивні пухлини (наприклад, пухлини молочної залози і немілкоклітинний рак легені) є переважними. Протипухлинні терапевтичні засоби можна вводити пацієнту в будь-якій прийнятній формі. Як правило, терапевтичний засіб постачається у вигляді фармацевтичної композиції, яка містить терапевтичні засоби в поєднанні з фізіологічно прийнятними носіями. За бажанням інші активні або неактивні інгредієнти можуть бути також включені у фармацевтичну композицію. У даному описі термін "фізіологічно прийнятні" позначає затверджені регуляторним органом федерального або державного управління (наприклад, FDA США або EMEA) або зареєстровані у Фармакопеї США або інших загальновизнаних Фармакопеях для застосування у тварин, і особливо у людей. Термін "носій" позначає розчинник, ад'ювант, наповнювач або середовище, в яке поміщено протипухлинний терапевтичний засіб для подальшого введення. Фізіологічно прийнятний носій може бути стерильною рідиною, такою як водний розчин, який є переважним носієм для внутрішньовенного або іншого парентерального способу введення. Фізіологічний розчин, водний розчин декстрози і розчин гліцерину - це приклади водних носіїв для ін'єкційних розчинів. Придатні фармацевтичні наповнювачі включають, наприклад, крохмаль, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, крейду, силікагель, стеарат натрію, гліцерину моностеарат, тальк, натрію хлорид, сухе знежирене молоко, гліцерин, пропіленгліколь, воду і етанол. Рецептура, за бажанням, може також містити невелику кількість зволожувача або емульгатора, буферні речовини для корекції рН або консерванти. Фармацевтичні композиції можуть бути створені для будь-якого відповідного способу введення, зокрема, наприклад, парентерального, інтраназального, перорального, або місцевого застосування, наприклад, за допомогою трансдермальних засобів для профілактики та/або терапевтичного лікування. Приклади відповідних фармацевтичних способів введення і носіїв описані в "Remington: The Science and Practice of Pharmacy," A.R. Gennaro, ed. Lippincott Williams & Wilkins, Philadelphia, PA (21st ed., 2005). Як правило, фармацевтичні композиції, використовувані в способах, передбачених в даному описі, вводяться парентерально (наприклад, внутрішньовенно, внутрішньом'язовий або підшкірно). Для парентерального введення протипухлинний терапевтичний засіб може бути у вигляді суспензії або розчину в носії. Стерильні водні носії, як правило, є переважними, такі як вода, буфер, фізіологічний розчин або фосфатний буферний розчин. Крім того, стерильні жирні масла можуть бути використані як розчинник або середовище для суспендування. Для цього будь-яке нелетке жирне масло може бути використане, зокрема синтетичні моно- або дигліцериди. Крім того, жирні кислоти, такі як олеїнова кислота, знайшли застосування в приготуванні композицій для ін'єкцій. Фармацевтично прийнятні допоміжні речовини також можуть включати в наближених до фізіологічних умовах рН регулятори і буферні засоби, що регулюють тонічність, диспергувальні засоби, суспендувальні засоби, зволожуючі засоби, детергенти, консерванти, місцеві анестетики і буферні речовини. В одному з переважних варіантів фармацевтична композиція створюється для внутрішньовенного введення пацієнту (наприклад, людині). Як правило, композиції для внутрішньовенного введення являють собою розчини в стерильному ізотонічному водному буферному розчині. У разі потреби, композиція може також включати солюбілізуючі агенти. Компоненти можуть поставлятися окремо або змішуватися в єдину лікарську форму, наприклад, сухий ліофілізований порошок або безводний концентрат в герметичному контейнері, такому як ампули. Якщо композиція підлягає введенню за допомогою інфузії, вона може поставлятися з ємністю для інфузій, що містить стерильну воду фармацевтичної якості або фізіологічний розчин. Якщо композицію вводять шляхом ін'єкції, ампула із стерильною водою для ін'єкцій або фізіологічним розчином повинна поставлятися таким чином, щоб інгредієнти могли бути змішані перед введенням. Фармацевтичні композиції можуть бути стерилізовані звичайними способами стерилізації або стерилізуючою фільтрацією. Стерильні водні розчини можуть бути упаковані для використання або ліофілізовані, ліофілізований препарат постачають із стерильним водним носієм для введення. рН водної фармацевтичній композиції буде звичайно знаходитись між 3 і 11, більш переважно, від 5 до 9 або між 6 і 8, і, найбільш переважно, між 7 і 8, наприклад, від 7 до 7,5. 24 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 Терапевтичний засіб, як правило, присутній у фармацевтичній композиції в концентрації, при якій введення одноразової дози пацієнту забезпечує терапевтично ефективну кількість. Терапевтично ефективна кількість - це кількість, яка приводить до помітного ефекту у пацієнта, наприклад, уповільнення або припинення росту пухлини або, переважно, зменшення розмірів пухлини. Терапевтично ефективна кількість залежить від цілого ряду факторів, зокрема активності вживаного протипухлинного терапевтичного засобу; віку, маси тіла, загального стану здоров'я, статі і раціону пацієнта, часу і способу введення; швидкості екскреції; будь-якого супутнього лікування, такого як комбінація лікарських засобів, а також виду і тяжкості пошкодження тканин у хворого, що проходить лікування. Оптимальні дози можуть бути визначені за допомогою звичайних випробувань і процедур, які добре відомі в даній галузі. В цілому, переважними є композиції, що забезпечують рівень дози від 1 мг до 100 мг на кг маси тіла на добу, на тиждень або 1 раз на 2 тижні. Необмежуючі приклади відповідного діапазону доз і схеми прийому включають 2–50 мг/кг (маси тіла суб'єкта), введення 1 раз на тиждень або 2 рази на тиждень або 1 раз на 3 дні, 1 раз 2 на тиждень або 1 раз 3 на тиждень, і 1–100 мг/кг 1 раз на тиждень, або 2 рази на тиждень або 1 раз на 3 дні, або 1 раз на 2 тижні. У різних варіантах терапевтичний засіб вводять в дозі 3,2 мг/кг, 6 мг/кг, 10 мг/кг, 15 мг/кг, 20 мг/кг, 25 мг/кг, 30 мг/кг, 35 мг/кг або 40 мг/кг з періодичністю 1 раз на тиждень або 2 рази на тиждень або 1 раз на 3 дні, 1 раз на 2 тижні або 1 раз на 3 тижні. Додатково діапазон доз включає: 1–1000 мг/кг, 1–500 мг/кг, 1–400 мг/кг, 1–300 мг/кг і 1–200 мг/кг. Відповідно, схеми застосування включають 1 раз на 3 дні, 1 раз на 5 днів, 1 раз на 7 днів (тобто, 1 раз на тиждень), 1 раз на 10 днів, 1 раз на 14 днів (тобто, 1 раз на 2 тижні), 1 раз на 21 день (тобто, 1 раз на 3 тижні), 1 раз на 28 днів (тобто, 1 раз на 4 тижні) і 1 раз на місяць. Переважно, терапевтичний засіб (наприклад, анти-ErbB3 антитіла) вводять пацієнту відповідно до вказівок інструкцій з медичного застосування препарату, наданих фірмоювиробником або дистриб'ютором терапевтичного засобу. Також пропонуються набори для застосування в лікуванні пацієнтів із злоякісними пухлинами. Деякі з таких наборів звичайно включають: а) як мінімум один тест для визначення рівня, принаймні, одного компоненту сигнального шляху ErbB3 в зразку; і б) інструкцію з обчислення Стану активації мережі (САМ), який імітує рівень pErbB3, за допомогою обчислювальної моделі сигнального шляху ErbB3 на базі вхідних даних, одержаних, принаймні, з одного випробування. У деяких варіантах такі набори додатково містять інструкції із застосування алгоритмів статистичної класифікації. У деяких варіантах набір також включає анти-ErbB3 антитіло. Тест звичайно включає один або декілька реагентів, які дозволяють визначити рівень, принаймні, одного білкового компоненту або, принаймні, одного мРНК компоненту. У деяких варіантах інструкції з обчислення САМ є керівництвом з використання комп'ютерної програми, що включає виконувані інструкції, які запускають процесор на виконання операцій з обчислення САМ; у таких варіантах користувачу може бути доручено запустити комп'ютерну програму на локальному комп'ютері або користувачу може бути доручено взаємодіяти з Інтернет-сервісом, через який комп'ютерна програма працює дистанційно. В інших варіантах запропоновані набори складаються з анти-ErbB3 антитіл та інструкцій (наприклад, у вигляді наклейок або листка-вкладиша), де вказано, що анти-ErbB3 антитіла слід вводити пацієнту, якщо рівень pErbB3 при біопсії пухлини у пацієнта перевищує вказане мінімальне значення, і що анти-ErbB3 антитіла не слід вводити пацієнту, якщо рівень pErbB3 не перевищує вказаного мінімального значення. Наприклад, такі інструкції можуть означати, що анти-ErbB3 антитіла вводяться пацієнту із злоякісною пухлиною, якщо рівень фосфорильованих ErbB3, визначений в зразку, не нижчий за 50 % від рівня фосфорильованих ErbB3, виміряного в культурі клітин раку нирки ACHN (АТССCRL-1611), інкубованих близько 20–24 годин в середовищі без сироватки; і що анти-ErbB3 антитіла не повинні вводитися пацієнту із злоякісною пухлиною, якщо рівень фосфорильованих ErbB3, визначений в зразку, нижчий за 50 % від рівня фосфорильованих ErbB3, виміряного в культурі клітин раку нирки ACHN. VIII. Компю'теризовані варіанти Як згадувалося вище, і як повинно бути очевидним з даного опису, в багатьох варіантах винаходу застосовується одна або декілька обчислювальних систем для виконання різних способів, описаних вище, зокрема, не обмежуючись ними, прогнозування реакції пацієнта, генерації рекомендованого лікування, визначення рівня біомаркерів, обчислення значень САМ або СІМ, одержання обчислювальних моделей сигнальних шляхів, і т. д. На фіг. 15А і 15В блок-схеми ілюструють деякі із способів, які можуть бути виконані однією або декількома обчислювальними системами під час здійснення деяких варіантів винаходу. Як показано, наприклад, обчислювальні системи можуть бути використані для вимірювання та/або 25 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 60 одержання вхідних даних щодо виміряних рівнів компонентів клітинної мережі пухлини, а також статусу мутації генів пухлини. Обчислювальні системи також можуть застосовуватися для одержання обчислювальних моделей, які можуть бути одержані, наприклад, шляхом одержання, завантаження, побудови, модифікації, навчання та/або доступу до обчислювальної моделі з локальних і видалених джерел. Іноді обчислювальну модель одержують шляхом обчислення однією або декількома обчислювальними системами САМ або СІМ для клітин, наприклад, шляхом імітації відповідних рівнів фосфорильованих білків, гомодимерів та/або гетеродимерів в клітинах. Розрахункова модель також може бути використана обчислювальною системою для визначення прогностичних біомаркерів шляхом виявлення відповідних додаткових компонентів клітинної мережі, на підставі призначених для користувача параметрів налаштувань, одержаних від обчислювальної системи. Обчислювальна система може також застосовуватися для ідентифікації алгоритмів статистичної класифікації, які можуть бути одержані, побудовані та/або змінені в обчислювальній системі, як частина процесу ідентифікації, і які можуть бути використані в різних комбінаціях із значеннями САМ або СІМ, значеннями інших біомаркерів і даними про пацієнта для генерації спрогнозованої реакції пацієнта на лікування та/або для генерації і вибору рекомендованого лікування. Хоча елементи, показані на блок-схемах фіг. 15А і 15Б, передбачають пропоновану послідовність або впорядкованість для виконання обчислювальних процесів за винаходом, слід мати на увазі, що процеси, показані на фіг. 15А і 15Б, можуть також бути виконані з іншим порядком послідовності. Наприклад, рекомендоване лікування може бути встановлено до генерації обчислювальної моделі або обчислень САМ або СІМ, які можуть бути використані в побудові обчислювальної моделі. Аналогічним чином, вимірювання рівня білка може відбутися до або після генерації обчислювальної моделі. Також слід відзначити, що додаткові процеси можуть бути виконані як частина винаходу, тобто винахід не обмежується тільки способами, які включають процеси, показані на схемі. Наприклад, винахід також може включати процеси для одержання інформації про пацієнта (наприклад, вік, стать, стан здоров'я), а також для відстежування фактичних результатів рекомендованого лікування, та інші процеси. Слід також відзначити, що обчислювальні системи, використовувані для здійснення способів за винаходом, можуть включати одну або декілька різноманітних обчислювальних систем, різних типів, а також таких, що знаходяться в різних місцях. Фіг. 16 демонструє один такий приклад обчислювальної системи, яка може бути використана для виконання деяких аспектів винаходу (включаючи, наприклад, принаймні, деякі з процесів, показані на фіг. 15А і 15Б, а також описані в даному описі). Як показано, обчислювальна система включає різноманітні ввідні пристрої, вивідні пристрої, обчислювальні модулі, компоненти обробки і зберігання інформації. Ввідний пристрій може включати клавіатуру, мишу, сенсорну панель, сенсорний дисплей, мікрофон, а також будь-які інші ввідні пристрої. Вивідні пристрої можуть включати звукові колонки, дисплей, принтер, комутаційний пристрій, а також інші вивідні пристрої. Обчислювальні модулі включають різноманітні модулі, необхідні для виконання функцій, описаних в даному описі, зокрема, модулі для одержання і побудови обчислювальної моделі, модулі для обчислень САМ або СІМ, модулі для ідентифікації прогностичних біомаркерів, модулі для одержання, розпізнавання і зберігання виміряних рівнів компонентів і для виявлення певного статусу мутації гена, модулі для визначення і застосування алгоритмів статистичної класифікації, модулі для генерації спрогнозованої реакції на лікування, модулі для генерації і вибору рекомендованого лікування, комунікаційні модулі для здійснення зв'язку користувача з одним або декількома іншими пристроями, а також модулі для виконання різноманітних інших процесів, описаних в даному описі. Обчислювальна система також включає один або декілька процесорів та інших технологічних компонентів, необхідних для виконання вищевикладених програмних модулів, а також носії для зберігання вищевикладених програмних модулів, а також різноманітні структури даних, обчислювальні моделі та інші дані, описані в даному описі. Хоча середовище для зберігання даних представлене локально до обчислювальної системи, слід розуміти, що середовище для зберігання інформації також може розташовуватися віддалено від обчислювальної системи, або бути тільки частково локалізована в обчислювальній системи. Наприклад, в деяких випадках, середовище для зберігання даних є зберіганням згідно схемі, яке використовується для множини різноманітних обчислювальних систем і яка включає об'єм пам'яті, розташований в множині обчислювальних систем. Середовище для зберігання даних може також містити будь-яке поєднання оперативної і дискової пам'яті. 26 UA 104868 C2 5 10 15 20 25 30 35 40 45 50 55 Фіг. 16 також показує, що обчислювальна система - це мережа, яка може бути сполучена з одним або декількома іншими пристроями, включаючи вимірювальні прилади, віддалені комп'ютери, дистанційне обслуговування і віддалені мережі. В деяких випадках один або декілька з вказаних інших пристроїв виконує один або декілька процесів, описаних в даному описі, таким чином, що виконання деяких способів здійснюється в розподіленій мережі, що включає декілька розподілених обчислювальних систем і пристроїв. У зв'язку з вищевикладеним, слід враховувати, що сфера застосування даного винаходу може бути реалізована для різних несхожих конфігурацій комп'ютерів. IX. Приклади Наступні необмежуючі приклади додатково ілюструють даний винахід. Опис винаходу до кожного патенту США, міжнародних або інших патентів або патентних заявок або публікацій, на які посилаються в даному описі, включено до даного опису шляхом посилання в повному обсязі. Приклад 1: Дослідження ефективності Ab #6 з використанням ксенотрансплантата: учбовий набір даних У даному прикладі використовували чотири моделі ксенотрансплантата пухлини з метою ідентифікації ліній пухлинних клітин, які відповідають на лікування анти-ErbB3 антитілом Ab #6. Чотири досліджувані моделі ксенотрансплантата пухлини представляють різні показання: MALME3M (лінія раку меланоми; ATCC, Ні. HTB-64), ADRr (лінія клітин раку яєчників; NCI-60, зразок COSMIC ID № 905987), ACHN (лінія клітин раку нирки; ATCC, № CRL-1611) і DU145 (лінія клітин раку передміхурової залози; ATCC, № HTB-81). Як детально описано нижче, ксенотрансплантати MALME3M і ADRr не продемонстрували реакції на лікування Ab #6, тоді як ксенотрансплантати ACHN і DU145 продемонстрували реакцію на лікування Ab #6. У моделях ксенотрансплантата пухлини мишам (миші nu/nu: самки віком 3-4 тижні, з дефіцитом T-клітин; аутбредна популяція; походження Albino; з лабораторії Charles River Labs, 6 8 Wilmington, MA) вводили шляхом підшкірної ін'єкції в правий бік 200 мкл 3,5 x 10 –3 x 10 клітин/мишу (в залежності від лінії клітин). Стан мишей контролювали з метою спостереження за початковим ростом пухлини. Пухлинні клітини вирощували протягом декількох днів, поки об'єм пухлини не досягав приблизно 200 мм3. Об'єм пухлини обчислювали як: 2 V = (π L x W ). Мишам вводили антитіло Ab #6 в дозі 600 мкг/інє'кцію кожні 3 дні (qd3). Мишам контрольної групи вводили фосфатний буферний сольовий розчин (ФБР). Об'єм пухлини вимірюють протягом 60–80 днів. Результати (одержані з використанням способів, описаних вище або їх незначних варіацій), виражені як вплив лікування антитілом на ріст пухлини, наведені на графіках, показаних на фіг. 1A-1D, які демонструють, що лікування Ab #6 уповільнювало ріст пухлини на моделях ксенотрансплантата DU145 і ACHN, тоді як лікування Ab #6 не уповільнювало росту (в порівнянні з контрольним фосфатним буферним розчином) пухлини на моделях ксенотрансплантата ADRr і MALME3M. Як показник сприйнятливості пухлини до Ab #6 визначають експоненціальний темп росту, який найкращим чином описує експериментальні дані. Для опису експоненціального росту використовують наступну формулу: V=Vo*exp(k*t), де 3 V - об'єм пухлини в мм ; Vo - об'єм пухлини на нульовому відрізку часу; ДО - експоненціальний темп росту; t - час в днях. Для порівняння уповільнення росту в різних дослідженнях ксенотрансплантатів для кожної досліджуваної лінії клітин обчислюють показник сповільнення темпів росту (СТР, GRR), який повя'зує спостережуваний темп росту в присутності Ab #6 з темпом росту, що спостерігається в контрольній групі, яка одержує фосфатний буферний розчин; даний показник обчислюють за наступною формулою: Уповільнення темпу росту = 1 – (темп росту в групі Ab #6 до Ab #6)/(темп росту в групі фосфатного буферного розчину kPBS) Показники СТР для чотирьох досліджуваних ліній клітин (одержані з використанням способів, описаних вище або їх незначних модифікацій) наведені в табл. 1 нижче. У разі негативного уповільнення темпу росту показник СТР приймають за нуль. 27 UA 104868 C2 Таблиця 1 Узагальнені результати за показниками уповільнення темпу ріст (ПСТР) пухлини для дослідження учбового набору ксенотрансплантатів Лінія клітин ПСТР [%] 0 72,6 0 28,0 MALME3M DU145 ADRr ACHN 5 10 15 20 25 30 35 40 45 50 Результати демонструють, що чотири ксенотрансплантати показують інтервал сприйнятливості клітин до лікування Ab #6, причому клітини ADRr і MALME3M не демонстрували реакції на лікування Ab #6, ACHN виявляє помірну сприйнятливість, а клітини DU145 демонструють найвищу сприйнятливість до лікування Ab #6. Приклад 2: Рівні pErbB3 в лізатах ліній пухлинних клітин корелюють із сприйнятливістю до Ab #6 в ксенотрансплантатах У даному прикладі концентрацію фосфорильованого ErbB3 (pErbB3) вимірювали in vivo в кожній з чотирьох ліній пухлинних клітин, досліджених в Прикладі 1, MALME3M, ADRr, DU145 і ACHN, в короткостроковому дослідженні фармакодинаміки (ФД). Ксенотрансплантат OvCAR8 також включили в даний експеримент (у Прикладі 5, описаному нижче, показано, що даний ксенотрансплантат реагує на лікування Ab #6). Клітини MALME3M, ADRr, DU145, OvCAR 8 і ACHN вирощують в культурі і збирають після культивування для імплантації (пластинки 15 x 15 см, ~80 % заселення, загальна кількість 8 7 клітин = 2–4 x 10 ) і вміщують на лід до імплантації. Клітини (приблизно 2 x 10 клітин/мишу) імплантують 20 мишам (шляхом підшкірної ін'єкції, 200 мкл клітин/інє'кцію/мишу) в правий бік, а потім спостерігають за мишами до їх одужання, контролюючи початковий ріст пухлини. Пухлини вимірюють (Д x Ш) цифровим товщиноміром. Як тільки у мишей пухлина досягає об'єму більше 3 100 мм , тварин піддають евтаназії з використанням CО2, пухлини від кожної миші вирізують і миттєво заморожують в рідкому азоті. Заморожені зразки пухлинної тканини зберігають при температурі -80 °С для біохімічного аналізу. Кількість фосфорильованого ErbB3 (pErbB3) в пухлинних лізатах визначають методом твердофазного імуноферментного аналізу (ELISA) з використанням набору R&D Systems Human pErbB3 ELISA (кат. № DYC1769). Приготування зразка і протоколи ELISA детально описані нижче. Для приготування зразка і екстракції білка, спочатку заморожені пухлини подрібнюють і переносять в заздалегідь зважені кріопробірки VWR обє'мом 2 мл (VWR International). Подрібнені зразки зважують, їх масу реєструють. Після обчислення маси зразка в кожну пробірку додають відповідну кількість крижаного лізисного буфера і доводять до кінцевої концентрації 62 мг/мл. Зразки деякий час перемішують на вихровій мішалці при низькій швидкості і, обертаючи, інкубують при температурі 4 °С. Далі необроблений пухлинний лізат переносять в Qiagen Qiashredder і центрифугують при 12000 об/хв. протягом 8 хвилин для подальшої гомогенізації зразків. Після перенесення очищених лізатів в чисту пробірку відбирають невелику кількість кожного лізату для кількісного аналізу вмісту білка. Решту лізату розділяють на аліквоти і зберігають при температурі -80 °С для подальшого аналізу методом ELISA. Для кількісного визначення загального вмісту білка з використанням набору для кількісного аналізу вмісту білка (BCA) (Pierce, кат. № 23225) спочатку будують стандартну криву вмісту бичачого сироваткового альбуміну (БСА), що складається з 8 точок, використовуючи стандартний розчин 2 мг/мл з набору BCA, розпочинаючи з початкової концентрації 2 мг/мл. Після змішування реактивів А і б з даного набору (50:1) і приготування 3-разового і 5-разового розведень початкового пухлинного лізату за допомогою фосфатного буферного розчину в кожну лунку 96-лункового планшета вміщують 20 мкл стандартного розчину бичачого сироваткового альбуміну або розбавленого зразка пухлинного лізату і 160 мкл робочого реактиву. Планшет інкубують при температурі 37 °С протягом 20 хвилин. Зчитують OD562 і визначають загальний вміст білків в пухлинних лізатах за допомогою стандартної кривої БСА. Для проведення твердофазного імуноферментного аналізу pErbB3 різні іммобілізовані антитіла розбавляють фосфатним буферним розчином до робочої концентрації, рекомендованої виробником набору (R&D Systems DYC1769). Після вкриття чорних 96-лункових планшетів (Nunc Maxisorb) розведеними іммобілізованими антитілами, всі планшети інкубують 28
ДивитисяДодаткова інформація
Назва патенту англійськоюMethods and systems for predicting response of cells to a therapeutic agent
Автори російськоюSchoeberl, Birgit, Harms, Brian, Gibbons, Francis, David, Fitzgerald, Jonathan, Basil, Onsum, Matthew, David, Nielsen, Ulrik, Kubasek, William
МПК / Мітки
МПК: C12Q 1/68, C07K 16/32
Мітки: лікування, неопластичну, реакції, відповідно, пухлину, спосіб, пацієнта, спрогнозованої, має
Код посилання
<a href="https://ua.patents.su/95-104868-sposib-likuvannya-paciehnta-shho-maeh-neoplastichnu-pukhlinu-vidpovidno-do-sprognozovano-reakci.html" target="_blank" rel="follow" title="База патентів України">Спосіб лікування пацієнта, що має неопластичну пухлину, відповідно до спрогнозованої реакції</a>
Попередній патент: Похідні феноксихроманкарбонової кислоти, заміщені в 6-ому положенні
Наступний патент: Фармацевтичні композиції, що містять ліганди рецептора дофаміну
Випадковий патент: Спосіб діагностики захворювань зорового нерву