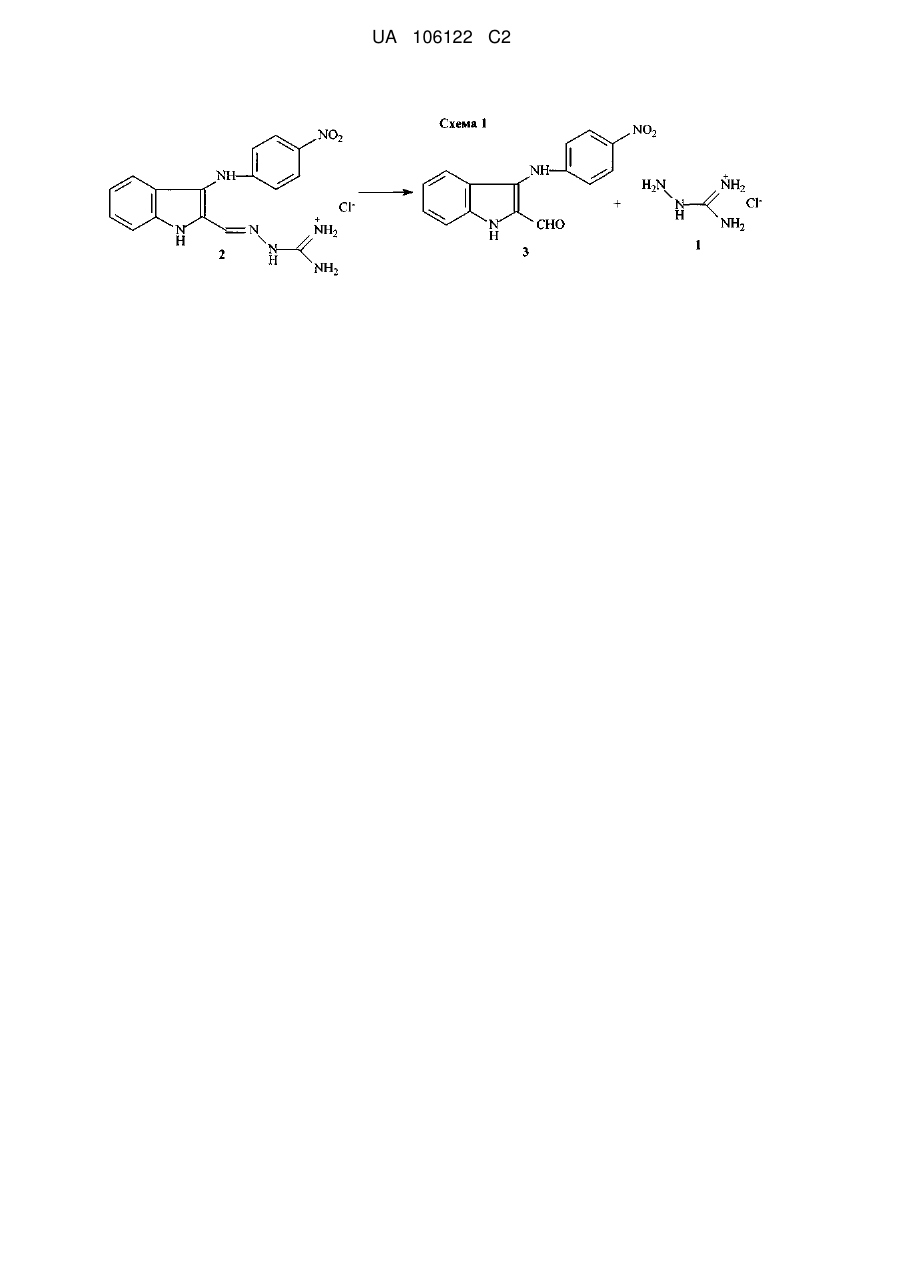
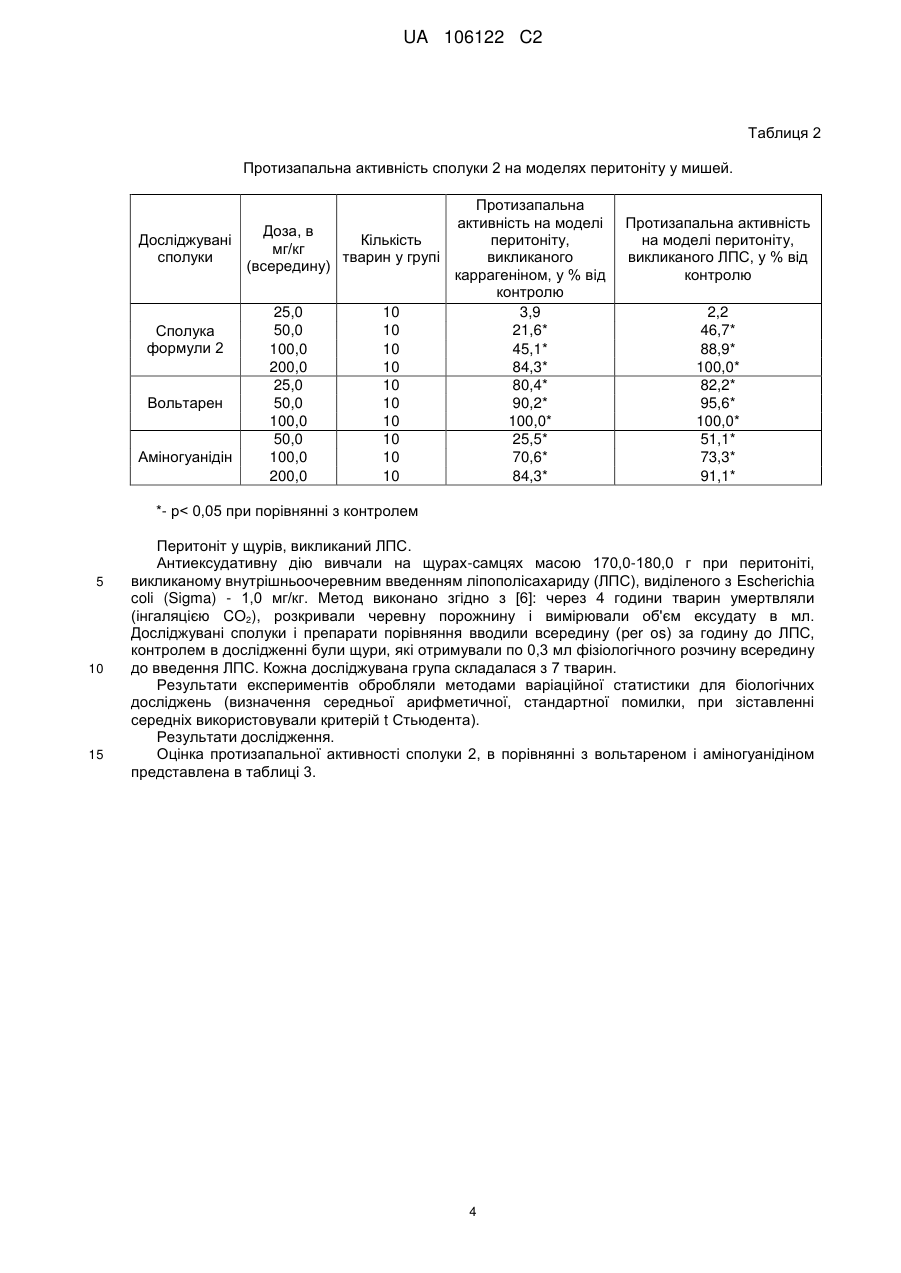
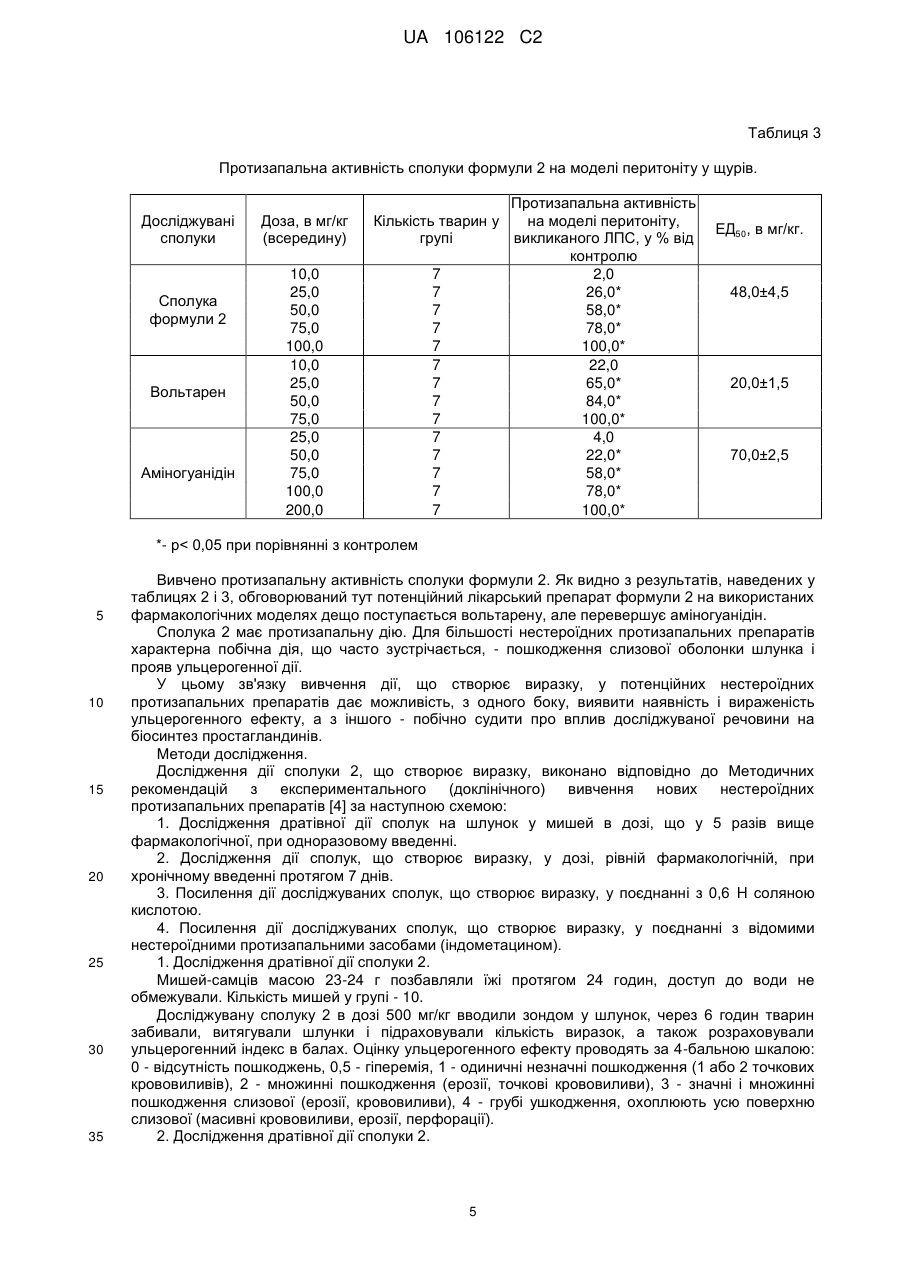
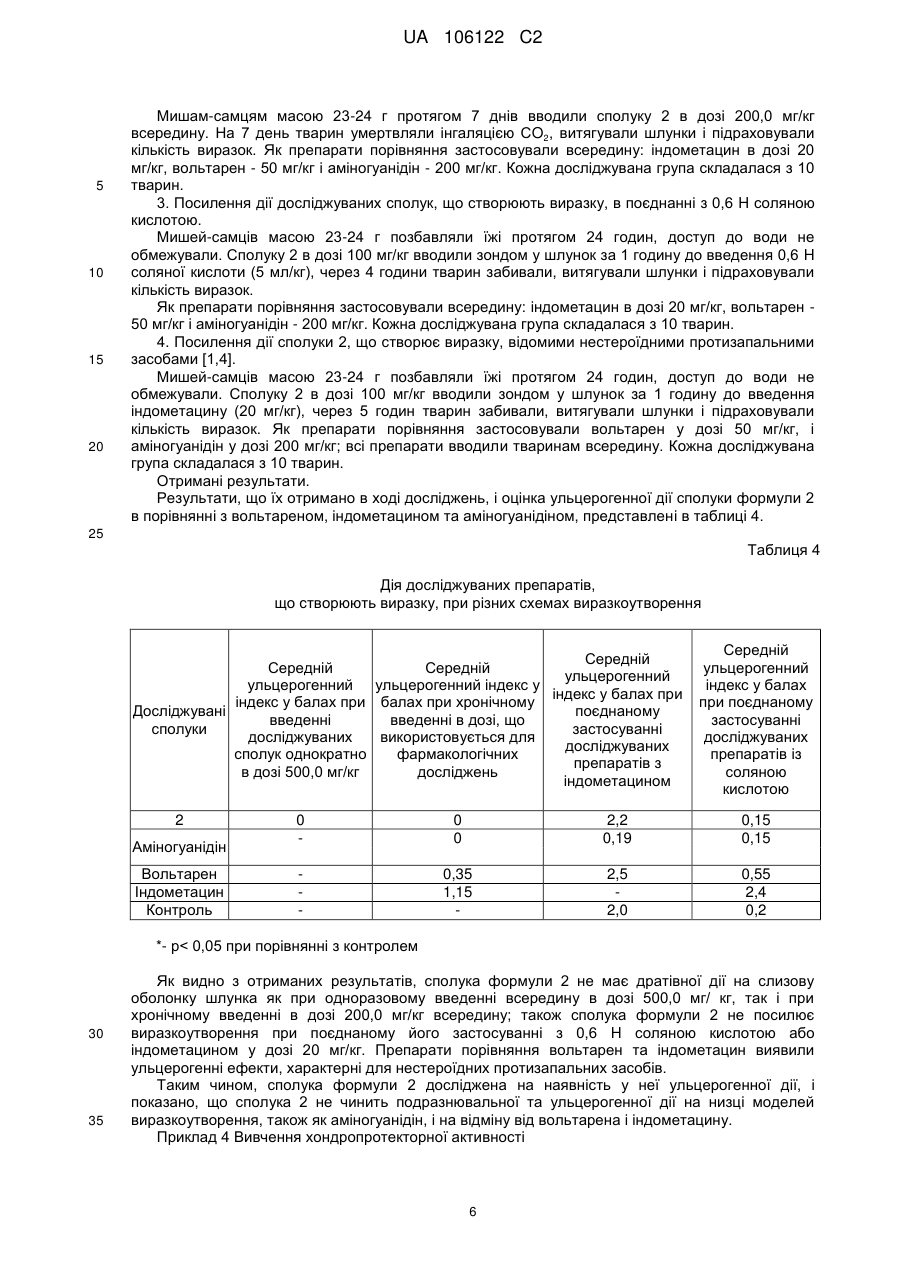
Біологічно активна сполука n-[3-(4-нітрофеніламіно)-індол-2-ілметилен]аміногуанідину гідрохлорид з протизапальною активністю
Номер патенту: 106122
Опубліковано: 25.07.2014
Автори: Гранік Владімір Грігорьєвіч, Рябова Свєтлана Юрьєвна, Зайцев Сєргєй Анатольєвіч, Панішева Єлєна Константіновна, Калінкіна Маріна Алєксєєвна, Грігорьєв Нікіта Борісовіч, Лєвіна Вікторія Ісааковна, Паршін Валєрій Алєксандровіч
Формула / Реферат
1. N-[3-(4-нітрофеніламіно)-індол-2-ілметилен]аміногуанідину гідрохлорид формули (2)
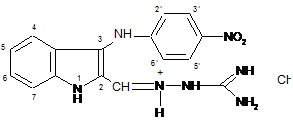 , 2
, 2
або його фармацевтично прийнятна сіль або комплексне похідне.
2. N-[3-(4-нітрофеніламіно)-індол-2-ілметилен]аміногуанідину гідрохлорид формули (2) за п. 1, що виявляє системну протизапальну дію.
3. N-[3-(4-нітрофеніламіно)-індол-2-ілметилен]аміногуанідину гідрохлорид формули (2) за п. 1, що виявляє хондропротекторну дію.
Текст
Реферат: Винахід стосується галузі хіміко-фармацевтичної промисловості та медицини. Запропоновано N-[3-(4-нітрофеніламіно)-індол-2-ілметілен]аміногуанідину гідрохлорид формули (2), що має протизапальну і хондропротекторну дії. Сполука не виявляє побічних ефектів при застосуванні. UA 106122 C2 (12) UA 106122 C2 UA 106122 C2 5 10 15 Область техніки, до якої належить винахід Винахід відноситься до області хіміко-фармацевтичної промисловості та медицини і стосується нової сполуки, що може знайти застосування як протизапальний засіб. Попередній рівень техніки Відомо, що найбільш використовуваними в медичній практиці засобами для лікування запальних патологій є нестероїдні протизапальні засоби, такі як кислота ацетилсаліцилова (аспірин), індометацин, вольтарен (диклофенак натрію), ібупрофен (бруфен) та ін [1]. Зі впливом на біосинтез простагландинів пов'язаний основний побічний ефект нестероїдних протизапальних препаратів - ульцерогенна дія (здатність пошкоджувати слизову оболонку шлунка та дванадцятипалої кишки, аж до розвитку виразкових станів). Це ускладнення пов'язане з інгібуванням біосинтезу простагландинів, що є фізіологічними (ендогенними) гастроцітопротекторними речовинами. Внаслідок цього актуальним завданням є пошук нових сполук, що матимуть системний протизапальний ефект, але будуть позбавлені зазначеної ульцерогенної дії. З цієї точки зору вважалося перспективним знайти речовину, що матиме значний протизапальний ефект, не пов'язаний з інгібуванням синтезу простагландинів, а такий, що впливає на організм за іншим механізмом. Добре відомо, що цілий ряд похідних гуанідину виявляють виражений антагонізм до NOсинтаз. І в цьому відношенні виділяється N-аміногуанідін (1) [2], а також деякі його похідні. 20 25 30 35 40 У більшості in vitro-систем аміногуанідін і відомий інгібітор синтаз оксиду азоту L-NMMA (NGмонометил-L-аргінін) рівноефективні при інгібуванні індуцибельного ізоферменту, але перший є на порядок менш активний стосовно конститутивних форм, тобто перший суттєво селективніший [3]. На моделях тварин аміногуанідін зменшує тяжкість перебігу хвороби при запаленнях, септичному шоці, підвищує виживаність при введенні ендотоксинів. Профіль активності аміногуанідіна сприятливий для хворого, в плані лікування запальних захворювань. Як найближчий аналог можуть бути зазначені солі похідних амідіна і інгібітора циклооксигенази загальної формули AB, в якій А - інгібітор циклооксигенази з карбоксильною функцією; В - сполука загальної формули Сполуки по винаходу мають подвійний біологічний ефект, при якому вони інгібують утворення окису азоту (NO) та активність циклооксигенази і можуть застосовуватися як протизапальні препарати [8]. Однак їм притаманні, хоча менш виражені, побічні ефекти, характерні для вищезгаданих нестероїдних протизапальних засобів. Сутність винаходу Завданням винаходу є вишукування нового протизапального засобу, що не виявляє ульцерогенної дії. Виходячи з цього, вважалось оптимальним розробити синтез такої сполуки, що не лише містила б аміногуанідіновий фрагмент у своїй структурі, але мала властивість метаболізуватися в живому організмі з виділенням аміногуанідіна. Саме ця якість є цілком імовірною для сполуки, що заявляється в цій роботі, - Н-[3-(4нітрофеніламіно)-індол-2-ілметилен]аміногуанідіна гідрохлорид формулы (2): 1 UA 106122 C2 > Іміноструктура цієї сполуки передбачає, що у водному середовищі вона може гідролізуватися (як це характерно для імінів) за схемою 1 з утворенням 2-форміл-3-пнітрофеніліндола (3) і гідрохлориду аміногуанідіна: 5 10 15 20 25 30 35 40 Детальний опис винаходу Спосіб отримання N-[3-(4-нітрофеніламіно)-індол-2-ілметілен] аміногуанідіна гідрохлориду формули (2) заснований на взаємодії 2-форміл-3-(4-нітрофеніл) аміноіндола [9, 10] з аміногуанідіном в присутності соляної кислоти при нагріванні в спирті ректифікаті, що забезпечує технологічно прийнятні умови одержання цільового продукту з доступної сировини і без застосування особливих умов проведення процесу. Нова сполука виявляє цінні фармакологічні властивості: чинить системну протизапальну дію, а також виявляє властивості хондропротективного агента. Можливість здійснення винаходу може бути продемонстрована наступними конкретними прикладами виконання: Приклад 1 Синтез N- [3-(4-нітрофеніламіно)-індол-2-ілметилен] аміногуанідіна гідрохлориду (2) Суміш 1 г (0.356 ммоль) 2-форміл-3-(4-нітрофеніл) аміноіндола, 0.58 г (0.43 ммоль) аміногуанідіна карбонату, 0.87 мл (0.86 ммоль) конц. соляної кислоти, 0.87 мл води і 26 мл етанолу ректифікатукип'ятять 1.5 год. Охолоджують, осад відфільтровують, промивають спиртом і ацетоном. Отримують 1.23 г гідрохлориду, який перекристалізують в суміші етанолвода (3:1). Вихід 0.8 г (65 %). T. пл. 310-312° C. При великих завантаженнях речовину кристалізували з водного N, N-діметілформаміду (ДМФА). Отримана сполука характеризується наступними даними ЯМР-спектра: 1 Спектр H (ДМСО-d6, δ, м.д.): 6,75 і 8,03 7,02, 7,26, 7,44, (всі м. по 1H, 2Н, 1Н, 4Н, 7Н) 7,83 (уш.с., 4Н, HN-CH=NH2) 8,18 (с. 1H- -Н) + 9,21, 11,69, 11,98 (уш.с. по IH, NH(Ph), NH (індол), NH ) Приклад 2 Вивчення токсичних властивостей сполуки Дослідження сполуки формули 2 проводилось in vivo у порівнянні з найефективнішими нестероїдними протизапальними препаратами - вольтареном і індометацином, головним недоліком яких є вищезазначений ульцерогенний ефект. Для визначення доз, в яких цю сполуку необхідно вивчати за фармакологічними показниками, в першу чергу необхідне визначення його гострої токсичності. Досліди проведено на мишах-самцях масою 18-20 г. Сполуку 2 вводили всередину у вигляді суспензії з водою. Кожну дозу вводили п'яти тваринам. Спостерігали за поведінкою і станом тварин протягом 5 днів. Величину показника ЛД5о, який характеризує дозу, що викликає загибель 50 % піддослідних тварин, розраховували за методом Кербера. 2 UA 106122 C2 Таблиця 1 Вплив сполуки, що досліджується, на загибель мишей Доза, в мг/кг внутрішньовенно 500,0 1000,0 1500,0 2000,0 5 10 15 20 25 30 35 Кількість тварин у групі 5 5 5 5 Загибель тварин Живі Загинули 5 0 5 0 5 0 4 1 Примітка Поведінка тварин без змін Поведінка тварин без змін Поведінка тварин без змін Тварини пригнічені Враховуючи загибель однієї тварини з п'яти лише при внутрішньовенному введенні препарату в дозі 2000,0 мг/кг, можна стверджувати, що досліджувана сполука відноситься по ГОСТ 12.1.007-76 (Класифікація виробничих шкідливих речовин за ступенем небезпеки) як мінімум до 3 класу - помірно небезпечні речовини, а враховуючи, що при введенні всередину ЛД5о може перевищувати 5000 мг/кг, цю сполуку формули 2 можна віднести до 4 класу малонебезпечні речовини, тобто сполука практично не токсична. Приклад 3 Вивчення протизапальної активності Активність вивчено за методиками, представленими в "Методичних рекомендаціях з експериментального (доклінічного) вивчення нових нестероїдних протизапальних засобів" для скринінгового вивчення нових сполук, на моделях перитоніту у мишей, викликаного ліпополісахаридом (ЛПС) і каррагеніном [4]. 1. Перитоніт у мишей, викликаний каррагеніном. Дослідження виконано згідно з методом, описаним в роботі [5]. Досліди проведено на мишах-самцях масою 23-24 г, в кожній групі по 10 тварин. Досліджувані сполуки вводили зондом у шлунок за 1,5 години до внутрішньочеревного введення 0,2 мл 1 % λ-каррагеніна, через 4 години тварин забивали і вимірювали в мл кількість ексудату в перитоніальній порожнині. Результати експериментів обробляли методами варіаційної статистики для біологічних досліджень (визначення середньої арифметичної, стандартної помилки, при зіставленні середніх використовували критерій t Стьюдента). 2. Перитоніт у мишей, викликаний ЛПС. Антиексудативну дію вивчали на мишах-самцях масою 22,0-23,0 г при перитоніті, викликаному внутрішньоочеревним введенням ліпополісахариду (ЛПС), виділеного з Escherichia coli (Sigma) 1,0 мг/кг, як описано в [6]: через 4 години тварин забивали (інгаляцією CO2), розкривали черевну порожнину і вимірювали об'єм ексудату в мл. Досліджувані сполуки і препарати порівняння вводили всередину (per os) за годину до ЛПС, контролем в дослідженні були миші, які одержували по 0,3 мл фізіологічного розчину всередину до введення ЛПС. Кожна досліджувана група складалася з 10 тварин. Результати експериментів обробляли методами варіаційної статистики для біологічних досліджень (визначення середньої арифметичної, стандартної помилки, при зіставленні середніх використовували критерій t Стьюдента). Результати дослідження. Результати, отримані в ході експерименту, відображені, і оцінка протизапальної активності сполуки 2 представлена в таблиці 2. 3 UA 106122 C2 Таблиця 2 Протизапальна активність сполуки 2 на моделях перитоніту у мишей. Протизапальна активність на моделі Доза, в Досліджувані Кількість перитоніту, мг/кг сполуки тварин у групі викликаного (всередину) каррагеніном, у % від контролю 25,0 10 3,9 50,0 10 21,6* Сполука формули 2 100,0 10 45,1* 200,0 10 84,3* 25,0 10 80,4* Вольтарен 50,0 10 90,2* 100,0 10 100,0* 50,0 10 25,5* Аміногуанідін 100,0 10 70,6* 200,0 10 84,3* Протизапальна активність на моделі перитоніту, викликаного ЛПС, у % від контролю 2,2 46,7* 88,9* 100,0* 82,2* 95,6* 100,0* 51,1* 73,3* 91,1* *- р< 0,05 при порівнянні з контролем 5 10 15 Перитоніт у щурів, викликаний ЛПС. Антиексудативну дію вивчали на щурах-самцях масою 170,0-180,0 г при перитоніті, викликаному внутрішньоочеревним введенням ліпополісахариду (ЛПС), виділеного з Escherichia coli (Sigma) - 1,0 мг/кг. Метод виконано згідно з [6]: через 4 години тварин умертвляли (інгаляцією CO2), розкривали черевну порожнину і вимірювали об'єм ексудату в мл. Досліджувані сполуки і препарати порівняння вводили всередину (per os) за годину до ЛПС, контролем в дослідженні були щури, які отримували по 0,3 мл фізіологічного розчину всередину до введення ЛПС. Кожна досліджувана група складалася з 7 тварин. Результати експериментів обробляли методами варіаційної статистики для біологічних досліджень (визначення середньої арифметичної, стандартної помилки, при зіставленні середніх використовували критерій t Стьюдента). Результати дослідження. Оцінка протизапальної активності сполуки 2, в порівнянні з вольтареном і аміногуанідіном представлена в таблиці 3. 4 UA 106122 C2 Таблиця 3 Протизапальна активність сполуки формули 2 на моделі перитоніту у щурів. Досліджувані сполуки Сполука формули 2 Вольтарен Аміногуанідін Доза, в мг/кг (всередину) 10,0 25,0 50,0 75,0 100,0 10,0 25,0 50,0 75,0 25,0 50,0 75,0 100,0 200,0 Протизапальна активність Кількість тварин у на моделі перитоніту, групі викликаного ЛПС, у % від контролю 7 2,0 7 26,0* 7 58,0* 7 78,0* 7 100,0* 7 22,0 7 65,0* 7 84,0* 7 100,0* 7 4,0 7 22,0* 7 58,0* 7 78,0* 7 100,0* ЕД50, в мг/кг. 48,0±4,5 20,0±1,5 70,0±2,5 *- р< 0,05 при порівнянні з контролем 5 10 15 20 25 30 35 Вивчено протизапальну активність сполуки формули 2. Як видно з результатів, наведених у таблицях 2 і 3, обговорюваний тут потенційний лікарський препарат формули 2 на використаних фармакологічних моделях дещо поступається вольтарену, але перевершує аміногуанідін. Сполука 2 має протизапальну дію. Для більшості нестероїдних протизапальних препаратів характерна побічна дія, що часто зустрічається, - пошкодження слизової оболонки шлунка і прояв ульцерогенної дії. У цьому зв'язку вивчення дії, що створює виразку, у потенційних нестероїдних протизапальних препаратів дає можливість, з одного боку, виявити наявність і вираженість ульцерогенного ефекту, а з іншого - побічно судити про вплив досліджуваної речовини на біосинтез простагландинів. Методи дослідження. Дослідження дії сполуки 2, що створює виразку, виконано відповідно до Методичних рекомендацій з експериментального (доклінічного) вивчення нових нестероїдних протизапальних препаратів [4] за наступною схемою: 1. Дослідження дратівної дії сполук на шлунок у мишей в дозі, що у 5 разів вище фармакологічної, при одноразовому введенні. 2. Дослідження дії сполук, що створює виразку, у дозі, рівній фармакологічній, при хронічному введенні протягом 7 днів. 3. Посилення дії досліджуваних сполук, що створює виразку, у поєднанні з 0,6 H соляною кислотою. 4. Посилення дії досліджуваних сполук, що створює виразку, у поєднанні з відомими нестероїдними протизапальними засобами (індометацином). 1. Дослідження дратівної дії сполуки 2. Мишей-самців масою 23-24 г позбавляли їжі протягом 24 годин, доступ до води не обмежували. Кількість мишей у групі - 10. Досліджувану сполуку 2 в дозі 500 мг/кг вводили зондом у шлунок, через 6 годин тварин забивали, витягували шлунки і підраховували кількість виразок, а також розраховували ульцерогенний індекс в балах. Оцінку ульцерогенного ефекту проводять за 4-бальною шкалою: 0 - відсутність пошкоджень, 0,5 - гіперемія, 1 - одиничні незначні пошкодження (1 або 2 точкових крововиливів), 2 - множинні пошкодження (ерозії, точкові крововиливи), 3 - значні і множинні пошкодження слизової (ерозії, крововиливи), 4 - грубі ушкодження, охоплюють усю поверхню слизової (масивні крововиливи, ерозії, перфорації). 2. Дослідження дратівної дії сполуки 2. 5 UA 106122 C2 5 10 15 20 Мишам-самцям масою 23-24 г протягом 7 днів вводили сполуку 2 в дозі 200,0 мг/кг всередину. На 7 день тварин умертвляли інгаляцією СO2, витягували шлунки і підраховували кількість виразок. Як препарати порівняння застосовували всередину: індометацин в дозі 20 мг/кг, вольтарен - 50 мг/кг і аміногуанідін - 200 мг/кг. Кожна досліджувана група складалася з 10 тварин. 3. Посилення дії досліджуваних сполук, що створюють виразку, в поєднанні з 0,6 H соляною кислотою. Мишей-самців масою 23-24 г позбавляли їжі протягом 24 годин, доступ до води не обмежували. Сполуку 2 в дозі 100 мг/кг вводили зондом у шлунок за 1 годину до введення 0,6 H соляної кислоти (5 мл/кг), через 4 години тварин забивали, витягували шлунки і підраховували кількість виразок. Як препарати порівняння застосовували всередину: індометацин в дозі 20 мг/кг, вольтарен 50 мг/кг і аміногуанідін - 200 мг/кг. Кожна досліджувана група складалася з 10 тварин. 4. Посилення дії сполуки 2, що створює виразку, відомими нестероїдними протизапальними засобами [1,4]. Мишей-самців масою 23-24 г позбавляли їжі протягом 24 годин, доступ до води не обмежували. Сполуку 2 в дозі 100 мг/кг вводили зондом у шлунок за 1 годину до введення індометацину (20 мг/кг), через 5 годин тварин забивали, витягували шлунки і підраховували кількість виразок. Як препарати порівняння застосовували вольтарен у дозі 50 мг/кг, і аміногуанідін у дозі 200 мг/кг; всі препарати вводили тваринам всередину. Кожна досліджувана група складалася з 10 тварин. Отримані результати. Результати, що їх отримано в ході досліджень, і оцінка ульцерогенної дії сполуки формули 2 в порівнянні з вольтареном, індометацином та аміногуанідіном, представлені в таблиці 4. 25 Таблиця 4 Дія досліджуваних препаратів, що створюють виразку, при різних схемах виразкоутворення Середній Середній Середній ульцерогенний ульцерогенний ульцерогенний індекс у індекс у балах при індекс у балах при балах при хронічному Досліджувані поєднаному введенні введенні в дозі, що сполуки застосуванні досліджуваних використовується для досліджуваних сполук однократно фармакологічних препаратів з в дозі 500,0 мг/кг досліджень індометацином 2 Аміногуанідін Вольтарен Індометацин Контроль Середній ульцерогенний індекс у балах при поєднаному застосуванні досліджуваних препаратів із соляною кислотою 0 0 0 2,2 0,19 0,15 0,15 0,35 1,15 2,5 2,0 0,55 2,4 0,2 *- р< 0,05 при порівнянні з контролем 30 35 Як видно з отриманих результатів, сполука формули 2 не має дратівної дії на слизову оболонку шлунка як при одноразовому введенні всередину в дозі 500,0 мг/ кг, так і при хронічному введенні в дозі 200,0 мг/кг всередину; також сполука формули 2 не посилює виразкоутворення при поєднаному його застосуванні з 0,6 H соляною кислотою або індометацином у дозі 20 мг/кг. Препарати порівняння вольтарен та індометацин виявили ульцерогенні ефекти, характерні для нестероїдних протизапальних засобів. Таким чином, сполука формули 2 досліджена на наявність у неї ульцерогенної дії, і показано, що сполука 2 не чинить подразнювальної та ульцерогенної дії на низці моделей виразкоутворення, також як аміногуанідін, і на відміну від вольтарена і індометацину. Приклад 4 Вивчення хондропротекторної активності 6 UA 106122 C2 5 10 15 20 25 30 35 40 45 Сполука формули 2 була вивчена також на моделі хронічного (ад'ювантний артрит) артриту у щурів лінії Вістар. Встановлено, що досліджувана сполука перешкоджала генералізації запального процесу, зменшуючи лейкоцитоз, рівень фактора некрозу пухлин - TNF в плазмі крові та вираженість прояву реакції гіперчутливості уповільненого типу (за даними рентгенологічного дослідження дрібних п'ястнофалангових і дистальних міжфалангових суглобів задньої ураженої кінцівки). Сполука в дозі 50 мг/кг знижувала рівень TNF, за своєю ефективністю була порівнянною з препаратом порівняння - індометацином. Сполука формули 2 в дозуванні 50 мг/кг найбільш ефективно перешкоджала утворенню склерозу суглобових поверхонь і звуження міжфалангових суглобів задньої стопи, перевершуючи за ефективністю препарат порівняння. Зниження товщини хряща в групах із застосуванням різних концентрацій нової сполуки у порівнянні з групою інтактних щурів було достовірним, хондропротекторний вплив сполука формули 2 виявила в дозі 50 мг/кг. На підставі вищенаведених експериментальних досліджень було зроблено висновок, що нова сполука має при внутрішньошлунковому введенні (аналог перорального) системну протизапальну дію (зменшує лейкоцитоз і вироблення протизапального цитокіну TNF). Досліджуваний препарат в дозах 50 і 75 мг/кг зменшував вираженість набряку задньої кінцівки, а в дозі 50 мг/кг частково перешкоджав розвитку дистрофії міжсуглобного хряща скакального суглоба. У цій же дозі препарат виявляв найбільш виражену (що перевищує індометацин) хондропротектівну дію стосовно міжфалангових суглобів ураженої кінцівки (рентгенологічні дані). При внутрішньошлунковому введенні (аналог перорального) препарат виявляв системну протизапальну дію (зниження набряку, лейкоцитозу, рівня TNF, хондропротектівну дію), що можна пов'язати з купіруванням розвитку реакції гіперчутливості уповільненого типу. Оцінка інших видів фармакологічної активності сполуки 2 показала, що вона має протиалергічну, антигіпоксичну і анальгетичну активність. Всі виявлені види фармакологічної активності сполуки 2 зберігалися при використанні його не лише у вигляді гідрохлориду, але і у вигляді інших фармацевтично прийнятних солей (наприклад Na, K, Ca, Mg), а також у вигляді комплексних сполук з прийнятними у фармацевтиці комплексонами (наприклад, з гліціррізіновою кислотою). Джерела інформації: 1. Машковский M.Д. // Лекарственные средства, изд. 13, Харьков, Торгсин, 1997. 2. Saavedra J.E., Billiar T.R., Williams D.L., et al. // J. Med. Chem. 1997, 40, 1947. 3. Граник В.Г., Григорьев Н.Б. // Оксид азота, M., Вузовская книга, 2004. 4. Шварц Г.Я., Сюбаев Р.Д. / Методические рекомендации по экспериментальному (доклиническому) изучению новых нестероидных противовоспалительных препаратов // Ведомости научного центра экспертизы и государственного контроля ЛC МЗ России, 2000, № 1, С. 44-50. 5. Cuzzocrea S., Mazzon E., Dugo L., et al. / Protective effects of n-acetylcysteine on lung injury and red blood cell modification induced by carrageenan in the rat // FASEB J., 2001, 15(7), P. 11871200. 6. Freyria A.M, Paul J., Belleville J., et al. / Rat peritoneal macrophage procoagulant and fibrinolytic activities. An expression of the local inflammatory response // Соmр. Biochem. Physiol. A. 1991, V99, N4, P.517-524. 7. Vogel H.G. // Drug Discovery and evaluation: Pharmacological assays. Springer, 2008. 8. Патент РФ RU 2167856. 9. Рябова С.Ю., Тугушева Н.З., Алексеева Л.М., Граник В.Г. // Хим. фарм. журн. 1996, т.30, №7, С. 42-46. 10. Рябова С.Ю., Расторгуева Н.А., Лисица Е.А., и др. // Известия АН, Сер. хим., 2003, №6, С. 1312-1323. 50 ФОРМУЛА ВИНАХОДУ 1. N-[3-(4-нітрофеніламіно)-індол-2-ілметилен]аміногуанідину гідрохлорид формули (2) 7 UA 106122 C2 2' 4 3 5 NH NO2 6' 6 1 7 N H 2 CH + N H 5 3' 5' NH NH Cl NH2 ,2 або його фармацевтично прийнятна сіль або комплексне похідне. 2. N-[3-(4-нітрофеніламіно)-індол-2-ілметилен]аміногуанідину гідрохлорид формули (2) за п. 1, що виявляє системну протизапальну дію. 3. N-[3-(4-нітрофеніламіно)-індол-2-ілметилен]аміногуанідину гідрохлорид формули (2) за п. 1, що виявляє хондропротекторну дію. Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
Назва патенту англійськоюНовое биологически активное соединение n-[3-(4-нитрофениламино)- индол-2-илметилен]аминогуанидина гидрохлорид с противовоспалительной активностью
Автори російськоюГраник Владимир Григорьевич, Рябова Светлана Юрьевна, Паршин Валерий Александрович, Калинкина Марина Алексеевна, Григорьев Никита Борисович, Левина Виктория Исааковна, Панишева Елена Константиновна, Зайцев Сергей Анатольевич
МПК / Мітки
МПК: A61K 31/404, C07D 209/18, A61P 19/00
Мітки: гідрохлорид, n-[3-(4-нітрофеніламіно)-індол-2-ілметилен]аміногуанідину, протизапальною, сполука, активна, біологічно, активністю
Код посилання
<a href="https://ua.patents.su/10-106122-biologichno-aktivna-spoluka-n-3-4-nitrofenilamino-indol-2-ilmetilenaminoguanidinu-gidrokhlorid-z-protizapalnoyu-aktivnistyu.html" target="_blank" rel="follow" title="База патентів України">Біологічно активна сполука n-[3-(4-нітрофеніламіно)-індол-2-ілметилен]аміногуанідину гідрохлорид з протизапальною активністю</a>