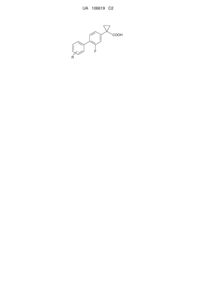
Спосіб отримання похідних 1-(2-галогенбіфеніл-4-іл)-циклопропанкарбонової кислоти
Номер патенту: 106619
Опубліковано: 25.09.2014
Автори: Ре Марко, Форнаретто Марія Джіоя, Піветті Фаусто
Формула / Реферат
1. Спосіб отримання сполуки формули (ІА)
 (ІА)
(ІА)
або її фармацевтично прийнятної солі,
де R - одна або більше груп, незалежно вибраних з атомів галогену;
в якому здійснюють наступні стадії:
(і) здійснюють взаємодію сполуки формули (IV)
 , (IV)
, (IV)
де X' вибрано з наступного: хлор, бром, йод та трифлат (CF3SO3),
з 1,2-диброметаном з утворенням сполуки формули (V)
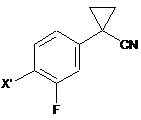 , (V)
, (V)
(іі) сполучають сполуку формули (V) зі сполукою формули (VI)
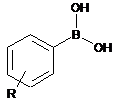 , (VI)
, (VI)
де R розкрито вище,
з утворенням сполуки формули (VII)
 , (VII)
, (VII)
ііі) сполуку формули (VII) гідролізують з отриманням сполуки формули (ІА).
2. Спосіб за п. 1, де X' - бром.
3. Спосіб за п. 1 або 2, в якому додатково здійснюють стадії виділення та кристалізації сполуки формули (ІА).
4. Спосіб за будь-яким із пп. 1-3, де стадію (іі) проводять в присутності паладієвого каталізатора, вибраного з групи, що складається з: тетракис(трифенілфосфін)паладію, паладію на активованому вугіллі, паладію на глиноземі та суміші Рd(ОСОСН3)2 і трифенілфосфіну (PPh3).
5. Спосіб за п. 4, де паладієвий каталізатор є сумішшю Pd(OCOCH3)2 та PPh3 у співвідношенні 1:2 мас./мас.
6. Спосіб за будь-яким із попередніх пунктів, в якому додатково здійснюють наступні стадії:
і) здійснюють реакцію радикального бромування сполуки формули (II)
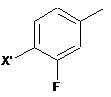 , (II)
, (II)
де X' визначено вище, з утворенням сполуки формули (III)
 , (III)
, (III)
іі) перетворюють сполуку формули (III) у відповідне похідне нітрилу формули (IV).
7. Спосіб за п. 6, де стадію бромування проводять з N-бромосукцинімідом в присутності каталітичної кількості бензоїлпероксиду, із застосуванням ацетонітрилу як розчинника.
8. Спосіб за будь-яким із попередніх пунктів, де атом галогену - хлор.
9. Спосіб за п. 7, де сполукою формули (1А) є 1-(3',4'-дихлоро-2-флуоро[1,1'-біфеніл]-4-іл)циклопропанкарбонова кислота.
10. Спосіб отримання фармацевтичної композиції, в якому здійснюють стадії (і)-(ііі) за п. 1 та додаткову стадію, за якою отримують співсуміші з одним або більше фармацевтично прийнятними наповнювачами.
Текст
Реферат: Винахід стосується способу отримання сполуки формули (ІА) COOH F R (ІА). UA 106619 C2 (12) UA 106619 C2 COOH F R UA 106619 C2 Винахід стосується способу отримання сполук формули (IA): COOH F R 5 10 15 (IA) Сполуки є корисними для попередження та/або лікування нейродегенеративних хвороб, якто хвороба Альцгеймера. Хвороба Альцгеймера − нейродегенеративний розлад, який з гістологічної з точки зору охарактеризовано розповсюдженою присутністю зовнішньоклітинних та периваскулярних старечих бляшок та внутрішньоклітинних нейрофібрилярних вузлів у мозковій паренхімі пацієнтів з хворобою Альцгеймера. Старечі бляшки переважно скомпоновано з агрегатів білку з 39-43 залишків амінокислоти, відомих як β-амілоїд (βA), та залежних від числа амінокислот, Aβ 39, Aβ40, Aβ42 та Aβ43. Повідомлено про сполуки, які можуть зменшувати створення найбільш нейротоксичної ізоформи β-амілоїду, тобто форми, які містить 42 амінокислоти (Aβ 42), внаслідок їх взаємодії з макромолекулярним/мультибілковим ферментним комплексом з активністю аспартилпротеази, відомим як γ-секретаза. У WO 2004/074232 розкрито похідні 1-(2-галогенбіфеніл-4-іл)-циклопропанкарбонової кислоти формули (I), здатної модулювати активність γ-секретази без ураження інших важливих метаболічних процесів, як-то активність ферментів циклогенази. COOH X 20 25 30 35 40 R (I) R визначено нижче, та X переважно - флуор. Ключовим проміжним етапом отримання названих сполук - реакція Сузукі між придатною фенілбороновою кислотою або її естером з 3,4-дигалоген-циклопропанкарбоновою кислотою, переважно 3-флуоро-4-галоген-циклопропанкарбоновою кислотою. У WO 2004/074232 3-флуоро-4-галоген-циклопропанкарбонову кислоту можна отримувати, починаючи з 3-флуоро-4-галоген-толуолу, який перетворюють до відповідного бензилброміду радикальним бромуванням до карбон тетрахлориду (CCl4); отриманий бромід перетворюють до 3-флуоро4-галогенфенілацетонітрилу; останній реагував з 1,2-диброметаном, що дало відповідний 3-флуоро-4-галоген-фенілциклопропаннітрил, який кінцево гідролізували до бажаної 3-флуоро-4-галоген-циклопропанкарбонової кислоти. Однак, спосіб, описаний в WO 2004/074232, має низький загальний вихід (12-14 %) та потерпає від деяких обмежень для промислового застосування. Зокрема, кінцева реакція сполучення Сузукі має недостатній вихід, та отриманий продукт важко очищати кристалізацією без втрати виходу. Для такого очищення застосовували кристалографію на силікагелі, але поступове підвищення масштабу кристалографії на силікагелі є громіздким та потребує великих об'ємів розчинників. Крім того, застосування радикального бромування для отримання похідного бензилброміду дає значну кількість біс-галогенованого побічного продукту, що є збитковим щодо виходу та залучає застосування CCl4, яке є високотоксичним, і також руйнує озон та тепличний газ. Заявлений винахід стосується способу отримання похідних 1-(2-галогенбіфеніл-4-іл)циклопропанкарбонової кислоти формули (IA), де атом галогену − флуор, який не має всіх указаних вище недоліків. Мети заявленого винаходу переважно досягали уведенням перед гідролізом реакції Сузукі на нітриловому похідному до відповідного похідного карбонової кислоти. 1 UA 106619 C2 5 Крім того, введено різні режими для покращення виходу на інших етапах, зокрема, на етапі радикального бромування. Спосіб винаходу виявився більш ефективним, зокрема, для великомасштабного виробництва, що забезпечує вищий вихід сполук формули (IA) з високою хімічною чистотою без потреби в етапі хроматографічного очищення Заявлений винахід стосується способу отримання сполуки формули (IA) COOH F R 10 15 20 25 30 (IA) де R - одна або більше груп, незалежно вибраних з наступного: - атоми галогену, переважно хлор; - CF3; - CH=CH2; - CN; - CH2OH; - NO2; - метилендіоксил; - етилендіоксил; - циклоапкіл, переважно C3-C6 циклоапкіл; - феніл; - OR1 або NHCOR1 де R1 вибрано з наступного: CF3, алкеніл, алкініл; бензил; та феніл; - SR2, SOR2 або COR2 де R2 - алкіл; та її фармацевтично прийнятних солей, названий спосіб полягає в наступних етапах згідно зі схемою 1: i) реакція сполуки формули (IV) де X" − хлор, бром, іод або трифлат (CF 3SO3), переважно бромід, з 1,2-диброметаном для утворення сполуки формули (V); ii) сполучення сполуки формули (V) зі сполукою формули (VI), де R розкрито вище, для створення сполуки формули (VII); та iii) гідролізація сполуки формули (VII) для отримання сполуки формули (I) Переважно, згідно з винаходом запропоновано спосіб отримання сполуки формули (IA), де R - хлор. Краще, згідно з винаходом запропоновано спосіб отримання 1-(3',4'-дихлоро-2-флуоро[1,1'біфеніл]-4-іл)-циклопропанкарбонової кислоти формули COOH F Cl 35 40 Cl Названа сполука також стосується коду CHF 5074. Винахід також стосується способу отримання фармацевтичної композиції, названий спосіб складається з етапів (i)–(iii) та додаткового етапу, який полягає в змішуванні одного або більше фармацевтично прийнятних наповнювачів. Термін "атоми галогену" охоплює флуор, хлор, бром, та іод. "Алкіл" означає C1-C4 алкіл із прямим або розгалуженим ланцюгом, як-то метил, етил, нпропіл, ізопропіл, н-бутил, ізобутил, сек-бутил, трет-бутил, "Алкеніл" означає C2-C6 алкеніл із прямим або розгалуженим ланцюгом, як-то вініл, 1 2 UA 106619 C2 5 10 15 пропеніл, 2-пропеніл, 1-бутеніл, ізобутеніл, або прямий, або розгалужений пентеніл та гексеніл. Термін "алкініл" створено аналогічним способом. "Циклоапкіл" означає циклічну неароматичну вуглеводневу групу, яка містить 3 − 8 атомів карбону. Приклади охоплюють циклопропіл, циклобутил, циклопентил, циклогексил та циклогептил. "Насичена гетероциклічна" означає насичену гетероциклічну групу, яка має, принаймні, 4 атоми карбону та, принаймні, один гетероатом, переважно від одного до чотирьох гетероатомів, вибраних із наступного: нітроген, оксиген та сульфур. Приклади охоплюють піперидил або тетрагідрофурил. Термін "фармацевтично прийнятні солі" стосується солей, отриманих реакцією головної сполуки в кислотній формі з неорганічною або органічною основою для створення солі, апробованої для застосування до людей, наприклад, наступного: солі натрію, калію, кальцію, магнію та амонію. Згідно із заявленим винаходом запропоновано спосіб отримання сполуки формули (IA), де R визначено вище, названий спосіб, який складається з етапів схеми 1. COOH F R 20 25 30 (IA) Коли R − циклоапкіл, його необов'язково заміщено одною або більше групами, незалежно вибраними з наступного: алкіл, CF3, OH та оксо-групи. Переважно циклоапкіл − C3-C6 циклоапкіл. Коли R − феніл, його необов'язково заміщено одною або більше групами, незалежно вибраними з наступного: атоми галогену, CF3, OCF3, OH, алкіл та насичена гетероциклічна група. Насичена гетероциклічна група переважно − моноциклічне кільце, яке має 5 або 6 атомів та один або два атоми нітрогену, або один атом нітрогену та один атом оксигену, як-то піролідин, імідазолідин та ізоксазолідин. СХЕМА 1 Будь-яку сполуку формули (IV), з X', вибраним із наступного: хлор, бромід, іод та CF 3SO3 3 UA 106619 C2 5 10 15 20 25 30 35 40 45 50 55 60 (трифлат), яка є в продажу, можна застосовувати як вихідний матеріал. Переважно, як вихідний матеріал застосовують сполуку, де X' − бромід. У першому етапі (етап i) сполука формули (IV) реагувала з 1,2-диброметаном для утворення сполуки формули (V), де X' визначено вище. Переважно етап (i) можна проводити в органічному розчиннику, як-то етанол або ацетонітрил, або їх суміші з водою. Переважно названий етап утворення циклічного пропану здійснювали як каталітичну реакцію фазового переходу в присутності концентрованого NaOH та тетрабутиламоній хлориду (TBAC) або тетрабутиламоній броміду (TBAB). Концентрація NaOH переважно могла бути в діапазоні 30 − 50 мас./об. %. Температуру на етапі (i) переважно можна підтримувати приблизно при 20 °C − 50 °C. Звичайно сполука формули (V), яка переважно є 4-бромо-3флуорофенілциклопропаннітрилом, отримували з виходом вище 80 %, переважно, з виходом, який дорівнював або був вище 90 %. Отриману сполуку перед її застосуванням у наступному етапі способу необов'язково можна очищувати кристалізацією згідно зі звичайними процедурами. У другому етапі (етап ii) сполука формули (V) реагувала з фенілбороновою кислотою формули (VI), де R − одна або більше груп, незалежно вибраних з наступного: атоми галогену, переважно хлор; CF3; CH=CH2; CN; CH2OH; NO2; метилендіоксил; етилендіоксил; циклоапкіл; феніл; OR1 або NHCOR1 де R1 вибрано з наступного: CF3, алкеніл, алкініл; бензил; феніл; SR2, SOR2 та COR2, де R2 − алкіл. Переважно реакцію, відому як реакція Сузукі або Міяура-Сузукі, здійснювали, застосовуючи 4-бромо-3-флуоро-фенілциклопропаннітрил як сполуку формули (V) та 3,4-дихлорофенілборонову кислоту як сполуку формули (VI). Названу реакцію, яка базується на паладієвому каталізаторі, також можна здійснювати, застосовуючи алкілборонові естери замість боронових кислот. Переважно можна застосовувати будь-який паладієвий каталізатор, як-то, наприклад, тетракіс(трифенілфосфін)паладій [Pd(PPh)3], паладій на активованому вугіллі, також відомий як паладій на вугіллі (Pd/C), паладій на глиноземі, або можна застосовувати як каталізатор суміш Pd(OCOCH3)2 та PPh3. Переважно етап (ii) можна здійснювати в присутності органічного розчиннику, як-то етанол, ацетон, тетрагідрофуран (ТГФ), ізопропіловий спирт, N-метилпіролідон (NMP), діоксан та їх суміші з водою. Також можна застосовувати комбінацію органічних розчинників. Переважно, коли застосовували Pd(PPh)3 або суміш Pd(OCOCH3)2 та PPh3, реакцію здійснювали в присутності N-метилпіролідону (NMP) або суміші діоксану/води 2:1. Інакше, при застосуванні Pd/C переважним розчинником є етанол. Етап (ii) переважно здійснювати в присутності 1 − 4 еквівалентів основи. Основи, які переважно можна застосовувати охоплюють Na2CO3, K2CO3, K3PO4, Cs2CO3, NaOH та KOH. Переважними основами є Na2CO3, K2CO3 або K3PO4. До реакційного середовища необов'язково можна додавати трифенілфосфін (P(Ph 3)), поліметилгідросилоксан (PMHS), тетрабутиламоній бромід (TBAB), 1,4-діазабіцикло[2.2.2]октан (DABCO), або NaI. Звичайно реакцію здійснювали при температурі 80 − 140 °C, переважно − при 110°. Переважно етап (ii) можна проводити, застосовуючи еквімолярну кількість сполуки (VI) стосовно сполуки (V) або з незначним надлишком. Звичайно сполуку формули (VI) отримували з виходом вищим 60 %, переважно − вищим 70 %, краще − вищим 80 %. Переважно сполукою формули (VI) є 3',4'-дихлоро-2-флуоро-4-ціанометил-біфеніл. Переважними умовами етапу (ii) є наступні: - розчинник: NMP; - основа: 4 еквіваленти K3PO4 у вигляді порошку; - каталізатор: 1:2 масова частка суміші Pd(OCOCH3)2 та PPh3. - температура: 110°C. У цих умовах отримано 3',4'-дихлоро-2-флуоро-4-ціанометил-біфеніл із виходом вище 90 %. Отриману сполуку перед її застосуванням у наступному етапі способу необов'язково далі очищувати кристалізацією згідно зі звичайними процедурами. У третьому етапі (етап iii) для отримання бажаної сполуки формули (IA) сполуку формули (VII) гідролізували згідно з добре відомими способами. Переважно, гідроліз проводили в суміші метанолу та води в присутності сильної основи, переважно KOH, під дефлегмацією. Звичайно сполуку формули (IA), яка переважно є 1-(3',4'-дихлоро-2-флуоро[1,1'-біфеніл]-4 4 UA 106619 C2 5 10 15 20 25 30 35 40 іл)-циклопропанкарбоновою кислотою, отримували з виходом вище 65 %. Сполуку формули (IA) можна промивати, фільтрувати та виділяти різними добре відомими способами. Названу сполуку можна далі очищувати кристалізацією згідно зі звичайними процедурами та отримувати з високою хімічною чистотою, наприклад, вище 95 %, без застосування кінцевого очищення хроматографією. Конкретно переважною є кристалізація із суміші н-гептану та ізопропілового спирту. Отриману сполуку (IA) далі можна перетворювати до відповідних фармацевтично прийнятних солей згідно з різними відомими способами. В альтернативному втіленні, коли NMP застосовано як розчинник у реакції етапу (ii), сполуку формули (IA) у формі лужної солі можна отримувати безпосереднім осадженням у лужному водному розчині без виділення проміжної сполуки (VII). Як було знайдено, можливим є те, що всі домішки на етапі (II) не містять групи, які можуть утворювати солі у водній фазі. Це дозволяє підвищити вихід усього способу. Лужну сіль можна перетворювати до вільної кислоти згідно з відомими способами. Загальний вихід звичайно дорівнював, принаймні, 30 %, переважно дорівнював або був вище 40 %, краще − вище 50 %. У конкретному аспекті спосіб винаходу далі може охоплювати етапи отримання сполуки (IV), виходячи зі сполуки (II), яка є в продажу, згідно зі схемою 2. СХЕМА 2 Для отримання сполуки (IV) сполуку формули (II) з X', вибраним із наступного: хлор, бромід, іод та CF3SO3 (трифлат), піддавали радикальному бромуванню для створення сполуки формули (III). Переважним радикальним бромуванням є реакція з N-бромосукцинімідом (NBS) у присутності каталітичної кількості бензоіл пероксиду [PhCOO) 2] та ацетонітрилу як розчиннику. Звичайно реакцію здійснювали при температурі дефлегмації розчиннику. Переважно, для мінімізації створення дибромованого продукту, названий етап здійснювали з незначним надлишком NBS, переважно, 1.05 моль-еквівалентів − 1 моль-еквівалентів сполуки (II), та у присутності 0,04 еквівалентів PhCOOO2. Звичайно, сполуку формули (III), як переважно є 3-флуоро-4-бромо-бензил бромідом, отримано з виходом вище 85 %, переважно вище 90 %. Сполуку формули (III), необов'язково потім очищену кристалізацією згідно зі звичайними процедурами, далі перетворювали до відповідного похідного нітрилу формули (IV), застосовуючи натрій ціанід або іншу придатну сіль. Переважно назване перетворення проводили в органічному розчиннику, як-то етанол або ацетонітрил, переважно - етанол, підтримуючи температуру, приблизно, при 20 °C - 60 °C, переважно, приблизно, 40 °C - 50 °C. Переважно реакцію проводили з молярним надлишком натрій ціаніду, переважно 1.2 мольеквіваленту − 1.0 моль-еквіваленту натрій ціаніду, переважно 1.05 моль-еквіваленту − 1 5 UA 106619 C2 5 10 15 20 25 30 35 40 45 50 55 60 еквіваленту сполуки (III). Звичайно сполуку формули (IV), яка переважно є 4-бромо-3-флуоро-бензилнітрилом, отримували з виходом вище 50 %. Отриману сполуку (IV) необов'язково перед піддаванням до описаних вище етапів потім можна очищувати кристалізацією згідно зі звичайними процедурами. Отже, заявлений також винахід стосується способу отримання сполуки формули (IA) з R, яке визначено вище, та її фармацевтично прийнятних солей, названий спосіб полягає в наступних етапах згідно зі схемою 2: i) радикальне бромування сполуки формули (II), де X' − хлор, бром, іод або трифлат (CF3SO3), переважно − бромід, для створення сполуки формули (III); ii) перетворення сполуки формули (III) до відповідного похідного нітрилу формули (IV); iii) реакція сполуки формули (IV) з 1,2-диброметаном для утворення сполуки формули (V); iv) сполучення сполуки формули (V) зі сполукою формули (VI), де R визначено вище, для створення сполуки формули (VII); та v) гідролізація сполуки формули (VII) для отримання сполуки формули (IA). Сполуки формули (IA), отримані способами винаходу, можна застосовувати для отримання фармацевтичних композицій для лікування та/або попередження нейродегенеративних хвороб, як-то хвороба Альцгеймера. Названі фармацевтичні композиції, переважно − для перорального застосування, містять, принаймні, одну сполуку формули (IA) у співсуміші з фармацевтично прийнятними наповнювачами та/або носіями, описаними, наприклад, в Remington's Pharmaceutical Sciences Handbook, XVII Ed., Mack Pub., N.Y., U.S.A… Винахід детально ілюстровано в наступних прикладах. Приклад 1 Отримання 4-бромо-3-флуоробензил броміду (III) Розчин 4-бромо-3-флуоротолуолу (21.5 г, 0,114 молей) в ацетонітрилі (200 мл) з'єднували з N-бромосукцинімідом, (NBS; 21.2 г, 0,119 молей). Суміш піддавали дефлегмації, з'єднували з дибензоіл пероксидом (1.4 г, 0,004 молей), піддавали дефлегмації протягом 3 год., потім охолоджували при кімнатній температурі та екстрагували водою. Водну фазу відкидали, органічну фазу промивали розсолом, сушили над натрій сульфатом та концентрували піл вакуумом, що дало олію (27.1 г, 90 % вихід). Приклад 2 Отримання 4-бромо-3-флуорофенілацетонітрилу (IV) Розчин 4-бромо-3-флуоробензил броміду (27 г, 0,1 молей) в етанолі (200 мл) з'єднували з NaCN (5.4 г, 0,11 молей) та піддавали дефлегмації протягом 3 год. Суміш концентрували піл вакуумом; отриманий залишок поєднували з водою, потім екстрагували етилацетатом. Органічну фазу промивали розсолом, сушили над натрій сульфатом та концентрували піл вакуумом, що дало темну олію (12.1 г, 56 % вихід). Приклад 3 Отримання 4-бромо-3-флуорофенілциклопропаннітрилу (V) Розчин 4-бромо-3-флуорофенілацетонітрилу (1 г, 4.6 ммолей) у толуолі (4 мл) з'єднували з 0,6 мл (7 ммолей) 1,2-диброметану, 50 % водн. розчином NaOH (4 мл) та тетрабутиламоній бромідом (0,32 г, 1 ммолей). Суміш перемішували при кімнатній температурі протягом 4 год., потім розбавляли водою та екстрагували етилацетатом. Органічну фазу відбирали та розчинник видаляли піл вакуумом, що дало a коричневу тверду речовину, яку піддавали очищенню кристалографією на силікагелі, що дало оранжево-жовтий продукт у твердій формі (1 г, вихід 90 %). Приклад 4 Отримання 1-(3',4'-дихлоро-2-флуоро[1,1'-біфеніл]-4-іл)-циклопропаннітрилу (VI) У колбі в інертній атмосфері до 4-бромо-3-флуорофенілциклопропаннітрилу (470 мг, 1 екв.) додавали 3,4-дихлорофенілборонову кислоту (374 мг, 1 екв.), Pd(OAc) 2 (44 мг, 0,1 екв.), PPh3 (105 мг, 0,2 екв.) та дрібний K3PO4 (1.6 г, 4 екв.). Додавали при кімнатній температурі 5 мл попередньо дегазованого N-метилпіролідону (NMP). 19 Реакційну суміш нагрівали при 110°C протягом 2 год. для завершення (контрольовано F NMR), потім розбавляли етилацетатом, та промивали водою. Органічну фазу відокремлювали та розчинник випаровували, що дало рожево-фіолетовий порошок (700 мг). До твердої речовини додавали суміш води:ацетону 1:1 об'ємна частка (40 мл), потім для отримання розчину суспензію нагрівали під дефлегматором при перемішуванні. Після випаровування ацетону отримували блідий фіолетовий продукт (560 мг, вихід 95 %). 6 UA 106619 C2 5 10 15 Приклад 5 Отримання 1-(3',4'-дихлоро-2-флуоро[1,1'-біфеніл]-4-іл)-циклопропан карбонової кислоти (IA) 1-(3',4'-Дихлоро-2-флуоро[1,1'-біфеніл]-4-іл)-циклопропаннітрил (14.3 г, 0,047 мол) розчиняли в суміші метанолу (143 мл) та води (71.5 мл), поміркованими порціями додавали калій гідроксид (35.1 г, 0,563 мол), та суміш піддавали дефлегмації протягом 48 год. Реакційну суміш охолоджували та заливали в розчин водного гідрогенхлориду 36 % (57 мл) у воді (57 мл) при 20-25°C. Суспензію перемішували та фільтрували; тверду речовину повторно промивали водою та сушили при 40°C піл вакуумом. Сирий продукт розчиняли при дефлегмації в 2-пропанолі (178 мл), розчин з'єднували з активованим вугіллям (0,3 г), перемішували при дефлегмації та фільтрували, концентрували та з'єднували з н-гептаном (116 мл). Гарячий розчин охолоджували до 0-5°C та кристалізовану тверду речовину фільтрували, промивали 2пропанолом та сушили при 40°C піл вакуумом. Сполуку 1-(3',4'-дихлоро-2-флуоро[1,1'-біфеніл]-4-іл)-циклопропанкарбонову кислоту отримували як білий порошок (10,3 г, 68 % вихід). ВЕРХ-УФ чистота (255 нм): 99.8 % 1 H ЯМР (ДМСО-d6, 300 МГц): 12.51 (bs, 1H); 7.78 (m, 2H); 7.54 (m, 2H); 7.30 (m, 2H); 1.48 (m, 2H); 1.22 (m, 2H). МС (ESI , 40 В): 323 (M ); 279. Інтервал плавлення: 199-200°C. 20 ФОРМУЛА ВИНАХОДУ 1. Спосіб отримання сполуки формули (ІА) COOH F 25 R (ІА) або її фармацевтично прийнятної солі, де R - одна або більше груп, незалежно вибраних з атомів галогену; в якому здійснюють наступні стадії: (і) здійснюють взаємодію сполуки формули (IV) CN X' F 30 , (IV) де X' вибрано з наступного: хлор, бром, йод та трифлат (CF3SO3), з 1,2-диброметаном з утворенням сполуки формули (V) CN X' F , (V) (іі) сполучають сполуку формули (V) зі сполукою формули (VI) OH B R OH , (VI) 7 UA 106619 C2 де R розкрито вище, з утворенням сполуки формули (VII) CN F R 5 10 15 , (VII) ііі) сполуку формули (VII) гідролізують з отриманням сполуки формули (ІА). 2. Спосіб за п. 1, де X' - бром. 3. Спосіб за п. 1 або 2, в якому додатково здійснюють стадії виділення та кристалізації сполуки формули (ІА). 4. Спосіб за будь-яким із пп. 1-3, де стадію (іі) проводять в присутності паладієвого каталізатора, вибраного з групи, що складається з: тетракис(трифенілфосфін)паладію, паладію на активованому вугіллі, паладію на глиноземі та суміші Рd(ОСОСН3)2 і трифенілфосфіну (PPh3). 5. Спосіб за п. 4, де паладієвий каталізатор є сумішшю Pd(OCOCH3)2 та PPh3 у співвідношенні 1:2 мас./мас. 6. Спосіб за будь-яким із попередніх пунктів, в якому додатково здійснюють наступні стадії: і) здійснюють реакцію радикального бромування сполуки формули (II) X' F , (II) де X' визначено вище, з утворенням сполуки формули (III) Br X' F 20 25 , (III) іі) перетворюють сполуку формули (III) у відповідне похідне нітрилу формули (IV). 7. Спосіб за п. 6, де стадію бромування проводять з N-бромосукцинімідом в присутності каталітичної кількості бензоїлпероксиду, із застосуванням ацетонітрилу як розчинника. 8. Спосіб за будь-яким із попередніх пунктів, де атом галогену - хлор. 9. Спосіб за п. 7, де сполукою формули (1А) є 1-(3',4'-дихлоро-2-флуоро[1,1'-біфеніл]-4іл)циклопропанкарбонова кислота. 10. Спосіб отримання фармацевтичної композиції, в якому здійснюють стадії (і)-(ііі) за п. 1 та додаткову стадію, за якою отримують співсуміші з одним або більше фармацевтично прийнятними наповнювачами. Комп’ютерна верстка Л. Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of derivatives of 1-(2-halobiphenyl-4-yl)-cyclopropanecarboxylic acid
Автори англійськоюPivetti, Fausto, Fornaretto, Maria Gioia, Re, Marco
Автори російськоюПиветти Фаусто, Форнаретто Мария Джиоя, Ре Марко
МПК / Мітки
МПК: C07C 255/35, C07C 253/30, C07C 51/09, C07C 253/14, C07C 61/00, C07C 255/46
Мітки: спосіб, 1-(2-галогенбіфеніл-4-іл)-циклопропанкарбонової, отримання, кислоти, похідних
Код посилання
<a href="https://ua.patents.su/10-106619-sposib-otrimannya-pokhidnikh-1-2-galogenbifenil-4-il-ciklopropankarbonovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання похідних 1-(2-галогенбіфеніл-4-іл)-циклопропанкарбонової кислоти</a>
Попередній патент: Застосування інгібіторів сукцинатдегідрогенази для контролю підвиду sclerotinia
Наступний патент: Панелі з цеглою та спосіб їх збирання
Випадковий патент: Пристрій для сочетаної вакуум-лазерної терапії