Спосіб синтезу діарилпіримідинового ненуклеозидного інгібітора зворотної транскриптази
Номер патенту: 106972
Опубліковано: 10.11.2014
Автори: Мехта Саміт Сатіш, уржар Мукунд Кешав, Майкап Голакчандра Сударшан, Пардеші Девісінґ Рамешсінґ, Кембл Мангеш Ґоракханат, Джоші Шашікант Ґангарам
Формула / Реферат
1. Спосіб отримання етравірину, при якому проводять стадії:
a) конденсації 2,4,6-трихлорпіримідину з 3,5-диметил-4-гідроксибензонітрилом з отриманням сполуки формули (V)
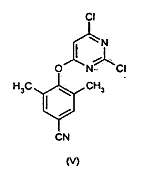 ;
;
b) перетворення сполуки формули (V) на сполуку формули (VI)
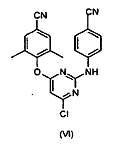
конденсацією з 4-амінобензонітрилом;
c) необов'язково, очищення сполуки формули (VI);
d) амонолізу сполуки формули (VI) з утворенням сполуки формули (IV)
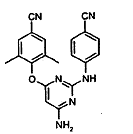 (IV); і
(IV); і
e) галогенування сполуки формули (IV) з утворенням етравірину.
2. Спосіб отримання етравірину за п. 1, який відрізняється тим, що стадію (а) здійснюють у присутності інертного розчинника і основи.
3. Спосіб отримання етравірину за п. 2, який відрізняється тим, що інертним розчинником є 1,4-діоксан, і як основу використовують N,N-діізопропілетиламін.
4. Спосіб отримання етравірину за п. 1, який відрізняється тим, що стадію (b) здійснюють з використанням алкоксиду як основи.
5. Спосіб отримання етравірину за п. 4, який відрізняється тим, що основа є третинним бутоксидом калію.
6. Спосіб отримання етравірину за п. 1, який відрізняється тим, що стадію (b) здійснюють з використанням інертного розчинника, вибраного з етанолу, 1-метил-2-піролідону, N,N-диметилформаміду, 1,4-діоксану, тетрагідрофурану, диметилсульфоксиду, тетраліну, сульфолану і ацетонітрилу.
7. Спосіб отримання етравірину за п. 6, який відрізняється тим, що як інертний розчинник використовують 1-метил-2-піролідон.
8. Спосіб отримання етравірину за п. 1, який відрізняється тим, що стадію (с) здійснюють з використанням промивання етилацетатом.
9. Спосіб отримання етравірину за п. 1, який відрізняється тим, що стадію (d) здійснюють з використанням водного розчину аміаку в 1,4-діоксані при температурі 120-130 °C.
10. Спосіб отримання етравірину за п. 1, який відрізняється тим, що стадію (e) здійснюють з використанням вільного галогену.
Текст
Реферат: Винахід стосується простого і рентабельного способу синтезу діарилпіримідинового ненуклеозидного інгібітора зворотної транскриптази, такого як етравірин. Типово етравірин синтезують з використанням 2,4,6-трихлорпіримідину і 3,5-диметил-4-гідроксибензонітрилу. Крім того, розкриваються прості способи конденсації 4-амінобензонітрилу зі сполукою формули (V), тобто 4-[(2,6-дихлор)-4-піримідинілокси]-3,5-диметилбензонітрилом. UA 106972 C2 (12) UA 106972 C2 UA 106972 C2 5 10 15 20 Область техніки, до якої відноситься винахід Даний винахід відноситься до способу синтезу ненуклеозидного інгібітора зворотної транскриптази. Зокрема, даний винахід відноситься до способу синтезу диарилпіримідинового ненуклеозидного інгібітора зворотної транскриптази, такого як етравірин. Рівень техніки Ненуклеозидні інгібітори зворотної транскриптази (NNRTI) є ключовим компонентом високоактивної антиретровірусної терапії (HAART) через їх здатність націлювати алостеричну зв'язуючу «кишеню» на фермент зворотну транскриптазу, що призводить до розвитку широкого спектру активності проти мутацій HIV RT. HAART стала стандартом лікування у разі зараження вірусом імунодефіциту людини (ВІЛ) з 1996 і призвела до істотного зростання виживання. Диарилпіримідини є другим поколінням NNRTI і придатні для лікування ВІЛ-інфікованих пацієнтів із вірусами, стійкими до NNRTI. Етравірин (I), раніше ТМС 125 і хімічно відомий як 4[[6-аміно-5-бром-2-[(4-ціанофеніл)аміно]-4-піримідиніл]окси]-3,5-диметилбензонітрил, є NNRTI, схвалений в 2008 для застосування у поєднанні з іншими антиретровірусними засобами для дорослих пацієнтів, які піддавалися лікуванню, з ВІЛ-інфекціями з множинною лікарською стійкістю. Етравірин продається у всьому світі у вигляді пероральних пігулок і уперше розкритий De Corte et al. у US 7037917. Етравірин (I) De Corte et al. у US 7037917 пропонують спосіб отримання диарилпіримідинових похідних, згідно з яким сполуку формули (II) гріють з аміаком у присутності інертного розчинника, такого як 1,4-діоксан, в автоклаві при 150 °C протягом 4 діб. (І) 25 30 (ІІ) X - галоген Davis et al. у Drug of the Future, 2005, 30(5) : 462-468, розкривають, що проміжну сполуку (II) можна отримати двома різними способами. Перший спосіб показує, що 5-бром-2,4,6трихлорпіримідин вводять у взаємодію з 4-амінобензонітрилом за допомогою диізопропілетиламіну в киплячому діоксані з утворенням диаріламіну, який потім вводять у взаємодію з 4-гідрокси-3,5-диметилбензонітрилом, і отримують проміжну сполуку формули(схема - 1). Схема 1 1 UA 106972 C2 (ІІ) 5 Другий спосіб синтезу сполуки формули (II) показує, що 4-гуанідинобензонітрил циклізують з діетилмалонатом за допомогою етоксиду натрію, і отримують 4-(4,6-дигідроксипіримідин-2іламіно)бензонітрил, який після обробки РОСl3 дає відповідну дихлорпохідну. Подальше бромування бромом у присутності бікарбонату натрію у водному метанолі дає 4-(4-бром-4,6дихлорпіримідин-2-іламіно)бензонітрил, який після конденсації з натрієвою сіллю ціано-2,6диметилфеноляту у присутності N-метилпіролідону та діоксану дає проміжну сполуку формули (II) (схема - 2). Схема 2 10 (ІІ) 15 Проте вищезгадана процедура синтезу диарилпіримідинових NNRTI страждає від недоліку, яким є дуже повільна конверсія сполуки формули II в кінцеву сполуку. Взаємодія сполуки формули (ІІ) з аміаком навіть в киплячому діоксані вимагає чотири доби для завершення, і отриманий вихід не є дуже задовільним. Нещодавно De Kock et al. у US 2008/0194602 повідомили, що похідні диарилпіримідиноксиду мають інгібувальні властивості на реплікацію ВІЛ. Похідні диарилпіримідиноксиду отримують з відповідних похідних диарилпіримідину формули III за допомогою N-окислення третинного азоту піримідинового циклу. 20 2 UA 106972 C2 (ІІІ) Є різні способи, описані для синтезу похідних диарилпіримідину формули III, які наведені на схемі - 3. Схема 3 5 10 15 20 25 30 35 Halogenation - Галогенування Одним з найбільш прийнятних способів, описаних для синтезу похідних диарилпіримідину формули III, є галогенування сполуки формули (IV). Також повідомляється, що сполуку (IV) отримують з 4-амінобензонітрилу і ціанаміду. Таку взаємодію проводять у воді у присутності сильної кислоти, і отримують 4-ціанофенілгуанідин, який потім вводять у взаємодію з алкілмалоновим ефіром у присутності сильної основи і при підвищеній температурі. Потім отриманий 4,6-дигідроксипіримідин обробляють галогенуючим агентом. Потім похідну піримідину вводять у взаємодію з 4-заміщеним бензонітрилом і потім додатково з аміаком, і отримують проміжні сполуки формули (IV). Хоча спосіб, розкритий в даному випадку, відноситься до синтезу N-оксидних похідних, а не конкретно етравірину, цей спосіб можна використати для синтезу етравірину. Проте вказаний спосіб також страждає від такого обмеження, як використання в ньому ціанаміду, який є високотоксичною сполукою. Таким чином, з описаного вище очевидно, що хоча NNRTI, такі як етравірин, є головною опорою терапії для лікування ВІЛ-інфекцій, проте не повідомляється про способи, які є безпечними, економічними і задовільними для комерційного синтезу таких NNRTI. Отже, існує потреба у розробці альтернативного рентабельного і безпечного способу синтезу диарилпіримідинових NNRTI. Цілі винаходу Метою даного винаходу є простий рентабельний і ефективний спосіб синтезу диарилпіримідинових NNRTI. Іншою метою даного винаходу є простий рентабельний і ефективний спосіб синтезу етравірину. Ще однією метою даного винаходу є спосіб синтезу етравірину з використанням сполуки формули (V), тобто, 4-[(2,6-дихлор)-4-піримідинілокси]-3,5-диметилбензонітрилу. Ще однією метою даного винаходу є спосіб синтезу сполуки формули (VI) 4-[[6-хлор-2-[(4ціанофеніл)аміно]-4-піримідиніл]окси]-3,5-диметилбензонітрилу зі сполуки формули (V), тобто, 4-[(2,6-дихлор)-4-піримідинілокси]-3,5-диметилбензонітрилу. Розкриття винаходу У своїх зусиллях розробити простий рентабельний спосіб синтезу етравірину автори даного винаходу виявили, що диарилпіримідинові NNRTI можна отримати з використанням недорогого 3 UA 106972 C2 5 10 15 20 25 початкового матеріалу, такого як 2,4,6-трихлорпіримідин, і похідної гідроксибензонітрилу. Потім отриману похідну піримідину обробляють відповідними похідними амінобензонітрилу, і отримують проміжні диарилпіримідини, які можна легко перетворити на диарилпіримідинові NNRTI, які мають активність проти ВІЛ. Автори даного винаходу розробили простий і комерційно практично здійсненний спосіб синтезу етравірину. Типовий спосіб синтезу етравірину включає стадії 1) конденсації 2,4,6-трихлорпіримідину з 3,5-диметил-4-гідроксибензонітрилом з отриманням сполуки формули (V); 2) перетворення сполуки формули (V) на сполуку формули (VI) конденсацією з 4амінобензонітрилом; 3) амонолізу сполуки формули (VI) з утворенням сполуки формули (IV); і 4) галогенування сполуки формули (IV) з утворенням етравірину. Даний винахід також відноситься до нового, простого і ефективного способу конверсії сполуки формули (V) в сполуку формули (VI). Типово, вказаний спосіб включає конденсацію сполуки формули (V) з 4-амінобензонітрилом у відповідному розчиннику з утворенням сполуки формули (VI). Таким чином, даний винахід відноситься до відповідного великомасштабного виробництва простого, економічного і ефективного способу синтезу диарилпіримідинових NNRTI. У іншому аспекті даний винахід відноситься до практично здійсненного комерційно способу синтезу етравірину. У ще одному аспекті даний винахід відноситься до простого способу конверсії сполуки формули (V) в сполуку формули (VI). Здійснення винаходу Даний винахід відноситься до простого, економічного і практично здійсненного комерційно способу отримання диарилпіримідинових NNRTI. Зокрема, даний винахід відноситься до нового способу синтезу етравірину. Типово, даний винахід відноситься до способу синтезу етравірину з використанням сполуки формули (V), тобто, 4-[(2,6-дихлор)-4-піримідинілокси]-3,5диметилбензонітрилу, і 4-амінобензонітрилу, як показано на схемі - 4. Схема 4 30 Base - Основа, aq. ammonia - водн. аміак, Halogenation – Галогенування. У вищезгаданій процедурі 2,4,6-трихлорпіримідин вводять у взаємодію з 3,5-диметил-4гідроксибензонітрилом, з утворенням сполуки формули (V), в інертному розчиннику, такому як 4 UA 106972 C2 5 10 15 20 25 30 35 40 45 50 55 60 етанол, N-метил-2-піролідон, N,N-диметилформамід, 1,4-діоксан, тетрагідрофуран, диметилсульфоксид, тетралін, сульфолан, ацетонітрил, тощо. Взаємодію переважно здійснюють при температурах утворення флегми і, необов'язково, у присутності основи. Переважно як розчинник використовують 1,4-діоксан і в якості основи N,N-диізопропілетиламін. Потім отриману сполуку формули (V) конденсують з 4-амінобензонітрилом з утворенням сполуки формули (VI). Конденсація сполуки формули (V) з 4-амінобензонітрилом є найкритичнішою стадією за даним винаходом. Автори даного винаходу знайшли, що кисле середовище типово несприятливе для такої взаємодії. Коли вказану реакцію конденсації здійснюють у присутності кислотного каталізатора, такого як 1 N НСl, і в інертному розчиннику, такому як диметилформамід або N-метилпіролідон, реакція не протікає так гладко, як бажано для отримання потрібних продуктів. Навіть у присутності неорганічних основ, таких як гідроксид натрію, гідроксид калію, карбонат натрію, карбонат калію, реакції не вдаються. Присутність органічних основ, таких як диетиламін, піридин, дибутилсечовина, також не призводить до ініціації реакції конденсації. Проте автори даного винаходу несподівано виявили, що реакцію конденсації сполуки формули (V) з 4-амінобензонітрилом з утворенням сполуки формули (VI) можна здійснити у присутності алкоксидів, таких як третинний бутоксид калію, третинний бутоксид натрію. Вказану реакцію можна здійснити у присутності інертного розчинника з використанням алкоксиду в якості основи. Переважно, як розчинник використовують N-метилпіролідон, і в якості основи використовують третинний бутоксид калію. Третинний бутоксид калію можна використати для вказаної реакції в кількості до чотирьох молярних еквівалентів. Переважно, для проведення вказаної реакції конденсації використовують два молярні еквіваленти. Взаємодія отриманої таким чином сполуки формули (VI) з водним аміаком в киплячому діоксані дає сполуку формули (IV). Несподівано виявилося, що через відсутність замісника брому в піримідиновому циклі в положенні 5 вказана взаємодія проходить до завершення за 1012 годин замість 96 годин, як вказано у способі відомого рівня техніки. Переважно для взаємодії використовують 25% водний розчин аміаку. Хоча реакцію здійснюють з використанням діоксану в якості розчинника і температури 120-130 °C, проте для такої взаємодії можна використати інші інертні розчинники, вказані в цьому описі раніше. Крім того, автори даного винаходу виявили, що сполуку формули (VI) можна очистити промиванням етилацетатом. Більшість небажаних домішок і ізомерів видаляються промиванням розчину етилацетатом. Типово обробку промиванням етилацетатом проводять при 60-70 °C з подальшою фільтрацією при кімнатній температурі, і отримують потрібний продукт в чистій формі. Потім отриману сполуку (IV) можна легко перетворити на потрібний продукт етравірин галогенуванням його вільним галогеном, наприклад, вільним бромом, або використовуючи сполуки донори галогену. Реакцію галогенування переважно проводять у відповідному інертному розчиннику. Переважними розчинниками є метиленхлорид або ефір. Таким чином, даний винахід відноситься до ефективного, простого і рентабельного способу синтезу етравірину. Спосіб типово включає стадії: 1) конденсації 2,4,6-трихлорпіримідину з 3,5-диметил-4-гідроксибензонітрилом у присутності основи в інертному розчиннику з отриманням сполуки формули (V); 2) перетворення сполуки формули (V) на сполуку формули (VI) конденсацією з 4амінобензонітрилом з використанням алкоксиду в якості основи; 3) необов'язково, очищення сполуки формули (VI); 4) амонолізу сполуки формули (VI) з утворенням сполуки формули (IV); і 5) галогенування сполуки формули (IV) в інертному розчиннику з утворенням етравірину. Таким чином, даний винахід також відноситься до способу отримання етравірину з використанням сполуки формули (V) і 4-амінобензонітрилу. Даний винахід також відноситься до простого способу конденсації сполуки формули (V) з 4амінобензонітрилом. Принципи, переважні втілення і типи операцій за даним винаходом описані в описі далі. Проте не слід мати на увазі, що винахід, який передбачається для охорони, обмежується певними розкритими формами, оскільки їх слід розглядати як ілюстративні, а не обмежувальні. Варіації і зміни можуть бути здійснені фахівцями в цій області техніки без відходу від суті винаходу. Винахід пояснюється далі за допомогою подальших пояснювальних прикладів, проте вказані приклади жодним чином не повинні розглядатися як винаходи, що обмежують обсяг. Приклади Приклад 1 5 UA 106972 C2 5 10 15 20 25 30 35 40 Синтез 4-[(2,6-дихлор)-4-піримідинілокси]-3,5-диметилбензонітрилу (сполука -V) 2,4,6-Трихлорпіримідин (100 г, 0,545 моль) розчиняють в 1,4-диоксані (300 мл), і при перемішуванні додають 3,5-диметил-4-гідроксибензонітрил (80,1 г, 0,545 моль). Додавання до отриманого розчину N,N-диізопропілетиламіну (141,00 г, 1,09 моль) здійснюють впродовж 30 хвилин. Реакційну масу гріють при 70 °C і перемішують впродовж 2,0 годин. Реакційну масу поступово охолоджують до 15 °C, і отриманий продукт фільтрують при 12-15 °C з подальшим промиванням залишку на фільтрі 50 мл 1,4-діоксану. Нарешті, залишок на фільтрі промивають водою (200 мл), і отримують потрібний продукт. Температура плавлення 208-210 °C. Вихід 128 г, вихід в % = 80%. Приклад 2 Синтез 4-[[6-хлор-2-[(4-ціанофеніл)аміно]-4-піримідиніл]окси]-3,5-диметилбензонітрилу (сполука - VI) Сполуку - V (100 г, 0,34 моль) розчиняють в N-метилпіролідоні (500 мл), і при перемішуванні додають 4-амінобензонітрил (40,12 г, 0,34 моль). Реакційну масу охолоджують до 0 °C. Додавання до отриманого розчину трет-бутоксиду калію (76,3 г, 0,68 моль) здійснюють порціями впродовж 1,0 години при 0-10 °C. Реакційну масу поступово, впродовж 1-2 годин, приводять до кімнатної температури. Потім реакційну масу поступово додають в холодну воду (2,0 л), підтримуючи температуру реакційної маси нижче 20 °C. Реакційну масу фільтрують, і залишок на фільтрі промивають 200 мл води. Вологий залишок на фільтрі знову розводять в 1,0 л води при температурі нижче 20 °C і фільтрують. Отриманий продукт очищують з використанням етилацетату (2x300 мл) при 60-70 °C з подальшою фільтрацією при 10-15 °C. Вихід 50 г. Приклад 3 Синтез 4-[[6-аміно-2-[(4-ціанофеніл)аміно]-4-піримідиніл]окси]-3,5-диметилбензонітрилу (сполука - IV) До розчину сполуки - VI (100 г, 0,266 моль) в 1,4-диоксані (100 мл) додають водний аміак (600 мл), і реакційну масу нагрівають в автоклаві до 120 °C і витримують при 120-125 °C впродовж 10-12 годин. Реакційну масу охолоджують до 50 °C і знову нагрівають до 70-80 °C, при яких поступово додають воду (200 мл). Реакційну масу поступово охолоджують до 10 °C і фільтрують, і отримують вологий залишок на фільтрі, який сушать, і отримують потрібний продукт. Вихід 75 г, вихід в % = 80%. Приклад 4 Синтез етравірину Сполуку - IV (100 г, 0,28 моль) розчиняють в метиленхлориді (800 мл) і охолоджують до температури 0-5 °C. При 0-5 °C поступово додають рідкий бром (47,2 г, 0,294 моль), розчинений в 200 мл метиленхлориду. Реакційну масу перемішують при 0-5 °C впродовж 4 годин. До реакційної суміші додають холодну воду (800 мл), і доводять рН до 9-10 шляхом поступового додавання розчину гідроксиду натрію при 0- 5 °C. При 0-5 °C додають розчин метабісульфіту натрію, і реакційну масу перемішують при 0-10 °C впродовж 1 години, підтримуючи рН реакційної маси при 8-9. Реакційну масу фільтрують, і залишок на фільтрі промивають 200 мл води. Вологий продукт сушать при 50-60 °C і перекристалізовують з ацетону. Вихід 100 г. Температура плавлення 252-254 °C. 45 ФОРМУЛА ВИНАХОДУ 50 1. Спосіб отримання етравірину, при якому проводять стадії: a) конденсації 2,4,6-трихлорпіримідину з 3,5-диметил-4-гідроксибензонітрилом з отриманням сполуки формули (V) 6 UA 106972 C2 ; b) перетворення сполуки формули (V) на сполуку формули (VI) 5 10 15 20 25 конденсацією з 4-амінобензонітрилом; c) необов'язково, очищення сполуки формули (VI); d) амонолізу сполуки формули (VI) з утворенням сполуки формули (IV) (IV); і e) галогенування сполуки формули (IV) з утворенням етравірину. 2. Спосіб отримання етравірину за п. 1, який відрізняється тим, що стадію (а) здійснюють у присутності інертного розчинника і основи. 3. Спосіб отримання етравірину за п. 2, який відрізняється тим, що інертним розчинником є 1,4-діоксан, і як основу використовують N,N-діізопропілетиламін. 4. Спосіб отримання етравірину за п. 1, який відрізняється тим, що стадію (b) здійснюють з використанням алкоксиду як основи. 5. Спосіб отримання етравірину за п. 4, який відрізняється тим, що основа є третинним бутоксидом калію. 6. Спосіб отримання етравірину за п. 1, який відрізняється тим, що стадію (b) здійснюють з використанням інертного розчинника, вибраного з етанолу, 1-метил-2-піролідону, N,Nдиметилформаміду, 1,4-діоксану, тетрагідрофурану, диметилсульфоксиду, тетраліну, сульфолану і ацетонітрилу. 7. Спосіб отримання етравірину за п. 6, який відрізняється тим, що як інертний розчинник використовують 1-метил-2-піролідон. 8. Спосіб отримання етравірину за п. 1, який відрізняється тим, що стадію (с) здійснюють з використанням промивання етилацетатом. 9. Спосіб отримання етравірину за п. 1, який відрізняється тим, що стадію (d) здійснюють з використанням водного розчину аміаку в 1,4-діоксані при температурі 120-130 °C. 10. Спосіб отримання етравірину за п. 1, який відрізняється тим, що стадію (e) здійснюють з використанням вільного галогену. 30 7 UA 106972 C2 Комп’ютерна верстка Л. Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for synthesis of diarylpyrimidine non-nucleoside reverse transcriptase inhibitor
Автори російськоюGurjar, Mukund Keshav, Maikap, Golakchandra, Sudarshan, Joshi, Shashikant Gangaram, Pardeshi, Devising Rameshsing, Kamble, Mangesh Gorakhanath, Mehta, Samit Satish
МПК / Мітки
МПК: A61K 31/505, C07D 239/46, C07D 239/47
Мітки: спосіб, ненуклеозидного, інгібітора, синтезу, діарилпіримідинового, зворотної, транскриптази
Код посилання
<a href="https://ua.patents.su/10-106972-sposib-sintezu-diarilpirimidinovogo-nenukleozidnogo-ingibitora-zvorotno-transkriptazi.html" target="_blank" rel="follow" title="База патентів України">Спосіб синтезу діарилпіримідинового ненуклеозидного інгібітора зворотної транскриптази</a>
Попередній патент: Похідне імідазопіразину та фармацевтична композиція на його основі
Наступний патент: Пігментні гранули
Випадковий патент: Запірний пристрій кришки люка піввагона












