Ненуклеозидні інгібітори зворотної транскриптази та їх застосування
Номер патенту: 79285
Опубліковано: 11.06.2007
Автори: Сімоно Брюно, О'Мара Джеффрі, Ландрі Серж, Тавонехам Боунхам, Маланфан Ерік, Йоакім Крістіан, Но Жюлі
Формула / Реферат
1. Сполука, представлена формулою І:
 І,
І,
у якій
R2 вибирають із ряду, який включає: Н, галоген;
R4 означає Н або Me;
R5 означає Н або Me;
R11 означає Н, С1-С4алкіл або С3-С4циклоалкіл;
А означає з'єднувальний ланцюг С1-С3алкілу;
В означає О;
n означає 0 або 1;
причому, коли n означає 0, кільце С означає феніл, заміщений C1-С6алкілом;
і Е вибирають із ряду, який включає:
(I) CONR12R13, де R12 й R13 кожен незалежно один від одного означає Н, SО2С1-С6алкіл, С1-С6алкіл-СООН, С1-С6алкіл-С3-С7циклоалкіл, де циклоалкіл заміщений СООН;
(II) CONHNR14R15, де R14 й R15 кожен незалежно один від одного означає Н або С1-С6алкіл, необов'язково заміщений СООН;
(III) NR16COR17, де R16 означає Н або C1-С6алкіл, заміщений СООН, або феніл-СООН і R17 означає С2-С4алкеніл-СООН, С3-С7циклоалкіл-СООН, NНC1-С6алкіл-СООН; С1-С6алкіл, необов'язково заміщений СООН; або С1-С6алкіл-С3-С7циклоалкіл, де циклоалкіл заміщений СООН;
(IV) NR18SO2C1-С6алкіл, де R18 означає Н;
(V) SO2NR19R20, де R19 означає Н і R20 означає C1-С6алкіл, заміщений СООН;
або, коли n означає 1, то кільце С означає феніл, необов'язково заміщений 1-2 замісниками, вибраними з галогену та C1-С6алкілу, необов'язково заміщеного ОН; і
Е означає простий зв'язок або з'єднувальну групу, вибрану з ряду, який включає:
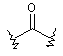 (VII);
(VII);
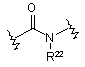 (VIII); де R22 означає Н або С1-С6алкіл;
(VIII); де R22 означає Н або С1-С6алкіл;
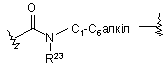 (IX); де R23 означає Н або С1-С6алкіл;
(IX); де R23 означає Н або С1-С6алкіл;
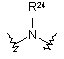 (X); де R24 означає Н або С1-С6алкіл;
(X); де R24 означає Н або С1-С6алкіл;
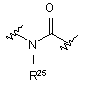 (XI); де R25 означає Н;
(XI); де R25 означає Н;
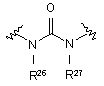 (XII); де R26 й R27 кожний означає Н або С1-С6алкіл;
(XII); де R26 й R27 кожний означає Н або С1-С6алкіл;
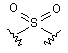 (XIV);
(XIV);
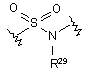 (XV); де R29 означає Н; і
(XV); де R29 означає Н; і
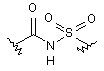 (XVI);
(XVI);
кільце D означає феніл, необов'язково заміщений 1-3 замісниками, вибраними з галогену, NH2, NO2, СООН, ОН, СОО(С1-С6)алкілу, С1-С6алкокси і С1-С6алкілу, необов'язково заміщеного СООН або ОН; або
кільце D означає 5- або 6-членний гетероцикл, який містить 1-4 гетероатоми, вибрані з групи, яка включає: О, N та S, причому цей гетероцикл необов'язково заміщений 1-2 замісниками, вибраними з галогену, NH2, СООН, ОН, СОО(С1-С6)алкілу та С1-С6алкілу, необов'язково заміщеного СООН; або її сіль.
2. Сполука за п. 1, у якій:
R2 вибирають із ряду, який включає: Н, галоген; коли n означає 0, Е вибирають із ряду, який включає:
(I) CONR12R13, де R12 й R13 кожен незалежно один від одного означає Н, SО2С1-С6алкіл, С1-С6алкілСООН, С1-С6алкіл-С3-С7циклоалкіл, де циклоалкіл необов'язково може бути заміщений СООН;
(II) CONHNR14R15, де R14 та R15 кожен незалежно один від одного означає Н або С1-С6алкіл, необов'язково заміщений СООН;
(III) NR16COR17, де R16 означає Н або С1-С6алкіл, заміщений СООН, або фенілСООН; і R17 означає С2-С4алкенілСООН, С3-С7циклоалкіл-СООН, NHC1-С6алкілСООН; С1-С6алкіл, необов'язково заміщений СООН; або С1-С6алкіл-С3-С7циклоалкіл, де циклоалкіл заміщений СООН; і
(IV) NR18SO2С1-С6алкіл, де R18 означає Н; або
коли n означає 1, то Е означає простий зв'язок або з'єднувальну групу, вибрану з ряду, який включає:
 (VII);
(VII);
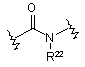 (VIII); де R22 означає Н або С1-С6алкіл;
(VIII); де R22 означає Н або С1-С6алкіл;
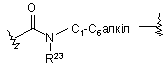 (IX); де R23 означає Н або С1-С6алкіл;
(IX); де R23 означає Н або С1-С6алкіл;
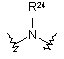 (X); де R24 означає Н або С1-С6алкіл;
(X); де R24 означає Н або С1-С6алкіл;
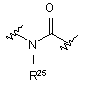 (XI); де R25 означає Н;
(XI); де R25 означає Н;
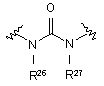 (XII); де R26 й R27 кожний означає Н або С1-С6алкіл;
(XII); де R26 й R27 кожний означає Н або С1-С6алкіл;
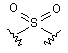 (XIV) i
(XIV) i
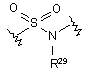 (XV), де R29 означає Н; і
(XV), де R29 означає Н; і
кільце D необов'язково заміщене: галогеном, NH2, NO2, СООН, ОН, С1-С6алкокси і С1-С6алкілом, необов'язково заміщеним СООН або ОН.
3. Сполука формули І за п. 1, у якій А означає -СН2-СН2-; В означає О; R2 означає Н або галоген; R4 означає Н; R5 означає Me; R11 означає Н, Et або С3-С4циклоалкіл;
коли n означає 0, то кільце С означає феніл, заміщений С1-С6алкілом, і коли n означає 1, то кільце С означає феніл, необов'язково заміщений 1 або 2 замісниками, вибраними з ряду, який включає: галоген і С1-С6алкіл, необов'язково заміщений ОН;
кільце D означає феніл необов'язково заміщений 1-3 замісниками, вибраними з ряду, який включає:
галоген, NH2, NO2, СООН, ОН, СООС1-С6алкіл, С1-С6алкокси, С1-С6алкіл, необов'язково заміщений СООН або ОН;
або кільце D означає тіофен, фуран, тіазол, оксазол, ізоксазол, піразол, триазол, імідазол, піридин, піридин-N-оксид, піридинон, піримідин або тетразол, кожний з яких необов'язково може бути заміщений 1 або 2 замісниками, вибраними з ряду, який включає: галоген, NH2, COOH, ОН, С1-С6алкіл, необов'язково заміщений СООН.
4. Сполука за п. 3, у якій R2 означає Н, F або Сl; R11 означає Et або циклопропіл; n означає 0 і кільце С означає феніл, заміщений С1-С6алкілом; або n означає 1 і кільце С означає:
 або
або 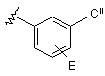 ,
,
де Сi означає С1-С6алкіл й Сii означає Н, галоген або С1-С6алкіл; і кільце D вибирають із ряду, який включає:
- феніл, необов'язково заміщений 1-3 замісниками, вибраними з ряду, який включає: СООН, ОН, С1-С6алкіл-СООН або С1-С6алкіл(ОН)-СООН, С1-С6алкіл, галоген, С1-С6алкокси, NH2 й NO2;
- тіофен, фуран або тіазол, кожний з яких необов'язково заміщений 1-2 замісниками, вибраними з ряду, який включає: СООН, NH2 й С1-С6алкіл, необов'язково заміщений СООН;
- імідазол, необов'язково заміщений 1 або 2 С1-С6алкільними замісниками;
- піразол, необов'язково заміщений 1-2 замісниками, вибраними з ряду, який включає: СООН, С1-С6алкіл, необов'язково заміщений СООН;
- триазол, заміщений СООН;
- ізоксазол, необов'язково заміщений СООН;
- оксазол;
-піридин або піридин-N-оксид, кожен необов'язково заміщений 1-2 замісниками, вибраними з ряду, який включає: СООН, С1-С6алкіл, галоген, NH2 й ОН;
- піримідин;
- піридинон, необов'язково заміщений 1-2 замісниками, вибраними з ряду, який включає: С1-С6алкіл, необов'язково заміщений СООН; або
- тетразол.
5. Сполука за п. 4, у якій R2 означає Н; R11 означає Et; Сi означає СН3 й Сii означає Н, Сl або СН3; кільце D вибирають із ряду, який включає:
- феніл, необов'язково заміщений 1 або 2 замісниками, вибраними з ряду, який включає: СООН, СН2СООН, СН2СН2СООН, СН3, F, Сl, ОМе, NO2, NH2 й ОН;
- тіофен, фуран або тіазол, кожний з яких може бути незаміщений або моно- або дизаміщений замісниками, вибраними з ряду, який включає СООН, -СН2-СООН або NH2;
- імідазол, який може бути незаміщений або монозаміщений Me;
- піразол, який може бути незаміщений або моно- або дизаміщений замісниками, вибраними з ряду, який включає: Me, СООН або -СН2-СООН;
- піридин або піридин-N-оксид, кожний з яких може бути моно- або дизаміщений замісниками, вибраними з ряду, який включає: Me, Сl, NH2 або ОН; і
- піридинон, монозаміщений на атомі азоту -СН2-СООН.
6. Сполука за п. 5, у якій кільце D означає:
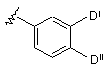 ,
,
де Di означає СООН, С1-С6алкіл, необов'язково заміщений СООН, або галоген й Dii означає СООН, ОН, NH2, галоген, С1-С6алкіл, необов'язково заміщений СООН, за умови, що Di й Dii обидва не означають СООН.
7. Сполука за п. 6, у якій Di означає СООН, -СН2СООН, Me, F або Сl й Dii означає ОН, NH2, F, Сl, -СН2СООН або СООН.
8. Сполука за п. 5, у якій кільце D означає феніл, монозаміщений СООН, СН2СООН або СН2СН2СООН.
9. Сполука за п. 1 або за будь-яким з пп. 3-8, у якій n означає 0, Е вибирають із ряду, який включає: CONHSO2C1-C6алкіл, СONНС1-С6алкіл-СООН або СОNНС1-С6алкіл-С3-С7циклоалкіл-СООН; CONHNH2, CONHNHMe або CONHNHCH2COOH;
NR16COR17,
де R16 означає Н або С1-С6алкіл, заміщений СООН або феніл-СООН; і R17 означає С2-С4алкеніл-СООН, С3-С7циклоалкіл-СООН, NHС1-С6алкіл-СООН; С1-С6алкіл-С3-С7циклоалкіл-СООН; або С1-С6алкіл, необов'язково заміщений СООН; NHSO2Me; SO2NHCH2COOH.
10. Сполука за п. 9, у якій Е знаходиться в пара-положенні.
11. Сполука за п. 1 або за будь-яким з пп. 3-10, у якій n означає 1 й
Е означає простий зв'язок або з'єднувальну групу, вибрану з ряду, який включає: -С(О)-; -C(O)-N(R22)-, де R22 означає Н або Me; -C(O)-N(R23)-С1-С6алкіл-, де R23 означає Н або Me; -N(R24)-, де R24 означає Н або Me; -NH-С(О)-; -NH-C(O)-NH-; -SO2-; -SO2-NH- і -C(O)-NH-SO2-.
12. Сполука за п. 11, у якій Е означає з'єднувальну групу, вибрану з ряду, який включає: -C(O)-N(R22)-, де R22 означає Н або Me; -N(R24)-, де R24 означає Н або Me; і NH-C(O)-.
13. Сполука за п. 12, у якій Е знаходиться в пара-положенні.
14. Застосування сполуки формули І за будь-яким з пп. 1-13 або її фармацевтично прийнятної солі для приготування лікарського засобу, призначеного для лікування або профілактики ВІЛ-інфекції.
Текст
Винахід стосується нових сполук й їх фармацевтично прийнятних солей, їх застосування індивідуально або в сполученні з іншими терапевтичними агентами для лікування або профілактики ВІЛ-інфекції й фармацевтичних композицій, які містять такі сполуки. Захворювання, відоме як синдром набутого імунодефіциту (СНІД) викликається вірусом імунодефіциту людини (ВІЛ), насамперед штамом, відомим як ВІЛ-1. Для реплікації ВІЛ у клітині-хазяїні інформація, яка міститься у вірусному геномі, повинна бути інтегрована в ДНК клітини-хазяїна. Однак ВІЛ являє собою ретровірус, тобто вірус, у якого генетична інформація зчитується із РНК. Таким чином, цикл реплікації ВІЛ включає стадію транскрипції вірусного геному (РНК) з утворенням ДНК, цей процес є зворотним по відношенню до нормального процесу транскрипції. Транскрипція вірусної РНК із утворенням ДНК відбувається за допомогою ферменту, який називається зворотної транскриптазою (ЗТ). Віріон ВІЛ містить копію ЗТ разом з вірусною РНК. Відомо, що зворотна транскриптаза має три ферментативні функції: вона діє як РНК-залежна ДНКполімерази, як рибонуклеаза й ДНК-залежна ДНК-полімераза. Як РНК-залежна ДНК-полімерази, ЗТ здійснює транскрипцію копії одноланцюгової ДНК вірусної РНК. Як рибонуклеаза ЗТ розщеплює вихідну вірусну РНК і вивільняє ДНК, отриману безпосередньо на матриці вихідної РНК. Нарешті, як ДНК-залежна ДНК-полімераза ЗТ створює другий комплементарний ланцюг ДНК, використовуючи перший ланцюг ДНК як матрицю. Два ланцюги утворюють дволанцюгову ДНК, яка інтегрується в геном клітини-хазяїна за допомогою іншого ферменту, який називається інтегразою. Сполуки, які мають здатність інгібувати ферментативні функції зворотної транскриптази ВІЛ-1, можуть інгібувати реплікацію ВІЛ-1 в інфікованих клітинах. Такі сполуки можна застосовувати для запобігання або лікування викликаної ВІЛ-1 інфекції у хворих людей, як це встановлено при використанні відомих інгібіторів ЗТ, таких як 3'-азидо-3'-дезокситимідин (AZT), 2',3'-дидезоксіінозин (ddl), 2',3'-дидезоксицитидин (ddC), d4T, ЗТС, невірапін, делавірдин, ефавіренц й абакавір, які зараз є основними лікарськими засобами, дозволеними для застосування при лікуванні СНІДу. Як і при будь-якій антивірусній терапії застосування інгібіторів ЗТ для лікування СНІДу в остаточному підсумку приводить до зниження чутливості вірусу до конкретного лікарського засобу. Стійкість (знижена чутливість) до таких лікарських засобів є результатом мутацій, які відбуваються в сегменті зворотної транскриптази гена рої. До теперішнього часу визначені характеристики декількох мутантних штамів ВІЛ і встановлено, що стійкість до відомих терапевтичних агентів зумовлена мутаціями в гені ЗТ. Одними з мутантів, які найбільш часто зустрічаються в клінічних умовах, є: мутант Y181C, у якому залишок тирозину (Y) у кодоні 181 замінений на залишок цистеїну (С), і K103N, у якому залишок лізину (K) у положенні 103 замінений на залишок аспарагіну (N). Інші мутанти, які виникають із зростаючою частотою, при лікуванні з використанням відомих антивірусних лікарських засобів, являють собою мутанти з однією мутацією V106A, G190A, Y188C й P236L; і мутанти із двома мутаціями K103N/Y181C, K103N/P225H, K103N/V108I й K103N/L100I. Триваюче застосування антивірусних сполук для лікування й запобігання ВІЛ-інфекції безсумнівно буде приводити до збільшення випадків виникнення нових стійких штамів ВІЛ. Таким чином, існує невідкладна потреба в створенні нових інгібіторів ЗТ, які мають різні параметри ефективності відносно різних мутантів. Сполуки, які мають трицикличні структури, які є інгібіторами ВІЛ-1, описані в [U.S. No. 5366972]. Інші інгібітори зворотної транскриптази ВІЛ-1 описані в [Hargrave й ін., J. Med. Chem., 34, (1991), с.2231]. В [U.S. No. 5705499] описані 8-арилалкіл- і 8-арилгетероалкіл-5,11-дигідро-6Н-дипіридо[3,2-В:2',3'Е][1,4]діазепіни як інгібітори ЗТ. В [WO 01/96338 й US 6420359] описані діазепінові структури, які містять хінолінові й хінолін-N-оксидні замісники, як інгібітори ЗТ. Наведені як приклади сполуки мають активність відносно штамів ВІЛ дикого типу (WT), мутантних штамів з однієї й двома мутаціями. В [WO 02/076982 й WO 03/011862] описані також діазепінові структури, що містять замісники, які структурно відрізняються від запропонованих у даному винаході. У винаході запропоновані нові сполуки, які є ефективними інгібіторами ЗТ ВІЛ-1 дикого типу (WT) і мутантних штамів із двома мутаціями. Переважно сполуки, запропоновані в даному винаході, є ефективними інгібіторами важливого із клінічної точки зору мутантного штаму із двома мутаціями K103N/Y181C. Першим об'єктом винаходу є сполука, представлена формулою І: 5 R O R 4 N A B R2 N N N Кільце C E Кільце D n R 11 I у якій R2 вибирають із ряду, який включає: Н, С1-С4алкіл, галоген, галоалкіл, ОН, С1-С6алкокси, NH(C1C4алкіл) або N(C1-C4алкіл)2 ; R4 означає Η або Me; R5 означає Η або Me; R11 означає Н, С1-С4алкіл, С3-С4циклоалкіл й С1-С4алкіл-С3-С4циклоалкіл; А означає з'єднувальний ланцюг С 1-С3алкілу; В означає О або S; n означає 0 або 1; причому, коли n означає 0, то кільце С означає 6- або 10-членний арил або 5- або 6-членний гетероцикл, який містить 1-4 гетероатоми, вибраних з: О, N й S, де арил і гетероцикл необов'язково можуть бути заміщені 1-4 замісниками, вибраними з ряду, який включає: галоген й С1-С6алкіл, необов'язково заміщений ОН; і Ε вибирають із ряду, який включає: (I) CONR12R13, де R12 й R13 кожен незалежно один від одного означає Н, SО2С1-С6алкіл, С1-С6алкілСООН, С1-С6алкіл-С3-С7циклоалкіл, де циклоалкіл необов'язково може бути заміщений СООН; (II) CONHNR14R15, де R14 й R15 кожен незалежно один від одного означає Η або С1-С6алкіл, необов'язково заміщений СООН; (III) NR16COR17, де R16 означає Η або С1-С6алкіл, необов'язково заміщений СООН або С6-С10арилСООН; і R17 означає С2-С4алкеніл-СООН, С3-С7циклоалкіл-СООН, NHC1-C6алкіл)-COOH; С1-С6алкіл, необов'язково заміщений СООН; або С1-С6алкіл-С3-С7ациклоалкіл, де циклоалкіл необов'язково може бути заміщений СООН; (IV) NR18SО2С1-С6алкіл, де R18 означає Η або С1-С6алкіл; (V) SO2NR19R20, де R19 означає Η або С1-С6алкіл; і R20 означає С1-С6алкіл, необов'язково заміщений СООН; і (VI) SO2R21, де R21 означає С1-С6алкіл; або, коли n означає 1, то кільце С має вказане вище значення; і Ε означає простий зв'язок або з'єднувальну групу, вибрану з ряду, який включає: i кільце D означає 6- або 10-членний арил або 5- або 6-членний гетероцикл, який містить 1-4 гетероатоми, вибраних з О, N й S, де арил і гетеро цикл необов'язково можуть бути заміщені 1-5 замісниками, вибраними з ряду, який включає: галоген, NH2, NO2, СООН, ОН, СООС1-С6алкіл, С1-С6алкокси, С2-С4алкеніл-СООН, С3-С7циклоалкілСООН й С1-С6алкіл, необов'язково заміщений СООН або ОН; або її сіль або проліки. Другим об'єктом винаходу є фармацевтична композиція, призначена для лікування або запобігання ВІЛінфекції, яка містить представлену в даному описі сполуку формули І, або її фармацевтично прийнятну сіль, і фармацевтично прийнятний носій. Третім об'єктом винаходу є спосіб лікування або запобігання ВІЛ-інфекції, який полягає в тому, що пацієнтові вводять кількість сполуки формули І, яка інгібує ВІЛ, її фармацевтично прийнятної солі, або фармацевтичної композиції, представлених у даному описі. Четвертим об'єктом винаходу є спосіб лікування або запобігання ВІЛ-інфекції, який полягає в тому, що вводять сполуку формули І, представлену в даному описі, або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій у сполученні з антиретровірусним лікарським засобом. П'ятим об'єктом винаходу є спосіб запобігання перинатальної передачі ВІЛ-1 від матері до дитини, який полягає в тому, що матері перед пологами вводять представлену в даному описі сполуку формули І або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій. Шостим об'єктом винаходу є застосування вказаної в даному описі сполуки формули І для приготування лікарського засобу, призначеного для лікування або запобігання ВІЛ-інфекції. Докладний опис винаходу Визначення Якщо не вказане інше, то в описі використовуються наступні визначення: У контексті даного опису поняття "С1-С4алкіл" й "С1-С6алкіл" індивідуально або в сполученні з іншим радикалом означають ациклічні із прямим або розгалуженим ланцюгом алкільні радикали, які містять від одного до чотирьох або від одного до шести атомів вуглецю відповідно. Прикладами таких радикалів є метил, етил, пропіл, ізопропіл, бутил, emop-бутил, трет-бутил, гексил, 1-метилетил, 1-метилпропіл, 2-метилпропіл, 1,1-диметилетил. У контексті даного опису поняття "С3-С4циклоалкіл" й "С3-С7циклоалкіл" індивідуально або в сполученні з іншим радикалом означають насичені циклічні вуглеводневі радикали, які містять від трьох до чотирьох або від трьох до семи атомів вуглецю відповідно. Прикладами таких радикалів є циклопропіл, циклобутил, циклопентил, циклогексил і циклогептил. У контексті даного опису поняття "С1-С6алкокси" або "ОС1-С6алкіл" використовуються взаємозамінно й означають ациклічні алкільні радикали, які містять від одного до шести атомів вуглецю, ковалентно зв'язані з атомом кисню. У контексті даного опису поняття "6- або 10-членний арил" індивідуально або в сполученні з іншим радикалом означає ароматичний радикал, який містить шість або десять атомів вуглецю, наприклад, феніл або нафтил. У контексті даного опису поняття «гетероцикл» або «Het» індивідуально або в сполученні з іншим радикалом означає одновалентний радикал, отриманий шляхом видалення атома водню з 5-, 6- або 7членного насиченого або ненасиченого (включаючи ароматичний) гетероциклу, який містить 1-4 гетероатоми, вибраних з азоту, кисню й сірки. Крім того, «Het» у контексті даного опису означає вказаний вище гетероцикл, сконденсований з одним або декількома іншими циклами, які являють собою гетероцикл або будь-який інший цикл. Гетероцикли можуть нести замісники. Приклади замісників включають (але не обмежуючись ними) галогени, аміни, гідразини й N-оксидогрупи. Прикладами придатних гетероциклів є: піролідин, тетрагідрофуран, тіазолідин, пірол, тіофен, діазепін, 1Н-імідазол, ізоксазол, тіазол, тетразол, піперидин, 1,4-діоксан, 4-морфолін, піридин, піримідин, тіазоло[4,5-b]піридин, хінолін або індол або наступні гетероцикли: S , , N+ N N N N , N S N або N O _ У контексті даного опису поняття "гало" означає атом галогену й включає фтор, хлор, бром і йод. У контексті даного опису поняття "галоалкіл" означає вказаний вище алкіл, у якому кожен атом водню можна послідовно заміщати атомом галогену, наприклад, СН2Вr або CF3. У контексті даного опису поняття "фармацевтично прийнятна сіль" означає солі, які отримані з фармацевтично прийнятних основ й є нетоксичними. Прикладами придатних основ можуть служити холін, етаноламін й етилендіамін. Мається на увазі, що під обсяг винаходу підпадають також Na+-, K+- і Са++-солі [див. також Birge S.M. і ін., Pharmaceutical salts, J. Pharm. Sci., 66, (1977), стор.1-19, публікація включена в даний опис як посилання]. У контексті даного опису поняття "проліки" означає фармакологічно прийнятні похідні, з яких у результаті біотрансформації утворюється активний лікарський засіб, який належить до сполук формули І. Прикладами таких похідних є (але не обмежуючись ними) складні ефіри й аміди [див. Goodman й Gilman, The Pharmacological Basis of Therapeutics, 9-е вид., вид-во McGraw-Hill, Int. Ed., "Biotransformation of Drugs, 1995, стор.11-16, нублікація включена в даний опис як посилання]. Переважно сполуки, запропоновані в даному винаході, мають таку формулу: 4 R R 5 O N O Кільце C R 2 N N N 11 R E Кільце D n Переважно R2 вибирають із Н, С1-С4алкілу, галогену, галоалкілу, ОН або С1-С6алкокси. Більш переважно R2 означає Н, Me, OMe або галоген. Найбільш переважно R2 означає Н, F або СІ. Ще більш переважно R2 означає Н. переважно R4 означає Н. переважно R5 означає Me. переважно R11 означає Н, Et або С3-С4циклоалкіл. Більш переважно R11 означає Et або циклопропіл. Найбільш переважно R11 означає Et. Коли n=0, переважно кільце С являє собою феніл, необов'язково заміщений 1-2 замісниками, вибраними з ряду, який включає: галоген і С1-С4алкіл. необов'язково заміщений ОН. Переважно також кільце С являє собою феніл, необов'язково заміщений 1-2 замісниками, вибраними з ряду, який включає: галоген і С1-С6алкіл. Більш переважно кільце С являє собою феніл, необов'язково заміщений С1-С6алкілом. Крім того, коли n=0, переважно Ε вибирають із ряду, який включає (I) CONHSO2(C1-C6алкіл), CONH(C1-C6алкіл)-COOH або СОNH(С1-С6)алкіл-(С3-С7)циклоалкіл-СООН; (II) CONHNH2 , CONHNHMe або CONHNHCH2COOH; (III) NR16COR17, де R16 означає Н або С1-С6алкіл, необов'язково заміщений СООН або (С6-С10)арилСООН; і R17 означає (С2-С4)алкеніл-СООН, (С3-С7)циклоалкіл-СООН, NH(C1-C6)алкiл-COOH; (С1-С6)алкіл(С3-С7)циклоалкіл-СООН; або (С1-С6)алкіл, необов'язково заміщений СООН. (IV) NHSO2Me; (V) SO2NHCH2COOH; і (VI) SO2Me. Більш переважно Е вибирають із ряду, який включає (I) CONHSO2(C1-C6)anKm, CONH(C1-C6)алкiл-COOH або СОNH(С1-С6)алкіл-(С3-С7)циклоалкіл-СООН; (II) CONHNH2 , CONHNHMe або CONHNHCH2COOH; (III) NR16COR17, де R16 означає Н або С1-С6алкіл, необов'язково заміщений СООН або (С6-С10)арилСООН; і R17 означає (С2-С4)алкеніл-СООН, (С3-С7)циклоалкіл-СООН, NH(C1-C6)алкiл-COOH; (С1-С6)алкіл(С3-С7)циклоалкіл-СООН; або (С1-С6)алкіл, необов'язково заміщений СООН. (IV) NHSO2Me; Крім того, коли n=0, переважно Ε знаходиться в пара-положенні. В альтернативному варіанті, коли n=1, переважно кільце С являє собою феніл, необов'язково заміщений 1 або 2 замісниками, вибраними з ряду, який включає галоген й (С1-С6)алкіл, необов'язково заміщений ОН. В альтернативному варіанті, коли n=1, переважно кільце С являє собою феніл, необов'язково заміщений 1 або 2 замісниками, вибраними з ряду, який включає галоген й (С1-С6)алкіл. Більш переважно кільце С являє собою або де Сi означає С 1-С6алкіл й Сii означає Н, галоген або С1-С6алкіл. Переважно Сi означає СН3. Переважно, Сii означає Н, СІ або СН3. Найбільш переважно Сii означає Н. Коли n дорівнює 1, Ε означає простий зв'язок або з'єднувальну групу, вибрану з: В альтернативному варіанті Е переважно означає простий зв'язок або з'єднувальну групу, вибрану з: Найбільш переважно Ε являє собою з'єднувальну групу, вибрану з: Коли n дорівнює 1, переважно Ε знаходиться в пара-положенні. Переважно, кільце D являє собою феніл або 5- або 6-членний гетероцикл, який несе 1-4 гетероатоми, вибраних з ряду, який включає О, N й S, де феніл і гетероцикл необов'язково можуть бути заміщені 1-4 замісниками, вибраними з ряду, який включає: галоген, ΝΗ2, ΝΟ2, СООН, ОН, СООС1-С6алкіл, С1-С6алкокси, С2-С4алкеніл-СООН; С3-С7циклоалкілСООН; або С1-С6алкіл, необов'язково заміщений СООН або ОН. В альтернативному варіанті кільце D переважно являє собою феніл або 5- або 6-членний гетероцикл, який несе 1-4 гетероатоми, вибраних з ряду, який включає О, N й S, де феніл і гетероцикл необов'язково можуть бути заміщені 1-4 замісниками, вибраними з ряду, який включає: галоген, ΝΗ2, ΝΟ2, СООН, ОН, С1С6алкокси, С2-С4алкеніл-СООН; С3-С7циклоалкіл-СООН; або С1-С6алкіл, необов'язково заміщений СООН або ОН. Більш переважно кільце D являє собою феніл, необов'язково заміщений 1-3 замісниками, вибраними з ряду, який включає: СООН, ОН, С1-С6алкіл-СООН або С1-С6алкіл-ОН-СООН, С1-С6алкіл, галоген, С1-С6алкокси, ΝΗ2 або ΝΟ2. Ще більш переважно кільце D являє собою феніл, необов'язково заміщений 1 або 2 замісниками, вибраними з ряду, який включає: СООН, СН2СООН, СН2СН2СООН, СН3, F, СІ, ОМе, ΝΟ2, ΝΗ2 або ОН. Найбільш переважно, кільце D являє собою: де Di означає СООН, С1-С6алкіл, ii необов'язково заміщений СООН, або галоген, і D означає СООН, ОН, NH2 , галоген, С1-С6алкіл, необов'язково заміщений СООН, за умови, що Di й Dii обидва не означають СООН. Переважно, Di означає СООН, -СН2СООН, Me, F або СІ. Переважно, Dii означає ОН, NH2 , F, СІ, -СН2СООН або СООН. Ще більш переважно, кільце D являє собою феніл, монозаміщений СООН, СН2СООН або СН2СН2СООН у пара- або метa-положенні. В альтернативному переважному варіанті кільце D являє собою тіофен, фуран, тіазол, оксазол, ізоксазол, піразол, триазол, імідазол, піридин, піридин-N-оксид, піридинон, піримідин або тетразол, кожний з яких необов'язково може бути заміщений 1-2 замісниками, вибраними з ряду, який включає: галоген, NH2, СООН, ОН, С1-С6алкокси, С1-С6алкіл, необов'язково заміщений СООН або ОН. В альтернативному переважному варіанті кільце D являє собою тіофен, фуран, тіазол, оксазол, ізоксазол, піразол, триазол, імідазол, піридин, піридин-N-оксид, піридинон або піримідин, кожний з яких необов'язково може бути заміщений як вказано вище. Ще в одному альтернативному переважному варіанті кільце D являє собою тіофен, фуран або тіазол, кожний з яких необов'язково заміщений 1-3 замісниками, вибраними з: NH2, СООН й С1-С6алкілу, необов'язково заміщеного СООН. Більш переважно тіофен, фуран або тіазол є незаміщеними або моно або дизаміщеними СООН, -СН2-СООН або NH2. Ще в одному альтернативному переважному варіанті кільце D являє собою імідазол, необов'язково заміщений 1-2 С1-С6алкільними замісниками. Більш переважно імідазол є незаміщеним або монозаміщеним Me. У наступному альтернативному переважному варіанті кільце D являє собою піразол, необов'язково заміщений 1-2 замісниками, вибраними з ряду, який включає: СООН, С1-С6алкіл, необов'язково заміщений СООН. Більш переважно піразол є незаміщеним або моно- або дизаміщеним Me, COOH або -СН2-СООН. В альтернативному переважному варіанті кільце D являє собою триазол, заміщений СООН. В альтернативному переважному варіанті кільце D являє собою ізоксазол, необов'язково заміщений СООН. В альтернативному переважному варіанті кільце D являє собою оксазол. В альтернативному переважному варіанті кільце D являє собою піридин або піридин-N-оксид, необов'язково заміщений 1-3 замісниками, вибраними з ряду, який включає: СООН, С1-С6алкіл, галоген, NH2 або ОН. Більш переважно піридин або піридин-N-оксид є моно- або дизаміщеними Me, СІ, NH2 або ОН. Найбільш переважно кільце D являє собою піридин-N-оксид. В альтернативному переважному варіанті кільце D являє собою піримідин. В альтернативному переважному варіанті кільце D являє собою піридинон, необов'язково заміщений 12 замісниками, вибраними з ряду, який включає: С1-С6алкіл, необов'язково заміщений СООН. Більш переважно піридинон є монозаміщеним на атомі азоту групою -СН2 -СООН. В альтернативному переважному варіанті кільце D являє собою тетразол. Переважними варіантами здійснення даного винаходу є також кожна з конкретних сполук, перерахованих у таблицях 1-4. Антивірусна активність Сполуки, запропоновані в даному винаході, є ефективними інгібіторами зворотної транскриптази ВІЛ-1 дикого типу, а також важливого із клінічної точки зору ферменту K103N/Y181C, який несе дві мутації. Сполуки можуть служити також ефективними інгібіторами, наприклад, ферментів Y181C, V106A й Y188C, які несуть одну мутацію. При введенні у вигляді придатних лікарських засобів їх можна застосовувати для лікування СНІДу, стану, який передує синдрому набутого імунодефіциту (ARC) і споріднених захворювань, зв'язаних з ВІЛ-1інфекцією. Таким чином, наступним об'єктом винаходу є спосіб лікування інфекції, яка викликається ВІЛ-1, який полягає в тому, що людині, інфікованій ВІЛ-1, вводять терапевтично ефективну кількість описаної вище нової сполуки формули І. Крім вказаного вище застосування для лікування й профілактики, сполуку можна застосовувати також для запобігання перинатальної передачі ВІЛ-1 від матері до дитини шляхом введення сполуки матері перед пологами. Сполуки формули І можна вводити у вигляді однократної дози або у вигляді розділених доз оральним або парентеральним шляхом. Придатна оральна доза сполуки формули І може становити приблизно від 0,5мг до 3г на день. Переважно оральна доза сполуки формули І становить приблизно від 100 до 800мг на день для пацієнта вагою 70кг. У випадку композицій для парентерального введення придатна стандартна доза може становити від 0,1 до 250мг сполуки, переважно від 1 до 200мг. Однак слід враховувати, що доза, яку вводять, може змінюватися від пацієнта до пацієнта й доза для кожного конкретного пацієнта залежить від рішення лікуючого лікаря, який як критерій при призначенні відповідної дози повинен враховувати вагу і стан пацієнта, а також реакцію пацієнта на лікарський засіб. Якщо сполуки, запропоновані в даному винаході, вводять оральним шляхом, то їх можна вводити як лікарські засоби у формі фармацевтичних композицій, які їх містять у сполученні із сумісним фармацевтичним носієм. Такий носій може являти собою інертний органічний або неорганічний носій, придатний для орального введення. Прикладами таких носіїв є вода, желатин, тальк, крохмаль, стеарат магнію, аравійська камедь, рослинні олії, поліалкіленгліколі, вазелін і т.п. Сполуки формули І можна застосовувати в сполученні з антиретровірусним лікарським засобом, відомим фахівцеві в даній галузі, як комбінований лікарський засіб для одночасного, окремого або послідовного введення для лікування або запобігання ВІЛ-інфекції в індивідуума. Приклади антиретровірусних лікарських засобів, які можна застосовувати при комбінованому лікуванні з використанням сполук формули І, включають (але не обмежуючись ними) нуклеозидні/нуклеотидні інгібітори зворотної транскриптази (такі як АЗТ і тенофовір), ненуклеозидні інгібітори зворотної транскриптази (такі як невірапін), інгібітори протеази (такі як ритановір), інгібітори вірусного злиття (такі як Т-20), антагоністи CCR5 (такі як SCH-351125), антагоністи CXCR4 (такі як AMD-3100), інгібітори інтегрази (такі як L-870,810), інгібітори тирозинамінотрансферази (ТАТ), інші лікарські засоби, які знаходяться на стадії дослідження, (такі як PRO-542, BMS-806, ТМС-114 або АІ-183), протигрибкові або антибактеріальні агенти (такі як флуконазол), і імуномодулятори (такі як левамізол). Крім того, сполуку формули І можна застосовувати в сполученні з іншою сполукою формули І. Фармацевтичні композиції можна готувати стандартним методом і кінцеві лікарські форми можуть являти собою тверді лікарські форми, наприклад, таблетки, драже, капсули й т.п., або рідкі лікарські форми, наприклад, розчини, суспензії, емульсії й т.п. Фармацевтичні композиції можна піддавати стандартним фармацевтичним обробкам, таким як стерилізація. Крім того, фармацевтичні композиції можуть містити стандартні допоміжні речовини, такі як консерванти, стабілізатори, емульгатори, коригенти, змочувальні агенти, буфери, солі для зміни осмотичного тиску й т.п. Твердий носій, який можна застосовувати, являє собою, наприклад, крохмаль, лактозу, маніт, метилцелюлозу, мікрокристалічну целюлозу, тальк, діоксид кремнію, вторинний кислий фосфат кальцію й високомолекулярні полімери (такі як поліетиленгліколь). Для парентерального застосування сполуку формули І можна вводити у вигляді водного або неводного розчину, суспензії або емульсії у фармацевтично прийнятному маслі або суміші рідин, які можуть містити бактеріостатичні агенти, антиоксиданти, консерванти, буфери або інші розчинені речовини, які надають розчину ізотонічність із кров'ю, загусники, суспендуючі агенти або інші фармацевтично прийнятні добавки. Такі добавки включають, наприклад, тартратний, цитратний й ацетатний буфери, етанол, пропіленгліколь, поліетиленгліколь, комплексоутворюючі агенти (такі як ЕДТК), антиоксиданти (такі як бісульфіт натрію, метабісульфіт натрію й аскорбінова кислота), високомолекулярні полімери (такі як рідкі поліетиленоксиди) для регулювання в'язкості й поліетиленові похідні ангідридів сорбіту. При необхідності можна додавати також консерванти, такі як бензойна кислота, метил- або пропілпарабен, бензалконійхлорид й інші похідні четвертинного амонію. Сполуки, запропоновані у винаході, можна вводити також у вигляді розчинів для назального введення й вони можуть містити крім сполук, запропонованих у даному винаході, придатні буфери, агенти для регулювання тонічності, протимікробні консерванти, антиоксиданти й агенти, які підвищують в'язкість, у водному носії. Прикладами агентів, які підвищують в'язкість, є полівініловий спирт, похідні целюлози, полівінілпіролідон, полісорбати або гліцерин. Протимікробні консерванти, які можна додавати, включають бензалконійхлорид, тимерозал, хлорбутанол або фенілетиловий спирт. Крім того, сполуки, запропоновані у винаході, можна вводити у вигляді супозиторію. Методологія й синтез У прикладах реакційних схем, описаних в [WO 01/96338], зміст якої включений в даний опис як посилання, наведені численні методи синтезу трициклічного ядра й вони проілюстровані нижче. Сполуки, запропоновані в даному винаході, фахівець в галузі хімічного органічного синтезу може одержувати на основі своїх знань. Приклади реакційних схем проілюстровані на схемах 1-8. Замісники R2, R4, R5 й R11 мають значення, вказані в даному описі. На схемах 1-3 проілюстровані методи одержання арил- і гетероарилфенолів. Схема 1 P O O P H або С1-С 6-ал кіл B P'O H аб о С1-С 6-ал кіл Рекція сполучення Сузукі OP' Het-X або арил-X 1(i) Het або арил Видалення захисних груп, 1(ii) OH я кщо P не означає H OH OP' Het або арил + B OP' 1(iii) X 1(iv) H або С1 -С 6-алкіл Рекція сполучення Сузукі Het-X або арил-X Het або арил 1(v) де P або P' означає гідроксизахисну групу і Х означає групу, яку вилучають Загалом метод полягає в тому, що захищений фенол 1(і) можна піддавати реакції сполучення з гетероциклом або арилом, наприклад, за допомогою реакції сполучення Сузукі, одержуючи сполуку 1(іі), у якій при необхідності можна видаляти захисні групи, одержуючи сполуку 1(v). В альтернативному варіанті фенол 1(iv) можна піддавати реакції сполучення з арильним або гетероциклічним похідним 1(ііі), одержуючи сполуку 1(v). Схема 2 OH Н або С1 -С 6-алкіл N S R a-CSNH2 a R OH OH OH 2(ii) Н або С1 -С 6-алкіл Н або С1-С 6-алкіл Н або С1-С 6-алкіл HCONH2 захист N N O Br 2(i) N N H OH P 2(iii) HCONH2 2(iv) Де P означає захисну групу і Ra означає H, NH 2, NHC 1-С 6-алкіл або C1 -С6-алкіл. Н або С 1-С6 -алкіл N O 2(v) Загадом метод полягає в тому, що a-бромметилкетон 2(і) конденсують із відповідним реагентом, наприклад, формамідом, або RaCSNH2, одержуючи відповідні гетероциклічні сполуки 2(іі), 2(ііі) або 2(v). При необхідності в гетероцикл можна вводити захисні групи перед конденсацією зі спиртом 4(і), одержуючи сполуку 2(iv), як описано нижче. Схема 3 P O O P OH Н або С1-С6-алкіл Н або С1-С6-алкіл NH 2OH CHO P O Н або С1-С6-алкіл NaOCl N Видалення захисної групи CO2Et N O OH 3(i) Н або С1-С6-алкіл N O CO2Et 3(ii) 3(iii) CO2Et 3(iv) В альтернативному варіанті гетероциклічний фрагмент можна вводити при утворенні гетероциклу in situ. Альдегід 3(і) можна конденсувати з NH2OH, одержуючи сполуку 3(іі). Шляхом подальшої конденсації з алкінільним похідним одержують гетероцикл 3(іі), у якого потім можна видаляти захисні групи, одержуючи сполуку 3(iv). На схемі 4 представлений загальний метод сполучення заміщених фенолів із трициклічним ядром. Схема 4 OH Н або C1-C6-алкіл 4 R 5 R 4 O N 2 N R N 11 R 4(i) N 5 O N 1(v) OH R R Нet або арил O Міцунобу 2 R N N 11 Н або C 1-C 6-алкіл N R 4(ii) Нet або арил Модифікація гетероциклу або арилу При необхідності видалення або модифікація функціональних груп Сполуки формули I Як правило, фенол 1(v) можна конденсувати зі спиртом 4(і), за допомогою, наприклад, реакції типу Міцунобу, одержуючи сполуку 4(іі). Після цього гетероциклічний фрагмент можна піддавати подальшій модифікації, наприклад, шляхом окислення, або можна видаляти захисні групи в гетероциклу з одержанням сполук формули І. На схемах 5-8 представлений альтернативний варіант сполучення трициклічного ядра з фенолами, що несуть замісники, які є попередниками Е-D-фрагмента сполук формули І. Схема 5 R R 4 5 R O HO N R 5 O N O 4(i) N 11 R N 2 B O O N 11 R 4 Міцунобу OH + N N 2 R Н або С-С6-алкіл 1 R Н або С-С6-алкіл 1 N 5(ii) B O O 5(i) Реакція сполучення Сузукі R 5 R 4 Het-X або арил-X O N O R N N 2 R Н або С-С6 -алкіл 1 N 11 Het або арил 4(ii) В альтернативному варіанті сполуку 5(і), яка містить бор, можна конденсувати зі спиртом 4(і), одержуючи сполуку 5(іі). Після цього гетероциклічний або арильний фрагмент можна вводити за допомогою реакції сполучення Сузукі, одержуючи сполуку 4(іі). Схема 6 HO R R 4 Н або С1 -С6 -алкіл 6(i) 5 O z Міцунобу N R R 4 5 O N OH R N N 2 R 11 4(i) R 4 R 5 R R N R 11 імідазол CuBr, CsCO3 C6H5NO2 R Н або С 1-С 6-алкіл 4 R 5 O N N O H N 6(iv) z Z = Br O N Н або С 1-С 6-алкіл N 11 6(ii) N 2 N N 2 Z = CHO HOCH2CHO, NH4OH AcONa / MeOH O R O N R N 2 N N R 11 Н або С1 -С6 -алкіл N N 6(iii) N В альтернативному варіанті сполуку 6(іі), де Ζ означає або альдегід, або галоген, можна одержувати за допомогою описаної вище реакції конденсації. Потім гетероциклічний фрагмент можна вводити шляхом безпосереднього сполучення, одержуючи сполуку 6(ііі), або шляхом синтезу in situ, одержуючи сполуку 6(iv). Схема 7 OH Н або С1-С6-алкіл R 4 5 R O N OH R 2 N N R R СО 2С1-С6-алкіл 11 4(i) 4 5 R O N 7(i) N Міцунобу O R 2 N N R 11 Н або С1-С6 -алкіл N СО2 С1-С6-алкіл 7(ii) Сполучення гідразинами або омилення з і сполучення з амінами, сульфонамідами Видалення або модифікація захисних груп (при необхідності) Сполуки формули I В альтернативному варіанті сполуки 4(і) і 7(і) можна конденсувати за допомогою реакції Міцунобу, одержуючи сполуку 7(іі). Після цього можна застосовувати реакції сполучення, омилення або модифікацію функціональних груп для перетворення сполуки 7(іі) у сполуки формули І. Схема 8 R R 4 5 O N Н аб о С1 -С 6-алкіл O OH Н або С1 -С 6-алкіл R N N 2 R X 8(i) X 1. Pd амінування Ar-NH2 N 11 2. видалення або модифікація функціональних груп x = галоген Сполуки формули I Міцунобу 4(i) 1. Pd амінування Ar-X або сполучення (RCO 2H) R OH 4 R 5 2. видалення або модифікація функціональних груп O N O R N P H 2 N N R 11 Н або С1-С 6-алкіл R N 8(ii) N P H 4 R O N Видалення захисних груп R 5 O 2 N N R 11 Н або С 1-С6 -алкіл N 8(iii) NH 2 В іншому прикладі сполуку 8(і) можна перетворювати у відповідний амін за допомогою реакції амінування, яка каталізується паладієм з наступним видаленням або модифікацією функціональних груп, одержуючи сполуки формули I. В альтернативному варіанті амін у сполуці 8(іі) можна перетворювати в сполуки формули І за допомогою декількох реакцій видалення захисних груп й/або модифікації функціональних груп. За допомогою описаного нижче аналізу з використанням зворотної транскриптази (ЗТ) сполуки можна тестувати відносно їх здатності інгібувати РНК-залежну ДНК-полімеразну активність ЗТ ВІЛ-1. Таким шляхом було проведене тестування деяких конкретних сполук, які описані в наведені нижче прикладах і таблицях 1-4. Результати тестування наведені в таблиці 5 у вигляді значень ІС50 (нМ) і ЕС50 (нМ). Приклади Нижче винахід більш докладно проілюстрований на прикладах, які не обмежують його обсяг. Всі реакції проводили в атмосфері азоту або аргону, якщо не вказано інше. Температури подані в градусах Цельсію. Відсотки або співвідношення для розчинів являють собою об./об.-співвідношення, якщо не вказане інше. Скорочення або символи, які використовуються в описі, мають наступні значення: BINAP: 2,2'-біс(дифенілфосфіно)-1,1'-бінафтил; Біс-трис-пропан: 1,3-біс{трис(гідроксиметил)метиламіно}пропан; ДЦК: дициклогексилкарбодіімід; ДЕАД: діетилазодикарбоксилат; ДЕПК: діетилпірокарбонат; ДІАД: діізопропілазодикарбоксилат; ДІЕА: діізопропілетиламін; ДМАП: 4-(диметиламіно)піридин; ДМФ: диметилформамід; ДМСО: диметилсульфоксид; Dppf: 1,1'-біс(дифенілфосфіно)фероцен; ДТТ: дитіотреїтол; ЕДТА: етилендіамінтетраацетат; ES МС: мас-спектрометрія з використанням електронного пучка; Et: етил; Et2O: діетиловий ефір; EtOAc: етилацетат; EtOH: етанол; GHS: відновлений глутатіон; РХВР: рідинна хроматографія високого розділення; іРr: ізопропіл; МХПБК: .мета-хлорперпербензойна кислота; Me: метил; MeCN: ацетонітрил; МеОН: метанол; МЕС: 2-(н-морфоліно)етансульфонова кислота; ММСО: граничне значення молекулярної маси, яка пропускається через фільтр; NEC: N-бромсукцинімід; ОБГ: н-октил-b-D-глюкозид; Pd2(dba)3: трис(дибензиліденацетон)дипаладій(0); PdCl2(dppf)3: дихлорид[1,1'-біс(дифенілфосфіно)фероцен]паладію; БУО: бляшкоутворюючі одиниці; Ph: феніл; ДСН-ПААГ: гель-електрофорез у поліакриламідному гелі в присутності додецилсульфату натрію; ТБЕ: трис-борат ЕДТА; ТБТУ: тетрафторборат 2-(1H-бензотриазол-1-іл)-N,Ν,Ν',Ν'-тетраметилуронію; ТФК: трифтороцтова кислота; ТГФ: тетрагідрофуран; УМФ: уридин-5'-монофосфат; УТФ: уридин-5'-трифосфат. Синтез У наступних прикладах проілюстровані способи одержання сполук, запропонованих у винаході. Приклад 1 (сполука 1013): 4'-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси]-3'-метил[1,1'-біфеніл]-3-карбонова кислота а) 2-(4-Метокси-3-метилфеніл)-4,4,5,5-тетраметил-1,3,2-діоксоборолан Суміш, яка містить біс(пінаколато)диборан (10,7г, 42,1ммоля), 4-бром-1-метокси-2-метилбензол (7,70г, 38,3ммоля) і KОАс (10,9г, 114ммолів) у ДМСО (200мл) дегазували за допомогою аргону протягом 10хв. Потім додавали PdCl2dppf (у вигляді комплексу з СН2СI 2, (1:1), 2,50г, 3,06ммоля) і реакційну суміш нагрівали до 80°С протягом 24год. Реакційну суміш розбавляли водою й екстрагували С6Н6 (3´). Об'єднані органічні шари промивали соляним розчином, сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (гексан:EtOAc, 95:5), одержуючи вказану в заголовку сполуку (5,1г, вихід 54%) у вигляді безбарвного масла. б) Метил-4'-метокси-3'-метил-[1,1'-біфеніл]-3-карбоксилат До дегазованої (аргон, 10хв) суміші, яка містить 2-(4-метокси-3-метилфеніл)-4,4,5,5-тетраметил-1,3,2діоксоборолан (500мг, 2,01ммоля), 3-бромбензойну кислоту (446мг, 2,22ммоля) і 1М водний розчин Na2CO3 (6,3мл) у ДМСО (20мл), додавали PdCl2dppf (у вигляді комплексу з СН2СI 2, (1:1), 132мг, 0,16ммоля). Реакційну суміш нагрівали до 80°С протягом 12год. Охолоджену суміш підкисляли 1н. водним розчином НСI й екстрагували EtOAc. Органічний шар промивали соляним розчином, сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Неочищену кислоту, яка утворилася, розчиняли в Et2O (150мл) і обробляли надлишком ефірного розчину CH2N2 (приблизно 0,6М). Суміш концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (гексан:EtOAc, 20:1), одержуючи вказану в заголовку сполуку (350мг, вихід 68%). в) Метил-4'-гідрокси-3'-метил-[1,1'-біфеніл]-3-карбоксилат 1,0Μ розчин BBr3 в СН2СI 2 (3,4мл, 3,40ммоля) додавали до охолодженого на льоді розчину метил-4'метокси-3'-метил-[1,1'-біфеніл]-3-карбоксилату (345мг, 1,35ммоля) в СН2СI 2 (13мл). Реакційну суміш перемішували при 25°С протягом 2год, потім охолоджували до 0°С. Додавали МеОН (5мл) і суміш перемішували при 0°С протягом 15хв, потім екстрагували СН2СI 2 (2´). Об'єднані органічні шари промивали соляним розчином, сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (EtOAc:гексан, від 10 до 15%), одержуючи вказану в заголовку сполуку (278мг, вихід 85%) у вигляді твердої речовини білого кольору. г) Метил-4'-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси]-3'метил-[1,1'-біфенілі-3-карбоксилат Розчин ДЕАД (65мкл, 0,41ммоля) у ТГФ (0,15мл) додавали протягом 2год до охолодженого на льоді розчину, який містить 11-етил-5,11-дигідро-8-(2-гідроксіетил)-5-метил-6H-дипіридо[3,2-b:2',3'-е][1,4]діазепін6-он (100мг, 0,34ммоля, отриманий відповідно до методів, описаних в [WO 01/96338], яка включена в даний опис як посилання), метил-4'-гідрокси-3'-метил-[1,1'-біфеніл]-4-карбоксилат (100мг, 0,41ммоля) і PPh3 (108мг, 0,41ммоля), у ТГФ (4,0мл). Реакційну суміш перемішували при 25°С протягом 16год. Додавали додаткову кількість ДЕАД (30мкл, 0,19ммоля) і реакційну суміш перемішували при 25°С протягом 16год, потім концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (толуол:EtOAc, 85:15), одержуючи вказану в заголовку сполуку (136мг, вихід 78%) у вигляді твердої речовини білого кольору. д) 4'-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси]-3'метил-[1,1'-біфеніл]-3-карбонова кислота 1н. водний розчин NaOH (0,78мл, 0,78ммоля) додавали до розчину метил-4'-[2-(11-етил-6,11-дигідро-5метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси]-3'-метил-[1,1'-біфеніл]-3-карбоксилату (136мг, 0,26ммоля) у ТГФ (2мл) і МеОН (1,0мл). Суміш перемішували при 25°С протягом 1год. Утворений розчин підкисляли 1н. водним розчином НСl і суміш екстрагували EtOAc (3´). Об'єднані органічні шари промивали соляним розчином, сушили (MgSO4), фільтрували й концентрували при зниженому тиску, одержуючи вказану в заголовку сполуку 1013 (108мг, вихід 77%) у вигляді твердої речовини білого кольору. Приклад 2 (Сполука 1034) 4-аміно-4'-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси]-3'метил-[1,1'-біфеніл]-3-карбонова кислота а) 2-(4-гідрокси-3-метилфеніл)-4,4,5,5-тетраметил-1,3,2-діоксоборолан Суміш, яка містить біс(пінаколато)диборан (19,6г, 77,0ммолів), 4-бром-2-метилфенол (12,00г, 64,2ммоля) і KОАс (18,9г, 192ммоля) у ДМСО (300мл), дегазували аргоном протягом 1год. Потім додавали PdCl2dppf (у вигляді комплексу з СН2СI 2, 1:1, 7,04г, 9,6ммоля) і реакційну суміш нагрівали до 80°С протягом 10год. Реакційну суміш розбавляли EtOAc (1л) і утворений розчин промивали водою (3´500мл) і соляним розчином (500мл), сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (гексан:EtOAc, 4:1), одержуючи вказану в заголовку сполуку (6,76г, вихід 45%) у вигляді масла жовтого кольору. б) 2-{4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси1-3метилфеніл}-4,4,5,5-тетраметил-1,3,2-діоксоборолан ДІАД (1,93мл, 9,80ммоля) додавали по краплях до розчину, який містить 11-етил-5,11-дигідро-8-(2гідроксіетил)-5-метил-6H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-6-он (2,44г, 8,19ммоля), 2-(4-гідрокси-3метилфеніл)-4,4,5,5-тетраметил-1,3,2-діоксоборолан (2,30г, 9,83ммоля) і РРh3 (2,58г, 9,82ммоля) у ТГФ (33 л), при 25°С. Реакційну суміш перемішували при 25°С протягом 72год. Суміш концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (гексан:EtOAc, 3:2), одержуючи вказану в заголовку сполуку (3,11г, вихід 74%) у вигляді піни білого кольору. в) 4-аміно-4'-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси]3'-метил-[1,1'-біфеніл]-3-карбонова кислота Суміш, яка містить 2-{4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дитридо[3,2-b:2',3'-е][1,4]діазепін-8іл)етокси]-3-метилфеніл}-4,4,5,5-тетраметил-1,3,2-діоксоборолан (160мг, 0,31ммоля), метил-5-бром-2амінобензоат (143мг, 0,62ммоля) і K3РО4 (247мг, 1,17ммоля) в 1,4-діоксані (10мл), дегазували за допомогою N2 протягом 30хв. Потім додавали PdCl2(dppf) (у вигляді комплексу з СН2СI 2, (1:1), 28,5мг, 34,8мкмоля) і dppf (21,6мг, 38,9мкмоля) і реакційну суміш нагрівали в атмосфері N2 до 80°С протягом 16год. Охолоджену суміш концентрували при зниженому тиску й залишок розчиняли в ЕtOАс (50мл). Органічний шар промивали водою (10мл) і соляним розчином (10мл), сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (EtOAc:гексан, 1:1). Складний метиловий ефір, що утворився, розчиняли в МеОН (2мл) і ТГФ (2мл) і додавали 1н. водний розчин NaOH (2,0мл, 2,0ммоля). Суміш перемішували при 25°С протягом 18год, потім концентрували при зниженому тиску. Водний розчин, який залишився, розбавляли 1н. водним розчином NaOH (50мл) і утворений розчин промивали Et2O (15мл). Водний шар підкисляли за допомогою 1н. водного розчину НСI й екстрагували ЕtOАс (3´30мл). Об'єднані органічні шари промивали водою (15мл) і соляним розчином (15мл), сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Залишок очищали за допомогою РХВР із оберненою фазою (колонка типу CombiPrep ODS-AQ 50´20мм, 5мкм, 120А, MeCN/вода+0,10% ТФК), одержуючи вказану в заголовку сполуку 1034 (60мг) у вигляді твердої речовини жовтого кольору. Кислоту обробляли 0,1н. водним розчином NaOH (1,14мл, 1екв.) у воді/MeCN (3:1, 5мл) і утворений розчин заморожували й ліофілізували, одержуючи натрієву сіль вказаної в заголовку сполуки 1034 (56мг, вихід 33%) у вигляді твердої речовини білого кольору. Приклад 3 (Сполука 1041) 3-{4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)стокси]-3метилфеніл)-5-ізоксазолкарбонова кислота а) 4-(Метоксиметокси)-3-метилбензальдегід До розчину 4-гідрокси-3-метилбензальдегіду (900мг, 6,61ммоля) в СН2СI 2 (19мл) додавали Et3 N (5,90мл, 42,3ммоля) і простий метилхлорметиловий ефір (2,00мл, 26,3ммоля). Реакційну суміш перемішували при 25°С протягом 16год. Реакційну суміш розбавляли EtOAc і промивали послідовно 1н. водним розчином НСl, насиченим водним розчином NaHCO3, водою й соляним розчином, сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Залишок очищали за допомогою експресхроматографії (гексан:EtOAc, 4:1), одержуючи вказану в заголовку сполуку (630мг, вихід 53%) у вигляді прозорого масла. б) Оксим 4-(метоксиметокси)-3-метилбензальдегіду Et3N (1,68мл, 12,0ммолів) і гідрохлорид гідроксиламіну (320мг, 4,64ммоля) додавали до розчину 4(метоксиметокси)-3-метилбензальдегіду (620мг, 3,44ммоля) в 1,4-діоксані (12мл). Реакційну суміш опромінювали ультразвуком протягом 10хв і перемішували при 25°С протягом 3 днів. Реакційну суміш розбавляли ЕtOАс і промивали послідовно водою й соляним розчином, сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (гексан:EtOAc, 3:1), одержуючи вказану в заголовку сполуку (580мг, вихід 86%) у вигляді прозорої смоли. в) Етил-3-[4-(метоксиметокси)-3-метилфеніл]-5-ізоксазолкарбоксилат Етилпропіолат (0,60мл, 5,88ммоля) і 6% (мас/об.) розчин NaOCl у воді (10,8мл) додавали до розчину оксиму 4-(метоксиметокси)-3-метилбензальдегіду (570мг, 2,92ммоля) у ТГФ (12мл). Реакційну суміш перемішували при 25°С протягом 2год, потім розбавляли EtOAc. Утворений розчин промивали послідовно 10%-ним водним розчином Na2S2O3, водою й соляним розчином, сушили (MgSO4), фільтрували й концентрували при зниженому тиску, одержуючи вказану в заголовку сполуку (745мг, вихід 88%) у вигляді твердої речовини жовтого кольору. г) Етил-3-(4-гідрокси-3-метилфеніл)-5-ізоксазолкарбоксилат Розчин етил-3-[4-(метоксиметокси)-3-метилфеніл]-5-ізоксазолкарбоксилату (725мг, 2,49ммоля) і 4н. водний розчин НСI (6мл) у ΤΓΦ (10мл) перемішували при 25°С протягом 16год. Реакційну суміш розбавляли ЕtOАс і послідовно промивали водою й соляним розчином, сушили (MgSO4), фільтрували й концентрували при зниженому тиску, одержуючи вказану в заголовку сполуку (434мг, вихід 70%) у вигляді твердої речовини жовтого кольору. д) Етил-3-{4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси]3-метилфеніл}-5-ізоксазолкарбоксилат ДЕАД (55мкл, 0,35ммоля) додавали протягом 30хв до розчину, який містить 11-етил-5,11-дигідро-8-(2гідроксіетил)-5-метил-6H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-6-он (70,0мг, 0,23ммоля), етил-3-(4-гідрокси-3метилфеніл)-5-ізоксазолкарбоксилат (86,5мг, 0,35ммоля) і РРh3 (91,8мг, 0,35ммоля) у ТГФ (2мл) при 25°С. Реакційну суміш перемішували при 25°С протягом 18год. Суміш концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (СН2СI 2:EtOAc, 10:1), одержуючи вказану в заголовку сполуку (55мг, вихід 45%). e) 3-{4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси]-3метилфеніл}-5-ізоксазолкарбонова кислота Розчин, який містить етил-3-{4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'е][1,4]діазепін-8-іл)етокси]-3-метилфеніл}-5-ізоксазолкарбоксилат (50,0мг, 0,090ммоля) і 1н. водний розчин NaOH (0,90мл, 0,90ммоля) у ТГФ (2мл) і МеОН (0,5мл) перемішували при 25°С протягом 1год. Реакційну суміш концентрували при зниженому тиску, підкисляли 4н. водним розчином НСl й екстрагували ЕtOАс (1´) і СН2СI 2 (1´). Об'єднані органічні шари промивали водою й соляним розчином, сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Утворений твердий продукт розтирали із сумішшю EtOAc/гексан, одержуючи вказану в заголовку сполуку (40мг, вихід 85%) у вигляді твердої речовини ясножовтого кольору. 1н. розчин NaOH (78мкл, 0,078ммоля) додавали до розчину вказаної в заголовку сполуки (39,0мг, 0,078ммоля) у ТГФ (3мл). Через 45хв суміш концентрували. Залишок розчиняли у воді й MeCN, потім розчин заморожували й ліофілізували, одержуючи відповідну натрієву сіль вказаної в заголовку сполуки 1041 (40,5мг, вихід 100%) у вигляді твердої речовини білого кольору. Приклад 4 (Сполука 1046) 5-{4-[2-[11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси]-3метилфеніл}-2-фуранкарбонова кислота а) 5-(4-гідрокси-3-метилфеніл)-2-фуранкарбоксальдегід Pd(PPh3)4 (69,3мг, 0,06ммоля) додавали до дегазованого (шляхом пронускання N2 протягом 15хв) розчину, який містить 4-бром-2-метилфенол (225мг, 1,20ммоля), 2-формілфуран-5-боронову кислоту (177мг, 1,26ммоля) і водний 0,4М Na2CO3 (6мл) в MeCN (12мл). Суміш нагрівали до температури дефлегмації протягом 12год. Гарячу суміш фільтрували й осад на фільтрі промивали MeCN (6мл). Фільтрат концентрували до половини об'єму й розбавляли EtOAc. Утворений розчин промивали водою й соляним розчином, сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (гексан:EtOAc, 7:3), одержуючи вказану в заголовку сполуку (115мг, вихід 47%) у вигляді твердої речовини жовтого кольору. б) 11-етил-5,11-дигідро-8-{2-[4-(5-форміл-2-фураніл)-2-метилфенокси]етил}-5-метил-6H-дипіридо[3,2b:2',3'-е][1,4]діазепін-6-он ДІАД (107мкл, 0,54ммоля) додавали по краплях до розчину, який містить 11-етил-5,11-дигідро-8-(2гідроксіетил)-5-метил-6H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-6-он (135мг, 0,45ммоля), 5-(4-гідрокси-3метилфеніл)-2-фуранкарбоксальдегід (110мг, 0,54ммоля) і PPh3 (143мг, 0,54ммоля) у ТГФ (4мл), при 25°С. Реакційну суміш перемішували при 25°С протягом 18год. Суміш концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (гексан:EtOAc, 3:2), одержуючи вказану в заголовку сполуку (147мг, вихід 67%) у вигляді піни ясно-жовтого кольору. в) 5-{4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)стокси]-3метилфеніл}-2-фуранкарбонова кислота Розчин NaClO2 (13,7мг, 0,15ммоля) у воді (0,5мл) додавали протягом 10хв до охолодженого на льоді розчину, який містить 11-етил-5,11-дигідро-8-{2-[4-(5-форміл-2-фураніл)-2-метилфенокси]етил}-5-метил-6Hдипіридо[3,2-b:2',3'-е][1,4]діазепін-6-он (57,0мг, 0,12ммоля), сульфамінову кислоту (16,7мг, 0,17ммоля) і водний розчин NaH2PO4 (63,2мг, 0,46ммоля в 0,5мл води) в 1,4-діоксані (2мл). Суміш перемішували при 0°С протягом 15хв, потім додавали Na2SO3 (17,3мг, 0,14ммоля). Через 15хв реакційну суміш підкисляли (до рН 4) 1н. водним розчином НСl й екстрагували СН2СI 2 (50мл). Органічний шар промивали водою (15мл) і соляним розчином (15мл), сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Залишок очищали за допомогою РХВР із оберненою фазою (колонка типу CombiPrep ODS-AQ 50´20мм, 5мкм, 120А, MeCN/вода+0,10% ТФК), одержуючи вказану в заголовку сполуку 1046 (34мг). Кислоту обробляли 1н. водним розчином NaOH (67мкл, 1екв.) у воді (15мл) і MeCN (10мл) і утворений розчин заморожували й ліофілізували, одержуючи натрієву сіль вказаної в заголовку сполуки 1046 (33мг, вихід 53%) у вигляді твердої речовини білого кольору. Приклад 5 (Сполука 1047) 5-{4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси]феніл}-2метил-3-фуранкарбонова кислота а) Етил 5-(4-амінофеніл)-2-метил-3-фуранкарбоксилат Суміш, яка містить етил-2-метил-5-(4-нітрофеніл)-3-фуранкарбоксилат (500мг, 1,82ммоля), порошкоподібне залізо (325меш, 811мг, 14,5ммоля) і 1н. водний розчин НСl (0,36мл, 0,36ммоля) в ЕtOН (5мл), нагрівали до температури дефлегмації протягом 2год. Реакційну суміш фільтрували й концентрували при зниженому тиску, одержуючи вказану в заголовку сполуку (396мг, вихід 89%) у вигляді масла коричневого кольору. б) Етил-5-(4-гідроксифеніл)-2-метил-3-фуранкарбоксилат Розчин NaNO2 (111мг, 1,61ммоля) у воді (1мл) додавали протягом 5хв до охолодженої на льоді суспензії етил-5-(4-амінофеніл)-2-метил-3-фуранкарбоксилату (395мг, 1,61ммоля) в 1М водному розчині H2SO4 (12мл). Реакційну суміш перемішували при 0°С протягом 20хв, потім нагрівали до 90°С протягом 1год. Охолоджену суміш екстрагували EtOAc. Органічний шар промивали водою (2´) і соляним розчином, сушили (MgSO4), фільтрували й концентрували при зниженому тиску, одержуючи вказану в заголовку сполуку (78мг, вихід 20%) у вигляді твердої речовини білого кольору. в) Етил-5-{4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-e][1,4]діазепін-8іл)етокси]феніл}-2-метил-3-фуранкарбоксилат ДІАД (60мкл, 0,31ммоля) додавали по краплях до розчину, який містить 11-етил-5,11-дигідро-8-(2гідроксіетил)-5-метил-6H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-6-он (75,8мг, 0,25ммоля), етил-5-(4гідроксифеніл)-2-метил-3-фуранкарбоксилат (75мг, 0,30ммоля) і PPh3 (80,0мг, 0,30ммоля) у ТГФ (3мл), при 25°С. Реакційну суміш перемішували при 25°С протягом 48год. Суміш концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (гексан:EtOAc, 3:2), одержуючи вказану в заголовку сполуку (64мг, вихід 48%) у вигляді масла жовтого кольору. г) 5-{4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)стокси]феніл}2-метил-3-фуранкарбонова кислота Суміш, яка містить етил-5-{4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'е][1,4]діазепін-8-іл)етокси]феніл}-2-метил-3-фуранкарбоксилат (64,0мг, 0,12ммоля) і 1н. водний розчин NaOH (2,00мл, 2,00ммоля) в МеОН (2мл) і ТГФ (2мл), перемішували при 25°С протягом 3год. Реакційну суміш концентрували при зниженому тиску. Залишок розбавляли водою й утворений розчин промивали Et2O (3´). Водний шар підкисляли за допомогою 1н. водного розчину НСl (рН 3) і екстрагували EtOAc. Органічний шар промивали водою, соляним розчином, сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Вказану в заголовку сполуку (53мг, 0,11ммоля) суспендували у воді (5мл) і обробляли 0,1н. водним розчином NaOH (1,06мл, 0,11ммоля). Суміш розбавляли MeCN (2мл) і утворений розчин заморожували й ліофілізували, одержуючи відповідну натрієву сіль вказаної в заголовку сполуки 1047 (50мг, вихід 79%) у вигляді твердої речовини ясно-жовтого кольору. Приклад 6 (сполука 1076) 11-етил-5,11-дигідро-5-метил-8-{2-[2-метил-4-(4-метил-3-піридиніл)фенокси]етил}-6H-дипіридо[3,2b:2',3'-e][1,4] діазепін-6-он Суміш, яка містить 2-{4-[2-(етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-e]діазепін-8іл)етокси]-3-метилфеніл}-4,4,5,5-тетраметил-1,3,2-діоксоборолан (200мг, 0,39ммоля), 3-бром-4метилпіридин (86,9мг, 0,51ммоля) і K3РО4 (248мг, 1,17ммоля) в 1,4-діоксані (8,0мл), дегазували за допомогою N2 протягом 45хв. Потім додавали PdCl2(dppf) (у вигляді комплексу з СН2СI 2, 1:11, 28,4мг, 38,9мкмоля) і dppf (21,6мг, 38,9мкмоля) і реакційну суміш перемішували в атмосфері N2 у трубі високого тиску при 100°С протягом 16год. Охолоджену суміш, розведену ЕtOАс (25мл) фільтрували. Фільтрат концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (від EtOAc:гексан, 4:1, до ЕtOАс), одержуючи вказану в заголовку сполуку 1076 (154мг, вихід 82%) у вигляді твердої речовини білого кольору. Приклад 7 (сполука 1077) 11-етил-5,11-дигідро-5-метил-8-{2-[2-метил-4-(4-метил-1-оксидо-3-піридиніл)фенокси]етил)-6Hдипіридо[3,2-b:2',3'-е][1,4]діазепін-6-он Розчин, який містить 5,11-дигідро-11-етил-5-метил-8-{2-[2-метил-4-(4-метил-3-піридиніл)фенокси]етил}6H-дипіридо[3,2-b:2',3'-e][1,4] діазепін-6-он (114мг, 0,24ммоля) і МХПБК (62,6мг, 0,31ммоля) в СН2СI 2 (10мл), перемішували при кімнатній температурі протягом 2год. Реакційну суміш розбавляли EtOAc (50мл) і утворений розчин промивали 10%-ним водним розчином Na2S2O3 (3´10мл), водним розчином NaHCO3 (3´10мл), водою (10мл) і соляним розчином (10мл), потім сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії, одержуючи вказану в заголовку сполуку 1077 (55мг, вихід 47%) у вигляді твердої речовини білого кольору. Приклад 8 (сполука 1090) 11-етил-5,11-дигідро-5-метил-8{2-[4-(4-піридиніл)фенокси]етил}-6H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-6он а) 4-[4-(Фенілметокси)феніл]піридин Pd(PPh3)4 (10,0мг, 0,01ммоля) додавали до дегазованої (N2) суміші, яка містить 4(фенілметокси)фенілборонову кислоту (230мг, 1,01ммоля), гідробромід 4-бромпіридину (194мг, 1,00ммоль), 1М водний розчин Na2CO3 (4,0мл), в MeCN (4мл). Реакційну суміш нагрівали до 85°С протягом 5год. Охолоджену суспензію фільтрували й утворену тверду речовину промивали водним розчином MeCN. Фільтрат екстрагували за допомогою СН2СI 2. Органічний шар сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (EtOAc) і об'єднували з отриманим фільтрацією твердим продуктом, у результаті чого одержували вказану в заголовку сполуку (247мг, вихід 94%) у вигляді твердої речовини білого кольору. б) 4-(4-Гідроксифеніл)піридин Розчин, який містить 4-[4-(фенілметокси)феніл]піридин (120мг, 0,46ммоля), Pd(OH)2/C (20мас.%, 10мг) і 1,0М водний розчин НСl (0,5мл) в МеОН (20мл), перемішували в атмосфері водню (50фунтів/кв.дюйм) протягом 17год при 25°С. Каталізатор видаляли фільтрацією, додавали Et3 N (0,1мл) і фільтрат концентрували при зниженому тиску. Залишок обробляли гарячим ТГФ. Утворену суспензію фільтрували й фільтрат концентрували при зниженому тиску, одержуючи вказану в заголовку сполуку (69мг, вихід 88%) у вигляді твердої речовини бежевого кольору. в) 11-етил-5,11-дигідро-5-метил-8-{2-[4-(4-піридиніл)фенокси]етил}-6H-дипіридо[3,2-b:2',3'e][1,4]діазепін-6-он Розчин ДІАД (96,9мкл, 0,50ммоля) у ТГФ (0,5мл) додавали по краплях до розчину, який містить 11етил-5,11-дигідро-8-(2-гідроксіетил)-5-метил-6H-дипіридо[3,2-b:2',3'-e][1,4]діазепін-6-он (100мг, 0,33ммоля), 4-(4-гідроксифеніл)піридин (61,0мг, 0,36ммоля) і PPh3 (132мг, 0,50ммоля), у ТГФ (5,0мл), при 25°С. Суміш перемішували при 25°С протягом 16год. Реакційну суміш концентрували при зниженому тиску й залишок очищали за допомогою експрес-хроматографії (від EtOAc до EtOAc:ТГФ, 4:1), одержуючи вказану в заголовку сполуку 1090 (70мг, вихід 46%). Приклад 9 (сполука 1091) 11-етил-5,11-дигідро-5-метил-8-{2-[4-(1-оксидо-4-піридиніл)фенокси]етил}-6H-дипіридо[3,2-b:2',3'е][1,4]діазетн-6-он Розчин, який містить 11-етил-5,11-дигідро-5-метил-8-{2-[4-(4-тридиніл)фенокси]етил}-6H-дипіридо[3,2b:2',3'-е][1,4]діазепін-6-он (45,0мг, 0,10ммоля) і МХПБК (37,0мг, 0,18ммоля) в СН2СI 2 (7мл), переміщували при 25°С протягом 2год. Суміш концентрували при зниженому тиску й залишок очищали за допомогою РХВР із оберненою фазою (колонка типу CombiPrep ADS-AQ 50´20мм, 5мкм, 120A, MeCN+0,10% ТФК/вода+0,10% ТФК), одержуючи вказану в заголовку сполуку 1091 (25мг, вихід 54%) у вигляді твердої речовини білого кольору. Приклад 10 (сполука 1093) 8-{2-[4-(2-аміно-4-тіазоліл)-2-метилфенокси]етил}-11-етил-5,11-дигідро-5-метил-6H-дипіридо[3,2-b:2',3'е][1,4]діазепін-6-он а) 4-(2-аміно-4-тіазоліл)-2-метилфенол Тіосечовину (79,8мг, 1,05ммоля) додавали до розчину 2-бром-1-(4-гідрокси-3-метилфеніл)етанону (200мг, 0,87ммоля) в 1,4-діоксані (15мл). Реакційну суміш перемішували при 25°С протягом 24год. Утворену суспензію фільтрували й твердий продукт промивали 1,4-діоксаном і сушили при зниженому тиску. Твердий продукт суспендували у воді (30мл), додавали буферний розчин з рН 7 (15мл) і суміш екстрагували ЕtOАс (3´50мл). Об'єднані органічні шари промивали послідовно водою (20мл) і соляним розчином (20мл), сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (гексан:EtOAc, 1:1), одержуючи вказану в заголовку сполуку (180мг, вихід 100%). б) 8-{2-[4-(2-Аміно-4-тіазоліл)-2-метилфенокси]етил}-11-етил-5,11-дигідро-5-метил-6H-дипіридо[3,2b:2',3'-e][1,4]діазепін-6-он ДЕАД (192мг, 1,10ммоля) додавали по краплях до охолодженого на льоді розчину, який містить 11етил-5,11-дигідро-8-(2-гідроксіетил)-5-метил-6H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-6-он (274мг, 0,92ммоля), 4-(2-аміно-4-тіазоліл)-2-метилфенол (190мг, 0,92ммоля) і PPh3 (289мг, 1,10ммоля) у ТГФ (10мл). Реакційну суміш перемішували при 25°С протягом 2год, потім концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (колонка типу CombiPrep ADS-AQ 50´20мм, 5мкм, 120A, MeCN+0,10% ТФК/вода+0,10% ТФК), одержуючи трифторацетат вказаної в заголовку сполуки 1093 (119мг, вихід 27%) у вигляді твердої речовини білого кольору. Приклад 11 (сполука 1094) 11-етил-5,11-дигідро-8-{2-[4-(1H-імідазол-4-іл)-2-метилфенокси]етил)-5-метил-6H-дипіридо[3,2-b:2',3'e][1,4]діазепін-6-он а) 2-метил-4-[1-(трифенілметил)-1H-імідазол-4-іл]фенол Розчин 2-бром-1-(4-гідрокси-3-метилфеніл)етанону (400мг, 1,75ммоля) у формаміді (10мл) перемішували при 190°С протягом 5год. Надлишок формаміду видаляли шляхом дистиляції при зниженому тиску. Залишок розчиняли в EtOAc (50мл) і утворений розчин промивали послідовно буферним розчином з рН 7,0 (10мл), водою (10мл) і соляним розчином (10мл), потім сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Розчин, який містить залишок, Et3N (0,88мг, 8,73ммоля) і трифенілметилхлорид (584мг, 2,10ммоля) у ДМФ (10мл), перемішували при 60°С протягом 3год. Реакційну суміш охолоджували до 25°С, підкисляли за допомогою 1,0н. водного розчину НСI і розбавляли EtOAc (200мл). Утворену суміш промивали послідовно водою (3´50мл) і соляним розчином (50мл), потім сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Залишок очищали за допомогою експресхроматографії (гексан:EtOAc, 1:1), одержуючи вказану в заголовку сполуку (514мг, вихід 71%). б) 11-етил-5,11-дигідро-8-{2-{2-метил-4-[1-(трифенілметил)-1H-імідазол-4-іл]фенокси}етил}-5-метил-6Hдипіридо[3,2-b:2',3'-е][1,4]діазепін-6-он ДЕАД (90,7мкл, 0,58ммоля) додавали по краплях до розчину, який містить 11-етил-5,11-дигідро-8-(2гідроксіетил)-5-метил-6H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-6-он (143мг, 0,48ммоля), 2-метил-4-[1(трифенілметил)-1H-імідазол-4-іл)]фенол (200мг, 0,48ммоля) і PPh3 (151мг, 0,58ммоля) у ТГФ (10мл), при 25°С. Після перемішування протягом 2год при 25°С, суміш концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (СН2СI 2:МеОН, 95:5), одержуючи вказану в заголовку сполуку (180мг, вихід 54%). в) 11-етил-5,11-дигідро-8-{2-[4-(1H-імідазол-4-іл)-2-метилфенокси]етил}-5-метил-6H-дипіридо[3,2-b:2',3'е][1,4]діазепін-6-он Розчин, який містить 11-етил-5,11-дигідро-8-{2-{2-метил-4-[1-(трифенілметил)-1H-імідазол-4іл]фенокси}етил}-5-метил-6H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-6-он (180мг, 0,26ммоля) і трифтороцтову кислоту (8,0мл) в СН2СІ 2 (8,0мл), перемішували при 25°С протягом 3год. Реакційну суміш концентрували при зниженому тиску. Залишок очищали за допомогою РХВР із оберненою фазою (колонка типу CombiPrep ADS-AQ 50´20мм, 5мкл, 120А, MeCN+0,10% ТФК/вода+0,10% ТФК), одержуючи трифторацетат вказаної в заголовку сполуки 1094 (82мг, вихід 70%) у вигляді твердої речовини білого кольору. Приклад 12 (сполука 1095) 11-етил-5,11-дигідро-5-метил-8-{2-[2-метил-4-(1-метил-1H-імідазол-4-іл)фенокси]етил}-6H-дипіридо[3,2b:2',3'-е][1,4]діазепін-6-он 60%-ну дисперсію NaH у маслі (10,5мг, 0,26ммоля) додавали до охолодженого на льоді розчину сполуки 1094 (54,5мг, 0,12ммоля) у ТГФ (3,0мл). Через 30хв додавали МеІ (37мг, 0,26ммоля) і суміш перемішували при 25°С протягом 2год. До реакційної суміші додавали декілька крапель АсОН. Суміш концентрували при зниженому тиску й очищали за допомогою РХВР із оберненою фазою (колонка типу CombiPrep ADS-AQ 50´20мм, 5мкм, 120А, MeCN+0,10% ТФК/вода+0,10% ТФК), одержуючи трифторацетат вказаної в заголовку сполуки 1095 (31мг, вихід 56%), який містив 31% ізомеру 1-метил-1Н-імідазол-5-ілу. Приклад 13 (сполука 1096) 11-етил-5,11-дигідро-8-{2-[4-(1H-імідазол-2-іл)-2-метилфенокси]етил}-5-метил-6H-дипіридо[3,2-b:2',3'е][1,4]діазепін-6-он a) 11-етил-8-[2-(4-форміл-2-метилфенокси)етил]-5,11-дигідро-5-метил-6H-дипіридо[3,2-b:2',3'e][1,4]діазепін-6-он Розчин ДІАД (395мкл, 2,15ммоля) у ТГФ (0,8мл) додавали по краплях до розчину, який містить 11-етил5,11-дигідро-8-(2-гідроксіетил)-5-метил-6H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-6-он (430мг, 1,44ммоля), 4гідрокси-3-метилбензальдегід (200мг, 1,47ммоля) і PPh3 (564мг, 2,15ммоля) у ТГФ (15мл), при 25°С. Суміш перемішували при 25°С протягом 16год. Реакційну суміш концентрували при зниженому тиску й залишок очищали за допомогою експрес-хроматографії (EtOAc:толуол, 1:3), одержуючи вказану в заголовку сполуку (385мг, вихід 64%). б) 11-етил-5,11-дигідро-8-{2-[4-(1H-імідазол-2-іл)-2-метилфенокси]етил}-5-метил-6H-дипіридо[3,2b:2',3'-е][1,4]діазепін-6-он Розчин, який містить 11-етил-8-[2-(4-форміл-2-метилфенокси)етил]-5,11-дигідро-5-метил-6Hдипіридо[3,2-b:2',3'-е][1,4]діазепін-6-он (107мг, 0,26ммоля), гліоксал (40мас.%, 0,20мл, 1,25ммоля), 15М водний розчин NH4OH (3,0мл) і NaOAc (84,0мг, 1,02ммоля) в МеОН (6,0мл), перемішували при 25°С протягом 21год. Додавали 1,0М водний розчин Na2CO3 і суміш екстрагували EtOAc (2´). Об'єднані органічні шари сушили (Na2SO4), фільтрували й концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (від EtOAc до EtOAc:ТГФ, 7:3), одержуючи вказану в заголовку сполуку 1096 (30мг, вихід 26%) у вигляді твердої речовини ясно-жовтого кольору. Приклад 14 (сполука 1097) 11-етил-5,11-дигідро-5-метил-8-{2-[2-метил-4-(1-метил-1Н-імідазол-2-іл)фенокси]етил}-6H-дипіридо[3,2b:2',3'-е][1,4]діазепін-6-он Суміш, яка містить 11-етил-5,11-дигідро-8-{2-[4-(1H-імідазол-2-іл)-2-метилфенокси]етил}-5-метил-6Hдипіридо[3,2-b:2',3'-е][1,4]діазепін-6-он (20,0мг, 0,04ммоля), 5М водний розчин NaOH (15мкл, 0,05ммоля) і МеІ (10мкл, 0,16ммоля) в MeCN (2,0мл), перемішували при 25°С протягом 1год. Суміш концентрували при зниженому тиску, зливали на воду й екстрагували EtOAc (2´). Об'єднані органічні шари сушили (Na2SO4), фільтрували й концентрували при зниженому тиску. Залишок очищали за допомогою РХВР із оберненою фазою (колонка типу CombiPrep ADS-AQ 50´20мм, 5мкм, 120A, MeCN+0,10% ТФК/вода+0,10% ТФК), одержуючи трифторацетат вказаної в заголовку сполуки 1097 (6,0мг, вихід 30%) у вигляді твердої речовини білого кольору. Приклад 15 (сполука 1098) 11-етил-5,11-дигідро-8-{2-[4-(1H-імідазол-1-іл)-2-метилфенокси]етил}-5-метил-6H-дипіридo[3,2-b:2',3'e][1,4]діазепін-6-он а) 8-[2-(4-Бром-2-метилфенокси)етил]-11-етил-5,11-дигідро-5-метил-6H-дипіридо[3,2-b:2',3'e][1,4]діазепін-6-он Розчин ДІАД (0,44мл, 2,40ммоля) у ТГФ (1,0мл) додавали по краплях до охолодженого на льоді розчину, який містить 11-етил-5,11-дигідро-8-(2-гідроксіетил)-5-метил-6H-дипіридо[3,2-b:2',3'-е][1,4]діазепін6-он (480мг, 1,61ммоля), 4-бром-2-метилфенол (318мг, 1,70ммоля) і PPh3 (629мг, 2,40ммоля) у ТГФ (20мл), при 25°С. Суміш перемішували при 0°С протягом 3год. Реакційну суміш концентрували при зниженому тиску й залишок очищали за допомогою експрес-хроматографії (гексан:EtOAc, 7:3), одержуючи вказану в заголовку сполуку (437мг, вихід 58%) у вигляді твердої речовини білого кольору. б) Етил-5,11-дигідро-8-{2-[4-(1H-імідазол-1-іл)-2-метилфенокси]етил}-5-метил-6H-дипіридо[3,2-b:2',3'е][1,4]діазепін-6-он Розчин, який містить 8-[2-(4-бром-2-метилфенокси)етил]-11-етил-5,11-дигідро-5-метил-6Hдипіридо[3,2-b:2',3'-е][1,4]діазепін-6-он (30мг, 0,06ммоля), імідазол (7,0мг, 0,10ммоля), CuBr (2мг, 0,014ммоля) і CsCO3 (23мг, 0,07ммоля) у нітробензолі (0,8мл), дегазували у вакуумі й в атмосфері аргону. Розчин нагрівали до 180°С і витримували протягом 36год. Суміш розбавляли СН2СI 2 і фільтрували. Утворений розчин промивали водою, сушили (Na2SO4), фільтрували й концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (від EtOAc до ТГФ:EtOAc, 1:3) і наступної РХВР із оберненою фазою (колонка типу CombiPrep ODS-AQ 50´20мм, 5мкм, 120A, MeCN+0,10% ТФК/вода+0,10% ТФК), одержуючи трифторацетат вказаної в заголовку сполуки 1098 (28мг, вихід 77%) у вигляді смоли жовтого кольору. Приклад 16 (сполука 1099) 11-етил-5,11-дигідро-5-метил-8-{2-[2-метил-4-(4-оксазоліл)фенокси]етил}-6H-дипіридо[3,2-b:2',3'e][1,4]діазепін-6-он а) 4-(4-оксазоліл)-2-метилфенол Розчин 2-бром-1-(4-гідрокси-3-метилфеніл)етанону (200мг, 0,87ммоля) у формаміді (10мл) нагрівали до 110°С протягом 24год. Надлишок формаміду видаляли шляхом дистиляції при зниженому тиску. Утворений залишок розподіляли між буферним розчином з рН 7,0 (10мл) і ЕtOАс (50мл). Органічний шар промивали водою (10мл) і соляним розчином (10мл), сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (гексан:EtOAc, 1:1), одержуючи вказану в заголовку сполуку (51мг, вихід 33%). б) 11-етил-5,11-дигідро-5-метил-8-{2-[2-метил-4-(4-оксазоліл)фенокси]етил}-6H-дипіридо[3,2-b:2',3'е][1,4]діазепін-6-он ДЕАД (51,0мг, 0,29ммоля) додавали по краплях до розчину, який містить 11-етил-5,11-дигідро-8-(2гідроксіетил)-5-метил-6H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-6-он (72,8мг, 0,24ммоля), 4-(4-оксазоліл)-2метилфенол (51,0мг, 0,29ммоля) і PPh3 (76,8мг, 0,29ммоля) у ТГФ (4мл), при 25°С. Після перемішування протягом 2год при 25°С, суміш концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (СН2СI 2:ацетон, 95:5), одержуючи вказану в заголовку сполуку 1099 (23,3мг, вихід 21%) у вигляді твердої речовини ясно-жовтого кольору. Приклад 17 (сполука 2001) 3'-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-e][1,4]діазепін-8-іл)етокси]-[1,1'біфеніл]-4-карбонова кислота а) Метил-3'-гідрокси-[1,1'-біфеніл]-4-карбоксилат 0,4М водний розчин Na2CO3 (21,7мл) додавали до розчину, який містить 3-бромфенол (50 мг, 2,89ммоля) і 4-борбензойну кислоту (480мг, 2,89ммоля) в MeCN (14,5мл). Суміш дегазували аргоном (10хв), потім додавали Pd(PPh3)4 (168мг, 0,14ммоля). Реакційну суміш нагрівали до 90°С протягом 12год. Охолоджену суміш підкисляли за допомогою 1н. водного розчину НСl й екстрагували EtOAc. Органічний шар промивали соляним розчином, сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Розчин залишку в Et2O (150мл) обробляли надлишком ефірного розчину CH2N2 (приблизно 0,6М), потім концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (гексан:EtOAc, 85:15), одержуючи вказану в заголовку сполуку (375мг, вихід 57%) у вигляді твердої речовини жовтого кольору. б) Метил 3'-[2-11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси][1,1'-біфеніл]-4-карбоксилат Розчин ДЕАД (84мкл, 0,54ммоля) у ТГФ (0,5мл) додавали протягом 2год до охолодженого на льоді розчину, який містить 11-етил-5,11-дигідро-8-(2-гідроксіетил)-5-метил-6H-дипіридо[3,2-b:2',3'-е][1,4]діазепін6-он (100мг, 0,34ммоля), метил-3'-гідрокси-[1,1'-біфеніл]-4-карбоксилат (123мг, 0,54ммоля) і PPh3 (141мг, 0,54ммоля) у ТГФ (3,4мл). Реакційну суміш перемішували при 25°С протягом 12год і концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (толуол:EtOAc, 85:15), одержуючи вказану в заголовку сполуку (74мг, вихід 43%) у вигляді смолоподібної твердої речовини білого кольору. в) 3'-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси]-[1,1'біфеніл]-4-карбонова кислота 1н. водний розчин NaOH (3,0мл, 3,00ммоля) додавали до розчину, який містить метил-3'-[2-(11-етил6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси]-[1,1'-біфеніл]-4-карбоксилат (74мг, 0,15ммоля), у суміші 2:1 ТГФ і МеОН (3,4мл). Суміш перемішували при 25°С протягом 2год. Утворений розчин підкисляли 1н. водним розчином НСl і суміш екстрагували EtOAc (3´). Об'єднані органічні шари промивали соляним розчином, сушили (MgSO4), фільтрували й концентрували при зниженому тиску, одержуючи вказану в заголовку сполуку 2001 (35мг, вихід 49%) у вигляді твердої речовини білого кольору. Приклад 18 (Сполука 3001) 4-{{4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси]-3метилбензоїл}аміно}бензойна кислота а) Метил 4-гідрокси-3-метилбензоат Розчин, який містить 4-гідрокси-3-метилбензойну кислоту (5,13г, 33,7ммоля) і 12н. водний розчин НСl (1,0мл) в МеОН (100мл), нагрівали до температури дефлегмації протягом 16год. Охолоджену реакційну суміш концентрували при зниженому тиску й залишок розчиняли в EtOAc. Утворений розчин промивали насиченим водним розчином NaHCO3 і соляним розчином, сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Залишок розтирали із сумішшю гексан:EtOAc (9:1), одержуючи вказану в заголовку сполуку (4,70г, вихід 84%) у вигляді твердої речовини бежевого кольору. б) Метил 4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)стокси]-3метилбензоат Розчин ДІАД (250мкл, 1,27ммоля) у ТГФ (1мл) додавали по краплях до розчину, який містить 11-етил5,11-дигідро-8-(2-гідроксіетил)-5-метил-6H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-6-он (346мг, 1,16ммоля), метил-4-гідрокси-3-метилбензоат (212мг, 1,27ммоля) і PPh3 (333мг, 1,27ммоля), у ТГФ (5мл), при 25°С. Реакційну суміш перемішували при 25°С протягом 1год. Суміш концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (гексан:EtOAc, 1:1), одержуючи вказану в заголовку сполуку (471мг, вихід 91%) у вигляді твердої речовини білого кольору. в) 4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси]-3метилбензойна кислота Розчин, який містить метил-4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'е][1,4]діазепін-8-іл)етокси]-3-метилбензоат (471мг, 1,05ммоля) і 1н. водний розчин NaOH (5,0мл, 5,0ммоля) в МеОН (10мл) і ТГФ (5мл), нагрівали до 50°С протягом 5год. До охолодженої реакційної суміші додавали 1н. водний розчин НСl (6мл). Утворену суспензію фільтрували й твердий продукт промивали водою й сушили, одержуючи вказану в заголовку сполуку (382мг, вихід 83%) у вигляді твердої речовини білого кольору. г) 4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-e][1,4]діазепін-8-іл)етокси]-3метилбензоїлхлорид (СОСl)2 (25мкл, 0,87ммоля) і ДМФ (10мкл) додавали до розчину, який містить 4-[2-(11-етил-6,11дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси]-3-метилбензойну кислоту (52,8мг, 0,12ммоля) в СН2СI 2 (5мл). Реакційну суміш нагрівали до температури дефлегмації протягом 1год. Охолоджену суміш концентрували при зниженому тиску, одержуючи вказану в заголовку сполуку (55мг, вихід 100%), яку використовували без подальшого очищення. д) Метил-4-{{4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8іл)етокси]-3-метилбензоїл}аміно}бензоат Розчин, який містить 4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8іл)етокси]-3-метилбензоїлхлорид (47,0мг, 0,11ммоля), метил-4-амінобензоат (15,8мг, 0,11ммоля) і Et3N (15,3мкл, 0,11ммоля) в СН2СI 2 (4мл), перемішували при 25°С протягом 5год. Реакційну суміш розбавляли EtOAc і утворений розчин промивали послідовно насиченим водним розчином NaHCO3 і соляним розчином, сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (гексан:EtOAc, 1:1), одержуючи вказану в заголовку сполуку (45мг, вихід 76%) у вигляді твердої речовини білого кольору. e) 4-{{4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси]-3метилбензоїл}аміно}бензойна кислота Суміш, яка містить метил-4-{{4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'е][1,4]діазепін-8-іл)етокси]-3-метилбензоїл}аміно}бензоат (43,0мг, 0,076ммоля) і 1н. водний розчин NaOH (0,5мл, 0,5ммоля) в MeCN (4мл) і воді (0,2мл), перемішували при 25°С протягом 48год. Реакційну суміш концентрували при зниженому тиску й водну фазу, що залишилася, підкисляли 1н. водним розчином НСl. Утворену суспензію фільтрували й твердий продукт, що виділився, сушили, одержуючи вказану в заголовку сполуку 3001 (22мг). Відповідну натрієву сіль одержували шляхом обробки 1н. водним розчином NaOH (18мг, вихід 42%) у вигляді твердої речовини білого кольору. Приклад 19 (Сполука 3004) 4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси]-3-метил-N(1-оксидо-4-піридиніл)бензамід а) 4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4] діазепін-8-іл)етокси]-3-метилN-(4-піридиніл)бензамід Розчин, який містить 4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8 іл)етокси]-3-метилбензоїлхлорид (47,4мг, 0,11ммоля), 4-амінопіридин (9,88мг, 0,11ммоля) і Et3N (15,3мкл,0,11ммоля) в СН2Сl2 (4мл), перемішували при 25°С протягом 5год. Реакційну суміш розбавляли EtOAc і утворений розчин промивали послідовно насиченим водним розчином NaHCO3 і соляним розчином, сушили (MgSO4), фільтрували й концентрували при зниженому тиску, одержуючи вказану в заголовку сполуку (58мг, вихід 100%) у вигляді безбарвного масла. б) 4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси]-3-метилN-(1-оксидо-4-піридиніл)бензамід Розчин, який містить 4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8іл)етокси]-3-метил-N-(4-піридиніл)бензамід (52,0мг, 0,10ммоля) і 80% МХПБК (35мг, 0,16ммоля) в СН2СI 2 (4мл), перемішували при 25°С протягом 4год. Додавали насичений водний розчин NaHCO3 і розділяли фази. Органічний шар сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Залишок очищали за допомогою РХВР із оберненою фазою (колонка типу CombiPrep ODS-AQ 50´20мм, 5мкм, 120А) з використанням градієнта суміші MeCN/вода, що містить ТФК (0,06%), одержуючи вказану в заголовку сполуку 3004 (19мг, вихід 36%) у вигляді твердої речовини білого кольору. Приклад 20 (Сполука 3022) 4-{{4-[2-(11-етил-6,11-дигідіро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)стокси]-3метилфеніл}аміно}бензойна кислота а) 1,1-Диметилетил N-{4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-e][1,4]діазепін8-іл)стокси]-3-метилфеніл}карбамат Розчин ДІАД (258мкл, 1,31ммоля) у ТГΦ (4мл) додавали протягом 2год до розчину, який містить 11етил-5,11-Дигідро-8-(2-гідроксіетил)-5-метил-6H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-6-он (300мг, 1,01ммоля), 1,1-диметилетил N-(4-гідрокси-3-метилфеніл)карбамат (225мг, 1,01ммоля) і PPh3 (343мг, 1,31ммоля) у ТГФ (12мл), при 25°С. Реакційну суміш перемішували при 25°С протягом 1год. Суміш концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (гексан:EtOAc, від 7:3 до 1:1), одержуючи вказану в заголовку сполуку (230мг, вихід 45%) у вигляді твердої речовини білого кольору. б) 11-етил-5,11-дигідро-8-[2-(4-аміно-2-метилфенокси)етил]-5-метил-6H-дипіридо[3,2-b:2',3'е][1,4]діазепін-6-он Суміш, яка містить 1,1-диметилетил N-{4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2b:2',3'-е][1,4]діазепін-8-іл)етокси]-3-метилфеніл}карбамат (540мг, 1,07ммоля) і 4н. НСl в 1,4-діоксані (5,0мл, 20ммолів), перемішували при 25°С протягом 2год. Реакційну суміш концентрували при зниженому тиску. Залишок розчиняли у воді (6мл) і утворений розчин промивали EtOAc. Водний шар підлуговували (рН 9) за допомогою 2н. водного розчину NaOH і суміш екстрагували ЕtOАс. Органічний шар сушили (MgSO4), фільтрували й концентрували при зниженому тиску, одержуючи вказану в заголовку сполуку (398мг, вихід 92%) у вигляді піни бежевого кольору. в) Етил 4-{{4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси]3-метилфеніл}аміно}бензоат Дегазовану суміш, яка містить 11-етил-5,11-дигідро-8-[2-(4-аміно-2-метилфенокси)етил]-5-метил-6Hдипіридо[3,2-b:2',3'-е][1,4]діазепін-6-он (100мг, 0,25ммоля), етил-4-бромбензоат (61,0мкл, 0,37ммоля), третВuОNa (36,0мг, 0,37ммоля), Pd2(dba)3 (2,5мг, 2,7мкмоля) і (+/-)-BINAP (5,0мг, 8,0мкмолів) у толуолі (8мл), нагрівали до 105°С в атмосфері азоту протягом 48год. Охолоджену реакційну суміш розбавляли EtOAc, фільтрували через невелику пробку з діатомової землі й концентрували при зниженому таску. Залишок очищали за допомогою експрес-хроматографії (гексан:EtOAc, 1:1), одержуючи вказану в заголовку сполуку (55мг, вихід 40%) у вигляді твердої речовини білого кольору. г) 4-{{4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси]-3метилфеніл}аміно}бензойна кислота Розчин, який містить етил-4-{{4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'е][1,4]діазепін-8-іл)етокси]-3-метилфеніл}аміно}бензоат (55,0мг, 0,10ммоля) і 1н. водний розчин LiOH (1,0мл, 1,0ммоль) у ТГФ (3мл) і МеОН (1мл), перемішували при 25°С протягом 18год. Реакційну суміш підкисляли (рН 6,5) за допомогою 1н. водного розчину НСl й екстрагували EtOAc (2´). Об'єднані органічні шари сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Залишок очищали за допомогою РХВР із оберненою фазою (колонка типу CombiPrep ODS-AQ 50´20мм, 5мкм, 120А) з використанням градієнта суміші MeCN/вода, що містить ТФК (0,06%). Утворений твердий продукт (трифторацетат) розчиняли в EtOAc і розчин екстрагували 1,0н. водним розчином НСl (2´). Значення рН об'єднаних водних шарів доводили до 6,0-6,5 за допомогою 1н. водного розчину NaOH і утворений розчин екстрагували EtOAc (2´). Об'єднані органічні шари сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Залишок (17мг, 32мкмоля) суспендували в MeCN (3мл), додавали 0,02н. водний розчин NaOH (1,62мл, 32мкмоля) і суміш опромінювали ультразвуком до одержання гомогенного розчину. Розчин заморожували й ліофілізували, одержуючи натрієву сіль вказаної в заголовку сполуки 3022 (15мг, вихід 29%) у вигляді твердої речовини білого кольору. Приклад 21 (Сполука 4011) Гідразид 4-[2-(11-етил-6Л 1-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-e][1,4] діазепін-8-іл)стокси]-3метилбензойної кислоти Розчин, який містить метил-4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'е][1,4]діазепін-8-іл)етокси]-3-метилбензоат (55,0мг, 0,12ммоля) і гідразин (130мкл, 4,14ммоля) в EtOН (10мл), нагрівали до температури дефлегмації протягом 16год. Реакційну суміш концентрували при зниженому тиску. Залишок очищали за допомогою РХВР із оберненою фазою (колонка типу CombiPrep ODS-AQ 50´20мм, 5мкм, 120А) з використанням градієнта суміші MeCN/вода, що містить ТФК (0,06%), одержуючи вказану в заголовку сполуку 4011 (23мг, вихід 42%) у вигляді трифторацетату. Приклад 22 (Сполука 4013) 4-[2-(11-етил-6,11-дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси]-3-метил-N(метилсульфонил)бензамід 1,0М розчин ДЦК в СН2СI 2 (0,25мл, 0,25ммоля) додавали до суміші, яка містить 4-[2-(11-етил-6,11дигідро-5-метил-6-оксо-5H-дипіридо[3,2-b:2',3'-е][1,4]діазепін-8-іл)етокси]-3-метилбензойну кислоту (50,0мг, 0,11ммоля), ДМАП (24мг, 0,19ммоля) і MeSO2NH2 (55мг, 0,58ммоля) у ТГФ (5мл). Після перемішування при 25°С протягом 72год, реакційну суміш підкисляли 1н. водним розчином НСl й екстрагували EtOAc. Органічний шар промивали соляним розчином, сушили (MgSO4), фільтрували й концентрували при зниженому тиску. Залишок очищали за допомогою експрес-хроматографії (суміш EtOAc:гексан, від 50% до 100% , що містить 1% АсОН), одержуючи вказану в заголовку сполуку 4013 (25мг, вихід 42%). Аналізи з використанням зворотної транскриптази (ЗТ) Методи аналізу описані в [WO 01/96338], зміст якого включений в даний опис як посилання. Результати наведені в таблиці 5 у вигляді значень IC50(hM) і ЕС50(нМ). Написи в таблиці: ІС50: А = >100нМ; В = 100-50нМ; С = 50нМ; В = 50-10нМ; С =
ДивитисяДодаткова інформація
Назва патенту англійськоюNon-nucleoside reverse transcriptase inhibitors and use thereof
Назва патенту російськоюНенуклеозидные ингибиторы обратной транскриптазы и их использование
Автори російськоюLandry, Serge, Naud, Julie
МПК / Мітки
МПК: A61P 43/00, C07D 471/14, A61P 31/18, A61K 31/551
Мітки: інгібітори, ненуклеозидні, застосування, зворотної, транскриптази
Код посилання
<a href="https://ua.patents.su/32-79285-nenukleozidni-ingibitori-zvorotno-transkriptazi-ta-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Ненуклеозидні інгібітори зворотної транскриптази та їх застосування</a>
Попередній патент: Похідні ациламінобензолу як селективні інгібітори моноаміноксидази b
Наступний патент: Пристрій для вивчення окоміру
Випадковий патент: Спосіб утилізації червоного шламу і феросплавного газу












