Спосіб одержання водорозчинної лікарської форми антибіотика з групи рифаміцинів
Номер патенту: 108527
Опубліковано: 12.05.2015
Автори: Ванчугова Людміла Вітальєвна, Шіпуло Єлєна Владіміровна, Гєльпєріна Свєтлана Еммануіловна, Максімєнко Ольга Олєговна, Ігнатьєв Алєксєй Владіміровіч, Бабій Владімір Євстахієвіч
Формула / Реферат
Спосіб одержання водорозчинної лікарської форми антибіотика з групи рифаміцинів, солюбілізованого альбуміном до порошку-ліофілізата, що включає:
а) розчинення антибіотика з групи рифаміцинів, яка включає рифабутин, рифампіцин, рифапентин і рифаксимін і їх фармацевтично прийнятні похідні, в органічному розчиннику, вибраному з групи розчинників, що змішуються з водою, яка включає ацетон, етанол та ізопропанол;
б) додавання до розчину, отриманого на стадії а), водного розчину альбуміну, отриманого розчиненням 1-10 % м/о альбуміну в стерилізованій демінералізованій воді;
в) перемішування отриманої суміші;
г) фільтрацію;
д) додавання кріопротектора;
е) заморожування;
ж) висушування ліофільне або розпилювальне.
Текст
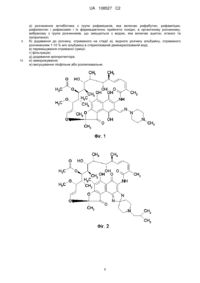
Реферат: Винахід належить до галузі медицини, фармації, нанотехнології та колоїдної хімії, зокрема до способу одержання водорозчинної лікарської форми антибіотика з групи рифаміцинів, що включає: а) розчинення антибіотика з групи рифаміцинів в органічному розчиннику, вибраному з групи розчинників, що змішуються з водою (ацетон, етанол, ізопропанол); б) додавання до розчину, отриманого на стадії а), водного розчину альбуміну, отриманого розчиненням 1-10 % м/о альбуміну в стерилізованій демінералізованій воді; в) перемішування отриманої суміші; г) фільтрацію; д) додавання кріопротектора; е) заморожування; ж) висушування ліофільне або розпилювальне. UA 108527 C2 (12) UA 108527 C2 UA 108527 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки Даний винахід відноситься до галузі медицини, фармації, нанотехнології та колоїдної хімії, зокрема до способу одержання водорозчинної лікарської форми (фармацевтичної композиції) антибіотика з групи рифаміцинів, такого як рифабутин, рифампіцин, рифапентин, рифаксимін і їх фармацевтично прийнятних похідних для лікування туберкульозу. Рівень техніки та завдання винаходу В останні десятиліття проблема підвищення ефективності лікування туберкульозу та інших мікобактеріозів набула особливої актуальності у зв'язку з підвищенням рівня захворюваності в усьому світі і, зокрема, в Росії. У зв'язку з поширенням ВІЛ-інфекції виділилася група хворих з підвищеним ризиком розвитку як туберкульозу, так і нетуберкульозних мікобактеріозів, що характеризуються важким дисемінованим перебігом захворювання. Фатальний імунодефіцит у ВІЛ-інфікованих хворих, а також вторинний імунодефіцит у хворих на туберкульоз на тлі полірезистентності збудника викликають серйозні труднощі в лікуванні туберкульозу. Найбільш перспективним шляхом підвищення ефективності лікування туберкульозу та інших мікобактеріозів (наприклад, прокази, що також являє собою дуже актуальну проблему для країн, що розвиваються) виявилося створення принципово нових протитуберкульозних препаратів шляхом скринінгу нових природних молекул або хімічної модифікації відомих структур. Однак їхня дієвість обмежена в часі внаслідок безперервності процесу виникнення та поширення резистентності до нових препаратів. Проте створення наприкінці 80-х років нового напівсинтетичного антибіотика широкого спектра дії з групи рифаміцинів - рифабутину - стало важливим досягненням фармацевтичної хімії (Цибанев А.А., Соколова Г.Б. Противотуберкулезний антибиотик пролонгированного действия - рифабутин. Антимикробний спектр, особенности фармакодинамики и фармакокинетики. - Антибиотики и химиотерапия, 1999; 44(8), стр. 30-36). Рифаміцини - група напівсинтетичних антибіотиків, утворених променистими грибками роду Streptomyces, а також їхні напівсинтетичні похідні. Один з перших антибіотиків даної групи, рифампіцин (фіг. 1), що являє собою напівсинтетичну похідну рифаміцину SV, має широкий спектр антибактеріальної дії і хорошу розчинність. Рифампіцин швидко всмоктується при внутрім'язовому введенні; максимум концентрації в плазмі крові досягається через 30 хв, терапевтична концентрація зберігається протягом 6-8 г. Оскільки рифампіцин є розчинним у воді, відома його лікарська форма у вигляді розчину для ін'єкцій, одержувана шляхом розчинення 0,15 г рифампіцину в 2,5 мл стерильної води для ін'єкцій, енергійного струшування ампули з порошком до повного розчинення та розведення отриманого розчину в 125 мл 5 % розчину глюкози; зазначений розчин вводять пацієнту внутрішньовенно крапельно, зі швидкістю 60-80 крапель за хвилину. В той же час, при повторному застосуванні даного антибіотика можливий дуже швидкий розвиток резистентності до нього мікроорганізмів, у зв'язку з чим були запропоновані нові антибіотики даної групи, зокрема рифабутин, який за хімічною структурою являє собою дезоксо3,4 - [2-спіро [N-ізобутил-4-піпераїдил] 2, дигідро-1Н-імідазол] (фіг. 2). За спектром і механізмом дії рифабутин схожий з рифампіцином (препарат пригнічує синтез РНК шляхом утворення комплексу з ДНК-залежною РНК-полімеразою), однак істотно перевершує його за фармакодинамічними та фармакокінетичними властивостями. Актуальним залишається завдання розробки розчинної лікарської форми рифабутину, придатної для внутрішньовенного введення пацієнту, який цього потребує, (при її розчиненні у відповідному фармацевтично прийнятному носії), при цьому малотоксичної і такої, що має ефективність, не меншу, ніж традиційні пероральні форми даного антибіотика. Дана проблема актуальна і стосовно інших напівсинтетичних антибіотиків даної групи рифапентину (фіг. 3) і рифаксиміну (фіг. 4), що також пов'язано з їхньою низькою розчинністю у водному середовищі. З рівня техніки відомий спосіб одержання придатної для внутрішньовенного введення експериментальним тваринам лікарської форми рифапентину, що включає в себе: розчинення рифапентину в 0,1М NaHCO3, що містить 10 % N, N-диметилформаміду та 0,001М аскорбінової кислоти, з наступним доведенням рН розчину до 8.5-8.6 шляхом додавання 1н. NaOH; отримана таким чином лікарська форма рифапентину була придатною для внутрішньовенного введення експериментальним тваринам у дозі 3 мг/кг маси тіла та 10 мг/кг маси тіла (Assandri A., Ratti B., Cristina T. Pharmacokinetics of rifapentine, a new long lasting rifamycin, in the rat, the mouse and the rabbit. - The Journal of Antibiotics, Sept.1984, стор.1067). В той же час, дані про можливу канцерогеність (здатність викликати розвиток ракових новоутворень) і тератогеність (здатність викликати розвиток уроджених каліцтв плода) диметилформаміду, використовуваного, відповідно до роботи Assandri A., Ratti B, для 1 UA 108527 C2 5 10 15 20 25 30 35 40 45 50 55 60 розчинення антибіотика, унеможливлюють створення подібних розчинних форм антибіотиків рифаміцинового ряду, придатних для внутрішньовенного введення пацієнту (людині), що потребує цього, з використанням зазначеної методики. З Євразійського патенту (ЕА 012121 В1, опублікований 28.08.2009), заявника даної заявки, відома фармацевтична композиція для лікування туберкульозу та захворювань, опосередкованих Helicobacter pilory, на основі полімерних частинок розміром 100-800 нм (наночастинок), що містять антибіотик рифабутин у терапевтично ефективній кількості та допоміжні речовини, придатна для внутрішньовенного введення пацієнту, що потребує цього, при цьому як допоміжні речовини використовують полімер(и) молочної кислоти (PLA) і/або співполімер(и) молочної та гліколевої кислот (PLGA), при вмісті гліколевої кислоти в співполімерах до 50 моль. % з додатковою карбоксильною групою або без додаткової карбоксильної групи на кінці молекули або співполімери полімерів молочної кислоти або співполімерів молочної або гліколевої кислоти з поліетиленгліколем; при цьому молекулярна маса полімерів і співполімерів становить від 2 до 200 кДа, причому композиція являє собою ліофілізат, який при додаванні води або фізіологічного розчину утворює стійку суспензію з розміром частинок 0,1- 0,8 мкм. Зазначена композиція додатково містить водорозчинний природний або синтетичний полімерний стабілізатор з молекулярною масою не більше 70 кДа і, у разі необхідності, пластифікатор ліпідної природи та наповнювачі при певному кількісному співвідношенні компонентів. Однак недоліком наносомальної лікарської форми рифабутину на основі полілактидів є те, що згадана лікарська форма при тривалому внутрішньовенному введенні може проявляти токсичність, причому дана токсичність обумовлена не самим рифабутином, а саме високою концентрацією полімеру (PLGA або PLA), який біодеградує і міститься в наночастинках, що обмежує можливість подальшої розробки та клінічного застосування таких наночастинок. Як найближчий аналог рішення, що заявляється, можна назвати спосіб одержання порошку (ліофілізату) наносомального рифабутину, солюбілізованого альбуміном, розкритий у Євразійському патенті (ЕА 013569 В1, кл. А61К 31/438, опублікований 30.06.2010), де водну суміш рифабутину, альбуміну та органічного розчинника при температурі від 0 до +40 °C диспергують, піддають гомогенізації високим тиском з одержанням наноемульсії, видаляють з отриманої наноемульсії органічний розчинник, фільтрують, додають кріопротектор, заморожують і ліофілізують, причому зазначену водну суміш рифабутину та альбуміну одержують шляхом розчинення 2-5 % (м/о) альбуміну в демінералізованій воді з наступним додаванням до зазначеного розчину альбуміну 2-5 % (о/о) органічного розчинника та рифабутину в кількості від 0,2 до 20,0 мас. %. В згаданому аналогу розкрита також фармацевтична композиція для лікування туберкульозу та захворювань, опосередкованих Helicobacter pylori, що являє собою порошок (ліофілізат) рифабутину, солюбілізованого альбуміном, отриманий зазначеним способом і який характеризується середнім розміром частинок від 4 до 10 нм, а при додаванні фармацевтично прийнятного розріджувача або носія - придатний для внутрішньовенного введення пацієнту, який цього потребує, стійкий розчин, що характеризується середнім розміром частинок від 4 до 10 нм. Незважаючи на властиві даній розчинній (внутрішньовенній) формі рифабутину достоїнства (порівняльна простота одержання даної форми та висока ефективність у лікуванні гострої мікобактеріальної інфекції), в синтезі даної лікарської форми використовуються високотоксичні хлорорганічні розчинники, такі як хлористий метилен (пункти 2,3,6 формули і приклади 1-2); крім того, одержання зазначеної розчинної форми пов'язано з необхідністю здійснення гомогенізації (переважно з використанням гомогенізатора високого тиску), що також ускладнює технологію синтезу даної форми та збільшує його собівартість. Завданням, на вирішення якого спрямоване рішення, що заявляється, є спрощення технології одержання фармацевтичної композиції антибіотика з групи рифаміцинів, а також виключення високотоксичних хлорорганічних розчинників, що не змішуються з водою. Суть винаходу Технічне рішення, що заявляється, спрямоване на одержання фармацевтичної композиції антибіотика з групи рифаміцинів, придатних для парентерального (внутрішньовенного) введення пацієнту, який цього потребує. Згадана композиція отримана способом, що включає: а) розчинення антибіотика з групи рифаміцинів в органічному розчиннику, вибраному з групи розчинників, що змішуються з водою; б) додавання до розчину, отриманого на стадії а), водного розчину альбуміну, отриманого розчиненням 1-10 % м/о альбуміну в стерилізованій демінералізованій воді; 2 UA 108527 C2 5 10 15 20 25 30 35 40 45 50 55 60 в) перемішування отриманої суміші; г) фільтрацію; д) додавання кріопротектора; е) заморожування; ж) висушування (ліофільне або розпилювальне). Згаданий спосіб здійснюють наступним чином: розчиняють антибіотик, вибраний з групи рифаміцинів, в органічному розчиннику, вибраному з групи розчинників, що змішуються з водою, наприклад ацетон, ізопропанол, етанол. Далі отриманий розчин додають до водного розчину людського сироваткового альбуміну та перемішують, переважно, на мішалці до повного видалення органічного розчинника, при швидкості перемішування 300-400 об/хв., або ж видаляють органічний розчинник відгоном при зниженому тиску (за допомогою роторного випарника). Отриману суспензію фільтрують крізь скляний фільтр (пор 1), додають кріопротектор, переважно, вибраний з 1-5 % маніту, 1-5 % глюкози, 1-5 % лактози або 1-5 % трегалози; заморожують (при температурі -60-70 °C) і ліофілізують (або висушують за допомогою розпилювального сушіння). Порошок-ліофілізат при ресуспендуванні в попередньому об'ємі характеризується середнім розміром частинок 100-800 нм, а при розведенні в 100 разів - 5-80 нм (визначено методом динамічного світлорозсіювання, за допомогою аналізатора Malvern Zetasizer Nano ZS). В межах даного винаходу пропонується фармацевтична композиція для лікування туберкульозу та захворювань, обумовлених персистуванням в організмі пацієнта Helicobacter pylori. Згадана фармацевтична композиція являє собою порошок (ліофілізат) антибіотика з групи рифаміцинів, солюбілізованого альбуміном, а при додаванні фармацевтично прийнятного розріджувача та/або носія, де прийнятний розріджувач або носій являє собою, наприклад, 0,9 % розчин NaCl або додатково містить 0,1-0,3 % аскорбінової кислоти, придатна для внутрішньовенного введення пацієнту, який цього потребує, і являє собою стійку суспензію, при цьому зазначений ліофілізат і зазначена суспензія характеризуються середнім розміром частинок 200-800 нм, а при розведенні в 100 разів - 5-80 нм, причому зазначений ліофілізат одержують способом, що заявляється у відповідності з даним винаходом. Наведені нижче приклади призначені для ілюстрації винаходу, що заявляється, а не для обмеження обсягу претензій, і розкривають одержання водорозчинної лікарської форми антибіотиків з групи рифаміцинів (включаючи рифампіцин, рифабутин, рифапентин і рифаксимін) пропонованим в межах винаходу, що заявляється, способом, а також застосування зазначених водорозчинних лікарських форм для лікування мікобактеріозів (на прикладі гострої мікобактеріальної інфекції, обумовленої внутрішньовенним введенням тваринам суспензії мікобактерій). ПРИКЛАД 1 140 мг рифабутину (Rb) розчиняють в 1,7 мл ацетону і додають до 100 мл 3 % водного розчину людського сироваткового альбуміну. Перемішують на магнітній мішалці до повного видалення органічного розчинника, при швидкості перемішування 300-400 об/хв., або ж видаляють органічний розчинник відгоном при зниженому тиску (за допомогою роторного випарника); фільтрують крізь скляний фільтр (пор 1), додають кріопротектор (3 % трегалозу), заморожують (при температурі -60-70 °C) і ліофілізують (або висушують за допомогою розпилювального сушіння). Отриманий порошок-ліофілізат при ресуспендуванні в попередньому обсязі характеризується середнім розміром частинок 100-800 нм, а при розведенні в 100 разів - 5-80 нм (визначено методом динамічного світлорозсіювання, за допомогою аналізатора Malvern Zetasizer Nano ZS). ПРИКЛАД 2 100 мг рифапентину (Rp) розчиняють в 2,5 мл ізопропанолу і додають до 100 мл 5 % водного розчину людського сироваткового альбуміну. Перемішують на магнітній мішалці до повного видалення органічного розчинника, при швидкості перемішування 300-400 об/хв., або ж видаляють органічний розчинник відгоном при зниженому тиску (за допомогою роторного випарника); фільтрують крізь скляний фільтр (пор 1), додають кріопротектор (5 % маніт), заморожують (при температурі -60-70 °C) і ліофілізують (або висушують за допомогою розпилювального сушіння). Отриманий порошок-ліофілізат при ресуспендуванні в попередньому обсязі характеризується середнім розміром частинок 100-800 нм, а при розведенні в 100 разів - 5-80 нм (визначено методом динамічного світлорозсіювання, за допомогою аналізатора Malvern Zetasizer Nano ZS). ПРИКЛАД 3 130 мг рифаксиміну (Rx) розчиняють в 2,0 мл етанолу і додають до 100 мл 4 % водного розчину людського сироваткового альбуміну. Перемішують на магнітній мішалці до повного 3 UA 108527 C2 5 10 видалення органічного розчинника, при швидкості перемішування 300-400 об/хв., або ж видаляють органічний розчинник відгоном при зниженому тиску (за допомогою роторного випарника); фільтрують крізь скляний фільтр (пор 1), додають кріопротектор (3 % маніт), заморожують (при температурі -60-70 °C) і ліофілізують (або висушують за допомогою розпилювального сушіння). Отриманий порошок-ліофілізат при ресуспендуванні в попередньому обсязі характеризується середнім розміром частинок 100-800 нм, а при розведенні в 100 разів - 5-80 нм (визначено методом динамічного світлорозсіювання, за допомогою аналізатора Malvern Zetasizer Nano ZS). Характеристики отриманих зразків (включаючи вид використаного органічного розчинника, спосіб його видалення з лікарської форми, кількісний вміст лікарської речовини (антибіотика) в кожному зразку, а також розміри частинок до розведення та після розведення) наведені в Таблиці 1. Таблиця 1 Характеристики композицій (наночастинок) рифабутину, рифапентину та рифаксиміну, отриманих відповідно до Прикладів 1-4 № п/п 2 1 Rb 2 2 Rb 3 3 Rp 4 Rx 1 15 20 25 30 1 ЛВ 4 Розчинник Кріопротектор Трегалоза, 1 мас. % в розрахунку на об'єм фільтрату Трегалоза, 5 мас. % в розрахунку на об'єм фільтрату Етанол Етанол Маніт, 3 мас. % в Ізопропанол розрахунку на об'єм фільтрату Маніт, 5 мас. % в розрахунку на об'єм фільтрату Ацетон 2 Середній діаметр наночастинок (Z-Ave D), нм 358,6±4,676 нм Індекс полідисперсності (PDI) 0.204±0.028 Розведення в 100 разів: Розведення в 100 разів: 17.20±0.729 нм 0.664±0.028 395,8±4,981 нм 0.216±0.007 Розведення в 100 разів: Розведення в 100 разів: 34.28±17.76 нм 0.415±0.123 748.8±29.81 нм 0.500±0.076 Розведення в 100 разів: Розведення в 100 разів: 22.72±4.770 нм 0.567±0.131 601,4±43,92 нм 0.451±0.039 Розведення в 100 разів: Розведення в 100 разів: 23.02±6.016 нм 0.576±0.077 3 4 Лікарська речовина; Рифабутин; Рифапентин; Рифаксимін ПРИКЛАД 4. Експериментальні тварини: лінійні миші Balb/c, самиці, вік 7-8 тижнів, вага 20-22 г. В кожній експериментальній групі 10 тварин. Зразки органів для висіву: легені (Л) і селезінка (С) мишей. 6 Зараження: внутрішньовенне введення в бічну хвостову вену, доза - 5×10 КУО Mycobacterium tuberculosis штаму H37Rv. Використовували стоковий запас штаму Mycobacterium tuberculosis H37Rv, що зберігається при -70 °С. Антибіотики: рифабутин (субстанція) і внутрішньовенна форма за винаходом (рифабутин в/в - 687), готували не більш ніж за годину до початку терапії відповідно до паспортних рекомендацій. Для приготування розчину рифабутину, 10 мг субстанції розтирали в ступці, додавали 4 мл стерильної дистильованої води і розчиняли тривалим пипетуванням до кінцевої концентрації 2,5 мг/мл. Внутрішньовенну форму (рифабутин в/в - 687) розводили водою до кінцевої концентрації 2,5 мг/мл. Тривалість терапії склала 4 тижні. Лікування почали на 7 день після зараження. Препарати вводили тваринам експериментальних груп протягом 4-х тижнів 3 рази на тиждень (понеділок, середа, п'ятниця) в/в в об'ємі 0,2 мл у бічну хвостову вену в наступних дозах: 500, 100 і 20 мкг/миша. Мишам контрольної групи вводили по 0,2 мл фізіологічного розчину. Евтаназію тварин проводили наступного дня після закінчення лікування. Десятикратні розведення гомогенатів органів (легені і селезінка) висівали на середовище Мідлбрук 7H11 агар. Підрахунок КУО (колонієутворюючі одиниці) проводився через 21 день після посіву. 4 UA 108527 C2 5 При виконанні експерименту були отримані результати, представлені на фіг. 5, що ілюструє залежність ефективності лікування туберкульозу від форми, дози та способу введення антибіотика рифабутину, де на осі ординат показані Lg10 КУО M.tuberculosis при висівах з органів мишей, на осі абсцис показані використовувані для лікування дози, дані також наведені таблицях 2 і 2а. Таблиця 2 Середні значення десяткових логарифмів КУО з довірчими інтервалами, отриманими з легенів і селезінки мишей (графічні дані представлені на фіг. 5) Орган Препарат Субстанція рифабутину (per os) Легені Форма в/в (в/в.) Субстанція рифабутину (per Селезінка os) Форма в/в (в/в.) 500 мкг/миша 100 мкг/миша 20 мкг/миша Контроль 0,0 3,2±0,01 * 3,4±0,01 0,0 0,0 0,0 3,7±0,01 4,2±0,07 3,4±0,17 2,8±0,01 0,0 * 0,0 4,6±0,15 3,7±0,01 *- достовірна відмінність від значень КУО субстанції рифабутину при P>0,05 10 15 Результати експерименту показали, що при лікуванні експериментальної гострої туберкульозної інфекції мишей внутрішньовенна форма рифабутину (рифабутин 687) була ефективніша, ніж субстанція рифабутину, що вводиться перорально. Значна різниця в ефективності між субстанцією рифабутину та рифабутином в/в була показана для дози 100 мкг/миша або 5мг/кг (це ефективна доза для людини при пероральному введенні). При використанні цієї дози рифабутин в/в приводив до нульового росту колоній (ефективність 100 %), тобто стерилізації в легенях і селезінці, а ефективність субстанції рифабутину склала 17,8 % - в селезінці та 5,9 % - в легенях. Але і в мінімальній використовуваній дозі - 20 мкг/миша рифабутин в/в був значно ефективнішим за субстанцію рифабутину (таблиця 2а). Таблиця 2а Порівняльна ефективність лікування туберкульозу препаратом рифабутину в/в і субстанції рифабутину, виражена в % Орган Препарат Субстанція рифабутину (per os) Легені Форма в/в (в/в.) Субстанція Рифабутину (per os) Селезінка Форма в/в (в/в.) 20 25 30 500 мкг/миша 100 100 100 100 100 мкг/миша 5,9 100 17,8 100 20 мкг/миша 0 20,6 6,7 20 Застосування способу, що заявляється, для одержання розчинних форм антибіотиків з групи рифаміцинів (більшість з яких практично нерозчинні у воді і, отже, не можуть бути безпосередньо розчинені у водовмісному фармацевтично прийнятному розріджувачі або носії), у порівнянні з найближчим аналогом забезпечує наступні переваги: а) спрощення, здешевлення одержання лікарської форми за рахунок виключення стадій гомогенізації та диспергування, і б) забезпечення більшої екологічності технології, зокрема здатності не робити побічного негативного впливу на одержання лікарської форми, тобто відсутність у готовій лікарській формі залишкових кількостей високотоксичного хлористого метилену, за рахунок виключення з технологічного процесу високотоксичних хлорорганічних розчинників, що не змішуються з водою, і крім того, у порівнянні з традиційними (пероральними) лікарськими формами рифабутину та інших антибіотиків групи рифаміцинів - забезпечення більш високої ефективності лікування мікобактеріозів і захворювань, обумовлених персистуванням в організмі пацієнта Helicobacter pylori. ФОРМУЛА ВИНАХОДУ 35 Спосіб одержання водорозчинної лікарської форми антибіотика з групи рифаміцинів, солюбілізованого альбуміном до порошку-ліофілізата, що включає: 5 UA 108527 C2 5 10 а) розчинення антибіотика з групи рифаміцинів, яка включає рифабутин, рифампіцин, рифапентин і рифаксимін і їх фармацевтично прийнятні похідні, в органічному розчиннику, вибраному з групи розчинників, що змішуються з водою, яка включає ацетон, етанол та ізопропанол; б) додавання до розчину, отриманого на стадії а), водного розчину альбуміну, отриманого розчиненням 1-10 % м/о альбуміну в стерилізованій демінералізованій воді; в) перемішування отриманої суміші; г) фільтрацію; д) додавання кріопротектора; е) заморожування; ж) висушування ліофільне або розпилювальне. 6 UA 108527 C2 7 UA 108527 C2 Комп’ютерна верстка Л. Ціхановська Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for producing a water-soluble medicinal form of an antibiotic from the group consisting of rifamycins, and composition produced by said method
Автори англійськоюBabij, Vladimir Evstakhievich, Ignatev, Aleksei Vladimirovich, Gelperina, Svetlana Ehmmanuilovna, Maksimenko, Olga Olegovna, Vanchugova, Lyudmila Vitalevna, Shipulo, Elena Vladimirovna
Назва патенту російськоюСпособ получения водорорастворимой лекарственной формы антибиотика из группы рифамицинов и композиция, полученная способом
Автори російськоюБабий Владимир Евстахиевич, Игнатьев Алексей Владимирович, Гельперина Светлана Эммануиловна, Максименко Ольга Олеговна, Ванчугова Людмила Витальевна, Шипуло Елена Владимировна
МПК / Мітки
МПК: A61P 31/06, A61K 47/42, A61K 31/496
Мітки: водорозчинної, спосіб, одержання, лікарської, групи, рифаміцинів, форми, антибіотика
Код посилання
<a href="https://ua.patents.su/10-108527-sposib-oderzhannya-vodorozchinno-likarsko-formi-antibiotika-z-grupi-rifamiciniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання водорозчинної лікарської форми антибіотика з групи рифаміцинів</a>
Попередній патент: Спосіб і пристрій для електрохімічної обробки лопаток з титанових і жароміцних сплавів у неводному електроліті
Наступний патент: Стос множини целюлозовмісних абсорбуючих рушників і спосіб виготовлення стосу
Випадковий патент: Сполуки морфоліну