5-[2-хлоро-3-(4-нітрофеніл)-аліліден]-4-(3,5-діарил-4,5-дигідропіразол-1-іл)-5н-тіазол-2-они, що виявляють протипухлинну активність in vitro та in vivo, та спосіб їх солюбілізації
Номер патенту: 109177
Опубліковано: 27.07.2015
Автори: Панчук Ростислав Русланович, Лесик Роман Богданович, Зіменковський Борис Семенович, Луцик Максим Дмитрович, Стойка Ростислав Степанович, Гаврилюк Дмитро Ярославович, Чумак Віра Василівна
Формула / Реферат
1. 5-[2-Хлоро-3-(4-нітрофеніл)-аліліден]-4-(3,5-діарил-4,5-дигідропіразол-1-іл)-5H-тіазол-2-они загальної формули І:
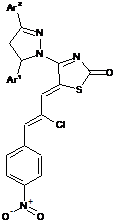 I,
I,
Ia, де Аr1 = 4-MeO-C6H4, Ar2= C6H5
Ib, де Аr1 = 4-Cl-C6H4, Ar2= нафтален-2-іл
Ic, де Аr1= 4-Cl-C6H4, Ar2 = C6H5
Id, де Аr1= 3,4-(MeO)2-C6H3, Ar2 = C6H5
Ie, де Аr1= 4-MeO-C6H4, Ar2 = нафтален-2-іл
If, де Аr1= 2-OH-C6H4, Ar2 = C6H5
що виявляють протипухлинну активність in vitro та in vivo.
2. Спосіб солюбілізації сполук загальної формули І, в якому здійснюють отримання колоїдного розчину для ін'єкцій внесенням 20 % водного розчину пропіленгліколю з додаванням дезоксихолату натрію або стеарату натрію (концентрація 1 мг/мл) у розчин сполуки, що заявляється, у диметилсульфоксиді (концентрація 8 мг/мл).
Текст
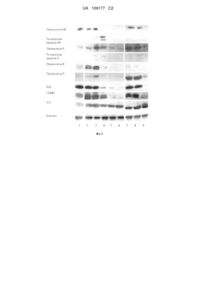
Реферат: Галузь застосування: винахід стосується синтезу нових гетероциклічних сполук, котрі можуть бути використані в медицині як перспективні протипухлинні лікарські засоби. Суть винаходу: синтезовано 5-[2-хлоро-3-(4-нітрофеніл)-аліліден]-4-(3,5-діарил-4,5дигідропіразол-1-іл)-5H-тіазол-2-они (ID-3661), що виявляють виражену протипухлинну активність in vitro та in vivo; розроблено ін'єкційну форму шляхом солюбілізації діючої субстанції: 20 % водного розчину пропіленгліколю з додаванням дезоксихолату натрію або стеарату натрію (концентрація 1 мг/мл) у розчин сполуки, що заявляється, у диметилсульфоксиді (концентрація 8 мг/мл). Технічний результат винаходу: одержано біологічно активні субстанції, що мають протипухлинну активність in vitro та in vivo, індукуючи апоптоз (запрограмовану загибель) злоякісних клітин, та розроблено спосіб їх солюбілізації для парентерального застосування. UA 109177 C2 (12) UA 109177 C2 UA 109177 C2 5 10 15 20 25 30 Винахід стосується синтезу нових гетероциклічних сполук, котрі можуть бути використані в медицині як перспективні протипухлинні лікарські засоби. У винаході запропоновано одержання біологічно активних субстанцій, що мають протипухлинну активність in vitro та in vivo, індукуючи апоптоз (запрограмовану загибель) злоякісних клітин, а також спосіб солюбілізації цих субстанцій для створення їхньої ін'єкційної форми. Пошук нових високоефективних протипухлинних препаратів, які мають високу селективність дії і низьку токсичність щодо нормальних клітин організму, є ключовим завданням сучасної медичної хімії і фармації. Гетероциклічні похідні 4-тіазолідинонів є перспективним класом біологічно активних речовин, здатних діяти як протитуберкульозні, протизапальні, імуномодуляторні та протипухлинні чинники [Зіменковський Б.С. 4-Тіазолідони. Хімія, фізіологічна дія, перспективи / Б.С. Зіменковський, Р.Б. Лесик. Вінниця: Нова книга, 2004. - 106 с.]. Серед зазначених сполук ідентифіковано потенційні протипухлинні препарати, наприклад, Necrostatin-7 (Nec-7), який пригнічує TNF-a-індукований некроптоз у клітинах лінії Jurkat Тлейкозу людини, із дефіцитом гена FADD [Zheng, W., Degterev, A., Hsu, E., Yuan, J., Yuan, C. Structure-activity relationship study of a novel necroptosis inhibitor, necrostatin-7 / W. Zheng, A. Degterev, E.Hsu [et.al] // Bioorg. Med. Chem. Lett. - 2008. - Vol. 18. - P. 4932-4935]. Тому пошук нових синтетичних протипухлинних засобів на основі похідних 4-тіазолідону із фармакологічно привабливими гетероциклами є актуальним для сучасної фармацевтичної і медичної хімії. Прототипом запропонованого винаходу є протипухлинна сполука 4-[5-(4-метоксифеніл)-3феніл-4,5-дигідропіразоліл-1]-5-(4-нітробензиліден)-5Н-тіазол-2-он (ID-3120), що структурно споріднена до заявлених сполук [Патент України на корисну модель № 44775, МПК C07D 277/00, опубл. 12.10.09, Бюл. № 19]. Ця сполука має широкий спектр протипухлинної активності in vitro у діапазоні концентрацій -4 -5 10 -10 моль/л. Однак помірна цитотоксична активність in vitro сполуки ID-3120 (LC50 становить 8-17 мкМ у порівнянні з такою активністю широковживаного протипухлинного препарату доксорубіцину із LC50, що дорівнює 0,2-0,5 мкМ), а також відсутність даних щодо активності вказаної сполуки in vivo, знижує перспективність її подальшого дослідження як потенційного протипухлинного препарату. В основі винаходу поставлено задачу створення нових ефективних протипухлинних засобів із низькими негативними побічними ефектами та зі встановленими механізмами їх дії на злоякісні клітини in vitro та in vivo. Поставлена задача вирішується тим, що синтезовано 5-[2-хлоро-3-(4-нітрофеніл)-аліліден]4-(3,5-діарил-4,5-дигідропіразол-1-іл)-5H-тіазол-2-они, що виявляють виражену протипухлинну активність in vitro та in vivo, загальної формули І: 35 Ar 2 1 N N N O Ar 1 S 2 Ia, де Аr =4-MeO-C6H4, Ar =C6H5 1 2 Ib, де Аr =4-Cl-C6H4, Ar = нафтален-2-іл 1 2 Ic, де Аr =4-Cl-C6H4, Ar =C6H5 1 2 Id, де Аr =3,4-(MeO)2-C6H3, Ar =C6H5 1 2 Ie, де Аr =4-MeO-C6H4, Ar = нафтален-2-іл 1 2 If, де Аr =2-OH-C6H4, Ar =C6H5, Cl I, O 40 N + O Поставлена задача вирішується тим, що спосіб солюбілізації сполук загальної формули І включає отримання колоїдного розчину для ін'єкцій внесенням 20 % водного розчину пропіленгліколю з додаванням дезоксихолату натрію або стеарату натрію (концентрація 1 мг/мл) у розчин сполуки, що заявляється, у диметилсульфоксиді (концентрація 8 мг/мл). Заявлені сполуки одержують методом синтезу, що ґрунтується на взаємодії 4-[3,5-діарил4,5-дигідропіразоліл-1]-5Н-тіазол-2-онів та 2-хлоро-3-(4-нітрофеніл)-пропеналю за умов реакції 1 UA 109177 C2 Кньовенагеля. Реакцію проводять у середовищі оцтової кислоти за присутності безводного ацетату натрію, як каталізатора, за схемою: Ar Ar 2 2 O N N + N Ar 1 N O O N S + O N + O 10 15 20 25 O Cl O 5 N AcOH N S Ar 1 Cl AcONa . Синтезовані сполуки є жовтими або оранжевими кристалічними порошками, розчинними у диметилсульфоксиді (ДМСО) і диметилформаміді (ДМФА), малорозчинними в оцтовій кислоті, нерозчинними у спирті, ацетоні, воді та діетиловому ефірі. Для доказу складу і структури синтезованих сполук були використані відомі фізико-хімічні методи, зокрема ПМР-спектроскопія та елементний аналіз. Одержані результати свідчать про відповідність синтезованих сполук заявленим хімічним структурам. Для розуміння запропонованого винаходу нижче наведено приклад одержання однієї із синтезованих сполук. Всі інші сполуки із ряду одержують аналогічно за вказаною методикою з використанням відповідного 4-[3,5-діарил-4,5-дигідропіразоліл-1]-5Н-тіазол-2-ону як вихідного реагенту. Приклад 1. Одержання 5-[2-хлоро-3-(4-нітрофеніл)-аліліден]-4-[5-(метоксифеніл)-3-феніл4,5-дигідропіразол-1-іл]-5Н-тіазол-2-ону (la). Суміш 0,003 моль 4-[5-(4-метоксифеніл)-3-феніл-4,5-дигідропіразоліл-1]-5Н-тіазол-2-ону, 0,0033 моль циміналю, 0,003 моль ацетату натрію в 10 мл оцтової кислоти нагрівають протягом 1 год. в колбі зі зворотним холодильником. Осад, який утворюється після повного охолодження реакційної суміші, відфільтровують, промивають оцтовою кислотою, водою, етанолом та ефіром і перекристалізовують із суміші ДМФА-ЕtOН (1:2). Одержують оранжевий порошок з Т топл 216218 °C, вихід - 72 %. Знайдено, %: N-10,40; S-6,02. C28H21ClN4O4S. Вирахувано, %: N-10,28; S-5,88. 1 ЯМР Н, δ, м. ч.: 3.38 дд (1Н, СН2СН, J=18,2, 2,4 Гц), 3,75 с (3Н, СН3), 4,01 дд (1H, СН2СH, J=18,2, 10,8 Гц), 5,95 дд (1Н, СН2СН, J=10,8, 2,4 Гц), 6,92 д (2Н, J=8,3 Гц), 7,22 д (2Н, С6Н4, J=8,4 Гц), 7,59-7,65 м (4Н), 7,99 д (2Н, J=6.4 Гц), 8,08 д (2Н, J=8,3 Гц), 8,30д (2Н, J=8,4 Гц), 8,94с (1Н, СН). Решту прикладів наведено у Таблиці 1 2 UA 109177 C2 Таблиця 1 № la Ib Ic Id Ie If 5 10 Тпл., °C 216-218 234-236 229-231 213-215 225-227 237-239 Вихід, % Елементний аналіз 72 C28H21CIN4O4S Знайдено: N-10,40; S6,02 Вирахувано: N10,28; S-5,88 68 C31H20Cl2N403S Знайдено: N-9,43; S-5,47 Вирахувано: N-9,35; S5,35 75 C27H18Cl2N4O3S Знайдено: N-10,12; S5,92 Вирахувано: N10,20; S-5,84 71 C29H23CIN4O5S Знайдено: N-9,88; S-5,70 Вирахувано: N-9,74; S5,58 69 C32H23CIN4O4S Знайдено: N-9,54; S-5,52 Вирахувано: N-9,41; S5,39 73 C27H19CIN4O4S Знайдено: N-10,69; S6,12 Вирахувано: N10,55; S-6,04 1 ЯМР Н, δ (м. ч.) 3,38 дд (1H, СH2СН, J=18,2, 2,4 Гц), 3,75 с (3Н, ОСН3), 4,01 дд (1H, СН2СН, J=18,2, 10,8 Гц), 5,95 дд (1H, СН2СН, J=10,8, 2,4 Гц), 6,92 д (2Н, J=8,3 Гц), 7,22 д (2Н, J=8,4 Гц), 7,59-7,65 м (4Н), 7,99 д (2Н, J=6,4 Гц), 8,08 д (2Н, J=8,3 Гц), 8,30 д (2Н, J=8,4 Гц), 8,94 с (1H, СН). 3.34 дд (1H, CH2CH, J=17,1, 3,6 Гц), 4,11 дд (1Н, СН2СН, J=17,1, 10,8 Гц), 5,80 дд (1Н, СН2СН, J=10,8, 3,6 Гц), 7,31 д (2Н, J=7,9 Гц), 7,46 д (2Н J=7,8 Гц), 7,54-7,58 м (2Н), 7,67 с (1Н), 7,92-8,00 м (4Н), 8,13 д (2Н, J=8,0 Гц), 8,24с (1Н), 8,30 д (2Н, J=8,2 Гц), 8,86 с (1Н). 3,42 дд (1Н, СН2СН, J=17,8, 2,5 Гц), 4,03 дд (1Н, СH2СН, J=17,8, 10,6 Гц), 5,88 дд (1Н, СН2СН, J=10,6, 2,5 Гц), 6,32 д (2Н, J=8,4 Гц), 7,44 д (2Н, J=8,4 Гц), 7,58-7,60 м (3Н), 7,65 с (1H, СН), 7,94 д (2Н, J=6,8 Гц), 8,03 д (2Н, J=8,2 Гц), 8,32 д (2H, J=8,3 Гц), 8,96 с (1H, СН). 3,43 дд (1H, СН2СН, J=16,9, 3,3 Гц), 3,79 с (6Н, 2*ОСН3), 4,05 дд (1H, СH2СН, J=16,9, 11,2 Гц), 5,88 дд (1Н, СН2СН, J=11,2, 3,3 Гц), 7,09 д (1H, J=7,9 Гц), 7,43 с (1H, СН), 7,49 д (1Н, J=8,1 Гц), 7,58-7,60 м (3Н), 7,65 с (1H, СН), 7,96 д (2Н, J=7,1 Гц), 8,12 д (2Н, J=8,1 Гц), 8,32 д (2Н, J=8,2 Гц), 8,91 с (1Н, СН). 3,45 дд (1Н, СH2СН, J=17,8, 2,8 Гц), 3,82 с (3H, OCН3), 4.07дд (1H, СH2СН, J=17,8, 9,8 Гц), 5,86 дд (1H СН2СН, J=9,8, 2,8 Гц), 6,97 д (2Н, J=7,7 Гц), 7,19 д (2Н, J=7,8 Гц), 7,577,60 м (2Н), 7,64 с (1H), 7,96-8,02 м (4Н), 8,08 д (2Н, J=8,1 Гц), 8,22 с (1Н), 8,30 д (2Н, J=8,0 Гц), 8,94 с (1H). 3,42 дд (1Н, СH2СН, J=14,0, 3,7 Гц), 4,01 дд (1Н, СH2СН, J=14,0, 7,2 Гц), 5,87 дд (1H, СН2СН, J=7,2, 3,7 Гц), 6,71 т (1H, J=7,5 Гц), 7,83-7,88 м (2Н), 7,06 т (1H, J=7,6 Гц), 7,427,45 м (3Н), 7,67 с (1Н, СН), 7,86 д (2Н, J=6,9 Гц), 8,01 д (2Н, J=7,9 Гц), 8,34 д (2Н, J=8,0 Гц), 8,93 с (1Н, СН), 9,92 с (1H, ОН). Експериментально встановлено, що дія сполуки, що заявляється, суттєво залежить від її лікарської форми. 5-[2-Хлоро-3-(4-нітрофеніл)-аліліден]-4-[5-(метоксифеніл)-3-феніл-4,5дигідропіразол-1-іл]-5Н-тіазол-2-он (ID-3661) нерозчинний у водних середовищах, деяких органічних розчинниках, найкраще розчинний у диметилсульфоксиді і дещо гірше - у хлороформі. Виражена протипухлинна активність in vivo притаманна колоїдному розчину сполуки ID-3661 у водному середовищі. Суспензія частинок речовини ID-3661, у тому числі дрібнокристалічна, біологічної активності не виявляє. Спосіб солюбілізації для отримання колоїдного розчину для ін'єкцій здійснюють таким чином. Спочатку готують два розчини. Розчин 1 препарату у диметилсульфоксиді (концентрація 8 мг/мл) розфасовують по 0,1 або 0,05 мл у стерильні ампули на 1 мл. Розчин 2-20 % водний розчин пропіленгліколю з додаванням дезоксихолату натрію або стеарату натрію (концентрація 1 мг/мл). Розчин 2 стерилізують фільтрацією через фільтр із величиною пор 0,21 мкм і 3 UA 109177 C2 5 10 15 20 25 30 35 40 45 розфасовують в ампули по 1 або 0,5 мл. Розчини зберігають при кімнатній температурі. Перед застосуванням 0,9 мл (або 0,45 мл) розчину 2 вносять шприцом до 0,1 мл (або відповідно 0,05 мл) розчину 1 і отримують опалесціюючий колоїдний розчин препарату. При тривалому стоянні у розчині 1 утворюються дрібні кристали речовини, які швидко розчиняються при нагріванні до 45-50 °C. Тому перед внесенням розчину 2 ампулу з розчином 1 необхідно підігріти. Розчин 2 стерилізують фільтрацією, при автоклавуванні утворюються мікрокристали детергента. Запропонований винахід ілюструється графічними матеріалами: Фіг. 1 - порівняння експресії молекулярних маркерів апоптозу (PARP-1 - полі-(АОР)-рибозо-полімераза, DFF45 - фактор фрагментації ДНК 45, прокаспаза-6 і активна каспаза-7, β-актин) під впливом сполуки ID-3661 і доксорубіцину, де 1 - контроль; 2 - сполука ID-3661, 2 мкМ, 1 год.; 3 - сполука ID-3661, 2 мкМ, 3 год.; 4 - сполука ID-3661, 2 мкМ, 6 год.; 5 - сполука ID-3661, 2 мкМ, 12 год.; 6 - сполука ID-3661, 2 мкМ, 24 год.; 7 - доксорубіцин, 0,5 мкМ, 6 год.; 8 - Доксорубіцин, 0,5 мкМ, 12 год.; 9 доксорубіцин, 0,5 мкМ, 24 год.; Фіг. 2 - порівняння експресії молекулярних маркерів апоптозу (прокаспаза-10, розщеплена каспаза-10, прокаспаза-9, розщеплена каспаза-9, прокаспаза-8, прокаспаза-2, Bid (ВНЗ interacting-domain deathagonist) - агоніст ВНЗ-зв'язучого домену смерті, FADD-Fas-асоційований білок з доменом смерті, AIF - апоптоз-індукуючий фактор, β-актин) під впливом сполуки ID-3661 і доксорубіцину, де 1 - контроль; 2 - сполука ID-3661, 2 мкМ, 1 год.; 3 сполука ID-3661, 2 мкМ, 3 год.; 4 - сполука ID-3661, 2 мкМ, 6 год.; 5 - сполука ID-3661, 2 мкМ, 12 год.; 6 - сполука ID-3661, 2 мкМ, 24 год.; 7 - доксорубіцин, 0,5 мкМ, 6 год.; 8 - Доксорубіцин, 0,5 мкМ, 12 год.; 9 - доксорубіцин, 0,5 мкМ, 24 год.; Фіг. 3 - вплив сполуки ID-3661 на ріст асцитної лімфоми NK/Ly при початку введення через 24 години після інокуляції пухлинних клітин, де горизонтальна маркована лінія - дослідна група (5 мишей); ламана лінія без маркерів контрольна група (4 миші, з яких дві загинуло на 20 і 26 день експерименту); вертикальні стрілки, спрямовані вниз, - введення сполуки в дозі 10 мг/кг, стрілки, спрямовані вверх, видалення (дренаж) асциту із черевної порожнини, проводили тільки у контрольній групі тварин; Фіг. 4 - вплив сполуки ID-3661 на ріст асцитної лімфоми NK/Ly при початку введення через 48 години після інокуляції пухлинних клітин, де горизонтальна маркована лінія - дослідна група (4 миші); ламана лінія без маркерів - контрольна група (3 миші); вертикальні стрілки, спрямовані вниз, - введення сполуки в дозі 20 мг/кг, стрілки, спрямовані вверх, - видалення (дренаж) асциту із черевної порожнини; Фіг. 5 - приклад рецидиву росту лімфоми NK/Ly після повторної інокуляції пухлинних клітин мишей-реконвалесцентів і лікування їх сполукою ID-3661 у дозі 10 мг/кг, де вертикальна стрілка - реінокуляція пухлинних клітин. Для визначення протипухлинної активності 5-[2-хлоро-3-(4-нітрофеніл)-аліліден]-4-(3,5діарил-4,5-дигідропіразол-1-іл)-5Н-тіазол-2-ону (Фіг. 1) проведено попередній скринінг його біологічної дії на лейкозні (Jurkat, HL-60) та карциномні (MCF-7, MDA-MD-231) лінії злоякісних клітин людини у порівнянні зі структурно близькими сполуками (ID-3120-4-[5-(4-метоксифеніл)-3феніл-4,5-дигідропіразоліл-1]-5-(4-нітробензиліден)-5Н-тіазол-2-он (Фіг. 2) і ID-3372-5-[2-хлоро-3(4-нітрофеніл)-аліліден]-4-[5-(метоксифеніл)-3-феніл-4,5-дигідропіразол-1-іл]-5Н-тіазол-2-он (Фіг. 3)). Показано, що 5-[2-хлоро-3-(4-нітрофеніл)-аліліден]-4-(3,5-діарил-4,5-дигідропіразол-1іл)-5Н-тіазол-2-он (ID-3661) має в середньому у 4-8,5 разу вищу цитотоксичну активність, порівняно зі сполукою ID-3120, та у 10-15 разів вищу активність, порівняно зі сполукою ID-3372 (дані наведено у Таблиці 2). Показник LC50 (концентрація сполуки, при якій гине 50 % пухлинних клітин) сполуки ID-3661 становив 2 мкМ, що є співмірним із діючою концентрацією інших протипухлинних агентів, які застосовують у медицині (доксорубіцин, цисплатин, вінкристин). Таблиця 2 Результати скринінгу цитотоксичної активності сполуки, що заявляється (ID-3661), та структурно близьких ID-3120 та ID-3372 Лінія клітин Jurkat HL-60 MDA-MD-231 MCF-7 Діюча концентрація (LC50) сполуки, мкМ ID-3120 ID-3372 ID-3661 8 20 2 8 20 2 10 25 2 17 30 3 Дослідження молекулярних механізмів дії сполуки ID-3661 на злоякісні клітини продемонструвало їхню загибель, яка супроводжується проявом характерних маркерів апоптозу 4 UA 109177 C2 5 10 15 20 25 30 35 40 45 50 55 (запрограмована загибель клітин) (Фіг. 1). У Т-клітинах лінії Jurkat лейкозу людини при дії ID3661 індукується апоптоз змішаного типу, який опосередкований як ініціаторною каспазою-10 (задіяна у рецептор-опосередкованому апоптозі), так й ініціаторною каспазою-9 (задіяна в апоптозі мітохондріального типу) (Фіг. 2). Одночасний запуск кількох різних шляхів індукції апоптозу досліджуваною сполукою свідчить про різноспрямованість впливу на пухлинні клітини, що передбачає його здатність долати набуту резистентність злоякісних клітин до хіміопрепаратів. Відомо, що багато пухлин володіють дефектами в генах, продукти яких задіяні у регуляції апоптозу [Krakstad С. Survival signalling and apoptosis resistance inglioblastomas: opportunities for targeted therapeutics / С Krakstad, M. Chekenya // Моl. Cancer. - 2010 Vol. 9:135. doi: 10.1186/1476-4598-9-135]. Тому протипухлинний препарат, який здатний елімінувати пухлинні клітини за участю різних механізмів, потенційно може діяти більш ефективно на клітини, незалежно від дефектів у механізмах їхнього запрограмованого відмирання. Порівняння сигнальних шляхів апоптозу, індукованих сполукою ID-3661 і доксорубіцином (Фіг. 1, 2), показало, що ID-3661 у напівлегальній дозі (LC50 становить 2 мкМ) викликає ранній запуск апоптозу (через 3 год. після додавання до клітин), тоді як доксорубіцин за аналогічних умов (LC50 становить 0,5 мкМ) індукує апоптоз значно пізніше (через 24 год.). Отримані дані вказують на те, що сполука ID-3661 здатна швидше, а, отже, й ефективніше, вбивати злоякісні клітини, порівняно із відомими протипухлинними препаратами у співмірних з ними концентраціях. Дослідження протипухлинної активності сполуки ID-3661 in vivo були проведені на асцитній формі лімфоми NK/Ly у мишей згідно із відомим методом [Шеллеи К., Экхардт Ш., Немет Л. Лекарственное лечение опухолевых заболеваний. Будапешт: Изд. АН Венгрии, 1975. - С. 2123]. Штам пухлини одержано із колекції Інституту експериментальної патології, онкології і радіобіології НАН України. Прививання пухлини здійснювали шляхом внутрішньочеревного 7 інокулювання мишам-самцям лінії С57В1 суспензії 10 пухлинних клітин з асциту, розведеного фізіологічним розчином. Асцит отримували від мишей-донорів на 7-8 день росту пухлини. Ін'єкційну форму сполуки вводили внутрішньочеревно, введення починали через 24, 48 або 72 год. після інокуляції пухлини. Моніторинг росту пухлини здійснювали шляхом щоденного зважування тварин. Контроль (без введення препарату) і дослід вели одночасно. Для отримання колоїдного розчину сполуки для ін'єкцій готували спочатку два розчини. Розчин 1 сполуки у диметилсульфоксиді (концентрація 8 мг/мл) розфасовували по 0,1 або 0,05 мл у стерильні ампули на 1 мл. Розчин 2-20 % водний розчин пропіленгліколю з добавкою ПАР (дезоксихолат натрію або стеарат натрію) (1 мг/мл) - стерилізували фільтрацією через фільтр із величиною пор 0,21 мкм і розфасовували в ампули по 1 або 0,5 мл. Обидва розчини зберігали при кімнатній температурі. Перед застосуванням 0,9 мл (або 0,45 мл) розчину 2 вносили шприцом до 0,1 мл (або відповідно 0,05 мл) розчину 1 і отримували опалесцюючий колоїдний розчин досліджуваної сполуки. Перед внесенням розчину 2 ампулу з розчином 1 підігрівали. Розчин 2 стерилізували фільтрацією, тому що при автоклавуванні утворювалися мікрокристали детергента. На Фіг. 3 наведені результати дослідження впливу сполуки ID-3661 на ріст асцитної лімфоми NK/Ly (умови експерименту і позначення наведені у поясненні до ілюстрації). Трикратне введення сполуки в дозі 10 мг/кг при початку введення через 24 год. після інокуляції пухлинних клітин повністю блокувало утворення асциту у всіх мишей дослідної групи, що свідчить про чітко виражену протипухлинну активність сполуки. При визначенні ефективної дози сполуки встановлено, що оптимальною є доза 10 мг/кг: доза 2,5 мг/кг не пригнічувала росту асциту, а доза 5 мг/кг пригнічувала ріст пухлини не у всіх тварин. Найвища переносима доза колоїдної форми сполуки становить 40 мг/кг, однак досягнути її введенням поміркованого об'єму розчинника (наприклад, 0,25-0,3 мл) не вдається через обмежену розчинність сполуки у ДМСО. Сам розчинник (20 % пропіленгліколь, 10 % ДМСО, 0,1 % ПАР) не впливав на ріст пухлини і також не впливав на вагу інтактних (здорових) мишей. Ефективність біологічної дії сполуки, що заявляється, залежить від початку її введення. Ріст асциту блокується при початку введення препарату у дозі 10 мг/кг через 24 год. після інокуляції пухлинних клітин, як це показано на Фіг. 3. При початку введення через 48 год. після інокуляції пухлинних клітин для повного пригнічення росту асциту необхідно застосовувати дозу 20 мг/кг (Фіг. 4). При цьому тривалість життя мишей у нелікованій групі становила 29-34 доби, у дослідній групі 3 миші пережили без ознак пухлини, одна миша загинула на 34 добу внаслідок розвитку солідних вузлів пухлини. 5 UA 109177 C2 5 10 15 За умов початку введення препарату через 72 год. після інокуляції пухлинних клітин пригнічення росту асцитної пухлини було неповним. Одержані результати свідчать про виражену протипухлинну активність сполуки ID-3661 щодо лімфоми NK/Ly. По мірі адаптації пухлинних клітин до середовища і посилення їх проліферації дія сполуки слабшає, і для пригнічення росту пухлини необхідно підвищувати її дозу. Повторна інокуляція клітин NK/Ly мишам-реконвалесцентам супроводжувалася рецидивом росту асцитної пухлини (Фіг. 5). Багаторазове введення сполуки ID-3661 гальмувало ріст пухлини, однак не запобігало виникненню солідних вузлів пухлини на пізніх стадіях, що й зумовлювало повільне зростання маси тіла і загибель тварин (57 і 70 день експерименту, відповідні ілюстрації не наведені). Одержаний результат свідчить про відсутність виникнення резистентності до повторного прищеплення пухлини після лікування ID-3661. При лікуванні лімфоми NK/Ly вінбластином або доксорубіцином виникнення резистентності до повторного прищеплення цієї пухлини спостерігається у 30 % мишей. Із 12 мишей-пухлиноносіїв, лікованих ID-3661, до 60 днів вижило 5, до 80 днів без ознак пухлини - 4. Середня тривалість життя 50 % нелікованих пухлиноносіїв, у яких періодично проводили дренаж асциту, становила 24-26 днів. ФОРМУЛА ВИНАХОДУ 20 1. 5-[2-Хлоро-3-(4-нітрофеніл)-аліліден]-4-(3,5-діарил-4,5-дигідропіразол-1-іл)-5H-тіазол-2-они загальної формули І: Ar 2 1 N Ar N O 1 2 Ia, де Аr = 4-MeO-C6H4, Ar = C6H5, 1 2 Ib, де Аr = 4-Cl-C6H4, Ar = нафтален-2-іл, 1 2 Ic, де Аr = 4-Cl-C6H4, Ar = C6H5, 1 2 Id, де Аr = 3,4-(MeO)2-C6H3, Ar = C6H5, 1 2 Ie, де Аr = 4-MeO-C6H4, Ar = нафтален-2-іл, 1 2 If, де Аr = 2-OH-C6H4, Ar = C6H5, N S Cl O 25 N + O I, що виявляють протипухлинну активність in vitro та in vivo. 2. Спосіб солюбілізації сполук загальної формули І, в якому здійснюють отримання колоїдного розчину для ін'єкцій внесенням 20 % водного розчину пропіленгліколю з додаванням дезоксихолату натрію або стеарату натрію (концентрація 1 мг/мл) у розчин сполуки, що заявляється, у диметилсульфоксиді (концентрація 8 мг/мл). 6 UA 109177 C2 7 UA 109177 C2 Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
Автори англійськоюHavryliuk Dmytro Yaroslavovych, Zimenkovskyi Borys Semenovych, Lesyk Roman Bohdanovych
Автори російськоюГаврилюк Дмитрий Ярославович, Зименковский Борис Семенович, Лесик Роман Богданович
МПК / Мітки
МПК: C07D 277/08, C07D 231/06
Мітки: 5-[2-хлоро-3-(4-нітрофеніл)-аліліден]-4-(3,5-діарил-4,5-дигідропіразол-1-іл)-5н-тіазол-2-они, vitro, протипухлинну, активність, солюбілізації, спосіб, виявляють, vivo
Код посилання
<a href="https://ua.patents.su/10-109177-5-2-khloro-3-4-nitrofenil-aliliden-4-35-diaril-45-digidropirazol-1-il-5n-tiazol-2-oni-shho-viyavlyayut-protipukhlinnu-aktivnist-in-vitro-ta-in-vivo-ta-sposib-kh-solyubilizaci.html" target="_blank" rel="follow" title="База патентів України">5-[2-хлоро-3-(4-нітрофеніл)-аліліден]-4-(3,5-діарил-4,5-дигідропіразол-1-іл)-5н-тіазол-2-они, що виявляють протипухлинну активність in vitro та in vivo, та спосіб їх солюбілізації</a>
Попередній патент: Зворотний канал введення даних користувачем для бездротових дисплеїв
Наступний патент: Обробка даних зображення, що містять результати турбулентності у рідкому середовищі
Випадковий патент: Пристрій для сублімаційного нанесення декоративних покрить на металеві вироби