Рідка фармацевтична композиція, яка включає нітизинон
Формула / Реферат
1. Рідка фармацевтична композиція, придатна для перорального прийому, яка включає:
a) суспензію ефективної кількості мікронізованого 2-(2-нітро-4-трифторметилбензоїл)-1,3-циклогександіону (нітизинону) і
b) буфер на основі лимонної кислоти з рН в діапазоні значень від 2,5 до 3,5, переважно рН 3,0.
2. Композиція за п. 1, яка відрізняється тим, що кількість нітизинону становить від 1 до 10 мг/мл, переважно 4 мг/мл.
3. Композиція за п. 1, яка включає додатково один або декілька фармацевтично прийнятних компонентів, вибраних з групи, яка складається із засобів, які сприяють суспендуванню, підсолоджувачів, консервантів, поверхнево-активних речовин і смакових речовин.
4. Композиція за п. 3, яка відрізняється тим, що засіб, який сприяє суспендуванню, являє собою гідроксипропілметилцелюлозу.
5. Композиція за п. 4, яка відрізняється тим, що засіб, який сприяє суспендуванню, являє собою гідроксипропілметилцелюлозу в кількості від 1 до 20 мг/мл, переважно 5 мг/мл.
6. Композиція за п. 3, яка відрізняється тим, що підсолоджувач являє собою гліцерин.
7. Композиція за п. 6, яка відрізняється тим, що підсолоджувач являє собою гліцерин в кількості від 100 до 500 мг/мл, переважно 500 мг/мл.
8. Композиція за п. 3, яка відрізняється тим, що консервант являє собою метилпарабен і/або пропілпарабен.
9. Композиція за п. 8, яка відрізняється тим, що консерванти являють собою метилпарабен в кількості від 1 до 2 мг/мл, переважно 1,4 мг/мл, і пропілпарабен в кількості від 0,1 до 0,2 мг/мл, переважно 0,14 мг/мл.
10. Композиція за п. 3, яка відрізняється тим, що консервант являє собою бензоат натрію в кількості від 0,2 до 5 мг/мл, переважно 1 мг/мл.
11. Композиція за п. 3, яка відрізняється тим, що поверхнево-активна речовина являє собою полісорбат 80.
12. Композиція за п. 11, яка відрізняється тим, що поверхнево-активна речовина являє собою полісорбат 80 в кількості від 0,1 до 20 мг/мл, переважно від 0,10 до 0,15 мг/мл.
13. Композиція за будь-яким з пп. 1-9, 11 або 12, що включає:
(a) нітизинон (4 мг/мл);
(b) моногідрат лимонної кислоти (9 мг/мл);
(c) тринатрію цитрат дигідрат (2,1 мг/мл);
(d) гідроксипропілметилцелюлозу (5 мг/мл);
(е) гліцерин (500 мг/мл);
(f) метилпарабен (1,4 мг/мл);
(g) пропілпарабен (0,14 мг/мл) і
(h) полісорбат 80 (0,14 мг/мл).
14. Композиція за будь-яким з пп. 1-7 або 10-12, що включає:
(a) нітизинон (4 мг/мл);
(b) моногідрат лимонної кислоти (9 мг/мл);
(c) тринатрію цитрат дигідрат (2,1 мг/мл);
(d) гідроксипропілметилцелюлозу (5 мг/мл);
(е) гліцерин (500 мг/мл);
(f) бензоат натрію (1,0 мг/мл) і
(g) полісорбат 80 (0,14 мг/мл).
15. Композиція за п. 13 або 14, яка включає додатково смакову речовину.
16. Композиція за будь-яким з пп. 1-15, яка застосовується для лікування медичного стану, вибраного з тирозинемії, хвороби Паркінсона, депресії, синдрому утомлених ніг і алкаптонурії.
17. Композиція за п. 16, яка застосовується для лікування спадкової тирозинемії типу І (НТ-І).
18. Композиція за п. 17, яка застосовується для лікування спадкової тирозинемії типу І (НТ-І) у дитини.
Текст
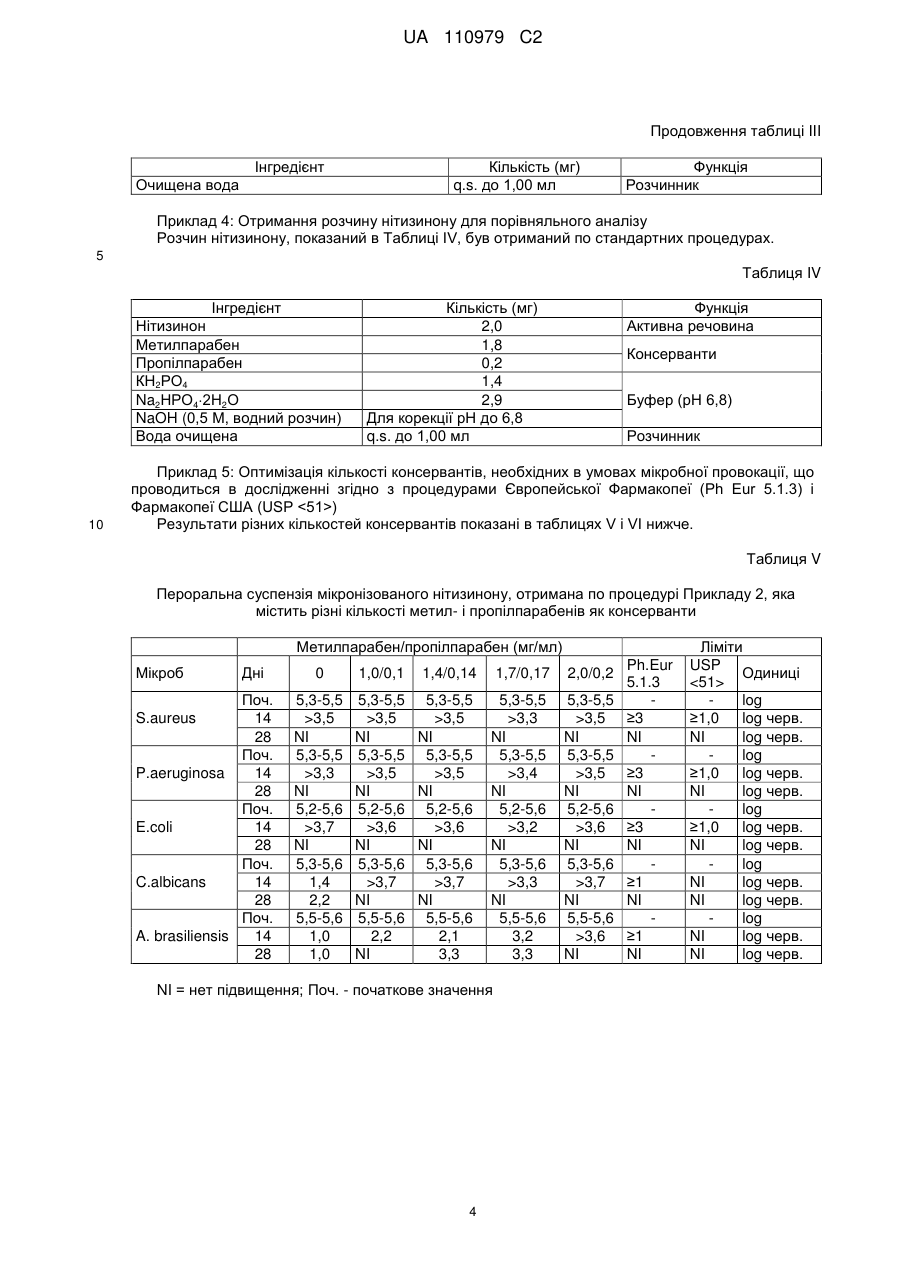
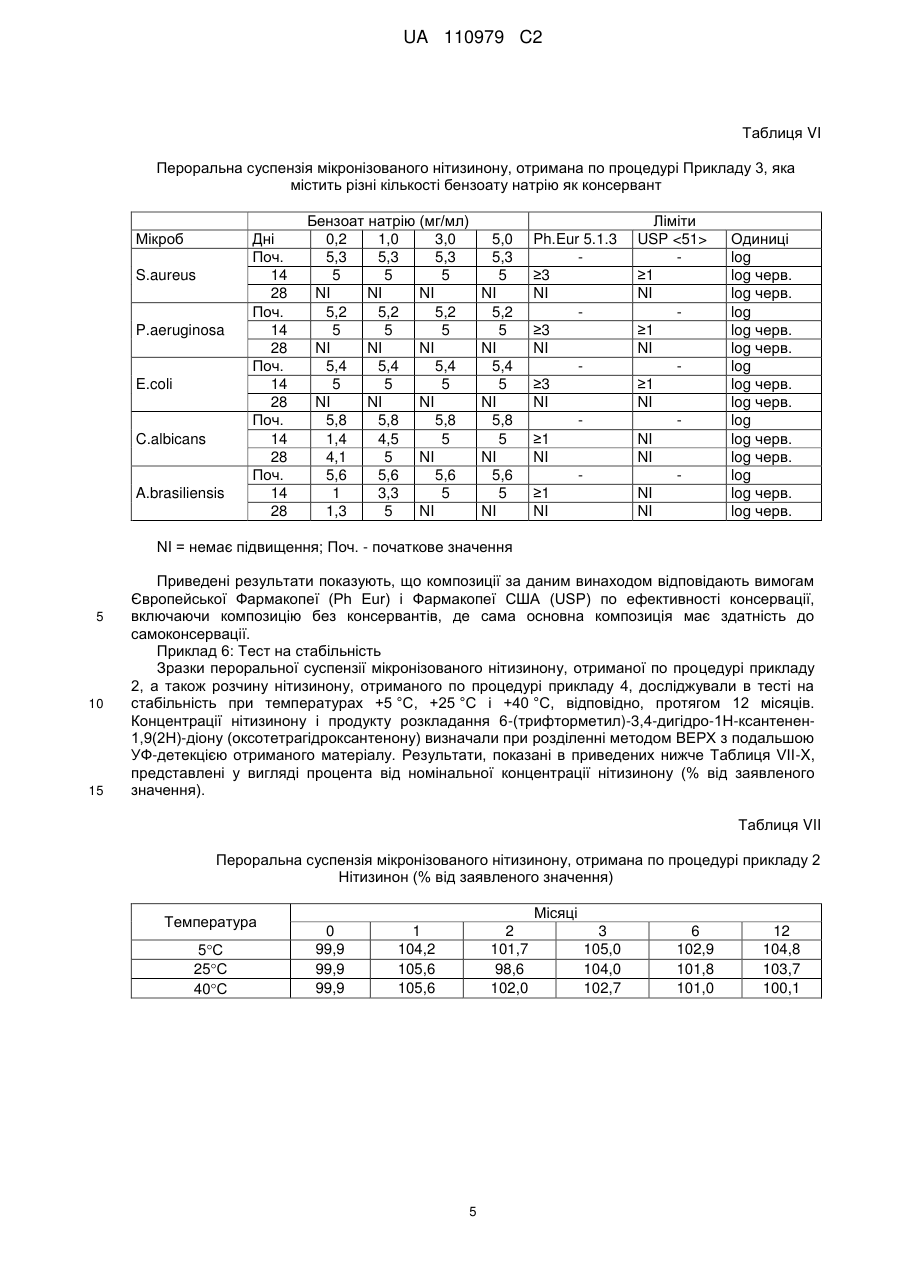
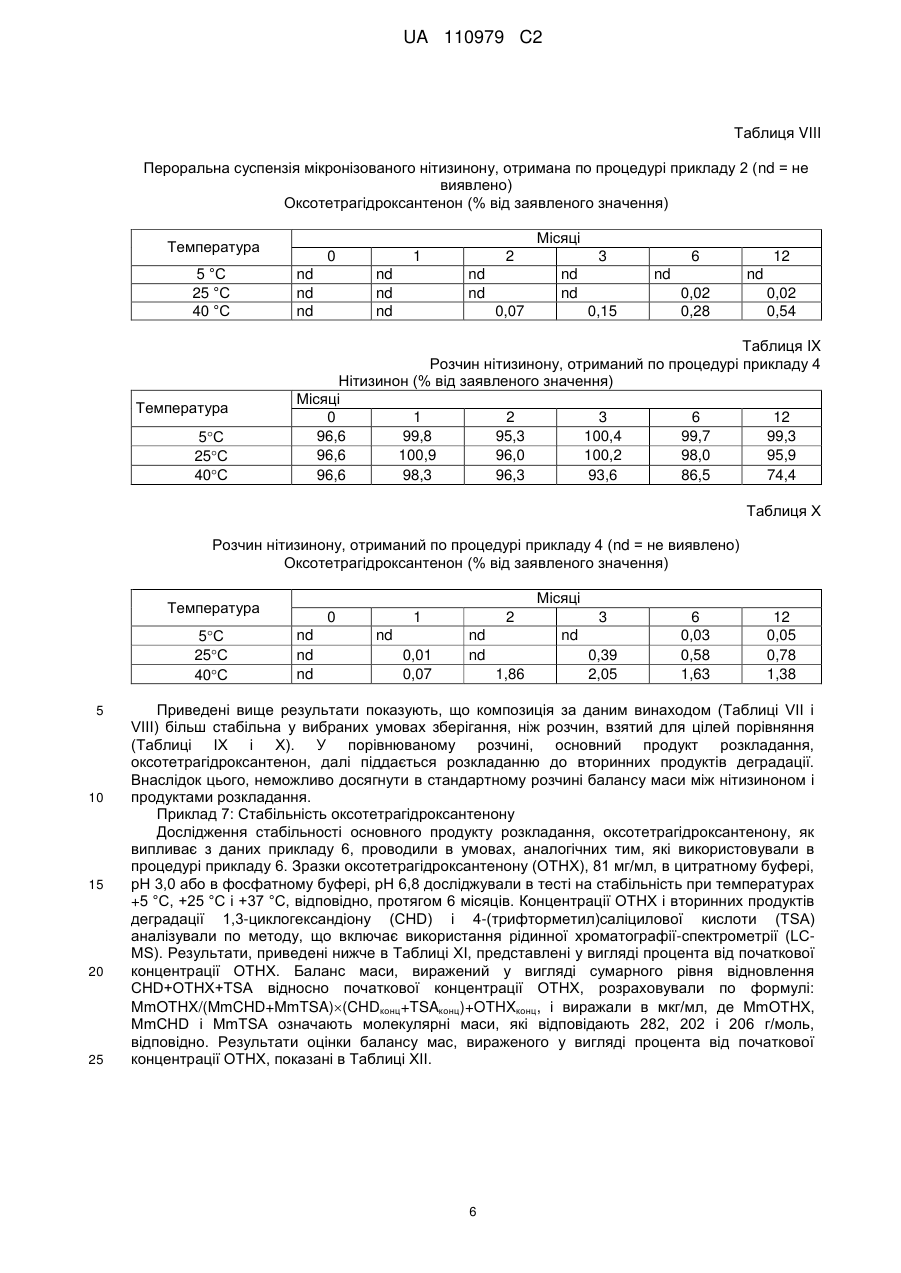
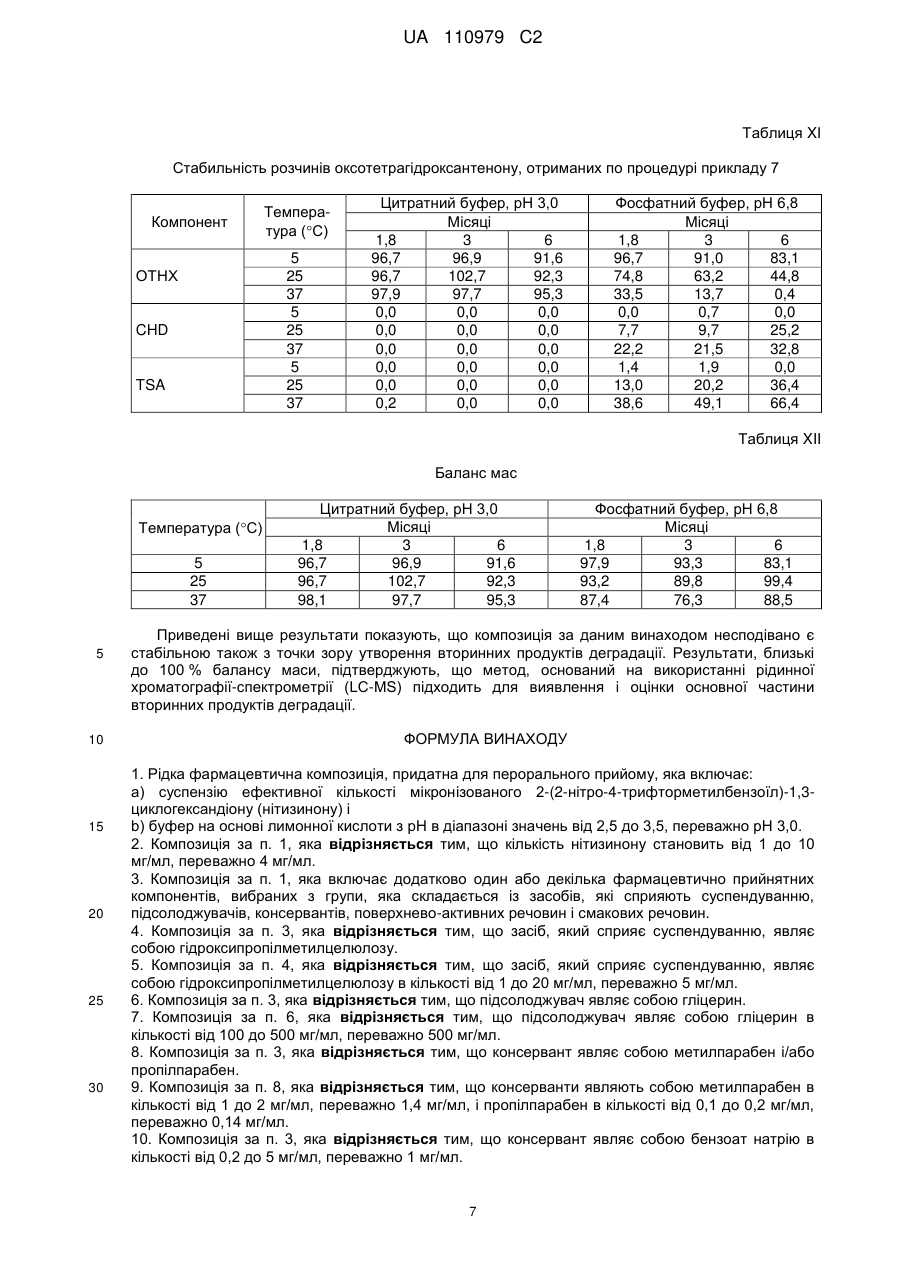
Реферат: Винахід стосується рідкої фармацевтичної композиції, придатної для перорального прийому, яка включає: a) суспензію ефективної кількості мікронізованого 2-(2-нітро-4грифторметилбензоїл)-1,3-циклогександіону (нітизинону) і b) буфер на основі лимонної кислоти з рН в діапазоні значень від 2,5 до 3,5, переважно рН 3,0. UA 110979 C2 (12) UA 110979 C2 UA 110979 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується фармацевтичних композицій, які включають 2-(2-нітро-4трифторметилбензоїл)-1,3-циклогександіон (нітизинон) як активний агент. Вказані композиції застосовуються при лікуванні розладів і захворювань, у випадку яких бажане інгібування 4гідроксифенілпіруватдіоксигенази (HPPD), наприклад, при лікуванні спадкової тирозинемії типу I. Передумови створення винаходу Сполука 2-(2-нітро-4-трифторметилбензоїл)-1,3-циклогександіон, відома також як нітизинон, або NTBC, була уперше описана як гербіцид [патент США 5006158, патент США 4695673, патент США 5668089]. Нітизинон використовується під торговою назвою Орфадін® (Orfadin®) для лікування спадкової тирозинемії типу I (HT-I), рідкісного дитячого захворювання. HT-I являє собою генетичний розлад метаболізму, який виникає через нездатність організму розщеплювати амінокислоту тирозин. В результаті печінкової недостатності і раку печінки, діти з HT-I рідко доживають до двадцятирічного віку без трансплантації печінки. Як було описано, наприклад, в патенті США 5550165, нітизинон являє собою конкурентний інгібітор 4-гідроксифенілпіруватдіоксигенази (HPPD), ферменту, локалізованого на шляху катаболічного розщеплення тирозину проти зчитування інформації для гідролази фумарилацетоацетату (FAH). За рахунок інгібування нормального катаболізму тирозину у пацієнтів з HT-I, нітизинон перешкоджає акумуляції катаболічних інтермедіатів малеїлацетоацетату і фумарилацетоацетату. У пацієнтів з HT-I, ці катаболічні інтермедіати перетворюються в токсичні метаболіти сукцинілацетон і сукцинілацетоацетат, які відповідають за токсичність, що спостерігається для печінки і нирок. Крім того, нітизинон був описаний як препарат, корисний при лікуванні інших розладів, таких як хвороба Паркінсона [WO 2006/090117], депресія [WO 2008/020150], синдром утомлених ніг [WO 2010/054273] і алкаптонурія [Sunwanarat, Р. еt al., Metabolism 54: 719-728, 2005]. Використання нітизинону було також описане як спосіб, направлений на посилення фаголізосомального злиття після інфекції пацієнта мікроорганізмом [заявка на патент США, публікація No. 2010-0227936]. Пероральне введення лікарських засобів являє собою один з переважних способів лікування, в зв'язку з його простотою. Але, якщо ці засоби в основному вводяться у вигляді таблеток або капсул, такий спосіб введення буде менш переважний, наприклад, в тому випадку, коли доза, що приймається, повинна бути добре адаптована для суб'єкта, який проходить лікування, або може бути менш зручний, наприклад, у випадку засобів для педіатричного або ветеринарного застосування. У цьому випадку, рідка дозована форма може являти собою зручну альтернативу. У зв'язку з цим, є потреба в стабільних рідких композиціях нізитинону, які пристосовані для введення дітям і які вільні від тих недоліків, які властиві твердим фармацевтичним композиціям. Розкриття винаходу У даному винаході було показано, що рідка фармацевтична композиція, яка включає суспензію мікронізованого нізитинону і має рН приблизно 3, характеризується сприятливими властивостями, такими як підвищена стабільність. Отже, даний винахід стосується рідкої фармацевтичної композиції, прийнятної для перорального введення, яка включає: (а) суспензію ефективної кількості мікронізованого 2-(2-нітро-4-трифторметилбензоїл)-1,3циклогександіону (нітизинону) і (b) буфер на основі лимонної кислоти зі значенням рН в діапазоні від 2,5 до 3,5, переважно, рН 3,0. Термін "ефективна кількість" нітизинону означає в контексті даного опису кількість, ефективну для інгібування 4-гідроксифенілпіруватдіоксигенази. Переважно, вказана кількість нітизинону складає від 1 до 10 мг/мл, більш переважно, 4 мг/мл. Нітизинон може бути отриманий по стандартних процедурах органічної хімії, які вже використовувалися для отримання структурно близьких матеріалів. Так, наприклад, нітизинон може бути отриманий шляхом взаємодії 2-нітро-4-трифторметилбензоїлхлориду з циклогексан1,3-діоном в присутності ціангідрину ацетону і відповідної основи, такої як триетиламін, як було описано в US 5550165. Сам вихідний матеріал 2-нітро-4-трифторметилбензоїлхлорид може бути отриманий з відповідної бензойної кислоти, наприклад, за допомогою реакції з тіонілхлоридом або оксалілхлоридом, як описано в Reagents for Organic Synthesis [J. Wiley and Sons, 1987, Vol.1, pp. 767-769], і в основному використовується без якого-небудь спеціального очищення. У свою чергу, 2-нітро-4-трифторметилбензойна кислота може бути отримана, наприклад, по методиці, описаній Haupstein et al. в роботі Amer. Chem. Soc., 1954, 76, 1051, або згідно з однією з основних методик, описаних в роботі The Chemistry of Carboxylic Acids and 1 UA 110979 C2 5 10 15 20 25 30 35 40 45 50 55 60 Esters [J. Wiley and Sons, 1969, editor S. Patai] і в огляді Survey of Organic Synthesis [J. Wiley and Sons, 1970, C.A. Buehler and D.F. Pearson]. Переважно, композиція за даним винаходом додатково включає один або декілька фармацевтично прийнятних компонентів, вибраних з групи, яка складається з засобів, які сприяють суспендуванню, підсолоджувачів, консервантів, поверхнево-активних речовин і смакових речовин. Прийнятним засобом, який сприяє суспендуванню, є, наприклад, гідроксипропілметилцелюлоза (ГПМЦ) в кількості від 1 до 20 мг/мл, переважно, 5 мг/мл. Прийнятним підсолоджувачем є гліцерин в кількості, яка приводить до досягнення потрібного смаку. Кількість гліцерину складає переважно від 100 до 500 мг/мл, більш переважно, 500 мг/мл. Композиція за даним винаходом переважно включає щонайменше один консервант, вибраний з метилпарабену, пропілпарабену і бензоату натрію. Переважно, вказані консерванти представлені метилпарабеном в кількості від 1 до 2 мг/мл, більш переважно, 1,4 мг/мл, пропілпарабеном в кількості від 0,1 до 0,2 мг/мл, більш переважно, 0,14 мг/мл, і бензоатом натрію в кількості від 0,2 до 5 мг/мл, більш переважно, 1,0 мг/мл. Композиція за даним винаходом переважно включає поверхнево-активну речовину, таку як полісорбат 80 (поліоксіетилен (80) сорбітану моноолеат, відомий як Alkest TW 80™ і Tween). Кількості полісорбату 80 повинно вистачати для зволоження дисперсії частинок нітизинону, з тим щоб полегшити отримання дисперсії нітизинону в процесі виробництва, а також уникнути агломерації частинок нітизинону при зберіганні готового продукту. Переважно, композиція за даним винаходом включає Полісорбат 80 в кількості від 0,1 до 20 мг/мл, більш переважно, від 0,10 до 0,15 мг/мл, наприклад, близько 0,135 мг/мл. Композиція за даним винаходом переважно включає ароматизатор, такий як ароматизатор зі смаком полуниці. Кількості ароматизатора повинно вистачати для надання композиції відповідного смаку і переважно складає від 0,2 до 1,1 мг/мл, більш переважно, 0,7 мг/мл. У особливо переважній формі, композиція за даним винаходом включає: (а) нітизинон (4 мг/мл); (b) моногідрат лимонної кислоти (9 мг/мл); (с) тринатрію цитрат дигідрат (2,1 мг/мл); (d) гідроксипропілметилцелюлозу (5 мг/мл); (е) гліцерин (500 мг/мл); (f) метилпарабен (1,4 мг/мл); (g) пропілпарабен (0,14 мг/мл) і (h) полісорбат 80 (0,14 мг/мл). У іншій особливо переважній формі, композиція за даним винаходом включає: (а) нітизинон (4 мг/мл); (b) моногідрат лимонної кислоти (9 мг/мл); (с) тринатрію цитрат дигідрат (2,1 мг/мл); (d) гідроксипропілметилцелюлозу (5 мг/мл); (е) гліцерин (500 мг/мл); (f) бензоат натрію (1,0 мг/мл); і (g) полісорбат 80 (0,14 мг/мл). Інша переважна форма композиції включає смакову речовину, таку як (h) смакова речовина зі смаком полуниці (0,7 мг/мл). Композиція за даним винаходом використовується для лікування розладів і захворювань, при яких бажане інгібування 4-гідроксифенілпіруватдіоксигенази (HPPD). Приклади таких розладів включають спадкову тирозинемію типу I (HT-I), хворобу Паркінсона, депресію, синдром утомлених ніг і алкаптонурію. Композиція за даним винаходом особливо корисна для цілей педіатричного застосування. Зокрема, ця композиція підходить для немовлят і для дітей у віці 8-10 років, з вагою тіла приблизно від 3,5 до 40 кг. Таким чином, денна доза в 1 мг/кг відповідає діапазону доз від 2×1,75 мг до 2×20 мг. Ефективна концентрація 4 мг/мл буде створюватися прийнятними об'ємами, які відповідають режиму щоденного двократного введення дози від 0,44 до 5 мл. Пероральний шприц може використовуватися як дозатор для введення точної дози, яка потрапляє в цей діапазон. Приклади Приклад 1: Мікронізація нітизинону Використовували лабораторний повітроструминний млин, 2-дюймову модель, Sturtevant, Inc., для мікронізації нітизинону, отриманого від компанії Bachem, Швейцарія. Млин працював з 2 UA 110979 C2 5 10 15 тангенціальним потоком (тобто повітря і лікарський засіб вводилися в одному напрямку в камері для подрібнення). Неподрібнений лікарський засіб вводили в млин за допомогою системи Venturi, Syncron®, Magnet Feeder, модель F-TO-C, яка за допомогою повітря проштовхувала матеріал, що вводиться в камеру для подрібнення. Фільтрувальний мішок для продукту прикріплювали до випускного отвору млини, з якого збирали відходи і подрібнений лікарський засіб. Були використані наступні умови для проведення процесу подрібнення: - Повітря для дроблення: сухий газ азот; - Тиск в процесі дроблення: 90 фунт/дюйм кв; - Тиск в системі введення: 85 фунт/дюйм кв; - Умови в робочому приміщенні: умови навколишнього середовища 5 г API пропускали через мікронізатор і збирали оброблений матеріал (3,7 г). Далі, матеріал аналізували по діаметру отриманих частинок (PSD), на ступінь його чистоти з використанням високоефективної рідинної хроматографії (ВЕРХ), порошкової дифракції рентгенівських променів (XRPD), диференціальної скануючої калориметрії (DSC) і поляризаційної мікроскопії (PLM). У Таблиці I показані результати, отримані при PSD аналізі. Таблиця I Вихідний матеріал Мікронізований матеріал 20 Діаметр частинок (мікрони) d10 d20 d50 20,50 33,10 60,01 0,30 0,47 1,29 d80 94,42 2,59 d90 115,11 3,59 Приклад 2: Отримання пероральної суспензії мікронізованого нітизинону, що містить метилі пропілпарабени як консерванти. Композиція за даним винаходом, показана в Таблиці II, була отримана по стандартних процедурах. Таблиця II Інгредієнт Нітизинон (мікронізований) Гідроксипропілметилцелюлоза (ГПМЦ) Гліцерин Кількість (мг) 4,0 5,0 500 Полісорбат 80 Метилпарабен Пропілпарабен Моногідрат лимонної кислоти Тринатрію цитрат дигідрат Очищена вода 25 0,135 1,4 0,14 8,98 2,13 q.s. до 1,00 мл Функция Активна речовина Суспендуючий засіб Підсолоджувач Поверхнево-активна речовина Консерванти Буфер (рН 3,0) Розчинник Приклад 3: Отримання пероральної суспензії мікронізованого нітизинону, що містить бензоат натрію, як консервант, і полуничний ароматизатор, як смакову речовину. Композиція за даним винаходом, показана в Таблиці III, була отримана по стандартних процедурах. Таблиця III Інгредієнт Нітизинон (мікронізований) Гідроксипропілметилцелюлоза (ГПМЦ) Гліцерин Кількість (мг) 4,0 5,0 500 Полісорбат 80 0,135 Бензоат натрію Ароматизатор зі смаком полуниці Моногідрат лимонної кислоти Тринатрію цитрат дигідрат 1,0 0,7 8,98 2,13 3 Функція Активна речовина Суспендуючий засіб Підсолоджувач Поверхнево-активна речовина Консервант Смакова речовина Буфер (рН 3,0) UA 110979 C2 Продовження таблиці III Інгредієнт Кількість (мг) q.s. до 1,00 мл Очищена вода Функція Розчинник Приклад 4: Отримання розчину нітизинону для порівняльного аналізу Розчин нітизинону, показаний в Таблиці IV, був отриманий по стандартних процедурах. 5 Таблиця IV Інгредієнт Нітизинон Метилпарабен Пропілпарабен КН2РО4 Na2НРО42Н2О NaOH (0,5 М, водний розчин) Вода очищена 10 Кількість (мг) 2,0 1,8 0,2 1,4 2,9 Для корекції рН до 6,8 q.s. до 1,00 мл Функція Активна речовина Консерванти Буфер (рН 6,8) Розчинник Приклад 5: Оптимізація кількості консервантів, необхідних в умовах мікробної провокації, що проводиться в дослідженні згідно з процедурами Європейської Фармакопеї (Ph Eur 5.1.3) і Фармакопеї США (USP ) Результати різних кількостей консервантів показані в таблицях V і VI нижче. Таблиця V Пероральна суспензія мікронізованого нітизинону, отримана по процедурі Прикладу 2, яка містить різні кількості метил- і пропілпарабенів як консерванти Метилпарабен/пропілпарабен (мг/мл) Мікроб Дні Поч. 14 28 Поч. P.aeruginosa 14 28 Поч. E.coli 14 28 Поч. C.albicans 14 28 Поч. A. brasiliensis 14 28 S.aureus 0 1,0/0,1 1,4/0,14 1,7/0,17 2,0/0,2 5,3-5,5 >3,5 NI 5,3-5,5 >3,3 NI 5,2-5,6 >3,7 NI 5,3-5,6 1,4 2,2 5,5-5,6 1,0 1,0 5,3-5,5 >3,5 NI 5,3-5,5 >3,5 NI 5,2-5,6 >3,6 NI 5,3-5,6 >3,7 NI 5,5-5,6 2,2 NI 5,3-5,5 >3,5 NI 5,3-5,5 >3,5 NI 5,2-5,6 >3,6 NI 5,3-5,6 >3,7 NI 5,5-5,6 2,1 3,3 5,3-5,5 >3,3 NI 5,3-5,5 >3,4 NI 5,2-5,6 >3,2 NI 5,3-5,6 >3,3 NI 5,5-5,6 3,2 3,3 5,3-5,5 >3,5 NI 5,3-5,5 >3,5 NI 5,2-5,6 >3,6 NI 5,3-5,6 >3,7 NI 5,5-5,6 >3,6 NI NI = нет підвищення; Поч. - початкове значення 4 Ph.Eur 5.1.3 ≥3 NI ≥3 NI ≥3 NI ≥1 NI ≥1 NI Ліміти USP Одиниці log ≥1,0 log черв. NI log черв. log ≥1,0 log черв. NI log черв. log ≥1,0 log черв. NI log черв. log NI log черв. NI log черв. log NI log черв. NI log черв. UA 110979 C2 Таблиця VI Пероральна суспензія мікронізованого нітизинону, отримана по процедурі Прикладу 3, яка містить різні кількості бензоату натрію як консервант Мікроб S.aureus P.aeruginosa E.coli C.albicans A.brasiliensis Дні Поч. 14 28 Поч. 14 28 Поч. 14 28 Поч. 14 28 Поч. 14 28 Бензоат натрію (мг/мл) 0,2 1,0 3,0 5,3 5,3 5,3 5 5 5 NI NI NI 5,2 5,2 5,2 5 5 5 NI NI NI 5,4 5,4 5,4 5 5 5 NI NI NI 5,8 5,8 5,8 1,4 4,5 5 4,1 5 NI 5,6 5,6 5,6 1 3,3 5 1,3 5 NI 5,0 5,3 5 NI 5,2 5 NI 5,4 5 NI 5,8 5 NI 5,6 5 NI Ph.Eur 5.1.3 ≥3 NI ≥3 NI ≥3 NI ≥1 NI ≥1 NI Ліміти USP ≥1 NI ≥1 NI ≥1 NI NI NI NI NI Одиниці log log черв. log черв. log log черв. log черв. log log черв. log черв. log log черв. log черв. log log черв. log черв. NI = немає підвищення; Поч. - початкове значення 5 10 15 Приведені результати показують, що композиції за даним винаходом відповідають вимогам Європейської Фармакопеї (Ph Eur) і Фармакопеї США (USP) по ефективності консервації, включаючи композицію без консервантів, де сама основна композиція має здатність до самоконсервації. Приклад 6: Тест на стабільність Зразки пероральної суспензії мікронізованого нітизинону, отриманої по процедурі прикладу 2, а також розчину нітизинону, отриманого по процедурі прикладу 4, досліджували в тесті на стабільність при температурах +5 °C, +25 °C і +40 °C, відповідно, протягом 12 місяців. Концентрації нітизинону і продукту розкладання 6-(трифторметил)-3,4-дигідро-1Н-ксантенен1,9(2Н)-діону (оксотетрагідроксантенону) визначали при розділенні методом ВЕРХ з подальшою УФ-детекцією отриманого матеріалу. Результати, показані в приведених нижче Таблиця VII-X, представлені у вигляді процента від номінальної концентрації нітизинону (% від заявленого значення). Таблиця VII Пероральна суспензія мікронізованого нітизинону, отримана по процедурі прикладу 2 Нітизинон (% від заявленого значення) Температура 5С 25С 40С Місяці 0 99,9 99,9 99,9 1 104,2 105,6 105,6 2 101,7 98,6 102,0 5 3 105,0 104,0 102,7 6 102,9 101,8 101,0 12 104,8 103,7 100,1 UA 110979 C2 Таблиця VIII Пероральна суспензія мікронізованого нітизинону, отримана по процедурі прикладу 2 (nd = не виявлено) Оксотетрагідроксантенон (% від заявленого значення) Місяці Температура 5 °C 25 °C 40 °C Температура 5С 25С 40С 0 nd nd nd 1 nd nd nd 2 nd nd 3 nd nd 0,07 6 nd 0,15 12 nd 0,02 0,28 0,02 0,54 Таблиця IX Розчин нітизинону, отриманий по процедурі прикладу 4 Нітизинон (% від заявленого значення) Місяці 0 1 2 3 6 12 96,6 99,8 95,3 100,4 99,7 99,3 96,6 100,9 96,0 100,2 98,0 95,9 96,6 98,3 96,3 93,6 86,5 74,4 Таблиця Х Розчин нітизинону, отриманий по процедурі прикладу 4 (nd = не виявлено) Оксотетрагідроксантенон (% від заявленого значення) Місяці Температура 5С 25С 40С 5 10 15 20 25 0 nd nd nd 1 nd 0,01 0,07 2 nd nd 3 nd 1,86 0,39 2,05 6 0,03 0,58 1,63 12 0,05 0,78 1,38 Приведені вище результати показують, що композиція за даним винаходом (Таблиці VII і VIII) більш стабільна у вибраних умовах зберігання, ніж розчин, взятий для цілей порівняння (Таблиці IX і X). У порівнюваному розчині, основний продукт розкладання, оксотетрагідроксантенон, далі піддається розкладанню до вторинних продуктів деградації. Внаслідок цього, неможливо досягнути в стандартному розчині балансу маси між нітизиноном і продуктами розкладання. Приклад 7: Стабільність оксотетрагідроксантенону Дослідження стабільності основного продукту розкладання, оксотетрагідроксантенону, як випливає з даних прикладу 6, проводили в умовах, аналогічних тим, які використовували в процедурі прикладу 6. Зразки оксотетрагідроксантенону (ОТНХ), 81 мг/мл, в цитратному буфері, рН 3,0 або в фосфатному буфері, рН 6,8 досліджували в тесті на стабільність при температурах +5 °C, +25 °C і +37 °C, відповідно, протягом 6 місяців. Концентрації ОТНХ і вторинних продуктів деградації 1,3-циклогександіону (CHD) і 4-(трифторметил)саліцилової кислоти (TSA) аналізували по методу, що включає використання рідинної хроматографії-спектрометрії (LCMS). Результати, приведені нижче в Таблиці XI, представлені у вигляді процента від початкової концентрації ОТНХ. Баланс маси, виражений у вигляді сумарного рівня відновлення CHD+OTHX+TSA відносно початкової концентрації ОТНХ, розраховували по формулі: MmOTHX/(MmCHD+MmTSA)(CHDконц+TSAконц)+OTHXконц, і виражали в мкг/мл, де MmOTHX, MmCHD і MmTSA означають молекулярні маси, які відповідають 282, 202 і 206 г/моль, відповідно. Результати оцінки балансу мас, вираженого у вигляді процента від початкової концентрації ОТНХ, показані в Таблиці XII. 6 UA 110979 C2 Таблиця XІ Стабильність розчинів оксотетрагідроксантенону, отриманих по процедурі прикладу 7 Компонент Температура (С) 5 25 37 5 25 37 5 25 37 ОТНХ CHD TSA Цитратний буфер, рН 3,0 Місяці 1,8 3 6 96,7 96,9 91,6 96,7 102,7 92,3 97,9 97,7 95,3 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,2 0,0 0,0 Фосфатний буфер, рН 6,8 Місяці 1,8 3 6 96,7 91,0 83,1 74,8 63,2 44,8 33,5 13,7 0,4 0,0 0,7 0,0 7,7 9,7 25,2 22,2 21,5 32,8 1,4 1,9 0,0 13,0 20,2 36,4 38,6 49,1 66,4 Таблиця XII Баланс мас Температура (С) 5 25 37 5 10 15 20 25 30 Цитратний буфер, рН 3,0 Місяці 1,8 3 6 96,7 96,9 91,6 96,7 102,7 92,3 98,1 97,7 95,3 Фосфатний буфер, рН 6,8 Місяці 1,8 3 6 97,9 93,3 83,1 93,2 89,8 99,4 87,4 76,3 88,5 Приведені вище результати показують, що композиція за даним винаходом несподівано є стабільною також з точки зору утворення вторинних продуктів деградації. Результати, близькі до 100 % балансу маси, підтверджують, що метод, оснований на використанні рідинної хроматографії-спектрометрії (LC-MS) підходить для виявлення і оцінки основної частини вторинних продуктів деградації. ФОРМУЛА ВИНАХОДУ 1. Рідка фармацевтична композиція, придатна для перорального прийому, яка включає: a) суспензію ефективної кількості мікронізованого 2-(2-нітро-4-трифторметилбензоїл)-1,3циклогександіону (нітизинону) і b) буфер на основі лимонної кислоти з рН в діапазоні значень від 2,5 до 3,5, переважно рН 3,0. 2. Композиція за п. 1, яка відрізняється тим, що кількість нітизинону становить від 1 до 10 мг/мл, переважно 4 мг/мл. 3. Композиція за п. 1, яка включає додатково один або декілька фармацевтично прийнятних компонентів, вибраних з групи, яка складається із засобів, які сприяють суспендуванню, підсолоджувачів, консервантів, поверхнево-активних речовин і смакових речовин. 4. Композиція за п. 3, яка відрізняється тим, що засіб, який сприяє суспендуванню, являє собою гідроксипропілметилцелюлозу. 5. Композиція за п. 4, яка відрізняється тим, що засіб, який сприяє суспендуванню, являє собою гідроксипропілметилцелюлозу в кількості від 1 до 20 мг/мл, переважно 5 мг/мл. 6. Композиція за п. 3, яка відрізняється тим, що підсолоджувач являє собою гліцерин. 7. Композиція за п. 6, яка відрізняється тим, що підсолоджувач являє собою гліцерин в кількості від 100 до 500 мг/мл, переважно 500 мг/мл. 8. Композиція за п. 3, яка відрізняється тим, що консервант являє собою метилпарабен і/або пропілпарабен. 9. Композиція за п. 8, яка відрізняється тим, що консерванти являють собою метилпарабен в кількості від 1 до 2 мг/мл, переважно 1,4 мг/мл, і пропілпарабен в кількості від 0,1 до 0,2 мг/мл, переважно 0,14 мг/мл. 10. Композиція за п. 3, яка відрізняється тим, що консервант являє собою бензоат натрію в кількості від 0,2 до 5 мг/мл, переважно 1 мг/мл. 7 UA 110979 C2 5 10 15 20 25 11. Композиція за п. 3, яка відрізняється тим, що поверхнево-активна речовина являє собою полісорбат 80. 12. Композиція за п. 11, яка відрізняється тим, що поверхнево-активна речовина являє собою полісорбат 80 в кількості від 0,1 до 20 мг/мл, переважно від 0,10 до 0,15 мг/мл. 13. Композиція за будь-яким з пп. 1-9, 11 або 12, що включає: (a) нітизинон (4 мг/мл); (b) моногідрат лимонної кислоти (9 мг/мл); (c) тринатрію цитрат дигідрат (2,1 мг/мл); (d) гідроксипропілметилцелюлозу (5 мг/мл); (е) гліцерин (500 мг/мл); (f) метилпарабен (1,4 мг/мл); (g) пропілпарабен (0,14 мг/мл) і (h) полісорбат 80 (0,14 мг/мл). 14. Композиція за будь-яким з пп. 1-7 або 10-12, що включає: (a) нітизинон (4 мг/мл); (b) моногідрат лимонної кислоти (9 мг/мл); (c) тринатрію цитрат дигідрат (2,1 мг/мл); (d) гідроксипропілметилцелюлозу (5 мг/мл); (е) гліцерин (500 мг/мл); (f) бензоат натрію (1,0 мг/мл) і (g) полісорбат 80 (0,14 мг/мл). 15. Композиція за п. 13 або 14, яка включає додатково смакову речовину. 16. Композиція за будь-яким з пп. 1-15, яка застосовується для лікування медичного стану, вибраного з тирозинемії, хвороби Паркінсона, депресії, синдрому утомлених ніг і алкаптонурії. 17. Композиція за п. 16, яка застосовується для лікування спадкової тирозинемії типу І (НТ-І). 18. Композиція за п. 17, яка застосовується для лікування спадкової тирозинемії типу І (НТ-І) у дитини. Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
Автори англійськоюSvensson, Lennart, Siden, Hans
Автори російськоюСвенссон Леннарт, Сиден Ханс
МПК / Мітки
МПК: A61K 9/10, A61P 3/00, A61K 31/122
Мітки: рідка, нітизинон, яка, включає, композиція, фармацевтична
Код посилання
<a href="https://ua.patents.su/10-110979-ridka-farmacevtichna-kompoziciya-yaka-vklyuchaeh-nitizinon.html" target="_blank" rel="follow" title="База патентів України">Рідка фармацевтична композиція, яка включає нітизинон</a>