Азетидинілфенілові, піридилові або піразинілкарбоксамідні похідні як інгібітори jak
Формула / Реферат
1. Сполука Формули І
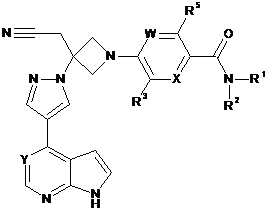 І
І
або її фармацевтично прийнятна сіль, де:
X являє собою N або CR4;
W являє собою N або CR6;
Υ являє собою N або CR7;
R1 являє собою С1-6алкіл, С1-6галоалкіл, С3-6циклоалкіл, С3-6циклоалкіл-С1-3алкіл, 4-6-членний гетероциклоалкіл або 4-6-членний гетероциклоалкіл-С1-3алкіл; причому кожен вказаний С1-6алкіл, С3-6циклоалкіл, С3-6циклоалкіл-С1-3алкіл, 4-6-членний гетероциклоалкіл і 4-6-членний гетероциклоалкіл-С1-3алкіл необов'язково заміщений 1, 2 або 3 замісниками, незалежно вибраними з фтору, -ОН, -О(С1-3алкіл), -CN, -CF3, С1-3алкілу, -NH2, -NH(С1-3алкіл), -N(С1-3алкіл)2, -C(O)N(С1-3алкіл)2, -C(O)NH(С1-3алкіл), -C(O)NH2, -С(О)О(С1-3алкіл), -S(O)2(С1-3алкіл), -S(O)2(С3-6циклоалкіл), -С(О)(С3-6циклоалкіл) і -С(О)(С1-3алкіл);
R2 являє собою Η або С1-3алкіл; причому вказаний С1-3алкіл необов'язково заміщений 1, 2 або 3 замісниками, незалежно вибраними з фтору, -ОН, -О(С1-3алкіл), -CN, -CF3, NH2, -NH(С1-3алкіл) і -N(С1-3алкіл)2; або
R1 і R2 разом з атомом азоту, до якого вони приєднані, утворюють 4-, 5- або 6-членне гетероциклоалкілове кільце; яке необов'язково заміщене 1, 2 або 3 замісниками, незалежно вибраними з фтору, -ОН, -О(С1-3алкіл), -CN, С1-3алкілу, С1-3галоалкілу, -NH2, -NH(С1-3алкіл), N(С1-3алкіл)2 і -CH2CN;
R3 являє собою Н, F, Сl, -CN, С1-3алкіл, -OCF3, -CF3 або -О(С1-3алкіл);
R4 являє собою Н, F, Сl, -CN, С1-3алкіл або -О(С1-3алкіл);
R5 являє собою Н, F, Сl, -CN, С1-3алкіл або -Ο(С1-3алкіл);
R6 являє собою Н, F, Сl, -CN або С1-3алкіл; і
R7 являє собою Н, F, Cl, -CN, С1-3алкіл -CH2CN, -C(O)N(С1-3алкіл)2, -C(O)NH(С1-3алкіл) або -C(O)NH2.
2. Сполука за п. 1 або її фармацевтично прийнятна сіль, в якій Υ являє собою N.
3. Сполука за п. 1 або її фармацевтично прийнятна сіль, в якій Υ являє собою CR.
4. Сполука за п. 3 або її фармацевтично прийнятна сіль, в якій R7 являє собою Н.
5. Сполука за будь-яким з пп. 1-4 або її фармацевтично прийнятна сіль, в якій X являє собою N.
6. Сполука за будь-яким з пп. 1-4 або її фармацевтично прийнятна сіль, в якій X являє собою CR4.
7. Сполука за п. 6 або її фармацевтично прийнятна сіль, в якій R4 являє собою Η або F.
8. Сполука за будь-яким з пп. 1-7 або її фармацевтично прийнятна сіль, в якій W являє собою N.
9. Сполука за будь-яким з пп. 1-7 або її фармацевтично прийнятна сіль, в якій W являє собою CR6.
10. Сполука за п. 9 або її фармацевтично прийнятна сіль, в якій R6 являє собою Н, F або Сl.
11. Сполука за будь-яким з пп. 1-10 або її фармацевтично прийнятна сіль, в якій R5 являє собою Η або F.
12. Сполука за будь-яким з пп. 1-11 або її фармацевтично прийнятна сіль, в якій R6 являє собою Η або F.
13. Сполука за будь-яким з пп. 1-11 або її фармацевтично прийнятна сіль, в якій R6 являє собою Н.
14. Сполука за будь-яким з пп. 1-13 або її фармацевтично прийнятна сіль, в якій R2 являє собою Η або метил.
15. Сполука за будь-яким з пп. 1-13 або її фармацевтично прийнятна сіль, в якій R2 являє собою Н.
16. Сполука за будь-яким з пп. 1-13 або її фармацевтично прийнятна сіль, в якій R2 являє собою метил.
17. Сполука за будь-яким з пп. 1-16 або її фармацевтично прийнятна сіль, в якій R1 являє собою С1-6алкіл, С1-6галоалкіл, С3-6циклоалкіл, С3-6циклоалкіл-С1-3алкіл, 5-6-членний гетероциклоалкіл або 5-6-членний гетероциклоалкіл-С1-3алкіл, причому кожен вказаний С1-6алкіл, С3-6циклоалкіл, С3-6циклоалкіл-С1-3алкіл, 5-6-членний гетероциклоалкіл або 5-6-членний гетероциклоалкіл-С1-3алкіл необов'язково заміщений 1, 2 або 3 замісниками, незалежно вибраними з фтору, -CF3 і метилу.
18. Сполука за будь-яким з пп. 1-16 або її фармацевтично прийнятна сіль, в якій R1 являє собою ізопропіл, етил, 1-метилпропіл, 2,2,2-трифтор-1-метилетил, 1-циклопропілетил, 1-циклогексилетил, циклопропіл, 1-трифторметилциклопропіл, 3,3-дифторциклобутил, 1-(1-метилпіперидин-4-іл)етил, 1-циклопропіл-2,2,2-трифторетил, 2,2,2-трифторетил або 2,2-дифторетил.
19. Сполука за п. 1 або її фармацевтично прийнятна сіль, в якій:
X є N або CR4;
W є N або CR6;
Υ є N або CR7;
R1 являє собою С1-6алкіл, С1-6галоалкіл, С3-6циклоалкіл, С3-6циклоалкіл-С1-3алкіл, 4-6-членний гетероциклоалкіл або 4-6-членний гетероциклоалкіл-С1-3алкіл; причому кожен вказаний С1-6алкіл, С3-6циклоалкіл, С3-6циклоалкіл-С1-3алкіл, 4-6-членний гетероциклоалкіл або 4-6-членний гетероциклоалкіл-С1-3алкіл необов'язково заміщений 1, 2 або 3 замісниками, незалежно вибраними з фтору, -ОН, -О(С1-3алкіл), -CN, -CF3, С1-3алкілу, -NH2, -NH(С1-3алкіл), -N(С1-3алкіл)2, -C(O)N(С1-3алкіл)2, -C(O)NH(С1-3алкіл), -C(O)NH2, -С(О)О(С1-3алкіл), -S(O)2(С1-3алкіл), -S(O)2(С3-6циклоалкіл), -С(О)(С3-6циклоалкіл) і -С(О)(С1-3алкіл);
R2 являє собою Η або С1-3алкіл; причому вказаний С1-3алкіл необов'язково заміщений 1, 2 або 3 замісниками, незалежно вибраними з фтору, -ОН, -О(С1-3алкіл), -CN, -CF3, NH2, -NH(С1-3алкіл) і -N(С1-3алкіл)2; або
R3 являє собою Н, F, Сl, -CN, С1-3алкіл, -OCF3, -CF3 або -О(С1-3алкіл);
R4 являє собою Н, F, Cl, -CN, С1-3алкіл або -О(С1-3алкіл);
R5 являє собою Н, F, Cl, -CN, С1-3алкіл або -О(С1-3алкіл);
R6 являє собою Н, F, Cl, -CN або С1-3алкіл; і
R7 являє собою Н, F, Cl, -CN, С1-3алкіл або -CH2CN.
20. Сполука за п. 1 або її фармацевтично прийнятна сіль, в якій:
X є N або CR4;
W є N або CR6;
Υ є N або CR7;
R1 являє собою С1-6алкіл, С1-6галоалкіл, С3-6циклоалкіл, С3-6циклоалкіл-С1-3алкіл, 5-6-членний гетероциклоалкіл або 5-6-членний гетероциклоалкіл-С1-3алкіл, причому кожен вказаний С1-6алкіл, С3-6циклоалкіл, С3-6циклоалкіл-С1-3алкіл, 4-6-членний гетероциклоалкіл або 4-6-членний гетероциклоалкіл-С1-3алкіл необов'язково заміщений 1, 2 або 3 замісниками, незалежно вибраними з фтору, -ОН, -О(С1-3алкіл), -CN, -CF3, С1-3алкілу, -NH2, -NH(С1-3алкіл) і -N(С1-3алкіл)2;
R2 являє собою Η або метил;
R3 являє собою Н, F, Сl або метил;
R4 являє собою Н, F, Сl або метил;
R5 являє собою Н, F, Сl або метил;
R6 являє собою Н, F, Сl або метил; і
R7 являє собою Н.
21. Сполука за п. 1 або її фармацевтично прийнятна сіль, в якій:
X являє собою N або CR4;
W являє собою N або CR6;
Υ являє собою N або CR7;
R1 являє собою С1-6алкіл, С1-6галоалкіл, С3-6циклоалкіл, С3-6циклоалкіл-С1-3алкіл, 5-6-членний гетероциклоалкіл або 5-6-членний гетероциклоалкіл-С1-3алкіл, причому кожен вказаний С1-6алкіл, С3-6циклоалкіл, С3-6циклоалкіл-С1-3алкіл, 4-6-членний гетероциклоалкіл або 4-6-членний гетероциклоалкіл-С1-3алкіл необов'язково заміщений 1, 2 або 3 замісниками, незалежно вибраними з фтору, -CF3 і метилу;
R2 являє собою Η або метил;
R3 являє собою Н, F або Сl;
R4 являє собою Η або F;
R5 являє собою Η або F;
R6 являє собою Н; і
R7 являє собою Н.
22. Сполука за будь-яким з пп. 1-4, 7 і 10-21, що має Формулу II:
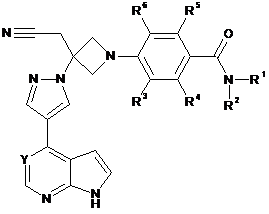 , II
, II
або її фармацевтично прийнятна сіль.
23. Сполука за будь-яким з пп. 1-4 і 10-21, що має Формулу III:
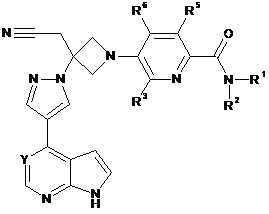 , III
, III
або її фармацевтично прийнятна сіль.
24. Сполука за будь-яким з пп. 1-4 і 11-21, що має Формулу IV:
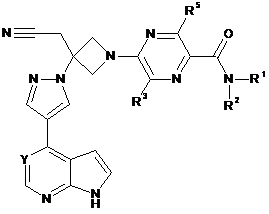 , IV
, IV
або її фармацевтично прийнятна сіль.
25. Сполука за будь-яким з пп. 1, 7 і 10-21, що має Формулу ІІа:
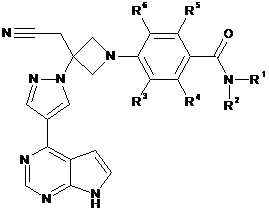 , IIa
, IIa
або її фармацевтично прийнятна сіль.
26. Сполука за будь-яким з пп. 1, 7 і 10-21, що має Формулу IIb:
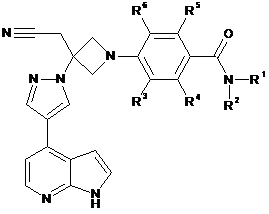 , IIb
, IIb
або її фармацевтично прийнятна сіль.
27. Сполука за будь-яким з пп. 1 і 10-21, що має Формулу IIIа:
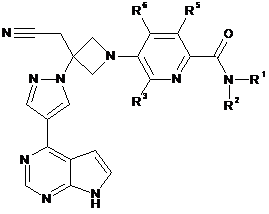 , IIIа
, IIIа
або її фармацевтично прийнятна сіль.
28. Сполука за будь-яким з пп. 1 і 10-21, що має Формулу ІІІb:
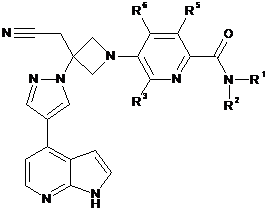 , ІІІb
, ІІІb
або її фармацевтично прийнятна сіль.
29. Сполука за будь-яким з пп. 1 і 11-21, що має Формулу IVa:
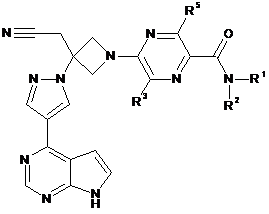 , IVa
, IVa
або її фармацевтично прийнятна сіль.
30. Сполука за будь-яким з пп. 1 і 11-21, що має Формулу IVb:
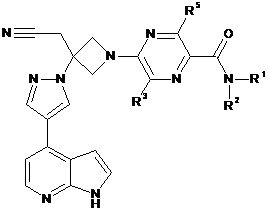 , IVb
, IVb
або її фармацевтично прийнятна сіль.
31. Сполука за п. 1, яка вибрана із:
4-{3-(ціанометил)-3-[4-(1Н-піроло[2,3-b]піридин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-ізопропілбензаміду;
5-{3-(ціанометил)-3-[4-(1Н-піроло[2,3-b]піридин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-[(1S)-1-циклопропілетил]піридин-2-карбоксаміду;
4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-3-фторізопропілбензаміду;
4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-[(1R)-1-циклопропілетил]-3-фторбензаміду;
4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-[(1S)-1-циклопропілетил]-3-фторбензаміду;
4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-2,5-дифтор-N-ізопропілбензаміду;
4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-циклопропіл-3-фтор-N-метилбензаміду;
5-хлор-4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-2-фтор-N-ізопропілбензаміду;
5-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-ізопропілпіридин-2-карбоксаміду;
4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-3-фтор-N-[(1S)-2,2,2-трифтор-1-метилетил]бензаміду;
5-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-[(1S)-1-циклопропілетил]піридин-2-карбоксаміду;
5-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-(3,3-дифторциклобутил)піридин-2-карбоксаміду;
4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-ізопропілбензаміду;
4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-2-фтор-N-ізопропілбензаміду;
4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-[(1S)-1-циклогексилетил]-2-фторбензаміду;
4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-3-фтор-N-[(1R)-2,2,2-трифтор-1-метилетил]бензаміду;
5-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-[1-(трифторметил)циклопропіл]піридин-2-карбоксаміду;
5-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-і-іл]азетидин-1-іл}-N-ізопропілпіразин-2-карбоксаміду;
4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-[1-(1-метилпіперидин-4-іл)етил]бензаміду;
4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-[(1R)-1-циклопропілетил]-2,5-дифторбензаміду;
5-хлор-4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-[(1R)-1-циклопропілетил]-2-фторбензаміду;
4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-2-фтор-Ν-[(1S)-2,2,2-трифтор-1-метилетил]бензаміду;
4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-[(1R)-2,2,2-трифтор-1-метилетил]бензаміду;
5-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-етилпіридин-2-карбоксаміду;
4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-[(1R)-1-метилпропіл]бензаміду і
4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-(2,2,2-трифтор-1-метилетил)бензаміду;
або її фармацевтично прийнятна сіль.
32. Сполука за п. 1, яка вибрана із:
4-{3-(ціанометил)-3-[4-(1Н-піроло[2,3-b]піридин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-3-фтор-N-ізопропілбензаміду;
4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-2,5-дифтор-N-[(1S)-2,2,2-трифтор-1-метилетил]бензаміду;
4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-2,5-дифтор-N-[(1R)-2,2,2-трифтор-1-метилетил]бензаміду;
5-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-Ν-[(1R)-2,2,2-трифтор-1-метилетил]піразин-2-карбоксаміду;
5-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-Ν-[(1S)-2,2,2-трифтор-1-метилетил]піразин-2-карбоксаміду;
5-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-[(1S)-1-циклопропіл-2,2,2-трифторетил]піразин-2-карбоксаміду;
5-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-[1-(трифторметил)циклопропіл]піразин-2-карбоксаміду;
5-{3-(ціанометил)-3-[4-(1Н-піроло[2,3-b]піридин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-ізопропілпіразин-2-карбоксаміду;
5-{3-(ціанометил)-3-[4-(1Н-піроло[2,3-b]піридин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-[(1S)-2,2,2-трифтор-1-метилетил]піразин-2-карбоксаміду;
5-{3-(ціанометил)-3-[4-(1Н-піроло[2,3-b]піридин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-(2,2,2-трифторетил)піразин-2-карбоксаміду;
4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-(2,2-дифторетил)-2,5-дифторбензаміду;
4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-[(1S)-1-циклопропіл-2,2,2-трифторетил]бензаміду;
4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-[(1R)-1-циклопропілетил]-2-фторбензаміду;
5-{3-(ціанометил)-3-[4-(1Н-піроло[2,3-b]піридин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-[1-(трифторметил)циклопропіл]піридин-2-карбоксаміду;
5-{3-(ціанометил)-3-[4-(1Н-піроло[2,3-b]піридин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-[(1S)-1-циклопропілетил]піразин-2-карбоксаміду і
5-{3-(ціанометил)-3-[4-(1Н-піроло[2,3-b]піридин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-N-[(1S)-1-циклопропіл-2,2,2-трифторетил]піразин-2-карбоксаміду;
або її фармацевтично прийнятна сіль.
33. Сполука за п. 1, яка являє собою 4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидін-1-іл}-2,5-дифтор-N-[(1S)-2,2,2-трифтор-1-метилетил]бензамід, або її фармацевтично прийнятна сіль.
34. Сполука за п. 1, яка являє собою 4-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидин-1-іл}-2,5-дифтор-N-[(1R)-2,2,2-трифтор-1-метилетил]бензамід, або її фармацевтично прийнятна сіль.
35. Сполука за п. 1, яка являє собою 5-{3-(ціанометил)-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]азетидін-1-іл}-N-ізопропілпіразин-2-карбоксамід.
36. Сполука за п. 1, яка являє собою 5-{3-(ціанометил)-3-[4-(1Н-піроло[2,3-b]піридин-4-іл)-1Н-піразол-1-іл]азетидін-1-іл}-N-ізопропілпіразин-2-карбоксамід, або її фармацевтично прийнятна сіль.
37. Композиція, що містить сполуку за будь-яким з пп. 1-36 або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій.
38. Спосіб інгібування активності JAK1, в якому JAK1 вводять в контакт із сполукою за будь-яким з пп. 1-36 або її фармацевтично прийнятною сіллю.
39. Спосіб за п. 38, в якому вказана сполука або її фармацевтично прийнятна сіль є селективною для JAK1, порівняно з JAK2.
40. Спосіб лікування аутоіммунного захворювання, раку, мієлопроліферативного розладу, запального захворювання, хвороби резорбції кісток або відторгнення трансплантата органа у пацієнта, який потребує цього, що включає введення вказаному пацієнту терапевтично ефективної кількості сполуки за будь-яким з пп. 1-36 або її фармацевтично прийнятної солі.
41. Спосіб за п. 40, в якому вказане аутоіммунне захворювання є шкірним розладом, розсіяним склерозом, ревматоїдним артритом, псоріатичним артритом, ювенільним артритом, діабетом І типу, вовчаком, запальною хворобою кишечнику, хворобою Крона, міастенією, імуноглобулін-нефропатією, міокардитом або аутоімунним тироїдним розладом.
42. Спосіб за п. 40, в якому вказаним аутоімунним захворюванням є ревматоїдний артрит.
43. Спосіб за п. 40, в якому вказане аутоімунне захворювання являє собою шкірний розлад, що вибирається з атопічного дерматиту, псоріазу, шкірної сенсибілізації, подразнення шкіри, шкірного висипу, контактного дерматиту або алергічної контактної сенсибілізації.
44. Спосіб за п. 40, в якому вказаний рак є раком простати, раком нирок, раком печінки, раком грудей, раком легенів, раком щитовидної залози, саркомою Капоші, хворобою Каслмана або раком підшлункової залози.
45. Спосіб за п. 40, в якому вказаний рак є лімфомою, лейкозом або множинною мієломою.
46. Спосіб за п. 40, в якому вказане мієлопроліферативне порушення являє собою справжню поліцитемію (PV), есенційну тромбоцитемію (ЕТ), первинний мієлофіброз (PMF), хронічний мієлолейкоз (CML), хронічний мієломоноцитарний лейкоз (CMML), гіпереозинофільний синдром (HES), ідіопатичний мієлофіброз (IMF) або системний мастоцитоз (SMCD).
47. Спосіб за п. 40, в якому вказаний мієлопроліферативний розлад являє собою мієлофіброз.
48. Спосіб за п. 40, в якому вказаний мієлопроліферативний розлад являє собою первинний мієлофіброз (PMF).
49. Спосіб за п. 40, в якому вказаний мієлопроліферативний розлад являє собою пост-мієлофіброз після справжньої поліцитемії (POST-PV MF).
50. Спосіб за п. 40, в якому вказаний мієлопроліферативний розлад являє собою пост-есенційну тромбоцитемію мієлофіброзу (POST-ET MF).
51. Спосіб за п. 40, в якому вказана хвороба резорбції кісток являє собою остеопороз, остеоартрит, резорбцію кісток, пов'язану з гормональним дисбалансом, резорбцію кісток, пов'язану з гормональною терапією, резорбцію кісток, пов'язану з аутоімунним захворюванням, або резорбцію кісток, пов'язану з раком.
Текст
Реферат: У даному винаході представлені азетидинілфенілові, піридилові або піразинілкарбоксамідні похідні формули (1), а також їх композиції і способи їх застосування, які модулюють активність Янус-кіназ (JAK) і придатні для лікування захворювань, пов'язаних з активністю JAK, включаючи, наприклад, запальні розлади, аутоіммунні розлади, рак і інші захворювання. UA 110978 C2 (12) UA 110978 C2 I UA 110978 C2 5 10 15 20 25 30 35 40 45 50 55 60 Дана заявка заявляє пріоритет на основі попередніх заявок на патент США з серійними номерами 61/498942, поданою 20 червня 2011 року, і 61/591094, поданою 26 січня 2012 року, кожна з яких включена у даний документ шляхом посилання у повному обсязі. ОБЛАСТЬ ТЕХНІКИ У даному винаході представлені азетидиніл-фенілові, піридилові або піразинілкарбоксамідні похідні, а також їх композиції і способи їх застосування, які інгібують активність янус-кіназ (JAK) і придатні для лікування захворювань, пов'язаних з активністю JAK, включаючи, наприклад, запальні розлади, аутоіммунні розлади, рак і інші захворювання. РІВЕНЬ ТЕХНІКИ Протеїнкінази (РК) регулюють різні важливі біологічні процеси, включаючи, окрім іншого, зростання, виживання і диференціювання клітин, формування органів, морфогенез, неоваскуляризацію, відновлення і регенерацію тканин. Протеїнкінази також відіграють спеціалізовані ролі у носії захворювань людини, включаючи рак. Цитокіни, поліпептиди з низькою молекулярною масою, або глікопротеїни, регулюють багато шляхів, що беруть участь у запальній реакції господаря на сепсис. Цитокіни впливають на диференціювання, проліферацію і активацію клітин, і можуть модулювати прозапальні і протизапальні реакції для забезпечення відповідної реакції господаря на патогени. Передача сигналів широкого ряду цитокінів зачіпає сімейство Янус-кіназ (JAK) протеїн-тирозинкіназ і сигнальні трансдуктори і активатори транскрипції (STAT). Відомо чотири JAK ссавців: JAK1 (Янус-кіназа-1), JAK2, JAK3 (також відома як Янус-кіназа, лейкоцит; JAKL; і L-JAK), і TYK2 (протеїн-тирозинкіназа 2). Цитокін-стимульовані імунні і запальні реакції сприяють патогенезу захворювань: патологій, таких як важкий комбінований імунодефіцит (ВКІД), що виникає через придушення імунної системи, тоді як гіперактивна або невідповідна імунна/запальна реакція сприяє патології аутоімунних захворювань (наприклад, астми, системного червоного вовчаку, тиреоїдиту, міокардиту) і хвороб, таких як склеродермія і остеоартрит (Ortmann, R. A., T. Cheng, et al. (2000) Arthritis Res 2 (1): 16-32). Недолік експресії JAK пов'язаний з багатьма хворобливими станами. Наприклад, миші JAK1/- низькорослі від народження, відмовляються від годування і гинуть внутрішньоутробно (Rodig, S. J., M. A. Meraz, et al. (1998) Cell 93 (3): 373-83). Ембріони мишей JAK2-/- є анемічними і гинуть приблизно на 12,5 день після запліднення через відсутність дефенітивного еритропоезу. Шлях JAK/STAT і, зокрема, всі чотири JAK, імовірно відіграють роль у патогенезі астматичної реакції, хронічній обструктивній хворобі легенів, бронхіті і інших родинних запальних захворюваннях нижніх дихальних шляхів. Багато цитокінів, що передають сигнал через JAK, пов'язані із запальними захворюваннями/станами верхніх дихальних шляхів, таких як ті, що вражають ніс і пазухи (наприклад, риніт і синусит), які є класичними алергічними реакціями або не є ними. Шлях JAK/STAT також бере участь у запальних захворюваннях/станах очей і хронічних алергічних реакціях. Активація JAK/STAT при раку може виникати шляхом стимуляції цитокінів (наприклад, IL-6 або GM-CSF) або шляхом зниження в ендогенних супресорах передачі сигналів JAK, таких як SOCS (супресор передачі сигналів цитокінів) або PIAS (білковий інгібітор активованого STAT) (Boudny, V., and Kovarik, J., Neoplasm. 49:349-355, 2002). Активація передачі сигналів STAT, а також інших низхідних шляхів JAK (наприклад, Akt) пов'язана з поганим прогнозом у багатьох типах раку (Bowman, T., et al. Oncogene 19:2474-2488, 2000). Підвищені рівні циркулюючих цитокінів, які передають сигнал через JAK/STAT, відіграють причинну роль у кахексії та/або хронічній втомі. Тому інгібування JAK може бути корисним для онкологічних пацієнтів за причинами, які виходять за межі потенційної протипухлинної активності. JAK2 тирозинкіназа може бути корисною для пацієнтів з мієлопроліферативними порушеннями, наприклад, дійсною поліцитемією (PV), есенціальною тромбоцитемією (ET), мієлоїдною метаплазією з мієлофіброзом (MMM) (Levin, et al., Cancer Cell, том 7, 2005: 387-397). Інгібування кінази JAK2V617F знижує проліферацію гематопоетичних клітин, що дозволяє передбачити, що JAK2 є потенційною мішенню для фармакологічного інгібування у пацієнтів з PV, ET і MMM. Інгібування JAK може принести користь пацієнтам, страждаючим на шкірні імунні порушення, такі як псоріаз і шкірна сенсибілізація. Збереження псоріазу, імовірно, залежить від ряду запальних цитокінів, окрім різних хемокінів і факторів зростання (JCI, 113:1664-1675), багато з яких передають сигнал через JAK (Adv Pharmacol. 2000; 47:113-74). Так, нові або вдосконалені агенти, що інгібують такі кінази, як JAK, постійно вимагають розробки нових і ефективніших лікарських засобів, призначених для посилення або придушення імунних і запальних шляхів (таких як імуносупресорні агенти для трансплантатів органів), а також агенти для запобігання і лікування аутоіммунних захворювань, захворювань, що 1 UA 110978 C2 5 10 15 20 25 30 35 включають гіперактивну запальну реакцію (наприклад, екзему), алергій, раку (наприклад, простати, лейкозу, множинної мієломи) і деяких імунних реакцій (наприклад, шкірного висипу або контактного дерматиту або діареї), викликаних іншими терапевтичними засобами. Сполуки за даним винаходом, а також їх композиції і способи, описані в даному документі, направлені на задоволення цих потреб і інших цілей. КОРОТКИЙ ОПИС У даному винаході, окрім іншого, представлені сполуки Формули I: I або їх фармацевтично прийнятні солі; де змінні є такими, як описано в даному документі. У даному винаході додатково представлені композиції, що містять сполуку Формули I або її фармацевтично прийнятну сіль, і фармацевтично прийнятний носій. У даному винаході додатково представлені способи модулювання активності JAK1, що включають взаємодію JAK1 із сполукою Формули I або її фармацевтично прийнятною сіллю. У даному винаході додатково представлені способи лікування захворювань або розладів, пов'язаних з аномальною експресією кінази або активністю в організмі пацієнта, шляхом введення пацієнту терапевтично ефективної кількості сполуки Формули I або її фармацевтично прийнятної солі. У даному винаході додатково представлені способи лікування аутоіммунного захворювання, раку, мієлопроліферативного розладу, запального захворювання, хвороби резобрції кісток, відторгнення трансплантата органу у пацієнта, який потребує такого лікування, що включають введення вказаному пацієнту терапевтично ефективної кількості сполуки Формули I або її фармацевтично прийнятній солі. У даному винаході також представлені сполуки Формули I або їх фармацевтично прийнятні солі, описані в даному документі, для застосування при лікуванні аутоіммунних захворювань, раку, мієлопроліферативних розладів, запальних захворювань, хвороби резорбції кісток або відторгнення трансплантата органу. У даному винаході додатково представлені сполуки Формули I, описані в даному документі, або їх фармацевтично прийнятні солі для застосування при модулювання JAK1. У даному винаході представлено також застосування сполук Формули I, описаних у даному документі, або їх фармацевтично прийнятних солей, для приготування лікарських засобів для застосування у способах модулювання JAK1. Подробиці одного або більше варіантів реалізації даного винаходу представлені далі у викладеному нижче описі. Інші особливості, цілі і переваги даного винаходу зрозумілі з опису і формули винаходу. ДЕТАЛЬНИЙ ОПИС У даному винаході, окрім іншого, представлена сполука Формули I: I 40 або його фармацевтично прийнятна сіль, де: 4 X є N або CR ; 2 UA 110978 C2 6 5 10 15 20 25 30 35 40 45 50 55 60 W є N або CR ; 7 Y є N або CR ; 1 R є C1-6 алкілом, C1-6 галоалкілом, C3-6 циклоалкілом, C3-6 циклоалкіл-C1-3 алкілом, 4-6членним гетероциклоалкілом або 4-6-членним гетероциклоалкіл-C1-3 алкілом; причому кожен вказаний C1-6 алкіл, C3-6 циклоалкіл, C3-6 циклоалкіл-C1-3 алкіл, 4-6-членний гетероциклоалкіл і 46-членний гетероциклоалкіл-C1-3 алкіл необов'язково заміщені 1, 2 або 3 замісниками, незалежно вибраними з фтору, -OH, -O(C1-3 алкіл), -CN, -CF3, C1-3 алкіла, -NH2, -NH(C1-3 алкіл), N(C1-3 алкіл)2, -C(O)N(C1-3 алкіл)2, -C(O)NH(C1-3 алкіл), -C(O)NH2, -C(O)O(C1-3 алкіл), -S(O)2(C1-3 алкіл), -S(O)2(C3-6 циклоалкіл), -C(O)(C3-6 циклоалкіл) і -C(O)(C1-3 алкіл); 2 R є H або C1-3 алкілом; причому вказаний C1-3 алкіл необов'язково заміщений 1, 2 або 3 замісниками, незалежно вибраними з фтору, -OH, -O(C1-3 алкіл), -CN, -CF3, NH2, -NH(C1-3 алкіл) та -N(C1-3 алкіл)2; або 1 2 R і R разом з атомом азоту, до якого вони приєднані, утворюють 4-, 5- або 6-членне гетероциклоалкілове кільце; яке необов'язково заміщене 1, 2 або 3 замісниками, незалежно вибраними з фтору, -OH, -O(C1-3 алкіл), -CN, C1-3 алкілу, C1-3 галоалкіла, -NH2, -NH(C1-3 алкіл), N(C1-3 алкіл)2 та -CH2CN; 3 R є H, F, Cl, -CN, C1-3 алкілом, -OCF3, -CF3 або -O(C1-3 алкіл); 4 R є H, F, Cl, -CN, C1-3 алкілом або -O(C1-3 алкіл); 5 R є H, F, Cl, -CN, C1-3 алкілом або -O(C1-3 алкіл); 6 R є H, F, Cl, -CN або C1-3 алкілом; і 7 R є H, F, Cl, -CN, C1-3 алкілом, -CH2CN, -C(O)N(C1-3 алкіл)2, -C(O)NH(C1-3 алкіл) або -C(O)NH2. У деяких варіантах реалізації, Y є N. 7 У деяких варіантах реалізації, Y є CR . 7 У деяких варіантах реалізації, R є Н. У деяких варіантах реалізації, X є N. 4 У деяких варіантах реалізації, X є CR . 4 У деяких варіантах реалізації, R є Н або F. У деяких варіантах реалізації, W є N. 6 У деяких варіантах реалізації, W є CR . 6 У деяких варіантах реалізації, R є H, F або Cl. 5 У деяких варіантах реалізації, R є Н або F. 6 У деяких варіантах реалізації, R є Н або F. 6 У деяких варіантах реалізації, R є Н. 2 У деяких варіантах реалізації, R є Н або метилом. 2 У деяких варіантах реалізації, R є Н. 2 У деяких варіантах реалізації, R є метилом. 1 У деяких варіантах реалізації, R є C1-6 алкілом, C1-6 галоалкілом, C3-6 циклоалкілом, C3-6 циклоалкіл-C1-3 алкілом, 5-6-членним гетероциклоалкілом або 5-6-членним гетероциклоалкіл-C13 алкілом, причому кожен вказаний C1-6 алкіл, C3-6 циклоалкіл, C3-6 циклоалкіл-C1-3 алкіл, 5-6членний гетероциклоалкіл і 5-6-членний гетероциклоалкіл-C1-3 алкіл необов'язково заміщені 1, 2 або 3 замісниками, незалежно вибраними з фтору, -CF3 і метила. 1 У деяких варіантах реалізації, R є ізопропілом, етилом, 1-метилпропілом, 2,2,2-трифтор-1метилетилом, 1-циклопропілетилом, 1-циклогексилетилом, циклопропілом, 1трифторметилциклопропілом, 3,3-дифторциклобутилом, 1-(1-метилпіперидин-4-іл)етилом, 1циклопропіл-2,2,2-трифторетилом, 2,2,2-трифторетилом або 2,2-дифторетилом. 1 У деяких варіантах реалізації, R є ізопропілом, етилом, 1-метилпропілом, 2,2,2-трифтор-1метилетилом, 1-циклопропілетилом, 1-циклогексилетилом, циклопропілом, 1трифторметилциклопропілом, 3,3-дифторциклобутилом або 1-(1-метилпіперидин-4-іл)етилом. 1 У деяких варіантах реалізації, R є ізопропілом. 1 У деяких варіантах реалізації, R є етилом. 1 У деяких варіантах реалізації, R є 1-метилпропілом. 1 У деяких варіантах реалізації, R є 2,2,2-трифтор-1-метилетилом. 1 У деяких варіантах реалізації, R є 1-трифторметилциклопропілом. 1 У деяких варіантах реалізації, R є 1-циклопропіл-2,2,2-трифторетилом. 1 У деяких варіантах реалізації, R є 2,2,2-трифторетилом. 1 У деяких варіантах реалізації, R є 2,2-дифторетилом. В одному варіанті реалізації (а): 4 X є N або CR ; 6 W є N або CR ; 7 Y є N або CR ; 3 UA 110978 C2 1 5 10 15 20 25 30 35 40 45 50 R є C1-6 алкілом, C1-6 галоалкілом, C3-6 циклоалкілом, C3-6 циклоалкіл-C1-3 алкілом, 4-6членним гетероциклоалкілом або 4-6-членним гетероциклоалкіл-C1-3 алкілом; причому кожен вказаний C1-6 алкіл, C3-6 циклоалкіл, C3-6 циклоалкіл-C1-3 алкіл, 4-6-членний гетероциклоалкіл або 4-6-членний гетероциклоалкіл-C1-3 алкіл необов'язково заміщені 1, 2 або 3 замісниками, незалежно вибраними з фтору, -OH, -O(C1-3 алкіл), -CN, -CF3, C1-3 алкілу, -NH2, -NH(C1-3 алкіл), N(C1-3 алкіл)2, -C(O)N(C1-3 алкіл)2, -C(O)NH(C1-3 алкіл), -C(O)NH2, -C(O)O(C1-3 алкіл), -S(O)2(C1-3 алкіл), -S(O)2(C3-6 циклоалкіл), -C(O)(C3-6 циклоалкіл) та -C(O)(C1-3 алкіл); 2 R є H або C1-3 алкілом; причому вказаний C1-3 алкіл необов'язково заміщений 1, 2 або 3 замісниками, незалежно вибраними з фтору, -OH, -O(C1-3 алкіл), -CN, -CF3, NH2, -NH(C1-3 алкіл) та -N(C1-3 алкіл)2; або 3 R є H, F, Cl, -CN, C1-3 алкілом, -OCF3, -CF3 або -O(C1-3 алкіл); 4 R є H, F, Cl, -CN, C1-3 алкіл або -O(C1-3 алкіл); 5 R є H, F, Cl, -CN, C1-3 алкіл або -O(C1-3 алкіл); 6 R є H, F, Cl, -CN або C1-3 алкілом; і 7 R є H, F, Cl, -CN, C1-3 алкілом або -CH2CN. У іншому варіанті реалізації (b): 4 X є N або CR ; 6 W є N або CR ; 7 Y є N або CR ; 1 R є C1-6 алкілом, C1-6 галоалкілом, C3-6 циклоалкілом, C3-6 циклоалкіл-C1-3 алкілом, 5-6членним гетероциклоалкілом або 5-6-членним гетероциклоалкіл-C1-3 алкілом, причому кожен вказаний C1-6 алкіл, C3-6 циклоалкіл, C3-6 циклоалкіл-C1-3 алкіл, 4-6-членний гетероциклоалкіл або 4-6-членний гетероциклоалкіл-C1-3 алкіл необов'язково заміщені 1, 2 або 3 замісниками, незалежно вибраними з фтору, -OH, -O(C1-3 алкіл), -CN, -CF3, C1-3 алкілу, -NH2, -NH(C1-3 алкіл) та -N(C1-3 алкіл)2; 2 R є H або метилом; 3 R є H, F, Cl або метилом; 4 R є H, F, Cl або метилом; 5 R є H, F, Cl або метилом; 6 R є H, F, Cl або метилом; і 7 R є H. У іншому варіанті реалізації (с): 4 X є N або CR ; 6 W є N або CR ; 7 Y є N або CR ; 1 R є C1-6 алкілом, C1-6 галоалкілом, C3-6 циклоалкілом, C3-6 циклоалкіл-C1-3 алкілом, 5-6членним гетероциклоалкілом або 5-6-членним гетероциклоалкіл-C1-3 алкілом, причому кожен вказаний C1-6 алкіл, C3-6 циклоалкіл, C3-6 циклоалкіл-C1-3 алкіл, 4-6-членний гетероциклоалкіл або 4-6-членний гетероциклоалкіл-C1-3 алкіл необов'язково заміщені 1, 2 або 3 замісниками, незалежно вибраними з фтору, -CF3 і метила; 2 R є H або метилом; 3 R є H, F або Cl; 4 R є H або F; 5 R є H або F; 6 R є H; і 7 R є H. У деяких варіантах реалізації, сполукою є сполука Формули II: II або її фармацевтично прийнятна сіль. У деяких варіантах реалізації, сполукою є сполука Формули III: 4 UA 110978 C2 III або її фармацевтично прийнятна сіль. У деяких варіантах реалізації, сполукою є сполука Формули IV: 5 IV або її фармацевтично прийнятна сіль. У деяких варіантах реалізації, сполукою є сполука Формули IIa: 10 15 IIa або її фармацевтично прийнятна сіль. У деяких варіантах реалізації, сполукою є сполука Формули IIb: IIb або її фармацевтично прийнятна сіль. У деяких варіантах реалізації, сполукою є сполука Формули IIIa: 5 UA 110978 C2 IIIa або її фармацевтично прийнятна сіль. У деяких варіантах реалізації, сполукою є сполука Формули IIIb: 5 IIIb або її фармацевтично прийнятна сіль. У деяких варіантах реалізації, сполукою є сполука Формули IVa: 10 15 20 IVa або її фармацевтично прийнятна сіль. У деяких варіантах реалізації, сполукою є сполука Формули IVb: IVb або її фармацевтично прийнятна сіль. 1 2 3 4 5 6 У деяких варіантах реалізації, сполука має Формулу II, причому Y, R , R , R , R , R , R є такими, як описано у варіанті реалізації (a). 1 2 3 5 6 У деяких варіантах реалізації, сполука має Формулу III, причому Y, R , R , R , R , R є такими, як описано у варіанті реалізації (a). 1 2 3 5 У деяких варіантах реалізації, сполука має Формулу IV, причому Y, R , R , R і R є такими, як описано у варіанті реалізації (a). 1 2 3 4 5 6 У деяких варіантах реалізації, сполука має Формулу II, причому Y, R , R , R , R , R , R є такими, як описано у варіанті реалізації (b). 6 UA 110978 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 2 3 5 6 У деяких варіантах реалізації, сполука має Формулу III, причому Y, R , R , R , R , R є такими, як описано у варіанті реалізації (b). 1 2 3 5 У деяких варіантах реалізації, сполука має Формулу IV, причому Y, R , R , R і R є такими, як описано у варіанті реалізації (b). 1 2 3 4 5 У деяких варіантах реалізації, сполука має Формулу II, причому Y, R , R , R , R , R , R6 є такими, як описано у варіанті реалізації (с). 1 2 3 5 6 У деяких варіантах реалізації, сполука має Формулу III, причому Y, R , R , R , R , R є такими, як описано у варіанті реалізації (с). 1 2 3 5 У деяких варіантах реалізації, сполука має Формулу IV, причому Y, R , R , R і R є такими, як описано у варіанті реалізації (с). 1 2 3 4 5 6 У деяких варіантах реалізації, сполука має Формулу IIa, причому R , R , R , R , R , R є такими, як описано у варіанті реалізації (a). 1 2 3 4 5 6 У деяких варіантах реалізації, сполука має Формулу IIa, причому R , R , R , R , R , R є такими, як описано у варіанті реалізації (b). 1 2 3 4 5 6 У деяких варіантах реалізації, сполуки має Формулу IIa, причому R , R , R , R , R , R є такими, як описано у варіанті реалізації (с). 1 2 3 5 6 У деяких варіантах реалізації, сполука має Формулу IIIa, причому R , R , R , R , R є такими, як описано у варіанті реалізації (a). 1 2 3 5 6 У деяких варіантах реалізації, сполука має Формулу IIIa, причому R , R , R , R , R є такими, як описано у варіанті реалізації (b). 1 2 3 5 6 У деяких варіантах реалізації, сполука має Формулу IIIa, причому R , R , R , R , R є такими, як описано у варіанті реалізації (с). 1 2 3 5 У деяких варіантах реалізації, сполука має Формулу IVa, причому R , R , R і R є такими, як описано у варіанті реалізації (a). 1 2 3 5 У деяких варіантах реалізації, сполука має Формулу IVa, причому R , R , R і R є такими, як описано у варіанті реалізації (b). 1 2 3 5 У деяких варіантах реалізації, сполука має Формулу IVa, причому R , R , R і R є такими, як описано у варіанті реалізації (с). 1 2 3 4 5 6 У деяких варіантах реалізації, сполука має Формулу IIb, причому R , R , R , R , R , R є такими, як описано у варіанті реалізації (a). 1 2 3 4 5 6 У деяких варіантах реалізації, сполука має Формулу IIb, причому R , R , R , R , R , R є такими, як описано у варіанті реалізації (b). 1 2 3 4 5 6 У деяких варіантах реалізації, сполука має Формулу IIb, причому R , R , R , R , R , R є такими, як описано у варіанті реалізації (с). 1 2 3 5 6 У деяких варіантах реалізації, сполука має Формулу IIIb, причому R , R , R , R , R є такими, як описано у варіанті реалізації (a). 1 2 3 5 6 У деяких варіантах реалізації, сполука має Формулу IIIb, причому R , R , R , R , R є такими, як описано у варіанті реалізації (b). 1 2 5 6 У деяких варіантах реалізації, сполука має Формулу IIIb, причому R , R , R3, R , R є такими, як описано у варіанті реалізації (с). 1 2 3 5 У деяких варіантах реалізації, сполука має Формулу IVa, причому R , R , R і R є такими, як описано у варіанті реалізації (a). 1 2 3 5 У деяких варіантах реалізації, сполука має Формулу IVa, причому R , R , R і R є такими, як описано у варіанті реалізації (b). 1 2 3 5 У деяких варіантах реалізації, сполука має Формулу IVa, причому R , R , R і R є такими, як описано у варіанті реалізації (с). У деяких варіантах реалізації, сполука вибрана з: 4-{3-(Ціанометил)-3-[4-(1H-піроло[2,3-b]піридин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-Nізопропілбензаміда; 5-{3-(Ціанометил)-3-[4-(1H-піроло[2,3-b]піридин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N-[(1S)-1циклопропілетил]піридин-2-карбоксаміда; 4-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-3фтор-N-ізопропілбензаміда; 4-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N[(1R)-1-циклопропілетил]-3-фторбензаміда; 4-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N[(1S)-1-циклопропілетил]-3-фторбензаміда; 4-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-2,5дифтор-N-ізопропілбензаміда; 4-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N 7 UA 110978 C2 5 10 15 20 25 30 35 40 45 50 55 60 циклопропіл-3-фтор-N-метилбензаміда; 5-Хлор-4-{3-(ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}2-фтор-N-ізопропілбензаміда; 5-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-Nізопропілпіридин-2-карбоксаміда; 4-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-3фтор-N-[(1S)-2,2,2-трифтор-1-метилетил]бензаміду; 5-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N[(1S)-1-циклопропілетил]піридин-2-карбоксаміда; 5-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N-(3,3дифторциклобутил)піридин-2-карбоксаміда; 4-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-Nізопропілбензаміда; 4-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-2фтор-N-ізопропілбензаміда; 4-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N[(1S)-1-циклогексилетил]-2-фторбензаміда; 4-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-3фтор-N-[(1R)-2,2,2-трифтор-1-метилетил]бензаміда; 5-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N-[1(трифторметил)циклопропіл]піридин-2-карбоксаміда; 5-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-Nізопропілпіразин-2-карбоксаміда; 4-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N-[1-(1метилпіперидин-4-іл)етил]бензаміда; 4-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N[(1R)-1-циклопропілетил]-2,5-дифторбензаміда; 5-Хлор-4-{3-(ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}N-[(1R)-1-циклопропілетил]-2-фторбензаміда; 4-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-2фтор-N-[(1S)-2,2,2-трифтор-1-метилетил]бензаміда; 4-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N[(1R)-2,2,2-трифтор-1-метилетил]бензаміда; 5-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-Nетилпіридин-2-карбоксаміда; 4-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N[(1R)-1-метилпропіл]бензаміда; і 4-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N(2,2,2-трифтор-1-метилетил)бензаміда; або її фармацевтично прийнятна сіль. У деяких варіантах реалізації, сполука вибрана з: 4-{3-(Ціанометил)-3-[4-(1H-піроло[2,3-b]піридин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-3-фторN-ізопропілбензаміда; 4-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-2,5дифтор-N-[(1S)-2,2,2-трифтор-1-метилетил]бензаміда; 4-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-2,5дифтор-N-[(1R)-2,2,2-трифтор-1-метилетил]бензаміда; 5-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N[(1R)-2,2,2-трифтор-1-метилетил]піразин-2-карбоксаміда; 5-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N[(1S)-2,2,2-трифтор-1-метилетил]піразин-2-карбоксаміда; 5-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N[(1S)-1-циклопропіл-2,2,2-трифторетил]піразин-2-карбоксаміда; 5-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N-[1(трифторметил)циклопропіл]піразин-2-карбоксаміда; 5-{3-(Ціанометил)-3-[4-(1H-піроло[2,3-b]піридин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-Nізопропілпіразин-2-карбоксаміда; 5-{3-(Ціанометил)-3-[4-(1H-піроло[2,3-b]піридин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N-[(1S)2,2,2-трифтор-1-метилетил]піразин-2-карбоксаміда; 5-{3-(Ціанометил)-3-[4-(1H-піроло[2,3-b]піридин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N-(2,2,2 8 UA 110978 C2 5 10 15 20 25 30 35 трифторетил)піразин-2-карбоксаміда; 4-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N-(2,2дифторетил)-2,5-дифторбензаміда; 4-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N[(1S)-1-циклопропіл-2,2,2-трифторетил]бензаміда; 4-{3-(Ціанометил)-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N[(1R)-1-циклопропілетил]-2-фторбензаміда; 5-{3-(Ціанометил)-3-[4-(1H-піроло[2,3-b]піридин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N-[1(трифторметил) циклопропіл]піридин-2-карбоксаміда; 5-{3-(Ціанометил)-3-[4-(1H-піроло[2,3-b]піридин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N-[(1S)-1циклопропілетил]піразин-2-карбоксаміда; 5-{3-(Ціанометил)-3-[4-(1H-піроло[2,3-b]піридин-4-іл)-1H-піразол-1-іл]азетидин-1-іл}-N-[(1S)-1циклопропіл-2,2,2-трифторетил]піразин-2-карбоксаміда; або її фармацевтично прийнятна сіль. Далі слід розуміти, що певні особливості даного винаходу, які для ясності описані в контексті окремих варіантів реалізації, також можуть бути представлені в комбінації у складі одного варіанту реалізації (тоді як варіанти реалізації призначені для комбінування так, як якби вони були записані у багатократно залежній формі). І навпаки, різні особливості даного винаходу, які скорочено описані в контексті одного варіанту реалізації, можуть бути представлені окремо або в будь-якій прийнятній підкомбінації. У різних місцях даного опису замісники сполук за даним винаходом описані в групах або в діапазонах. Особливо мається на увазі, що даний винахід включає кожну і будь-яку індивідуальну підкомбінацію членів таких груп і діапазонів. Наприклад, термін «C 1-6 алкіл» особливо має на увазі індивідуальний опис метила, етила, C 3 алкіла, C4 алкіла, C5 алкіла і C6 алкіла. Термін «n-членний», де n є цілим числом, зазвичай описує кількість атомів, що утворюють кільце, у фрагменті, причому кількість атомів, що утворюють кільце, дорівнює n. Наприклад, піперидиніл є прикладом 6-членного гетероциклоалкілового кільця, піразоліл є прикладом 5членного гетероарилового кільця, піридил є прикладом 6-членного гетероарилового кільця, і 1,2,3,4-тетрагідронафталін є прикладом 10-членної циклоалкілової групи. Для сполук за даним винаходом, у яких змінні виникають більше одного разу, кожна змінна може бути різним фрагментом, незалежно вибраним з групи, що визначає цю змінну. Наприклад, якщо структура описана як така, що має дві групи R, що одночасно присутні в одній і тій самій сполуці, то ці дві групи R можуть бути різними фрагментами, незалежно вибраними з групи, визначеної для R. У іншому прикладі, якщо необов'язково складний замісник указаний у формі: (R)p (CH2)n Q 40 45 50 55 , то слід розуміти, що замісник R може виникати в кільці р разів, і R у кожному випадку може бути різним фрагментом. Слід розуміти, що кожна група R може заміщати будь-який атом водню, приєднаний до кільцевого атома, включаючи один або обидва атоми водню в (CH 2)n. Далі, у представленому вище прикладі, якщо змінна Q описана як така, що включає атоми водню, як якщо вказано, що Q є CH2, NH і так далі, то будь-який вільний замісник, такий як R у представленому вище прикладі, може заміщати водень змінної Q, а також водень у будь-якому іншому компоненті кільця, що не є змінною. При використанні в даному документі, вираз «необов'язково заміщений» означає незаміщений або заміщений. При використанні в даному документі, термін «заміщений» означає, що атом водню видалений і замінений замісником. Слід розуміти, що заміщення у даного атома обмежене валентністю. При використанні в даному документі, термін «C n-m алкіл», що використовується окремо або в комбінації з іншими термінами, відноситься до насиченої вуглеводневої групи, яка може бути прямою або розгалуженою, і такою, що має від n до m вуглецевих атомів. У деяких варіантах реалізації, алкілова група містить від 1 до 6, від 1 до 4 або від 1 до 3 вуглецевих атомів. Приклади алкілових фрагментів груп включають, але не обмежуючись цим, хімічні групи, такі як метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил, н-пентил, 2-метил-1бутил, 3-пентил, н-гексил, 1,2,2-триметилпропіл і тому подібні. При використанні в даному документі, термін «гало» або «галоген», що використовується окремо або в комбінації з іншими термінами, включає фтор, хлор, бром і йод. При використанні в цьому документі, термін «C n-m галоалкіл», що використовується окремо 9 UA 110978 C2 5 10 15 20 25 30 35 40 45 50 55 60 або в комбінації з іншими термінами, відноситься до C n-m алкілової групи, що має до {2(від n до m)+1} атомів галогену, які можуть бути однаковими або різними. У деяких варіантах реалізації, атомами галогену є атоми фтору. У деяких варіантах реалізації, алкілова група має від 1 до 6 або від 1 до 4 вуглецевих атомів. Приклади галоалкілових груп включають CF3, C2F5, CHF2, CCl3, CHCl2, C2Cl5 і тому подібні. У деяких варіантах реалізації, галоалкілова група є фторалкіловою групою. При використанні в цьому документі, термін «C n-m циклоалкіл», що використовується окремо або в комбінації з іншими термінами, відноситься до неароматичного циклічного вуглеводня, включаючи циклізовані алкілові і алкенілові групи, і який має від n до m кільцевих атомів вуглецю. Циклоалкілові групи можуть містити моно- або біциклічні (наприклад, такі, що мають два конденсованих або мостикових кільця) кільцеві системи. Один або більше утворюючих кільце вуглецевих атомів циклоалкілової групи можуть бути необов'язково заміщені оксогрупою. Циклоалкілові групи включають також циклоалкілідени. У деяких варіантах реалізації, циклоалкілова група має 3, 4, 5 або 6 кільцевих членів. У деяких варіантах реалізації, циклоалкілова група має від 3 до 6 кільцевих членів, від 3 до 5 кільцевих членів або від 3 до 4 кільцевих членів. У деяких варіантах реалізації, циклоалкілова група є моноциклічною. У деяких варіантах реалізації, циклоалкілова група є моноциклічною або біциклічною. У деяких варіантах реалізації, циклоалкілова група є C3-6 моноциклічною циклоалкіловою групою. Приклади циклоалкілових груп включають циклопропіл, циклобутил, циклопентил, циклогексил, циклопентеніл, циклогексеніл, циклогексадієніл, норборніл, норпініл, біцикло[2.1.1]гексаніл, біцикло[1.1.1]пентаніл і тому подібні. При використанні в цьому документі, термін «C n-m циклоалкіл-Co-p алкіл», що використовується окремо або в комбінації з іншими термінами, відноситься до групи формули алкілен-циклоалкіл, у якій циклоалкілова частина має від n до m вуглецевих атомів, а алкіленова частина має від о до p вуглецевих атомів. У деяких варіантах реалізації, алкіленова частина має від 1 до 3, від 1 до 2 або 1 вуглецевий атом(-ів). У деяких варіантах реалізації, алкіленовою частиною є метилен або етилен. У деяких варіантах реалізації, алкіленовою частиною є метилен. У деяких варіантах реалізації, циклоалкілова частину має від 3 до 6 кільцевих членів, від 3 до 5 кільцевих членів, від 3 до 4 кільцевих членів або 3 кільцеві члени. У деяких варіантах реалізації, циклоалкілова група є моноциклічною або біциклічною. У деяких варіантах реалізації, циклоалкілова частина є моноциклічною. У деяких варіантах реалізації, циклоалкілова частина є C3-6 моноциклічною циклоалкіловою групою. При використанні в цьому документі, термін «4-6-членний гетероциклоалкіл», що використовується окремо або в комбінації з іншими термінами, відноситься до неароматичного кільця або кільцевої системи, яка може необов'язково містити одну або більше алкеніленових груп як частина цієї кільцевої структури, і яка має щонайменше один гетероатомний кільцевий член, незалежно вибраний з азоту, сірки, кисню і фосфору, і яка має 4, 5 або 6 кільцевих членів. Гетероциклоалкілові групи можуть містити моно- або біциклічні (наприклад, такі, що мають два конденсованих або мостикових кільця) кільцеві системи. У деяких варіантах реалізації, гетероциклоалкілова група є моноциклічною групою, що має 1, 2 або 3 гетероатоми, незалежно вибраних з азоту, сірки і кисню. У деяких варіантах реалізації, гетероциклоалкілова група є 4-6членним кільцем, 5-6-членним кільцем, 6-членним кільцем, 5-членним кільцем або 4-членним кільцем. Один або більше вуглецевих атомів або гетероатомів у кільці(-ях) гетероциклоалкілової групи можуть бути окислені з утворенням карбоніла, N-оксида або сульфонілової групи (або іншого оксидованого зв'язку), або атом азоту може бути кватернізований. Приклади гетероциклоалкілових груп включають азетидин, піролідин, піперидин, піперазин, морфолін, тіоморфолін і піран. У деяких варіантах реалізації, 4-6-членний гетероциклоалкіл є азетидином, піролідином або піперидином. При використанні в даному документі, термін «4-6-членний гетероциклоалкіл-Cn-m алкіл», що використовується окремо або в комбінації з іншими термінами, відноситься до групи формули алкілен-гетероциклоалкіл, в якій гетероциклоалкілова частина має 4, 5 або 6 кільцевих членів, а алкіленова частина має від n до m вуглецевих атомів. У деяких варіантах реалізації, алкіленова частина має від 1 до 3, від 1 до 2 або 1 вуглецевий атом(-ів). У деяких варіантах реалізації, алкіленовою частиною є метилен. У деяких варіантах реалізації, циклоалкілова частина має від 4 до 6 кільцевих членів, від 5 до 6 кільцевих членів або 5 кільцевих членів. У деяких варіантах реалізації, гетероциклоалкілова група є моноциклічною або біциклічною. У деяких варіантах реалізації, гетероциклоалкілова частина є моноциклічною. У деяких варіантах реалізації, гетероциклоалкілова частина є 4-6-членною моноциклічною гетероциклоалкіловою групою. При використанні в даному документі, поява терміну «біциклічний» перед назвою фрагмента вказує, що цей фрагмент має два конденсованих кільця. 10 UA 110978 C2 5 10 15 20 25 30 35 40 45 50 55 60 При використанні в даному документі, поява терміну «моноциклічний» перед назвою фрагмента вказує, що цей фрагмент має одне кільце. Сполуки, описані в даному документі, можуть бути асиметричними (наприклад, такими, що мають один або декілька стереоцентрів). Маються на увазі всі стереоізомери, такі як енантіомери і діастереомери, якщо не вказане інше. Сполуки за даним винаходом, що містять асиметрично заміщені вуглецеві атоми, можуть бути виділені в оптично активних або рацемічних формах. У даній області відомі способи отримання оптично активних форм з оптично неактивних первинних матеріалів, наприклад, розділення рацемічних сумішей або стереоселективний синтез. У сполуках, описаних у даному документі, можуть бути також присутніми багато геометричних ізомерів олефінів, подвійних зв'язків C=N і тому подібних, і всі такі стійкі ізомери входять у даний винахід. Описані цис- і транс- геометричні ізомери сполук за даним винаходом, і вони можуть бути виділені у вигляді суміші ізомерів або як окремі ізомерні форми. Розділення рацемічних сумішей сполук може бути виконане будь-яким з багаточисельних способів, відомих у даній області. Приклади таких способів включають фракційну перекристалізацію з використанням хіральної розділяючої кислоти, яка є оптично активною, солетворною органічною кислотою. Придатними розділяючими агентами для способів фракційної перекристалізації є, наприклад, оптично активні кислоти, такі як D і L форми винної кислоти, діацетилвінної кислоти, дибензоїлвинної кислоти, мигдалевої кислоти, яблучної кислоти, молочної кислоти або різні оптично активні камфорсульфонові кислоти, такі як камфорсульфонова кислота. Інші розділяючі агенти, придатні для способів фракційної кристалізації, включають стереоізомерно чисті форми -метилбензиламіна (наприклад, S і R форми або діастереомерно чисті форми), 2-фенілгліцин, норефедрин, ефедрин, Nметилефедрин, циклогексиленетиламін, 1,2-діаміноциклогексан і тому подібні. Розділення рацемічних сумішей може бути виконане також елююванням на колонці, заповненій оптично активним розділяючим агентом (наприклад, динітробензоїлфенілгліцином). Прийнятний склад елююючих розчинників може бути визначений фахівцем у даній області. Сполуки за даним винаходом включають також таутомерні форми. Таутомерні форми утворюються, коли одинарний зв'язок міняється місцями з сусіднім подвійним зв'язком, разом з супутньою міграцією протона. Таутомерні форми включають прототропні таутомери, які є ізомерними станами протонування, що мають однакову емпіричну формулу і загальний заряд. Приклади прототропних таутомерів включають кетон-енольні пари, амід-імідні кислотні пари, лактам-лактимні пари, енамін-імінні пари і кільцеві форми, в яких протон може займати два або більше положень у гетероциклічній системі, наприклад, 1H- і 3H-імідазол, 1H-, 2H- і 4H- 1,2,4триазол, 1H- і 2H- ізоіндол, і 1H- і 2H-піразол. Таутомерні форми можуть знаходитися у рівновазі або бути стерично заблокованими в одній формі за допомогою відповідного заміщення. Сполуки даного винаходу можуть також включати всі ізотопи атомів, що знаходяться у проміжних продуктах або кінцевих продуктах. Ізотопи включають ті атоми, які мають такий же атомний номер, але інше масове число. Наприклад, ізотопи водню включають тритій і дейтерій. У деяких варіантах реалізації, 1, 2 або 3 групи CH 2 в азетидиновому кільці Формули I заміщені групою CHD або CD2. У деяких варіантах реалізації, 1, 2 або 3 групи CH 2 або CH у піперидиновому кільці Формули I заміщені групою CHD, CD 2 або CD, відповідно. У деяких варіантах реалізації, 1, 2, 3, 4 або 5 груп CH 2 або CH у піперидиновому кільці Формули I заміщені групою CHD, CD2 або CD, відповідно. Термін «сполука», що використовується в даному документі, включає всі стереоізомери, геометричні ізомери, таутомери і ізотопи зображених структур. Усі сполуки і їх фармацевтично прийнятні солі можуть бути отримані разом з іншими речовинами, такими як вода або розчинники (наприклад, гідрати і сольвати), або можуть бути виділені. У деяких варіантах реалізації, сполуки за даним винаходом або їх солі є, в основному, виділеними. Термін «в основному, виділені» означає, що сполука є щонайменше частково або здебільшого відокремленою від довкілля, в якому вона була утворена або виявлена. Часткове розділення може включати, наприклад, композицію, збагачену сполуками за даним винаходом. Істотне розділення може включати композиції, що містять щонайменше близько 50%, щонайменше близько 60%, щонайменше близько 70%, щонайменше близько 80%, щонайменше близько 90%, щонайменше близько 95%, щонайменше близько 97% або щонайменше близько 99% по масі сполуки за даним винаходом або її солі. Способи виділення сполук і їх солей є стандартними у даній області. Вираз «фармацевтично прийнятний», що застосовується в даному документі, відноситься до таких сполук, матеріалів, композицій та/або лікарських форм, які, за результатами ретельної 11 UA 110978 C2 5 10 15 20 25 30 35 40 45 50 55 60 медичної клінічної оцінки, придатні для використання у контакті з тканинами організму людини і тварин, без надлишкової токсичності, роздратування, алергічних реакцій або інших проблем або ускладнень, пропорційно з відношенням прийнятної користі і ризику. Вирази «температура довкілля» і «кімнатна температура», що використовуються в даному документі, зрозумілі в даній області і позначають, в основному, температуру, наприклад, температуру реакції, яка приблизно дорівнює температурі в кімнаті, в якій виконується реакція, наприклад, температуру від близько 20°C до близько 30°C. У даний винахід включені також фармацевтично прийнятні солі сполук, описаних у даному документі. При використанні в даному документі, термін «фармацевтично прийнятні солі» відноситься до похідних описаних сполук, в яких первинна сполука модифікована перетворенням існуючої кислотної або основної групи на її сольову форму. Приклади фармацевтично прийнятних солей включають, але не обмежуючись цим, солі неорганічних або органічних кислот основних залишків, таких як аміни; лужні або органічні солі кислотних залишків, таких як карбонові кислоти; і тому подібні. Фармацевтично прийнятні солі за даним винаходом включають нетоксичні солі первинної сполуки, утворені, наприклад, з нетоксичних неорганічних або органічних кислот. Фармацевтично прийнятні солі за даним винаходом можуть бути синтезовані з первинної сполуки, що містить основний або кислотний фрагмент, звичайними хімічними способами. Як правило, такі солі можуть бути отримані при взаємодії вільної кислотної або основної форми цих сполук із стехіометричною кількістю відповідної основи або кислоти у воді або органічному розчиннику, або в суміші їх обох; як правило, бажаними є такі неводні середовища як ефір, етилацетат, спирти (наприклад, метанол, етанол, ізопропанол або бутанол) або ацетонітрил (ACN). Списки придатних солей представлені в публікаціях Remington Pharmaceutical Sciences, 17-е видання, Mack Publishing Company, Істон, штат Пенсільванія, 1985 рік, с. 1418, і в Journal of Pharmaceutical Science, 66, 2 (1977), кожна з яких включена в дану заявку шляхом посилання в повному обсязі. У деяких варіантах реалізації, сполуки, описані в даному документі, включають N-оксидні форми. Синтез Сполуки за даним винаходом, включаючи їх солі і N-оксиди, можуть бути отримані за відомими методиками синтезу і можуть бути синтезовані за будь-якою з багаточисельних можливих шляхів синтезу, таких як шляхи, показані на Схемах нижче. Реакції отримання сполук за даним винаходом можуть бути виконані у прийнятних розчинниках, які фахівець в області органічного синтезу може легко підібрати. Прийнятними розчинниками можуть бути розчинники, що здебільшого не реагують з первинними матеріалами (реагентами), проміжними сполуками або продуктами при температурах виконання реакції, наприклад, температурах, які можуть знаходитися в діапазоні від температури замерзання розчинника до температури кипіння розчинника. Дана реакція може бути виконана в одному розчиннику або в суміші більше ніж одного розчинника. Залежно від конкретної стадії реакції, придатні розчинники для конкретної стадії реакції можуть бути підібрані фахівцем у даній області. Отримання сполук за даним винаходом може включати захист і зняття захисту з різних хімічних груп. Необхідність захисту або зняття захисту, а також вибір відповідних захисних груп, може бути легко встановлена фахівцем в даної області. Хімія захисних груп представлена, наприклад, у публікації Wuts and Greene, Protective Groups in Organic Synthesis, 4-е видання, John Wiley & Sons: Нью-Джерсі, (2007 рік), яка включена в дану заявку шляхом посилання в повному обсязі. Реакції можна контролювати відповідно до будь-якого придатного способу, відомого в даній області. Наприклад, утворення продукту можна контролювати спектроскопічними засобами, 1 13 такими як спектроскопія ядерного магнітного резонансу (наприклад, H або C), інфрачервона спектроскопія, спектрофотометрія (наприклад, УФ-видима), мас-спектрометрія, або хроматографічними способами, такими як високоефективна рідинна хроматографія (ВЕРХ) або тонкошарова хроматографія (ТШХ). 7 6 Серія ариламідних похідних 13 (Y може бути N, CH або CR ; W може бути N або CR , і X 4 може бути N або CR ) може бути отримана за способом, зображеним на Схемі 1. Захищена біцикло-гетеросполука 2 може бути отримана за реакцією відповідної біцикло-гетеросполуки 1 з (2-хлорметокси)етил)триметилсиланом (SEMCl) у присутності відповідної основи, такої як NaH у ДМФ. Поєднання Сузукі біцикло-гетеросполуки 2 з відповідною бороновою кислотою 3 дає відповідну сполуку 4. Захисна група (PG) у сполуці 4 може бути видалена з утворенням сполуки 5 шляхом гідрогенування у присутності палладію на вуглеці у випадку, якщо PG = Cbz, або у випадку якщо PG = Boc - обробкою кислотою, такою як, але не обмежуючись цим, трифтороцтова кислота (ТФК) або HCl, у відповідному розчиннику, такому як, але не обмежуючись цим, дихлорметан (ДХМ), метанол, діоксан або комбінація двох розчинників, або 12 UA 110978 C2 5 10 основою, такою як карбонат натрію або карбонат калію в гарячому метанолі. Приєднання Міхаеля сполуки 5 з ,-ненасиченим нітрилом 6 може давати аддукт 7. Видалення Boc-групи в 7 дає амінне похідне 8, яке може бути перетворене на відповідний ариловий складний ефір 10 за реакцією з гало-заміщеним складним ефіром арилової кислоти 9, у присутності придатного каталізатора, такого як, але не обмежуючись цим, BINAP [2,2’-біс(дифенілфосфіно)-1,1’бінафталін], TOL-BINAP [2,2’-біс(ди-п-толілфосфіно)-1,1’-бинафталін], Xanthpos [4,5біс(дифенілфосфіно)-9,9-диметилксантен]. Ариловий складний ефір 10 може бути гідролізований до відповідної кислоти 11 з використанням луги, такої як гідроксид літію, гідроксид натрію або гідроксид калію. Зв’язування кислоти 11 з відповідним аміном може давати ариламід 12, з використанням зв'язуючого реагенту, такого як, але не обмежуючись цим, BOP, PYOP, HATU, HBTU, EDC або CDI. Видалення захисної групи SEM у 12 з утворенням ариламідного похідного 13 може бути досягнуто обробкою кислотою, такою як BF 3 або ТФК, з подальшою обробкою аміном, таким як етилендіамін або аміак. Схема 1 O Hal Y N N B Hal O 3 Y N H N PG N N PG N SEM N Y N SEM N 2 1 4 NC N N NH N Boc N NH 6 N N N N N Boc Y Y Y N 5 N SEM N 7 SEM N 8 R5 R5 R5 W N O W N O N N ORa X OR a X 9 X OH R3 Y N N 10 SEM N 11 N W N O X R3 W O N N N N N SEM R5 R5 R 1R 2 NH O N N R3 Y N N N R1 X R3 R2 N R1 R2 Y Y N 15 W N N Hal R3 N SEM N 12 N H N N SEM 13 Альтернативно, ариламідні похідні 13 можуть бути отримані за способом, зображеним на 13 UA 110978 C2 5 Схемі 2. Ароматична кислота 14 може бути легко перетворена на відповідний амід 15 з використанням амідного зв'язуючого реагенту, такого як BOP, PYOP, HATU, HBTU, EDC або CDI. Ароматичне амінування 8 за допомогою аміда 15 з утворенням 12 може бути досягнуто так само, як описано вище, у присутності відповідного каталізатора, такого як, але не обмежуючись цим, BINAP [2,2’-біс(дифенілфосфіно)-1,1’-бінафталін], TOL-BINAP [2,2’-біс(ди-п-толілфосфіно)1,1’-бінафталін], Xantphos [4,5-біс(дифенілфосфіно)-9,9-диметилксантен]. Зняття захисної групи SEM у 12 може давати ариламід 13, як описано вище. Схема 2 N NH N N Y R5 W R5 O W R 1R 2NH Hal R OH X 3 R 14 N W R1 R2 R5 N O X R3 W O N N N N N N N R1 X R R2 N R1 3 R2 Y Y N 20 N 3 N SEM 15 R5 15 8 Hal X 10 N O N N SEM N H 13 12 Серія арилових складноефірних похідних 10 може бути отримана за способами, зображених на Схемі 3. Заміщення вирушаючої групи Hal (Hal може бути галогеном, OTs або OTf) у сполуці 9 3-гідроазетидином з утворенням сполуки 16 може бути досягнуто за термічних умов у відповідному розчиннику, такому як, але не обмежуючись цим, ДМСО, діоксан, ДМФ або NMP, у присутності основи, такої як карбонат калію, карбонат цезію або карбонат натрію; або в умовах реакції N-арилування типа Ульмана на мідному каталізаторі, з використанням йодиду міді (I) і карбонату калію; або в умовах реакції утворення зв'язку C-N на паладієвому каталізаторі, з використанням Xantphos [4,5-біс(дифенілфосфіно)-9,9-диметилксантен], BINAP [2,2'біс(дифенілфосфіно)-1,1'-бінафталін] або P(о-Tol)3 [три(о-толіл) фосфін] як ліганда і карбонату калію або карбонату цезію, або трет-бутоксиду калію як основи. ,-ненасичений нітрил 18 може бути отриманий за реакцією Віттіга діетилціанометилфосфоната з кетоном 17, який може бути отриманий окисленням Сверна сполуки 16. Приєднання Міхаеля 5 з ,-ненасиченим нітрилом 18 може давати аддукт 10. Схема 3 14 UA 110978 C2 5 10 Точно так само, серія ариламідних похідних 12 може бути отримана за способами, зображених на Схемі 4. Ариловий складний ефір 16 може бути гідролізований до відповідної кислоти 19 з використанням луги, такої як гідроксид літію, гідроксид натрію або гідроксид калію. Кислота 19 може бути перетворена на ариламід 20 за реакцією з відповідним аміном у присутності відповідного зв'язуючого реагенту, такого як, але не обмежуючись цим, BOP, PYOP, HATU, HBTU, EDC або CDI. Окислення Сверна сполуки 20 може давати відповідний кетон 21, який може бути перетворений на ,-ненасичений нітрил 22 за реакцією Віттіга з діетилціанометилфосфонатом. Приєднання Міхаеля сполуки 5 з ,-ненасиченим нітрилом 21 може давати аддукт 12. Схема 4 15 UA 110978 C2 5 10 15 20 25 30 Способи Сполуками за даним винаходом є інгібітори JAK, і більшість із сполук за даним винаходом є селективні інгібітори JAK1. Селективним інгібітором JAK1 є сполукою, яка бажано інгібує активність JAK1, у порівнянні з іншими Янус-кіназами. Наприклад, сполуки за даним винаходу бажано інгібують JAK1, у порівнянні з однією або більше з JAK2, JAK3 і TYK2. У деяких варіантах реалізації, сполуки бажано інгібують JAK1, у порівнянні з JAK2 (наприклад, мають відношення IC50 JAK1/JAK2 >1), за результатами розрахунку з вимірюванням IC 50 при 1 мМ АТФ (наприклад, дивись Приклад A). У деяких варіантах реалізації, сполуки є більше ніж біля 10кратно більш селективними для JAK1, у порівнянні з JAK2, за результатами розрахунку з вимірюванням IC50 при 1 мМ АТФ. У деяких варіантах реалізації, сполуки є більше ніж біля 15кратно селективними для JAK1, у порівнянні з JAK2, за результатами розрахунку з вимірюванням IC50 при 1 мМ АТФ. У деяких варіантах реалізації, сполуки є більше ніж біля 20кратно селективними для JAK1, у порівнянні з JAK2, за результатами розрахунку з вимірюванням IC50 при 1 мМ АТФ. JAK1 відіграє центральну роль у ряді сигнальних шляхів цитокінів і факторів зростання, які, при дисрегуляції, можуть призвести або сприяти хворобливим станам. Наприклад, рівні IL-6 підвищені при ревматоїдному артриті, захворюванні, в якому він імовірно надає згубну дію (Fonesca, J.E. et al., Autoimmunity Reviews, 8:538-42, 2009 рік). Оскільки IL-6 передає сигнал, щонайменше частково, через JAK1, та протидія IL-6 прямо або побічно шляхом інгібування JAK1 імовірно дасть клінічну перевагу (Guschin, D., N., et al. Embo J 14:1421, 1995 рік; Smolen, J. S., et al. Lancet 371:987, 2008 рік). Більше того, у деяких видах раку JAK1 є мутованою, що призводить до істотного небажаного зростання і виживання клітин пухлини (Mullighan CG, Proc Natl Acad Sci U S A.106:9414-8, 2009 рік; Flex E., et al. J Exp Med. 205:751-8, 2008 рік). У інших аутоіммунних захворюваннях і типах раку підвищені системні рівні запальних цитокінів, що активують JAK1, також можуть сприяти захворюванню та/або супутнім симптомам. Тому пацієнти з такими захворюваннями можуть отримати користь від інгібування JAK1. Селективні інгібітори JAK1 можуть бути ефективними для запобігання непотрібним і потенційно небажаним ефектам інгібування інших JAK кіназ. Селективні інгібітори JAK1, у порівнянні з іншими JAK кіназами, можуть мати множинні терапевтичні переваги, в порівнянні з менш селективними інгібіторами. Відносно селективності проти JAK2, ряд важливих цитокінів і факторів зростання передають сигнал через JAK2, включаючи, наприклад, еритропоетин (Epo) і тромбопоетин (Tpo) (Parganas E, et al. Cell. 93:385 16 UA 110978 C2 5 10 15 20 25 30 35 40 45 50 55 60 95, 1998 рік). Epo є ключовим фактором зростання для вироблення червоних кров'яних тілець; тому недостатність Epo-залежного сигналінга може призвести до зниженої кількості червоних кров'яних тілець і анемії (Kaushansky K, NEJM 354:2034-45, 2006 рік). Tpo, інший приклад JAK2залежного фактора зростання, відіграє центральну роль у контролі проліферації і дозріванні мегакаріоцитів - клітин, з яких виробляються тробмоцити (Kaushansky K, NEJM 354:2034-45, 2006 рік). Тому знижена передача сигналів Тро знижує кількість мегакаріоцитов (мегакаріоцитопенія) і знижує кількість циркулюючих тромбоцитів (тромбоцитопенія). Це може призвести до небажаної та/або неконтрольованої кровотечі. Також може бути бажаним знижене інгібування інших JAK, таких як JAK3 і Tyk2, оскільки було показано, що люди з недоліком функціональної версії цих кіназ страждають від багатьох хвороб, таких як складний комбінований імунодефіцит або синдром гіперімуноглобуліну Е (Minegishi, Y, et al. Immunity 25:745-55, 2006 рік; Macchi P, et al. Nature. 377:65-8, 1995 рік). Тому інгібітор JAK1 із зниженою спорідненістю до інших JAK має істотні переваги, у порівнянні з менш селективним інгібітором відносно зниженої кількості побічних ефектів, включаючи придушення імунітету, анемію і тромбоцитопенію. Інший аспект даного винаходу відноситься до способів лікування JAK-пов’язаного захворювання або розладу у суб'єкта (напимер, пацієнта) шляхом введення суб'єктові, що потребує такого лікування, терапевтично ефективної кількості або дози сполуки за даним винаходом або її фармацевтичної композиції. Захворювання, пов'язані з JAK, можуть включати будь-які захворювання, розлади або стани, прямо або побічно пов'язані з експресією або активністю JAK, включаючи надекспресію та/або аномальний рівень активності. Захворювання, пов'язані з JAK, також можуть включати будь-які захворювання, розлади або стани, яким можна запобігти, поліпшити або вилікувати модуляцією активності JAK. Приклади JAK-пов’язаних захворювань включають захворювання, що зачіпають імунну систему, включаючи, наприклад, відторгнення трансплантата органу (наприклад, відторгнення алотрансплантата і захворювання «трансплантат проти господаря»). Додаткові приклади JAK-пов’язаних захворювань включають аутоіммунні захворювання, такі як розсіяний склероз, ревматоїдний артрит, ювенільний артрит, діабет I типа, вовчак, псоріаз, запальне захворювання кишковика, неспецифічний виразковий коліт, хвороба Крону, міастенія, імуноглобулін-нефропатія, міокардит, аутоіммунне порушення щитовидної залози, хронічна обструктивна хвороба легенів (ХОХЛ) і тому подібні. У деяких варіантах реалізації, аутоіммунним захворюванням є аутоіммунне бульозне порушення шкіри, таке як звичайна пухирчатка (PV) або бульозний пемфігоїд (ВР). Додаткові приклади JAK-пов’язаних захворювань включають алергічні стани, такі як астма, харчові алергії, екзематичний дерматит, контактний дерматит, атопічний дерматит (атопічна екзема) і риніти. Додаткові приклади JAK-пов’язаних захворювань включають вірусні хвороби, такі як вірус Епштейна-Барра (EBV), гепатит В, гепатит С, ВІЛ, лімфотропний вірус людини типа 1 (HTLV 1), вірус вітряної віспи (VZV) і вірус папіломи людини (HPV). Додаткові приклади JAK-пов’язаних захворювань включають захворювання, пов'язані з оновленням хрящів, наприклад, подагричний артрит, септичний або інфекційний артрит, реактивний артрит, рефлекторну симпатичну дистрофію, альгодистрофію, синдром Тітце, реброву атропатію, деформуючий ендемічний остеоартрит, хворобу Мселіні, хворобу Хандігоду, дегенерацію в результаті фіброміалгії, системний червоний вовчак, склеродермію або анкілозуючий спондилоартрит. Додаткові приклади JAK-пов’язаних захворювань включають пороки оновлення хрящів, включаючи спадковий хрондроліз, хрондродисплазію і псевдохрондодисплазію (наприклад, мікротію, енотію і метафізарну хрондродисплазію). Додаткові приклади JAK-пов’язаних захворювань або станів включають шкірні розлади, такі як псоріаз (наприклад, звичайний псоріаз), атопічний дерматит, шкірні висипання, роздратування шкіри, чутливість шкіри (наприклад, контактний дерматит або алергічний контактний дерматит). Наприклад, деякі речовини, включаючи деякі фармацевтичні засоби, при локальному нанесенні, можуть викликати сенсибілізацію шкіри. У деяких варіантах реалізації, спільне введення або послідовне введення щонайменше одного інгібітору JAK за даним винаходом разом з агентом, що викликає небажану сенсибілізацію, може бути корисним для лікування таких небажаних сенсибілізацій або дерматитів. У деяких варіантах реалізації, шкірний розлад лікують місцевим введенням щонайменше одного інгібітору JAK даного винаходу. У додаткових варіантах реалізації, JAK-пов'язаним захворюванням є рак, включаючи рак, що характеризується солідними пухлинами (наприклад, рак простати, рак нирок, рак печінки, рак підшлункової залози, рак шлунку, рак грудей, рак легенів, рак голови і шиї, рак щитовидної 17 UA 110978 C2 5 10 15 20 25 30 35 40 45 50 55 60 залози, гліобластома, саркома Капоши, хвороба Каслмана, маткова лейоміосаркома, меланома і так далі), гематологічні види раку (наприклад, лімфома, лейкоз, такий як гострий лімфобластний лейкоз (ALL), гострий мієлогенний лейкоз (AML) або множинна мієлома) і рак шкіри, такий як лімфома Т-клітин шкіри (CTCL) і лімфома В-клітин шкіри. Приклади CTCL включають синдром Сезарі і грибоподібний мікоз. У деяких варіантах реалізації, інгібітори JAK, описані в даному документі, або у комбінації з іншими інгібіторами JAK, такими як інгібітори, описані в публікації США з серійним номером 11/637545, яка включена в даний документ шляхом посилання в повному обсязі, можуть бути використані для лікування ракових захворювань, пов'язаних із запаленням. У деяких варіантах реалізації, рак пов'язаний із запальною хворобою кишковика. У деяких варіантах реалізації, запальна хвороба кишковика є неспецифічним виразковим колітом. У деяких варіантах реалізації, запальна хвороба кишковика є хворобою Крону. У деяких варіантах реалізації, запальна хвороба кишковика є раком, пов'язаним з колітом. У деяких варіантах реалізації, раком, пов'язаним з колітом, є рак ободової кишки або колоректальний рак. У деяких варіантах реалізації, рак є шлунковим раком, шлунковокишковою карциноїдною пухлиною, шлунковокишковою стромальную пухлиною (GIST), аденокарциномою, раком тонкої кишки або ректальним раком. JAK-пов’язані захворювання можуть додатково включати захворювання, які характеризуються експресією: мутантів JAK2, таких як мутанти, що мають щонайменше одну мутацію в домені псевдо-кінази (наприклад, JAK2V617F); мутанти JAK2, що мають щонайменше одну мутацію за межами домена псевдо-кінази; мутанти JAK1; мутанти JAK3; мутанти рецептора еритропоетину (EPOR); або розрегульованою експресією CRLF2. JAK-пов’язані захворювання можуть додатково включати мієлопроліферативні розлади (MPD), такі як дійсна поліцитемія (PV), есенціальна тромбоцитемія (ET), первинний мієлофіброз (PMF), хронічний мієлолейкоз (CML), хронічний мієломоноцитарний лейкоз (CMML), гипереозинофільний синдром (HES), системний мастоцитоз (SMCD) і тому подібні. У деяких варіантах реалізації, мієлопроліферативним розладом є мієлофіброз (наприклад, первинний мієлофіброз (PMF), або пост-дійсну поліцитемію мієлофіброзу (POST-PV MF), або постесенціальну тромбоцитемію мієлофіброзу (POST-ET MF)). У деяких варіантах реалізації, мієлопроліферативним розладом є мієлофіброз з мієлоїдною метаплазією (MMM). У деяких варіантах реалізації, мієлопролиферативним розладом є пост-есенціальна тромбоцитемія мієлофіброзу (POST-ET MF). У деяких варіантах реалізації, мієлопроліферативним розладом є пост-мієлофіброз після дійсної поліцитемії (POST-PV MF). У даному винаході додатково представлені способи лікування псоріазу або інших шкірних розладів шляхом введення місцевої композиції, що містить сполуки за даним винаходом. У деяких варіантах реалізації, інгібітори JAK, описані в даному документі, можуть бути використані для лікування легеневої артеріальної гіпертонії. У даному винаході додатково представлений спосіб лікування дерматологічних побічних ефектів від інших фармацевтичних засобів шляхом введення сполуки за даним винаходом. Наприклад, багаточисельні фармацевтичні засоби призводять до небажаних алергічних реакцій, які можуть викликати вугреподібний висип або супутній дерматит. Приклади фармацевтичних засобів, що мають такий небажаний побічний ефект, включають протиракові ліки, такі як гефітиніб, цетуксимаб, ерлотиніб і тому подібні. Сполуки за даним винаходом можуть бути введені системно або місцево (наприклад, в області дерматиту), у комбінації (наприклад, одночасно або послідовно) з фармацевтичним засобом, що має небажаний дерматологічний побічний ефект. У деяких варіантах реалізації, сполука за даним винаходом може бути введена місцево разом з одним або декількома іншими фармацевтичними засобами, причому вказані інші фармацевтичні засоби при місцевому застосуванні без сполуки за даним винаходом викликають контактний дерматит, алергічну контактну сенсибілізацію або схожі шкірні розлади. Відповідно, композиції за даним винаходом включають місцеві композиції, що містять сполуку за даним винаходом і додатковий фармацевтичний засіб, який може викликати дерматит, шкірні розлади або родинні побічні ефекти. Додаткові JAK-пов’язані захворювання включають запалення і запальні захворювання. Приклади запальних захворювань включають саркоїдоз, запальні захворювання очей (наприклад, ірит, увеїт, склерит, кон'юнктивіт або родинні захворювання), запальні захворювання дихальних шляхів (наприклад, верхніх дихальних шляхів, включаючи ніс і пазухи, такі як риніт або синусит, або нижніх дихальних шляхів, включаючи бронхіт, хронічну обструктивну хворобу легенів і тому подібні), запальну міопатію, таку як міокардит, і інші запальні захворювання. У деяких варіантах реалізації, запальним захворюванням очей є блефарит. 18 UA 110978 C2 5 10 15 20 25 30 35 40 45 50 55 60 Інгібітори JAK, описані в даному документі, можуть бути додатково використані для лікування ішемічних реперфузійних пошкоджень, або захворювання або стану, пов'язаного із запальною ішемією, такою як інсульт або зупинка серця. Інгібітори JAK, описані в даному документі, можуть бути додатково використані для лікування ендотоксин-керованих хворобливих станів (наприклад, ускладнень після шунтування або хронічних ендотоксинових станів, що беруть участь у хронічній серцевій недостатності). Інгібітори JAK, описані в цьому документі, можуть бути додатково використані для лікування анорексії, кахексії або виснаження, такого як виснаження, пов'язане з раком. Інгібітори JAK, описані в цьому документі, можуть бути додатково використані для лікування рестенозу, склеродерміта або фіброзу. Інгібітори JAK, описані в даному документі, можуть бути додатково використані для лікування станів, пов'язаних з гіпоксією або астрогліозом, таких як, наприклад, діабетична ретинопатія, рак або нейродегенерація. Дивись, наприклад, Dudley, A.C. et al. Biochem. J. 2005 рік, 390 (Pt 2):427-36 і Sriram, K. et al. J. Biol. Chem. 2004 рік, 279(19):19936-47, електронна публікація 2 березня 2004 року, які включені в даний документ шляхом посилання у повному обсязі. Інгібітори JAK, описані в даному документі, можуть бути використані для лікування хвороби Альцгеймера. Інгібітори JAK, описані в даному документі, можуть бути додатково використані для лікування інших запальних захворювань, таких як синдром системної запальної реакції (SIRS) і септичного шоку. Інгібітори JAK, описані в цьому документі, можуть бути додатково використані для лікування подагри і збільшеного розміру простати, наприклад, через доброякісну гіпертрофію простати або доброякісну гіперплазію простати. Додаткові JAK-пов’язані захворювання включають захворювання резорбції кісток, такі як остеопороз, остеоартрит. Резорбція кісток також може бути пов'язана з іншими станами, такими як гормональний дисбаланс і гормональна терапія, аутоіммунне захворювання (наприклад, кістковий саркоїдоз), або рак (наприклад, мієлома). Зниження кісткової резорбції завдяки інгібіторам JAK може складати близько 10%, близько 20%, близько 30%, близько 40%, близько 50%, близько 60%, близько 70%, близько 80% або близько 90%. У деяких варіантах реалізації, інгібітори JAK, описані в даному документі, можуть бути додатково використані для лікування захворювання сухості очей. При використанні в даному документі, «розлад сухості очей» охоплює хворобливі стани, узагальнені у недавно опублікованому офіційному звіті Dry Eye Workshop (DEWS), в якому сухість очей визначається як «багатофакторне захворювання виділення сліз і поверхні очей, яке призводить до симптомів дискомфорту, порушення зору і нестабільності слізної плівки з потенційним пошкодженням поверхні очей. Воно супроводжується збільшеною осмотичною концентрацією слізної плівки і запаленням поверхні очей». Публікація Lemp, “The Definition and Classification of Dry Eye Disease: Report of the Definition and Classification Subcommittee of the International Dry Eye Workshop”, The Ocular Surface, 5(2), 75-92, квітень 2007 року, яка включена в даний документ шляхом посилання в повному обсязі. У деяких варіантах реалізації, розлад сухості очей вибраний з сухості очей, пов'язаної з дефіцитом водянистих сліз (ADDE), або порушення сухості очей у результаті випаровування, або їх комбінації. У деяких варіантах реалізації порушенням сухості очей є синдром сухості очей Шегрена (SSDE). У деяких варіантах реалізації, сухістю очей є синдром сухості очей не-Шегрена (NSSDE). У додатковому аспекті даного винаходу представлений спосіб лікування кон'юнктивіту, увеїту (у тому числі хронічного увеїту), хоріодиту, ретиніту, цикліту, склериту, епісклериту або іриту; лікування запалення або болю, пов'язаного з пересадкою рогівки, LASIK (кератомілез за допомогою лазера in situ), фоторефракційною кератектомією або LASEK (суб-епітеліальний кератомілез за допомогою лазера); уповільнення втрати гостроти зору, пов'язаного з пересадкою рогівки, LASIK, фоторефракційною кератектомією або LASEK; або інгібування відторгнення трансплантата у пацієнта, який потребує цього, що включає введення пацієнту терапевтично ефективної кількості сполуки за даним винаходом або її фармацевтично прийнятної солі. Крім того, сполуки за даним винаходом, або в комбінації з іншими інгібіторами JAK, такими як інгібітори, описані в публікації США з серійним номером 11/637545, яка включена в цей документ шляхом посилання в повному обсязі, можуть бути використані для лікування респіраторної дисфункції або недостатності, пов'язаної з вірусною інфекцією, такою як грип і SARS. У деяких варіантах реалізації даного винаходу представлено сполуку, описану в будь-якому з варіантів реалізації, представлених у даному документі, або її фармацевтично прийнятну сіль для застосування у способі лікування будь-яких захворювань і розладів, описаних у даному документі. У деяких варіантах реалізації даного винаходу представлене застосування сполуки, 19 UA 110978 C2 5 10 15 20 25 30 35 40 45 50 55 60 описаної в будь-якому з варіантів реалізації, представлених у даному документі, або її фармацевтично прийнятної солі для отримання лікарського засобу для застосування в способі лікування будь-яких захворювань і розладів, описаних у даному документі. У деяких варіантах реалізації даного винаходу представлено сполуку, описану в будь-якому з варіантів реалізації, представлених у даному документі, або її фармацевтично прийнятну сіль для застосування у способі модулювання JAK1. У деяких варіантах реалізації даного винаходу представлено також застосування сполуки, описаної в будь-якому з варіантів реалізації, представлених у даному документі, або її фармацевтично прийнятній солі для отримання лікарського засобу для застосування у способі модулювання JAK1. При використанні в даному документі, термін «контакт» відноситься до зіткнення вказаних фрагментів у системі in vitro або в системі in vivo. Наприклад, «контакт» JAK із сполукою за даним винаходом включає введення сполуки за даним винаходом індивідуумові або пацієнту, такому як людина, який має JAK, а також, наприклад, введення сполуки за даним винаходом у зразок, що містить клітинний або очищений препарат, що містить JAK. При використанні у даному документі, терміни «індивідуум» або «пацієнт», що використовуються взаємозамінно, відносяться до будь-якої тварини, включаючи ссавців, бажано мишей, щурів, інших гризунів, кроликів, собак, кішок, свиней, велику рогату худобу, овець, коней або приматів, і, найбажаніше, людей. При використанні в даному документі, вираз «терапевтично ефективна кількість» відноситься до такої кількості активної сполуки або фармацевтичного засобу, яка викликає біологічну або медичну реакцію, що очікується дослідником, ветеринаром, лікарем, який лікує, або іншим клініцистом, у тканині, системі, організмі тварини, індивідуума або людини. У деяких варіантах реалізації, терапевтично ефективна кількість складає від близько 5 мг до близько 1000 мг, або від близько 10 мг до близько 500 мг. При використанні в даному документі, термін «лікувати» або «лікування» відноситься до одного або більше з (1) інгібування захворювання; наприклад, інгібування захворювання, стану або розладу в індивідуума, який страждає на нього або демонструє патологію або симптоматологію захворювання, стану або розладу (тобто зупинки подальшого розвитку патології та/або симптоматології); і (2) покращення захворювання; наприклад, покращення захворювання, стану або розладу в індивідуума, який страждає на нього або демонструє патологію або симптоматологію захворювання, стану або розладу (тобто реверсування патології та/або симптоматології), такого як зниження важкості захворювання. В одному варіанті реалізації, лікувати або лікування включає запобігання захворюванню; наприклад, запобігання захворюванню, стану або розладу в індивідуума, який може бути схильний до вказаного захворювання, стану або розладу, але ще не страждає на нього або не демонструє патологію або симптоматологію вказаного захворювання. Комплексні терапії Один або більше додаткових фармацевтичних агентів, таких як, наприклад, засоби хіміотерапій, протизапальних, стероїди, імунодепресанти, а також інгібітори кіназ Bcr-Abl, Flt-3, RAF і FAK, такі як, наприклад, описані в публікації WO 2006/056399, яка включена в цей документ шляхом посилання в повному об'ємі, або інші засоби можуть бути використані в комбінації із сполуками, описаними в даному документі, для лікування пов'язаних з JAK захворювань, розладів або станів. Один або більше додаткових фармацевтичних агентів можуть бути введені пацієнту одночасно або послідовно. Приклади засобів хіміотерапевтичних засобів включають інгібітори протеосом (наприклад, бортезоміб), талідомід, ревлімід і ДНК-ушкоджуючі агенти, такі як мелфалан, доксорубіцин, циклофосфамід, вінкристин, етопозид, кармустин і тому подібні. Приклади стероїдів включають кортикостероїди, такі як дексаметазон або преднізон. Приклад інгібіторів Bcr-Abl включає сполуки і їх фармацевтично прийнятні солі, родів і видів, описаних у патенті США № 5521184, WO 04/005281 і публікації США з серійним номером 60/578491, які включені в цей документ шляхом посилання в повному обсязі. Приклад придатних інгібіторів Flt-3 включає сполуки і їх фармацевтично прийнятні солі, описані в публікаціях WO 03/037347, WO 03/099771 і WO 04/046120, які включені в цей документ шляхом посилання в повному обсязі. Приклад придатних інгібіторів RAF включає сполуки і їх фармацевтично прийнятні солі, описані в публікаціях WO 00/09495 і WO 05/028444, які включені в даний документ шляхом посилання в повному обсязі. Приклад придатних інгібіторів FAK включає сполуки і їх фармацевтично прийнятні солі, описані в публікаціях WO 04/080980, WO 04/056786, WO 03/024967, WO 01/064655, WO 00/053595 і WO 01/014402, які включені в даний документ шляхом посилання в повному обсязі. 20 UA 110978 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких варіантах реалізації, одна або більше сполук даного винаходу можуть бути використані в комбінації з одним або декількома іншими інгібіторами кіназ, включаючи іматиніб, зокрема, для лікування пацієнтів, резистентних до іматинібу або інших інгібіторів кіназ. У деяких варіантах реалізації, один або більше інгібіторів JAK за даним винаходом можуть бути використані в комбінації із хіміотерапевтичними засобами лікування раку, такого як множинна мієлома, і можуть покращувати реакцію на лікування, у порівнянні з реакцією на лікування лише хіміотерапевтичним засобом, без посилення його токсичного ефекту. Приклади додаткових фармацевтичних агентів, що використовується для лікування множинної мієломи, наприклад, можуть включати, без обмеження, мелфалан, мелфалан плюс преднізон [MP], доксорубіцин, дексаметазон і Велкад (бортезоміб). Інші додаткові агенти, що використовуються для лікування множинної мієломи, включають інгібітори кіназ Bcr-Abl, Flt-3, RAF і FAK. Аддитивні або синергетичні ефекти є бажаними результатами комбінування інгібітору JAK за даним винаходом з додатковим агентом. Більше того, стійкість клітин множинної мієломи до таких агентів, як дексаметазон, може бути оборотною при лікуванні з інгібітором JAK за даним винаходом. Ці агенти можна комбінувати із сполуками за даним винаходу у складі однієї або суцільної лікарської форми, або ці агенти можуть бути введені одночасно або послідовно у вигляді окремих лікарських форм. У деяких варіантах реалізації, кортикостероїди, такі як дексаметазон, вводять пацієнту в комбінації щонайменше з одним інгібітором JAK, причому дексаметазон вводять періодично, в протилежність безперервному введенню. У деяких додаткових варіантах реалізації, комбінації одного або більше інгібіторів JAK за даним винаходом з іншими терапевтичними агентами можуть бути введені пацієнту до, під час та/або після трансплантата кісткового мозку або трансплантата стволових клітин. У деяких варіантах реалізації, додатковим терапевтичним агентом є флуцинолон ацетонід ® (Retisert ) або римексолон (AL-2178, Vexol, Alcon). У деяких варіантах реалізації, додатковим терапевтичним агентом є циклоспорин ® (Restasis ). У деяких варіантах реалізації, додатковим терапевтичним агентом є кортикостероїд. У деяких варіантах реалізації, кортикостероїд є триамцинолоном, дексаметазоном, флуцинолоном, кортизоном, преднізолоном або флуметолоном. У деяких варіантах реалізації, додатковий терапевтичний агент вибраний з Dehydrex™ (Holles Labs), циваміда (Opko), гіалуроната натрію (Vismed, Lantibio/TRB Chemedia), циклоспорина (ST-603, Sirion Therapeutics), ARG101(T) (тестостерон, Argentis), AGR1012(P) (Argentis), екабета натрію (Senju-Ista), гефарната (Santen), 15-(s)-гідроксіейкозатетраенової кислоти (15(S)-HETE), цевілеміна, доксицикліна (ALTY-0501, Alacrity), миноцикліна, iDestrin™ (NP50301, Nascent Pharmaceuticals), циклоспорина A (Nova22007, Novagali), окситетрацикліна (Duramycin, MOLI1901, Lantibio), CF101 (2S,3S,4R,5R)-3,4-дигідрокси-5-[6-[(3йодфеніл)метиламіно]пурин-9-іл]-N-метил-оксолан-2-карбаміл, Can-Fite Biopharma), воклоспорина (LX212 або LX214, Lux Biosciences), ARG103 (Agentis), RX-10045 (синтетичний аналог резолвіна, Resolvyx), DYN15 (Dyanmis Therapeutics), ривоглітазона (DE011, Daiichi Sanko), TB4 (RegeneRx), OPH-01 (Ophtalmis Monaco), PCS101 (Pericor Science), REV1-31 (Evolutec), лакритина (Senju), ребаміпида (Otsuka-Novartis), OT-551 (Othera), PAI-2 (Університет Пенсільванії і Університет Темпла), пілокарпіна, такролимуса, пімекролімуса (AMS981, Novartis), лотепреднола етабоната, ритуксимаба, диквафозола тетранатрію (INS365, Inspire), KLS-0611 (Kissei Pharmaceuticals), дегідроепіандростерона, анакінра, ефалізумаба, мікофенолята натрію, етанерцепта (Embrel®), гідроксихлорохина, NGX267 (TorreyPines Therapeutics), актемра, гемцитабіна, оксаліплатина, L-аспарагінази або талідоміда. У деяких варіантах реалізації, додатковий терапевтичний агент є анти-ангіогенним агентом, холінергічним агоністом, модулятором рецептора TRP-1, блокатором кальцієвого каналу, стимулятором секреції муцина, стимулятором MUC1, інгібітором кальциневрина, кортикостероїдом, агоністом рецептора P2Y2, агоністом мускаринового рецептора, інгібітором mTOR, іншим інгібітором JAK, інгібітором кінази Bcr-Abl, інгібітором кінази Flt-3, інгібітором кінази RAF і інгібітором кінази FAK, такий як, наприклад, агенти, описані в публікації WO 2006/056399, яка включена в даний документ шляхом посилання в повному обсязі. У деяких варіантах реалізації, додатковий терапевтичний агент є тетрацикліновим похідним (наприклад, миноциклін або доксициклін). У деяких варіантах реалізації, додатковий терапевтичний агент зв'язується з FKBP12. У деяких варіантах реалізації, додатковий терапевтичний агент є алкілуючим агентом або поперечно зшиваючим ДНК агентом; анти-метаболітний/деметилуючим агентом (наприклад, 5фторурацил, капецитабін або азацитидин); анти-гормональною терапією (наприклад, 21 UA 110978 C2 5 10 15 20 25 30 35 40 45 50 55 60 антагоністи рецепторів гормонів, SERM або інгібітором ароматази); мітотичним інгібітором (наприклад, вінкристин або паклітаксел); інгібітором топоізомерази (I або II) (наприклад, митоксантрон і іринотекан); апоптичним ініціатором (наприклад, АВТ-737); нуклеїнокислотною терапією (наприклад, антисмислова або РНКи); лігандами ядерних рецепторів (наприклад, агоністами і антагоністами: повністю-транс-ретиноєва кислота або бексаротен); епігенетичними цільовими агентами, такі як інгібітори гістон деацетилази (наприклад, вориностат), гіпометилуючими засобами (наприклад, децитабін); регулювальниками білкової стійкості, такі як інгібітори Hsp90, убіквітин і убіквітин-подібні кон'югуючі або декон'югуючі молекули; або інгібітором EGFR (ерлотиніб). У деяких варіантах реалізації, додатковим терапевтичним агентом(-ами) є знеболюючі очні краплі (також відомі як «штучні сльози»), що включають, але не обмежуючись цим, композиції, що містять полівініловий спирт, гідроксипропілметилцелюлозу, гліцерин, поліетиленгліколь (наприклад, ПЕГ400) або карбоксиметилцелюлозу. Штучні сльози можуть сприяти лікуванню сухості очей шляхом компенсації зниженого зволоження і змащуючої здатності слізної плівки. У деяких варіантах реалізації, додатковий терапевтичний агент є муколітичними ліками, таким як N-ацетил-цистеїн, які можуть взаємодіяти з мукопротеїнами і, отже, знижувати в'язкість слізної плівки. У деяких варіантах реалізації, додатковий терапевтичний агент включає антибіотики, антивірусні, протигрибкові, анестезуючі, протизапальні засоби, включаючи стероїдні і нестероїдні протизапальні засоби, і протиалергічні засоби. Приклади придатних лікарських засобів включають аміноглікозиди, такі як амікацин, гентаміцин, тобраміцин, стрептоміцин, нетилміцин і канаміцин; фторхінолони, такі як ципрофлоксацин, норфлоксацин, офлоксацин, тровафлоксацин, ломефлоксацин, левофлоксацин і еноксацин; нафтирідини; сульфонаміди; поліміксин; хлорамфенікол; неоміцин; парамоміцин; колістиметат; бацитрацин; ванкоміцин; тетрациклін; рифампін і його похідні («рифампіни»); циклосерин; бета-лактами; цефалоспірини; амфотерицини; флуконазол; флуцитозин; натаміцин; міконазол; кетоконазол; кортикостероїди; диклофенак; флурбіпрофен; кеторолак; супрофен; кромолін; лодоксамід; левокабастин; нафазолін; антазолін; фенірамін або азалідні антибіотики. У деяких варіантах реалізації, додатковий терапевтичний агент є інгібітором однієї або більше кіназ Pim. Другий терапевтичний агент у способах і композиціях за даним винаходом може бути будь-яким активним агентом, таким як хімічна сполука або макромолекула, або біополімером, що інгібує щонайменше одну кіназу Pim, таку як Pim-1, Pim-2 або Pim-3. У деяких варіантах реалізації, інгібітор Pim інгібує Pim-1. У деяких варіантах реалізації, інгібітор Pim інгібує Pim-2. У деяких варіантах реалізації, інгібітор Pim інгібує Pim-3. У деяких варіантах реалізації, інгібітор Pim інгібує Pim-1, Pim-2 і Pim-3. У деяких варіантах реалізації, інгібітор Pim є селективним для однієї або більше Pim, у порівнянні з іншими кіназами. У наступних варіантах реалізації, інгібітором Pim є селективний інгібітор Pim-1, у порівнянні з Pim-2 і Pim-3. У наступних варіантах реалізації, інгібітором Pim є селективний інгібітор Pim-2, у порівнянні з Pim1 і Pim-3. У наступних варіантах реалізації, інгібітором Pim є селективний інгібітор Pim-3, у порівнянні з Pim-1 і Pim-2. Селективний інгібітор Pim, як правило, селективно інгібує мішень-кіназу Pim з більшою силою, ніж мішень, проти якої він селективний. У деяких варіантах реалізації, селективність може бути щонайменше біля 2-кратної, щонайменше біля 3-кратної, щонайменше біля 5кратної, щонайменше біля 10-кратної, щонайменше біля 20-кратної, щонайменше біля 50кратної або щонайменше біля 100-кратної. Ефективність може бути виміряна одним або декількома аналізами in vitro, такими як аналізи, представлені нижче в Прикладах. Приклади інгібіторів кінази Pim включають сполуки, описані в патенті США номер 7750007, WO 2011/057784, WO 2011/029802, WO 2010/026121, WO 2010/026122, WO 2010/026124, WO 2010/022081, WO 2010/022076, WO 2010/001169, WO 2010/000978, WO 2009/064486, WO 2009/109576, WO 2008/106692, WO 2008/124323 (US 2010/029633), WO 2008/082840 (US 2008/161578), WO 2008/082839 (публікація заявки на патент США номер 2008/161559), WO 2008/058126 (патент США номер 7750007) і WO 2008/022164 (публікація заявки на патент США номер 2010/210627), кожна з яких включена в даний документ шляхом посилання в повному обсязі. Фармацевтичні композиції і лікарські форми При використанні як лікарські засоби, сполуки за даним винаходом можуть бути введені у формі фармацевтичних композицій. Ці композиції можуть бути отримані добре відомими у фармацевтиці способами, і можуть бути введені різними шляхами, залежно від того, чи потрібне локальне або системне лікування, а також від області, що підлягає лікуванню. Введення може бути місцевим (включаючи трансдермальне, епідермальне, офтальмічне і в слизові оболонки, 22 UA 110978 C2 5 10 15 20 25 30 35 40 45 50 55 60 включаючи інтраназальну, вагінальну і ректальну доставку), пульмональним (наприклад, при інгаляції або інсуфляции порошків або аерозолів, включаючи введення через розпилювач; внутрішньотрахеально або інтраназально), оральним або парентеральним. Парентеральне введення включає внутрішньовенні, внутрішньоартеріальні, підшкірні, внутрішньочеревинні, внутрішньом'язові ін'єкції або інфузії; або внутрічерепне, наприклад, інтратекальне або внутрішньошлуночкове введення. Парентеральне введення може здійснюватися у формі єдиного болюсного введення або, наприклад, через безперервний перфузійний дозатор. Фармацевтичні композиції і рецептури для локального застосування можуть включати трансдермальні пластири, мазі, лосьйони, креми, гелі, краплі, супозиторії, спреї, рідини і порошки. Можуть бути необхідні або бажані стандартні фармацевтичні носії, водні, порошкові або масляні основи, загусники і тому подібне. У даний винахід включені також фармацевтичні композиції, що містять як активний інгредієнт сполуку за дани винаходом або її фармацевтично прийнятну сіль у комбінації з одним або більше фармацевтично прийнятними носіями (формотворними засобами). У деяких варіантах реалізації, композиція придатна для місцевого застосування. При приготуванні композицій за даним винаходом, активний інгредієнт зазвичай змішують з формотворним засобом, розбавляють формотворним засобом або внідряють у такий носій у формі, наприклад, капсули, саше, паперової або іншої упаковки. Якщо формотворним засобом служить розчинник, це може бути твердий, напівтвердий або рідкий матеріал, який діє як наповнювач, носій або середовище для активного інгредієнта. Таким чином, композиції за даним винаходом можуть бути у формі пігулок, пілюль, порошків, лепешек, саше, капсул, еліксирів, суспензій, емульсій, розчинів, сиропів, аерозолів (у вигляді твердої речовини або в рідкому середовищі), мазей, що містять, наприклад, до 10% по масі активної сполуки, м'яких або твердих желатинових капсул, супозиторіїв, стерильних розчинів для ін'єкцій або стерильних фасованих порошків. При приготуванні композиції, активна сполука перед змішуванням з іншими інгредієнтами може бути подрібнена для отримання відповідного розміру часток. Якщо активна сполука практично нерозчинна, вона може бути подрібнена до розмірів часток менше 200 меш. Якщо активна сполука, в основному, розчинна у воді, то розмір часток може бути підібраний подрібненням для отримання практично однорідного розподілу в композиції, наприклад, близько 40 меш. Сполуки за даним винаходом можуть бути подрібнені відомими способами подрібнення, такими як вологе подрібнення для отримання відповідного розміру часток для формування пігулок і для складання інших типів фармацевтичних композицій. Тонко подрібнені (нанорозмірні) композиції сполук за даним винаходом можуть бути отримані за відомими в даній області методикам, дивись, наприклад, заявку на Міжнародний патент № WO 2002/000196. Деякі приклади придатних носіїв включають лактозу, декстрозу, сахарозу, сорбіт, маніт, крохмалі, гуміарабік, фосфат кальцію, альгінати, трагакант, желатин, силікат кальцію, мікрокристалічну целюлозу, полівінілпіролідон, целюлозу, воду, сироп і метилцелюлозу. Композиції можуть додатково містити: змащуючі агенти, такі як тальк, стеарат магнію і мінеральне масло; зволожуючі агенти, емульгатори і суспендуючі агенти; консервуючі агенти, такі як метил і пропілгідрокси-бензоати, підсолоджувачі і ароматизатори. Композиції за даним винаходом можуть бути складені так, щоб забезпечувати швидке, безперервне або сповільнене вивільнення активного інгредієнта після введення пацієнту, шляхом використання відомих у даній області способів. У деяких варіантах реалізації, фармацевтична композиція включає силікатовану мікрокристалічну целюлозу (SMCC) і щонайменше одну сполуку, описану в даному документі, або її фармацевтично прийнятну сіль. У деяких варіантах реалізації, силікатована мікрокристалічна целюлоза містить близько 98% мікрокристалічної целюлози і близько 2% діоксиду кремнію, мас./мас. У деяких варіантах реалізації, ця композиція є композицією із стійким вивільненням, що містить щонайменше одну сполуку, описану в даному документі, або її фармацевтично прийнятну сіль і щонайменше один фармацевтично прийнятний носій. У деяких варіантах реалізації, композиція містить щонайменше одну сполуку, описану в даному документі, або її фармацевтично прийнятну сіль і щонайменше один компонент, вибраний з мікрокристалічної целюлози, моногідрата лактози, гідроксипропілметилцелюлози і поліетиленоксиду. У деяких варіантах реалізації, композиція містить щонайменше одну сполуку, описану в даному документі, або її фармацевтично прийнятну сіль і мікрокристалічну целюлозу, моногідрат лактози і гідроксипропілметилцелюлозу. У деяких варіантах реалізації, композиція містить щонайменше одну сполуку, описану в даному документі, або її фармацевтично прийнятну сіль і мікрокристалічну целюлозу, моногідрат лактози і поліетиленоксид. У деяких варіантах 23 UA 110978 C2 5 10 15 20 25 30 35 40 45 50 55 60 реалізації, композиція додатково містить стеарат магнію або діоксид кремнію. У деяких варіантах реалізації, мікрокристалічна целюлоза є Avicel PH102™. У деяких варіантах реалізації, моногідрат лактози є Fast-flo 316™. У деяких варіантах реалізації, гідроксипропілметилцелюлоза є гідроксипропілметилцелюлозою 2208 K4M (наприклад, Methocel K4 M Premier™) та/або гідроксипропілметилцелюлозою 2208 K100LV (наприклад, Methocel K00LV™). У деяких варіантах реалізації, поліетиленоксидом є поліетиленоксид WSR 1105 (наприклад, Polyox WSR 1105™). У деяких варіантах реалізації, для отримання композиції використовують процес вологої грануляції. У деяких варіантах реалізації, для отримання композиції використовують процес сухої грануляції. Композиції можуть бути складені у вигляді одиничних лікарських форм, кожна форма містить від близько 5 до близько 1000 мг (1 г), частіше від близько 100 до близько 500 мг активного інгредієнта. У деяких варіантах кожна доза містить близько 10 мг активного інгредієнта. У деяких варіантах реалізації, кожна доза містить близько 50 мг активного інгредієнта. У деяких варіантах реалізації, кожна доза містить близько 25 мг активного інгредієнта. Термін «одинична лікарська форма» відноситься до фізично окремої одиниці, придатної як однократна доза для організму людини або інших ссавців, кожна одиниця містить заздалегідь встановлену кількість активного матеріалу, розраховану для забезпечення бажаного терапевтичного ефекту, у поєднанні з придатним фармацевтичним носієм. У деяких варіантах реалізації, композиції за даним винаходом містять від близько 5 до близько 50 мг активного інгредієнта. Фахівцеві в даній області зрозуміло, що сполуки або композиції за цими варіантами реалізації містять від близько 5 до близько 10, від близько 10 до близько 15, від близько 15 до близько 20, від близько 20 до близько 25, від близько 25 до близько 30, від близько 30 до близько 35, від близько 35 до близько 40, від близько 40 до близько 45 або від близько 45 до близько 50 мг активного інгредієнта. У деяких варіантах реалізації, композиції за даним винаходом містять від близько 50 до близько 500 мг активного інгредієнта. Фахівцям у даній області зрозуміло, що сполуки або композиції за цими варіантами реалізації містять від близько 50 до близько 100, від близько 100 до близько 150, від близько 150 до близько 200, від близько 200 до близько 250, від близько 250 до близько 300, від близько 350 до близько 400 або від близько 450 до близько 500 мг активного інгредієнта. У деяких варіантах реалізації, композиції за даним винаходом містять від близько 500 до близько 1000 мг активного інгредієнта. Фахівцям у даній області зрозуміло, що сполуки або композиції за цими варіантами реалізації містять від близько 500 до близько 550, від близько 550 до близько 600, від близько 600 до близько 650, від близько 650 до близько 700, від близько 700 до близько 750, від близько 750 до близько 800, від близько 800 до близько 850, від близько 850 до близько 900 або від близько 900 до близько 950 мг, або від близько 950 до близько 1000 мг активного інгредієнта. Активна сполука може бути ефективною в широкому діапазоні доз, і зазвичай її вводять у фармацевтично ефективній кількості. Проте слід розуміти, що фактична кількість сполуки, що вводиться, зазвичай визначає лікар відповідно до існуючих обставин, включаючи стан, що підлягає лікуванню, вибраний спосіб введення, сполука, що фактично вводиться, вік, масу і реакцію конкретного пацієнта, важкість симптомів пацієнта і тому подібне. Для отримання твердих композицій, таких як пігулки, основний активний інгредієнт змішують з фармацевтичним формотворним засобом для отримання заздалегідь складеної твердої композиції, що містить гомогенну суміш сполуки за даним винаходом. При згадуванні таких заздалегідь складених гомогенних композицій, активний інгредієнт зазвичай рівномірно диспергують по всій композиції, так що цю композицію можна легко розділити на рівні ефективні одиничні лікарські форми, такі як пігулки, пілюлі і капсули. Такі тверді заздалегідь складені композиції потім ділять на одиничні лікарські форми описаних вище типів, що містять, наприклад, від близько 0,1 до близько 1000 мг активного інгредієнта за даним винаходом. Пігулки або пілюлі за даним винаходом можуть бути покриті або компаундовані іншим способом для отримання лікарської форми, що надає можливість отримувати пролонговану дію. Наприклад, пігулки або пілюлі можуть містити внутрішній або зовнішній лікарський компонент, при цьому останній у формі оболонки довкола першого. Ці два компоненти можуть бути розділені ентеральним шаром, який служить для запобігання руйнуванню у шлунку і проходженню неушкодженого внутрішнього компонента в дванадцятипалу кишку або для уповільнення його вивільнення. Для таких ентеральних шарів або покриттів можуть бути використані різні матеріали, включаючи ряд полімерних кислот і сумішей полімерних кислот з такими матеріалами як шелак, цетиловий спирт і ацетат целюлози. 24 UA 110978 C2 5 10 15 20 25 30 35 40 45 50 55 60 Рідкі форми, в яких сполуки і композиції за даним винаходом можуть бути використані для орального або ін'єкційного введення, включають водні розчини, придатні ароматізовані сиропи, водні або олійні суспензії і ароматізовані емульсії з їстівними оліями, такими як хлопокова олія, кунжутна олія, кокосова олія або арахісова олія, а також еліксири і аналогічні фармацевтичні середовища. Композиції для інгаляції або інсуфляції містять розчини і суспензії у фармацевтично прийнятних, водних або органічних розчинниках, або їх сумішах, і порошки. Рідкі або тверді композиції можуть містити прийнятні фармацевтично прийнятні носії, як описано раніше. У деяких варіантах реалізації, композиції вводять оральним або назальним респіраторним шляхом для місцевого або системного ефекту. Композиції можуть розпилюватися за допомогою інертних газів. Розпилені розчини можуть вдихатися безпосередньо з розпилюючого пристрою, або розпилювальний пристрій може бути підключений до маски для обличчя, тенту або дихальному апарату надлишкового тиску періодичної дії. Композиції в розчинах, суспензіях або порошках можуть бути введені орально або назально через пристрої, що забезпечують доставку композиції відповідним чином. Композиції для локального застосування можуть містити один або більше звичайних носіїв. У деяких варіантах реалізації, мазі можуть містити воду і один або більше гідрофобних носіїв, вибраних, наприклад, з рідкого парафіну, поліоксиетиленалкілового ефіру, пропіленгліколя, білого вазеліну і тому подібного. Композиції носіїв у кремах можуть бути засновані на воді в комбінації з гліцерином і одним або більше іншими компонентами, наприклад, гліцеринмоностеаратом, ПЕГ-гліцеринмоностеаратом і цетилстеариловим спиртом. Гелі можуть бути отримані з використанням ізопропілового спирту і води, у відповідній комбінації з іншими компонентами, такими як, наприклад, гліцерин, гідроксіетилцелюлоза і тому подібні. У деяких варіантах реалізації, композиції для локального застосування містять, щонайменше, близько 0,1, щонайменше, близько 0,25, щонайменше, близько 0,5, щонайменше, близько 1, щонайменше, близько 2 або, щонайменше, близько 5 мас. % сполуки за даним винаходом. Композиції для локального застосування можуть бути упаковані в туби, наприклад, по 100 г, які необов'язково супроводжуються інструкціями по лікуванню вибраного показу, наприклад, псоріазу або іншого шкірного стану. Кількість сполуки або композиції, що вводиться пацієнту, варіюється залежно від того, що саме вводиться, мети введення, такої як профілактика або терапія, стану пацієнта, способу введення і тому подібного. У терапевтичних застосуваннях сполуки можуть бути введені пацієнту, страждаючому на захворювання, в кількості, ефективній для лікування або щонайменше часткового припинення симптомів захворювання і його ускладнень. Ефективні дози залежать від стану захворювання, що підлягає лікуванню, а також від вирішення лікаря, який лікує, залежно від таких факторів, як важкість захворювання, вік, маса і загальний стан пацієнта, і тому подібного. Композиції, що вводяться пацієнту, можуть бути у формі фармацевтичних композицій, описаних вище. Ці композиції можуть бути стерилізовані звичайними способами стерилізації або можуть бути стерилізовані фільтруванням. Водні розчини можуть бути упаковані для використання в початковому або ліофилізованому вигляді, ліофилізованний препарат змішують із стерильним водним носієм перед введенням. рН препаратів сполук за даним винаходом складає зазвичай від 3 до 11, бажаніше, від 5 до 9, і бажаніше, від 7 до 8. Слід розуміти, що використання певних вищезазначених носіїв, наповнювачів або стабілізаторів призводить до утворення фармацевтичних солей. Терапевтична доза сполуки за даним винаходом може варіюватися у відповідності, наприклад, з використанням для лікування певного захворювання, способом введення сполуки, здоров'ям і станом пацієнта і вирішенням лікаря, який лікує. Пропорція або концентрація сполуки за даним винаходом у фармацевтичній композиції може варіюватися залежно від ряду факторів, включаючи дозу, хімічні властивості (наприклад, гідрофобність) і спосіб введення. Наприклад, сполуки за даним винаходом можуть бути отримані у водному фізіологічному буферному розчині, що містить від близько 0,1 до близько 10 мас./об. % сполуки для парентерального введення. Деякі стандартні рівні доз складають від близько 1 мкг/кг до близько 1 г/кг маси тіла на день. У деяких варіантах реалізації, рівень дози складає від близько 0,01 мг/кг до близько 100 мг/кг маси тіла на день. Доза, ймовірно, залежить від таких змінних, як тип і міра прогресування захворювання або розладу, загальний стан здоров'я конкретного пацієнта, відносна біологічна ефективність вибраної сполуки, склад формотворного засобу і спосіб введення. Ефективні дози можуть бути екстрапольовані за кривими залежності реакції від дози, отриманими з випробувальних систем in vitro або моделей на тваринах. Композиції за даним винаходом можуть додатково містити один або більше додаткових 25 UA 110978 C2 5 10 15 20 25 30 35 40 45 50 55 60 фармацевтичних агентів, таких як хіміотерапевтичні, стероїдні, протизапальні сполуки, або імунодепресанти, приклади яких перераховані вище у даному документі. У деяких варіантах реалізації, сполуку або її фармацевтично прийнятну сіль вводять у вигляді офтальмічної композиції. Відповідно, у деяких варіантах реалізації, способи включають введення сполуки або її фармацевтично прийнятній солі і офтальмічно прийнятного носія. У деяких варіантах реалізації, офтальмічна композиція є рідкою композицією, напівтвердою композицією, вставкою, плівкою, мікрочастками або наночастками. У деяких варіантах реалізації, офтальмічна композиція є рідкою композицією. У деяких варіантах реалізації, офтальмічна композиція є напівтвердою композицією. У деяких варіантах реалізації, офтальмічна композиція є композицією місцевого застосування. Композиції місцевого застосування включають, але не обмежуючись цим, рідкі і напівтверді композиції. У деяких варіантах реалізації, офтальмічна композиція є композицією місцевого застосування. У деяких варіантах реалізації, композиції місцевого застосування включають водний розчин, водну суспензію, мазь або гель. У деяких варіантах реалізації, офтальмічну композицію наносять локально на передню частину ока, під верхню повіку, на нижню повіку і в сліпий мішок. У деяких варіантах реалізації, офтальмічна композиція є стерилізованою. Стерилізація може бути здійснена відомими способами, такими як стерилізуюча фільтрація розчину або шляхом нагрівання розчину в ампулі, готової до застосування. Офтальмічні композиції за даним винаходом можуть додатково містити фармацевтичні формотворні засоби, придатні для складання офтальмічних композицій. Прикладами таких формотворних засобів є консервуючі засоби, буферні агенти, хелатуючі агенти, антиокислювачі і солі для регулювання осмотичного тиску. При використанні в даному документі, термін «офтальмічно прийнятний носій» відноситься до будь-якого матеріалу, який може містити і вивільняти сполуку за даним винаходом або її фармацевтично прийнятну сіль, і який сумісний з очима. У деяких варіантах реалізації, офтальмічно прийнятний носій є водою або водним розчином, або суспензією, але також включає масла, такі як масла, що використовуються для отримання мазей, і полімерні матриці, такі як матриці, що використовуються в очних вставках. У деяких варіантах реалізації, композиція може бути водною суспензією, що містить сполуку за даним винаходом або її фармацевтично прийнятну сіль. Рідкі офтальмічні композиції, включаючи мазі і суспензії, можуть мати відповідну в'язкість для вибраного способу введення. У деяких варіантах реалізації, офтальмічна композиція має в'язкість у діапазоні від близько 1000 до близько 30000 сантипуаз. У деяких варіантах реалізації, офтальмічні композиції можуть додатково містити одну або більше поверхнево-активних речовин, ад'ювантів, буферів, антиоксидантів, регулювальників тонічності, консервантів (наприклад, ЕДТК, БАХ (бензалконію хлорид), хлорит натрію, перборат натрію, полікватеріум-1), загусників або модифікаторів в'язкості (наприклад, карбоксиметилцелюлоза, гідроксиметилцелюлоза, полівініловий спирт, поліетиленгліколь, гліколь 400, пропіленгликоль гідроксиметилцелюлоза, гідроксипропіл-гуар, гіалуронова кислота і гідроксипропілцелюлоза) і тому подібних. Добавки у композиції можуть включати, але не обмежуючись цим, хлорид натрію, бікарбонат натрію, сорбінову кислоту, метилпарабен, пропілпарабен, хлоргексидин, касторову олію і перборат натрію. Водні офтальмічні композиції (розчини або суспензії) зазвичай не містять фізіологічно або офтальмічно шкідливих компонентів. У деяких варіантах реалізації, у композиції використовують очищену або деіонізовану воду. рН може бути відрегульований додаванням будь-яких фізіологічно і офтальмічно прийнятних регулюючих рН кислот, основ або буферів до діапазону від близько 5,0 до 8,5. Офтальмічно прийнятні приклади кислот включають оцтову, борну, лимонну, молочну, фосфорну, хлороводневу і тому подібні, а приклади основ включають гідроксид натрію, фосфат натрію, борат натрію, цитрат натрію, ацетат натрію, лактат натрію, трометамін, трис-гідроксиметиламіно-метан і тому подібні. Солі і буфери включають цитрат/декстрозу, бікарбонат натрію, хлорид амонію і суміші вищезазначених кислот і основ. У деяких варіантах реалізації, способи включають формування або доставку депо терапевтичного засобу у контакті із зовнішньою поверхнею ока. Депо відноситься до джерела терапевтичного засобу, який повільно виводиться із сльозами або іншим механізмом очищення очей. Це забезпечує наявність безперервної, стійкої концентрації терапевтичного засобу в рідині на зовнішній поверхні ока при однократному застосуванні. Не обмежуючись межами якоїнебудь теорії, передбачається, що абсорбція і проникнення може залежати як від концентрації розчинених ліків, так і від тривалості контакту зовнішньої тканини з рідиною, що містить ліки. У міру видалення ліків при очищенні очної рідини та/або абсорбції всередину очної тканини, з депо в поповнену кількість очної рідини виділяється додаткова кількість ліків, наприклад, 26 UA 110978 C2 5 10 15 20 25 30 35 40 45 50 55 60 розчинених. Відповідно, використання депо може простіше сприяти поповненню очної тканини більш нерозчинними терапевтичними засобами. У деяких варіантах реалізації, депо може зберігатися до восьми годин або більше. У деяких варіантах реалізації, форми офтальмічного депо включають, але не обмежуючись цим, водні полімерні суспензії, мазі і тверді вставки. У деяких варіантах реалізації, офтальмічна композиція є маззю або гелем. У деяких варіантах реалізації, офтальмічна композиція є засобом доставки на основі масла. У деяких варіантах реалізації, композиція містить нафтову або ланолінову основу, до якої доданий активний компонент, зазвичай у кількості 0,1-2%, і формотворні засоби. Звичайні основи можуть включати, але не обмежуючись цим, мінеральне масло, петролатум і їх комбінації. У деяких варіантах реалізації, мазь наносять у вигляді стрічки на нижню повіку. У деяких варіантах реалізації, офтальмічна композиція є офтальмічною вставкою. У деяких варіантах реалізації, офтальмічна вставка є біологічно інертною, м'якою, біорозкладаною, в'язкоеластичною, стійкою до стерилізації після дії терапевтичних засобів, стійкою до інфекцій від бактерій, що знаходяться у повітрі, біорозкладаною, біосумісною та/або в'язкоеластичною. У деяких варіантах реалізації, вставка містить офтальмічно прийнятну матрицю, наприклад, полімерну матрицю. Матриця зазвичай є полімером, а терапевтичний засіб зазвичай є диспергованим у ньому або пов'язаний з полімерною матрицею. У деяких варіантах реалізації, терапевтичний засіб може повільно вивільнятися з матриці шляхом розчинення або гідролізу ковалентного зв'язку. У деяких варіантах реалізації, полімер є біорозкладаним (розчинним), і швидкість його розчинення може регулювати швидкість вивільнення терапевтичного засобу, диспергованого в ньому. В іншій формі полімерна матриця є біорозкладаним полімером, який руйнується, наприклад, гідролізом, вивільняючи таким чином терапевтичний агент, пов'язаний з ним, або диспергований у ньому. У додаткових варіантах реалізації, матриця і терапевтичний агент можуть бути поміщені в додаткову полімерну оболонку для додаткового регулювання вивільнення. У деяких варіантах реалізації, вставка містить біорозкладаний полімер, такий як полікапролактон (PCL), етилен/вініл-ацетатний співполімер (EVA), поліалкіл ціаноакрилат, поліуретан, нейлон або полі(dl-лактид-со-гліколід) (PLGA), або їх співполімер. У деяких варіантах реалізації, терапевтичний агент диспергований у матеріалі матриці або диспергований у композиції мономерів, що використовуються для отримання матеріалу матриці перед полімеризацією. У деяких варіантах реалізації, кількість терапевтичного агенту складає від близько 0,1 до близько 50%, або від близько 2 до близько 20%. У додаткових варіантах реалізації, використовують біорозкладану або біоруйновану полімерну матрицю, щоб відпрацьовану вставку не потрібно було видаляти. У міру руйнування або розчинення біорозкладаного або біоруйнованого полімеру вивільняється терапевтичний засіб. У додаткових варіантах реалізації, офтальмічна вставка містить полімер, включаючи, але не обмежуючись цим, полімери, описані в публікації Wagh, et al., “Polymers used in ocular dosage form and drug delivery systems”, Asian J. Pharm., сторінки 12-17 (січень 2008 року), яка включена в дану заявку шляхом посилання в повному обсязі. У деяких варіантах реалізації, вставка містить полімер, вибраний з полівінілпіролідону (ПВП), полімеру або співполімера акрилата або ® метакрилату (наприклад, сімейство полімерів Eudragit компанії Rohm або Degussa), гідроксиметилцелюлози, поліакрилової кислоти, полі(амідоамін) дендримерів, полі(диметилсилоксану), поліетиленоксиду, полі(лактид-со-гліколіда), полі(2гідроксіетилметакрилата), полі(вінілового спирту) або полі(пропіленфумарата). У деяких ® варіантах реалізації, вставка містить Gelfoam R. У деяких варіантах реалізації, вставка є поліакриловою кислотою кон'югата цистеїну 450 кДа. У деяких варіантах реалізації, офтальмічна композиція є офтальмічну плівкою. Полімери, придатні для таких плівок, включають, але не обмежуючись цим, полімери, описані в публікації Wagh, et al. (ibid). У деяких варіантах реалізації, плівка є м'якою контактною лінзою, такою як лінзи, зроблені зі співполімерів N,N-діетилакриламіда і метакрилової кислоти, зшитої з диметилакрилатом етиленгліколя. У деяких варіантах реалізації, офтальмічна композиція містить мікросфери або наночастки. У деяких варіантах реалізації, мікросфери містять желатин. У деяких варіантах реалізації, ці мікросфери вводять ін'єкцією у задній сегмент ока, в хороїдальний простір, у склеру, у склоподібне тіло або під сітківку. У деяких варіантах реалізації, мікросфери або наночастки містять полімер, включаючи, але не обмежуючись цим, полімери, описані в публікації Wagh, et al. (ibid), яка включена в даний документ шляхом посилання в повному обсязі. У деяких варіантах реалізації, полімером є хітозаном, полікарбоновую кислотою, такою як поліакрилова кислота, частки альбуміну, складні ефіри гіалуронової кислоти, поліітаконовою кислоту, полі(бутил)ціаноакрилатом, полікарпролактоном, полі(ізобутил) капролактоном, полімолочною кислотою, співполімерізовану з гліколевою кислотою або полімолочною кислотою. У деяких 27 UA 110978 C2 5 10 15 20 25 30 35 40 45 50 55 60 варіантах реалізації, мікросфери або наночастки містять тверді ліпідні частки. У деяких варіантах реалізації, офтальмічна композиція містить іонообмінну смолу. У деяких варіантах реалізації, іонообмінна смола є неорганічним цеолітом або синтетичною органічною смолою. У деяких варіантах реалізації, іонообмінні смоли включають, але не обмежуючись цим, смоли, описані в публікації Wagh, et al. (ibid), яка включена в даний документ шляхом посилання в повному обсязі. У деяких варіантах реалізації, іонообмінна смола є частково нейтралізованою поліакриловою кислотою. У деяких варіантах реалізації, офтальмічна композиція є водною полімерною суспензією. У деяких варіантах реалізації, терапевтичний агент або полімерний суспендуючий агент суспендований у водному середовищі. У деяких варіантах реалізації, водна полімерна суспензія може бути складена так, щоб зберігати таку ж або переважно таку ж в'язкість в оці, яку вона мала до введення в око. У деяких варіантах реалізації, вони можуть бути складені так, щоб при контакті із слізною рідиною збільшувалося гелеутворення. Мічені сполуки і способи аналізу Інший аспект даного винаходу відноситься до мічених сполук даного винаходу (з радіоактивною міткою, з флуоресцентною міткою і тому подібним), які можуть бути корисні не лише для засобів візуалізації, але також і в аналізах, як in vitro, так і in vivo, для локалізації і кількісної оцінки JAK у зразках тканин, включаючи людину, а також для визначення лігандів JAK шляхом інгібування зв’язування мічених сполук. Відповідно, даний винахід включає зразки JAK, які містять такі мічені сполуки. Даний винахід додатково включає мічені ізотопами сполуки за даним винаходом. «Мічена ізотопом» або сполука «з радіоактивною міткою» є сполукою за даним винаходом, в якій один або більше атомів заміщені або замінені атомом, що має атомну масу або масове число, відмінне від атомної маси або масового числа, що зазвичай зустрічається в природі (тобто, природного). Придатні радіонукліди, які можуть бути упроваджені в сполуки за даним 3 11 винаходом, включають, але не обмежуються цим, H (також записується як T для тритію), C, 13 14 13 15 15 17 18 18 35 36 82 75 76 77 123 124 125 131 C, C, N, N, O, O, O, F, S, Cl, Br, Br, Br, Br, I, I, I і I. Радіонукліди, які впроваджують у сполуки з радіоактивною міткою, залежать від конкретного застосування цієї сполуки з радіоактивною міткою. Наприклад, для маркування JAK і конкурентних аналізів in vitro 3 14 82 125 131 35 зазвичай більш придатні сполуки, , що містять H, C, Br, I, I, S. Для отримання радіо11 18 125 123 124 131 75 76 77 зображення зазвичай більш придатні C, F, I, I, I, I, Br, Br або Br. Слід розуміти, що «мічена сполука» або сполука «з радіоактивною міткою» є сполукою, що містить щонайменше один радіонуклід. У деяких варіантах реалізації, радіонуклід вибраний з 3 14 125 35 82 групи, що складається з H, C, I, S і Br. У деяких варіантах реалізації, сполука містить 1, 2 або 3 атоми дейтерію. Даний винахід додатково включає способи синтезу для впровадження радіоізотопів у сполуки за даним винаходом. Способи синтезу для впровадження радіоізотопів в органічні сполуки добре відомі в даній області, і фахівець у даній області легко встановить способи, застосовні для сполук за даним винаходом. Мічені сполуки за даним винаходом можуть бути використані в скринінгових дослідженнях для ідентифікації/оцінки сполук. Наприклад, нещодавно синтезована або ідентифікована мічена сполука (тобто тестова сполука), може бути оцінена на її здатність зв'язувати JAK моніторингом зміни її концентрації при взаємодії з JAK шляхом відстежування мітки. Наприклад, тестова (мічена) сполука може бути оцінене на її здатність знижувати зв’язування іншого сполуки, зв'язуючої JAK (тобто, звичайної сполуки). Відповідно, здатність тестової сполуки конкурувати із звичайною сполукою за зв'язування з JAK прямо корелює з її зв'язуючою здатністю. І навпаки, у деяких інших скринінгових дослідженнях, стандартна сполука є міченою, а тестова сполука не має мітки. Відповідно, контролюють концентрацію міченої стандартної сполуки для оцінки конкуренції між стандартною сполукою і тестовою сполукою, таким чином встановлюють відносну зв'язуючу здатність тестової сполуки. Набори Даний винахід включає також фармацевтичні набори, придатні, наприклад, для лікування або запобігання захворюванням або розладам, пов'язаним з JAK, таких як рак, що містять одну або більше упаковок, що містять фармацевтичну композицію, що містить терапевтично ефективну кількість сполуки за даним винаходом. Такі набори можуть додатково містити, при необхідності, один або більше різних компонентів звичайних фармацевтичних наборів, таких як, наприклад, контейнери для одного або декількох фармацевтично прийнятних носіїв, додаткові ємності і тому подібне, що очевидно для фахівця у даній області. Також до складу набору можуть входити інструкції, як у вигляді вкладишів, так і у вигляді етикеток, що показують кількість компонентів, що підлягають введенню, інструкції по введенню та/або інструкції по 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAzetidinyl phenyl, pyridyl or pyrazinyl carboxamide derivatives as jak inhibitors
Автори англійськоюYao, Wenqing, Burns, David M., Zhuo, Jincong
Автори російськоюЯо Веньцин, Бернс Дэвид М., Чжо Цзиньцун
МПК / Мітки
МПК: A61P 35/00, A61P 37/02, A61K 31/519, A61K 31/437, A61P 29/00, C07D 471/04, C07D 487/04
Мітки: піразинілкарбоксамідні, похідні, піридилові, азетидинілфенілові, інгібітори
Код посилання
<a href="https://ua.patents.su/78-110978-azetidinilfenilovi-piridilovi-abo-pirazinilkarboksamidni-pokhidni-yak-ingibitori-jak.html" target="_blank" rel="follow" title="База патентів України">Азетидинілфенілові, піридилові або піразинілкарбоксамідні похідні як інгібітори jak</a>
Попередній патент: Лінія для формування заготовок цукрової вати
Наступний патент: Рідка фармацевтична композиція, яка включає нітизинон
Випадковий патент: Електронна система пожежно-охоронної сигналізації