Препарат, що містить активно діючий компонент на основі тореміфену, спосіб лікування раку молочної залози, спосіб зміни багатолікарської стійкості клітин та спосіб лікування меланоми або лімфоми
Номер патенту: 27461
Опубліковано: 15.09.2000
Текст
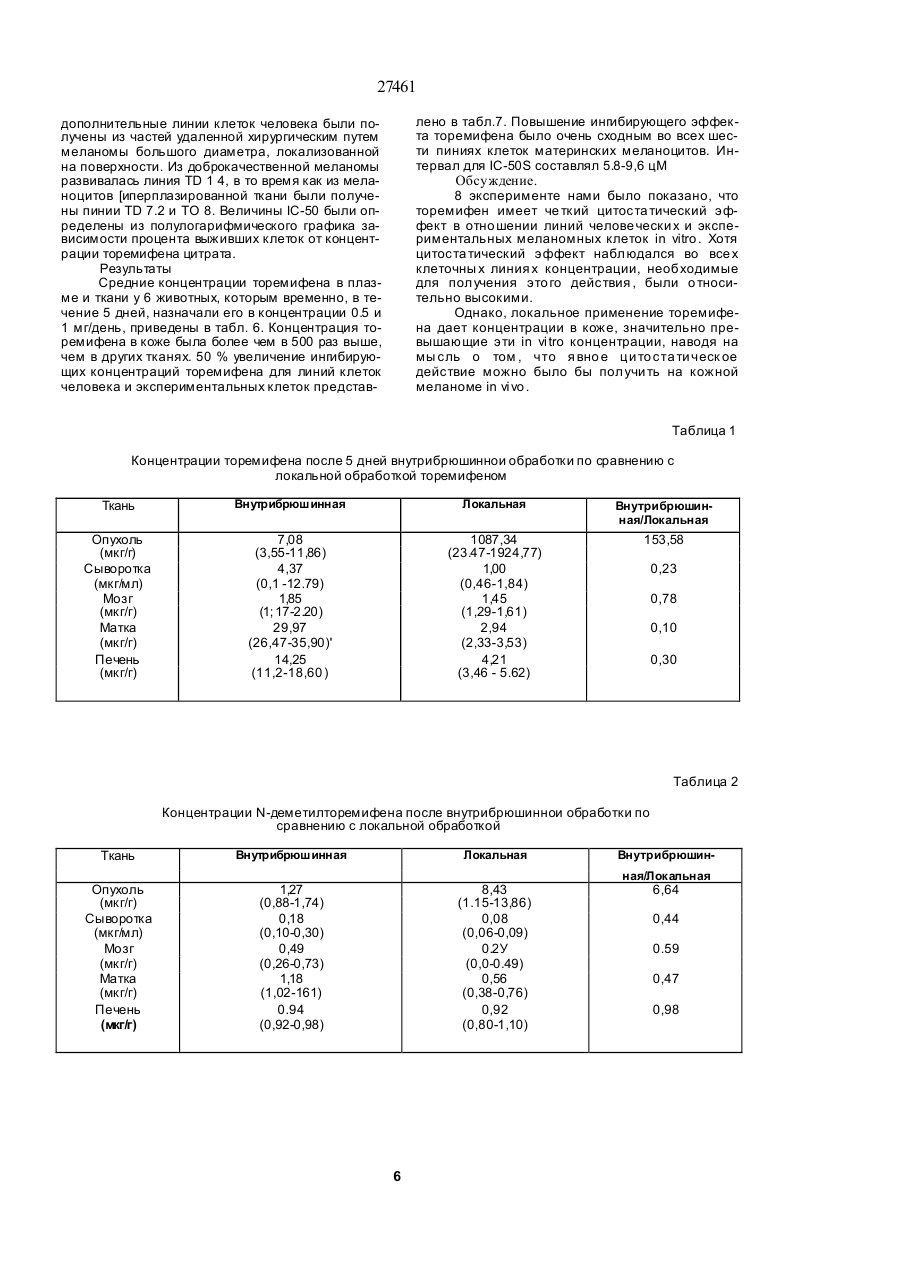
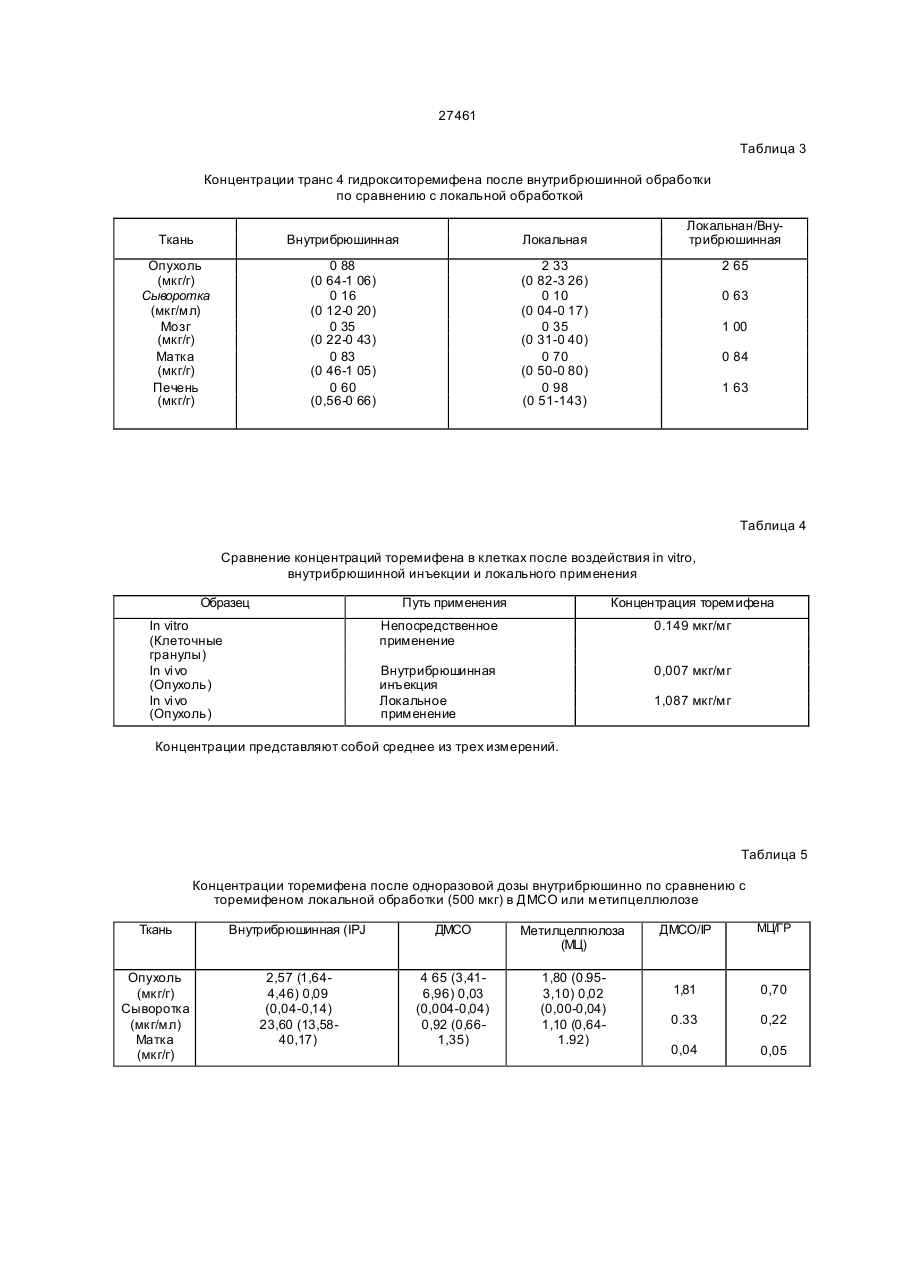
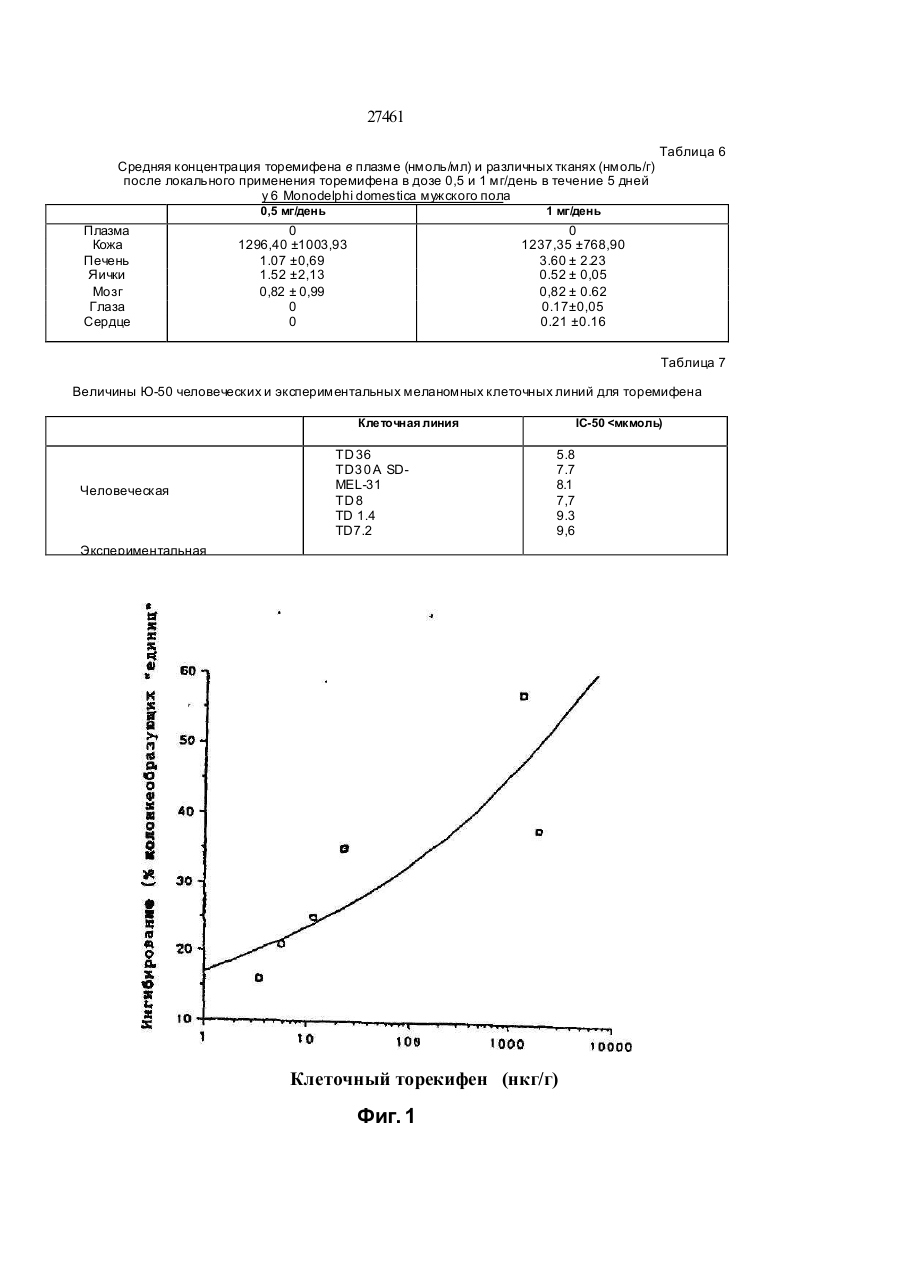
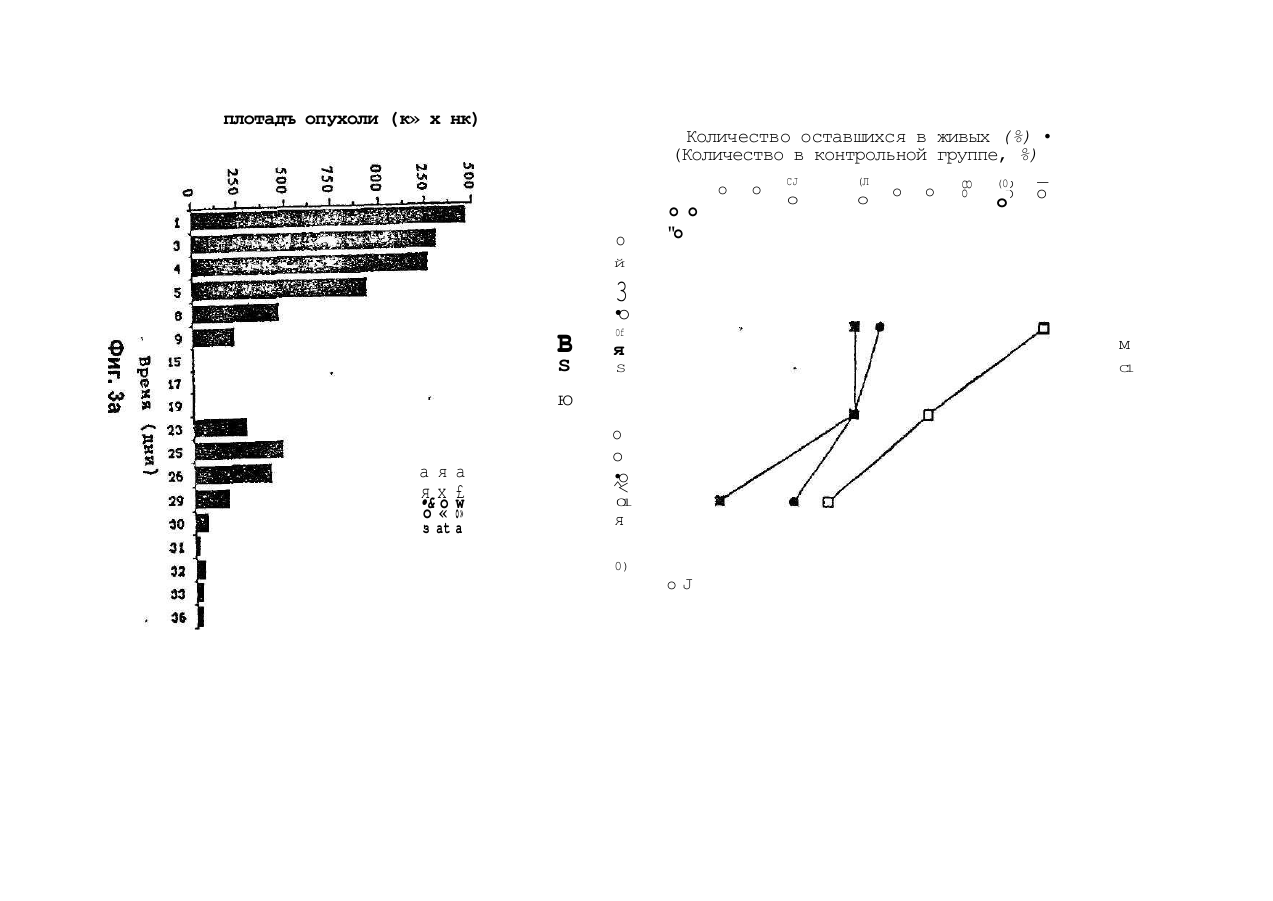
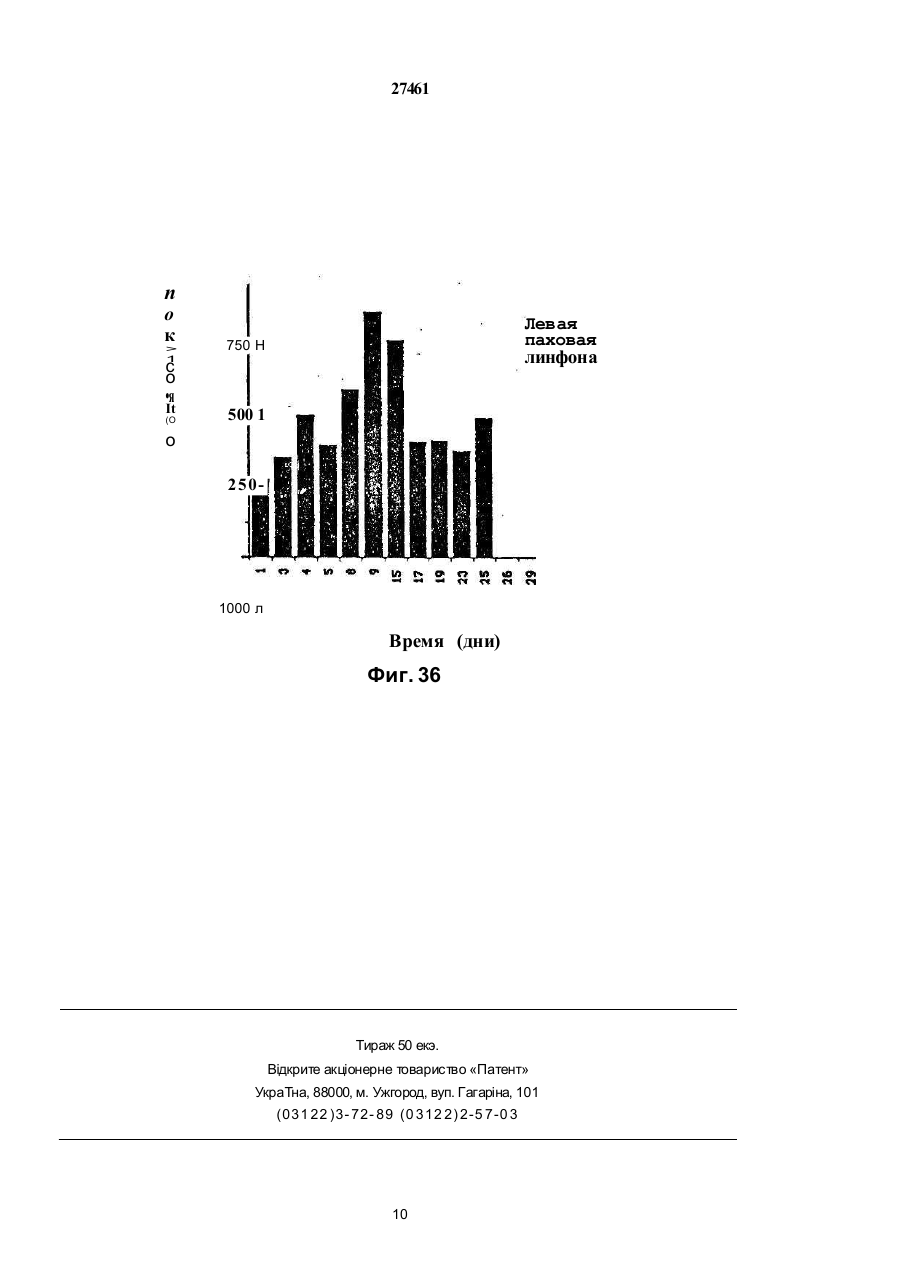
1.Препарат, содержащий активно действую щий компонент на основе торемифена или одного из его метаболитов N-диметилторемифена или 4гидрокситоремифена, или его фармацевтически приемлемой нетоксичной сопи и фармацевтичес ки приемлемый наполнитель, о тличающий ся тем, что препарат предста влен в виде трансдермальной лекарственной формы. 2 Препарат по п.1, отличающийся тем, что представлен в виде мази, эмульсии, примочки, раствора, геля или крема. 3.Препарат по п.1, отличающийся тем, что представляет собой пластыревую систему трансдермальной доставки. 4.Препарзт по п 2 или 3, отли чающийся тем, что активно действующий компонент представляет со бой комплекс с циклодекстрином или с производным циклодекстрина. 5.Препарат по любому из пп.2-4, о тличающий ся тем,- что активно действующий компонент представляет собой торемифен или его фармацевтически приемлемую соль. б.Препарат по любому из пп 1-4, отличающийся тем, что он предназначен для течения рака молочной железы. 7.Препарат по любому из пп.1-4, отли чающийся тем, что он предназначен для профилактики рака молочной железы 8.Препарат по любому из пп.1-4, отли чающийся тем. что он предназначен для изменения многолекарственной устойчивости клеток злокачественной опухопи к цитотоксическим лекарствам. 9 Препарат по любом у из пп.1 -4, о тли чающий ся тем. что он предназначен для лечения меланомы, пимфомы. 10 Способ лечения рака молочной жепезы, отли чающийся тем , что субъекту, н ужда ющем уся в лечении, трансдермально вводят эффективное количество препарата по п.1 11 Способ изменения многолекарственной устойчи вости клеток злокачественней опухоли к цитотсжсическому лекарству, отличающийся тем, что субъекту, нуждающемуся в лечении, трансдермально вводят эффективное количество препарата по п. 1. 12 Способ лечения меланомы или лимфомы, от личающийся тем, что субъекту, н уждающемуся в печении, трансдермапьно вводят эффективное количество препарата по п. 1. Настоящее изобретение относится к локальным препаратам, содержащим в качестве активного компонента торемифен или один из его метаболитов N-деметилторемифен (4-хлор-1,2-дифенил-/4-/ 2-( М-метиламино)-этокси/фенил/-1-бутен) или 4-гидрокситоремифен(4-хлор-1-(4-гидроксифенил)-2-фенил -1-/47-2- (N,N -диметиламино)этокси /-фенилУ-1-бутен) или их фармацевтически приемпемые нетоксичные соли. Использование подобных локальных препарато в, например, для ле чения з локачественны х опухолей, локализованных в коже или на малом расстоянии от кожи, например, метастатических образований рака молочной железы, также входит в объем изобретения. Кроме того, использование этих локальных препаратов для дополнительных лечебных мероприятий при раке молочной железы, а также их использование для изменения много лекарственной устойчивости клеток злокачественной опухоли к цитотоксическим лекарствам также находятся в объеме изобретения. Локальное применение то (31)9207437 6 ' (32)03.04.1992 (33) GB (86) PCT/FI93/00119, 25.03 1993 (46) 15 09.2000, Бюл. № 4, 2000 р (72) Дігрггоріо Майкл Уілл'ям (US), Куркела Ка уко Ойва Ан теро (FI) (73) Орюн Іхтюмя Ой (Ft) (56) 1. US, A, 4 990 538, Q5 02.1991. 2. Fornander J. et a!.. Lancet, 1989, 21:117-120. 3. Wtebe VJ. et a!, Cancer Chemother. Pharmacol., 1990,25:247-251. 04 О 27461 ремифена ипи его метаболитов представляет особый интерес при лечении мелачомы. лимфомы, саркомы Калоши и грибовидного микоза. Тамоксифен и торемифен представляют собой трифенилэтиленовые антиэстрогены, используемые при лечении рака молочной железу, положительного в отношении эстрогенорецепторов. Эти лекарства наиболее часто используют в качестве эндокринного средства для лечения рака молочной железы. Тамоксифен и торемифен интибируют вызванное эстрогеном развитие при помощи конкурирующего антагонизма эстрогенорецепторов опухоли (ER) Антиэстрогенная терапия является эффективной при продлении безболезненного состояния и общей продолжительности жизни женщин после первичного хирургического вмешательства. Антизстрогенная терапия замедляет рецидив и продлевает продолжительность жизни у пациентов с первичным раком молочной железы, подвергающихся дополнительным лечебным мероприятиям после мастэктомии. Около двух третей пациентов с метастатическим ратом молочной железы, положительным в отношении эстроген о рецепторов (ER), будут иметь временную ремиссию при использовании Тамоксифена. Хотя тамоксифен считают лекарством относительно слабого действия, недавние наблюдения наводят на мысль, что женщины, принимающие тамоксифен в качестве дополнительного лечебного мероприятия, могут иметь повышенный риск развития вкутриматочных оп ухолей (Fornander Т. et al, Lancet 1989, 21.117-120). Гистопатология определяет эти опухоли, как проникающие внутриматочные опухоли, не относящиеся к метастазу опухоли молочной железы. Факторы, способствующие этому, не поняты в достаточной степени. Однако ряд исследований связал внутриматочную глокачественную опухоль со средствами, обладающими эстрогенной активностью (Smith Dc. et al, N. England J. Med. 1975; 2931, 1164-67. Развитие многолекарственной устойчивости (MDR) представляет собой один из основных механизмов, посредством которого злокачественная опухоль становится резистентной к химотерапевтическим средствам, особенно к антрациклинам и винка алкалоидам. Классическую MDR связывают с повышенным проявлением гена MDR-I, осуществляющим кодирование Р-гликопротеина клеточных оболочек (р170). Полагают, что проявление гена M0R-I связано с пониженным клеточным накоплением лекарства, вследствие обусловленного действующего механизма эманации. Хотя известно, что многие средства, включая верапамип, трифторперизины и циклоспорины, изменяют многолекарственную устойчи вость in vitro, большинство средств не достигают in vi vo достаточно высоких для изменения концентраций без значительной токсичности для пациента. Это особенно справедливо для верапамила, который связывают со значительной кардиотоксичностью. Нестероидные трийренилэтиленовые антиэстрогены продемонстрировали in vitro активность по индуцированию чувствительности к химиотерапии, по-видимому, не связанную с их антиэстрогенным действием. Тореммфен и его метаболиты N-деме тилторемифен и 4-гидрокситоремифен представляют собой примеры новых трифенилэтиленов, обладающих активностью по индуцированию чувствительности к химиотерапии в MDR-положительных клетках при концентрациях, которые достигаются у людей без существенной токсичности. Торемифен, по-видимому, является уникальным в том, что концентрации, которые изменяют устойчивость in vitro (5 мкмоль), могут быть достигнуты in vivo после оральной терапии без существенной токсичности (Wiebe VJ. et al, Cancer Chemother. Pharmacol., 1990, 25:247-251). Концентрации торемифена и N-деметилторемифена в плазме после больших оральных доз составляют порядка 10 мкмоль. Однако, плазменные концентрации могут не отражать эффективной анти-MDR активности на опухопевом уровне. Хотя общее токсическое действие торемифена в высоких дозах (400 мг/день) обычно ограничивают головокружением, тошнотой и приступообразным ощущением жара, сочетание терапии с другими цитотоксическими средствами может изменить общую характеристику токсичное™. Поэтому способы повышения концентрации торемифена и его метаболитов в опухоли при минимизации общего воздействия могут улучшить эффективность анти-MDR терапии этими лекарствами. Итак, было обнаружено, что локальное применение торемифена и его метаболитов можно использовать для достижения очень высоких локальных опухолевых концентоаций без риска общей токсичности. Такие локальные препараты торемифена и его метаболитов полезны при обработке злокачественных опухолей, локализованных в коже или на малом расстоянии от кожи, например, меланомы, лимфомы, саркомы Калоши, грибовидного микоза и локальных метастатических образований рака молочной железы. Кроме того, локальное применение может дать эффективный способ профилактики рецидива рака молочной железы у пациентов высокого риска при минимизации опасности онутриматочных опухолей и общей токсичности. Чрезкожное применение торемифена и его метаболитов можно осуществить в основном двумя различными способами; (І) посредством смешивания терапевтически активного соединения или его нетоксичной фармацевтически приемлемой соли с соответствующими фармацевтическими носителями и необязательно средствамиусипитепями проникновения с получением мазей, эмульсий, примочек, растворов, кремов, гелей и т.п., причем предпочтительно количество указанного препарата наносят на определенную область кожи, или (ІІ) посредством включения терапевтически активного вещества в пластыри или системы чрезкожной доставки, согласно известной технологии. Примеры пригодных наполнителей включают наполнители, хорошо известные в области приготовления локальных препаратов, например, диметилсульфоксид. растительные и животные масла, нелетучие жирные спирты, кислоты, сложные эфиры, например, цетостеариловый спирт и цетиловый спирт; летучие спиртовые соединения, например, этанол или изопропанол; гликоли ипи 2/451 эфиры гликолей, полиэтиленгликоль, попипропиленгликоль, глицерол или эфиры глицеролэ, производные л целлюлозы, например, метилцеллюлоза. или карбоксиметилцеллюлоза. Также могут быть включены эмульгирующие средства, например, стеарат сорбита или полисорбат 60, и консервирующие средства и средства - усилители проникновения, известные в области фармакологии. Свойства растворения в водной среде торемифена и его метаболитов можно значительно улучши ть посредством образования комплексов лекарственного вещества с циклодекспринами. Циклодекстрины (включая альфа, бета- и гаммацикл оде кстрины и их производные) все представляют собой циклические олигомеры глюкозы. Циклодекстрины могут образовывать комплексы включения с лекарствами, в которых молекула лекарства включается в липофильные полости молекулы циклодекстрина. Поэтому циклодекстрины эффективно солюбилизируют липофильные лекарства в водную среду Использование циклодекстринов в фармацевтической области было описано, например, в Drug Development and Industrial Pharmacy, 17(11), 1503-1549, 1991. Пределы дозы торемифена или его метаболитов для профилактики (дополнительных лечебных мероприятий у людей составляют порядка 1-200 мг/день) на человека в зависимости от биологичео кой доступности лекарства Предпочтительная доза могла бы быть близка к вспомогательной оральной дозе в 60 мг/день, или к одноразовой недельной дозе в 300-500 мг/пластырь. Для короткого курса с высокими дозами торемифена (или метаболита торемифена) предполагается доза в 400-1000 мг/день, предпочтительно 500-600 мг/день. Эксперименты Следующие широкие исследования осуществлялись в соответствии с настоящим изобретением. Эксперимент 1 описывает распределение торемифена и е го метаболи то в в тканя х после короткого курса локального применения с высокими дозами по сравнению с внутрибрюшинным (IP) применением у мыши, а также распределение в тканях антиэстро генных доз торемифена и его метаболи то в после локального применения с одноразовой дозой по сравнению с вн утрибрюшииным. Эксперимент 2 описывает эффективность торемифена и его метаболитов после локального применения при профилактике роста опухоли рака молочной железы у мыши Эксперимент 3 описывает эффективность локально примененного в высоких дозах торемифена в усилении цитотоксичности доксорубицина в MDR опухолях у мыши. Эксперимент 4 описывает эффективность торемифена и его метаболитов после локального применения при профилактике роста лимфомы у бабуина. Эксперимент 5 описывает распределение торемифена в тканях после локального применения у Monodeiphis domestica и цитостатическое действие торемифена у клеточных линий меланомы. Чертежи Фиг 1 показывает результаты исследований по клонированию, проведенных на опухолях, иссеченных из мыши, обработанной локальным и внутрибрюшинным торемифеном Фиг 2 показывает результаты исследований по клонированию, проведенных на опухолях, иссеченных из мышей, обработанных и необработанных локальным торемифеном. Фиг. За показывает реакцию, наблюдаемую в правой паховой лимфоме бабуина, обработанной локальным торемифеном, и Фиг . Зв показывает реакцию, наблюдаемую в необработанной левой паховой лимфоме бабуина. Эксперимент 1 Методика Шестнадцати самкам атимических лишенных шерсти мышей вводили подкожно иглой 20 калибра 5 х 106 MDA A-I клеток в область левой лопатки. Опухолям до обработки давали расти в течение 3 недель. Для IP применения цитрат торемифена суспендировали в арахисовом масле Каждой из трех мышей в течение 5 дней вводили вн утрибрюшинно, используя иглу 18 калибра, 50 мкл. подавая 1 мг/день Локальный торемифен применяли в смеси димети л сул ьфоксид/зтано л/мети лцеплю лоза/ вода (10.257:58) при дозе 2,5 мг/живо тное/день в течение 5 дней Цитрат торемифена сначала растворяли в дим етил сульфоксиде, а затем разбавляли в смеси этанола, метилцеллюлозы и воды Всех мышей умерщвляли на пятый день обработки через два часа после последней дозы. Образцы крови собирали капиллярной пипеткой после перерезания подмышечных сосудов и помещали в геларинизированные трубки центрифуги . Мозг, печень и матку удаляли хир ургически и помещали э отдельные трубки. Одноразовую дозу торемифена применяпи внутрибрюшинно в соотве тствии с вышеописанным или локально с диметилсульфоксид/этанол/ метилцеллюлоза/вода в качестве разбавителей. Доза внутрибрюшинною или локального торемифена составляла 500 мкг. Образцы тканей собирали как описывалось выше Все образцы крови центрифугировали при 1000 об. Ппазму собирали, измеряли ее объем и помещали в чистые экстракционные трубки Все остающиеся образцы тканей взеешивапи, помещали в экстракционные трубки и помечали внутренним стандартом нафоксидином Ткани тщательно гомогенизировали перед доба влением 6 мл экстракционной жидкости. Образцы собирали и сушили в соотве тстзии с нижеописанным. Перед впрыскиванием в колонку жидкостной хроматографии высокого разрешения каждый образец составляли повторно при помощи 200 мкл метанола Все образцы помещали в кварцевую кюве ту для У Ф акти вации Образцы мозга требовали фильтрования посредством фильтров со шприцтюбиками Концентрации торемифена рассчитывали для всех образцов на основе стандартной кривой Количество торемифена и его метаболитов определяли при помощи жидкостной хроматографии высокого разрешения (HPL С). 27461 Результаты: Таблица 1 показывает, что при дозе в 2,5 раза превышающей дозу внутрибрюшинного применения локально обработанные опухоли содержат в 150 раз более высокие концентрации торемифена при более низкой концентрации в сыворотке. Это указывает на явное фармакологическое преимущество. Интересно, что мыши, получающие локальный торемифен имели одну десятую концентрации торемифена в матке, по сравнению о мышами, получающими внутрибрюшинный торемифен. В печени локально обработанные мыши также демонстрировали более низкие концентрации торемифена, предполагая меньшее общее распределение. Концентрации торемифена в мозговых тканях были эквивалентны Таблица 2 показывает, что локально обработанные опухоли имели более высокую концентрацию N-деметипторемифена при более низкой концентрации в сыворотке. Это указывает, что MD A A-l опухолевые клетки могут метаболизировать торемифен. По существу, не было разницы в концентрации в печени между мышами с внутрибрюшинно и локально обработанными опухолями. Мозг и матка локально обработанных мышей также демонстрировали меньшую концентрацию Nдеметилторемифена.чем у знутрибрюшинно обработанной группы. Таблица 3 показывает, что локально обработанные опухоли имели более высокие концентрации транс-4-гидрокситоремифена, чем опухоли, обработанные внутрибрюшинно. Этот метаболит представляет собой наиболее сильнодействующий антиэстрогенный метаболит. Сывороточные содержания в локально обработанных опухолях были ниже, тогда как в мозге концентрации были идентичны Было исследовано также поглощение торемифена в клетках. МСГ-7 ER+ т vitro при эффективной антиэстрогенной дозе лекарства и сравнили эти исследования с результатами вышеописанных исследований по распределению in vivo . После 20 часо вой инкубации с 6,6 мкмоль торемифена, клетки промывали, считали, взвешивали и при помощи жидкостной хроматографии высокого разрешения измеряли клеточные концентрации торемифена. Концентрация торемифена (мкг/мг) представлена в Таблице 4. При сравнении концентраций торемифена, достигнуты х в опухолях после локального и внутрибрюшинного способов применения, наибольшие концентрации наблюдаются после локального применения торемифена. Локальное применение приводило к концентрации торемифена,бопее чем в 7 раз превышающей концентрацию торемифена, обнаруживаемую после экспозиции in vitro, и более, чем в 150 раз превышающей концентрацию, обнаруживаемую после внутрибрюшинной инъекции. Эти результаты наводят на мысль о том, что эти концентрации торемифена можно легко попучить после локального применения к подкожным опухолям, тогда как внутрибрюшинное применение соста вляло 1/20 от данны х погло щения in vitro, тем самым предполагая дополнительное кинетическое преимущество локальной терапии. Таблица 5 показывает концентрации торемифена после одноразовой внутрибрюшинной дозы в 500 мкг по сравнению с 500 мкг, примененными локально В качестве разбавителей использовали диметилсульфоксид и гіетилцеллюлозу Оба локально примененных способа имели в сравнении с внутрибрюшинными одинаковые содержания торемифена в опухоли, но намного меньшее общее распределение. Это представляло собой тенденцию, наблюдаемую как для сыворотки, так и для матки. Таким образом, экспериментом было доказано, что торемифен легко подвергается чрезкожному проникновению и достигает очень высоких опухолевых концентраций при ограничении общего воздействия. Интересно, что в то время как больше торемифена могло бы быть доставлено к опухолям локальным способом, концентрации в сыворотке были намного ниже, что указывает на значительное терапевтическое преимущество для локального поступления торемифена. Кроме того, как активные N-деметип-, так и 4-гидроксиметаболиты торемифена присутствовали в ткани опухоли в более высоких концентрациях после локального поступления, чем после внутрибрюшинного, что наводит на мысль о том, что метаболизм в эти активные метаболиты может также происходить на уровне тканей, а не исключительно в печени. Матка и печень содержали значительно более низкие концентрации торемифена после локального поступления, чем после внутрибрюшинного, предоставляя дополнительное доказательство уменьшенного общего воздействия в случае локальной терапии Уменьшенное воздействие на матку может представлять собой значительное клиническое преимущество, вследствие потенциального риска вторичных опухолей у антиэстрогенов. Известно о внутриматочной дисплазии, кровотечении, образовании полипов и опухолей после длительного вспомогательного лечения тамоксифеном (Nouvo MAelal , In t J. G^n Pathoi 1989, 8 125-131) Ме таболиты самоксифена (бисфенол и метаболит Е), присутствующие в маточной ткани после тамоксифенной терапии, можно потенциально связывать с разви тием втор ичной ма то чной неоплазии (Nuovo MA et ai, Int J. Gyn Pathoi , 1989, 21; 117120). Локальное применение торемифена может исключить возможность возникновения этих побочных явлений. Эксперимент 2 Методика В этом исследовании 12 мышам трансплантировали клетки MCF-7 и позволяли клеткам расти до тех пор, пока у все х мышей не обнаруживали небольшую опухоль ( 6 х 8 мм) В других группах только у одной мыши в 4-гидрокситоремифеновой группе развилась небольшая опухоль ( 30% ингибирования, тогда как все три внутрибрюшинно обработанные опухоли имели < 30% ингибирование. Чертеж 2 показывает результаты исследований по клонированию, проведенных на опухолях, иссеченных У мышей,обработанных и необработанных локальным торемифеном Верхняя кривая показывает опухоль, устойчивую к доксорубицину у мыши, необработанной торемифеном Нижние две кривых показывают опухоли, которые обрабатывали торемифеном Очевидно, что торемифен, по-видимому, повышает чувстви тельность этих MDP MDA A-I оп ухолей к доксорубицину. Т.о., эти результаты показывают, что чем, выше достижимые концентрации торемифена в опухопи, наблюдаемые в присутствии локального торемифена in vivo , тем вы ше будет синергическое действие при изменении приобретенной лекарственной устойчивости к доксорубицину. Эксперимент 4 Методика Оцени вали локальн ую тореми фено вую те рапию 15-летней самки бабуина с самозародившейся не-Ходжкиновой лимфомой Увеличенные лимфатические узлы диаметром 1-2 см были очевидны в обеих паховы х областя х. Торемифен растворяли в смеси диметилсуль фоксида, этанола и метилцеллюлозы. За период в 8 дней всего 1,4 г торемифена применили в основном на правой области опухоли Через 15 дней от начала локальной терапии начали оральную обработку с применением 1 г торемифена на 15, 17, 19 и 23 дни, при общей дозе в 4 г На 25 день после начала обработки еще раз начали локальную терапию правой паховой области, продолжая оральную обработку. За это время всего 1,4 г торемифена применили чрезкожно и 11 г орально. Реакцию на терапию определяли, измеряя размеры опухопей в двух перпендикулярных направлениях. Результаты Реакция на терапию приводится на Чертежах За и 36 Очевидн ую реакцию наблюдали в обработанной правой па ховой лим фоме, тогда как необработанная левая лимфома увеличилась в размерах за время локальной обработки Во время оральной торемифеновой терапии левая паховая лимфома стабилизировалась, тогда как правая паховая лимфома снооа начала расти. Поэтому на этой опухоли была снова начата локальная торемифеновая терапия Аналогично начальной реакции на локальную терапию лимфома уменьшилась с площади опухоли в 476 мм 2 до 24 мм2. Лечение регионарной Т-клеточной лимфомы у самки бабуина показало, что локальный торемифен может давать противоопухолевую реакцию in vivo. Эксперимент 5 Методика Торемифен в виде цитрата торемифена сначала растворяли в ДМСО, после чего добавляли к 3% раствору метилцеллюлозы в этаноле до конечной концентрации 1 мг/мл. Шести Monodelphis domestica мужского пола в течение 5 дней давали торемифен локально Доза составляла 0.5 мг/день у 3 и 1 мг/день - у 3-х животных Торемифен применяли локально к выбритой коже на площади поверхностью 1 см 2 нижней части спины На 5 день животных умерщвляли, и измеряли концентрации торемифена и его метаболитов э плазме, коже, яичках, печени, глазах, мозге и сердце Три клеточные линии меланомы человека (TD 36, TD ЗОА и SK-MEL-31) и три экспериментальные клеточные линии (TD 1,4. ТО 7,2 и TD 8), полученных из вызванного ультра фиолетовым облуче н и е м ме п а но ци ти че ск о го ви р уса у Monodeiphis domestica, выращи вали in vitro для оценки цитостатических значений IC-50 для торемифеча Клеточная линия метастатической меланомы, SK-MEL-31. была получена из коллекции куль тур американско го типа (Rockville , MD ). Две 27461 лено в табл.7. Повышение ингибирующего эффекта торемифена было очень сходным во всех шести пиниях клеток материнских меланоцитов. Интервал для IC-50S составлял 5.8-9,6 цМ дополнительные линии клеток человека были получены из частей удаленной хирургическим путем меланомы большого диаметра, локализованной на поверхности. Из доброкачественной меланомы развивалась линия TD 1 4, в то время как из меланоцитов [иперплазированной ткани были получены пинии TD 7.2 и ТО 8. Величины IC-50 были определены из полулогарифмического графика зависимости процента выживших клеток от концентрации торемифена цитрата. Результаты Средние концентрации торемифена в плазме и ткани у 6 животных, которым временно, в течение 5 дней, назначали его в концентрации 0.5 и 1 мг/день, приведены в табл. 6. Концентрация торемифена в коже была более чем в 500 раз выше, чем в других тканях. 50 % увеличение ингибирующих концентраций торемифена для линий клеток человека и экспериментальных клеток представ Обсуждение. 8 эксперименте нами было показано, что торемифен имеет че ткий цитоста тический эффект в отно шении линий челове чески х и экспериментальных меланомных клеток in vitro . Хотя цитоста тический эффект наблюдался во все х клеточны х линия х концентрации, необходимые для получения это го действия , были о тносительно высокими. Однако, локальное применение торемифена дает концентрации в коже, значительно превышающие эти in vi tro концентрации, наводя на мы сль о том , что я вно е ци то ста ти ческ ое действие можно было бы получи ть на кожной меланоме in vi vo . Таблица 1 Концентрации торемифена после 5 дней внутрибрюшиннои обработки по сравнению с локальной обработкой торемифеном Ткань Внутрибрюш инная Локальная Внутрибрюшинная/Локальная Опухоль (мкг/г) Сыворотка (мкг/мл) Мозг (мкг/г) Матка (мкг/г) Печень (мкг/г) 7,08 (3,55-11,86) 4,37 (0,1 -12.79) 1,85 (1; 17-2.20) 29,97 (26,47-35,90)' 14,25 (11,2-18,60 ) 1087,34 (23.47-1924,77) 1,00 (0,46-1,84) 1,45 (1,29-1,61) 2,94 (2,33-3,53) 4,21 (3,46 - 5.62) 153,58 0,23 0,78 0,10 0,30 Таблица 2 Концентрации N-деметилторемифена после внутрибрюшиннои обработки по сравнению с локальной обработкой Ткань Внутрибрюш инная Локальная Опухоль (мкг/г) Сыворотка (мкг/мл) Мозг (мкг/г) Матка (мкг/г) Печень (мкг/г) 1,27 (0,88-1,74) 0,18 (0,10-0,30) 0,49 (0,26-0,73) 1,18 (1,02-161) 0.94 (0,92-0,98) 8,43 (1.15-13,86) 0,08 (0,06-0,09) 0.2У (0,0-0.49) 0,56 (0,38-0,76) 0,92 (0,80-1,10) 6 Внутрибрюшинная/Локальная 6,64 0,44 0.59 0,47 0,98 27461 Таблица 3 Концентрации транс 4 гидрокситоремифена после внутрибрюшинной обработки по сравнению с локальной обработкой Ткань Внутрибрюшинная Опухоль (мкг/г) Сыворотка (мкг/мл) Мозг (мкг/г) Матка (мкг/г) Печень (мкг/г) 0 88 (0 64-1 06) 0 16 (0 12-0 20) 0 35 (0 22-0 43) 0 83 (0 46-1 05) 0 60 (0,56-0 66) Локальнан/Внутрибрюшинная Локальная 2 33 (0 82-3 26) 0 10 (0 04-0 17) 0 35 (0 31-0 40) 0 70 (0 50-0 80) 0 98 (0 51-143) 2 65 0 63 1 00 0 84 1 63 Таблица 4 Сравнение концентраций торемифена в клетках после воздействия in vitro, внутрибрюшинной инъекции и локального применения Образец Путь применения In vitro (Клеточные гранулы) In vi vo (Опухоль) In vi vo (Опухоль) Концентрация торемифена Непосредственное применение 0.149 мкг/мг Внутрибрюшинная инъекция Локальное применение 0,007 мкг/мг 1,087 мкг/мг Концентрации представляют собой среднее из трех измерений. Таблица 5 Концентрации торемифена после одноразовой дозы внутрибрюшинно по сравнению с торемифеном локальной обработки (500 мкг) в ДМСО или метипцеллюлозе Ткань Внутрибрюшинная (IPJ ДМСО Метилцелпюлоза (МЦ) Опухоль (мкг/г) Сыворотка (мкг/мл) Матка (мкг/г) 2,57 (1,644,46) 0,09 (0,04-0,14) 23,60 (13,5840,17) 4 65 (3,416,96) 0,03 (0,004-0,04) 0,92 (0,661,35) 1,80 (0.953,10) 0,02 (0,00-0,04) 1,10 (0,641.92) ДМСО/ІР МЦ/ГР 1,81 0,70 0.33 0,22 0,04 0,05 27461 Средняя концентрация торемифена в плазме (нмоль/мл) и различных тканях (нмоль/г) после локального применения торемифена в дозе 0,5 и 1 мг/день в течение 5 дней у 6 Monodelphi domestica мужского пола 0,5 мг/день Плазма Кожа Печень Яички Мозг Глаза Сердце 1 мг/день 0 1296,40 ±1003,93 1.07 ±0,69 1.52 ±2,13 0,82 ± 0,99 0 0 Таблица 6 0 1237,35 ±768,90 3.60 ± 2.23 0.52 ± 0,05 0,82 ± 0.62 0.17±0,05 0.21 ±0.16 Таблица 7 Величины Ю-50 человеческих и экспериментальных меланомных клеточных линий для торемифена Клеточная линия Человеческая TD 36 TD3 0 A SDMEL-31 TD 8 TD 1.4 TD7.2 IC-50
ДивитисяДодаткова інформація
Назва патенту англійськоюPreparation containing as active ingredient toremifene, method for the treatment of breast cancer, method for the reversal of multidrug resistance of cancer cells and method for the treatment of melanoma or lymphoma
Автори англійськоюDEGREGORIO MICHAEL WILLIAM, KURKELA KAUKO OIVA ANTERO
Назва патенту російськоюПрепарат, содержащий активно действующий компонент на основе торемифена, способ лечения рака молочной железы, способ изменения многолекарственной устойчмвости клеток и способ лечения меланомы или лимфомы
Автори російськоюДигригорио Майкл Уилльям, Куркела Кауко Ойва Антеро
МПК / Мітки
МПК: A61K 9/06, A61K 9/107, A61K 9/70, A61K 9/08, A61K 31/135
Мітки: стійкості, зміни, залози, меланоми, тореміфену, препарат, активної, молочної, клітин, спосіб, діючий, раку, компонент, багатолікарської, лімфоми, основі, лікування, містить
Код посилання
<a href="https://ua.patents.su/10-27461-preparat-shho-mistit-aktivno-diyuchijj-komponent-na-osnovi-toremifenu-sposib-likuvannya-raku-molochno-zalozi-sposib-zmini-bagatolikarsko-stijjkosti-klitin-ta-sposib-likuvannya-mela.html" target="_blank" rel="follow" title="База патентів України">Препарат, що містить активно діючий компонент на основі тореміфену, спосіб лікування раку молочної залози, спосіб зміни багатолікарської стійкості клітин та спосіб лікування меланоми або лімфоми</a>
Попередній патент: Упаковка для текучих мас
Наступний патент: Пакувальна ємність та заготовка для її виготовлення
Випадковий патент: Лазер з сонячною накачкою