Дикалієва сіль n-сукцин – dl-триптофану, що має антиангінальну та антигіпоксантну дію
Номер патенту: 33865
Опубліковано: 15.02.2001
Автори: Ніженківська Ірина Володимирівна, Ткаченко Олександр Петрович, Гриневич Олександр Йосипович, Горчакова Надія Олександрівна, Чекман Іван Сергійович
Текст
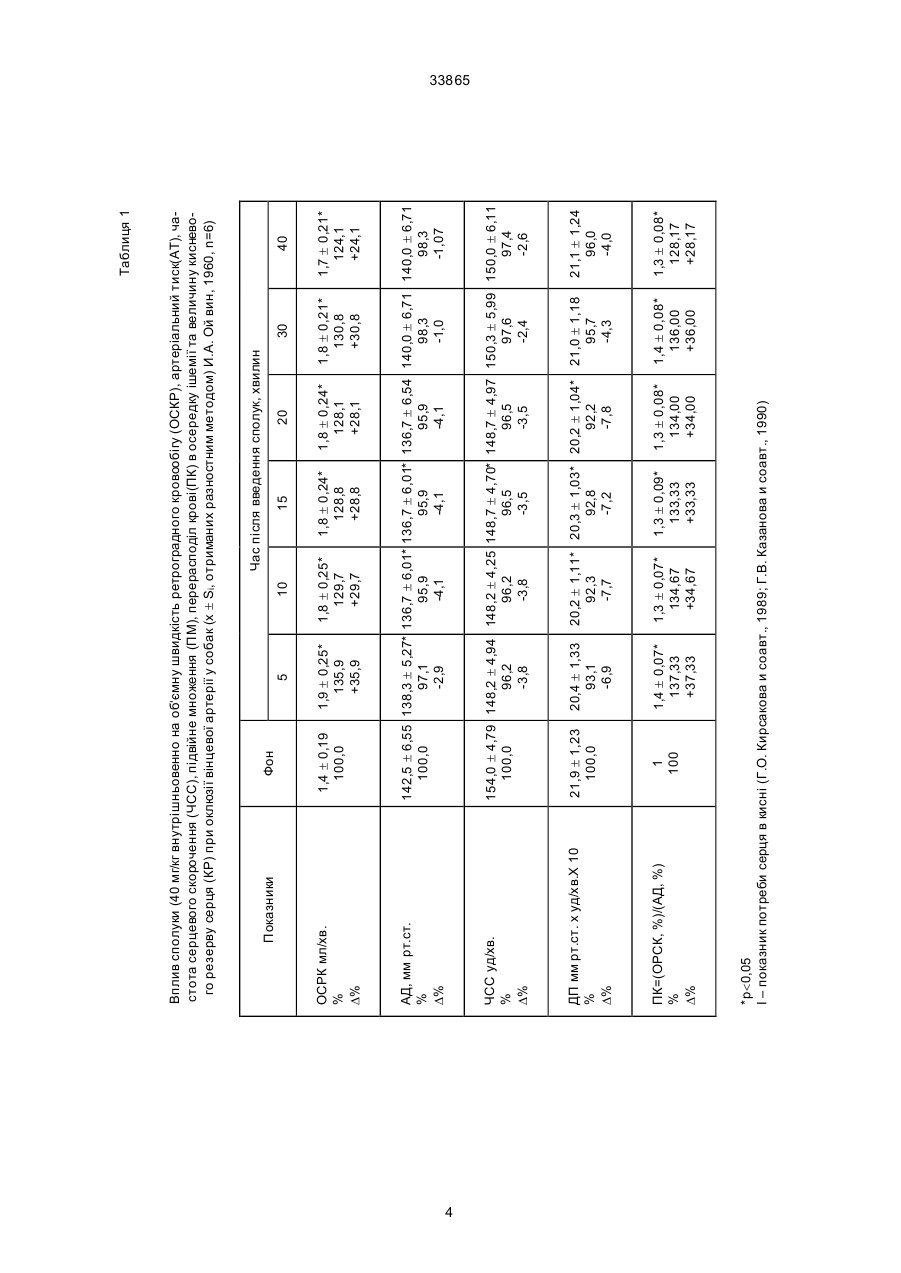
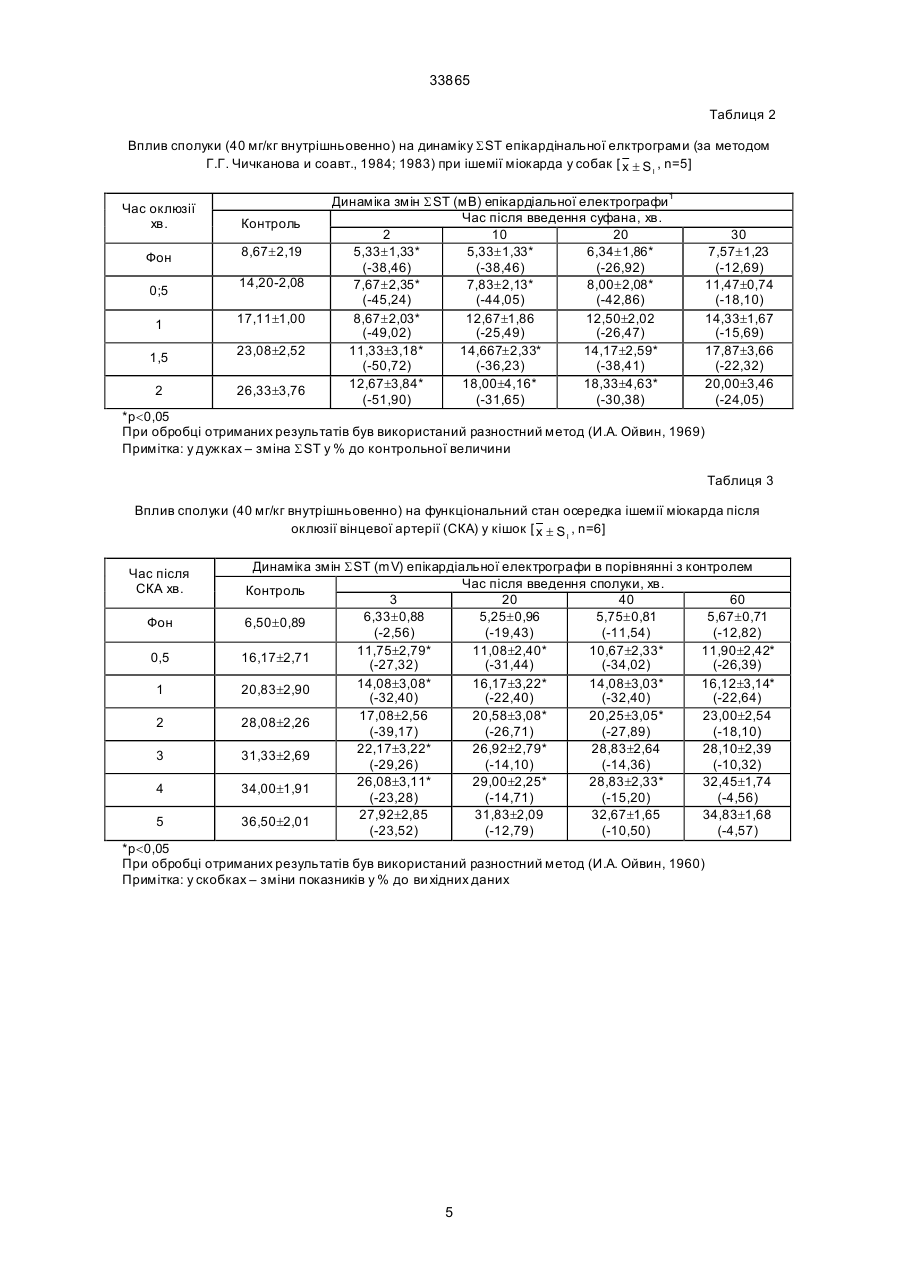
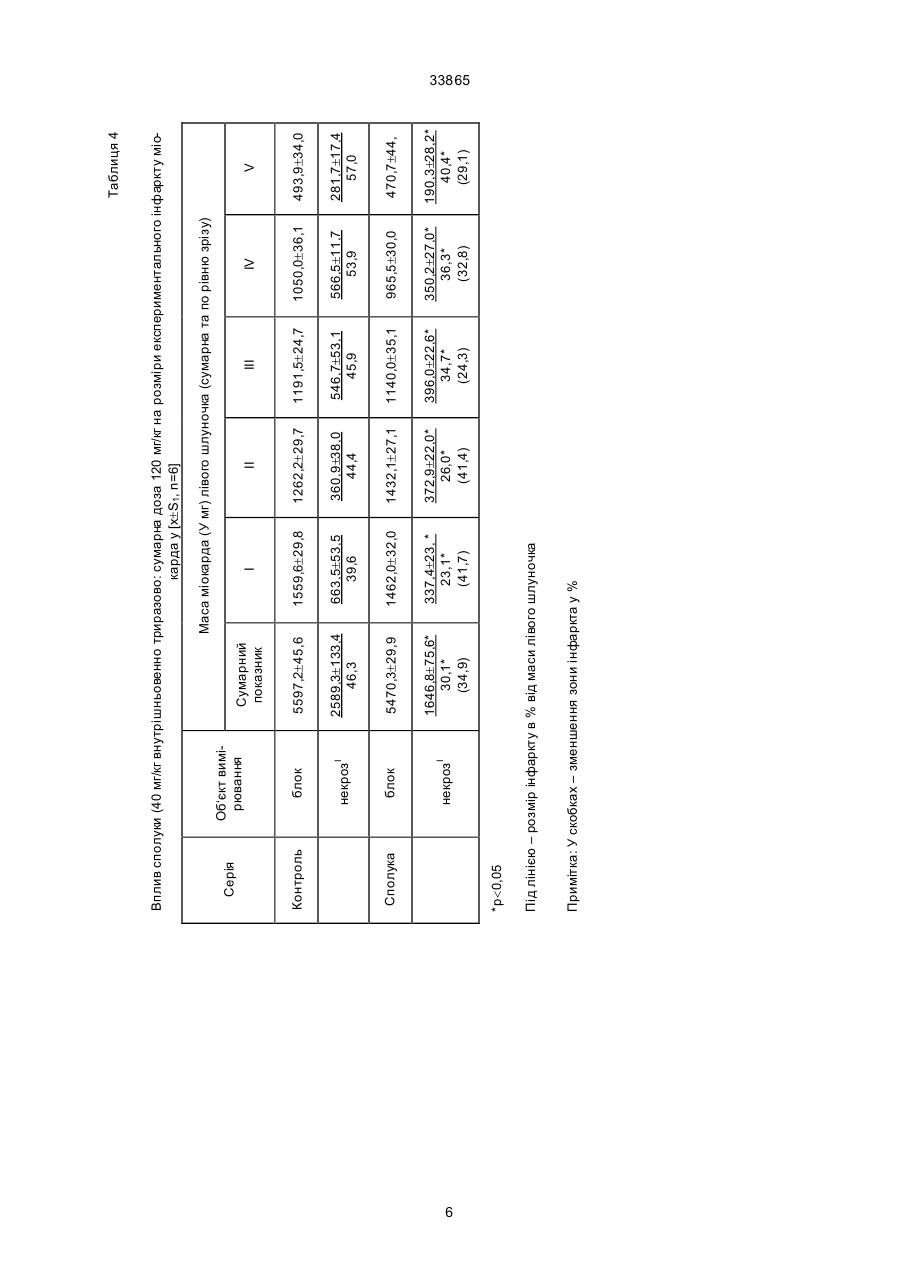
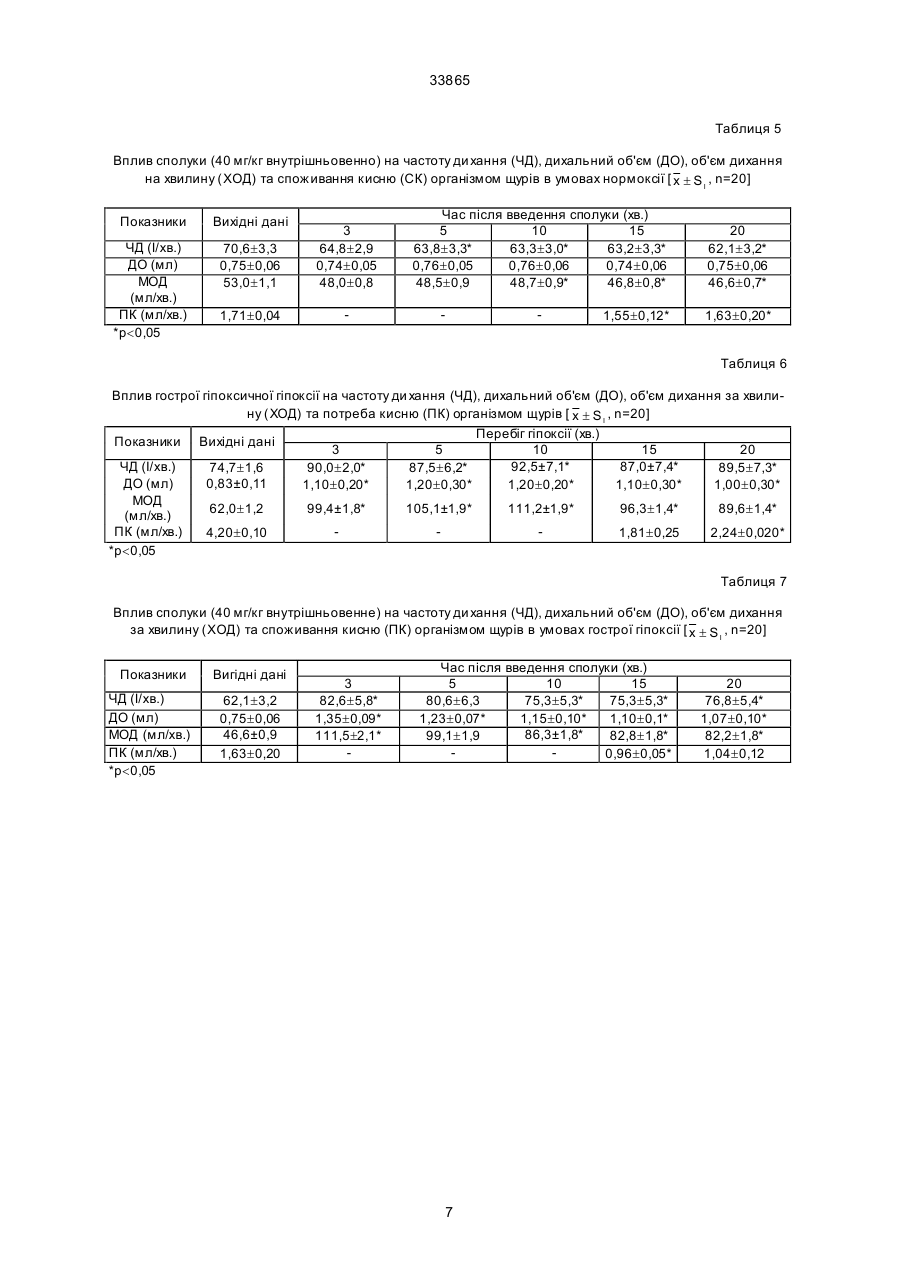
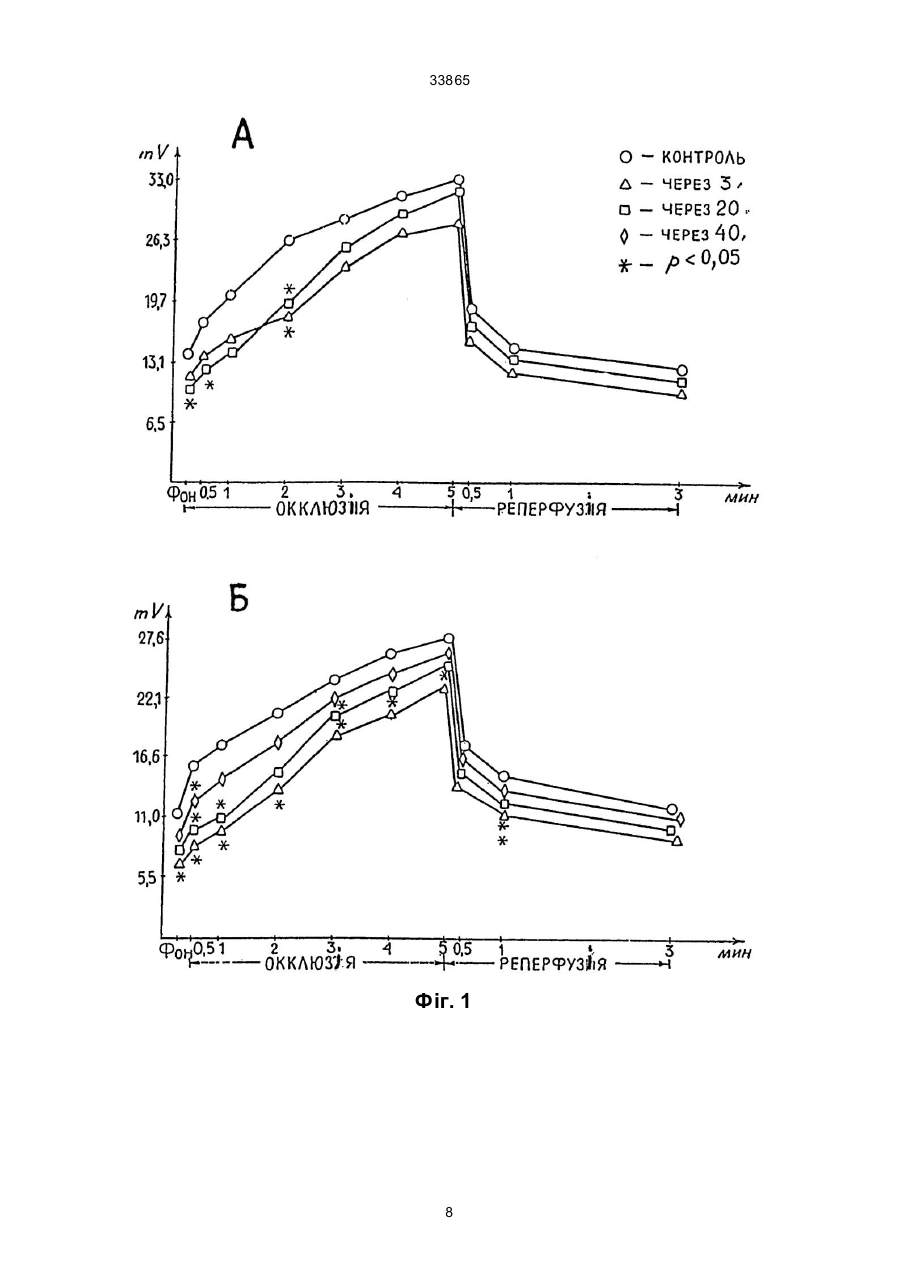
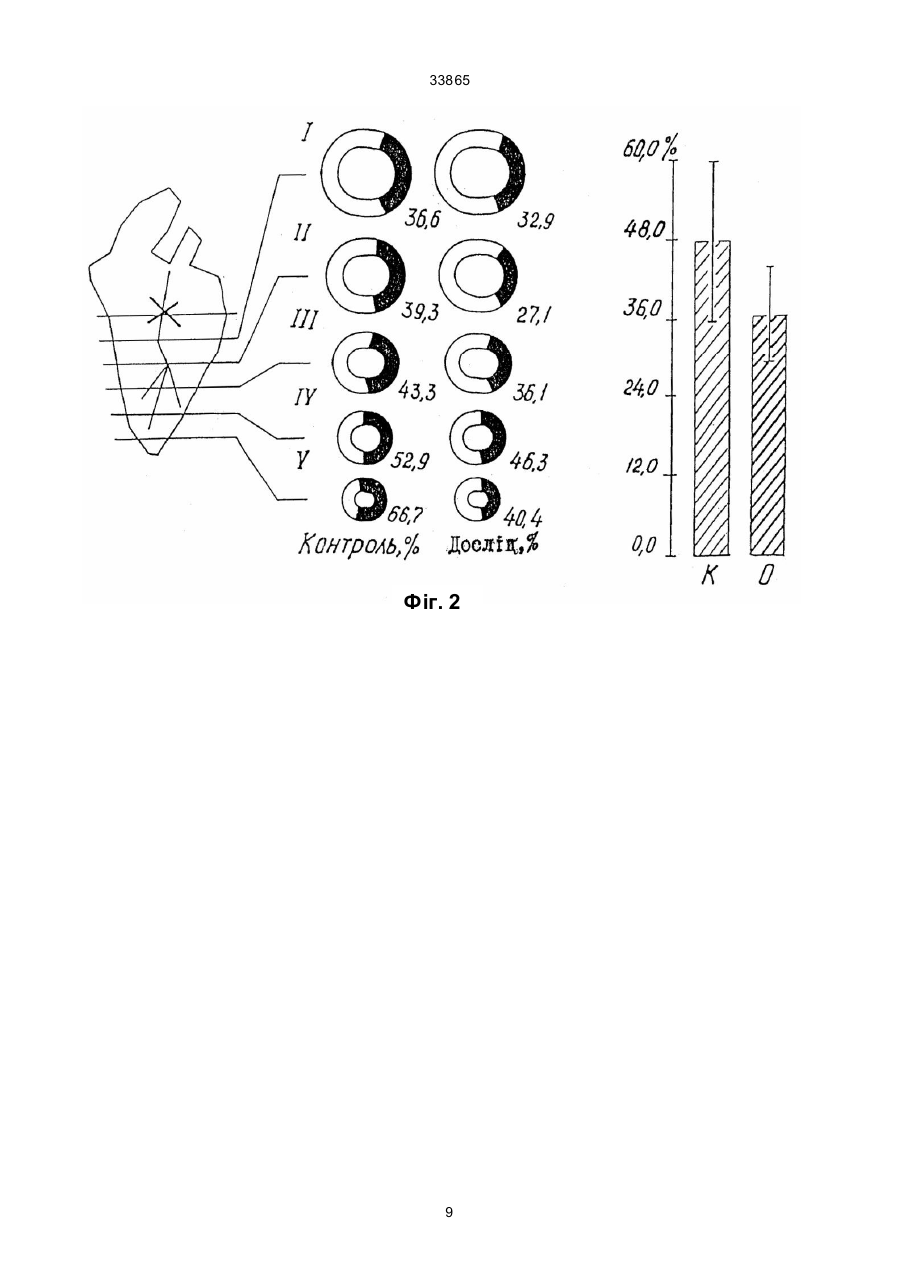
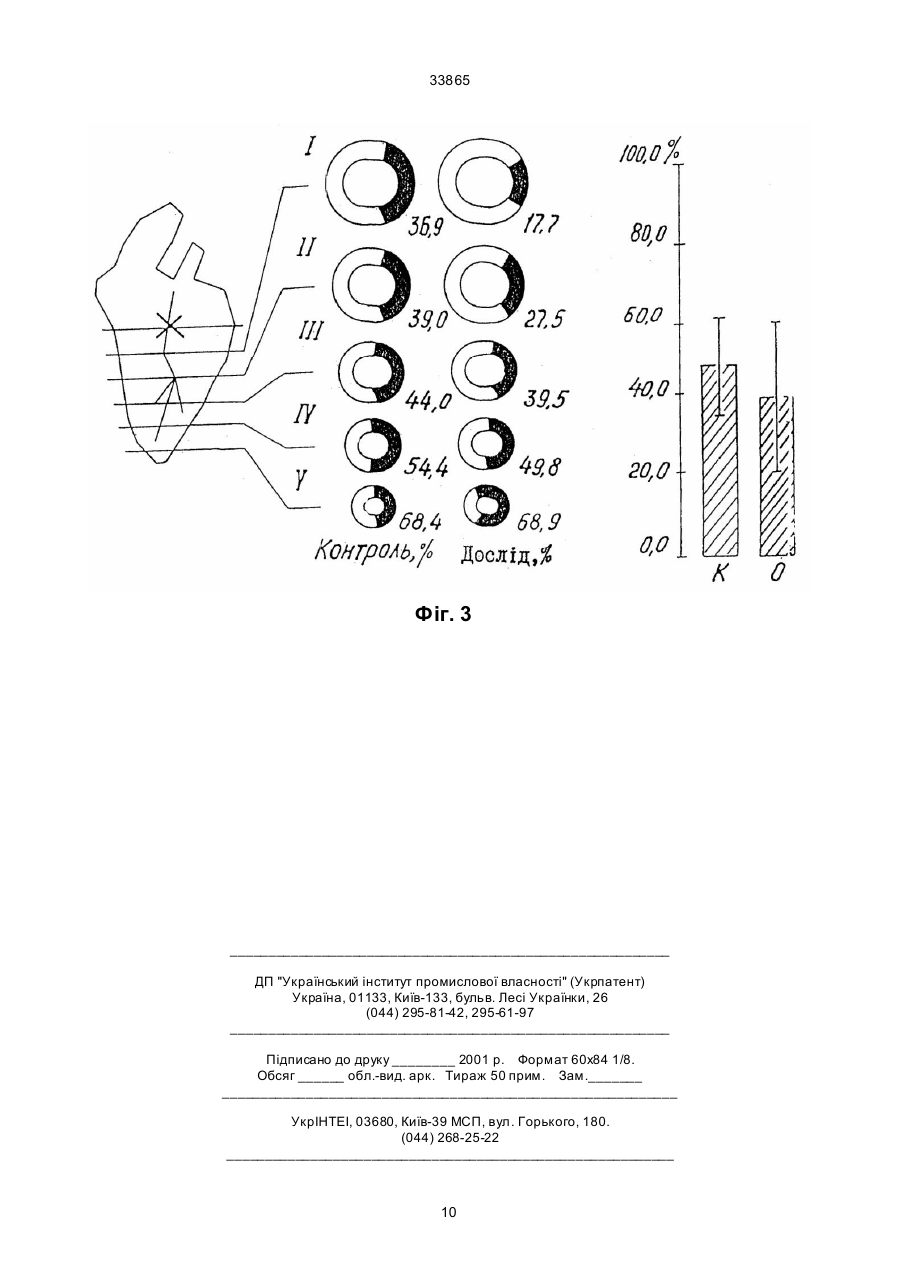
Дикалієва сіль N-сукцин-dL-триптофану формули Винахід належить до нової хімічної сполуки, а саме, дикалієвої солі N-сукцин-dL-триптофану, що має антиангінальні та антигіпоксантні властивості, формули Про здатність сполуки викликати перерозподіл крові в ішемізовану зону міокарда судили за зміною об'ємної швидкості ретроградного кровотока (ОШРК) у дистальному відрізку лігованої передньої низхідної вітки лівої коронарної артерії ]3]. У наркотизованих (етамінал-натрія 40 мг/кг внутрішньоплеврально) собак після переводу їх на кероване дихання проводили резекцію четвертого ребра та розтинали грудну клітину. Під низхідну вітку лівої коронарної артерії в середній її третині підводили лігатур у та здійснювали перев'язку. У дистальний відрізок артерії вводили скляну канюлю, що з'єднувалась з поліхлорвіловим катетером. За 10-15 хвилин після встановлення стабільного ретроградного кровообігу об'ємну швидкість останнього приймали за вихідну. Паралельно реєстрували AT (в сонній артерії) і ЧСС. Експерименти проводили з використанням гепарину 10001500 ОД/кг. Про здатність сполуки викликати перерозподіл кровообігу на користь ішемізованої ділянки судили за коефіцієнтом перерозподілу крові (КПК), який представляє собою відношення ОШРК та AT, виражене в % (В.В. Гацура, Л.А. Бандурина, 1964; А.В. Сапожков, 1965, 1971, 1972; А.С. Саратиков і співавтори, 1980). При цьому показники потреби міокарда в кисні слугувало ДП. Ви ходячи з останнього, розраховували КР міокарда як співвідношення ОШРК до ДП, виражене у %. Експериментальний інфаркт міокарду моделювали у кішок шляхом перев'язки передньої низхідної вітки лівої коронарної артерії на розі верхньої та середньої третини. Вивчення розмірів некрозів міокарду проводили за С.В. Гацурою (1984). (13) A що має антиангінальну та антигіпоксантну дію. 33865 Задача винаходу - пошук нових сполук, що мають покращені антиангінальні та антигіпоксантні властивості. Дикалієва сіль N-сукцин-dL-триптофану (далі в тексті - сполука) представляє собою кремовий, гігроскопічний порошок, добре розчинний в воді та метиловому спирті, погано в етиловому спирті та практично не розчинний у хлороформі. Має слабкий характерний запах. Експериментальне вивчення проводили відповідно до програм доклінічної оцінки антиангінальних та антигіпоксантних властивостей сполук [1, 2]. Дослідження виконані на 114 щура х лінії Вістар, 12 кішках і 11 собаках обох статей вагою 0,200,30, 2,7-4,0 та 10,0-22,0 кг відповідно. Функціональний стан вогнища ішемії (ФСВІ) міокарда досліджували в експериментах на собаках, моделюючи ішемію перетисненням (на 2 хв) передньої низхідної вітки лівої коронарної артерії в середній третині та кішках при ОКА протягом 5 хвилин. Антиангінальну активність оцінювали за депресією (середньої та сумарної величини ) сегменту ST епікардіальної електрокардіограми. CO/CH2/2-COOK (11) H CO/CH2/2-COOK H UA NH N NH N (19) -CH2 -CH-COOK -CH2 -CH-COOK 33865 Вплив на процес споживання кисню міокардом вивчали у дослідах на наркотизованих хлоралозою (50 мг/кг) та уретаном (1 г/кг) внутрішньочеревно щурах, що знаходились в умовах нормоксії та гострої гіпоксичної гіпоксії (6,8% кисню в азоті, експозиція 30 хв). Після декапітації тварин, виділення та подрібнення міокарда на льоді визначали споживання кисню манометричним методом Варбурга, при цьому одну частину манометрів заповнювали повітрям, іншу - гіпоксичною газовою сумішшю (6,8% кисню в азоті). Тканина міокарда знаходилась в фосфатному буфері (рН=7,4). Споживання кисню цілосним організмом щурів, хвилинний об'єм та частоту дихання реєстрували за допомогою спеціальної автоматичної установки для безконтактного визначення параметрів зовнішнього дихання у лабораторних тварин. Вплив на активність дегідрогеназ циклу трикарбонових кислот - сукцинатдегідрогеназу (СДГ) та ізоцитратдегідрогеназу (І ЦДГ) - вивчали за методиками Ф.Є. Путіліної, Н.Д. Єщенко (1969) у модифікації В.П. Терентьєва (1978). Вплив на ультраструктурн у організацію міокарда при гострогіпоксичному впливі, що утворювався за допомогою подачі газової суміші (експозиція 30 хв) , що містить близько 7% кисню в азоті вивчали в дослідах на наркотизованих уретаном (0,5 г/кг) та хлоралозою (50 мг/кг) внутрішньочеревно щурах. Досліджувані речовини вводили внутрішньовенно. Після декапітації тварин забір шматочків міокарду проводили з правого та лівого шлуночків серця з наступною фіксацією їх у глутаральдегіді та чотирьохокису осмію, збезводнюванням у спиртах та заливкою в епон за загальноприйнятою методикою. Ультратонкі зрізи завтовшки 40-60 нм контрастували в уранілацетаті та цитраті свинцю та продивлялись в електронному мікроскопі типу JEM- 100 СХ. Результати дослідження впливу сполуки на колатеральний кровообіг у вогнищі ішемії міокарда у собак подані в табл. 1, з якої видно, що введення сполуки в дозі 40 мг/кг внутрішньовенно призводить до підвищення ОШКР, який у подальшому поступово знижується, залишаючись статистично ймовірно підвищеним протягом 50 хвилин. Такі показники, як AT, ЧСС та ДП знижувались, а КПК підвищувався максимально на 50% до 5-ї хвилини. Таким чином, сполука при внутрішньовенному введенні собакам за умов ішемії міокарда викликає статистично ймовірне підвищення ретроградного кровообігу, зниження потреби серця в кисні, підвищення кисневого резерву міокарду. Результати дослідження впливу (превентивного) сполуки на функціональний стан вогнища ішемії у собак приведено в табл. 2. Дані табл. 2 дозволяють говорити про те, що суфан збільшує толерантність міокарду до ішемії, знижуючи середню та сумарну величину сегменту ST при тимчасовій оклюзії вінцевої артерії. За умов гострої ішемії міокарда, що викликана оклюзією (на 5 хв) вінцевої артерії у кішок, попереднє введення сполуки призводило до депресії сумарної величини сегменту ST епікардіальної електрокардіограми (табл. 3). Тривалість дії становила 60 хвилин. Максимальне зниження ∑ST за 20, 40 та 60 хвилин після введення відмічалося на 30-й секунді оклюзії. Отримані результати дозво ляють говорити про те, що сполука покращує функціональний стан вогнища ішемії в кішок при тимчасовій оклюзії вінцевої артерії. Проведені дослідження впливу сполуки на розміри експериментальних некрозів міокарду при триразовому внутрішньочеревному введенні кішкам у дозі 340 мг/кг (сумарна доза 120 мг/кг) показали (табл. 4), що сполука зменшує зону інфаркту міокарду. Антинекротична активність сполуки в найбільшому ступені проявилась на І та II рівнях зрізів лівого шлуночка, далі - на ІV, V, III рівнях. Як видно з наведених даних, сполука виявляє здатність помірно зменшува ти розміри зони інфаркту міокарду при оклюзії передньої низхідної вітки лівої вінцевої артерії. В результаті проведених досліджень встановлено, що у наркотизованих щурів в умовах гострої гіпоксичної гіпоксії, активність ізоцитратдегідрогенази (І ЦДГ) та сукцинатдегідрогенази (СДГ) знижуються. Введення сполуки за тих же умов призводить до відновлення активності І ЦДГ та до ще більшого зниження СДГ. Таким чином, сполука в умовах гострої гіпоксичної гіпоксії викликає підвищення активності І ЦДГ та зниження СДГ. Введення сполуки (40 мг/кг внутрішньовенно) щурам в умовах нормоксії призводило до статистично ймовірного зменшення вентиляції легень, що виражалося в зниженні (на 9,4%) хвилинного об'єму дихання (ХОД) на 3-й хвилині після введення. Такий рівень легеневої вентиляції утримувався протягом всього наступного періоду спостереження (30 хв), коливаючись у межах 88-92% вихідного рівня ХОД. Описані зміни рівня вентиляції легень в умовах нормоксії під впливом сполуки були викликані зменшенням частоти дихальних рухів (ЧД), виражених в тій же мірі, як і зниження ХОД. Інший компонент показника ХОД, що має значно більше значення для ефективного здійснення процесу оксигенації крові в легенях - дихальний об'єм (ДО), не змінювався під впливом сполуки. Дуже важливим є також і той факт, що сполука не впливає на енергетичний обмін цілосного організму в умовах нормоксії, про що свідчить відсутність змін інтегрального показника енергетичного метаболізму - споживання кисню (СК). Як видно з табл. 5, величини споживання кисню зареєстровані на 15-й та 20-й хвилинах після введення сполуки практично не відрізняються від вихідного рівня цього показника. Все вищезазначене дозволяє зробити висновок, що в умовах нормоксії сполука не має впливу на здійснення газообмінної функції легень (про що можна судити з відсутності змін ДО та СК) та призводить до незначного зниження величин показників, які характеризують вентиляційну функцію легень (ЧД та ХОД) у наркотизованих тварин. До речі, на користь відсутності впливу сполуки на газообмінну функцію легень (та, відповідно, на ефективність оксигенації крові в легенях) свідчить і відсутність змін з боку ще одного важливого показника - коефіцієнта використання кисню (КВК) з легень, який розраховується з величин СК та ХОД за Хербстом. Так, якщо в вихідному стані він дорівнював 34,2 мл кисню, який був використаний (що перейшов з повітря в кров) з кожного 1 літра повітря, що вентилюється в легенях, то на 15-й хвилині 2 33865 після введення сполуки КВК становив 33,1 мл/л, а на 20-й - 35,0 мл/л, тобто практично не змінювався протягом вивчаємого періоду. Перевід тварин в умови токсичної гіпоксії (подача для дихання замість звичайного атмосферного повітря, що містить 21% кисню, газової токсичної суміші, що містить близько 7% кисню в азоті), призводив, як це характерно для реакції організму на зменшення концентрації кисню в повітрі, що вдихається, до підсилення вентиляції легень як у контрольній, так і в дослідній групах тварин (табл. 6). Характерно, що зростання легеневої вентиляції було обумовлене як прискоренням дихання, так і збільшенням дихального об'єму. Однак, якщо у контрольних тварин підвищення ХОД доходило до 60-90% вище ви хідного рівня в різні моменти гіпоксичної гіпоксії, то у щурів, що отримували сполуку, зростання ХОД було виявлено в більшій мірі, доходячи до 80-140% (табл. 7). Слід підкреслити, що у тварин дослідної групи таке підсилення вентиляції легень було обумовлене більш виразним збільшенням ДО (на 40-80% вище вихідного рівня при перевищенні ДО у контрольних тварин на 20-45%), ніж частоти дихальних рухів (ЧД зростала на 20-35% в дослідній групі і на 15-25% в контрольній). Такий характер змін вентиляції легень до нестачі кисню під впливом сполуки можна розцінювати як явне покращення в забезпеченні організму киснем при дефіциті останнього у вдихаємому повітрі. На підтвердження останнього положення можна навести дані по зміні СК організмом щурів в умовах такої різкої гіпоксичної гіпоксії, яка виникає при диханні газової суміші з 7% кисню. Так, якщо у контрольних тварин цей показник значно знижений при гіпоксії (див. табл. 6) становив 43% (на 15-й хв) та 53 % (на 20-й хв) вихідного рівня, то у щурів, яким попередньо була введена сполука (див. табл. 7), СК становило 59% (на 15-й хв) та 64% (на 20-й хв) від вихідного рівня, тобто було помітно вищим, ніж у контрольних тварин. Таким чином, аналізуючи результат даної серії досліджень, можна зробити висновок про те, що введена сполука позитивно впливає на характер змін вентиляторної та, особливо, газообмінної функції легень при гострій та різкій гіпоксичній гіпоксії, що утворюється переводом тварин на дихання газовою сумішшю, що містить близько 7% кисню в азоті. Ці дані можуть свідчити про наявність виразливого антигіпоксичного ефекту у досліджуваної сполуки. При вивченні впливу сполуки на ультрабудову кардіоміоцитів виявлено, що гострогіпоксична дія на міокард проявляється в порушенні будови гепатопаренхіматозного бар'єру (ІПБ). Характерним є підсилення мікропіноцитозу в ендотеліальних клітинах, набряк ендотелію капілярів, розширення субендотеліальних просторів, наявність ділянок з виразливою диструкцією бар'єру, що пояснюється графічно. На фіг. 1 представлений вплив перлинганіту (А) та фіноптіну (Б) на динаміку зростання сегпента Т-епікардіальної електрограми у кішок, де O контроль, D - через 3 хв, - через 20 хв, à - через 40 хв, х - р 0,05. На фіг. 2 показаний вплив перлінганіту на розмір експериментального інфаркту міокарда у кішок, де наведена схема, яка ілюструє рівень перев’язки (злива направо) низхідної гілки лівої вінцевої артерії та умовні рівні (І-V) зрізів, величина розмірів інфаркту міокарда в контрольній та дослідній серіях, як виражена у процентах від загальної площини зрізу; стовпчиками представлена величина експериментального некрозу в процентах до загальної маси лівого шлуночка контрольної та дослідної груп. Різкі зміни відмічаються з боку мітохондріального апарату міоцитів, що проявляються вакудізацією мітохондрій, їхнім набуханням з просвітленням матриксу, деструкцією крист (фіг. 1 та 2). Зазначенні ушкодження притаманні для патологічних змін міокарда, а саме, виразливій гіпоксичній дії. Превентивне введення сполуки (40 мг/кг внутрішньовенно) щурам призводить до практично повної нормалізації ультрабудови ІПБ - відсутня деструкція і вакулізація ,спостерігаються лише окремі ділянки набряку ендотелію капілярів. На фіг. 3 показаний вплив фіноптину на розміри експериментального некрозу міокарда у кішок. Позначення ті самі, що на фіг. 2 Можна припустити, що на етапі дифузії (транспорту) кисню з крові до місця його утилізації (кардіоміоцити), сполука здатна усувати порушення, що мають місце при виразливій гіпоксії. В мітохондріальному апараті клітин суттєвим є повне усунення вакуолізації та набухання вивчаємих органел. Значна кількість мітохондрій набула під впливом сполуки будову, характерну для нативного стану - регулярні кристи, світлий матрикс (фіг. 3). Однак слід відзначити, що в ци х умовах з'являється значна кількість мітохондрій, у яких практично повністю відсутні кристи, вміст їх набуває вигляд слабко структурованої відносно оптично цільної маси. Подібна ультрабудова характерна, як правило, або для "юних" мітохондрій, або для тих, що перебувають в неактивному стані. Можна припустити, що оскільки в цьому стані мітохондрій відбувається зниження потреби в находженні кисню для нормальної життєдіяльності клітин, подібні зміни, що відбуваються мітохондріальному апараті міоцитів під впливом сполуки, сприяють зниженню споживання кисню міокардом в гіпоксичних умовах та тим самим відіграють захисну роль. Таким чином, сполука при гострогіпоксичному впливі здатна виразливо нормалізувати ультраструктурну організацію гепатопаренхіматозного бартеру та мітохондріальний апарат кардіоміоцитів. Джерела інформації. 1. Беленький М.Л. Элементы количественной оценки фармакологического эффекта. - Л.,1963. 151 с. 2. Беллман Р. Математические методы в медицине. - М.: Мир, 1987. - 200 с. 3. Гацура В.В.,Бандурина Л. А. К методике анализа действия фармакологических средств на коллатеральное кровообращение в миокарде. // Фармакол. и токсикол. - 1984. - Т. 27. - № 1. - С. 100-104. 3 1,8 ± 0,21* 130,8 +30,8 30 1,7 ± 0,21* 124,1 +24,1 40 4 1 100 1,3 ± 0,09* 133,33 +33,33 1,3 ± 0,08* 134,00 +34,00 1,3 ± 0,07* 134,67 +34,67 1,4 ± 0,07* 137,33 +37,33 *р
ДивитисяДодаткова інформація
Автори англійськоюChekman Ivan Serhiiovych, Hrynevych Oleksandr Yosypovych, Horchakova Nadiia Oleksandrivna, Nizhenkivska Iryna Volodymyrivna, Tkachenko Oleksandr Petrovych
Автори російськоюЧекман Иван Сергеевич, Гриневич Александр Иосифович, Горчакова Надежда Александровна, Ниженкивская Ирина Владимировна, Ткаченко Александр Петрович
МПК / Мітки
МПК: C07C 209/20, A61K 31/405, A61P 9/02
Мітки: антигіпоксантну, антиангінальну, n-сукцин, сіль, має, дикалієва, dl-триптофану, дію
Код посилання
<a href="https://ua.patents.su/10-33865-dikaliehva-sil-n-sukcin-dl-triptofanu-shho-maeh-antianginalnu-ta-antigipoksantnu-diyu.html" target="_blank" rel="follow" title="База патентів України">Дикалієва сіль n-сукцин – dl-триптофану, що має антиангінальну та антигіпоксантну дію</a>
Попередній патент: Спосіб виробництва фруктової пасти
Наступний патент: Спосіб оцінки ефективності лікування урогенітального хламідіозу
Випадковий патент: Пресерви з оселедця у гірчично-медовому соусі