Похідні n4-оксикарбоніл-5′-дезокси-5-фторцитидину та фармацевтичний препарат на їх основі
Номер патенту: 39158
Опубліковано: 15.06.2001
Автори: Ісао Умеда, Хідео Ішітсука, Нобуо Шимма, Ісамі Курума, Мотохіро Арасакі, Масанорі Міуа, Чикако Мурасакі
Формула / Реферат
1. Производные N4-оксикарбонил замещенного 5'-дезокси-5-фторцитидина общей формулы (I):
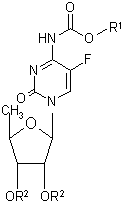 , (I)
, (I)
в которых R1 представляет собой n-пропил, n-бутил, n-пентил,
изопентил, неопентил, 3,3-диметилбутил, n-гексил, 2-этилбутил, фенилэтил и циклогексилметил,
R2 представляет собой атом водорода или радикал, который способен легко гидролизоваться в физиологических условиях, а также гидраты и сольваты соединений по общей формуле (I).
2. Соединение по п. 1, отличающееся тем, что представляет собой N4-(бутоксикарбонил)-5'-дезокси-5-фторцитидин.
3. Соединение по п. 1, отличающееся тем, что представляет собой 5'-дезокси-5-фтор-N4-(пентилоксикарбонил)цитидин.
4. Соединения по п. 1, отличающиеся тем, что выбраны из группы, включающей:
5'-дезокси-5-фтор-N4-(пропоксикарбонил)цитидин,
5'-дезокси-5-фтор-N4-(гексилоксикарбонил)цитидин,
5'-дезокси-5-фтор-N4-(изопентилоксикарбонил)цитидин,
5'-дезокси-5-фтор-N4-(неопентилоксикарбонил)цитидин,
5'-дезокси-N4-[(3,3 -диметилбутокси)карбонил)]-5-фторцитидин,
5'-дезокси-N4-[(2-этилбутокси)карбонил)]-5-фторцитидин,
N4- [(циклогексилметокси)карбонил)]-5'-дезокси-5-фторцитидин,
5'-дезокси-5-фтор-N4-[(2-фенилэтокси)карбонил)]цитидин,
2',3'-ди-О-ацетил-5'-дезокси-5-фтор-N4-(пропоксикарбонил)цитидин,
2',3'-ди-О-ацетил-N4-(бутоксикарбонил)-5'-дезокси-5-фторцитидин,
2',3'-ди-О-бензоил-N4-(бутоксикарбонил)-5'-дезокси-5-фторцитидин,
2',3'-ди-О-ацетил-5'-дезокси-5-фтор-N4-(пентилоксикарбонил)цитидин,
2',3'-ди-О-ацетил-5'-дезокси-5-фтор-N4-(изопентилоксикарбонил)цитидин,
2',3'-ди-О-ацетил-5'-дезокси-5-фтор-N4-(гексилоксикарбонил)цитидин,
2',3'-ди-О-ацетил-5'-дезокси-N4-[(2-этилбутил)оксикарбонил)]-5-фторцитидин,
2',3'-ди-О-ацетил-N4-[(циклогексилметокси)карбонил)]-5'-дезокси-5-фторцитидин,
2',3'-ди-О-ацетил-5'-дезокси-5-фтор-N4-[(2-фенилетокси)карбонил]цитидин.
5. Соединения по любому из пп. 1, 2, 3 или 4, обладающие противоопухолевой активностью.
6. Фармацевтический препарат, обладающий противоопухолевой активностью, содержащий активный компонент и фармацевтически приемлемый носитель, отличающийся тем, что в качестве активного компонента он содержит производные N4-оксикарбонил замещенного 5'-дезокси-5-фторцитидина формулы (I) по п. 1.
Текст
1. Производные N4-оксикарбонил замещенного 5'-дезокси-5-фторцитидина общей формулы (I): C2 (54) ПОХІДНІ N4-ОКСИКАРБОНІЛ-5'-ДЕЗОКСИ-5-ФТОРЦИТИДИНУ ТА ФАРМАЦЕВТИЧНИЙ ПРЕПАРАТ НА ЇХ ОСНОВІ 39158 Настоящее изобретение относится к производным N4-оксикарбонил замещенного 5'-деокси5-фторцитидина, а также фармацевтическим композициям, содержащим указанные выше производные, для лечения опухолевых новообразований. Более конкретно настоящее изобретение относится к производным N4-оксикарбонил замещенного 5'-деокси-5-фторцитидина, представленного общей формулой (I), признаки, в сравнении с другими соединениями, которые подвергаются испытаниям. Дальнейшие исследования, основанные на упомянутых выше данных, дали возможность изобретателям настоящего изобретения установить, что специфические производные N4-оксикарбонил замещенного 5'деокси-5-фторцитидина (далее по тексту N4 – оксикарбонил замещенного 5'-ДФУР), представленные в упомянутой выше общей формуле (I), имеют селективно улучшенные фармакокинетические признаки у обезьян, viz. в 4–7 раз выше максимальной концентрации (Смакс) 5'-ДФУР и в 4 раза обширнее более высокой зоны под кривой (AUS) 5'-ДФУР в крови, чем другие соединения, кроме того, они имеют меньшую кишечную токсичность. Термин "радикал, легко гидролизующийся при физиологических условиях", предпочтительно, обозначает ацетил, пропионил, бензоил, толуоил, b-аланил, валил и тому подобные вещества. Предпочтительными N4-оксикарбонил замещенными -5'-DFCRами по настоящему изобретению являются: 5'-деокси-5-фтор-N4-(пропоксикарбонил)цитидин, 5'-деокси-N4-[(3,3-диметилбутокси)карбонил)]-5-фторцитидин, N4-(бутоксикарбонил)-5'-деокси-5-фторцитидин, 5'-деокси-5-фтор-N 4 -(пентилоксикарбонил)цитидин, 5'-деокси-5-фтор-N 4 -(гексилоксикарбонил)цитидин, 5'-деокси-5-фтор-N 4 -(изопентилоксикарбонил)цитидин, 5'-деокси-5-фтор-N 4 -(неопентилоксикарбонил)цитидин, 5'-деокси-N 4 -[ (3,3-диметилбутокси)к арбонил)]-5-фторцитидин, 5'-деокси-N4-[(2-диэтилбутокси)карбонил)]-5фторцитидин, N4-[(циклогексилметокси)карбонил)]-5'-деокси-5-фторцитидин, 5'-деокси-5-фтор-N4-[(2-фенилетокси)карбонил)]цитидин, 2',3'-ди-О-ацетил-5'-деокси-5-Фтор-N4-(пропоксикарбонил)цитидин, 2',3'-ди-О-ацетил-N4-(бутоксикарбонил)-5'деокси-5-фторцитидин, 2',3'-ди-О-бензоил-N4-(бутоксикарбонил)-5'деокси-5-фторцитидин, 2',3'-ди-О-ацетил-5'-деокси-5-фтор-N4-(пентилоксикарбонил)цитидин, 2',3'-ди-О-ацетил-5'-деокси-5-фтор-N4-(изопентилоксикарбонил) цитидин, 2',3'-ди-О-ацетил-5'-деокси-5-фтор-N4-(гексилоксикарбонил) цитидин, 2',3'-ди-О-ацетил-5'-деокси-N4-[(2-этилбутил)оксикарбонил)]- 5-фторцитидин, 2',3'-ди-О-ацетил-N4-[(циклогексилметокси)карбонил)]-5'-деокси-5- фторцитидин, 2',3'-ди-О-ацетил-5'-деокси-5-фтор-N4-[(2фенилетокси)карбонил] цитидин, а также их гидраты или сольваты и им подобные. Среди упомянутых выше соединений особо предпочтительными N4-(замещенными-оксикарбонил)-5'-ДФЦТами по настоящем изобретению являются: (I) в котором R1 представляет собой n-пропил, n-бутил, n-пентил, изопентил, неопентил, 3, 3-диметилбутил, n-гексил, 2-этилбутил, фенилэтил и циклогексилметил; R2 представляет собой атом водорода или радикал, который способен легко гидролизоваться в физиологических условиях, а также гидраты и сольваты соединений по общей формуле (I) и фармацевтической композиции, содержащей упомянутое выше, с прекрасными фармакокинетическими показателями, для лечения опухолевых новообразований с высокой степенью надежности. Известно, что многие предшественники 5фтороурацила (5-ФУ) используются в качестве противоопухолевых средств, но, как правило, эффективность их биоконверсии недостаточна для лечения больных, страдающих от опухолевых новообразований. Кроме того, они вызывают кишечные интоксикации, а также интоксикации, подавляющие иммунную систему, которые являются интоксикациями, ограничивающими их дозировку. Патент США 4966891 раскрывает предшественников 5-ФУ, которые усовершенствованы в отношении упомянутых выше аспектов токсичности и эффективности биоконверсии. Они превращаются в 5'-деокси-5-фторцитидин (5'-ДФЦТ) с помощью ациломидаз в 5'-деокси-5-фтороридин (5'ДФУР) с помощью цитидин диаминазы, а затем в 5-ФУ с помощью пиримидин нуклеотидной фосфорилазы, которая, предпочтительно, локализуется в печени, тонкой кишке и тканях опухоли. При интенсивных исследованиях фармакокинетических признаков предшественников 5-ФУ, в частности, производных N4-оксикарбонил замещенного 5'деокси-5-фторцитидина, изобретатели пришли к заключению, что определенные специфические предшественники выборочно конвертируются в 5'ДФУР с помощью изоэнзима ациламидазы, который, предпочтительно, локализуется только в печени, а не в каких-либо иных органах человека, демонстрирует улучшенные фармакокинетические 2 39158 5'-деокси-5-фтор-N4-(пропоксикарбонил)цитидин, 5'-деокси-5-фтор-N4-(изопентилоксикарбонил)цитидин, 5'-д еок си-5- фтор-N 4 -(гексилоксикарбонил)цитидин, 5'-деокси-N4-[(2-этилбутил)оксикарбонил)]-5флуороцитидин, 5'-деокси-5-фтор-N4-(неопентилоксикарбонил)цитидин, 5'-деокси-N4-[(3,3-диметилбутокси)карбонил)]-5-фторцитидин, 5'-деокси-5-фтор-N4-[(2-фенилетокси)карбонил)]цитидин, N4-[(циклогексилметокси)карбонил)]-5'-деокси-5-фторцитидин, особенно. N4-(замещенный оксикарбонил)-5'-ДФЦТ общей формулы (I), а также их гидраты или сольваты могут быть получены реакцией соединения общей формулы (II): Соединения вышеприведенной формулы (I) могут существовать как в несольватированном, так и в сольватированном виде, в том числе в гидратированной форме. Гидратация может быть осуществлена в ходе процесса приготовления или же может произойти постепенно вследствие гигроскопических свойств первоначально безводного продукта. Сольваты с фармацевтически приемлемыми растворителями, такими как этанол, могут быть получены, например, в ходе кристаллизации. Производные N4-(замещенный оксикарбонил)-5'-ДФЦТ общей формулы (I), также как сольваты или гидраты соединений общей формулы (I), полученные способом изобретения, проявляют активность по отношению к ксенотрансплантантам рака ободочной кишки человека СХF280 и рака желудка GXF97, карциномы 26 ободочной кишки мышей, легочной карциномы Льюиса мышей и т.п. на мышах в очень широком интервале дозировок, как перорально, так и парентерально, вследствие чего применимы в качестве противоопухолевых средств. Под действием изофермента ациламидазы эти соединения успешно превращаются в 5'ДФЦТ, под действием цитидиндезаминазы, в 5'ДФУР и затем под действием пиридиннуклеозидной фосфорилазы превращаются в активный метаболит 5-ФУ. Настоящее изобретение, кроме того, относится к фармацевтическим препаратам, в частности препаратам для лечения опухолей, содержащим соединения вышеприведенной общей формулы (I). N4-(замещенный оксикарбонил)-5'-ДФЦТ настоящего изобретения могут быть введены пероральным путем или непероральным путем человеку различными обычными методами введения. Кроме того, N4-(замещенный оксикарбонил)-5'ДФЦТ настоящего изобретения используют в чистом виде или вводят в состав с совместимыми фармацевтическими носителями. Такой носитель может представлять собой органический или неорганический инертный материал, пригодный для энтерального, чрескожного или парентерального введения, такой как: вода, желатин, гумиарабик, лактоза, крахмал, стеарат магния, тальк, растительные масла, полиалкиленгликоли или петролатум. Фармацевтический препарат может быть приготовлен в твердом виде (напр.: в таблетках, драже, таблетках с желатиновым покрытием, гранул, свеч, капсул или желудочных капсул), в полужидком виде (напр., в виде мазей) или в жидкой форме (напр., в виде растворов, суспензий или эмульсий). Фармацевтический препарат может быть стерилизован и/или может содержать дополнительные вспомогательные добавки, такие как: стабилизаторы, консерванты, осадители, эмульгаторы, улучшающие вкус добавки, соли для изменения осмотического давления или действующие в качестве буфера вещества. Фармацевтический препарат может быть получен обычным путем. (II) в которой R4 представляет радикал для защиты гидроксигруппы, такой как: ацетил, бензоил, триметилсилил, трет-бутилдиметилсилил и т.п., с соединением общей формулы (III): R1OCOCl (III) 1 в которой R принимает вышеуказанные значения, с последующим, если необходимо, удалением защитного радикала. Соединения вышеприведенной общей формулы (II) могут быть получены 2',3'-ди-О-ацилированием или -силилированием 5'-дезокси-5- фторцитидина [J. Med. Chem.,22, 1330 (1979)] по методике, приведенной в патенте США 4966891 или прямым соединением 5-фторцитозина с 1,2,3-триО-ацетил-5-дезоксифуранозой по методике, аналогичной методике, приведенной в литературе [Synthesis, 748 (1981)]. Реакция соединения вышеприведенной общей формулы (II) с соединением вышеприведенной общей формулы (III) может быть проведена в растворителе, таком как: пиридин, диоксан, тетрагидрофуран, ацетонитрил, хлороформ, дихлорметан и т.п. в присутствии акцептора кислоты, такого как: триэтиламин, пиридин, пиколин, 4-(N,N-диметиламино)пиридин, лутидин и т.п. Реакция может быть проведена в температурном интервале 0– 30оС. Защитный радикал может быть, если необходимо, удален по окончании реакции по известным специалисту методикам /Защитные группы в органическом синтезе. Джон Вили и сыновья. НьюЙорк, Can. J. Chem., 49, 493 (1971) и патент США 4966891/, напр., щелочным или кислотным гидролизом. N4-(замещенный оксикарбонил)-5'-ДФЦТ настоящего изобретения могут быть использованы по отдельности или в виде смеси двух или более различных N4-(замещенный оксикарбонил)-5'ДФЦТ, при этом количество N4-(замещенный оксикарбонил)-5'-ДФЦТ составляет 0,1–99,5%, пред 3 39158 почтительно 0,5–95% в пересчете на массу фармацевтического препарата. Фармацевтический препарат настоящего изобретения может быть приготовлен в сочетании с другими обычными противоопухолевыми средствами. Подверженность действию ациламидазы N4(замещенный оксикарбонил)-5'-ДФЦТ настоящего изобретения и их фармакокинетические показатели приведены ниже. 1. Подверженность действию ациламидаз обезьяны и человека N4-(замещенный оксикарбонил)-5'-ДФЦТ настоящего изобретения инкубируют 60 мин при 37оС с сырыми экстрактами печени обезьяны и человека в присутствии в качестве ингибитора цитидиндезаминазы тетрагидроуридина (0,4 Мм). Затем с помощью ВЭЖХ выделяют 5'-ДФЦТ и подверженность к действию фермента подсчитывают по количеству продукта. Как видно из таблицы 1, соединения настоящего изобретения в высшей степени подвержены действию ациламидазы печени человека, что предполагает их эффективное биопревращение в 5'-ДФЦТ в человеке. Фармакологические показатели на обезьянах. Соединения настоящего изобретения вводят перорально группе из 2–5 циномолгичных обезьян (3–4 кг). Через различное время после введения отбирают плазму на определение в крови концентрации непревращенных молекул и их активного метаболита (5'-ДФУР). С помощью ВЭЖХ из плазмы выделяют метаболиты и подсчитывают их концентрацию. Как видно из таблицы 2, соединения настоящего изобретения характеризуются высоким уровнем Смакс и ППК активного метаболита 5'-ДФУР в плазме. Полученные результаты показывают, что соединения настоящего изобретения могут быть эффективно использованы для лечения различных опухолей человека. Противоопухолевая активность соединений изобретения показана ниже. 3. Противоопухолевая активность соединений изобретения показана ниже. Опухоль СХF280 (размером 2х2 мм) имплантируют подкожно мышам линии BALB/c nu/nu (21–22 г) в день 0. Когда размер опухоли достигает 100 мм3 (примерно на 14-ый день), мышам ежедневно в течение 3 недель перорально вводят соединения настоящего изобретения. В один из дней после последнего введения подсчитывают объем опухоли. Приведенный в таблице 3 процент ингибирования роста опухоли подсчитывают по формуле: % ингибирования = {(1 (T-Vo)/(C -Vo)}x100, где Vo – объем опухоли перед началом лечения, Т – объем опухолей в подвергаемой лечению группе, С – объем опухоли из контрольной группы. Как видно из таблицы 3, соединения настоящего изобретения характеризуются безопасным введением, не вызывают при этом кишечной токсичности и гораздо более эффективны, чем 5-ФУ. Противоопухолевую активность представительного соединения (пример 13) настоящего изобретения определяют следующим образом. Мышам (CDF1) подкожно инокулируют карциному 26 ободочной кишки (106 клеток) в день 0. Через 21 день, когда зверьки находятся в состоянии общего истощения, им ежедневно 7 раз дают испытуемое соединение. В день после последнего введения определяют прирост массы опухоли, прирост массы остова, массу жировой ткани, концентрацию глюкозы и острого фазового реагента ИКБ (иммуносупрессивного кислотного белка) в сыворотке. Как видно из таблицы 4, мыши, получавшие носитель, были ненормальны с точки зрения общего истощения, характеризующегося такими параметрами, как: масса жировой ткани, содержание в сыворотке глюкозы и ИКБ, в то время, как лечение соединением примера 13 подавляет рост опухоли и ведет к улучшению параметров общего истощения. Токсичность (ЛД50) представительных соединений (примеры 13, 14 и 17) настоящего изобретения выявлялась при пероральном введении ежедневно в течение 21 дня на мышах. Характерные значения ЛД50, полученные в таких опытах, составляют более 500 мг/кг/день. Суточная дозировка больному N4-(замещенный оксикарбонил)-5'-ДФЦТ настоящего изобретения может меняться в зависимости от массы и состояния больного, но, как правило, находится в интервале 0,5–500 мг на 1 кг массы, предпочтительно 2–200 мг. Следует отметить, что для соединений настоящего изобретения можно ожидать в 3–5 раз более высокой активности при лечении человека по сравнению с соединениями, раскрытыми в Патенте США 4966891, если эту активность рассматривать с точки зрения Смакс и ППК для 5'-ДФУР после перорального введения соединений настоящего изобретения обезьяне. По той же причине можно ожидать, что соединения настоящего изобретения покажут достаточную активность при дозировках, в 3–5 раз более низких по сравнению с дозировками соединений указанного патента США. Настоящим изобретением может быть получен фармацевтический препарат с высоким уровнем безопасности. Нижеследующие примеры предназначены для более подробной иллюстрации настоящего изобретения, но ни в коей мере не для ограничения его объема. Ссылочный пример. Получение исходных соединений. Приготовление 2',3'-ди-О-ацетил-5'-деокси5-фторцитидина. (а). Из 5'-деокси-5-фторцитидина. 5'-Деокси-5-фторцитидин (50 мг) растворяли в безводном пиридине (1,3 мл). К раствору добавляли уксуснокислый пиридин (39 мл) при перемешивании при 0оС. Реактивную смесь перемешивали в течение 3 часов при 0оС. После удаления растворителя при сниженном давлении осадок разделяли между этилацетатом и водой, охлажденной до состояния льда. Слой этилацетата осушали в среде сульфата магния и концентрировали при сниженном давлении. Осадок очищали методом силикагелевой хроматографии на колонках (дихлорметан/метанол=9/1 использовали в качест 4. Противоопухолевая активность и активность против общего истощения по отношению к карциноме 26 ободочной кишки мышей. 4 39158 ве элюата) с последующей рекристаллизацией из изопропанола для получения 37 мг 2',3'-ди-О-ацетил-5'-деокси-5-фторцитидина: 191,5–193oC FABMS m/z 330 (MH+). (b). Из 5-фторцитозина и 1,2,3-три-О-ацетил5-деокси-b-D- рибофуранозы. Раствор йодистого натрия (3,6 г) и хлоротриметилсилана (794 мл) в сухом ацетонитриле (15 мл) встряхивали с использованием молекулярных сит с разрешающей способностью 0,4 нм (4Å) (200 мг) при 0оС в течение 5 минут (бесцветный хлористый натрий, выпавший в виде осадка в процессе встряхивания). Добавляли 1,2,3-три-О- ацетил5-деокси-b-D- рибофуранозу (2,0 г), а смесь встряхивали в течение 30 минут при 0оС. Затем раствор триметилсилилатированного 5-фторцитозина, вновь приготовленного из 5-фторцитозина, (1,12) в безводном ацетонитриле (5 мл) добавляли при 0оС и непрерывно встряхивали в течение 3 часов при комнатной температуре. Смесь отфильтровывали. Фильтрат концентрировали в вакууме, а осадок разделяли между дихлорметаном и насыщенным водным раствором бикарбоната натрия. Водный раствор был экстрагирован с помощью CH2Cl2/MeOH (10:1). Комбинированые органические слои были обезвожены с использованием безводного сульфата натрия и выпарены при пониженном давлении. Осадок очищали методом силикагелевой хроматографии с использованием CH2Cl2/MeOH (15:1) в качестве элюата, после чего выполняли рекристаллизацию из изопропанола 1 Пример № R 2 н-бутил 3 R 2 1 для получения 1,24 мг 2',3'-ди-О-ацетил-5-деокси5-фторцитидина. Пример 1. Получение 2',3'-ди-О-ацетат-5'-дезокси-5фтор- N4(пропоксикарбонил)-цитидина. К раствору 2',3'-ди-О-ацетат-5-дезокси-5фторцитидина (2г) в СН2Cl2 (15 мл) в сухом пиридине при перемешивании и охлаждении в бане со льдом по каплям добавляют n-прополхлорформат (957 мл). После перемешивания в течение 30 минут при комнатной температуре смесь испаряют досуха при пониженном давлении. Остаток распределяют между эфиром и насыщенным водным раствором бикарбоната натрия. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и фильтруют. Испарением фильтрата получают 2',3'-ди-Оацетил-5'-дезокси-5-фтор-N4- (пропоксикарбонил)цитидин (2,5 г). Е1-МС m/z 415 (М+). 1Н-ЯМР (ДМСО-d6) d : 0,92 (3Н, т, J = 7,3 Гц), 1,37 (3Н, д, J = 6,3 Гц), 1,63 (2Н, секс, J = 7,3 Гц), 4,06–4,14 (3Н, м), 5,11 (1Н, т, J = 6,3 Гц), 5,47 (1Н, дв. д, J = 4,6 и 6,3 Гц), 5,81 (1Н, д, J = 4,6 Гц), 8,31 (1Н, ш. с), 10,63 (1Н, ш. с). Нижеприведенные соединения получены по методике, аналогичной методике примера 1 (R1 и R2 принимают значения, указанные для общей формулы (І)). Соединение примера 9 получено из известного 2',3'-ди-О-бензоил-5'-дезокси-5-фторцитидина (патент США 4966891) по методике, аналогичной методике примера 1. Н-ЯМР (в растворителе 1 или 2) ББАМС(m/z) ацетил d (1): 0,87 (3Н, т, J = 7,3 Гц), 1,36 (5Н, м), 1,59 (2Н, м), 2,05 (3Н, с), 2,07 (3Н, с), 4,12 (3Н, м), 5,11 (1Н, ш. т), 5,47 (1Н, ш. т), 5,81 (1Н, д, J = 4,3 Гц), 8,34 (1Н, ш. с), 10,6 (1Н, ш. с) 430 (МН+) н-пентил ацетил d (1): 0,88 (3Н, т, J = 7,3 Гц), 1,31 (5Н, м), 1,36 (3Н, д, J = 6,3 Гц), 1,61 (1Н, м), 2,06 (3Н, с), 2,07 (3Н, с), 4,07–4,14 (3Н, м), 5,11 (1Н, т, J = 6,3 Гц), 5,47 (1Н, дв. д, J = 6,3 и 4,6 Гц), 5,8 (1Н, д, J = 4,6 Гц), 8,28 (1Н, ш. с), 10,63 (1Н, ш. с) 444 (МН+) 4 н-гексил ацетил d (1): 0,87 (3Н, т, J = 6,9 Гц), 1,3 (6Н, м), 1,36 (3Н, д, J = 6,3 Гц), 1,59 (2Н, м), 2,06 (3Н, с), 2,07 (3Н, с), 4,07–4,14 (3Н, м), 5,11 (1Н, т, J = 6,3 Гц), 5,45 (1Н, дв. д, J = 6,3 и 4,6 Гц), 5,8 (1Н, д, J = 4,6 Гц), 8,28 (1Н, ш. с), 10,63 (1Н, ш. с) 458 (МН+) 5 изопентил ацетил d (1): 0,9 (6Н, д, J = 6,9 Гц), 1,36 (3Н, д, J = 6,3 Гц), 1,51 (2Н, к, J = 6,9 Гц), 1,68 (1Н, м), 2,06 (3Н, с), 2,07 (3Н, с), 4,09–4,2 (3Н, м), 5,11 (1Н, т, J = 6,3 Гц), 5,46 (1Н, дв. д, J = 6,3 и 4,3 Гц), 5,8 (1Н, д, J = 4,3 Гц), 8,28 (1Н, ш. с), 10,63 (1Н, ш. с) 444 (МН+) 6 2этилбутил ацетил d (1): 0,87 (6Н, т, J = 7,3 Гц), 1,23–1,45 (7Н, м), 1,51 (1Н, м), 2,06 (3Н, с), 2,07 (3Н, с), 4,04 (2Н, ш. д), 4,12 (1Н, т, J = 6,3 Гц), 5,11 (1Н, т, J = 6,3 Гц), 5,46 (1Н, дв. д, J = 6,3 и 4 Гц), 5,81 (д, J = 4,6 Гц), 8,32 (1Н, ш. с), 10,61 (1Н, ш. с) 458 (МН+) 5 39158 1 Пример № R R 7 циклогексилметил 8 9 2 1 Н-ЯМР (в растворителе 1 или 2) ББАМС(m/z) ацетил d (1): 1 (2Н, м), 1,11–1,29 (4Н, м), 1,36 (3Н, д, J = =6,3 Гц), 1,57–1,77 (5Н, м), 2,06 (3Н, с), 2,07 (3Н, с), 3,92 (2Н, ш. с), 4,12 (1Н, м), 5,11 (1Н, т, J = 6,3 Гц), 5,46 (1Н, дв. д, J = 6,3 и 4 Гц), 5,81 (1Н, д, J = 4 Гц), 8,33 (1Н, ш. с), 10,67 (1Н, ш. с) 470 (МН+) фенэтил ацетил d (1): 1,36 (3Н, д, J = 6,3 Гц), 2,06 (3Н, с), 2,07 (3Н, с), 2,94 (2Н, т, J = 6,8 Гц), 4,12 (1Н, м), 4,32 (2Н, ш. т), 5,11 (1Н, т, J = 6,3 Гц), 5,46 (1Н, дв. д, J = 6,3 и 4,3 Гц), 5,81 (1Н, д, J = 4,3 Гц), 7,16–7,37 (5Н, м), 8,32 (1Н, ш. с), 10,67 (1Н, ш. с) 478 (МН+) н-бутил бензоил d (2): 0,95 (3Н, т, J = 7,3 Гц), 1,42 (2Н, м), 1,58 (3Н, д, J = 6,3 Гц), 1,68 (2Н, м), 4,16 (2Н, ш. с), 4,52 (1Н, дв. к, J = 5,8 и 6,3 Гц), 5,4 (1Н, т, J = 5,8 Гц), 5,65 (1Н, дв. д, J = 4,6 и 5,8 Гц), 6,16 (1Н, д, J = 4,6 Гц), 7,35– 7,98 (11Н, м), 11,9 (1Н, ш. с) 554 (МН+) ЯМР: растворитель 1 – ДМСО-d6, растворитель 2 – CDCl3 гируют смесью растворителей CH2Cl2-MeOH (95:5) (40 мл х 10). Объединенные органические слои сушат над безводным сульфатом натрия и фильтруют. Раствор испаряют и кристаллизацией из этилацетата получают 5'-дезокси-5-фтор-N4- (пропоксикарбонил)цитидин (1,6 г, выход 79,8%), т. пл. 125–126,5оС. Е1-МС m/z 331 (М+). Нижеприведенные соединения получены по методике, аналогичной методике примера 10 (R1 и R2 принимают значения, указанные для общей формулы (I)). Пример 10. Получение 5'-дезокси-5-фтор-N4-(пропоксикарбонил)цитидина. К раствору 2',3'-ди-О-ацетил-5'-дезокси-5фтор-N4- (пропоксикарбонил)цитидина (2,5 г) в СН2Cl2 (17 мл) при перемешивании и охлаждении в бане со льдом по каплям прибавляют 1 н. NaOH (17 мл). После перемешивания 1 ч при 0оС к смеси добавляют МеОН (0,9 мл). Добавлением концентрированной HCl в реакционной смеси устанавливают рН 6 и слои разделяют. Водный слой экстраПр. № R1 R2 Т.пл.,оС Р-ритель перекристал. ББА-МС (m/z) 11 н-бутил Н 119–120 АсОЕt 346(МН+) 12 н-пентил Н 110–121 АсОЕt Е1 359(МН+) 13 н-гексил Н 114–116 АсОЕt Е1 373(МН+) 14 изопентил Н 119–120 АсОЕt 360(МН+) 15 2-этилбутил Н аморфно* 16 циклогексилметил Н 126–127 АсОЕt 386(МН+) 17 фенэтил Н 144–145 АсОЕt-МеОН 394(МН+) 18 аллил Н 118,5–120 АсОЕt 330(МН+) 374(МН+) * 1Н-ЯМР (ДМСО-d6) примера 15 d: 0,87 (6Н, т, J = 7 Гц), 1,25–1,45 (7Н, м), 1,53 (1Н, м), 3,68 (1Н, к, J = 6 Гц), 3,89 (1Н, ш. т, J = 6 Гц), 4,02 (2Н, д, J = 6 Гц), 4,1 (1Н, м), 5,05 (1Н, д, J = 6 Гц), 5,4 (1Н, д, J = 6 Гц), 5,67 (1Н, д, J = 3 Гц), 8 (1Н, ш. с), 10,55 и 11,6 (всего 1Н, ш. с. каждый). Пример 19. Получение N4-(циклогексилоксикарбонил)-5'дезокси-5-фтор-цитидина. В 20 мл сухого пиридина растворяют 5'-дезокси-5-фтор-цитидин (2,5 г), к раствору по каплям при 0оС добавляют триметилсилилхлорид (3,4 мл) и смесь перемешивают 30 мин при комнатной температуре. Одной порцией при 0оС к реакционной смеси добавляют циклогексилхлорформат. После перемешивания смеси 1 час при комнатной температуре пиридин испаряют при пониженном давлении. Остаток затем распределяют между насыщенным водным раствором NaHCO3 и эфиром. Органический слой промывают рассолом, сушат над безводным MgSO4 и концентрируют при пониженном давлении. К остатку добавляют лимонную 6 39158 кислоту (2 г) и метанол (50 мл). Смесь перемешивают примерно сутки при комнатной температуре. После удаления растворителя при пониженном давлении остаток растворяют в смеси СН2Cl2-МеОН (95:5) и нейтрализуют водным раствором NaOH. Органический слой сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле с применением в качестве элюента смеси СН2Cl2-МеОН (20:1) Пр. № R 1 R и после перекристаллизации из этилацетата получают N4-(циклогексилоксикарбонил)-5'-дезокси-5фторцитидин (3,47 г, выход 92%), т. пл. 134–136оС. ББА-МС m/z 372 (МН+). Нижеприведенные соединения получены по методике, аналогичной методике примера 19 (R1 и R2 принимают значения, указанные для общей формулы (I)). 2 о Т.пл., С Р-ритель перек ББА-МС (m/z) ристал. АсОЕt 400(МН+) 20 2-циклогексилэтил Н 128–129,5 21 3-циклогексилпропил Н аморфно* 22 3-фенилпропил Н 120–121 23 2-метоксиэтил Н аморфно** 24 изобутил Н 132–134 АсОЕt 346(МН+) 25 2-пропилэтил Н 116–118 АсОЕt 402(МН+) 26 2-этилгексил Н аморфно*** 27 н-гептил Н 115,5–117,5 414(МН+) АсОЕt 408(МН+) 348(МН+) 402(МН+) АсОЕt 388(МН+) * 1Н-ЯМР (ДМСО-d6) для примера 21 d: 0,78–0,93 (2Н, м), 1,15–1,27 (6Н, м), 1,31 (3Н, д, J = 7 Гц), 1,59–1,75 (7Н, м), 3,68 (1Н, к, J = 6 Гц), 3,89 (1Н, ш. т, J = 6 Гц), 4,01–4,14 (3Н, м), 5,04 (1Н, д, J = 6 Гц), 5,4 (1Н, д, J = 6 Гц), 5,67 (1Н, д, J = 2 Гц), 8 (1Н, ш. с), 10,03 и 10,53 (всего 1Н, ш. с. каждый). ** 1Н-ЯМР (ДМСО-d6) для примера 23 d: 1,31 (3Н, д, J = 5,9 Гц), 3,28 (3Н, с), 3,56 (2Н, ш. т), 3,69 (1Н, т, J = 6 Гц), 3,89 (1Н, м), 4,06 (1Н, м), 4,22 (2Н, ш. т), 5,05 (1Н, д, J = 6 Гц), 5,4 (1Н, ш. с), 5,67 (1Н, д, J = 3 Гц), 8,06 (1Н, ш. с), 10,65 (1Н, ш. с). *** 1Н-ЯМР (ДМСО-d6) для примера 26 d: 0,85–0,88 (6Н, м), 1,27–1,38 (11Н, м), 1,57 (1Н, ш. д, J = 6 Гц), 3,68 (1Н, к, J = 6 Гц), 3,89–4,02 (4Н, м), 5,05 (1Н, ш. с), 5,41 (1Н, ш. с), 5,67 (1Н, д, J = 3 Гц), 8,06 (1Н, ш. с), 10,52 (1Н, ш. с). Пример 28. Получение 5'-дезокси-5-фтор-N4-(неопентилоксикарбонил)цитидина. В 15 мл сухого дихлорметана растворяют 5'дезокси-2',3'-ди-О- ацетил-5-фторцитидин (1,5 г) и сухой пиридин (0,74 мл). К полученной смеси при 0оС по каплям прибавляют толуольный раствор неопентилхлорформата (3 экв.) и перемешивают 1 ч при комнатной температуре. После удаления растворителя при пониженном давлении остаток распределяют между эфиром и насыщенным водным раствором карбоната натрия. Органический слой последовательно промывают водой и рассолом, сушат над безводным сульфатом натрия и концентрированием при пониженном давлении получают сырой 2',3'-ди-О-ацетил-5'-дезокси-5-фторN4-(неопентилоксикарбонил)цитидин в виде бледно-желтого масла. Сырой продукт растворяют в этаноле (15 мл) и охлаждают в бане со льдом. При температуре ниже 15оС по каплям прибавляют 1 н. водный раствор гидроокиси натрия. По окончании прибавления реакционную смесь нейтрализуют при 0оC конц. соляной кислотой. Раствор концентрируют при пониженном давлении и концентрат распределяют между водой и смесью растворителей СН2Cl2-МеОН (95:5). Водный слой вновь экстрагируют десять раз смесью СН2Cl2МеОН (95:5) по 20 мл каждый раз. Все органические слои объединяют, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Очисткой остатка хроматографией на колонке с силикагелем с применением в качестве элюента смеси СН2Cl2-МеОН (20:1) в виде аморфного порошка 1,37 г (выход 84%) 5'-дезокси-5фтор-N4-(неопентилоксикарбонил)цитидина. ББАМС m/z 360 (МН+). 1Н-ЯМР (ДМСО-d6) d: 0,93 (9Н, с), 1,31 (3Н, д, J = 6,3 Гц), 3,68 (1Н, к, J = 5,9 Гц), 3,81 (2Н, ш. с), 3,87–3,92 (1Н, м), 4,04–4,09 (1Н, м), 5,05 (1Н, д, J = 5,9 Гц), 5,41 (1Н, ш. д, J = =5,3 Гц), 5,67 (1Н, дв. д, J = 1,3 и 3,6 Гц), 8,04 (1Н, ш. с), 10,53 (~1Н, ш. с). Пример 29. 5'-Дезокси-N4-(3,3-диметилбутоксикарбонил)5-фторцитидин. Заглавное соединение получено по методике, аналогичной методике примера 28, за исключением того, что в качестве ацилирующего средства используют 3,3-диметилбутилхлорформат, аморфный порошок (выход 71%). ББА-МС m/z 374 (МН+). 1Н-ЯМР (ДМСО-d6) d: 0,93 (9Н, с), 1,31 (3Н, д, J = 6,3 Гц), 1,55 (2Н, т, J = 7,3 Гц), 3,68 (1Н, к, J = 5,9 Гц), 3,84–3,93 (1Н, м), 4,03–4,09 (1Н, м), 4,15 (2Н, т, J = 7,3 Гц), 5,05 (1Н, д, J = 5,9 Гц), 5,4 (1Н, ш. д, J = 5,3 Гц), 5,67 (1Н, дв. д, J = 1,3 и 4 Гц), 8 (1Н, ш. с), 10,53 ( ~ 1Н, ш. с). Нижеследующие примеры иллюстрируют фармацевтические препараты, содержащие соединение настоящего изобретения. Пример А. Замкнутые желатиновые капсулы, каждая из которых содержит нижеперечисленные компоненты, получают известными методами. 7 39158 N4-(бутоксикарбонил)-5'-дезокси-5-фторцитидин 100 мг Зерновой крахмал 20 мг Двуокись титана 385 мг Стеарат магния 5 мг Пленка 20 мг ПЭГ 6000 3 мг Тальк 10 мг Всего 543 мг Пример В. Таблетки, каждая из которых содержит нижеперечисленные компоненты, получают известными методами. N4-(бутоксикарбонил)-5'-дезокси-5-фторцитидин 100 мг Лактоза 25 мг Зерновой крахмал 20,2 мг Гидроксипропилметилцеллюлоза 4 мг Стеарат магния 0,8 мг Пленка 10 мг ПЭГ 6000 1,5 мг Тальк 4,5 мг Всего 166 мг Пример С. Сухие парентеральные дозировочные формы приготовляют известными методами. (1) В общей сложности 5 г N4-(бутоксикарбонил)-5'-дезокси-5- фторцитидина растворяют в 75 мл дистиллированной воды, раствор подвергают бактериологическому фильтрованию и затем в асептических условиях разливают по сосудикам. Затем раствор сушат вымораживанием с получением в каждом сосудике по 500 мг стерильного сухого твердого вещества. (2) Чистый N4-(бутоксикарбонил)-5'-дезокси5-фторцитидин в количестве 500 мг на сосудик или ампулу герметизируют в сосуде и стерилизуют нагреванием. Указанные сухие дозировочные формы перед употреблением восстанавливают добавлением приемлемого стерильного водного растворителя, такого как: вода для инъекций или изотонический раствор хлорида натрия, или 5%-ная декстроза для парентерального введения. Таблица 1 Подверженность действию ациламидазы в печени человека и обезьяны Соединение (Пример №) 11 12 13 14 15 16 17 20 21 22 24 25 26 27 28 29 Активность ациламидазы (ммоль/мг белка/ч) Печень обезьяны 20 29 47 32 23 33 22 19 26 43 18
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of n4-oxycarbonyl- 5'-deoxy-5-fluorocytidine and pharmaceutical preparation based thereon
Автори англійськоюMotohiro Arasaki, Hideo Ishitsuka, Isami Kuruma, Masanori Miwa, Chikako Murasaki, Nobuo Shimma, Isao Umeda
Назва патенту російськоюПроизводные n4-оксикарбонил-5'-дезокси-5-фторцитидина и фармацевтический препарат на их основе
Автори російськоюМотохиро Арасаки, Хидео Ишитсука, Исами Курума, Масанори Миуа, Чикако Мурасаки, Нобуо Шимма, Исао Умеда
МПК / Мітки
МПК: A61K 31/7068, A61K 31/7052, C07H 19/06, A61K 31/7042, A61K 31/7064, A61P 35/00, A61K 31/70
Мітки: основі, похідні, фармацевтичний, n4-оксикарбоніл-5'-дезокси-5-фторцитидину, препарат
Код посилання
<a href="https://ua.patents.su/10-39158-pokhidni-n4-oksikarbonil-5-dezoksi-5-ftorcitidinu-ta-farmacevtichnijj-preparat-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Похідні n4-оксикарбоніл-5′-дезокси-5-фторцитидину та фармацевтичний препарат на їх основі</a>
Попередній патент: Вібраційна сушарка для дисперсних матеріалів
Наступний патент: Гірка настоянка “сандулин”
Випадковий патент: Похідні пурину або деазапурину, корисні для лікування (серед інших) вірусних інфекцій












