Спосіб препаративного хроматографічного розділення оптично-активних спиртів
Номер патенту: 94342
Опубліковано: 10.11.2014
Автори: Гавриленко Костянтин Сергійович, Манойленко Ольга Вікторівна, Комарова Наталія Петрівна, Сацька Юлія Анатоліївна, Колотілов Сергій Володимирович, Павліщук Віталій Валентинович
Формула / Реферат
1. Спосіб препаративного хроматографічного розділення оптично-активних спиртів, в якому суміш ізомерів спиртів пропускають через колонку, наповнену хіральним пористим координаційним полімером, який відрізняється тим, що як хіральний пористий координаційний полімер використовують сполуку формули [Zn2(bdc)(S-Lact)(DMF)]n або [Ni2(R-Asp)2(bipy)]n, або [Na7{(VO)7Na7(H2O)7(p-CD)2}]n, де bdc 1,4-бензолдикарбоксилат, S-Lact=S-лактат, DMF = диметилформамід, R-Asp=R-аспаргінат, bipy=4,4-біпіридил, CD - циклодекстрин.
2. Спосіб препаративного хроматографічного розділення оптично-активних спиртів за п. 1, який відрізняється тим, що розділяють суміш ізомерів 2-бутанолу, 2-гексанолу, 3-гексанолу.
Текст
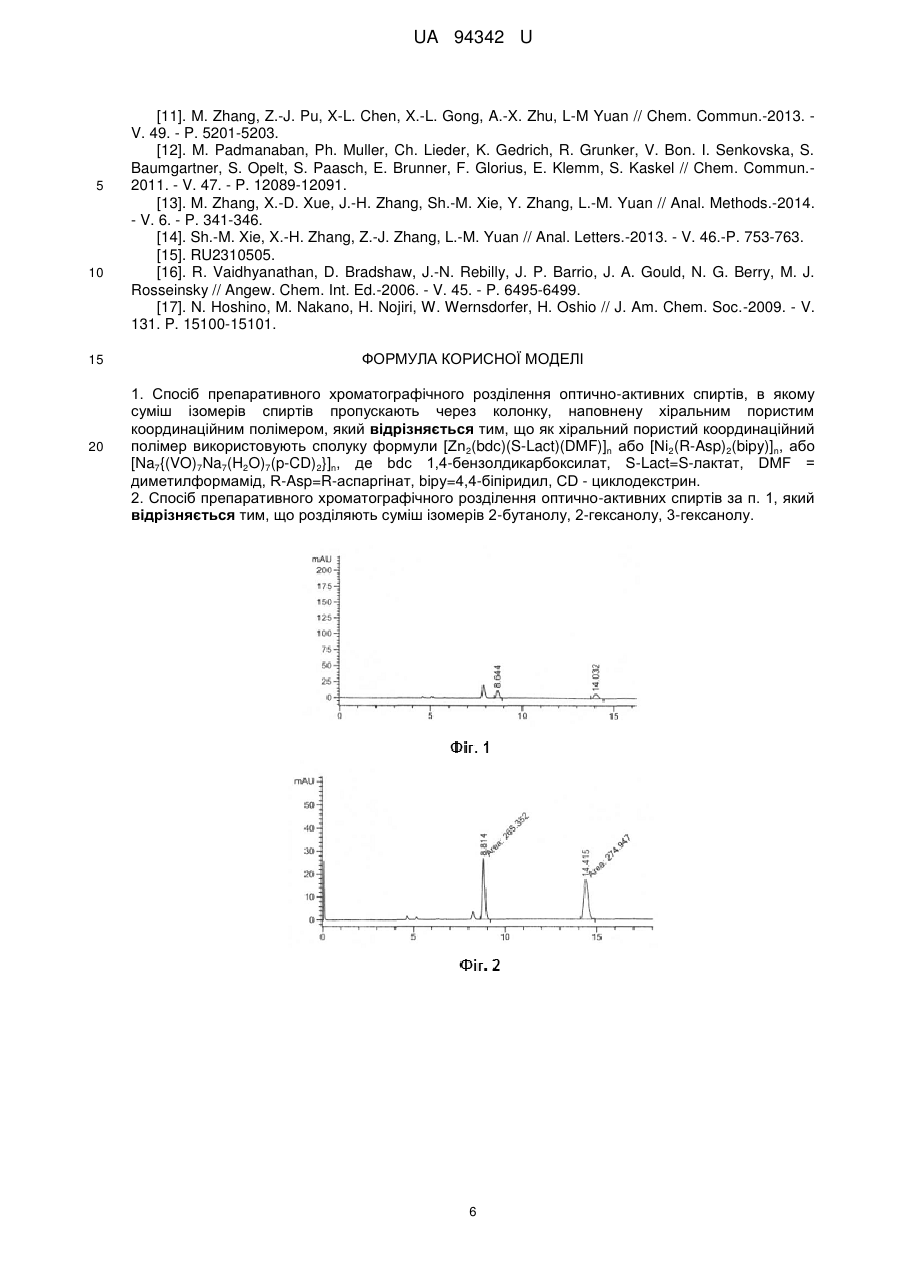
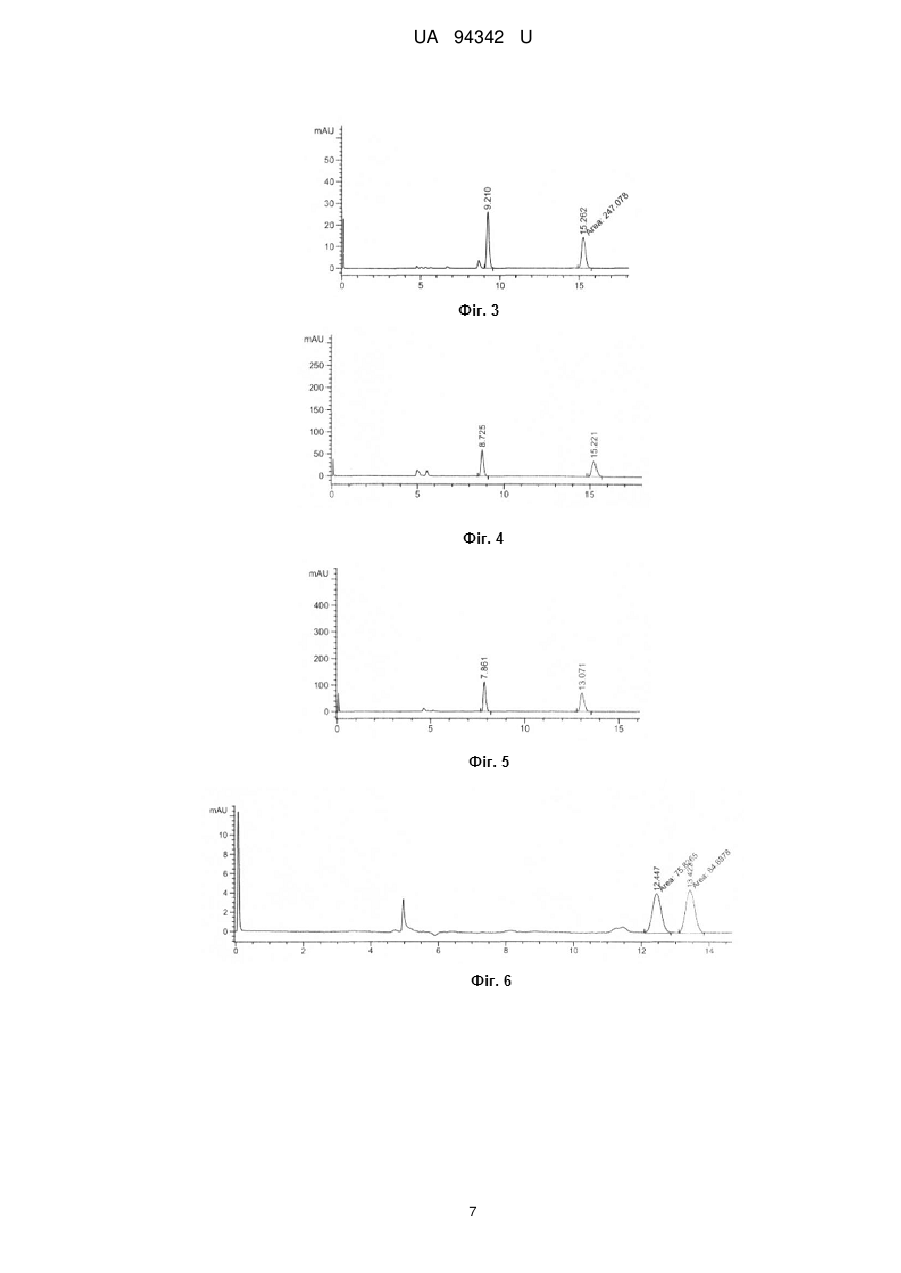
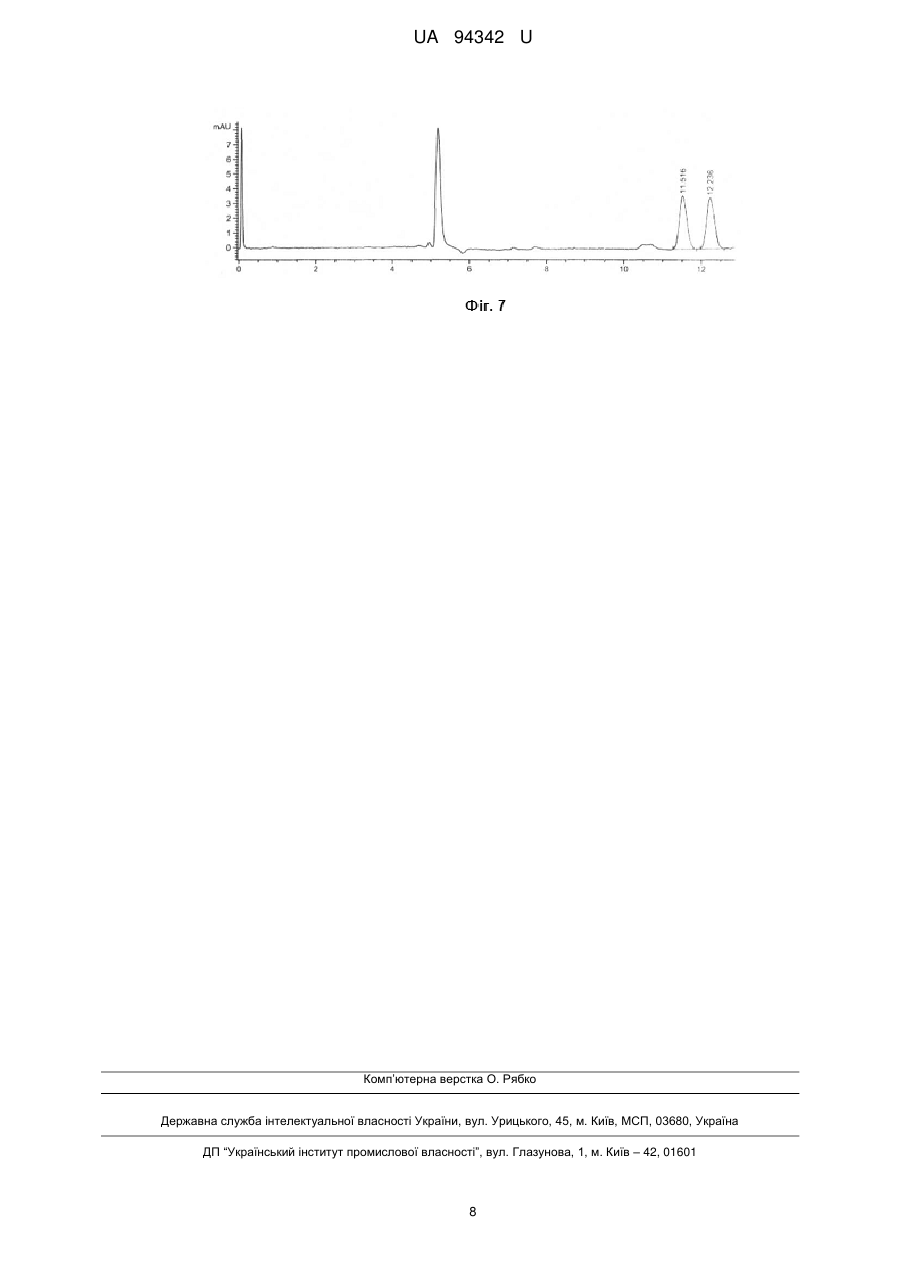
Реферат: Спосіб препаративного хроматографічного розділення оптично-активних спиртів, в якому суміш ізомерів спиртів пропускають через колонку, наповнену хіральним пористим координаційним полімером. Як хіральний пористий координаційний полімер використовують сполуку формули [Zn2(bdc)(S-Lact)(DMF)]n або [Ni2(R-Asp)2(bipy)]n, або [Na7{(VO)7Na7(H2O)7(p-CD)2}]n, де bdc 1,4бензолдикарбоксилат, S-Lact=S-лактат, DMF = диметилформамід, R-Asp=R-аспаргінат, bipy=4,4-біпіридил, CD - циклодекстрин. UA 94342 U (12) UA 94342 U UA 94342 U 5 10 15 20 25 30 35 40 45 50 55 Корисна модель належить до галузі хімії, а саме до методів розділення оптичних ізомерів спиртів або підвищення вмісту одного з ізомерів спирту в суміші із застосуванням хроматографічних колонок, наповнених хіральними пористими координаційними полімерами. Пористі координаційні полімери є представниками нового класу хіральних сорбентів, дослідження яких почалися порівняно недавно. Об'єктом корисної моделі є застосування трьох відомих хіральних пористих координаційних полімерів за новим призначенням, а саме, застосування таких сполук як носіїв для хроматографічного розділення оптично-активних спиртів або підвищення вмісту одного з ізомерів спирту в суміші. Розробка і вдосконалення методів розділення оптичних ізомерів спиртів мас велике значення для потреб біохімії, біотехнології, фармацевтики та інших сфер діяльності. Повне розділення оптичних ізомерів в суміші ізомерів є граничним випадком підвищення концентрації одного з ізомерів, проте у багатьох випадках може бути використана суміш, що містить надлишок одного з оптичних ізомерів. В широкому ряді робіт описуються мікробіологічні методи розділення оптичних ізомерів спиртів. Наприклад, описано підхід, в основі якого лежить стереонаправлена біотрансформація органічних сполук [1]. В цьому випадку чистий ізомер S-2бутанолу отримують шляхом проведення реакції стереоселективного окиснення рацемічного 2бутанолу у присутності ферменту оксидоредуктази, в результаті якої R-2-бутанол окиснюється до R-2-бутанону, а чистий S-2-бутанол залишається [2]. Ще одним прикладом розділення оптично активних ізомерів спиртів є реакція стереоселективного ензиматичного відновлення кетонів у присутності ферменту оксидоредуктази до відповідних хіральних спиртів [3]. Проте недоліками таких методів є висока собівартість та складність виконання процесу. Ці недоліки суттєвою мірою обумовлені потребою підтримки і зберігання живих мікроорганізмів, що потребує спеціального обладнання і навичок персоналу. В основу іншого методу розділення оптичних ізомерів спиртів покладено отримання діастереомерних солей та їх розділення шляхом кристалізації або хроматографії. Наприклад, оптичні ізомери рацемічних 1-феніл-2-диметиламіноетанолу та 1-феніл-3диметиламінопропанолу отримували в результаті фракційної кристалізації їх діастереомерних солей з дибензоїл-D-тартратною кислотою [4]. Іншим прикладом, де застосовують попередню дериватизацію оптично-активних спиртів для розділення їх ізомерів, є застосування похідного азулена як хірального модифікуючого реагенту для перетворення спиртів в азуленові похідні з подальшим розділенням таких похідних методом хроматографії [5]. Суттєвим недоліком таких методів є потреба у розробці спеціальних методик в кожному окремому випадку, необхідність використання стехіометричної кількості оптично активного агента. Крім того, при розділенні, як правило, має місце часткова втрата речовини. Одним з найперспективніших методів розділення оптичних ізомерів різних сполук (органічних і неорганічних) є хроматографічне розділення з використання хіральної нерухомої фази. Так, описано прямий спосіб розділення рацемічних ароматичних спиртів без дериватизації методом газової хроматографії з використанням хіральної стаціонарної фази на основі проліну [6]. Ще одним прикладом для розділення оптично-активних аміноспиртів є застосування хіральної стаціонарної фази на основі біфеніл-заміщеного 1,1’-бінафтол краунефіра [7]. Для успішного розділення оптичних ізомерів спиртів також можуть застосовуватись хіральні колонки на основі похідних циклодекстрину [8] та нерухомі фази полісахаридної природи [9]. Проте всі описані вище хіральні сорбенти застосовуються лише для аналітичного розділення, а їх використання для препаративного виділення оптичних ізомерів навряд чи можливе через край малу пропускну здатність (кількість ізомеру, що може бути виділена в одній порції). Було запропоновано використовувати ряд хіральних пористих координаційних полімерів для препаративного хроматографічного розділення оптично-активних органічних сполук. В періодичній науковій літературі описано хроматографічне розділення різних субстратів, в тому числі спиртів, з використанням окремих представників класу пористих координаційних полімерів [10, 11, 12, 13, 14]. В патентній літературі є приклади застосування хіральних пористих координаційних полімерів як стаціонарної фази для хроматографічного розділення оптично-активних сполук. В першому прикладі в якості носія для хроматографії використовували хіральний пористий координаційний полімер [Zn2(bdc)(S-Lact)(DMF)]n, де bdc-1,4-бензолдикарбоксилат, S-Lact аніон двічі депротоновоної S-молочної (S-2-гідроксіпропіонової) кислоти. 3D-кристалічна 2+ решітка цієї сполуки побудована з ID ланцюгів [Zn2(S-Lact)]n , що зв'язуються бензолдикарбоксилатними спейсерами в інших двох напрямках. Хіральні центри в [Zn 2(bdc)(SLact)(DMF)]n утворені залишками лактату, а пори заповнені молекулами ДМФ. Розмір пор 1 UA 94342 U 5 10 15 20 25 30 35 40 45 50 55 становить приблизно 5 Å в усіх трьох напрямках. Було показано, що полімер [Zn2(bdc)(SLact)(DMF)]n здатний до розмірно- та енантіоселективної сорбції алкіларилсульфоксидів [15]. Наприклад, відомий спосіб розділення оптичних ізомерів сульфоксидів, таких як метилфенілсульфоксид, метил-n-толілсульфоксиду метил-n-бромфенілсульфоксиду метил-nнітрофенілсульфоксид, із застосуванням [Zn2(bdc)(S-Lact)(DMF)]n як носія [15]. Для застосування цієї сполуки для розділення оптичних ізомерів сульфоксидів зразок [Zn 2(bdc)(SLact)(DMF)]n подрібнюють, витримують в 0,01 М розчині N, N-диметилформаміду в хлористому метилені і заповнюють ним скляну колонку діаметром 8 мм, довжиною 110 мм. На отриману таким чином хроматографічну колонку наносять розчин сульфоксиду (0,1-0,2 ммоля) в 0,2 мл елюенту (0,01 М розчин N, N-диметилформаміду в хлористому метилені). Через колонку пропускають зазначений елюент і відбирають фракції по 0,5 мл. Вміст сульфоксиду визначають 1 методом Н ЯМР при додаванні внутрішнього стандарту, а енантіомерні надлишки сульфоксиду 1 визначають методом Н ЯМР за допомогою зсуваючого реагенту Еu(nсf)3 в ССl4. Також відомий хіральний пористий координаційний полімер формули [Ni 2(R-Asp)2(bipy)]n, що побудований з хіральних нейтральних 2D шарів складу [NiAsp] n, які зв'язано молекулами 4,4'біпіридину [16]. Кристалічна решітка [Ni2(R-Asp)2(bipy)]n має одновимірні канали розміром 3,8 × 4,7 Å, а хіральними центрами є залишки аспаргату. Також відоме використання хірального пористого координаційного полімеру формули [Na7{(VO)7Na7(H2O)7(β-CD)2}]n, що побудований шляхом зв'язування бета-циклодекстрину (-CD) оксованадат-іонами [17] як наповнювача для хіральних колонок. Іони натрію та ванадію приєднано до депротонованих вторинних гідроксильних груп -CD. Для жодного з описаних в чотирьох попередніх абзацах хіральних пористих координаційних полімерів не була описана можливість їх використання як носіїв в способах розділення оптичних ізомерів спиртів - 2-бутанолу, 2-гексанолу, 3-гексанолу. Задача корисної моделі створити спосіб препаративного хроматографічного розділення оптично-активних спиртів. Поставлена задача вирішується тим, що спосіб препаративного хроматографічного розділення оптично-активних спиртів, в якому суміш ізомерів спиртів пропускають через колонку наповнену хіральним пористим координаційним полімером, згідно з корисною моделлю, як хіральний пористий координаційний полімер використовують сполуку формули [Zn 2(bdc)(SLact)(DMF)]n або [Ni2(R-Asp)2(bipy)]n, або [Na7{(VO)7Na7(H2O)7(p-CD)2}]n, де bdc=1,4бензолдикарбоксилат, S-Lact=S-лактат, DMF = диметилформамід, R-Asp=R-аспаргінат, bіру = 4,4-біпіридил, CD = циклодекстрин. Згідно з корисною моделлю, спосіб придатний для розділення сумішей оптичних ізомерів спиртів, таких як 2-бутанол, 2-гексанол і 3-гексанол. Для розділення оптичних ізомерів спирту рацемат відповідного спирту пропускають через колонку, заповнену координаційними полімерами [Zn2(bdc)(S-Lact)(DMF)]n, [Ni2(R-Asp)2(bipy)]n або [Na7{(VO)7Na7(H2O)7(P-CD)2}]n. Збільшення вмісту одного з оптичних ізомерів спирту в суміші підтверджено шляхом аналізу складу суміші, що виходить з колонки. Такий аналіз проводили методом рідинної хроматографії з використанням стандартної аналітичної колонки Chiralpak IB (довжина 250 мм, внутрішній діаметр 4,6 мм). Перед аналізом спирти модифікували шляхом перетворення на фенілуретани за реакцією з фенолізоціанатом. В запропонованому нами способі вперше для розділення оптично-активних спиртів застосовуються пористі координаційні полімери формул [Zn 2(bdc)(S-Lact)(DMF)]n, [Ni2(RAsp)2(bipy)]n або [Na7{(VO)7Na7(H2O)7(-CD)2}]n і при цьому через колонку пропускається чистий спирт без елюенту. Перевагою запропонованого нами способу є можливість розділення оптично-активних спиртів - 2-бутанолу, 2-гексанолу, 3-гексанолу. Перелік фігур креслень: На Фіг. 1 наведено результати хроматографічного аналізу першої порції 2-бутанолу після пропускання через колонку, наповнену [Zn2(bdc)(S-Lact)(DMF)]n. На Фіг. 2 наведено результати хроматографічного аналізу першої порції 2-бутанолу після пропускання через колонку, наповнену [Ni2(R-Asp)2(bipy)]n. На Фіг. 3 наведено результати хроматографічного аналізу першої порції 2-бутанолу після пропускання через колонку, наповнену |Na7{(VO)7Na7(H2O)7(-CD)2}]n. На Фіг. 4 наведено результати хроматографічного аналізу першої порції 2-гексанолу після пропускання через колонку, наповнену [Zn2(bdc)(S-Lact)(DMF)]n. На Фіг. 5 наведено результати хроматографічного аналізу першої порції 2-гексанолу після пропускання через колонку, наповнену [Na/{(VO)7Na7(H2O)7(-CD)2}]n. 2 UA 94342 U 5 10 15 20 25 30 35 40 45 50 55 60 На Фіг. 6 наведено результати хроматографічного аналізу першої порції 3-гексанолу після пропускання через колонку, наповнену [Zn2(bdc)(S-Lact)(DMF)]n. На Фіг. 7 наведено результати хроматографічного аналізу першої порції 3-гексанолу після пропускання через колонку, наповнену [Na7{(VO)7Na7(H2O)7(-CD)2}]n. Дана корисна модель підтверджується наведеними нижче прикладами. Приклади ілюструють отримання хіральних пористих координаційних полімерів [Zn 2(bdc)(SLact)(DMF)]n, [Ni2(R-Asp)2(bipy)]n і [Na7{(VO)7Na7(H2O)7(-CD)2}]n, виготовлення хроматографічних колонок на основі [Zn2(bdc)(S-Lact)(DMF)]n, [Ni2(R-Asp)2(bipy)]n і [Na7{(VO)7Na7(H2O)7(-CD)2}]n хроматографічне розділення 2-бутанолу з використанням [Zn2(bdc)(S-Lact)(DMF)]n, [Ni2(RAsp)2(bipy)]n і [Na7{(VO)7Na7(H2O)7(-CD)2}]n, хроматографічне розділення 2-гексанолу і 3гексанолу з використанням [Zn2(bdc)(S-Lact)(DMF)]n і [Na7{(VO)7Na7(H2O)7(-CD)2}]n. . . Вихідні речовини (Zn(NO 3)2 6H2O, VOSO4 2H2O, основний карбонат нікелю (II), S-молочна кислота, R-аспаргінова кислота, -циклодекстрин, 1,4-бензолдикарбонова кислота, 4,4'біпіридил, N, N-диметилформaмід (ДМФ), метиловий спирт, rac-2-бутанол, rac-2-гексанол, rас-3гексанол) були кваліфікації не нижче "х.ч." та їх використовували без додаткової очистки. Фазову чистоту зразків підтверджували з використанням Bruker D8 Advance з Сu анодом (λ = 0,154 нм). Приклад 1. Отримання хірального пористого координаційного полімеру [Zn 2(bdc)(SLact)(DMF)]n. Синтез цієї сполуки проводили, як описано в літературі [15]. Для синтезу [Zn 2(bdc)(SLact)(DMF)]n нагрівають розчин Zn(NO3)2 6H2O (3,0 г, 10 ммоль), S-молочної кислоти (0,498 г, 5 ммоль) та 1,4-бензолдикарбонової кислоти (0,83 г, 5 ммоль) в 80 мл N, N-диметилформаміду (ДМФ) при температурі 110 °C протягом 2 днів. При цьому утворюється [Zn2(bdc)(S-Lact)(DMF)]n у вигляді безбарвних голчатих кристалів, які відділяють фільтруванням, промивають ДМФ та ефіром та сушать у вакуумі протягом З хвилин. Вихід 75 % (2,1 г). Приклад 2. Виготовлення хроматографічної колонки на основі [Zn 2(bdc)(S-Lact)(DMF)]n. [Zn2(bdc)(S-Lact)(DMF)]n подрібнюють розтиранням в ступці і переносять підготовлений сорбент (приблизно 600 мг) в скляну трубку діаметром 3 мм та довжиною 15 см, в результаті отримують колонку для хроматографії. Приклад 3. Хроматографічне розділення 2-бутанолу з використанням колонки з [Zn2(bdc)(SLact)(DMF)]n. На хроматографічну колонку наносять 1 мл рацемічного 2-бутанолу, врівноважують колонку 30 хвилин, додають ще 1 мл спирту і відкривають колонку. Відбирають фракції по 0,25 мл, кожну з яких обробляють 0,6 мл фенолізоціанату в 7 мл бензолу при перемішуванні протягом 12 годин при 70 °C, після чого упарюють. Отримані відповідні фенілуретани аналізують методом хроматографії з використанням стандартної аналітичної колонки Chiralpak IB (довжина 250 мм, внутрішній діаметр 4,6 мм). Енантіомерні надлишки для кожної фракції розраховують з результатів отриманих хроматограмм за наступною формулою: ее = |a(R) - a(S)|/(a(R) + a(S)), де a(R) і a(S) - площі піків відповідних оптичних ізомерів 2-бутанола у довільних одиницях. Приклад 4. Хроматографічне розділення 2-гексанолу з використанням колонки з [Zn2(bdc)(SLact)(DMF)]n. На хроматографічну колонку наносять 1 мл рацемічного 2-гексанолу, врівноважують колонку 30 хвилин, додають ще 1 мл спирту і відкривають колонку. Відбирають фракції по 0,25 мл, кожну з яких обробляють 0,6 мл фенолізоціанатy в 7 мл бензолу при перемішуванні протягом 12 годин при 70 °C, після чого упарюють. Отримані відповідні фенілуретани аналізують методом хроматографії з використанням стандартної аналітичної колонки Chiralpak IB (довжина 250 мм, внутрішній діаметр 4,6 мм). Енантіомерні надлишки для кожної фракції розраховують, як вказано в прикладі 3. Приклад 5. Хроматографічне розділення 3-гексанолу з використанням колонки з [Zn2(bdc)(SLact)(DMF)]n. На хроматографічну колонку наносять 1 мл рацемічного 3-гексанолу, врівноважують колонку 30 хвилин, додають ще 1 мл спирту і відкривають колонку. Відбирають фракції по 0,25 мл, кожну з яких далі обробляють 0,6 мл фенолізоціанату у 7 мл бензолу протягом 12 годин при 70 °C, після чого упарюють. Отримані відповідні фенілуретани аналізують методом хроматографії з використанням стандартної аналітичної колонки Chiralpak IB (довжина 250 мм, внутрішній діаметр 4,6 мм). Енантіомерні надлишки для кожної фракції розраховують, як вказано в прикладі 3. Значення енантіомерних надлишків для кожної порції відповідного рацемічного спирту, що пройшла через колонку, наповнену [Zn2(bdc)(S-Lact)(DMF)]n, наведені в таблиці 1. 3 UA 94342 U 5 10 15 20 25 30 35 40 45 50 55 Приклад 6. Отримання хірального пористого координаційного полімеру [Ni2(R-Asp)2(bipy)]n. Синтез цієї сполуки проводили, як описано в літературі [16]. У 200 мл гарячої води розчиняють R-аспаргінову кислоту (2,66 г, 20 ммоль) і додають Ni 2(ОН)2СО3 (2,12 г, 10 ммоль). Отриманий розчин упарюють до початку утворення блакитного осаду NiAsp. Після цього розчин охолоджують до кімнатної температури і залишають при 0 °C на 12 годин. Утворюється осад блакитного кольору, який далі фільтрують, промивають метанолом та сушать на повітрі. Вихід 85 % (2,19 г). Отриманий таким чином NiAsp розчиняють у 60 мл суміші вода:метанол (1:1), додають 4,4-біпіридил (3,12 г, 20 ммоль), отриману суміш поміщають в автоклав і нагрівають . . при 150 °C протягом 48 год. Отримують сполуку [Ni 2(R-Asp)2(bipy)]n nCH3OH nH2O у вигляді блакитних кристалів. Цю сполуку активують шляхом нагрівання до 100 °C у вакуумі протягом 16 годин. Отриманий активований зразок [Ni2(R-Asp)2(bipy)]n використовується як матеріал для створення колонки. Приклад 7. Виготовлення хроматографічної колонки на основі [Ni2(R-Asp)2(bipy)]n. Хіральний координаційний полімер [Ni2(R-Asp)2(bipy)]n подрібнюють розтиранням в ступці і підготовлений сорбент (приблизно 600 мг) переносять в скляну колонку діаметром 3 мм та довжиною 15 см, в результаті отримують колонку для хроматографії. Приклад 8. Хроматографічне розділення 2-бутанолу з використанням колонки з [Ni2(RAsp)2(bipy)]n. На хроматографічну колонку наносять 1 мл рацемічного 2-бутанолу, врівноважують колонку 30 хвилин, додають ще 1 мл спирту відкривають колонку. Відбирають фракції по 0,25 мл, кожну з яких далі обробляють 0,6 мл фенолізоціанату в 7 мл бензолу протягом 12 годин при 70 °C. Розчини упарюють і отримані відповідні фенілуретани аналізують методом хроматографії з використанням стандартної аналітичної колонки Chiralpak IB (довжина 250 мм, внутрішній діаметр 4,6 мм). Енантіомерні надлишки для кожної фракції розраховують, як вказано в прикладі 3. Значення отриманих енантіомерних надлишків для кожної порції 2-бутанолу, що пройшла через колонку, наповнену [Ni2(R-Asp)2(bipy)]n, наведені в таблиці 2. Приклад 9. Отримання хірального пористого координаційного полімеру [Na7{(VO)7Na7(H2O)7(-CD)2}]n. Синтез цієї сполуки проводили, як описано в літературі [17]. VOSO 4 (55 мг, 0,25 ммоль) та Рциклодекстрин (70 мг, 0,062 ммоль) суспендують у воді (1,5 мл). До суспензії додають розчин NaOH (128 мг, 3,2 ммоль) та -циклодекстрин (70 мг, 0,062 ммоль) в 1 мл води, при цьому утворюється темно-зелений розчин. Газова дифузія метанолу у отриманий розчин призводить . до формування блакитних паличкоподібних кристалів [Na7{(VO)7Na7(H2O)7(-CD)2}]n nH2O. Приклад 10. Виготовлення хроматографічної колонки на основі [Na7{(VO)7Na7(H2O)7(CD)2}]n. Хіральний координаційний полімер [Na7{(VO)7Na7(H2O)7(-CD)2}]n подрібнюють розтиранням в ступці і переносять підготовлений сорбент (приблизно 600 мг) в скляну колонку діаметром 3 мм та довжиною 15 см, в результаті отримують колонку для хроматографії. Приклад 11. Хроматографічне розділення 2-бутанолу з використанням колонки з [Na7{(VO)7Na7(H2O)7(-CD)2}]n. На хроматографічну колонку наносять 1 мл рацемічного 2-бутанолу, врівноважують колонку 30 хвилин, додають ще 1 мл спирту і відкривають колонку. Відбирають 4 фракції по 0,25 мл, кожну з яких обробляють 0,6 мл фенолізоціанату в 7 мл бензолу протягом 12 годин при 70 °C, після чого упарюють. Отримані відповідні фенілуретани аналізують методом хроматографії з використанням стандартної аналітичної колонки Chiralpak IB (довжина 250 мм, внутрішній діаметр 4,6 мм). Енантіомерні надлишки для кожної фракції розраховують, як вказано в прикладі 3. Приклад 12. Хроматографічне розділення 2-гексанолу з використанням колонки з [Na7{(VO)7Na7(H2O)7(-CD)2}]n. На хроматографічну колонку наносять 1 мл рацемічного 2-гексанолу, врівноважують колонку 30 хвилин, додають ще 1 мл спирту і відкривають колонку. Відбирають 4 фракції по 0,25 мл, кожну з яких обробляють 0,6 мл фенолізоціанату в 7 мл бензолу протягом 12 годин при 70 °C, після чого упарюють. Отримані відповідні фенілуретани аналізують методом хроматографії з використанням стандартної аналітичної колонки Chiralpak IB (довжина 250 мм, внутрішній діаметр 4,6 мм). Енантіомерні надлишки для кожної фракції розраховують, як вказано в прикладі 3. Приклад 13. Хроматографічне розділення 3-гексанолу з використанням колонки з [Na7{(VO)7Na7(H2O)7(-CD)2}]n. 4 UA 94342 U 5 10 На хроматографічну колонку наносять 1 мл рацемічного 3-гексанолу, врівноважують колонку 30 хвилин, додають ще 1 мл спирту і починають пропускати його через колонку. Відбирають 4 фракції по 0,25 мл, кожну з яких обробляють 0,6 мл фенолізоціанату в 7 мл бензолу протягом 12 годин при 70 °C, після чого упарюють. Отримані відповідні фенілуретани аналізують методом хроматографії з використанням стандартної аналітичної колонки Chiralpak IB (довжина 250 мм, внутрішній діаметр 4,6 мм). Енантіомерні надлишки для кожної фракції розраховують, як вказано в прикладі 3. Значення отриманих енантіомерних надлишків для кожної порції відповідного рацемічного спирту, що пройшла через колонку, наведені в таблиці 3. Отже, наведені вище приклади підтверджують можливість застосування хіральних пористих координаційних полімерів [Zn2(bdc)(S-Lact)(DMF)]n, [Ni2(R-Asp)2(bipy)]n і [Na7{(VO)7Na7(H2O)7((CD)2}]n як стаціонарної фази для препаративного хроматографічного розділення оптичних ізомерів спиртів. Таблиця 1 Енантіомерні надлишки оптичного ізомеру спирту для кожної порції відповідного рацемічного спирту, що пройшла через колонку, наповнену [Zn 2(bdc)(S-Lact)(DMF)]n Рацемат ее, % (0-0,25 мл) ее, % (0,25-0,5 мл) ее, % (0,5-0,75 мл) ее, % (0,75-1,0мл) 1 2-бутанол 4,25 (R) 3,71 (R) 2,90 (R) 1,32 (R) 2-гексанол 4,8 1,3 3-гексанол 5,5 2,3 1 - буква в дужках показує, який ізомер краще сорбується 15 Таблиця 2 Енантіомерні надлишки оптичного ізомеру 2-бутанолу для кожної порції рацемічного 2-бутанолу, що пройшла через колонку, наповнену [Ni2(R-Asp)2(bipy)]n Рацемат ее, % (0-0,25 мл) ее, % (0,25-0,5 мл) ее, % (0,5-0,75 мл) ее, % (0,75-1,0мл) 1 2-бутанол 0,98 (R) 0,53 (S) 0,09 (S) 0,21 (R) 1 - буква в дужках показує, який ізомер краще сорбується Таблиця 3 Енантіомерні надлишки оптичного ізомеру спирту для кожної порції відповідного рацемічного спирту, що пройшла через колонку, наповнену [Na7{(VO)7Na7(H2O)7(-CD)2}]n Рацемат ее, % (0-0,25 мл) 2-бутанол 5,4 (R) 2-гексанол 0,98 3-гексанол 0,26 1 - буква в дужках показує, який ізомер краще сорбується 20 25 30 ее, % (0,25-0,5 мл) 4,69 (R) 0,41 0,07 Джерела інформації: [1]. С. Алленмарк. Хроматографическое разделение энантиомеров / М: Мир, 1991.-36 с. [2]. US11678177. [3]. US 13254820. [4]. L. D. Tomina, E. I. Klabunovskii, Yu. I. Petrov, L. A. Kretova, N. I. Kholdyakov, T. A. Antonova, E. M. Cherkasova // Bulletin of the Academy of Sciences of the USSR, Division of chemical science.1971. - V.20. - P. 2063-2067. [5]. JP2012051820(A). [6]. M. Li, J. Huang, T. Li // J. Chromatography A.-2009. - V.I 191. - P. 199-204. [7]. M. H. Hyun, S. С Han, B. H. Lipshutz, Y.-J. Shin, С J. Welch // J. Chromatography A.-2002. V.959. - P. 75-83. [8]. V. Schurig, H.-P. Nowotny // Angew. Chem. Int. Ed.-1990. - V. 29. - P. 939-957. [9]. H.-F.Kasai, M. Tsubuki, S. Matsuo, T. Honda // Chem. Pharm. Bull.-2005. -V.53-P. 1270-1276. [10]. S.-M. Xie, Z.-J. Zhang, Z-Y. Wang, L.-M. Yuan // J. Am. Chem. Soc.-2011. -V. 133. P.1189211895. 5 UA 94342 U 5 10 [11]. M. Zhang, Z.-J. Pu, X-L. Chen, X.-L. Gong, A.-X. Zhu, L-M Yuan // Chem. Commun.-2013. V. 49. - P. 5201-5203. [12]. M. Padmanaban, Ph. Muller, Ch. Lieder, K. Gedrich, R. Grunker, V. Bon. I. Senkovska, S. Baumgartner, S. Opelt, S. Paasch, E. Brunner, F. Glorius, E. Klemm, S. Kaskel // Chem. Commun.2011. - V. 47. - P. 12089-12091. [13]. M. Zhang, X.-D. Xue, J.-H. Zhang, Sh.-M. Xie, Y. Zhang, L.-M. Yuan // Anal. Methods.-2014. - V. 6. - P. 341-346. [14]. Sh.-M. Xie, X.-H. Zhang, Z.-J. Zhang, L.-M. Yuan // Anal. Letters.-2013. - V. 46.-P. 753-763. [15]. RU2310505. [16]. R. Vaidhyanathan, D. Bradshaw, J.-N. Rebilly, J. P. Barrio, J. A. Gould, N. G. Berry, M. J. Rosseinsky // Angew. Chem. Int. Ed.-2006. - V. 45. - P. 6495-6499. [17]. N. Hoshino, M. Nakano, H. Nojiri, W. Wernsdorfer, H. Oshio // J. Am. Chem. Soc.-2009. - V. 131. P. 15100-15101. 15 ФОРМУЛА КОРИСНОЇ МОДЕЛІ 20 1. Спосіб препаративного хроматографічного розділення оптично-активних спиртів, в якому суміш ізомерів спиртів пропускають через колонку, наповнену хіральним пористим координаційним полімером, який відрізняється тим, що як хіральний пористий координаційний полімер використовують сполуку формули [Zn2(bdc)(S-Lact)(DMF)]n або [Ni2(R-Asp)2(bipy)]n, або [Na7{(VO)7Na7(H2O)7(p-CD)2}]n, де bdc 1,4-бензолдикарбоксилат, S-Lact=S-лактат, DMF = диметилформамід, R-Asp=R-аспаргінат, bipy=4,4-біпіридил, CD - циклодекстрин. 2. Спосіб препаративного хроматографічного розділення оптично-активних спиртів за п. 1, який відрізняється тим, що розділяють суміш ізомерів 2-бутанолу, 2-гексанолу, 3-гексанолу. 6 UA 94342 U 7 UA 94342 U Комп’ютерна верстка О. Рябко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
Автори англійськоюSatska Yulia Anatoliivna, Havrylenko Kostiantyn Serhiiovych, Manoilenko Olha Viktorivna, Kolotilov Serhii Volodymyrovych, Pavlischuk Vitalii Valentynovych
Автори російськоюСацкая Юлия Анатольевна, Гавриленко Константин Сергеевич, Манойленко Ольга Викторовна, Колотилов Сергей Владимирович, Павлищук Виталий Валентинович
МПК / Мітки
МПК: B01D 15/30, C07B 57/00
Мітки: хроматографічного, оптично-активних, розділення, спиртів, препаративного, спосіб
Код посилання
<a href="https://ua.patents.su/10-94342-sposib-preparativnogo-khromatografichnogo-rozdilennya-optichno-aktivnikh-spirtiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб препаративного хроматографічного розділення оптично-активних спиртів</a>
Попередній патент: Тримач для гладкої поверхні
Наступний патент: Упаковка для харчових продуктів
Випадковий патент: Станок для ручної вишивки "тріостанн"