Синтез олігонуклеотидів
Номер патенту: 96411
Опубліковано: 10.11.2011
Автори: Шенбергер Андреас, Лінк Фрітц, Ланге Майнольф, Грессель Олаф, Кірххофф Крістіне, Холфельд Андреас
Формула / Реферат
1. Спосіб одержання олігонуклеотиду, що включає стадії:
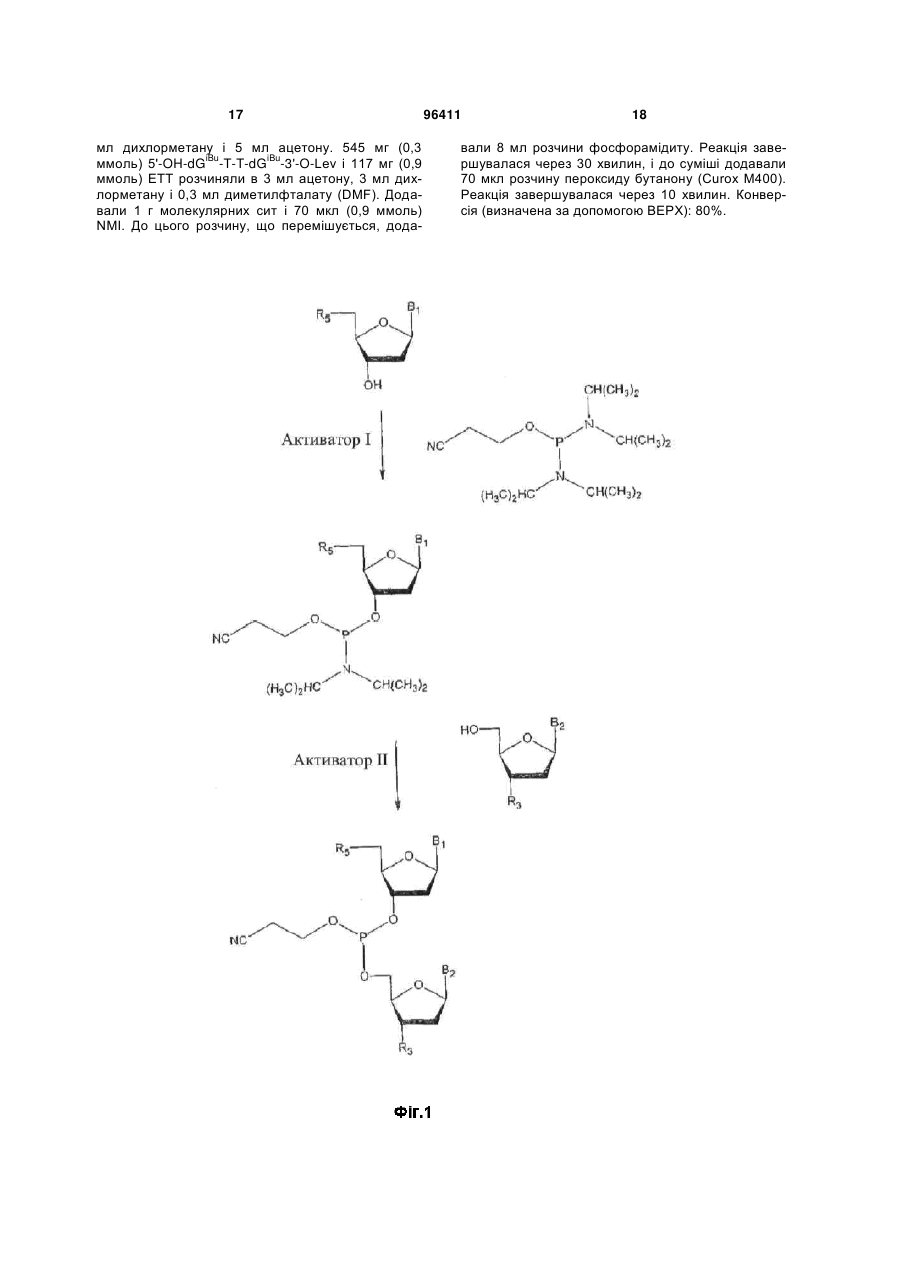
а) надання гідроксилвмісної сполуки, що має формулу
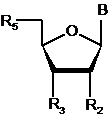 ,
,
в якій
В являє собою гетероциклічну основу,
і
і) R2 являє собою Н, захищену 2'-гідроксильну групу, F, захищену аміногрупу, О-алкільну групу, О-заміщений алкіл, заміщений алкіламіно або С4'-О2' метиленовий місток,
R3 являє собою OR'3, NHR''3, NR''3R"'3, де R'3 являє собою групу, що захищає гідроксил, захищений нуклеотид або захищений олігонуклеотид, R"3, R"'3, незалежно один від одного, являють собою групи, що захищають амін,
і R5 являє собою ОН,
або
іі) R2 являє собою Н, захищену 2'-гідроксильну групу, F, захищену аміногрупу, О-алкільну групу, О-заміщений алкіл, заміщений алкіламіно або С4'-О2' метиленовий місток,
R3 являє собою ОН, і
R5 являє собою OR'5, і R'5 являє собою групу, що захищає гідроксил, захищений нуклеотид або захищений олігонуклеотид,
або
ііі) R2 являє собою ОН,
R3 являє собою OR'3, NHR"3, NR"3R'''3, де R'3 являє собою групу, що захищає гідроксил, захищений нуклеотид або захищений олігонуклеотид, R"3, R'"3, незалежно один від одного, являють собою групи, що захищають амін, і
R5 являє собою OR'5, і R'5 являє собою групу, що захищає гідроксил, захищений нуклеотид або захищений олігонуклеотид;
b) взаємодія зазначеної сполуки з фосфітилуючим агентом у присутності активатора, що має формулу І (активатор І)
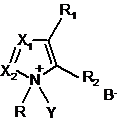 ,
,
в якій
R являє собою алкіл, циклоалкіл, арил, аралкіл, гетероалкіл, гетероарил,
R1, R2 являють собою Н, або вони разом утворюють 5-6-членне кільце,
X1, Х2, незалежно один від одного, являють собою N або СН,
Y являє собою Н або Si(R4)3, де R4 являє собою алкіл, циклоалкіл, арил, аралкіл, гетероалкіл, гетероарил,
В являє собою депротоновану кислоту,
з одержанням фосфітилованої сполуки,
с) взаємодія зазначеної фосфітилованої сполуки без виділення з другою сполукою, що має формулу
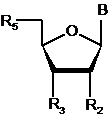 ,
,
в якій R5, R3, R2, В вибрані незалежно один від одного, але мають ті самі визначення, як зазначено вище,
у присутності активатора II, який відрізняється від активатора І,
причому реакційне середовище містить кетон, який має формулу Rx-C(=O)-Ry, в якій Rx і Ry, незалежно один від одного, являють собою С1-С6алкіл або разом утворюють циклоалкіл.
2. Спосіб за п. 1, в якому активатор формули І має формулу, вибрану з групи, що включає
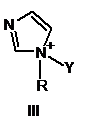 ,
,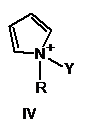 ,
,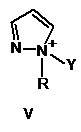 ,
,
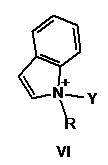 ,
,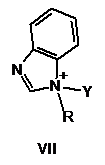 ,
,
в яких
Y такий, як визначено в п. 1
R являє собою метил, феніл або бензил.
3. Спосіб за п. 1 або 2, в якому фосфітилуючий агент має формулу II
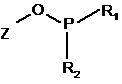 ,
,
в якій Z являє собою відхідну групу, a R1 і R2, незалежно один від одного, є вторинними аміногрупами.
4. Спосіб за будь-яким із пп. 1-3, в якому фосфітилуючий агент являє собою 2-ціаноетил-N,N,N',N'-тетраізопропілфосфордіамідит.
5. Спосіб за будь-яким із пп. 1-4, в якому депротонована кислота утворена з групи, яка включає трифтороцтову кислоту, дихлороцтову кислоту, метансульфонову кислоту, трифторметансульфонову кислоту, о-хлорфенолят.
6. Спосіб за будь-яким із пп. 1-5, в якому реакцію проводять у присутності ацетону.
7. Спосіб за будь-яким із пп. 1-6, в якому фосфітилуючий агент використовують у кількості від 1,0 до 1,2 моль/моль гідроксильних груп у гідроксилвмісній сполуці.
8. Спосіб за будь-яким із пп. 1-7, в якому фосфітилуючий агент використовують у кількості від 3 до 5 моль/моль гідроксильних груп у гідроксилвмісній сполуці.
9. Спосіб за будь-яким із пп. 1-8, в якому додатково полімерний спирт додають після стадії b) за п. 1.
10. Спосіб за будь-яким із пп. 1-9, в якому полімерний спирт є полівініловим спиртом.
11. Спосіб за будь-яким із пп. 1-10, в якому депротонована кислота утворена з групи, яка включає трифтороцтову кислоту, дихлороцтову кислоту, метансульфонову кислоту, трифторметансульфонову кислоту (трифлат), о-хлорфенолят та їхні суміші.
12. Спосіб за будь-яким із пп. 1-11, в якому реакцію проводять у присутності ацетону.
13. Спосіб за п. 11, в якому принаймні 95 % (мас./мас.) реакційного середовища являє собою ацетон.
14. Застосування кетонів, що мають формулу Rx-C(=O)-Ry, в якій Rx і Ry, незалежно один від одного, являють собою С1-С6алкіл або разом утворюють циклоалкіл, як реакційного середовища або додаткового розчинника при синтезі олігонуклеотидів.
15. Застосування за п. 14, в якому кетон являє собою ацетон, бутанон, пентанон, гексанон, циклогексанон або їх суміш.
Текст
1. Спосіб одержання олігонуклеотиду, що включає стадії: а) надання гідроксилвмісної сполуки, що має формулу B R5 O 2 96411 1 3 с) взаємодія зазначеної фосфітилованої сполуки без виділення з другою сполукою, що має формулу B R5 O R3 R2 , в якій R5, R3, R2, В вибрані незалежно один від одного, але мають ті самі визначення, як зазначено вище, у присутності активатора II, який відрізняється від активатора І, причому реакційне середовище містить кетон, який має формулу Rx-C(=O)-Ry, в якій Rx і Ry, незалежно один від одного, являють собою С1С6алкіл або разом утворюють циклоалкіл. 2. Спосіб за п. 1, в якому активатор формули І має формулу, вибрану з групи, що включає N N N N N N+ N++ N+ N + Y NY Y Y Y R R R R R III III III III III + N NN N+ N+ N++ N N+ N+ + N+ N + NY NY Y Y Y Y NY Y Y R R R Y R R R R R R R IV IV V V IV IV V V IV V, , , N N + + N N+ + + + N N N N +Y N Y Y N N + N+ + Y YN N Y Y YN Y Y R R R R R R R R R R VII VII VI VI VII VII , VI VI , VII VI в яких Y такий, як визначено в п. 1 R являє собою метил, феніл або бензил. 3. Спосіб за п. 1 або 2, в якому фосфітилуючий агент має формулу II O R1 P Z R2 96411 4 в якій Z являє собою відхідну групу, a R1 і R2, незалежно один від одного, є вторинними аміногрупами. 4. Спосіб за будь-яким із пп. 1-3, в якому фосфітилуючий агент являє собою 2-ціаноетил-N,N,N',N'тетраізопропілфосфордіамідит. 5. Спосіб за будь-яким із пп. 1-4, в якому депротонована кислота утворена з групи, яка включає трифтороцтову кислоту, дихлороцтову кислоту, метансульфонову кислоту, трифторметансульфонову кислоту, о-хлорфенолят. 6. Спосіб за будь-яким із пп. 1-5, в якому реакцію проводять у присутності ацетону. 7. Спосіб за будь-яким із пп. 1-6, в якому фосфітилуючий агент використовують у кількості від 1,0 до 1,2 моль/моль гідроксильних груп у гідроксилвмісній сполуці. 8. Спосіб за будь-яким із пп. 1-7, в якому фосфітилуючий агент використовують у кількості від 3 до 5 моль/моль гідроксильних груп у гідроксилвмісній сполуці. 9. Спосіб за будь-яким із пп. 1-8, в якому додатково полімерний спирт додають після стадії b) за п. 1. 10. Спосіб за будь-яким із пп. 1-9, в якому полімерний спирт є полівініловим спиртом. 11. Спосіб за будь-яким із пп. 1-10, в якому депротонована кислота утворена з групи, яка включає трифтороцтову кислоту, дихлороцтову кислоту, метансульфонову кислоту, трифторметансульфонову кислоту (трифлат), о-хлорфенолят та їхні суміші. 12. Спосіб за будь-яким із пп. 1-11, в якому реакцію проводять у присутності ацетону. 13. Спосіб за п. 11, в якому принаймні 95 % (мас./мас.) реакційного середовища являє собою ацетон. 14. Застосування кетонів, що мають формулу R xC(=O)-Ry, в якій Rx і Ry, незалежно один від одного, являють собою С1-С6алкіл або разом утворюють циклоалкіл, як реакційного середовища або додаткового розчинника при синтезі олігонуклеотидів. 15. Застосування за п. 14, в якому кетон являє собою ацетон, бутанон, пентанон, гексанон, циклогексанон або їх суміш. , Даний винахід стосується способів одержання олігонуклеотидів. Олігонуклеотиди є ключовими сполуками в галузі природничих наук, що відіграють важливі ролі в різних галузях. Вони, наприклад, використовуються як зонди в галузі аналізу експресії генів, як праймери в полімеразно-ланцюговій реакції (ПЛР) або секвенуванні ДНК. Крім того, існує також безліч потенційних терапевтичних застосувань, які включають, наприклад, антисмислові олігонуклеотиди. Зростаюча кількість застосувань вимагає більшої кількості олігонуклеотидів, отже, існує нагальна потреба в розробці поліпшених способів їхнього синтезу. Для загального огляду див., наприклад, "Antisense - From Technology to Therapy" Blackwell Science (Oxford, 1997). Одним із відомих типів будівельних блоків у синтезі олігонуклеотидів є фосфорамідити; див., наприклад, S.L Beaucage, Μ.Η. Caruthers, Tetrahedron Letters 1859 (1981) 22. Ці фосфорамі 5 дити нуклеозидів, дезоксирибонуклеозидів та їхніх похідних комерційно доступні. 3'-О-фосфорамідити застосовуються у звичайному твердофазовому синтезі, але в інших синтетичних процедурах також використовують 5'-O і 2'-О-фосфорамідити. Однією із стадій в одержанні таких фосфорамідитів нуклеозидів є фосфітилування (захищених) нуклеозидів. Після фосфітилування одержані амідити звичайно виділяють із використанням способів розділення, що дорого коштують, наприклад, хроматографії. Після виділення чутливі амідити повинні зберігатися в спеціальних умовах (наприклад, при низькій температурі, зневодненими). При зберіганні якість амідитів може знижуватися внаслідок певної міри їх розкладання і гідролізу. Можуть відбуватися обидві ці побічні реакції, а їхні результати стають помітними. Найчастіше гідроксильна група та аміногрупи, а також інші функціональні групи, присутні в нуклеозиді, захищають перед фосфітилуванням 3'-, 5'-, щозалишилася, або 2'-О-гідроксильної групи. Ці фосфорамідити потім конденсують із гідроксильними групами нуклеотидів або олігонуклеотидів. Застосування виділеного амідиту також може призводити до часткового гідролізу при конденсації амідиту. Фосфорамідити є сполуками, що дорого коштують. Звичайна ціна дезоксіамідитів знаходиться в діапазоні 40.00 євро за грам. Відповідні будівельні блоки РНК стоять ще дорожче. Завданням даного винаходу є пропонування способу одержання олігонуклеотидів, що долає, принаймні, деякі недоліки попереднього рівня техніки. В одному з варіантів реалізації даний винахід являє спосіб одержання олігонуклеотиду, що включає стадії: а) надання гідроксилвмісної сполуки, що має формулу в якій В являє собою гетероциклічну основу і і) R2 являє собою Н, захищену 2'-гідроксильну групу, F, захищену аміногрупу, О-алкільну групу, О-заміщений алкіл, заміщений алкіламіно або С4'О2' метиленовий місток, R3 являє собою OR'3, NHR"3, NR"3R''3, де R'3 являє собою групу, що захищає гідроксил, захищений нуклеотид або захищений олігонуклеотид, R"3, R"'3 незалежно один від одного являють собою групи, що захищають амін, і R5 являє собою ОН або іі) R2 являє собою Н, захищену 2'-гідроксильну групу, F, захищену аміногрупу, О-алкільну групу, О-заміщений алкіл, заміщений алкіламіно або С4'O2' метиленовий місток, R3 являє собою ОН і 96411 6 R5 являє собою OR'5 і R'5 являє собою групу, що захищає гідроксил, захищений нуклеотид або захищений олігонуклеотид або ііі) R2 являє собою ОН, R3 являє собою OR'3, NHR"3, NR'3R"'3, де R'3 являє собою групу, що захищає гідроксил, захищений нуклеотид або захищений олігонуклеотид, R"3, R"'3 незалежно один від одного являють собою групи, що захищають амін, і R5 являє собою OR'5 і R'5 являє собою групу, що захищає гідроксил, захищений нуклеотид або захищений олігонуклеотид; b) взаємодія зазначеної сполуки з фосфітилованим агентом в присутності активатора, що має формулу І (активатор І) в якій R являє собою алкіл, циклоалкіл, арил, аралкіл, гетороалкіл, гетероарил, R1, R2 являють собою Н, або утворюють 5-6членне кільце, Х1, Х2 незалежно один від одного являють собою N або СН, Υ являє собою Η або Si(R4)3, де R4 являє собою алкіл, циклоалкіл, арил, аралкіл, гетероалкіл, гетероарил, В являє собою депротоновану кислоту, з одержанням фосфітилованої сполуки, c) взаємодія зазначеної фосфітилованої сполуки без її виділення з другою сполукою, що має формулу в якої R5, R3, R2, В вибрані незалежно один від одного, але мають ті самі визначення, як зазначено вище, у присутності активатора II, вибраного з групи, що складається з тетразолу, похідних тетразолу, 4,5-диціаноімідазолу, трифторацетату піридинію та їхньої суміші. Відповідно до даного винаходу фосфітиловані сполуки одержують шляхом фосфітилування гідроксильної групи нуклеозиду, нуклеотиду або олігонуклеотиду з використанням активаторів, що мають формулу І, які переважно є похідними імідазолу. Одержаний чутливий фосфорамідит без очищення або виділення конденсують із гідроксильними групами нуклеозидів, нуклеотидів або олігонуклеотидів у присутності активатора II, іншого ніж активатор І. Ні виділення одержаного фосфорамідиту, ні відділення амідиту від активатора І не проводиться. Переважно, реакція продовжується у 7 тій самій реакційній посудині. Активатор II використовують у присутності активатора І. Активатори конденсації амідиту, відомі з рівня техніки, мали високу реакційну здатність в активуванні функції амідиту. Використання такого активатора для процедури фосфітилування призводить також до певної міри "надмірної реакції" (наприклад, до утворення 3'-3' побічного продукту). Щоб подолати цю та інші проблеми, реакційна здатність активатора модулюється. У цьому випадку реакція селективно припиняється на рівні амідиту, по суті вільного від побічних продуктів, таких як 3'-3'-побічний продукт. Тільки цей результат (утворення амідиту in situ) дозволяє продовжити такий процес шляхом початку конденсації амідиту. Активатор II здатний індукувати стадію конденсації. Після додавання активатора II амідит вступає в амідитну конденсацію. Можна використати у ролі активатора II всю активатори (інші, ніж активатор І), які здатні активувати одержаний амідит для реакції з гідроксилвмісною сполукою на стадії с); тобто тетразол і похідні тетразолу. Переважними похідними тетразолу є бензилмеркаптотетразол і етилтіотетразол (ЕТТ). Придатні сполуки вибрані з групи, що складається з азотовмісних гетероциклів, що мають непротоновану форму водню кислоти, піридину, солей піридину і їхніх сумішей. Азотовмісні гетеро0 цикли мають N -Н зв'язок, тобто N не протонований. Ці сполуки можуть бути використані у вигляді солей шляхом комбінування з кислотами, такими + як кислоти Н В , в яких В має таке ж значення, як визначено у формулі винаходу. Іншим придатним активатором II є піридин, переважно трифторацетат піридинію. Переважні сполуки вибрані з групи, що складається з тетразолу, похідних тетразолу, 4,5диціаноімідазолу, трифторацетату піридинію та їхніх сумішей. Після конденсації звичайно застосовують окиснення (утворення РО) або сульфірування (утворення PS). Для утворення РО переважним є пероксидний підхід. Цю реакцію можна виконати без будь-яких стадій екстракції (йодне окиснення вимагає декількох стадій екстракції). У разі сульфірування можливо використання будь-якого відомого реагенту для сульфірування (тобто PADS, S-Tetra, beaucage). Переважним реагентом для утворення PS є сірка. Різниця у вартості продукції свідчить на користь застосування сірки. В одному варіанті реалізації реакція може протікати у присутності ацетону. Фосфітилуючий агент може бути використаний у більш або менш еквімолярній кількості стосовно гідроксильних груп гідроксилвмісної сполуки. В іншому варіанті реалізації може бути використаний надлишок, наприклад 3-5 моль/моль, гідроксильних груп у гідроксилвмісній сполуці. У ще одному переважному варіанті реалізації полімерний спирт додають після стадії b) за п. 1 [формули винаходу]. Придатні полімерні спирти включають у себе полівініловий спирт (PVA), комерційно доступний як PVA 145000 фірми Merck, Дармштадт. Переважним є великопористий PVA із 96411 8 розміром частинок >120 мкм (80%). Придатними також є мембрани з гідроксильними групами або іншими сполуками, здатними утворювати еноли. Активатор І може бути використаний у стехіометричній, каталітичній (3-50 моль %, переважно 10-30 моль %) кількості або в надлишку. У переважному варіанті реалізації активатор І має формулу, вибрану з групи, що складається з в яких Υ являє собою Η або Si(R4)3, де R4 являє собою алкіл, циклоалкіл, арил, аралкіл, гетероалкіл, гетероарил, В являє собою депротоновану кислоту, R являє собою метил, феніл або бензил. Одержання цих активаторів описане, наприклад, у Hayakawa et al, J. Am. Chem. Soc. 123 (2001) 8165-8176. В одному варіанті реалізації активатор використовують у комбінації з добавкою. Добавки можуть бути вибрані з непротонованих форм сполук, що мають формулу І, та інших гетероциклічних основ, наприклад, піридину. Придатними співвідношеннями між активатором і добавкою є 1:1-1:10. В одному з переважних варіантів реалізації активатор може бути одержаний, йдучи за процедурою "in situ". У цьому випадку активатор не виділяють, що призводить до поліпшення результатів реакції. Гідроліз або розкладання цільової молекули пригнічуються. Для більшого виходу фосфітилування в 3'і/або 5'-положенні олігонуклеотидів (ди, три, тетра, пента, гекса, гепта та октамерів), одержання активатора in situ і комбінація з добавкою переважні. Як описано вище, фосфітилування особливо корисне при синтезі олігонуклеотидів і фосфорамідитних будівельних блоків. Отже, у переважному варіанті реалізації гідроксилвмісна сполука являє собою залишок цукру, наприклад, нуклеозид або одержаний із нього олігомер. Такими нуклеозидами є,наприклад, аденозин, цитозин, гуанозин і урацил, дезоксіаденозин, дезоксигуанозин, дезокситимідин, дезоксицитозин та їх похідні, які можливо містять захисні групи. Звичайно вони повинні бути придатним чином захищені за функціональними групами гетероциклу і гідроксильними групами, за винятком однієї, яка повинна бути фосфітилована. Типовими гру 9 96411 10 пами, які використовуються як захисні для 5'ОНгруп, є диметокситритил, монометокситритил або трет-бутилдиметилсиліл (TBDMS), що дозволяє провести фосфітилування 3'-ОН групи. Іншими можливими групами є фосфати і Н-фосфонати, див., наприклад, У випадку фосфоефіру і фосфодіефіру R може бути вибраний з алкілу, арилу, алкіларилу. Феніл є переважним. Інші групи, що захищають гідроксил у 5', 3' і 2' [положеннях] добре відомі в даній галузі техніки, наприклад, TBDMS. Загалом, фосфітилуючий агент може бути таким самим, що при реакції фосфітилування з використанням 1-Н-тетразолу. У переважному варіанті реалізації він має формулу Фіг. 1 показує схему реакції відповідно до даного винаходу. Придатними прикладами депротонованих кислот В є трифторацетат, трифлат, дихлорацетат, мезил, тозил, о-хлорфенолят. Кислоти з рKа нижчим від 4,5 є переважними. Переважно, вони мають низьку нуклеофільність. В одному з варіантів реалізації реакцію проводять у присутності молекулярних сит для зневоднення реакційного середовища. Загалом, вода повинна бути усунена або зв'язана шляхом зневоднення середовища в ході реакції. Можливо також комбінувати активатор І за даним винаходом із фосфітилуючим агентом і додати гідроксильний компонент пізніше. Також можливо комбінувати активатор І з гідроксилвмісною сполукою і додати потім фосфітилуючий агент. У разі використання добавки активатор змішують із гідроксильним компонентом перед додаванням фосфітилуючого агента. Для одержання активатора "in situ" вибрану кислоту переважно додають після додавання добавки при температурі реакції, що контролюється. Фосфітилуючий агент може бути доданий перед додаванням вибраної кислоти або після нього. Стосовно додавання кислоти і фосфітилуючого агента нуклеозидний компонент може бути доданий у кінці або на початку. У переважному варіанті реалізації відповідна основа активатора, гідроксилвмісну сполуку і фосфітилуючий агент об'єднують, і кислоту додають на початку реакції. Фосфітиловані сполуки (фосфорамідит) потім конденсують із гідроксильною групою нуклеозиду, нуклеотиду або олігонуклеотиду в присутності активатора II. Після реакції сполуки, описаної вище, одержаний триефір піддають окисненню. Окиснення може бути використане, наприклад, для одержання стабільних фосфатних і тіофосфатних зв'язків. Так, як це використовується в даному документі, термін "олігонуклеотиди" охоплює також олігонуклеозиди, аналоги олігонуклеотидів, модифіко в якій Ζ являє собою відхідну групу, наприклад, -CH2CH2CN, -CH2CH=CHCH2CN, пapaCH2C6H4CH2CN, -(CH2)2-5N(H)COCF3, CH2CH2Si(C6H5)2CH3, або -CH2CH2N(CH3)COCF3, a R1 і R2, незалежно один від одного, являють собою вторинні аміногрупи N(R3)2, в яких R3 являє собою алкіл, що має від 1 до близько 6 атомів вуглецю; або R3 являє собою гетероциклоалкільне або гетероциклоалкенільне кільце, що містить від 4 до 7 атомів і що має до 3 гетероатомів, вибраних з азоту, сірки і кисню. Типовий фосфітилуючий агент являє собою 2ціаноетил-N,N,N',N'тетраізопропілфосфородіамідит. Іншими переважними фосфітилуючими реагентами є похідні оксазафосфолідину, як описано в N. Ok et al., J. Am. Chem. Soc. 2003, 125, 83078317, включеному сюди як посилання. Цей фосфітилуючий агент дозволяє здійснити синтез олігонуклеотидів, в якому міжнуклеотидний зв'язок стереоселективним чином перетворюється у фосфотіоати. Такі діастереоселективно синтезовані міжнуклеотидні фосфотіоатні зв'язки мають багатообіцяючий вплив на застосування фосфотіоатів як антисмислових препаратів або імуностимулюючих препаратів. 11 вані олігонуклеотиди, міметики нуклеотидів і до них подібні у формі РНК і ДНК. Загалом, ці сполуки утворюють скелет зв'язаних мономерних субодиниць, де кожна зв'язана мономерна субодиниця прямо або побічно приєднана до залишку гетероциклічної основи. Зв'язки, що з'єднують мономерні субодиниці, і залишки гетероциклічних основ можуть варіювати за структурою, призводячи до множинності варіантів сполук, що утворюються. Даний винахід особливо корисний у синтезі олігонуклеотидів, що мають формулу Хn, в якій кожний X вибраний із A, dA, С, dC, G, dG, U, dT і n=2-30, переважно - 2-12, більш переважно 2-8 або 2-6, та їхніх похідних, що містять захисні групи. Модифікації, відомі в даній галузі техніки, є модифікаціями гетероциклічних основ, цукру або зв'язків, що з'єднують мономерні субодиниці. Варіації міжнуклеотидних зв'язків описані, наприклад, у WO 2004/011474, починаючи з низу сторінки 11, включеної як посилання. Типовими похідними є фосфотіоати, фосфодитіоати, метил- і алкіл-фосфонати і фосфоноацетопохідні. Інші типові модифікації мають місце в залишках цукру. Або рибоза замінена іншим цукром, або одне або більше положень є заміщеними іншими групами, такими як F, О-алкіл, S-алкіл, N-алкіл. Переважний варіант реалізації являє собою 2'метил і 2'-метоксіетокси. Всі ці модифікації відомі в даній галузі техніки. Що стосується залишку гетероциклічної основи, то існує безліч інших синтетичних основ, які використовуються в даній галузі техніки, наприклад 5-метилцитозин, 5-гідрокси-метилцитозин, ксантин, гіпоксантин, 2-аміноаденін, 6- або 2алкільні похідні аденіну і гуаніну, 2-тіоурацил. Такі модифікації також описані в WO 2004/011474, починаючи зі сторінки 21. При використанні в синтезі ці основи звичайно мають захисні групи, наприклад, N-6бензиладенін, N-4-бензилцитозин або N-2ізобутирилгуанін. Загалом, всі реакційноздатні групи, які не призначені для участі в подальшій реакції, повинні бути захищені, особливо, гідроксильні групи цукру. У варіантах реалізації, що стосуються синтезу олігонуклеотидів, є корисним проведення реакції у присутності альдегідів або кетонів, які можуть бути використані або як реакційне середовище, або як додатковий розчинник разом з іншими розчинниками. Придатними сполуками є такі, які здатні утворювати еноли. Типові сполуки мають формулу R1R2C=O, в якій R1 і R2 незалежно один від одного являють собою Η або складаються з 1-20 атомів вуглецю, які можуть утворювати циклічні структури самі по собі, або R1 і R2 утворюють циклічні системи разом, в яких ні R1, ні R2 не є Н. Особливо переважним кетоном є ацетон. Присутність ацетону пригнічує активність будь-яких кількостей амінів, таких як діізопропіламін (DIPА), які звільняються в ході процесу фосфітилування. Це може бути використано для фосфітилування коротших і довших олігонуклеотидів зі схожими результатами (відсутність розкладання). Інші кетонові сполуки, що ма 96411 12 ють формулу Rx-C(=O)-Ry, в якій Rx і Ry незалежно один від одного являють собою С1-С6 алкіл або разом утворюють циклоалкіл, також можуть бути використані остільки, оскільки вони здатні утворювати енолати в присутності, наприклад, амінів із СН2-групою в а-положенні. Даний винахід далі ілюструється наступними прикладами, що не обмежують. Приклад 1 Синтез 5'-O-DMTr-T-T-3'-O-Lev ціаноетилфосфотриефіру через одержання in situ 5'-O-DMTr-T3'-О-фосфорамідиту із застосуванням трифторацетату метилімідазолію (МІТ) 5,0 г 5'-O-DMTr-T-3'-OH (9,2 ммоль, 1,0 екв.) і 2,34 г МІТ (11,9ммоль, 1,3 екв.) розчиняли в 100 мл дихлорметану і додавали 3 г молекулярних сит 3Å (ангстрем), і суміш перемішували протягом 10 хвилин. Додавали 3,8 мл 2-ціаноетил Ν,Ν,Ν',Ν'тетра-ізопропілфосфордіамідиту (11,9 ммоль, 1,3 екв.). Утворення 5'-О-DМТr-Т-3'-О-фосфорамідиту завершувалося через 2години після чого додавали 3,28 г 5'-OH-T-3'-O-Lev (9,64 ммоль, 1,05 екв.) і 51 мл розчину тетразолу (0,45 М, 22,95 ммоль, 2,5 екв.) і перемішували протягом ночі. Тризаміщений фосфіт, що утворився, окиснювали додаванням 4,57 г І2, 140 мл тетрагідрофурану (THF), 35 мл піридину і 4 мл Н2О. Реакція завершилася через 10 хвилин. Реакційну суміш випарювали, розчиняли в 300 мл дихлорметану, екстрагували 200 мл насиченого розчину тіосульфату натрію, а потім екстрагували 200 мл насиченого розчину гідрокарбонату натрію. Об'єднані водні шари екстрагували 30 мл дихлорметану, об'єднані органічні шари зневоднювали сульфатом магнію, а розчинник випарювали. Вихід становив 9,0 г (безбарвна піна): 98%; чистота (визначено за допомогою високоефективної рідинної хроматографії (ВЕРХ)): 84%. Приклад 2 Bz Синтез 5'-O-DMTr-dC -T-3'-O-Lev ціаноетилBz фосфотриефіру через одержання 5'-O-DMTr-dC 3'-О-фосфорамідиту in situ з використанням трифторацетату метилімідазолію (МІТ) 108 мг МІТ (0,56 ммоль, 1,5 екв.) і 224 мг 5'-OBz DMTr-dC -3'-OH (0,37 ммоль, 1,0 екв.) розчиняли в 9 мл дихлорметану і додавали 300 мг молекулярних сит 3Å. 140 мкл 2-ціаноетил Ν,Ν,Ν',Ν'тетраізопропілфосфордіамідиту (0,44 ммоль, 1,2 екв.) додавали до розчину, що перемішується. Bz Утворення 5'-O-DMTr-dC -3'-O-фосфорамідиту завершувалося через 30 хвилин. Суміш фільтрували, додавали 125 мг 5'-ОН-Т-3'-O-Lev (0,37 ммоль, 1,0 екв.) і 2 мл розчину тетразолу (0,45 М, 0,9 ммоль, 2,4 екв.) і перемішували протягом ночі. Тризаміщений фосфіт, що утворився, окиснювали додаванням 10 мл окиснювального розчину (254 мг І2, 7,8 мл THF, 1,9 мл піридину і 222 мкл НгО). Реакція завершувалася через 30 хвилин. Вихід (визначений за допомогою ВЕРХ): 66%. Приклад 3 Bz iBu Синтез 5'-O-DMTr-dC -dG -3'-O-Lev ціаноетилфосфоротіоатного триефіру через одержання Bz 5'-O-DMTr-dC -3'-О-фосфорамідиту in situ з використанням трифторацетату метилімідазолію (МІТ) Bz 2,57 г 5'-O-DMTr-dC -3'-OH (6,0 ммоль, 1,0 екв.) і 1,76 г МІТ (9,0 ммоль, 1,5 екв.) розчиняли в 13 6 мл ацетону і 6 мл ацетонітрилу і додавали 3,0 г молекулярних сит 3Å. 2,46 мл 2-ціаноетил Ν,Ν,Ν',Ν'-тетраізопропілфосфордіамідиту (7,74 ммоль, 1,3 екв.) додавали до розчину, що переміBz шується. Утворення 5'-O-DMTr-dC -3'-Офосфорамідиту завершувалося через 30 хвилин. Розчин фільтрували і додавали до розчину 2,48 г iBu 5'-OH-G -3'-O-Lev (5,7 ммоль, 0,95 екв.) і 2,3 г бензилмеркаптотетразолу (12,0 ммоль, 2,0 екв.) у 20 мл дихлорметану і 20 мл ацетонітрилу і перемішували 30 хвилин. Розчин, що містить утворений тризаміщений фосфіт, фільтрували і сульфірували додаванням 14 г полімер-зв'язаного тетратіонату (25,2 ммоль, 4,2 екв.). Реакція завершувалася через 16 годин. Вихід (визначений за допомогою ВЕРХ): 84%. Приклад 4 Bz Bz Синтез 5'-O-DMTr-dC -dC -3'-O-Lev ціаноетилфосфоротіоатного триефіру через одержання Bz 5'-O-DMTr-dC -3'-О-фосфорамідиту in situ з використанням трифтор ацетату метилімідазолію (МІТ) Bz 10 г 5'-O-DMTr-dC -3'-OH (15,8 ммоль, 1,0 екв.) і 7,75 г МІТ (39,5 ммоль, 2,5 екв.) розчиняли в 30 мл дихлорметану і 30 мл ацетонітрилу, додавали 10 г молекулярних сит 3Å, і суміш перемішували протягом 30 хвилин. 9,0 мл 2-ціаноетил Ν,Ν,Ν',Ν'-тетраізопропілфосфордіамідиту (28,4 ммоль, 1,8 екв.) розчиняли в 15 мл дихлорметану і Bz 15мл ацетонітрилу. Розчин 5'-O-DMTr-dC -3'-ОН і МІТ по краплях додавали до розчину 2-ціаноетил Ν,Ν,Ν',Ν'-тетраізопропілфосфордіамідиту, що пеBz ремішується. Утворення 5'-O-DMTr-dC -3'-Офосфорамідиту завершувалося через 30 хвилин. Цей розчин фільтрували і додавали до розчину Bz 5,43 г 5'-OH-C -3'-O-Lev (12,6 ммоль, 0,8 екв.) і 7,6 г бензилмеркаптотетразолу (39,5 ммоль, 2,5 екв.) у 90 мл диметилформаміду і 450 мл ацетонітрилу і перемішували протягом 10 хвилин. Розчин, що містить утворений тризаміщений фосфіт, фільтрували і сульфірували додаванням 50 г полімерзв'язаного тетратіонату (90 ммоль, 5,7 екв.). Реакція завершувалася через 16 годин. Вихід (визначений за допомогою ВЕРХ): 80%. Приклад 5 Bz iBu Синтез 5'-O-DMTr-dA -dG -3'-O-Lev ціаноетилфосфоротіоатного триефіру через одержання Вz 5'-О-DМТr-dА -3'-О-фосфорамідиту in situ з використанням трифторацетату метилімідазолію (МІТ) Bz 5,0 г 5'-O-DMTr-dA -3'-OH (5,8 ммоль, 1,0 екв.) і 1,8 г МІТ (9,2 ммоль, 1,6 екв.) розчиняли в 50 мл ацетону і 50 мл ацетонітрилу, додавали 2,5 г молекулярних сит 3Å, і суміш перемішували протягом 15 хвилин. 3,0 мл 2-ціаноетил Ν,Ν,Ν',Ν'тетраізопропілфосфордіамідиту (9,5 ммоль, 1,6 екв.) додавали до розчину, що перемішується. Вz Утворення 5'-О-DМТr-dА -3'-О-фосфорамідиту завершувалася через 1 годину. Цей розчин фільтiBu рували і додавали до розчину 2,22 г 5'-OH-G -3'O-Lev (5,1 ммоль, 0,94 екв.) і 2,9 г бензилмеркаптотетразолу (15,1 ммоль, 2,6 екв.) у 25 мл дихлорметану і 25 мл ацетонітрилу і перемішували протягом 40 хвилин. Розчин, що містить утворений тризаміщений фосфіт, фільтрували і сульфірували додаванням 2 г полімер-зв'язаного тетратіонату (3,6 ммоль, 3,9 екв.). Реакція завершувалася че 96411 14 рез 16 годин. Вихід (визначений за допомогою ВЕРХ): 71%. Приклад 6 iBu Синтез 5'-O-DMTr-T-dG -3'-O-Lev ціаноетилфосфоротіоатного триефіру через одержання 5'O-DMTr-T-3'-О-фосфорамідиту in situ з використанням трифторацетату метилімідазолію (МІТ) 5,0 г 5'-O-DMTr-T-3'-OH (9,2 ммоль, 1,0 екв.) і 2,7 г МІТ (13,5 ммоль, 1,5 екв.) розчиняли в 50 мл ацетону і 50 мл ацетонітрилу, додавали 2,5 г молекулярних сит 3Å, і суміш перемішували протягом 15 хвилин. 3,0 мл 2-ціаноетил Ν,Ν,Ν',Ν'тетраізопропілфосфордіамідиту (9,5 ммоль, 1,03 екв.) додавали до розчину, що перемішується. Утворення 5'-О-DМТr-Т-3'-О-фосфорамідиту завершувалося через 1 годину. Цей розчин фільтруваiBu ли і додавали до розчину 4,44 г 5'-OH-G -3'-O-Lev (10,2 ммоль, 1.1 екв.) і 5,3 г бензилмеркаптотетразолу (27,6 ммоль, 1,6 екв.) у 50 мл дихлорметану і 50 мл ацетонітрилу і перемішували протягом 2 годин. Розчин, що містить утворений тризаміщений фосфіт, фільтрували і сульфірували додаванням 30 г полімер-зв'язаного тетратіонату (54 ммоль, 5,9 екв.). Реакція завершувалася через 16 годин. Вихід (визначений за допомогою ВЕРХ): 90%. Приклад 7 Bz Bz Bz Синтез 5'-O-DMTr-T-dC -dC -dC -3'-O-Lev ціаноетилфосфоротіоатного триефіру через одерBz жання 5'-O-DMTr-T-P(S)-dC -3'-О-фосфорамідиту in situ з використанням трифторацетату метилімідазолію (МІТ) Bz 100 мг 5'-O-DMTr-T-P(S)-dC -3'-OH (0,10 ммоль, 1,0 екв.) і 24,4 мг МІТ (0,11 ммоль, 1,1 екв.) розчиняли в 10 мл дихлорметану, додавали 200 мг молекулярних сит 4Å. 32 мкл 2-ціаноетил Ν,Ν,Ν',Ν'-тетраізопропілфосфордіамідиту (0,10 ммоль, 1,0 екв.) додавали до розчину, що переміBz шується. Утворення 5'-O-DMTr-T-P(S)-dC -3'-Офосфорамідиту завершувалося через 24 години. Bz Bz Додавали 82 мг 5'-OH-dC -3'-P(S)-dC -3'-O-Lev (0,09 ммоль, 0,9 екв.) і 366 мкл розчину тетразолу (0,45 М, 0,16 ммоль, 1,6 екв.) і перемішували протягом 45 годин. Утворений тризаміщений фосфіт сульфірували додаванням 400 мг полімерзв'язаного тетратіонату протягом 72 годин. Вихід (визначений за допомогою ВЕРХ): 58%. Приклад 8 Bz iBu Bz Bz Синтез 5'-O-DMTr-dC -dG -dC -dC -3'-OLev ціаноетилфосфоротіоатного триефіру через Bz iBu одержання 5'-Ο-DΜΤr-dC -Ρ(S)-dG -3'-Офосфорамідиту in situ з використанням трифторацетату метилімідазолію (МІТ) Bz iBu 100 мг 5'-O-DMTr-dC -P(S)-dG -3'-OH (0,09 ммоль, 1,0 екв.) і 17,8 мг МІТ (0,09 ммоль, 1,0 екв.) розчиняли в 10 мл дихлорметану, додавали 200 мг молекулярних сит 4Å. До розчину, що перемішується додавали 28 мкл 2-ціаноетил Ν,Ν,Ν',Ν'тетраізопропілфосфордіамідиту (0,09 ммоль, 1,0 Bz iBu екв.). Утворення 5'-О-DMTr-dC -P(S)-dG -3'-Офосфорамідиту завершувалося через 3 години. Bz Bz Додавали 40 мг 5'-OH-dC -3'-P(S)-dC -3'-O-Lev (0,04 ммоль, 0,5 екв.) і 0,9 мл розчину етилтіотетразолу (0,25 М, 0,23 ммоль, 2,5 екв.) і перемішували протягом 2 годин. Утворений тризаміщений 15 фосфіт сульфірували додаванням 200 мг полімерзв'язаного тетратіонату протягом 72 годин. Вихід 30 мг (14,1 мкмоль, білі кристали): 16%; чистота (визначена з допомогою ВЕРХ): 67%. Приклад 9 Bz Bz Bz Синтез 5'-O-DMTr-dC -dC -dA -T-3'-O-Lev ціаноетилфосфортіоатного триефіру через одерВz Вz жання 5'-O-DМТr-dС -Р(S)-dС -3'-Oфосфорамідиту in situ з використанням трифторацетату бензилімідазолію (ВІТ) Bz Bz 100 мг 5'-O-DMTr-dC -P(S)-dC -3'-OH (0,09 ммоль, 1,0 екв.) і 46 мг ВІТ (0,17ммоль, 1,9 екв.) розчиняли в 5 мл ацетону і 5 мл ацетонітрилу, додавали 500 мг молекулярних сит 3Å. 58 мкл 2ціаноетил Ν,Ν,Ν',Ν'тетраізопропілфосфордіамідиту (0,14 ммоль, 1,5 екв.) додавали до розчину, що перемішується. Вz Вz Утворення 5'-О-DМТr-dС -Р(S)-dС -3'-Офосфорамідиту завершувалося через 1 годину. Bz Додавали 41,3 мг 5'-OH-dA -3'-P(S)-T-3'-O-Lev (0,05 ммоль, 0,55 екв.) і 43,7 мг бензилмеркаптотетразолу (0,23 ммоль, 2,5 екв.) і перемішували протягом 1,5 години. Тризаміщений фосфіт, що утворився, сульфірували додаванням 500 мг полімер-зв'язаного тетратіонату протягом 72 годин. Вихід (визначений за допомогою ВЕРХ): 70%. Приклад 10 iBu iBu iBu iBu Синтез 5'-O-DMTr-dG -dG -dG -T-dG iBu dG -3'-O-Lev ціаноетилфосфотриефіру через iBu iBu одержання 5-O-DMTr-dG -P(O)-dG -3'-Oфосфорамідиту in situ з використанням трифторацетату метилімідазолію (МІТ) iBu iBu 200 мг 5'-O-DMTr-dG -P(O)-dG -3'-OH (0,18 ммоль, 1,0 екв.) і 56 мг МІТ (0,27 ммоль, 1,5 екв.) розчиняли в 5 мл ацетону і додавали 300 мг молекулярних сит. У розчин, що перемішується, додавали 128 мкл 2-ціаноетил Ν,Ν,Ν',Ν'тетраізопропілфосфордіамідиту (BisPhos) (0,4 іВu ммоль, 2,2 екв.). Утворення 5'-О-DМТr-dG -3'іВu Р(O)-dG -3'-O-фосфорамідиту завершувалося iBu через 15 хвилин. Додавали 156 мг 5'-OH-dG -TiBu iBu dG -dG -3'-O-Lev (0,09 ммоль, 1,0 екв.) і 87 мг бензилмеркаптотетразолу (0,46 ммоль, 5,0 екв.) і перемішували протягом 20 хвилин. Тризаміщений фосфіт, що утворився, окиснювали додаванням 3,7 мл окиснюючого розчину (94 мг І2, 2,9 мл THF, 0,7 мл піридин і 82 мкл Н2О). Реакція завершувалася через 30 хвилин. Вихід (визначений за допомогою ВЕРХ): 51%. Приклад 11 iBu Синтез 5-O-DMTr-dG -T-3'-O-Lev ціаноетилфосфатного триефіру iBu 200 г (312 ммоль) DMTr-dG -3'-OH і 80 г (408 ммоль) МІТ розчиняли в 400 мл дихлорметану і 400 мл ацетону. Додавали 200 г молекулярних сит і 89 мл (1,25 моль) NMI (N-метил-імідазол). При 15°С до розчину, що перемішується, додавали 109 мл (344 ммоль) BisPhos. Утворення 5'-O-DMTriBu dG -3'-O-фосфорамідиту завершувалося через 10 хвилин, і розчин перемішували ще 30 хвилин. 88,4 г (260 ммоль) 5'-OH-T-3'-O-Lev і 83,4 г (624 ммоль) ЕТТ розчиняли в 600 мл ацетону і 600 мл дихлорметану. Додавали 100 г молекулярних сит і 86 мл (1,08 моль) NMI. До цього розчину, що перемішується, додавали 800 мл розчину фосфора 96411 16 мідиту. Реакція завершувалася через 10 хвилин, і до охолодженої суміші (льодяна баня) додавали 46 мл розчину перекису бутанону (Curox M400). Реакція завершувалася через 5 хвилин. Конверсія (визначена за допомогою ВЕРХ): 100%. Приклад 12 iBu Синтез 5'-O-DMTr-dG -T-3'-O-Lev ціаноетилфосфоротіоатного три ефіру iBu 1,0 г (1,56 ммоль) DMTr-dG -3'-OH і 368 мг (1,88 ммоль) МІТ розчиняли в 3 мл дихлорметану і 3 мл ацетону. Додавали 1 г молекулярних сит і 154 мкл (1,25 моль) NMI. При 15°С до розчину, що перемішується, додавали 594 мкл (1,87 ммоль) іВu BisPhos. Утворення 5'-О-DМТr-dG -3'-Офосфорамідиту завершувалася через 10 хвилин, і розчин залишали перемішуватися протягом ще 30 хвилин. 438 мг (1,29 ммоль) 5'-OH-T-3'-O-Lev і 396 мг (3,07 ммоль) ЕТТ розчиняли в 5 мл ацетону і 5 мл дихлорметану. Додавали 1 г молекулярних сит і 248 мл (3,61 моль) NMI. До цього розчину, що перемішується, додавали 5,5 мл розчину фосфорамідиту. Реакція завершувалася через 10 хвилин і A) додавали 25 мг (7,8 ммоль) сірки (S8) і 2,5 мг Na2S×9H2O. Реакція завершувалася через 10 хвилин. Конверсія (визначена за допомогою ВЕРХ): 100%; B) додавали 25 мг (7,8 ммоль) сірки (S8). Реакція завершувалася через 3 години. Конверсія 99%. Приклад 13 Bz iBu iBu Синтез 5'-O-DMTr-T-dC -dG -T-T-dG -3'-OLev ціаноетилфосфоротіоатного триефіру Bz 5,0 г (4,9 ммоль) DMTr-T-dC -3'-OH і 2,4 г (12,3 ммоль) MIT розчиняли в 10 мл дихлорметану і 10 мл ацетону. Додавали 8 г молекулярних сит і 980 мкл (12,3 моль) NMI. При 15°С до розчину, що перемішується додавали 3,13 мл (9,85 ммоль) Вz BisPhos. Утворення 5'-О-DМТr-Т-dС -3'-Офосфорамідиту завершувалася через 10 хвилин, і розчину дозволяли перемішуватися протягом 30 хвилин. Додавали 100 мл гептану, декантували і до осаду, що утворився, додавали 10 мл дихлорметану і 10 мл ацетону. 4,44 г (2,79 ммоль) 5'-OHiBu iBu dG -T-T-dG -3'-O-Lev і 1,05 г (8,06 ммоль) ЕТТ розчиняли в 15 мл ацетону і 15 мл дихлорметану. Додавали 5 г молекулярних сит і 640 мкл (8,06 моль) NMI. До цього розчину, що перемішується, додавали 20 мл розчину фосфорамідиту. Реакція завершувалася через 10 хвилин, і додавали 930 мг (3,09 ммоль) PADS. Реакція завершувалася через 10 хвилин. Конверсія (визначена за допомогою ВЕРХ) 92%. Приклад 14 Bz Bz Bz Bz Bz Синтез 5'-O-DMTr-dC -dA -dC -dA -dC Bz dA -dCB-3'-O-Lev ціаноетилфосфатного триефіру Bz Bz Bz 860 мг (0,45 ммоль) 5'-O-DMTr-dC -dA -dC Bz dA -3'-OH і 133 мг (0,67 ммоль) МІТ розчиняли в 3 мл дихлорметану і 3 мл ацетону. Додавали 800 мг молекулярних сит і 55 мкл (69 моль) NMI. До розчину, що перемішується додавали 214 мкл (0,65 Bz Bz ммоль) BisPhos. Утворення 5'-O-DMTr-dC -dA Bz Bz dC -dA -3'-3'-O-фосфорамідиту завершувалася через 10 хвилин, і розчину дозволяли перемішуватися протягом 20 хвилин. Додавали 30 мл гептану, декантували і до осаду, що утворився, додавали 5 17 мл дихлорметану і 5 мл ацетону. 545 мг (0,3 iBu iBu ммоль) 5'-OH-dG -T-T-dG -3'-O-Lev і 117 мг (0,9 ммоль) ЕТТ розчиняли в 3 мл ацетону, 3 мл дихлорметану і 0,3 мл диметилфталату (DMF). Додавали 1 г молекулярних сит і 70 мкл (0,9 ммоль) NMI. До цього розчину, що перемішується, дода 96411 18 вали 8 мл розчини фосфорамідиту. Реакція завершувалася через 30 хвилин, і до суміші додавали 70 мкл розчину пероксиду бутанону (Curox M400). Реакція завершувалася через 10 хвилин. Конверсія (визначена за допомогою ВЕРХ): 80%. 19 Комп’ютерна верстка Т. Чепелева 96411 Підписне 20 Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSynthesis of oligonucleotides
Автори англійськоюLange Meinolf, Schoenberger Andreas, Hohlfeld Andreas, Groessel Olaf, Kirchhoff Christine, Link Fritz
Назва патенту російськоюСинтез олигонуклеотидов
Автори російськоюЛанге Майнольф, Шенбергер Андреас, Холфельд Андреас, Грессель Олаф, Кирххофф Кристине, Линк Фритц
МПК / Мітки
МПК: C07H 21/00
Мітки: олігонуклеотидів, синтез
Код посилання
<a href="https://ua.patents.su/10-96411-sintez-oligonukleotidiv.html" target="_blank" rel="follow" title="База патентів України">Синтез олігонуклеотидів</a>
Попередній патент: Сажа, спосіб її одержання, пристрій для здійснення цього способу та її застосування
Наступний патент: Застосування комбінації вірусу міксоми та рапаміцину для лікування
Випадковий патент: Пристрій для електроімпульсного нанесення покриття